
MIARECZKOWANIE STRĄCENIOWE

MIARECZKOWANIE STRĄCENIOWE
(precypitometria)
U podstaw metod miareczkowania strąceniowego leży
reakcja tworzenia trudnorozpuszczalnych osadów z
odpowiednich jonów
A
+
+ B
-
⃗ AB
Zalety
•
selektywne, a nawet specyficzne (podobnie jak
wagowe)
•
szybkie w wykonanie
•
prostota
Titrant
Titrant - roztwór zawierający odpowiedni kation lub
anion (od niego pochodzi nazwa metody)
Wska
Wska
ź
ź
nik
niki punktu końcowego miareczkowania -
najczęściej wskaźniki adsorpcyjne lub
kompleksujące.

MIARECZKOWANIE STRĄCENIOWE (precypitometria)
1.
Argentometria - miareczkowanie roztworem AgNO
3
lub
AgClO
4
głównie do Cl
-
, Br
-
, I
-
Substancje podstawowe:
¾
AgNO
3
cz.d.a., Ag rozpuszczone w HNO
3
¾
NaCl, KCl
woda bez chlorków
2.
Merkurometria - miareczkowanie solami Hg
+
Hg
2
(NO
3
)
2
– głównie do Cl
-
, Br
-
, I
-
3.
Sole Ba
2+
- BaCl
2
lub Ba(ClO
4
)
2
- wobec toronu (żółty
⃗ różowy) lub
DMSA-III (purpurowy
⃗ niebieski) - ozn. siarczanów
4.
Sole toru - Th(OCl
4
)
2
wobec alizaryny
(żółta
⃗ purpurowa) - oznaczanie fluorków

OGÓLNE RÓWNANIE KRZYWEJ MIARECZKOWANIA
ARGENTOMETRYCZNEGO
Reakcja analityczna
Ag
+
+ X
-
= AgX
↓
titrant analit
c
t
v
t
c
0
v
0
Z bilansu stężenia jonów X
-
całkowite stężenie
[X
-
] w miareczkowanym roztworze przed PR
wynosi:
[X
-
] = [X
-
] niezmiareczkowane + [X
-
] z R
AgX
czyli
[X-] =
/ · [X-]
]
[
,
0
0
0
−
+
+
−
X
K
v
v
v
c
v
c
AgX
SO
t
t
t

OGÓLNE RÓWNANIE KRZYWEJ MIARECZKOWANIA
ARGENTOMETRYCZNEGO
[X
-
]
2
+ [X
-
] – K
SO
,
AgX
= 0 [X
-
] = F(v
t
)
[X
-
]
2
+ (f-1)·[X
-
] – K
SO,AgX
= 0 [X
-
] = G(f)
podstawiamy [X
-
] =
[Ag
+
]≠ 0
t
t
t
v
v
v
c
v
c
+
−
0
0
0
t
v
v
v
c
+
0
0
0
]
[
,
+
Ag
K
AgX
SO
0
]
[
)
1
(
]
[
)
(
,
,
0
0
0
2
2
,
=
−
⋅
−
+
+
+
+
AgX
SO
AgX
SO
t
AgX
SO
K
Ag
K
f
v
v
v
c
Ag
K

OGÓLNE RÓWNANIE KRZYWEJ MIARECZKOWANIA
ARGENTOMETRYCZNEGO
mnożymy obie strony przez
otrzymujemy ogólne równanie
[Ag
+
]
2
-
·(f-1)·[Ag
+
] – K
SO,AgX
= 0
czyli:
uwikłana postać zależności [Ag
+
] = G(f) w postaci
dwuparametrycznego (c
0
, K
SO
) równania
kwadratowego
Warunek: [Ag
+
] ≠ 0, czyli v
t
> 0 oraz f > 0
Krzywa miareczkowania nie zaczyna się od f = 0
AgX
SO
K
Ag
,
2
]
[
+
−
t
v
v
v
c
+
0
0
0

MIARECZKOWANIE STRĄCENIOWE
(precypitometria)
Szczególne przypadki przybliżonych rozwiązań
równania ogólnego
warunek założeń upraszczających. Błąd oszacowania
stężenia [Ag+]
Przed PR
stąd ogólne równanie przyjmuje uproszczoną postać
równania pierwszego stopnia
[ ] [ ]
+
+
<<
Δ
Ag
K
Ag
so
[ ]
0
2
≅
>>
+
Ag
K
so
[ ]
0
0
0
0
=
−
+
⋅
−
+
so
K
Ag
v
v
v
c
v
c

MIARECZKOWANIE STRĄCENIOWE
(precypitometria)
Czyli
gdy c=c
0
[ ]
v
v
cv
v
c
K
Ag
so
+
−
=
+
0
0
0
[ ]
v
v
cv
v
c
pK
Ag
pAg
so
+
−
+
=
−
=
+
+
0
0
0
lg
lg
v
v
v
v
c
pK
pAg
so
+
−
+
=
+
0
0
lg
0
0
0
v
v
v
c
cv
f
=
=
(
)
f
v
v
v
c
pK
pAg
so
−
+
+
=
+
1
lg
0
0
MIARECZKOWANIE STRĄCENIOWE
(precypitometria)
W PR f=1
Po PR - 1<f< ∞
(odwrotnie niż przed PR)
Stąd
AgX
so
PR
pK
pAg
,
2
1
=
+
[ ]
0
2
≅
>>
+
Kso
Ag
[ ] [ ]
0
0
0
0
2
=
+
−
+
+
+
v
v
cv
v
c
Ag
Ag
[ ]
v
v
cv
v
c
Ag
+
−
−
=
+
0
0
0
v
v
v
v
c
v
v
v
c
cv
pAg
+
−
−
=
+
−
−
=
+
0
0
0
0
0
lg
lg

MIARECZKOWANIE STRĄCENIOWE
(precypitometria)
Ponieważ
błąd względny
0
0
v
c
cv
f
=
m
m
m
m
m
v
c
cv
f
Δ
=
−
=
−
=
−
0
0
0
0
1
1
)
1
(
lg
0
0
0
−
+
−
=
+
f
v
v
v
c
pAg

Wnioski ogólne wynikające z równań krzywej
miareczkowania (argentometrycznego)
strąceniowego
1.
Przebieg krzywych w zależności od K
SO
i c
o
pAg =f (K
SO
); pAg = f(c
o
)
2. Położenie PR zależy od pK
SO
, a nie zależy od c
o
3. PR leży przy tym większym pAg im większe pK
SO
, czyli im
trudniej rozpuszczalny osad.
4. Skok krzywej miareczkowania (a więc i precyzja) jest tym
większy im większe jest pK
SO
i c
o
5. Dla poprawienia precyzji stosuje się miareczkowanie w
środowiskach niewodnych, np. p K
SO
AgCl w roztworze
izopropanolu wzrasta o 2 (rozpuszczalność maleje o 2
rzędy)
6. Krzywa nie rozpoczyna się od v
t
= 0

Przykłady metod miareczkowania
strąceniowego
I.
Miareczkowanie bezpośrednie -
metoda Mohra
II.
Odmiareczkowanie nadmiaru -
metoda Volharda
III.
Pośrednie - oznaczanie siarczanów
metodą miareczkowania
strąceniowego jonami jodkowymi

Przykłady metod miareczkowania
strąceniowego
Argentometria
I.
Miareczkowanie bezpośrednie -
metoda Mohra
X
-
+Ag
+
AgX
X = Cl
-
, Br
-
Wskaźnik pK – roztwór K
2
CrO
4
2Ag
+
+ CrO
4
2-
Ag
2
CrO
4
(brunatno-czekoladowy osad)

Charakterystyka analityczna metody Mohra
1.
Metoda miareczkowania bezpośredniego
2.
Nadaje się do oznaczania tylko Cl
-
lub Br
-
gdyż AgI i AgSCN silnie adsorbują jony CrO
4
2-
3.
Nadaje się do roztworów wodnych o
6,5 < pH < 10,5 gdyż:
•
w roztworach kwaśnych rozpuszcza się
Ag
2
CrO
4
2 CrO
4
2-
+ 2 H
+
→ Cr
2
O
7
2-
+ H
2
O
•
w roztworach zasadowych wytrąca się jon
Ag
+
2Ag
+
+ 2OH
-
→ 2 AgOH↓ → 2 Ag
2
O
↓ + H
2
O

Charakterystyka analityczna metody Mohra
4.
W tym dopuszczalnym zakresie
przeszkadzają:
a) inne jony tworzące trudnorozpuszczalne
osady z Ag
+
,
np.: CO
3
2-
, Br
-
, I
-
, PO
4
3-
, AsO
4
3-
;
b)
jony Fe
3+
lub Al
3+
, które same wytrącają się
w postaci wodorotlenków;
c)
kationy Ba
2+
i Pb
2+
, tworzące
trudnorozpuszczalne chromiany;
d) Fe
2+
redukuje Ag
+
do metalicznego Ag.

Charakterystyka analityczna metody Mohra
W związku z tym:
- zakwasza się roztwór badany (HNO
3
) i
ogrzewając odpędza CO
2
;
- podwyższa się pH roztworu, wytrąca,
odsącza i przemywa Fe(OH)
3
;
- doprowadza się pH roztworu (przesączu) do
pH=7 i wykonuje się analizę.

Charakterystyka analityczna metody Mohra
5.
Metoda wymaga ścisłego przestrzegania
stężenia wskaźnika dla PK≈PR należy
kontrolować dodatek CrO
4
2-
6.
Metoda jest mało precyzyjna, gdyż K
so
dla
AgCl jest małe (≈10), a więc mały skok
krzywej miareczkowania
7. Do oznaczania Ag
+
miareczkowanie odwrotne
(nadmiar NaCl i odmiareczkowanie chlorków)

obliczanie skoku krzywej miareczkowania dla
AgCl
przed PR, K
SO
= 10
-10
,
c = 0,1 mol/dm
3
, f = 0,999, v
0
= 100 cm
3
c = 0,01 mol/dm
3
, f = 0,999, v
0
= 100 cm
3
c = 0,1 mol/dm
3
, f = 0,9999, v
0
= 100 cm
3
(
)
7
,
5
2
lg
4
10
10
200
100
10
lg
10
1
lg
3
1
0
0
≅
−
−
=
⋅
+
=
−
+
+
=
−
−
+
f
v
v
v
c
pK
pAg
t
so
(
)
7
,
4
2
lg
5
10
10
200
100
10
lg
10
1
lg
3
2
0
0
=
−
−
=
⋅
+
=
−
+
+
=
−
−
+
f
v
v
v
c
pK
pAg
t
so
(
)
7
,
4
2
lg
5
10
10
200
100
10
lg
10
1
lg
4
1
0
0
=
−
−
=
⋅
+
=
−
+
+
=
−
−
+
f
v
v
v
c
pK
pAg
t
so

obliczanie skoku krzywej miareczkowania dla AgCl
w PR pAg
+
nie zależy od stężenia i objętości
po PR, K
SO
= 10
-10
,
c = 0,1 mol/dm
3
, f = 1,001, v
0
= 100 cm
3
c = 0,01 mol/dm
3
, f = 1,001, v
0
= 100 cm
3
c = 0,1 mol/dm
3
, f = 1,0001, v
0
= 100 cm
3
3
,
5
10
200
100
10
lg
)
1
(
lg
3
2
0
0
0
≅
⋅
⋅
−
=
−
⋅
+
−
=
−
−
+
f
v
v
v
c
pAg
t
5
10
2
1
2
1
=
⋅
=
=
+
SO
PR
pK
pAg
3
,
4
10
200
100
10
lg
)
1
(
lg
3
1
0
0
0
≅
⋅
⋅
−
=
−
⋅
+
−
=
−
−
+
f
v
v
v
c
pAg
t
3
,
5
10
200
100
10
lg
)
1
(
lg
4
1
0
0
0
≅
⋅
⋅
−
=
−
⋅
+
−
=
−
−
+
f
v
v
v
c
pAg
t

obliczanie skoku krzywej miareczkowania dla
AgCl
obliczanie skoku krzywej miareczkowania dla
AgCl
K
SO
= 10
-10
,
c = 0,1 mol/dm
3
, f = 1,001, v
0
= 100 cm
3
ΔpAg
+
= 5,7 – 4,3 = 1,4
Przykłady metod miareczkowania
strąceniowego
II
. Odmiareczkowanie nadmiaru - metoda Volharda
X
-
+ Ag+
AgX + Ag
+
(nadmiar)
odmiareczkowanie nadmiaru I titrantu
Ag
+
+ SCN
-
AgSCN
wskaźnik PK - Fe
3+
SCN
-
+ Fe
3+
Fe(SCN)
2+
(krwistoczerwony kompleks)
reakcja przeszkadzająca
Fe(SCN)
2+
+ AgCl
AgSCN + Fe
3+
+ Cl
-
gdyż K
SO
AgCl ≈10
-10
> K
SO
AgSCN ≈ 10
-12
utrudnione uchwycenie PK (nieostre) - ujemny błąd
systematyczny

Przykłady metod miareczkowania
strąceniowego
Metody zapobiegania:
-
odsączenie osadu AgCl przed
miareczkowaniem SCN
-
, ale osad silnie
adsorbuje inne jony (reguła Fajansa)
-
wykorzystanie rozpuszczalników organicznych
(trichlorometan, nitrobenzen,
tetrachlorometan), które adsorbują się na
powierzchni osadu AgCl.

Charakterystyka analityczna metody
Volharda
1.
Metoda argentometryczna oparta na miareczkowaniu
odwrotnym.
2.
Nadaje się do oznaczania w środowiskach kwaśnych, w
których nie wytrącają się jony Fe
3+
i Al
3+
, a węglany są
nietrwałe.
3.
Dokładność wyników zakłóca reakcja uboczna.
4.
Precyzja wyników z zasady gorsza niż w metodzie Mohra
(zgodnie z zasadą propagacji wariancji).
5.
Metoda Volharda (także Mohra) nie nadaje się do
dokładnego oznaczania chlorków i bromków obok siebie,
aczkolwiek na krzywej miareczkowania występują dwa
rozróżnialne PR (współstrącanie, kryształy mieszane)

Przykłady metod miareczkowania
strąceniowego
III. Pośrednie - oznaczanie siarczanów metodą
miareczkowania strąceniowego jonami jodkowymi
Oznaczanie S w związkach organicznych, SO
2
w powietrzu
I etap SO
2
+ O
2
(powietrze) Ag
2
SO
4
II etap - ekstrakcja gorącą wodą (AgX nie rozpuszcza się -
selektywność)
III etap - titrant -KI wskaźnik - skrobia + I
2
Ag
+
+ I
-
AgI (wobec skrobi) pK
SO
≈ 16 (dobra precyzja)
1 cm
3
roztw. titrantu o c
KI
=0,02 mol/dm
3
= 0,3203 mg S
Dla błędu odczytu z mikrobiurety 0,01 cm
3
∆m
s
= ± 0,0032 mg S = 3,2 µg S (mikroanaliza)
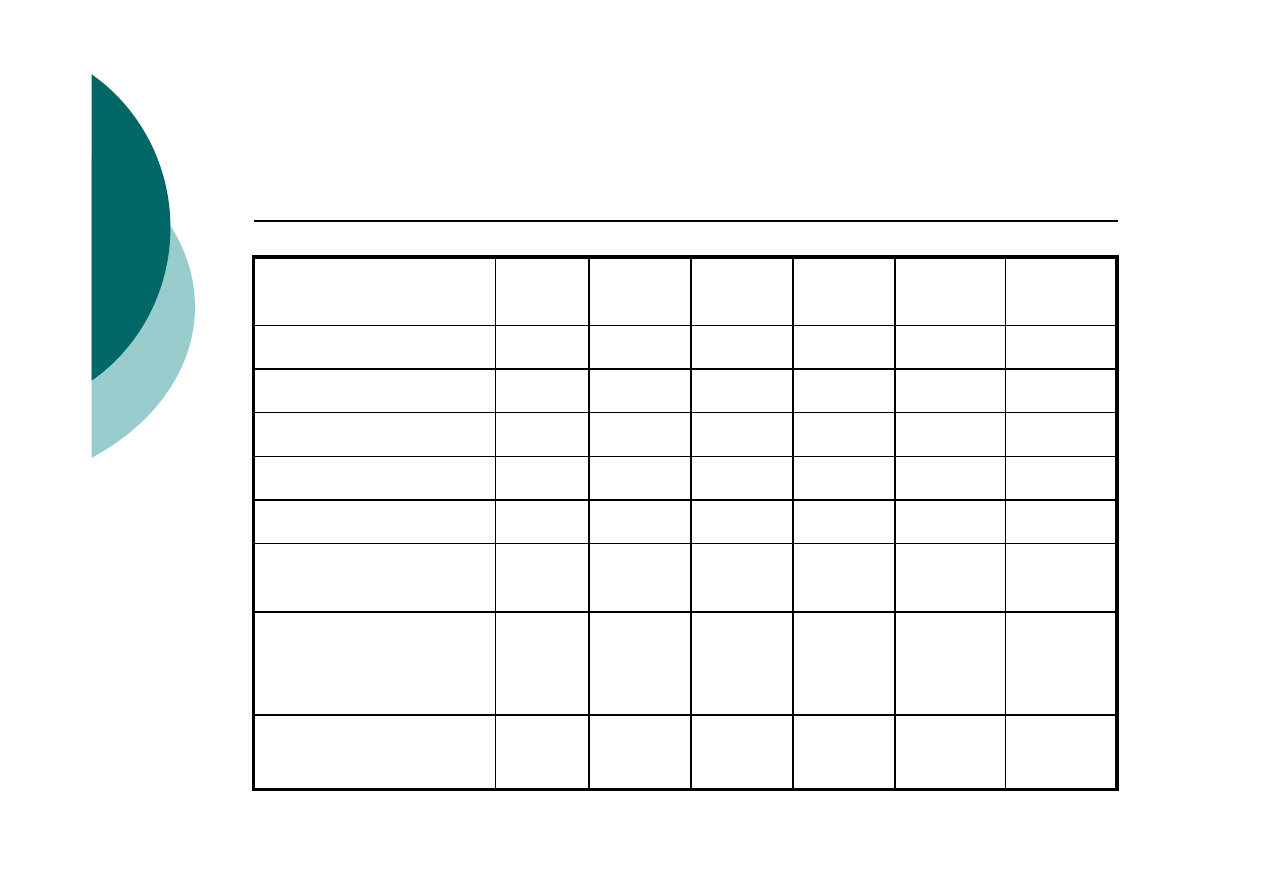
Zmiany w ilości zanieczyszczeń wprowadzanych do
środowiska przez Polskę
Rodzaj
zanieczyszczenia
1990
1995
2000
2002
2004
Zmiana
w [%]
Emisja SO
2
, mln ton
3,21
2,52
1,51
1,46
- 55
Emisja NO
x
, mln ton
1,28
1,13
0,84
0,80
- 38
Emisja CO
2
, mln ton
407
366
315
308
- 24
Emisja pyłów, mln t
1,95
1,15
0,46
0,47
- 75
Ścieki, biliony m
3
4,11
3,02
2,50
2,28
2,14
- 48
Ścieki nie oczyszcz-
one, biliony m
3
1,34
0,70
0,30
0,20
0,19
- 86
Odpady
przemysłowe,
produkcja, mln t
144
123
126
118
124
- 14
Odpady komunalne,
mln t
11,1
11,0
12,2
10,5
- 5

Przykłady metod miareczkowania
strąceniowego
{
MERKUROMETRIA
Hg
2
2+
+ 2X
-
Hg
2
X
2
Titrant - rozpuszczalna sól rtęci - HgNO
3
(trujący)
Anality – jony Cl
-
, Br
-
, szczególnie Cl
-
w wodach i
ściekach
Wskaźniki – adsorpcyjne
Szkodliwość soli rtęci
Merkurymetria – metoda kompleksometryczna,
Titrant – rozpuszczalna sól Hg
2+

SZKODLIWE ODDZIAŁYWANIA RTĘCI
Kumulują się w tkance mięsnej, szczególnie
ryb morskich;
Objawy zatrucia:
{
pobudzenie, podniecenie, utrata pamięci,
bezsenność,
{
zapalenie dziąseł,
{
utrata apetytu,
{
zaburzenia psychiczne,
{
zaburzenia słuchu i wzroku,
{
uszkodzenia płodu,
{
uszkodzenie układu pokarmowo-jelitowego,
{
ostra niewydolność nerek,
{
zaburzenia psychiatryczne i neurologiczne.

Wskaźniki w analizie strąceniowej
Wskaźniki wewnętrzne i zewnętrzne
Wskaźniki wizualne, spektrofotometryczne i elektrochemiczne
(potencjometryczne, konduktometryczne i amperometryczne)
Wskaźniki adsorpcyjne w argentometrii
(znacznie czulsze niż roztwór chromianu)
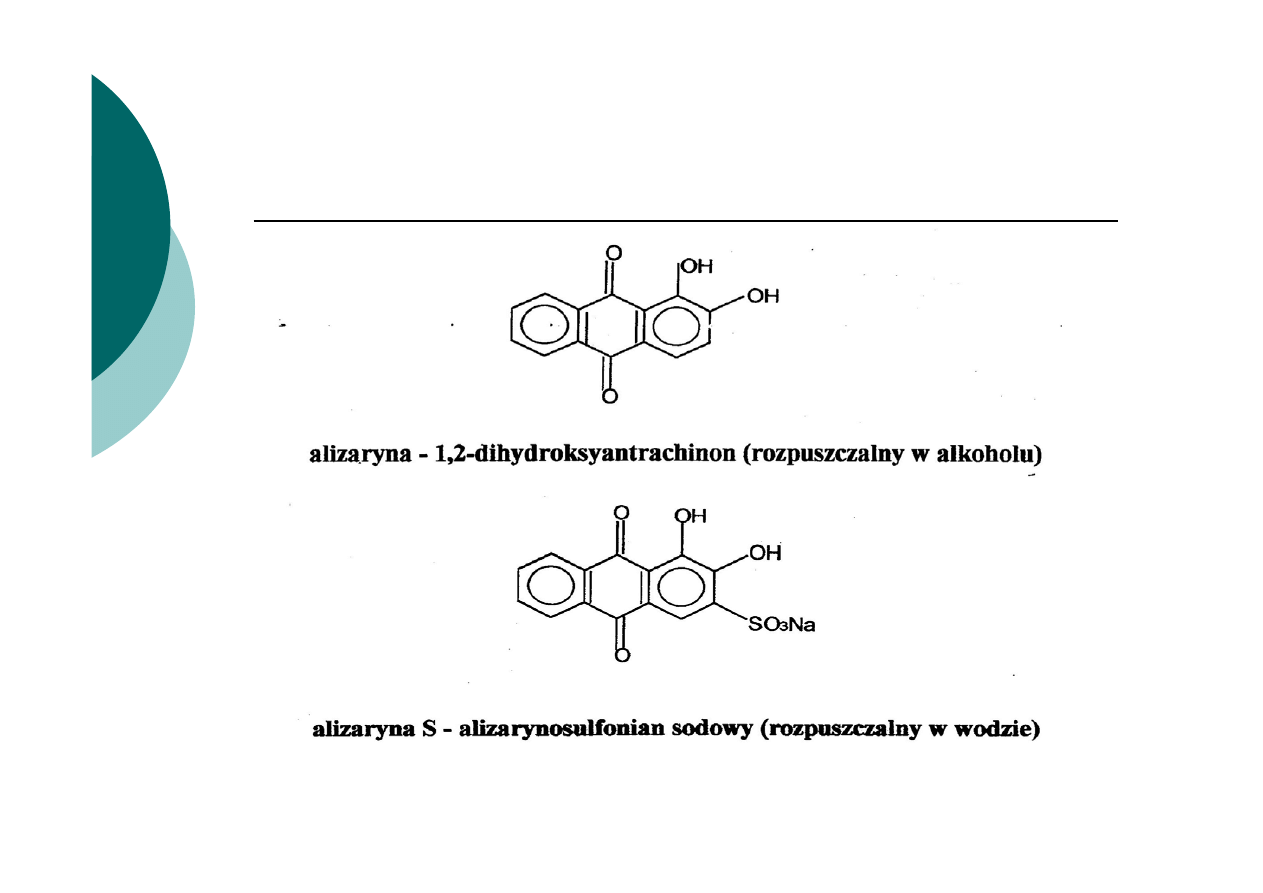
Zasada działania opiera się na wykorzystaniu reguły Fajansa
Osad adsorbuje w pierwszej kolejności jony wspólne z osadem, a
spośród innych te, które tworzą z jonem osadu związki
trudniej rozpuszczalne.
Micela - cząstka koloidalna wraz z zaadsorbowanymi
odpowiednimi jonami i otaczającą ją chmurą przeciwjonów
wraz z cząsteczkami
Wskaźniki w analizie strąceniowej
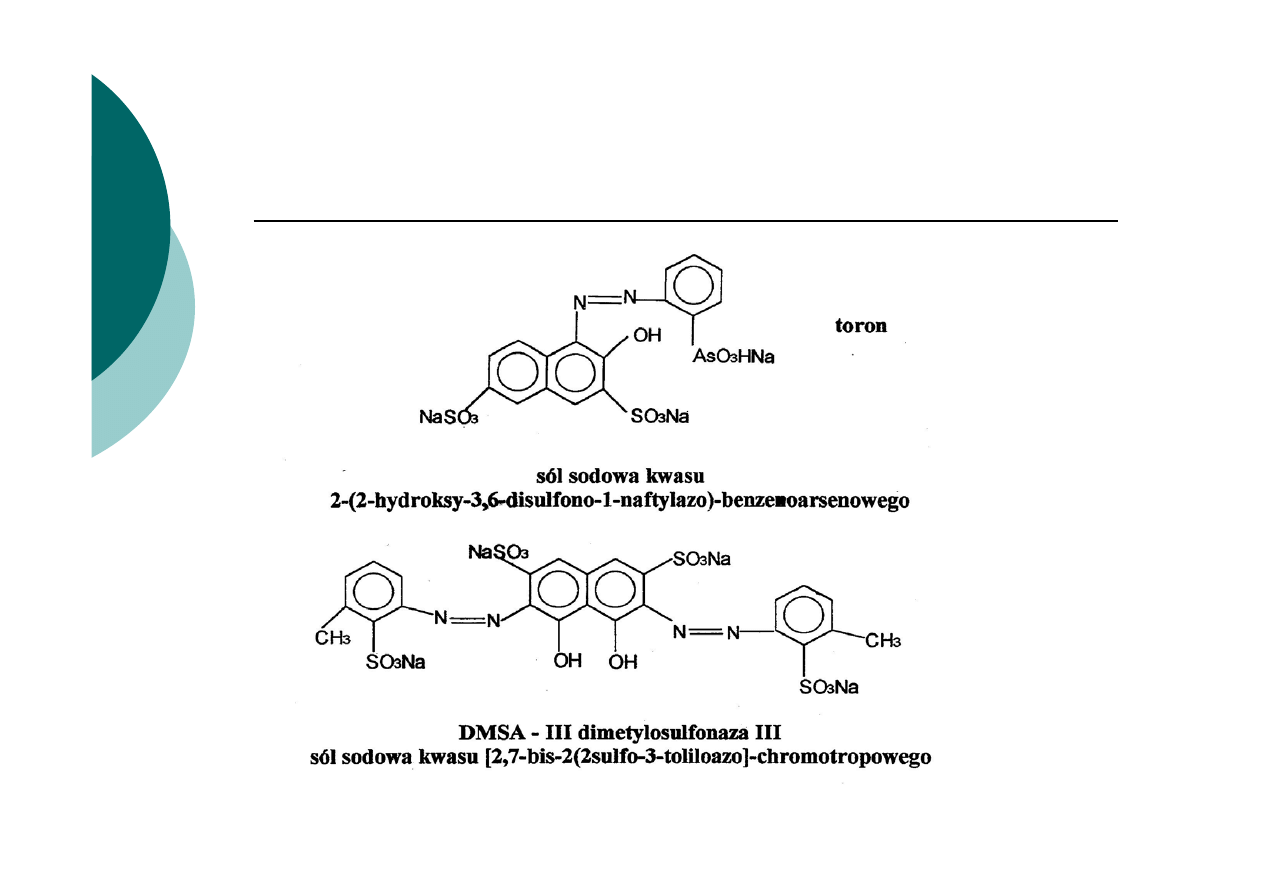
Wskaźniki w analizie strąceniowej

Wskaźniki adsorpcyjne
{
Istota zasady działania wskaźników adsorpcyjnych
1.
Na silnie rozwiniętej powierzchni koloidowej (np. AgCl)
ulegają adsorpcji jony wspólne z osadem, które znajdują
się w nadmiarze
2.
Po przekroczeniu PR zmienia się znak ładunku osadu
koloidowego.
3.
Na skutek zmiany znaku ładunku powierzchni osadu
ulegają na niej adsorpcji lub desorpcji jony pochodzące z
dysocjacji wskaźnika adsorpcyjnego (np. anion
fluoresceiny)
4.
Inna jest barwa wskaźnika zaadsorbowanego na osadzie
niż barwa tego jonu w roztworze.
5.
Pociąga to za sobą dostrzegalną zmianę barwy roztworu
miareczkowanego (barwy powierzchni osadu w przypadku
fluoresceiny)
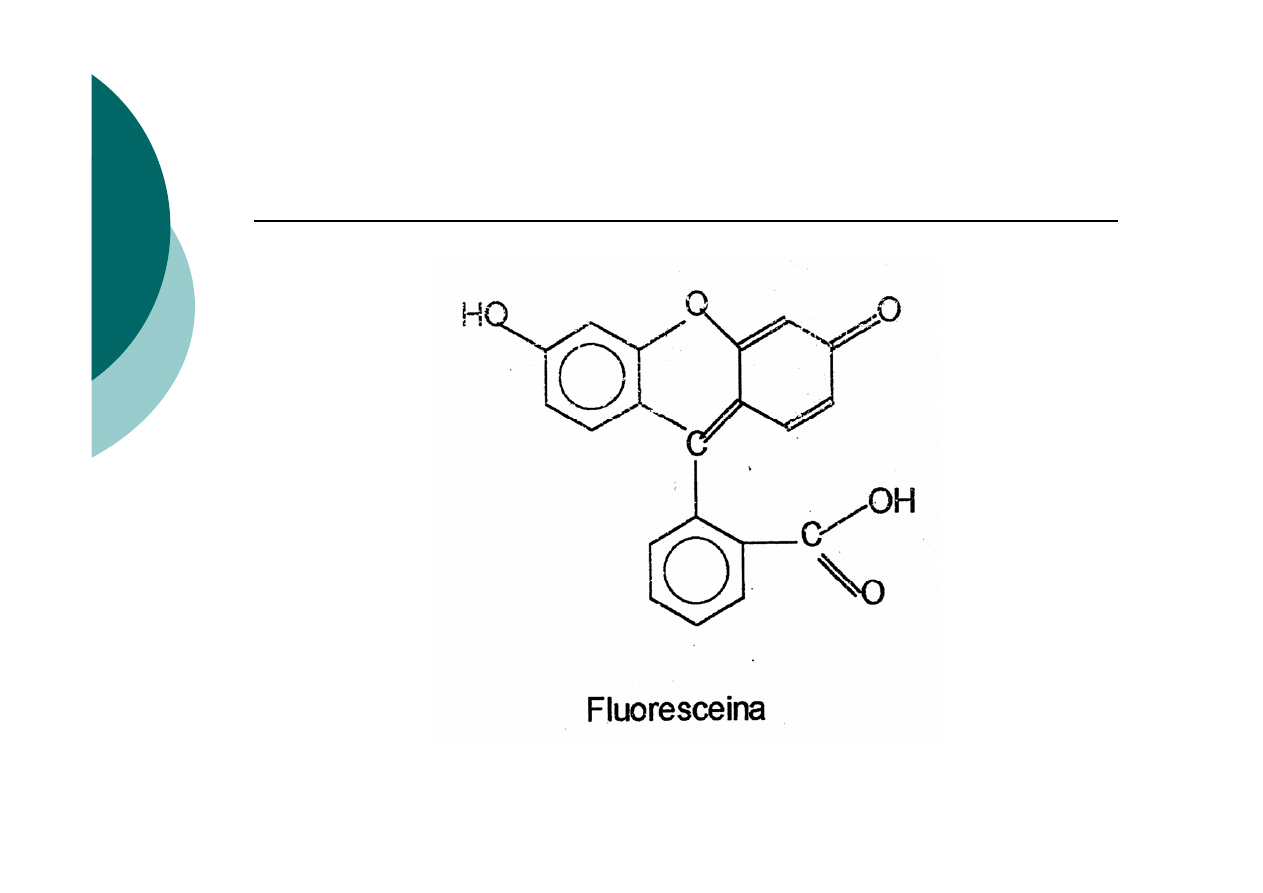
Fluoresceina
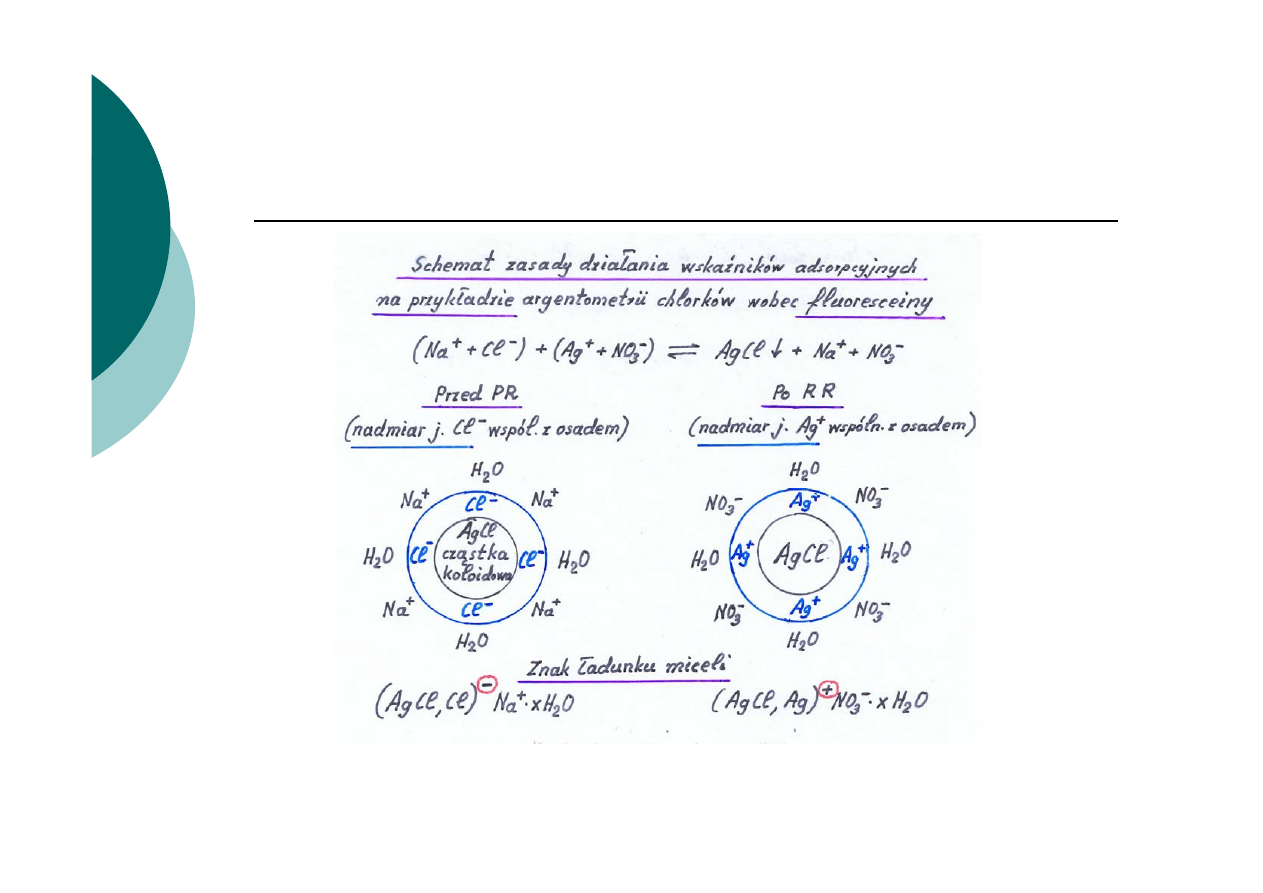
Istota zasady działania wskaźników
adsorpcyjnych
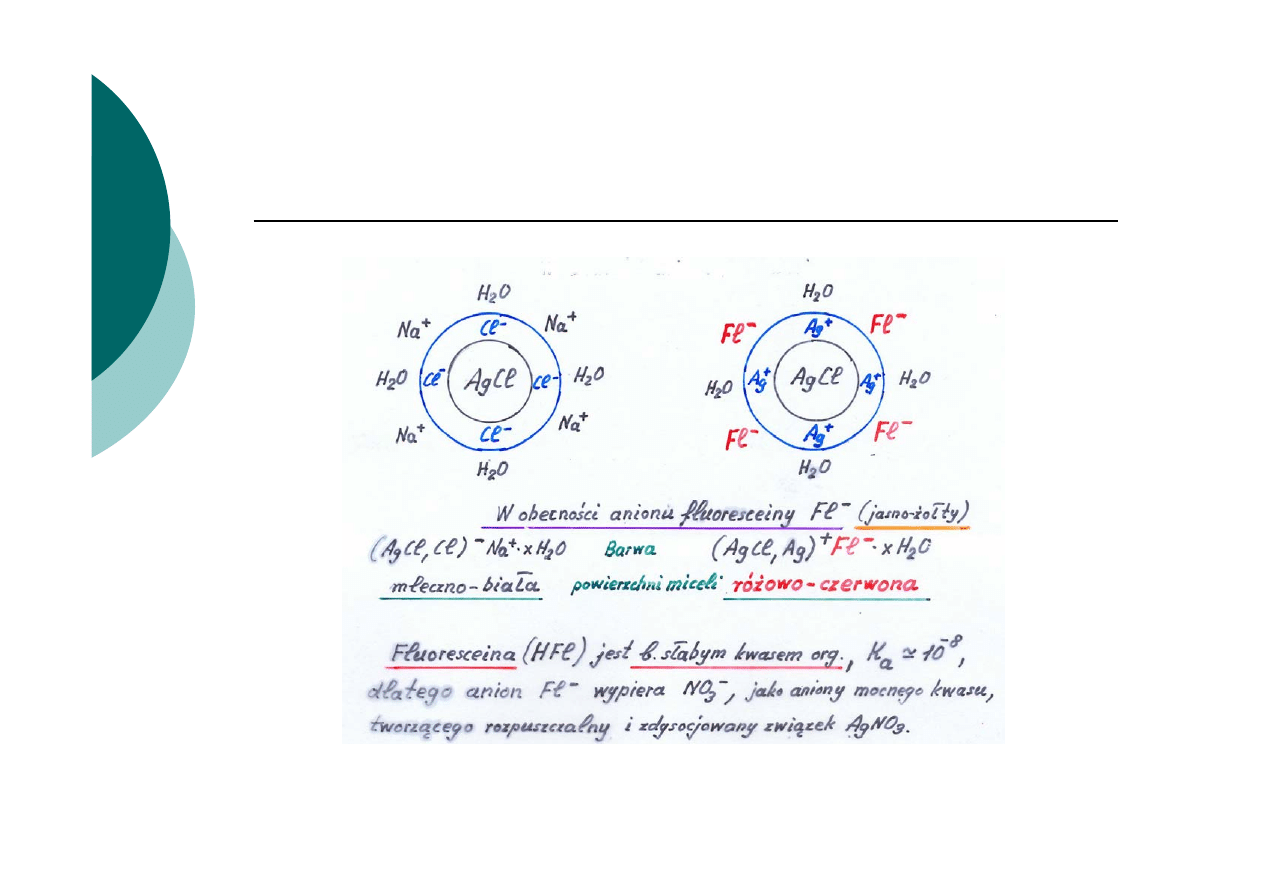
Istota zasady działania wskaźników adsorpcyjnych

Czułość metod analizy miareczkowej
m
ozn
= f·v·c
f [g/mol] = masa analitu równoważna masie v·c
titrantu
Wnioski:
1.
Czułość metod miareczkowych tym większa im
mniejsze c titrantu
2.
Dobieramy c ≈c
o
3.
Dla danej reakcji analitycznej (znane f) czułość
metody określa odwrotność f·c
4.
Możliwość automatyzacji z fotokomórką
ozn
m
c
f
v
⋅
=
1
c
f
dm
dv
dx
dy
E
ozn
⋅
=
=
=
1
Document Outline
- MIARECZKOWANIE STRĄCENIOWE
- MIARECZKOWANIE STRĄCENIOWE (precypitometria)
- MIARECZKOWANIE STRĄCENIOWE (precypitometria)
- OGÓLNE RÓWNANIE KRZYWEJ MIARECZKOWANIA ARGENTOMETRYCZNEGO
- OGÓLNE RÓWNANIE KRZYWEJ MIARECZKOWANIA ARGENTOMETRYCZNEGO
- OGÓLNE RÓWNANIE KRZYWEJ MIARECZKOWANIA ARGENTOMETRYCZNEGO
- MIARECZKOWANIE STRĄCENIOWE (precypitometria)
- MIARECZKOWANIE STRĄCENIOWE (precypitometria)
- MIARECZKOWANIE STRĄCENIOWE (precypitometria)
- MIARECZKOWANIE STRĄCENIOWE (precypitometria)
- Wnioski ogólne wynikające z równań krzywej miareczkowania (argentometrycznego) strąceniowego
- Przykłady metod miareczkowania strąceniowego
- Przykłady metod miareczkowania strąceniowego
- Charakterystyka analityczna metody Mohra
- Charakterystyka analityczna metody Mohra
- Charakterystyka analityczna metody Mohra
- Charakterystyka analityczna metody Mohra
- obliczanie skoku krzywej miareczkowania dla AgCl
- obliczanie skoku krzywej miareczkowania dla AgCl
- obliczanie skoku krzywej miareczkowania dla AgCl
- Przykłady metod miareczkowania strąceniowego
- Przykłady metod miareczkowania strąceniowego
- Charakterystyka analityczna metody Volharda
- Przykłady metod miareczkowania strąceniowego
- Zmiany w ilości zanieczyszczeń wprowadzanych do środowiska przez Polskę
- Przykłady metod miareczkowania strąceniowego
- SZKODLIWE ODDZIAŁYWANIA RTĘCI
- Wskaźniki w analizie strąceniowej
- Wskaźniki w analizie strąceniowej
- Wskaźniki w analizie strąceniowej
- Wskaźniki adsorpcyjne
- Fluoresceina
- Istota zasady działania wskaźników adsorpcyjnych
- Istota zasady działania wskaźników adsorpcyjnych
- Czułość metod analizy miareczkowej
Wyszukiwarka
Podobne podstrony:
Miareczkowanie strąceniowe,
Miareczkowanie strąceniowe
W19 kompleksonometria, wska«niki i krzywe miareczkowania kompleks i
MIARECZKOWANIE 4 id 298319 Nieznany
ANALIZA MIARECZKOWA
sprawozdanie z miareczkowania, UP Wrocław, IŚ I SEM, Chemia
Analiza Instrumentalna Miareczkowanie spektrofotometryczne Sprawozdanie 3 x
miareczkownie, NAUKA, chemia, lab
miareczkowanie kulometryczne
Miareczkowanie wykres
Sprawozdanie miareczkowanie
miareczkowanie suszu z owoców, 2 rok, OGÓLNA TECHNOLOGIA ŻYWNOŚCI, cw, pytania
13. Miareczkowanie amperometryczne, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metod
Miareczkowanie konduktometryczne kwasu solnego, Studia - IŚ - materiały, Semestr 05, Ochrona powietr
Sprawozdanie miareczkowanie
Sprawozdanie Konduktometryczne miareczkowanie surowca?rmaceutycznego
podstawy miareczkowania
miareczkowanie, miareczkowanie0001
więcej podobnych podstron