$
,
H
=
Ψ
Ψ Ψ Ψ
=
E
(x,y,z)
-
2m
E
2
h
∇
−
= ⋅
2
2
4
Ψ
Ψ
Ψ
e
r
o
πε
(
)
∂
∂
∂
∂
∂
∂
πε
2
2
2
2
2
2
x
2
2m
E
+
+
+
+ ⋅ =
y
z
o
e
r
h
Ψ
Ψ
Ψ
1
4
2
0
r
x
y
z
=
+
+
2
2
2
Atom wodoru
x
y
z
r
Równanie Schrödingera dla atomu wodoru
∂
∂
∂
∂
∂
∂
πε
2
2
2
2
2
2
x
y
z
Ψ
Ψ
Ψ
Ψ
+
+
+
⋅
+
+
+
=
2
0
1
4
2
2
2
2
m
E
e
x
y
z
o
h
2
Równanie Schrödingera dla atomu wodoru (c.d.)
NIE DA SI
Ę
ROZWI
Ą
ZA
Ć
ANALITYCZNIE !!
!!!
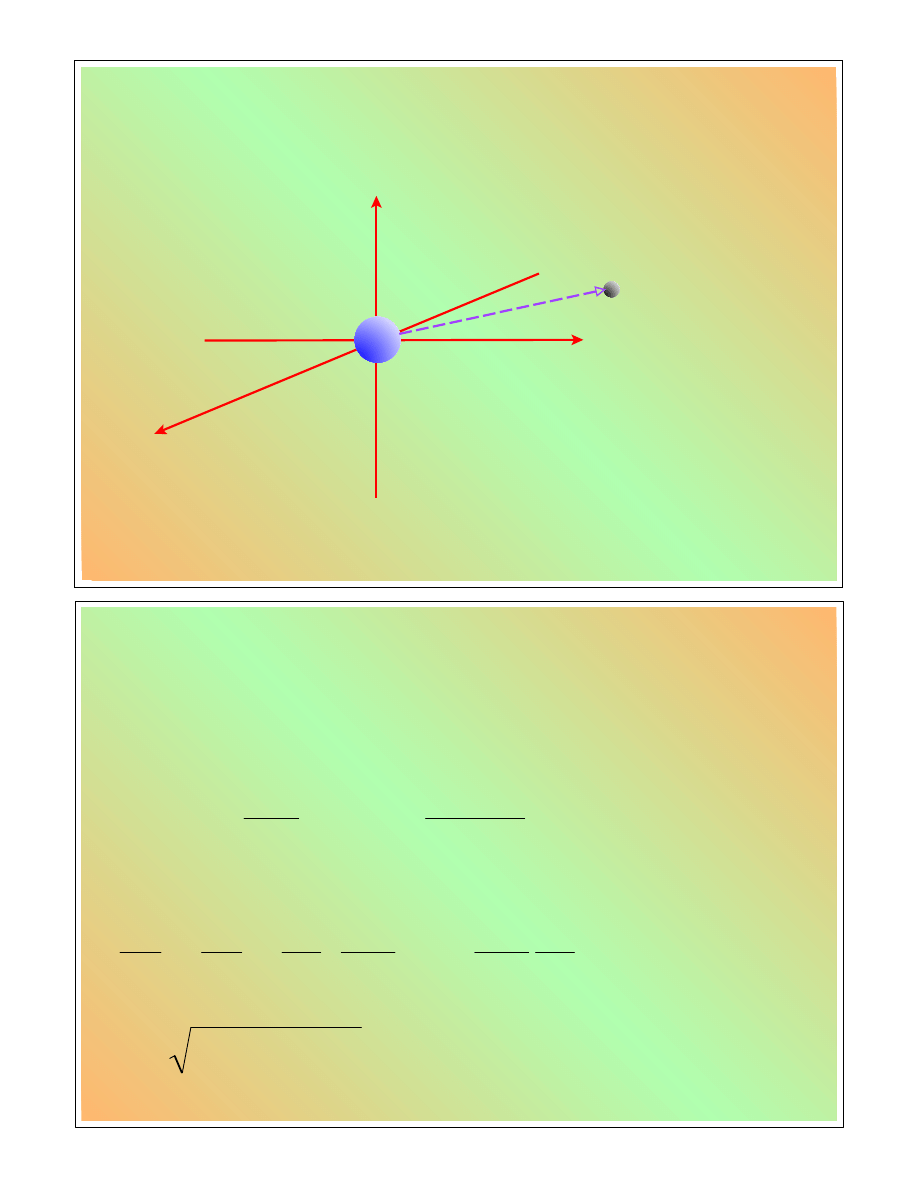
Układ współrzędnych
M
x
y
z
W układzie
współrz
ę
dnych
kartezja
ń
skich:
x
M
, y
M
, z
M
r
h
n
W układzie współrz
ę
dnych
biegunowych sferycznych:
r,
h
,
n
r
x
y
z
=
+
+
2
2
2
ϑ
=
arccos
z
r
ϕ
=
+
arccos
x
x
y
2
2
1
1
2
4
0
2
2
2
2
2
2
r
r
r
r
m
E
e
r
o
⋅
+
+
+
+
+
⋅
=
sin
sin
sin
sin
ϑ
ϑ ∂
∂
∂
∂
∂
∂ϑ
ϑ ∂
∂ϑ
ϑ
∂
∂ϕ
πε
Ψ
Ψ
Ψ
Ψ
h
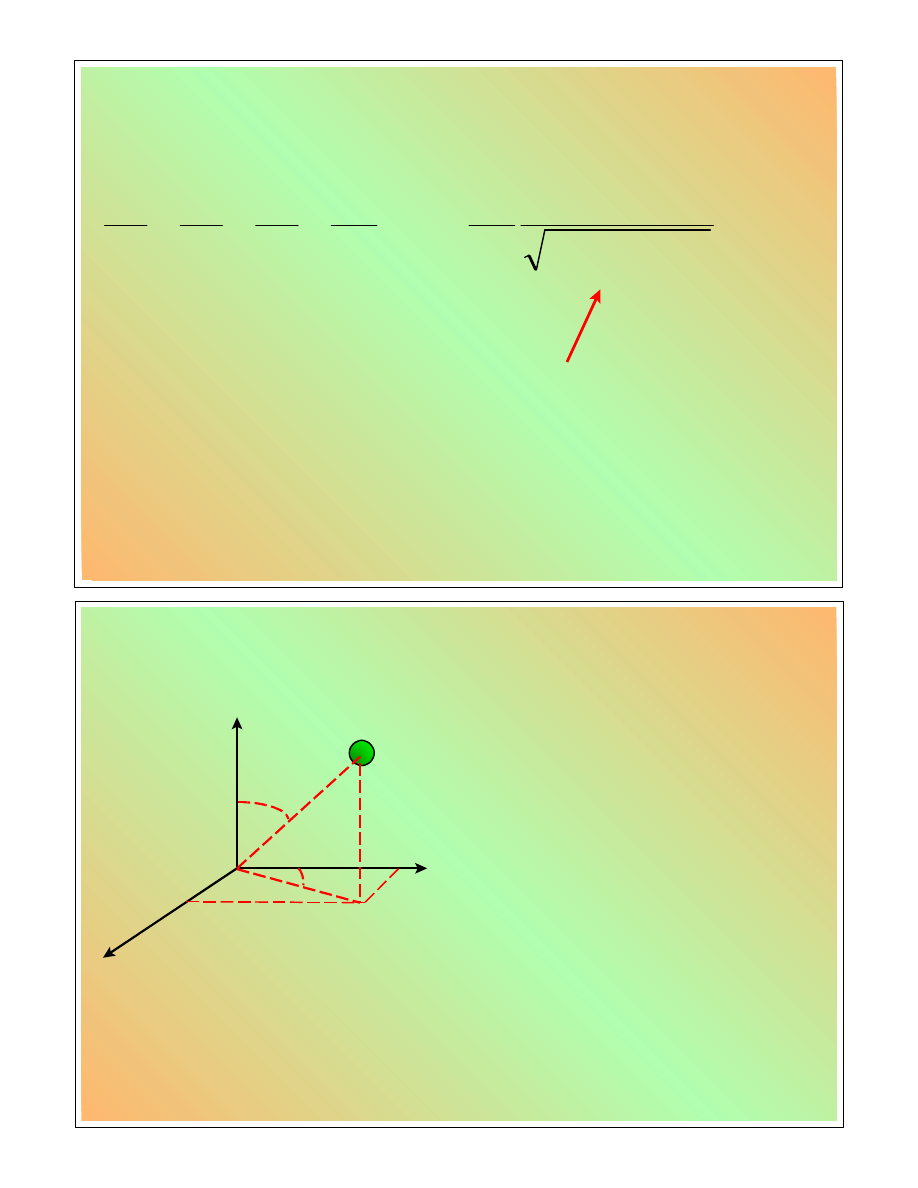
Układ współrzędnych (2)
M
x
y
z
r
h
n
x
M
=
r
@
cos
n@
sin
h
y
M
=
r
@
sin
n@
sin
h
z
M
=
r
@
cos
h
Równanie Schrödingera dla atomu wodoru (3)
Po zamianie układu współrzędnych na biegunowe sferyczne:
NIE UCZY
Ć
SI
Ę
NA PAMI
ĘĆ
!!!
Obejrze
ć
i zapomnie
ć
...
Rozwiązanie r. Schrödingera dla atomu
wodoru
*
R(r)
*
2
dr
prawdopodobie
ń
stwo radialne,
elektron pomi
ę
dzy r a r + dr
*
Y(
h
,
n
)
*
2
MhMn
prawdopodobie
ń
stwo k
ą
towe,
elektron w kierunku pomi
ę
dzy
h
a
h
+
Mh
oraz
n
a
n
+
Mn
Równanie Schrödingera dla atomu wodoru (2)
Q
Q
Q
Q
(x,y,z) =
Q
Q
Q
Q
(r,
h
h
h
h
,
n
n
n
n
)
Q
Q
Q
Q
(r,
h
h
h
h
,
n
n
n
n
) = R(r)
@@@@
Y(
h
h
h
h
,
n
n
n
n
)
Rozdzielenie zmiennych w równaniu
ró
ż
niczkowym =
rozdział na kilka równa
ń
WARUNEK KONIECZNY:
Q
Q
Q
Q
(r,
h
h
h
h
,
n
n
n
n
)
JEST
FUNKCJ
Ą
PORZ
Ą
DN
Ą
R(r)
Y(
h
h
h
h
,
n
n
n
n
) S
Ą
TAK
ś
E KLASY Q
E
m e
const
e
o
= −
=
π
ε
4
2
2 h n
n
2
2
r
r
r
M
m v
r
= × ×
M
l(l
)
=
+
1 h
Warunki dla funkcji klasy Q (1)
Energia całkowita mo
ż
e przybiera
ć
tylko
pewne warto
ś
ci:
gdzie n = 1,2,3, .......
GŁÓWNA LICZBA KWANTOWA
muszą być spełnione, żeby rozwiązanie dla atomu wodoru
składało się z funkcji porządnych
Warunki dla funkcji klasy Q (2)
Moment pędu:
Moment p
ę
du elektronu mo
ż
e przybiera
ć
tylko
pewne warto
ś
ci:
gdzie l = 0,1,2, ..... (n-1)
POBOCZNA LICZBA KWANTOWA
ORBITALNA LICZBA KWANTOWA
M
m
z
= ⋅
h
Warunki dla funkcji klasy Q (3)
Moment p
ę
du mo
ż
e mie
ć
tylko pewne orientacje
w przestrzeni, tj. jego składowa w wybranym
kierunku osi z mo
ż
e przybiera
ć
pewne warto
ś
ci:
gdzie m = -l, -l + 1,....,0, .....l - 1, l
MAGNETYCZNA LICZBA KWANTOWA
Wartości energii całkowitej
Energia
elektronu
n = 1
n = 2
n = 3
n = 4
n = 7
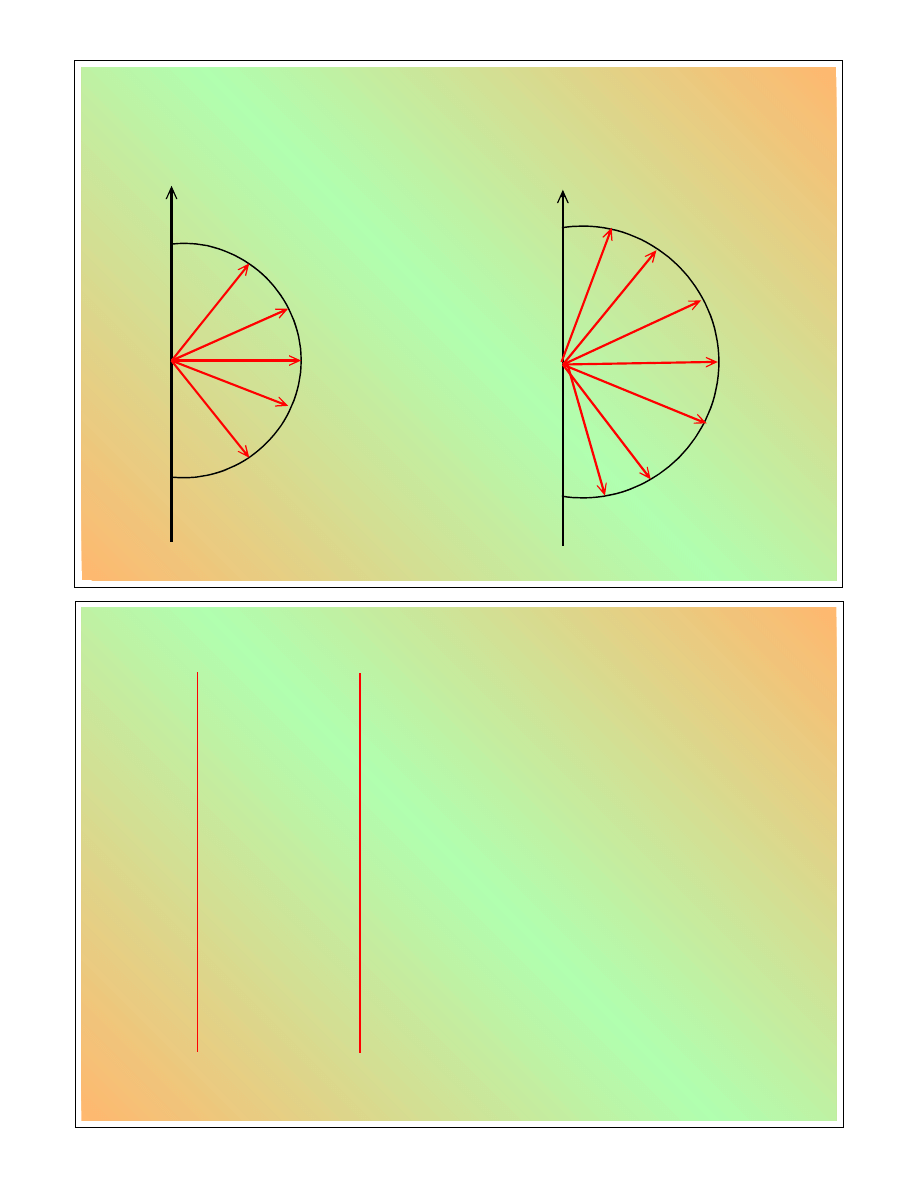
Moment pędu i jego składowa M
z
z
l
=2
m = 0,±1,±2
0
l
=3
£
-
£
2
£
-2
£
z
m = 0,±1,±2,±3
0
£
-
£
2
£
-2
£
3
£
-3
£
Liczby kwantowe
n
l
m
1
0
0
2
0
0
1
-1,0,+1
3
0
0
1
-1,0,+1
2
-2,-1,0,+1,+2
4
0
0
1
-1,0,+1
2
-2,-1,0,+1,+2
3
- 3,-2,-1,0,+1,+2+3
Każda kombinacja liczb odpowiada jednej funkcji falowej
Wyszukiwarka
Podobne podstrony:
podstawy chemii wyklad05
podstawy chemii wyklad16(1)
podstawy chemii wyklad07 id 366 Nieznany
podstawy chemii wyklad08
podstawy chemii wyklad10 id 366 Nieznany
podstawy chemii wyklad13
podstawy chemii wyklad11
podstawy chemii wyklad09
podstawy chemii wyklad12 id 366 Nieznany
podstawy chemii wyklad06
Podstawy chemii wykład II
podstawy chemii wyklad03
podstawy chemii wyklad01
podstawy chemii wyklad16(1)
podstawy chemii wyklad14
podstawy chemii wyklad04
podstawy chemii wyklad02 id 366 Nieznany
podstawy chemii wyklad05
więcej podobnych podstron