
Definicja immobilizacji
Immobilizacja – technika unieruchamiania
biokatalizatorów / enzymów na nośnikach,
stosowana powszechnie w badaniach naukowych i
przemyśle (chemicznym, spożywczym)

Problemy związane z wykorzystaniem
wolnych enzymów:
wysoka cena związana z kosztem izolacji i
oczyszczania enzymów,
szybka utrata stabilności powodowana
niestabilnością struktury ex vivo,
wrażliwość na zmianę pH, temperatury, obecność
aktywatorów lub inhibitorów.

Immobilizacja pozytywnie wpływa na stabilizację
struktury białek, a przez to zmniejsza ich
wrażliwość na zmiany temperatury, pH czy
obecność czynników denaturujących.

Zalety immobilizacji:
wielokrotne użycie immobilizowanego enzymu,
łatwe, całkowite i szybkie oddzielenie produktu od enzymu,
większa stabilność unieruchomionego enzymu w stosunku do
formy wolnej,
możliwość dokładnej i łatwej kontroli środowiska reakcji,
ułatwienie stosowania enzymów w technologiach ciągłych i
półautomatycznych,
możliwość stosowania rozpuszczalników organicznych w
środowisku reakcji (białko jest chronione przed denaturacją).
WSZYSTKO TO WPŁYWA NA OBNIŻENIE
KOSZTÓW WYKORZYSTANIA ENZYMÓW

Nośniki enzymów
Nieorganiczne:
szkła
żele krzemionkowe
tlenki metali
Organiczne:
białka (kolagen, albumina, żelatyna)
polisacharydy (celuloza, agar, alginiany)
polimery syntetyczne (celofan, akrylamidy, żywice
jonowymienne)

Metody immobilizacji
Adsorpcja na powierzchni nośnika:
1. Adsorpcja i adhezja (siły jonowe, w. wodorowe)
2. W. kowalencyjne (peptydowe, estrowe, C-C, C-N)
Wiązanie w matrycy nośnika:
1. Pułapkowanie w żelach
naturalnych i syntetycznych
(np. poliakrylamidzie,
alginianie)
2. Pułapkowanie we włóknach
(np. w octanie celulozy)
Zamykanie wewnątrz membran półprzepuszczalnych:
1. W komórkach naturalnych (np. erytrocytach)
2. Kapsułkowanie i mikrokapsułkowanie (liposomy, kapsułki nylonowe)
3. Zamykanie między membranami lub w wężach półprzepuszczalnych (np. silikonowych)
Unieruchamianie bez nośnika:
1. Sieciowanie przestrzenne,
kopolimeryzacja z nośnikami
rozuszczalnymi

ILOŚĆ, AKTYWNOŚĆ, STABILNOŚĆ,
OPTIMUM pH i TEMPERATURA DZIAŁANIA
IMMOBILIZOWANEGO ENZYMU ZALEŻĄ
OD
RODZAJU MATRYCY I SPOSOBU
WIĄZANIA

Warunki immobilizacji
Stosowana procedura nie powinna wpływać na aktywność
biologiczną enzymów. Należy unikać:
skrajnych pH,
dużych stężeń reagentów,
wysokiej temperatury,
obecności rozpuszczalników organicznych.
Katalityczne zdolności enzymów są warunkowane przez
trzeciorzędową strukturę białek, która jest utrzymywana
przez stosunkowo słabe oddziaływania jonowe,
hydrofobowe i mostki disiarczkowe między resztami
aminokwasów
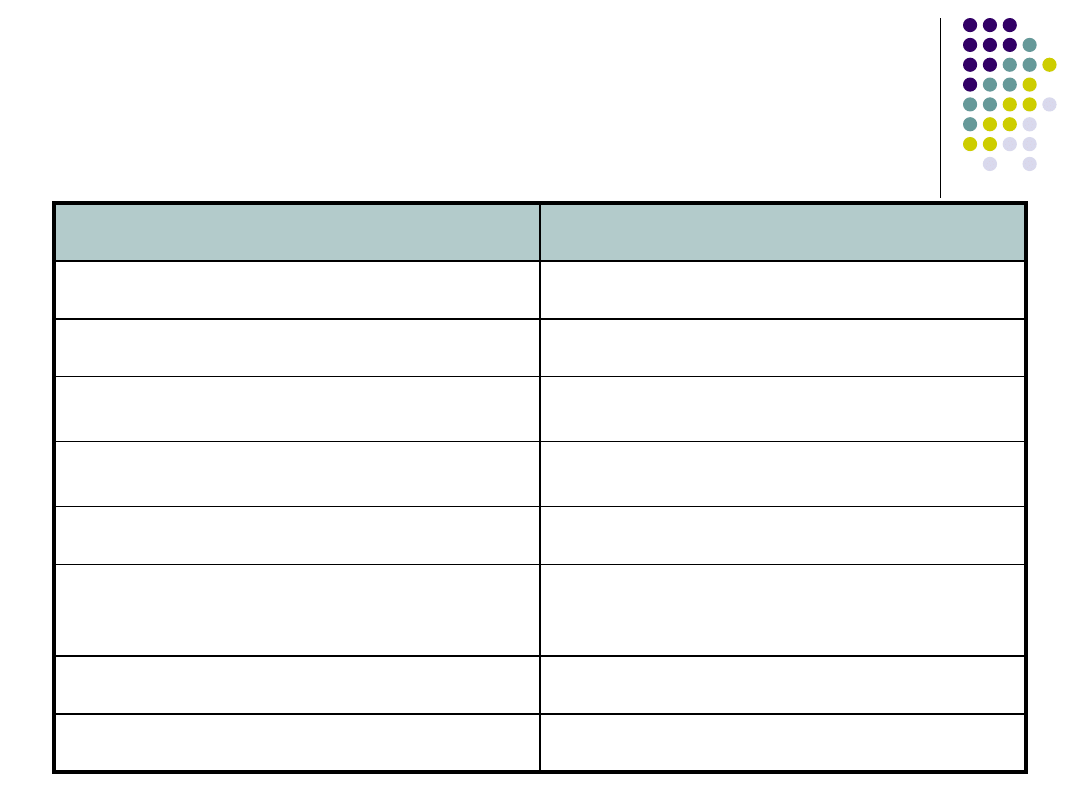
Wykorzystanie immobilizowanych
enzymów w przemyśle
ENZYM
ZASTOSOWANIE
Izomeraza glukozowa
Przemysł spożywczy (przetwórstwo skrobii)
Glukoamylaza
Przemysł spożywczy (przetwórstwo skrobii)
Lipaza
Przemysł spożywczy (produkcja tłuszczów
jadalnych)
Inwertaza
Przemysł spożywczy (produkcja cukru
inwertyzowanego)
Termolizyna
Przemysł spożywczy (produkcja aspartamu)
Acylaza penicylinowa
Przemysł farmaceutyczny (produkcja kw. 6-
aminopenicylanowego – półproduktu do produkcji
penicylin półsyntetycznych)
Beta - tyrozynaza
Przemysł farmaceutyczny (produkcja L-DOPA)
Nitrylaza
Przemysł chemiczny (produkcja akrylamidu)

β - laktamazy

β - laktamazy
Bakteryjne enzymy hydrolizujące wiązanie β-laktamowe w
cząsteczce antybiotyku β-laktamowego

β - laktamazy
Wydzielane przez bakterie gramujemne do przestrzeni
periplazmatycznej i przez gramdodatnie na zewnątrz
komórki.
Podział:
penicylinazy – rozkładające naturalne penicyliny (gronkowce)
cefalosporynazy – rozkładające wszystkie beta-laktamy z
wyjątkiem karbapenemów i cefalosporyn IV generacji;
produkowane przez bakterie gramujemne z wyjątkiem
Salmonella
plazmidowe beta-laktamazy (klasyczne i o rozszerzonym
spektrum działania); produkowane przez bakterie gramujemne
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 3 immobilizacja na chitynie
Ćwiczenie 1. immobilizacja, Mikrobiologia przemysłowa
trusek hołownia, procesy membranowe, IMMOBILIZACJA BIOKATALIZATORÓW
Lab PŁ, nr 6 immobilizowane biokatalizatory
IMMOBILIZACJA
IMMOBILIZOWANE BIOKATALIZATORY
Ćwiczenie nr 3 immobilizacja
20130312091648213id 28372 Nieznany
20130315 szacunek XII 2012
20130315 szacunek XII 2012
Engine Immobilizer System
10 Cellular phone Immobilzer ITK 02P
immobiliser PROXIMA KIDNAPER
2754A IMMOBILISER PRE BII
20130307 1 komunikat 23 MF 2009 standardy KZ
S6 Psychologia róznic indywidualnych wykład 2 20130315, Notatki(1)
Immobilizacja białek na powierzchni cząstek magnetycznych
więcej podobnych podstron