
© Copyright by Wydawnictwa Szkolne i Pedagogiczne Spółka Akcyjna, Warszawa 2009
1
Sprawdzian składa się z dwóch części. Część pierwsza zawiera 10 zadań testowych (każde za 1 punkt).
W każdym zadaniu należy wskazać jedną poprawną odpowiedź. Część druga składa się z innego typu
zadań. Za każde zadanie przewidziana jest inna liczba punktów zamieszczona po numerze zadania.
Łącznie można uzyskać 32 punkty. Ostatnie zadanie (z gwiazdką) jest dodatkowe.
Część pierwsza
1.
Nazwy pierwiastków tworzono od:
a) nazw państw lub kontynentów;
b) nazwisk znanych uczonych,
c) imion bogów greckich;
d) wszystkie odpowiedzi są poprawne.
2.
Atom pierwiastka jest to:
a) najmniejsza drobina pierwiastka zachowująca jego właściwości;
b) najmniejsza, kulista i niepodzielna drobina pierwiastka;
c) bardzo mała cząstka pierwiastka, której kulisty kształt można zobaczyć pod szkolnym
mikroskopem;
d) cząstka o bardzo małej masie, naładowana dodatnio.
3.
W osiemnastej grupie układu okresowego pierwiastków chemicznych znajdują się:
a) aktywne metale; b) gazy szlachetne; c) aktywne niemetale; d) niemetale i metale.
4.
Poniższy rysunek przedstawia model zjawiska dyfuzji:
a) gazu w gazie;
b) ciała stałego w cieczy;
c) cieczy w cieczy;
d) ciała stałego w ciele stałym.
5.
Liczba atomowa (Z) pierwiastka informuje o tym, ile w jego atomach jest:
a)
neutronów;
b)
protonów;
c)
elektronów walencyjnych;
d)
powłok elektronowych.
6.
W atomie pierwiastka o liczbie atomowej Z = 30 i liczbie masowej A = 66 liczba neutronów wynosi:
a)
30;
b)
66;
c)
36;
d)
96.
7.
W którym szeregu zapisano parę izotopów tego samego pierwiastka:
a)
X
20
8
i
X
20
9
;
b)
X
44
23
i
X
44
23
;
c)
X
32
15
i
X
34
16
;
d)
X
40
19
i
X
42
19
?
8.
Promieniowanie beta (β) przenika przez:
a) kartkę papieru;
b) folię aluminiową;
c) blachę ołowiową;
d) płytę betonową.
...........................................................................
.......................
.....................
imię i nazwisko
klasa
ocena
WERSJA
B
Sprawdzian: Budowa atomu a układ okresowy
pierwiastków chemicznych
© Copyright by Wydawnictwa Szkolne i Pedagogiczne Spółka Akcyjna, Warszawa 2009
2
9.
Pierwiastek o konfiguracji elektronowej [ 2, 8, 1 ] w układzie okresowym zajmuje
miejsce w:
a)
pierwszej grupie i drugim okresie;
b)
drugiej grupie i trzecim okresie;
c)
pierwszej grupie i trzecim okresie;
d)
trzeciej grupie i pierwszym okresie.
10.
Pierwiastki należące do drugiego okresu mają:
a)
2 powłoki elektronowe;
b)
2 protony w jądrze atomowym;
c)
2 elektrony walencyjne;
d)
2 neutrony w jądrze atomowym.
Część druga
11.
4 p.
Podanym opisom przyporządkuj nazwy pojęć.
a)
proton
1. Atomy tego samego pierwiastka różniące się liczbą neutronów
w jądrze
b)
elektron walencyjny 2. Substancja prosta, nie można jej rozłożyć na prostsze substancje
c)
pierwiastek
3. Cząstka elementarna o elektrycznym ładunku ujemnym, krążąca
wokół jądra atomowego
d)
izotopy
4. Elektron znajdujący się na ostatniej powłoce elektronowej atomu
5. Cząstka elementarna o ładunku dodatnim znajdująca się
w jądrze atomowym pierwiastka
a – …………, b – …………, c – …………, d – ………… .
12.
6 p.
Oblicz liczby protonów, elektronów i neutronów znajdujących się w atomach pierwiastka X
o liczbie atomowej Z = 5 i liczbie masowej A = 11. Narysuj model atomu pierwiastka X i określ jego
położenie w układzie okresowym.
Liczba protonów ...................
Liczba elektronów ................
Liczba neutronów .................
Model atomu pierwiastka X:
Położenie pierwiastka X w układzie okresowym: grupa ...............; okres ................
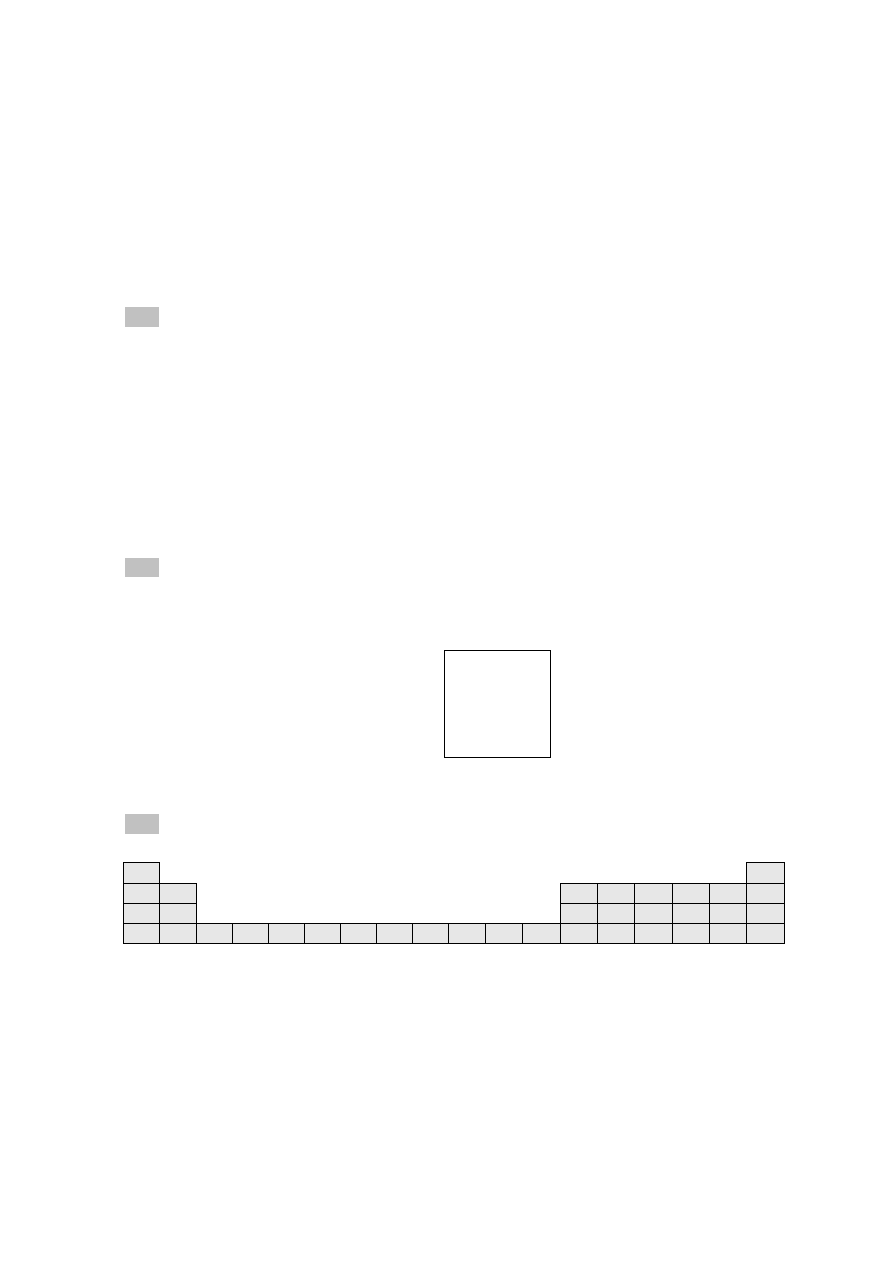
13.
5 p.
Poniżej przedstawiono fragment układu okresowego pierwiastków chemicznych.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
A
2
E
X
Y
3
Z
4
Q
Na podstawie położenia pierwiastków A–Z w układzie okresowym określ, który z nich:
a) jest najbardziej aktywnym metalem ………
b) jest najbardziej aktywnym niemetalem ………
c) ma 5 elektronów walencyjnych ………
d) ma trzy powłoki elektronowe ………
e) jest gazem szlachetnym ………
© Copyright by Wydawnictwa Szkolne i Pedagogiczne Spółka Akcyjna, Warszawa 2009
3
14.
5 p.
Określ, które zdanie jest prawdziwe, a które fałszywe. Obok każdego zdania wpisz
odpowiednio literę P (jeśli zdanie jest prawdziwe) lub F (jeśli zdanie jest fałszywe).
Promieniowanie alfa (α) przenika przez kartkę papieru. …….
Dyfuzja w gazach zachodzi szybciej niż w cieczach. …….
Gazy szlachetne są mało aktywne chemicznie. …….
Jądro atomowe zawiera protony i elektrony. ……
Neutron jest cząstką o ładunku ujemnym ……..
15.
2 p.
Podaj dwa argumenty przemawiające przeciw stosowaniu izotopów promieniotwórczych.
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………
16.
* Wiedząc, że w ciągu 3 lat połowa jąder atomowych izotopu
204
Tl ulega rozpadowi, oblicz, ile
gramów tego izotopu pozostanie po 9 latach w próbce zawierającej początkowo 100 g substancji
radioaktywnej.
Wyszukiwarka
Podobne podstrony:
Ciekawa Chemia Sprawdzian 8 Grupa A
Ciekawa Chemia Sprawdzian 4 Grupa A
Ciekawa Chemia Sprawdzian 7 Grupa A
Ciekawa Chemia Sprawdzian 8 Grupa B
Ciekawa Chemia Sprawdzian 3 Grupa A
Ciekawa Chemia Sprawdzian 6 Grupa A
Ciekawa Chemia Sprawdzian 9 Grupa B
Ciekawa Chemia Sprawdzian 1 Grupa A
Ciekawa Chemia Sprawdzian 9 Grupa A
Ciekawa Chemia Sprawdzian 5 Grupa A
Ciekawa Chemia Sprawdzian 2 Grupa A
Ciekawa Chemia Sprawdzian 6 Grupa B
Ciekawa Chemia Sprawdzian 4 Grupa B
Ciekawa Chemia Sprawdzian 5 Grupa B
Ciekawa Chemia Sprawdzian 8 Grupa A
Ciekawa Chemia Sprawdzian 4 Grupa A
więcej podobnych podstron