2012-03-28
1
ENZYMY
Kinetyka reakcji enzymatycznych na przykładzie
amylazy ślinowej
Ćwiczenie 2
To
biokatalizatory
przyspieszające szybkość reakcji biochemicznych
zachodzących na terenie organizmu (komórki, tkanki, narządu,
płynów ustrojowych)
I
ch funkcja regulowana jest przez nadrzędną kontrolę hormonalną
Hormony;
1)
aktywują lub dezaktywują enzymy w szlakach przekaźnictwa komórkowego
poprzez aktywację odpowiednich
kinaz białkowych
(fosforylacja zmieniająca
aktywność enzymów). W ten sposób działają hormony:
......
- białkowe
......
- katecholaminy
......
- czynniki wzrostowe
2) induku
ją
synte
zę enzymów
de novo.
W ten
sposób działają hormony steroidowe.
Hormony
białkowe w niektórych przypadkach także indukują syntezę enzymów
de novo.
P. Niemiec 2010
ENZYMY
2012-03-28
2
BUDOWA
O
koło 2000 znanych enzymów to białka globularne
C
zęść enzymów składa się jedynie z aminokwasów
W
iększość enzymów poza aminokwasami posiada część niebiałkową,
o
Apoenzym
-
białkowa część enzymu
o
Kofaktor
-
niebiałkowa część enzymu
–
koenzym
-
połączony słabymi wiązaniami, zdolny do
........................
oddysocjowania (np. NAD
+
, NADP
+
, FAD)
–
grupa prostetyczna
-
połączona z częścią białkową wiązaniami
...................................
kowalencyjnymi (np. grupa hemowa, jony nieorganiczne)
Holoenzym
jest połączeniem apoenzymu z kofaktorem.
Enzym wykazuje
aktywność biologiczną tylko w tej formie.
P. Niemiec 2010
ENZYMY
KINETYKA ENZYMATYCZNA
Opisuje il
ościowe zależności pomiędzy szybkością reakcji a stężeniami
enzymu (
E
) i substratu (
S
)
Pomiaru aktywn
ości enzymu dokonuje się poprzez zmierzenie
szybk
ości reakcji (
V
). Szybk
ość reakcji chemicznej obrazuje ilość
substratu przekszt
ałcona w jednostce czasu:
o
spadek stężenia substratu (
S
)
....
o
wzrost s
tężenia produktu (
P
)
Jednostki aktywn
ości enzymatycznej
....
o
KATAL
(kat)
– jednostka układu SI, określa
.......
przemia
nę 1 Mola substratu w czasie 1 s
....
o
UNIT
(U)
- okr
eśla przemianę 1 μMola
........
substratu w czasie 1 min
P. Niemiec 2010
ENZYMY
2012-03-28
3
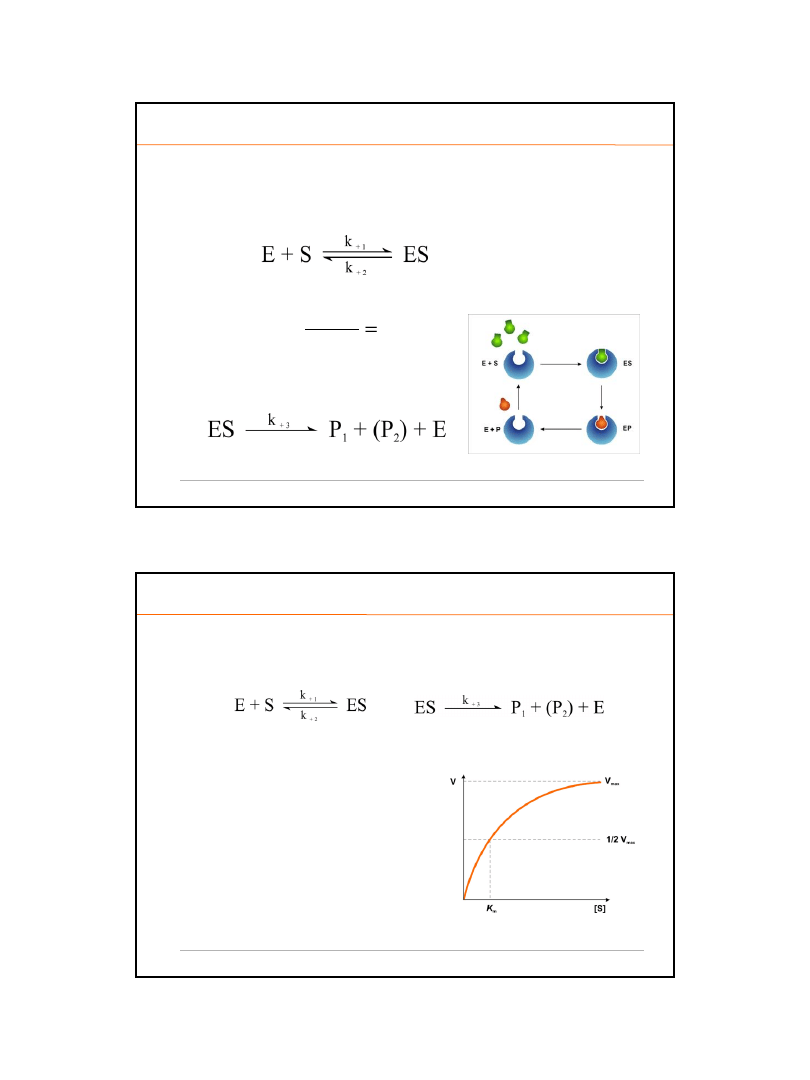
TEORIA MICHAELISA-MENTEN
1) reakcja enzymatyczna zaczyna się od przyłączenia enzymu do
substratu
gdzie k
+1
- stała szybkości tworzenia kompleksu ES,
.........
k
+2
- stała szybkości rozpadu kompleksu ES.
Do tej reakcji można zastosować prawo działania mas;
S
K
]
ES
[
]
S
][
E
[
gdzie K
S
– stała dysocjacji kompleksu ES
2) powstają produkty
gdzie k
+3
- stała szybkości tworzenia P
P. Niemiec 2010
ENZYMY
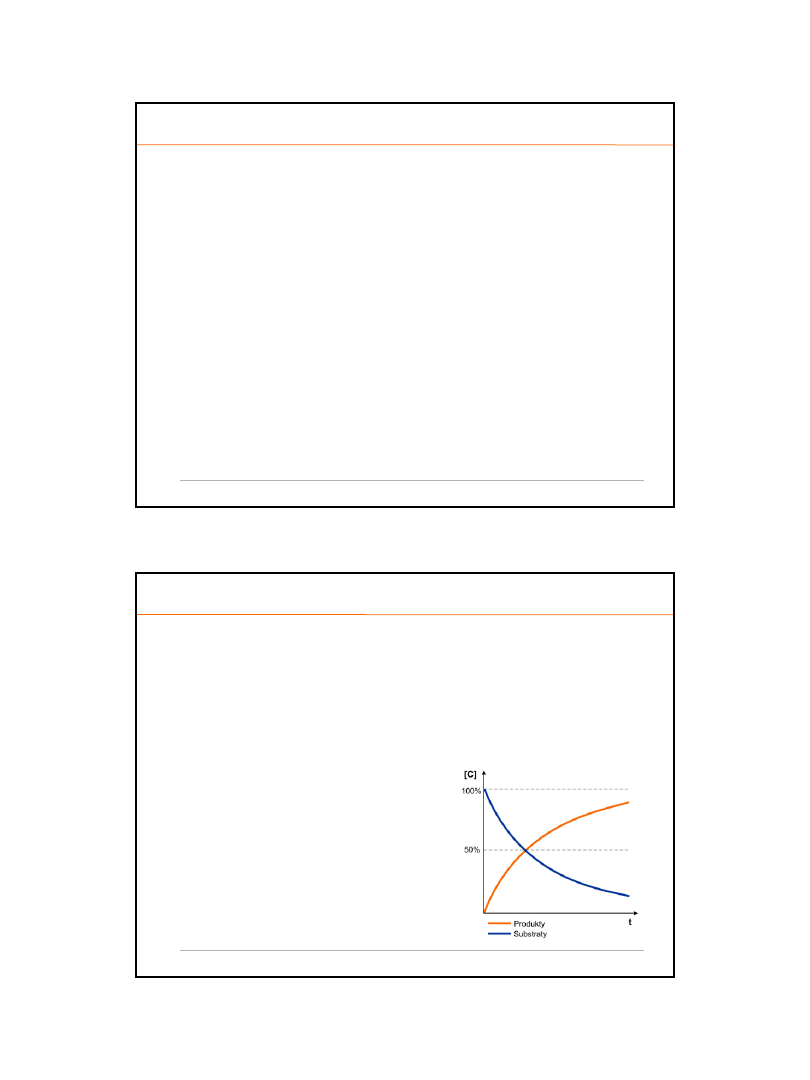
Równania te mówią, że:
o
przy okr
eślonym, niezmiennym stężeniu
E, zw
iększając stężenie S coraz więcej
......
E przekszt
ałca się w kompleks ES
o
wzrasta szybk
ość reakcji aż do momentu
.......
kiedy c
ała ilość E występuje w postaci
kompleksu ES (
stan wysycenia
) wtedy
szybk
ość osiąga wartość maksymalną
(V
max
).
TEORIA MICHAELISA-MENTEN cd.
P. Niemiec 2010
ENZYMY
2012-03-28
4
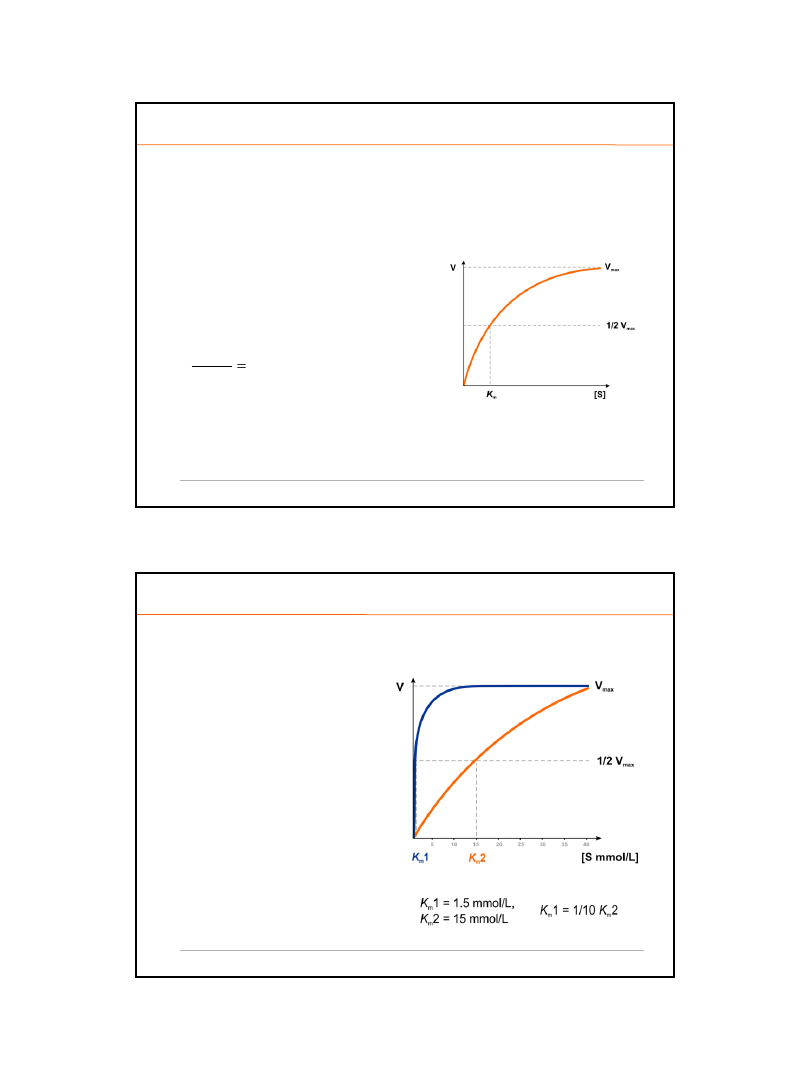
STAŁA MICHAELISA-MENTEN
Stężenie substratu w stanie wysycenia trudno odczytać z krzywej, dlatego za punkt
odniesienia obiera s
ię połowę szybkości maksymalnej (1/2 V
max
)
W tym punkcie:
o
połowa enzymu występuje w postaci E,
o
druga p
ołowa w postaci ES
Poniew
aż szybkość reakcji jest proporcjonalna
do s
tężenia ES wielkości [E] i [ES] się znoszą
[S]
1/2Vmax
= K
S
,
[S]
1/2Vmax
= K
m
gdzie K
m
– stała Michaelisa-Menten
K
m
to takie s
tężenie substratu (mmol/L) przy którym enzym jest nasycony w
p
ołowie (szybkość katalizy osiąga połowę szybkości maksymalnej)
S
K
]
ES
[
]
S
][
E
[
P. Niemiec 2010
ENZYMY
STAŁA MICHAELISA-MENTEN cd.
Wart
ość K
m
informuje
o powinowactwie enzymu
wzg
lędem substratu:
wysoka wart
ość K
m
– niskie
powinowactwo E do S
, potrzebne
d
uże [S] aby uzyskać połowiczne
nasycenie enzymu
niska
wartość K
m
– wysokie
powinowactwo
(specyficzność) E
do S
, wystarczy
małe [S] aby
uzyskać połowiczne nasycenie
enzymu
P. Niemiec 2010
ENZYMY
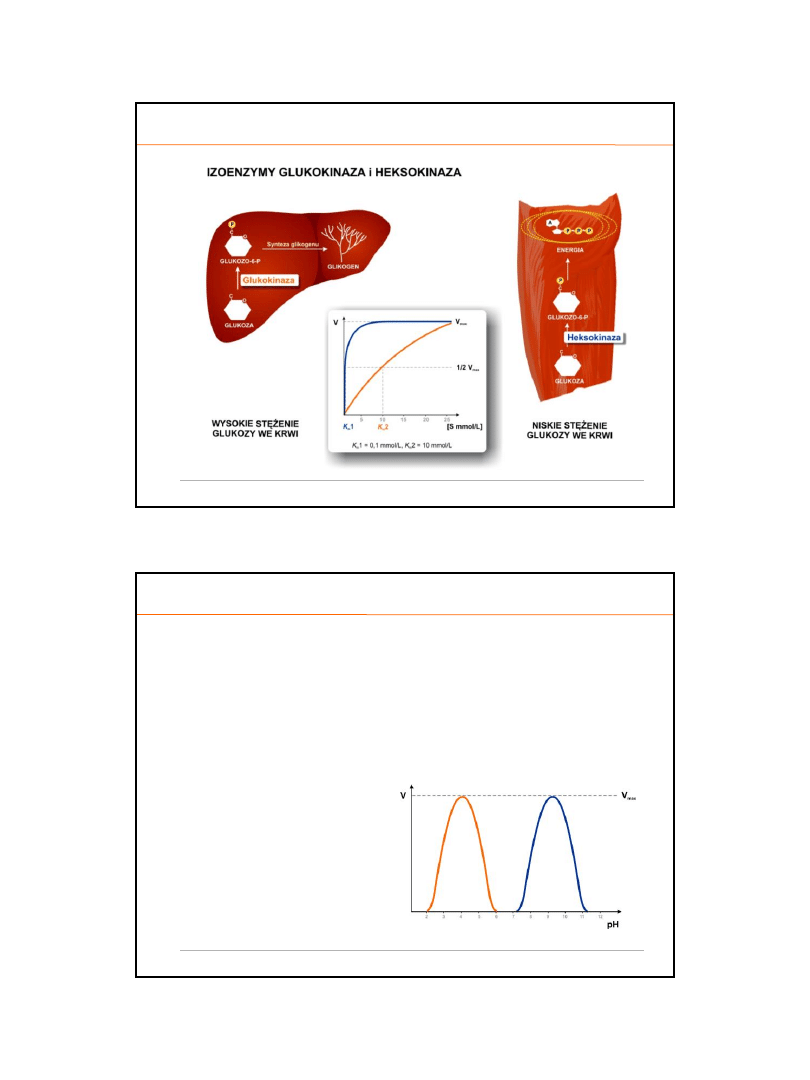
2012-03-28
5
P. Niemiec 2010
ENZYMY
W
PŁYW pH ŚRODOWISKA NA SZYBKOŚĆ REAKCJI ENZYMATYCZNEJ
o
s
zybkość katalizy największa jest w pH optymalnym
o
n
awet małe odchylenie wartości pH powoduje spadek aktywności enzymu
o
d
uże odchylenia pH powodują denaturację białka
o
o
ptimum pH dla większości enzymów człowieka to 6.8 – 7.2
o
z
darzają się jednak wyjątki
enzymy pH kwaśnego
..............
pepsyna (pH ok. 2)
................
fosfataza kwaśna (pH ok. 4)
................
enzymy lizosomalne (lipazy,
..............
nukleazy, proteinazy i inne)
enzymy pH zasadowego
fosfataza zasadowa (pH ok. 9)
P. Niemiec 2010
ENZYMY
2012-03-28
6
INHIBITORY ENZYMÓW
Hamują szybkość reakcji enzymatycznych
o
nieswoiste – powodują zwykle denaturację enzymu, lub jego
eliminację z roztworu (niektóre toksyny, metale ciężkie)
o
swoiste
– działają na określony enzym (leki, niektóre toksyny)
M
ożna je podzielić na:
o
.
kompetycyjne
– współzawodniczące, odwracalne
o
niekompetycyjne
– nieodwracalne
o
mieszane
P. Niemiec 2010
ENZYMY
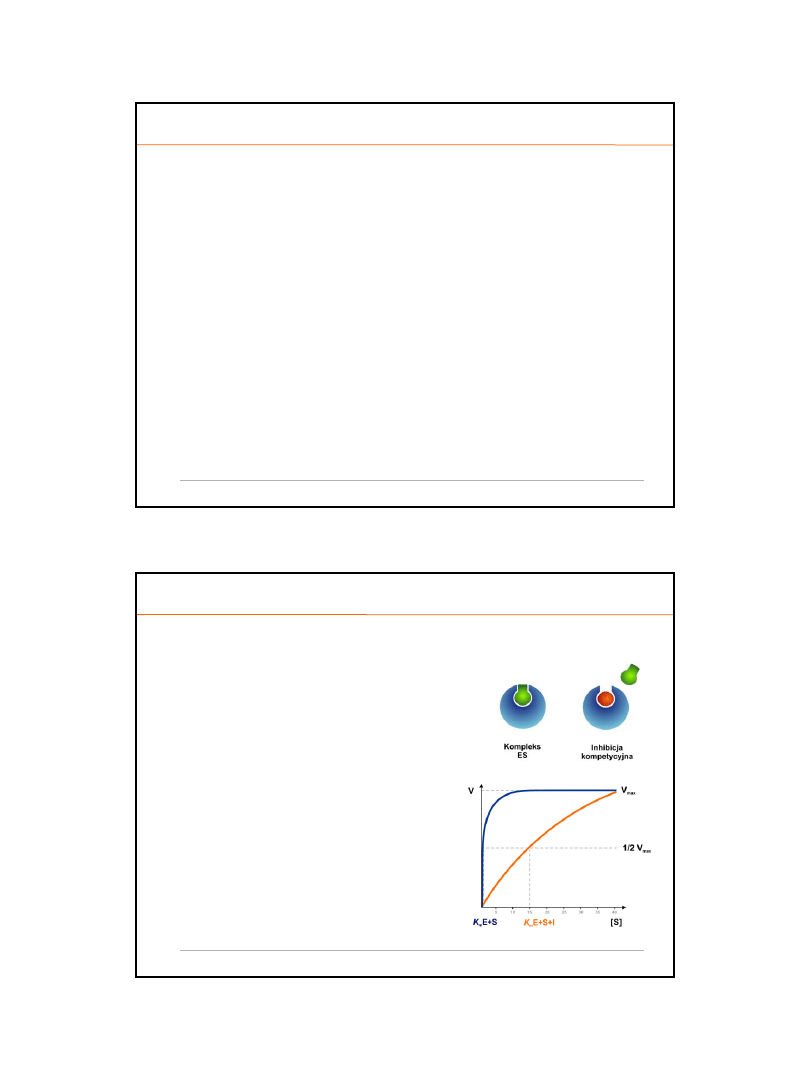
INHIBICJA KOMPETYCYJNA
o
inhibitor jest podobny strukturalnie
do substratu
o
inhibitor wsp
ółzawodniczy z substratem
o miejsce aktywne
o
inhibitor w
iąże się z centrum aktywnym
odwracalnie
. Może zostać z niego wyparty
nadmiarem substratu
o
inhibitor zmniejsza powinowactwo E do S,
zw
iększa się K
m
, V
max
nie ulega zmianie,
poniew
aż oznacza się ją przy nadmiarze
substratu.
o
często stosowane jako leki
P. Niemiec 2010
ENZYMY
2012-03-28
7
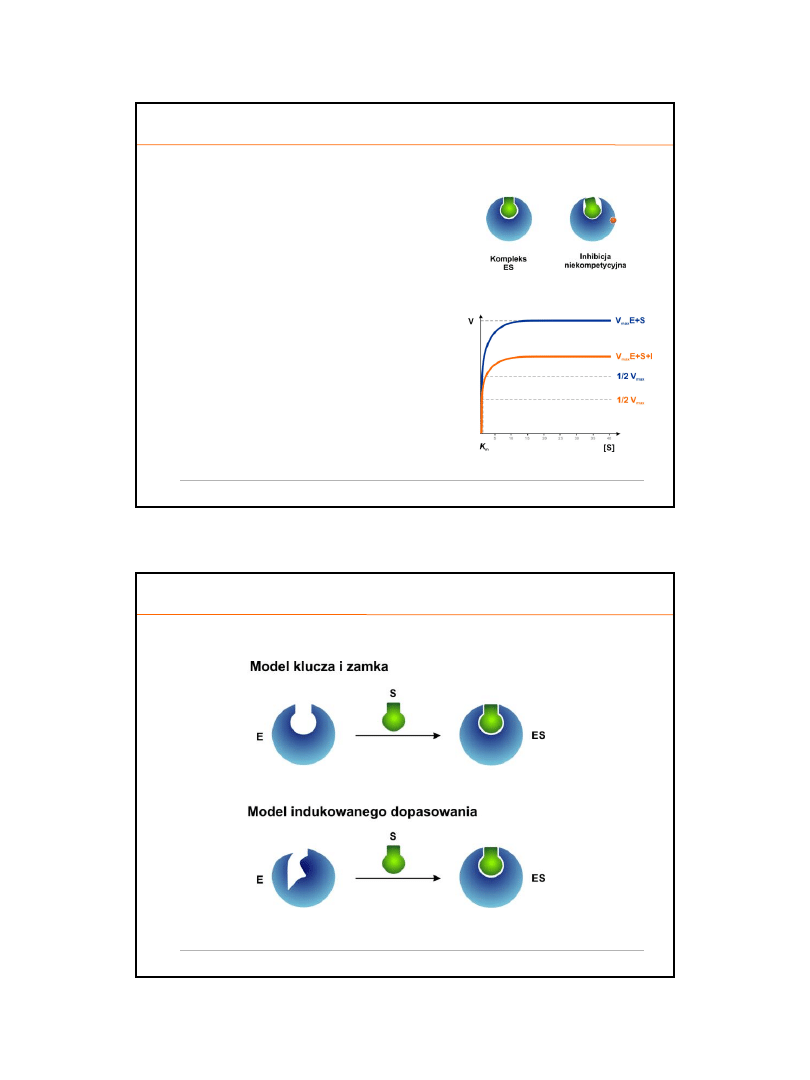
INHIBICJA NIEKOMPETYCYJNA
o
inhibitor nie jest podobny strukturalnie
do substratu
o
inhibitor
wiąże się poza miejscem
aktywnym
o
inhibitor nie zapobiega powstaniu
kompleksu ES, jednak jego obecn
ość
zmienia nieznacznie konformac
ję
miejsca aktywnego
o
pomimo w
iązania substratu szybkość
reakcji maleje (zmniejszenie V
max
), a
efektu tego nie m
ożna przezwyciężyć
nadmiarem substratu
o
wartość K
m
nie ulega zmianie, bo
c
ząsteczki enzymu, które nie przere-
agow
ały z inhibitorem nie zmieniają
swojego powinowactwa do S
P. Niemiec 2010
ENZYMY
P. Niemiec 2010
ENZYMY
2012-03-28
8
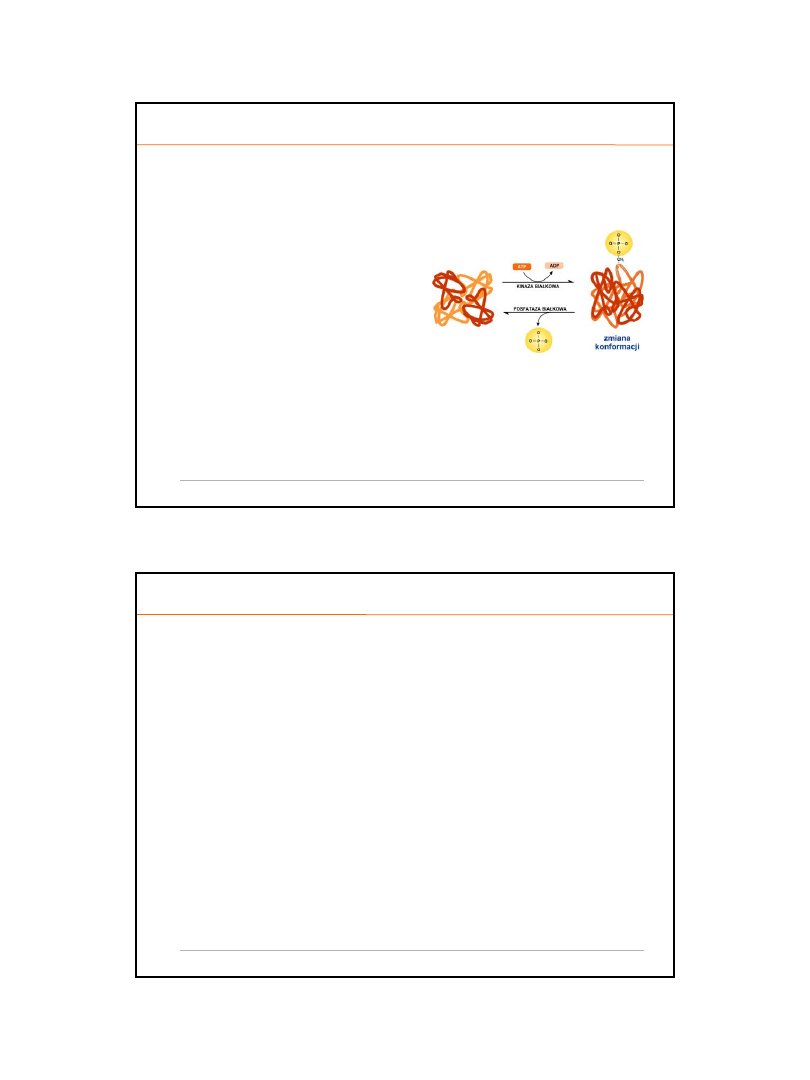
SPOSOBY AKTYWACJI ENZYMÓW -
FOSFORYLACJA
PODZIAŁ KINAZ BIAŁKOWYCH (PK)
1) w zależności od stopnia selektywności działania
o
specyficzne PK
o
wielofunkcyjne kinazy białkowe
2) w zależności od miejsca fosforylacji
o
serynowe
- fosforyl
ują reszty seryny
i treoniny (np. PKA, PKC)
o
tyrozynowe
- fosforyl
ują reszty tyro-
zyny (np. kinaza Src, receptory czy-
nników wzrostu i insuliny)
Fosforylacja zachodzi jedynie na terenie
komórki, gdzie występuje wysokie stężenie
ATP. Aktywn
ość białek zewnątrzkomórkowych nie jest regulowana przez fosforylację
SKUTKIEM FOSFORYLACJI JEST SILNE WZMOCNIENIE POC
ZĄTKOWEGO
SYGN
AŁU.
JEDNA
C
ZĄSTECZKA
PK
M
OŻE
W
KRÓTKIM
CZASIE
UFOSFORYLOW
AĆ SETKI BIAŁEK DOCELOWYCH, KTÓRE, JEŚLI SĄ
ENZYMAMI MO
GĄ PRZEKSZTAŁCIĆ DUŻĄ ILOŚĆ CZĄSTECZEK SUBSTRATU
P. Niemiec 2010
ENZYMY
AKTYWACJA PROTEOLITYCZNA
o
j
est nieodwracalną modyfikacją enzymu
o
m
oże zachodzić pozakomórkowo
o
zymogeny
(proenzymy)
to nieaktywne prekursory enzymów
o
s
ą aktywowane przez specyficzną hydrolizę jednego lub kilku
wiązań peptydowych
o
przykłady
- pepsynogen > pepsyna
- trypsynogen > trypsyna
- chymotrypsynogen > chymotrypsyna
- proelastaza > elastaza
- prokaspazy > kaspazy
- prorenina > renina
P. Niemiec 2010
ENZYMY

2012-03-28
9
AKTYWACJA PROTEOLITYCZNA cd.
o
t
rypsyna jest wspólnym aktywatorem
wszystkich zymogenów trzustkowych,
czyli:
- trypsynogenu
- chymotrypsynogenu
- proelastazy
- prokarboksypeptydazy
i innych enzymów
o
trypsynogen z trzustki przedostaje s
ię do dwunastnicy.
o
tutaj dzi
ała enzym
enterokinaza
hydrolizu
jący jedno wiązanie
peptydowe pom
iędzy lizyną i izoleucyną, tworząc trypsynę.
o
po aktywacji dochodzi do f
ałdowania obszarów białka o strukturze
rozl
uźnionej co w konsekwencji prowadzi do utworzenia miejsca
aktywnego
P. Niemiec 2010
ENZYMY
Wyszukiwarka
Podobne podstrony:
1 sienkiewicz nowele 1id 9747 Nieznany
2 1 V 1 02 ark 07id 20006 Nieznany
bns kalisz 02 06 id 90842 Nieznany (2)
18363354,zalacznik 1id 17967 Nieznany (2)
02 Identyfikacja zachowan konsu Nieznany (2)
02 2004 kurpiszid 3523 Nieznany
Cw 02 M 04A Badanie wlasciwos Nieznany
17 02 2011 2id 17062 Nieznany (2)
02 Charakteryzowanie typow i ro Nieznany (2)
02 Krotko i dlugoterminowe dec Nieznany
na5 pieszak 03 02 10 1 id 43624 Nieznany
2009 02 17 test egzaminacyjny n Nieznany (2)
2003 02 Fosdem February 2003, K Nieznany
02 Zielona wiosenkaid 3865 Nieznany
02 07 azbestid 3506 Nieznany (2)
02 rozdzial 01 t4p4wqyl4oclhuae Nieznany (2)
24 02 2011 2 id 30494 Nieznany (2)
02 Przestrzeganie przepisow bez Nieznany (2)
02 Charakteryzowanie maszyn rol Nieznany (2)
więcej podobnych podstron