POLITECHNIKA POZNAŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
str. 1
WPŁYW SIŁY JONOWEJ ROZTWORU NA STAŁĄ SZYBKOŚCI REAKCJI
WSTĘP
Rozpatrzmy reakcję przebiegającą w roztworze między jonami A oraz B :
A B
D
k
+ →
(1)
Gdy reakcja ta zachodzi przez równowagę wstępną, w układzie występuje produkt pośredni C:
A + B
K
C
k'
→
D
(2)
(K - stała równowagi pierwszej reakcji, k' - stała szybkości drugiego etapu)
Przy tego typu reakcjach następczych, pierwszy etap przebiega zwykle szybko, zaś drugi etap wolno. Etapem
określającym szybkość reakcji jest więc etap drugi:
v
d
dt
k'
=
=
[D]
[C]
(3)
Wyrażenie na stałą równowagi pierwszego etapu posiada postać:
K
a
a
a
f
f
f
C
B
A
C
B
A
=
⋅
=
⋅
⋅
⋅
[C]
[A] [B]
(4)
gdzie
a
i
jest aktywnością:
Równania te prowadzą do następującego wyrażenia na stałą szybkości rozpatrywanej reakcji:
v
d
dt
k K
f
f
f
A
B
C
=
= ⋅
⋅
⋅
[D]
[
'
A] [B]
(5)
Wartość współczynników aktywności,
f
i
, oszacować można na podstawie równania Debye'a - Hückel'a:
logf
A' z
I
i
i
2
= −
(6)
gdzie I jest siłą jonową roztworu:
I
1
2
c z
i
i
2
=
⋅
∑
(7)
zaś
z
i
jest ładunkiem i-tego jonu.
Spełniona musi być również zależność:
POLITECHNIKA POZNAŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
str. 2
z
z
z
C
A
B
=
+
(8)
Występujące w równaniu (12.4) i (12.5) współczynniki aktywności opisać można więc wyrażeniem:
(
)
[
]
log
f
f
f
A'
J z
z
z
z
2A'
J z
z
A
B
C
A
2
B
2
A
B
2
A
B
⋅
= −
+
−
+
=
⋅ ⋅
(9)
Równanie (5) napisać można więc w postaci:
v
d
dt
=
=
[D]
[B]
k
(10)
gdzie:
k =
= ⋅
⋅
k' K
f
f
f
A
B
C
[A]
(11)
Równania (10) i (11) słuszne są wtedy, gdy stężenie substratu A jest dużo wyższe od stężenia substratu B, a
więc stężenie A jest stałe w czasie trwania reakcji. Z równania (12.1) wynika ponadto, iż:
v
d
dt
d
dt
=
= −
[D]
[B]
oraz
−
=
d
dt
k
[B]
[B]
(12)
co prowadzi do zależności:
log
[A]
k
k' K
2A' z z
I
A B
=
⋅
(13)
lub inaczej
logk
= +
X
Y I
(14)
gdzie:
X
k' K
=
log
[A] oraz
Y
A z z
A
B
=
2 '
(15)
Równanie (14)) wskazuje iż szybkość reakcji następczej jonowej zależna jest od siły jonowej roztworu
(stężenia obcego elektrolitu).
Przykładem reakcji rozważanego typu jest reakcja jonów OH
-
(reagent A) z fioletem krystalicznym (reagent
B):
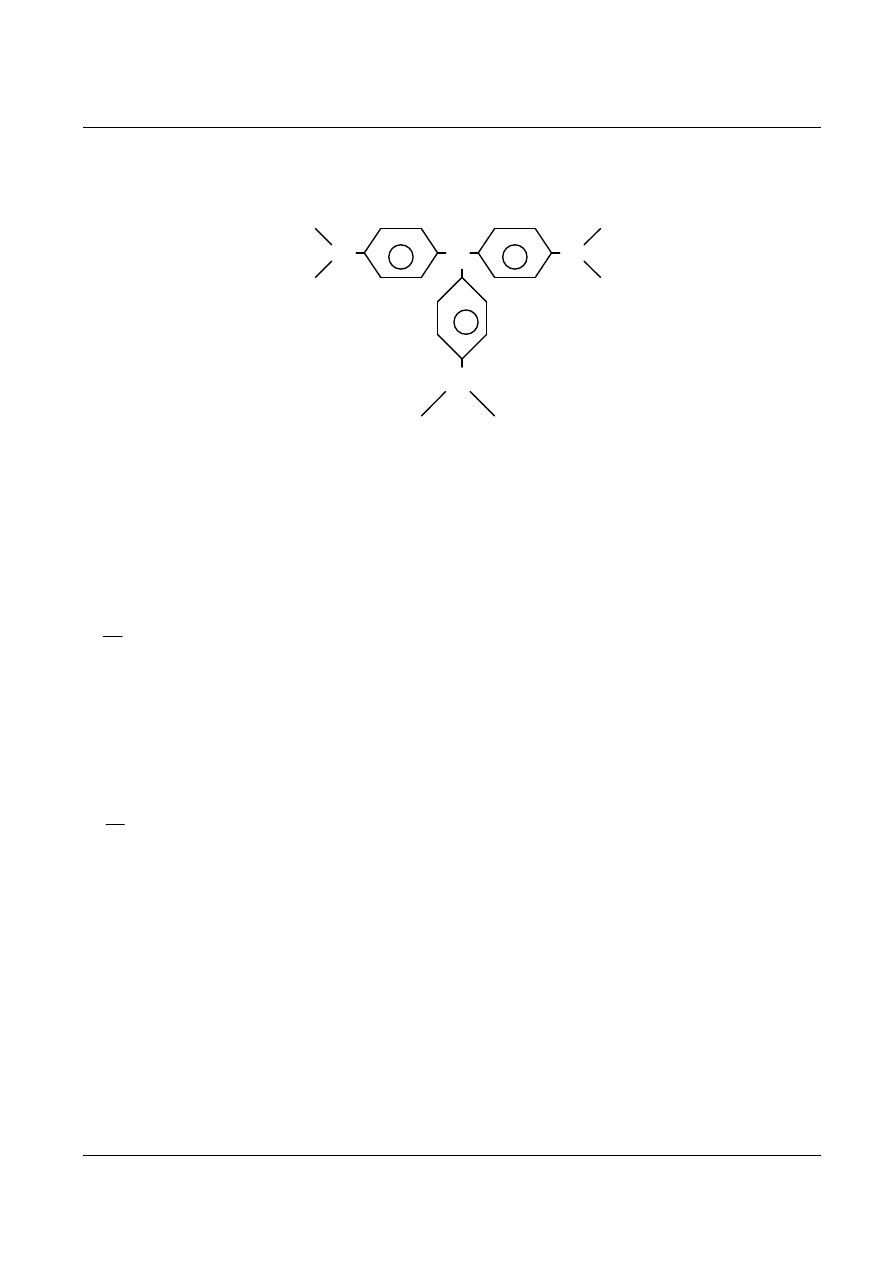
POLITECHNIKA POZNAŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
str. 3
C
+
N
N
CH
3
CH
3
CH
3
CH
3
N
CH
3
CH
3
B=
Przebieg reakcji wygodnie można śledzić metodą kolorymetryczną, gdyż fiolet krystaliczny posiada silne
widmo absorpcyjne, zaś produkt reakcji jest bezbarwny.
Równanie (12) po scałkowaniu przybiera postać:
ln
c
c
k t
0
= −
(16)
gdzie
c
- stężenia fioletu w czasie t,
c
0
- stężenie początkowe fioletu (dla t = 0),
t
- czas od rozpoczęcia reakcji (w sekundach).
Równanie (12.16) przekształcić można do postaci:
l n
A
A
kt
0
= −
gdyż A
≈
c
(17)
gdzie A oznacza absorbancję roztworu w chwili t, zaś A
o
w chwili początkowej (należy odróżnić symbol
absorbancji A od symbolu substratu A).
CEL ĆWICZENIA
Celem ćwiczenia jest znalezienie zależności stałej szybkości reakcji fioletu krystalicznego z jonami
wodorotlenowymi od siły jonowej roztworu.
APARATURA
SPECOL: z przystawką na 4 kuwety
Kuwety szklane - 4 szt., d =1 cm.

POLITECHNIKA POZNAŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
str. 4
SZKŁO
Zlewki 100 ml - 2szt.
Kolbki miarowe 50 ml - 4szt.
Pipety wielomiarowe 5 ml i 10 ml.
Tryskawka z wodą destylowaną.
ODCZYNNIKI
Roztwór KNO
3
(lub innej soli, np.KCl) 1 mol dm
-3
.
Roztwór KOH (lub NaOH) 0.1 mol dm
-3
.
Roztwór fioletu krystalicznego 10
-4
mol dm
-3
.
WYKONANIE ĆWICZENIA
1. Zmierzyć widmo fioletu krystalicznego o stężeniu 2 · 10
-5
mol dm
-3
.
Wyznaczyć długość fali dla maksymalnej absorpcji.
2. Zmierzyć zmianę absorbancji w czasie, roztworów zawierających fiolet krystaliczny o stężeniu 2
x
10
-5
mol
dm
-3
, OH
-
o stężeniu 10
-2
mol dm
-3
, obcą sól o stężeniach, 0,00, 0,01, 0,05, 0,10, 0,20, 0,25 1 mol dm
-3
.
Czas rozpoczęcia reakcji przyjąć za równy momentowi dodania do roztworów jonów OH
-
. Absorbancję
mierzyć co 5 minut od chwili rozpoczęcia reakcji.
Pomiary zakończyć po 30 minutach od chwili rozpoczęcia reakcji.
OPRACOWANIE WYNIKÓW
1. Wyznaczyć stałą szybkości reakcji dla poszczególnych roztworów.
2. Wykreślić zależność
( )
log
k f
I
=
na papierze milimetrowym.
3. Na podstawie wykresu wyznaczyć wartość liczbową stałej Debye'a-Hückel'a.
Porównać z wartością literaturową.

POLITECHNIKA POZNAŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
str. 5
Wzór tabeli i schematu opracowania
……………………………..
Wydział
……………………………….
Kierunek
Studia niestacjonarne
………………………………………………
Imi
ę
i Nazwisko studenta
…………………………………...
Data wykonywania
ć
wiczenia:
Nr grupy: …………
Nr zespołu: ………….
………..……………
Nr
ć
wiczenia:
…………………………………….
Nazwisko Prowadz
ą
cego:
1. Temat
ć
wiczenia:
2. Cel
ć
wiczenia:
3. Pomiary:
4. Obliczenia:
5. Wykresy:
6. Wnioski:
Wyszukiwarka
Podobne podstrony:
ćw 3 - siła jonowa - sprawozdanie, Chemia fizyczna
3 siła jonowa
Sprawko chemia fizyczna (Siła jonowa a stała szybkości reakcji)
3 siła jonowa
chfl ćw3 s4 siła jonowa a szybkość reakcji60
12 zginanie z sila osiowa imimi Nieznany (2)
2013 12 03 Siłą zrobili cesarskie cięcie
wykład 12 pamięć
Figures for chapter 12
Mechanika techniczna(12)
Socjologia wyklad 12 Organizacja i zarzadzanie
CALC1 L 11 12 Differenial Equations
zaaw wyk ad5a 11 12
budzet ue 11 12
więcej podobnych podstron