
PERWAPORACJA I SEPARACJA PAR – ROZDZIELANIE
MIESZANIN CIEKŁYCH Z WYKORZYSTANIEM MEMBRAN
Wojciech
KUJAWSKI
Uniwersytet Mikołaja Kopernika, Wydział Chemii,
Katedra Chemii Fizycznej i Fizykochemii Polimerów,
ul. Gagarina 7, 87-100 Toruń
e-mail: kujawski@chem.umk.pl
1. WPROWADZENIE
Metodą powszechnie stosowaną w przemyśle do rozdzielania mieszanin
substancji ciekłych na składniki jest destylacja. Jest to jednak metoda ener-
gochłonna, a w przypadku rozdziału azeotropów, składników blisko wrzą-
cych czy substancji nietrwałych termicznie wymaga stosowania wielostop-
niowych, złożonych rozwiązań.
Rozdzielcze techniki membranowe, szczególnie w połączeniu z kon-
wencjonalnymi metodami rozdziału, stwarzają warunki do uzyskania dużo
lepszych efektów końcowych zarówno pod względem jakościowym jak
i ekonomicznym.
Ogólnie rzecz ujmując, rozdzielanie składników mieszaniny w pro-
cesie membranowym polega na doprowadzeniu tej mieszaniny do kontaktu
z powierzchnią półprzepuszczalnej membrany, przez którą pewne składniki
przenikają preferencyjnie pod działaniem określonej siły napędowej oraz
dzięki specyficznym właściwościom membrany [1, 2]. Jednocześnie, mem-
brana stanowi zasadniczy element układu membranowego i powinna cha-
rakteryzować się następującymi właściwościami [3]:
• wysoką selektywnością w stosunku do wybranych składników roz-
dzielanej mieszaniny,
• dobrą przepuszczalnością,
• dobrą wytrzymałością mechaniczną i odpornością chemiczną,
• niskim kosztem wytwarzania.
2. CHARAKTERYSTYKA OGÓLNA PERWAPORACJI
MEMBRANY
TEORIA I PRAKTYKA
ZESZYT III
WYKŁADY
MONOGRAFICZNE
I SPECJALISTYCZNE
TORUŃ 2009
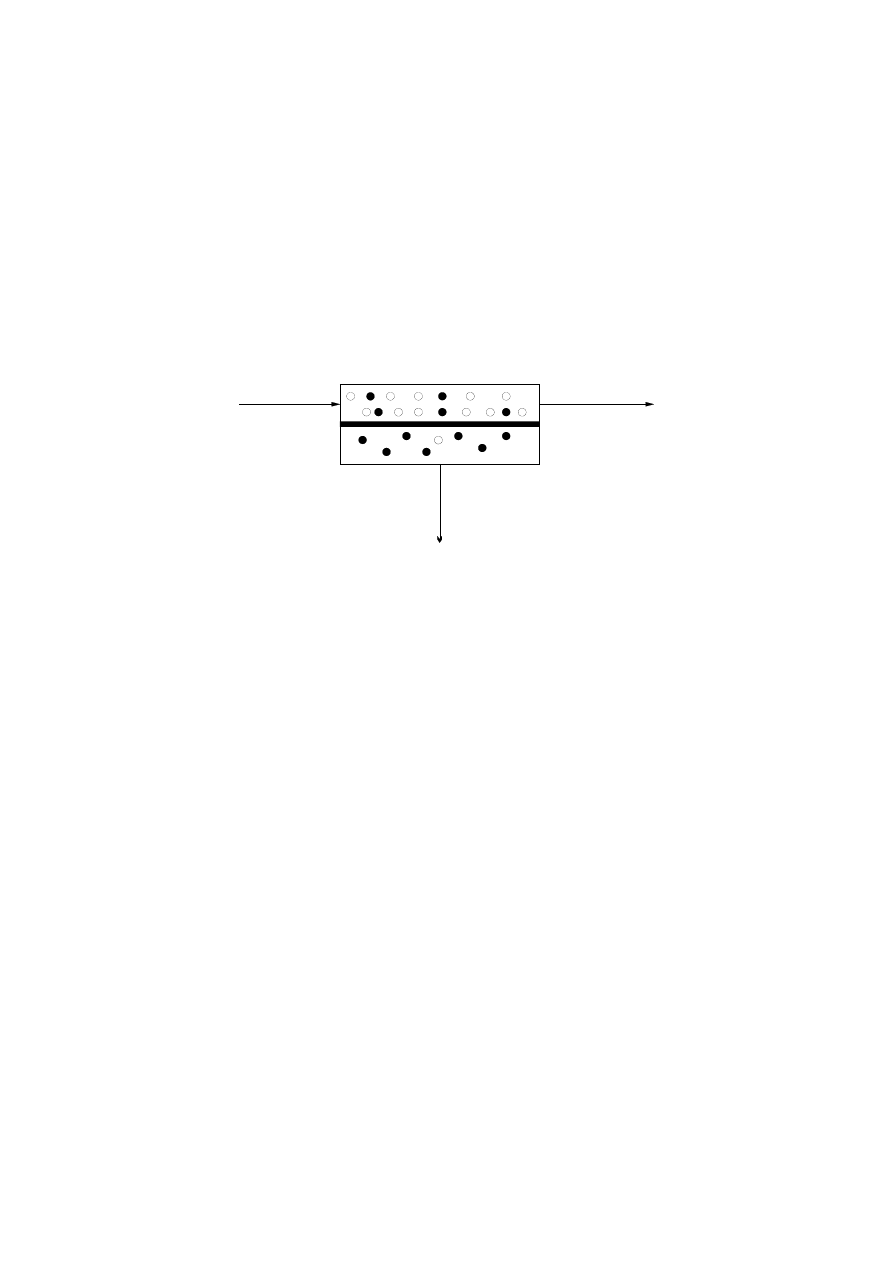
Perwaporacja i separacja…
111
I PERMEACJI PAR
Technikami membranowymi, które stosuje się do rozdzielania mieszanin
ciekłych na skalę przemysłową, są perwaporacja oraz permeacja par.
W perwaporacji składniki roztworu zasilającego znajdują się w fazie ciekłej,
natomiast w przypadku permeacji par nadawa jest w fazie parowej. W obu
tych technikach strumień zasilający znajduje się w bezpośrednim kontakcie
z powierzchnią membrany, a określony składnik mieszaniny jest preferen-
cyjnie transportowany na drugą stronę membrany (rys. 1) [1
−5].
nadawa
retentat
MEMBRANA
permeat
Rys. 1. Zasada rozdziału w perwaporacji i permeacji par
W wyniku procesu rozdzielenia strumień zasilający dzieli się na stru-
mień permeatu oraz strumień retentatu (rys. 1). Permeat wzbogacony jest
o składnik przenoszony preferencyjnie przez membranę, natomiast retentat
−
o składnik, który jest zatrzymywany na membranie. Selektywność rozdziału
w procesie perwaporacji i permeacji par wynika z różnic w przepuszczal-
ności składników rozdzielanej mieszaniny przez membranę polimerową.
Należy podkreślić, że rozdział w perwaporacji i permeacji par nie zależy od
równowagi ciecz
−para, w związku z czym, można te procesy efektywnie
stosować m.in. do rozdziału azeotropów i cieczy bliskowrzących.
Pierwsze informacje w literaturze dotyczące perwaporacji datują się
na początek XX wieku. W roku 1906 Kahlenberg opisał rozdział miesza-
niny węglowodorów i alkoholi przez błonę kauczukową, a w roku 1917
Kober wprowadził termin „perwaporacja” [6]. Dopiero jednak od lat 60.
ubiegłego stulecia liczyć należy współczesny etap badań nad tą techniką,
gdy Binning i współpracownicy podjęli próby komercjalizacji tego procesu
[7]. Na ten okres przypada także początek badań prowadzonych przez
Nèela. Szybki rozwój perwaporacji nastąpił jednak dopiero na początku lat
80. XX wieku, z chwilą opracowania hydrofilowych membran kompozyto-
wych z warstwą selektywną z polialkoholu winylowego, przeznaczonych do
odwadniania alkoholu etylowego [3, 8]. Dalszy szybki rozwój zastosowań
przemysłowych perwaporacji nastąpił na początku XXI wieku, z chwilą
opracowania membran ceramicznych do perwaporacji i permeacji par [9].

W. Kujawski
112
Permeacja par jest jedną z nowszych technik separacyjnych stosowa-
nych do rozdziału mieszanin ciekłych. W porównaniu z perwaporacją tech-
nika ta ma tę zaletę, że w czasie przebiegu procesu nie zachodzi przemiana
fazowa, w związku z czym nie ma problemu z dostarczeniem energii po-
trzebnej na zrównoważenie strat cieplnych w układzie [10].
Charakterystyka efektywności rozdzielenia mieszanin techniką per-
waporacji i permeacji par odnoszona jest zawsze do tego składnika, który
jest przenoszony preferencyjnie przez membranę. Podstawą oceny efektyw-
ności rozdziału są następujące wielkości: współczynnik rozdzielenia
α
,
współczynnik wzbogacenia
β
, strumień permeatu J, indeks separacji perwa-
poracyjnej (parametr Ψ) oraz diagram selektywności McCabe-Thielego [3,
5, 11].
Współczynniki rozdzielenia
α
i wzbogacenia
β
zdefiniowane są
równaniami (1) i (2):
B
A
B
A
B
A
B
A
B
A
X
X
J
J
X
X
Y
Y
/
/
/
/
/
=
=
α
,
(1)
A
A
B
A
X
Y
=
/
β
.
(2)
W wyrażeniach (1) i (2) X
i
oraz Y
i
oznaczają ułamek (molowy lub
masowy) składnika i, odpowiednio w nadawie oraz w permeacie, J
i
− stru-
mień cząstkowy składnika i, natomiast indeksy dolne A i B
− oznaczają
składniki rozdzielanej mieszaniny, przy czym
A odnosi się do składnika
przenoszonego preferencyjnie przez membranę.
Współczynniki
α
i
β
powiązane są następującymi zależnościami:
β
β
α
A
A
B
A
X
X
−
−
=
1
1
/
,
(3)
A
B
A
X
)
1
(
1
/
−
+
=
α
α
β
.
(4)
Strumień permeatu J określa ilość permeatu, jaka przeniknęła przez
jednostkową powierzchnię membrany w jednostce czasu i w przypadku
perwaporacji oraz permeacji par wyrażany jest najczęściej w [g m
-2
h
-1
] lub
[mol m
-2
h
-1
]. Strumień wywołany jest działaniem określonej siły
napędowej, co w przypadku omawianych procesów może być zapisane
następującym równaniem [2]:
l
)
p
p
(
P
J
P
i
N
i
i
i
,
,
−
=
, (5)
gdzie: J
i
– strumień składnika i, P
i
− współczynnik przepuszczalności
składnika i, l – grubość membrany, p
i, N
– cząstkowa prężność pary skład-
nika i po stronie nadawy, p
i, P
– cząstkowa prężność pary składnika i po stro-
nie permeatu. W procesie perwaporacji i permeacji par po stronie permeatu
ciśnienie parcjalne składnika i jest bliskie zeru (p
i, P
≈ 0), można więc przy-

Perwaporacja i separacja…
113
jąć, że strumień permeatu jest proporcjonalny do ciśnienia cząstkowego
składnika i w nadawie:
l
p
P
J
N
i
i
i
,
=
.
(6)
Ponieważ membrany mają różną grubość, wprowadzono pojęcie
strumienia znormalizowanego składnika i przez membranę J
Ni
, wyrażające
iloczyn strumienia rzeczywistego oraz grubości membrany. Taka procedura
umożliwia porównywanie właściwości transportowych membran o różnej
grubości:
l
J
J
i
Ni
=
.
(7)
Strumień całkowity permeatu, J, jest równy sumie strumieni cząstko-
wych:
.
∑
=
i
i
J
J
(8)
Strumień cząstkowy składnika i można obliczyć na podstawie znajo-
mości składu permeatu i strumienia całkowitego:
i
i
Y
J
J
=
.
(9)
Parametr Ψ, tzw. indeks separacji perwaporacyjnej (Pervaporation
Separation Index), zdefiniowany jest równaniem (10) [12, 13]:
)
(
1
−
α
= J
Ψ
. (10)
Parametr Ψ umożliwia porównanie efektywności rozdziału danej
mieszaniny ciekłej, z
wykorzystaniem różnych rodzajów membran.
Z dwóch membran, różniących się selektywnością oraz wielkością
strumienia permeatu, bardziej efektywna będzie ta membrana, dla której
parametr Ψ przyjmuje większą wartość.
Należy podkreślić, że parametry efektywności membrany zależą od
składu nadawy, dlatego też pełna charakterystyka wymaga określenia war-
tości tych parametrów w takim zakresie składu nadawy, w jakim będzie
stosowana membrana. W celu zobrazowania selektywności membrany
w omawianych procesach stosuje się także diagram separacyjny McCabe-
-Thielego będący wykresem zawartości składnika i w permeacie, w funkcji
zawartości tego składnika w nadawie [5, 11].
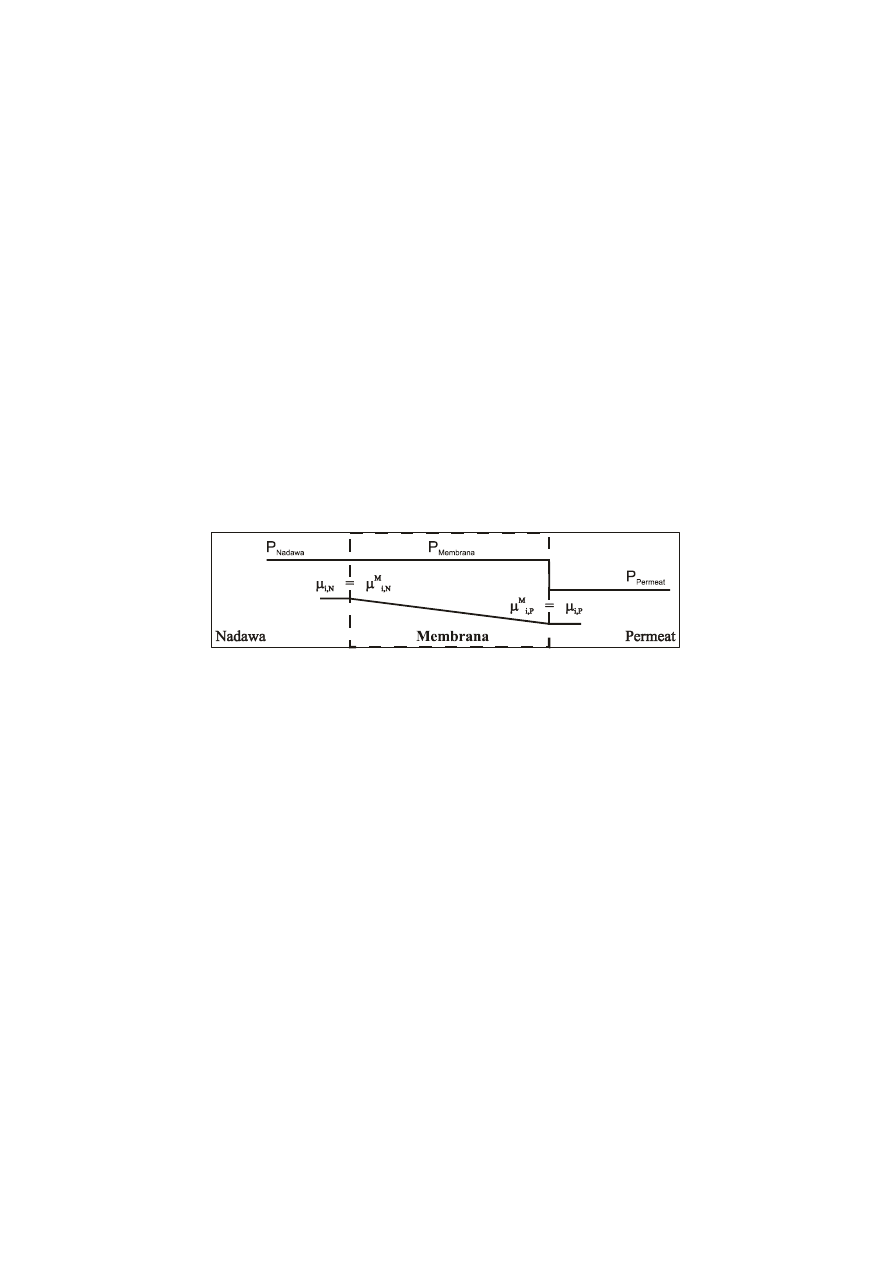
3. OPIS TRANSPORTU I SEPARACJI MASY W UJĘCIU MODELU
ROZPUSZCZANIA-DYFUZJI
Proces transportu przez nieporowate membrany polimerowe opisuje teoria
rozpuszczania-dyfuzji. Zgodnie z tą teorią transport i separacja masy w per-
waporacji i permeacji par odbywa się w trzech następujących po sobie, eta-
pach [4, 5, 11, 14]:
1. Sorpcja do spęczniałej części membrany.
Etap ten determinuje stężenie każdego składnika w tej części membrany
− jest to punkt początkowy profilu stężenia składnika w membranie.
Wielkość sorpcji do membrany będzie zależała zarówno od właściwości
W. Kujawski
114
składników rozdzielanej mieszaniny, znajdującej się w kontakcie
z membraną, jak i od rodzaju użytej membrany. W wyniku sorpcji do
membrany polimerowej następuje zmiana oddziaływań pomiędzy łań-
cuchami polimerowymi, powodując pęcznienie membrany.
2. Dyfuzja molekuł penetranta przez membranę.
Dyfundujący poprzez membranę składnik rozdzielanej mieszaniny
plastyfikuje amorficzne części membrany, zwiększając tym samym
odległości pomiędzy łańcuchami polimerowymi i ułatwiając przeni-
kanie. Stężenie penetranta na drodze dyfuzji spada, w wyniku czego
również zmniejsza się efekt plastyfikujący oraz szybkość dyfuzji. Etap
dyfuzji wraz z etapem sorpcji decydują o selektywności całego pro-
cesu.
3. Desorpcja permeatu.
Etap ten, z uwagi na panujące obniżone ciśnienie po stronie permeatu,
jest etapem bardzo szybkim. Dlatego zakłada się, że nie wpływa on na
całkowitą selektywność procesu permeacji.
Rys. 2. Schemat równowag w układzie: nadawa
−membrana nieporowata − permeat,
w ujęciu modelu rozpuszczania-dyfuzji
Matematyczny opis zjawisk transportowych w ujęciu modelu roz-
puszczania-dyfuzji wyprowadzony jest w oparciu o następujące założenia
(rys. 2) [15]:
• membrana traktowana jest jako faza ciągła,
• na granicach faz pomiędzy powierzchnią membrany a fazą nadawy
lub fazą permeatu panuje równowaga chemiczna odnośnie do
składników pojedynczych,
• ciśnienie wewnątrz membrany jest równe ciśnieniu po stronie
nadawy,
• pomija się oddziaływania pomiędzy strumieniami cząstkowymi per-
meujących składników,
• wzdłuż drogi dyfuzji składnika przez membranę istnieje ciągły gra-
dient potencjału chemicznego,
• strumień składnika przez membranę jest proporcjonalny do siły
napędowej, która jest wyrażana przez potencjał chemiczny skład-
nika i (
µ
i
):

Perwaporacja i separacja…
115
dx
d
L
J
i
i
i
µ
−
=
,
(11)
,
)
(
dp
υ
c
γ
ln
RTd
µ
d
i
i
i
i
+
=
(12)
J
i
− strumień składnika i,
L
i
− fenomenologiczny współczynnik przewodnictwa,
µ
i
− potencjał chemiczny składnika i,
c
i
– stężenie,
γ
i
− współczynnik aktywności,
υ
i
− objętość molowa składnika i.
W przypadku faz nieściśliwych (faza ciekła, membrana) objętość nie
zmienia się wraz ze zmianą ciśnienia, a scałkowanie równania (12) po stę-
żeniu i ciśnieniu daje następujące wyrażenie na potencjał chemiczny skład-
nika i:
)
(
)
(
o
i
i
i
i
o
i
i
p
p
υ
c
γ
ln
RT
µ
µ
−
+
+
=
. (13)
Natomiast w przypadku fazy gazowej objętość molowa zmienia się
z ciśnieniem i scałkowanie równania (12) prowadzi do następującego wyra-
żenia na potencjał chemiczny składnika i:
( )
o
i
i
i
o
i
i
p
p
ln
RT
c
ln
RT
µ
µ
+
γ
+
=
.
(14)
Standardowy potencjał chemiczny składnika i (
µ
i
o
) powinien być
identyczny w równaniu (13) i (14). W tym celu jako ciśnienie odniesienia
wybrane zostało ciśnienie pary nasyconej tego składnika (p
i, sat
). W takim
przypadku równania (13) i (14), opisujące potencjał chemiczny składnika i,
przyjmą następującą postać:
)
(
)
(
sat
,
i
i
i
i
o
i
i
p
p
υ
c
γ
ln
RT
µ
µ
−
+
+
=
, (15)
( )
sat
,
i
i
i
o
i
i
p
p
ln
RT
c
γ
ln
RT
µ
µ
+
+
=
.
(16)
Zgodnie z założeniem modelu rozpuszczania-dyfuzji ciśnienie we-
wnątrz membrany jest stałe i równe ciśnieniu po stronie nadawy, a gradient
potencjału chemicznego przez membranę wyrażony jest przez gradient ak-
tywności składnika i. Strumień tego składnika wyraża równanie (11), które
wobec stałości ciśnienia może być zapisane następująco:
dx
dc
c
RTL
J
i
i
i
i
−
=
,
(17)
a więc analogicznie do równania Ficka:
dx
dc
D
J
i
i
i
−
=
.
(18)
Scałkowanie tego ostatniego równania po grubości membrany daje
następujące wyrażenie na transport składnika przez membranę:

W. Kujawski
116
l
c
c
D
J
M
P
i
M
N
i
i
i
)
(
,
,
−
=
,
(19)
gdzie:
M
N
i
c
,
− oznacza stężenie składnika i w membranie, na granicy faz nadawa-
membrana,
M
P
i
c
,
− oznacza stężenie składnika i w membranie, na granicy faz mem-
brana-permeat.
Równanie (19) jest fundamentalnym równaniem modelu rozpuszcza-
nia-dyfuzji [19]. W celu wykorzystania tego równania do opisu zjawisk
transportowych należy je przekształcić przez wyprowadzenie dodatkowych
zależności opisujących stężenia składników w membranie (
M
N
i
c
,
oraz
M
P
i
c
,
)
w funkcji parametrów roztworów przymembranowych.
3.1. SEPARACJA PAR I GAZÓW
W procesie separacji gazów lub par nadawę stanowi mieszanina gazowa
o ciśnieniu p
N
, natomiast gazowy permeat odbierany jest po stronie ni-
skociśnieniowej (p
P
) membrany.
Wyprowadzenie odpowiednich równań transportowych rozpoczyna
się od przyrównania potencjałów chemicznych składników na granicy faz
nadawa/membrana i membrana/permeat. W procesie separacji gazów/par,
do fazy nadawy i permeatu musimy zastosować równania opisujące poten-
cjał chemiczny dla fazy ściśliwej (równanie (14)), natomiast potencjał che-
miczny składnika w membranie opisuje równanie dla fazy nieściśliwej (13).
Tak więc w procesie separacji gazów/par dla granicy faz gazowa
nadawa/membrana otrzymujemy dla stanu stacjonarnego:
)
(
)
(
)
(
,
,
,
,
,
sat
i
N
i
M
N
i
M
N
i
o
i
sat
,
i
N
N
i
N
i
o
i
p
p
υ
c
γ
ln
RT
µ
p
p
ln
RT
c
γ
ln
RT
µ
−
+
+
=
+
+
,
(20)
a w wyniku odpowiednich przekształceń:
)
)
(
(
,
,
,
RT
p
p
υ
exp
c
p
p
γ
γ
c
sat
i
N
i
N
,
i
sat
i
N
M
N
i
i
M
N
,
i
−
−
=
.
(21)
Ponieważ wyraz eksponencjalny w równaniu (21) jest bliski jedności,
to równanie to można przekształcić do postaci:
sat
i
N
M
N
i
N
i
i
M
N
i
p
p
γ
c
γ
c
,
,
,
,
=
. (22)
Wyraz c
i, N
p
N
jest ciśnieniem parcjalnym składnika w nadawie, więc
równanie powyższe upraszcza się do postaci:
sat
i
N
i
M
N
,
i
i
M
N
i
p
p
γ
γ
c
,
,
,
=
.
(23)
Perwaporacja i separacja…
117
Wyraz
γ
i, N
/(p
i, sat
M
N
i
γ
,
) jest określony mianem współczynnika sorpcji
,
G
i
K
więc ostatecznie, wyrażenie na stężenie składnika i w membranie na
granicy faz nadawa/membrana przyjmuje postać:
N
i
G
i
M
N
i
p
K
c
,
,
=
.
(24)
Analogiczną postać ma równanie na stężenie składnika i w membra-
nie na granicy faz membrana/permeat:
P
i
G
i
M
P
i
p
K
c
,
,
=
.
(25)
Podstawiając zależności (24) i (25) do równania (19), otrzymujemy
równanie opisujące transport składnika w procesie separacji par i gazów:
)
(
,
,
P
i
N
i
G
i
i
i
p
p
l
K
D
J
−
=
(26)
lub
)
(
,
,
P
i
N
i
G
i
i
p
p
l
P
J
−
=
.
(27)
Równanie (27) można wykorzystać do oceny właściwości selektyw-
nych membrany w separacji mieszaniny par lub gazów. Wykorzystuje się
do tego celu współczynnik przepuszczalności ,
G
i
P przekształcony do po-
staci [15]:
sat
i
M
i
i
i
G
i
p
D
P
,
γ
γ
=
.
(28)
Równanie powyższe było podstawą interpretacji zależności współ-
czynnika przepuszczalności membran w kontakcie z węglowodorami o ro-
snącej długości łańcucha węglowodorowego [15].
3.2. PERWAPORACJA
Perwaporacja jest procesem membranowym, w którym dwuskładnikowa
mieszanina ciekła jest transportowana przez selektywną membranę. Po stro-
nie permeatu panuje obniżone ciśnienie, więc separowane składniki odbie-
rane są w fazie gazowej.
Na granicy faz ciekła nadawa/membrana równość potencjałów che-
micznych składnika zapisujemy następująco:
)
(
)
(
)
(
)
(
,
,
,
,
,
,
sat
i
N
i
M
N
i
M
N
i
o
i
sat
i
N
i
N
i
N
i
o
i
p
p
υ
c
γ
ln
RT
µ
p
p
υ
c
γ
ln
RT
µ
−
+
+
=
=
−
+
+
co prowadzi, po prostych przekształceniach matematycznych, do wyrażenia
na stężenie składnika w membranie na granicy faz nadawa/membrana:
N
i
i
M
N
i
N
i
i
M
N
i
c
K
γ
c
γ
c
,
,
,
,
=
=
.
(30)
, (29)
W. Kujawski
118
Na granicy faz membrana/permeat ciśnienie spada od wartości p
0
w membranie do wartości p
P
w permeacie, a wyrażenie opisujące równość
potencjałów chemicznych jest następujące:
)
(
)
(
)
(
,
,
,
,
,
,
sat
i
P
i
M
P
i
M
P
i
o
i
sat
i
P
P
i
P
i
o
i
p
p
υ
c
γ
ln
RT
µ
p
p
ln
RT
c
γ
ln
RT
µ
−
+
+
=
=
+
+
Natomiast stężenie składnika w membranie otrzymane po przekształ-
ceniu powyższej zależności, przedstawia równanie (32):
)
)
(
(
,
,
,
,
,
,
RT
p
p
υ
exp
c
p
p
c
sat
i
P
i
P
i
sat
i
P
M
P
i
P
i
M
P
i
−
−
γ
γ
=
. (32)
Podobnie jak w poprzednim przypadku, wyraz eksponencjalny jest
bliski jedności, więc stężenie składnika w membranie na granicy faz mem-
brana/permeat wyraża równanie:
P
i
G
i
sat
i
P
i
M
P
i
P
i
M
P
i
p
K
p
p
c
,
,
,
,
,
,
=
γ
γ
=
.
(33)
Równania na stężenia składnika wewnątrz membrany (30) i (33)
mogą być podstawione do równania Fick’a (19) na strumień. Należy za-
uważyć, że współczynniki sorpcji w równaniu (30) i (33) odnoszą się do
innych faz, konieczne jest więc wyprowadzenie zależności na interkonwer-
sję tych współczynników. Dokonuje się tego w oparciu o równowagę po-
między cieczą a parą, opisaną równaniem (34) [12]:
sat
i
N
G
N
i
G
N
i
o
i
sat
i
N
i
L
N
i
L
N
i
o
i
p
p
ln
RT
c
γ
ln
RT
µ
p
p
υ
c
γ
ln
RT
µ
,
,
,
,
,
,
)
(
)
(
)
(
+
+
=
=
−
+
+
W równaniu (34) indeks górny L odnosi się do fazy ciekłej, a G
− do
fazy parowej.
Postępując podobnie jak przy wyprowadzaniu zależności (33), mo-
żemy zapisać:
sat
i
N
i
L
N
i
G
N
i
N
i
p
p
c
,
,
,
,
,
γ
γ
=
,
(35)
gdzie p
i, N
jest parcjalnym ciśnieniem składnika i w równowadze z fazą cie-
kłą. Wyraz
L
N
i
γ
,
p
i, sat
/
G
N
i
γ
,
jest określany jako stała Henry’ego. Podstawienie
równania (35) do równania (30) prowadzi do następującej zależności na
stężenie:
N
i
G
i
sat
i
N
i
L
N
i
G
N
i
N
i
p
K
p
p
c
,
,
,
,
,
,
=
γ
γ
=
.
(36)
. (31)
. (34)
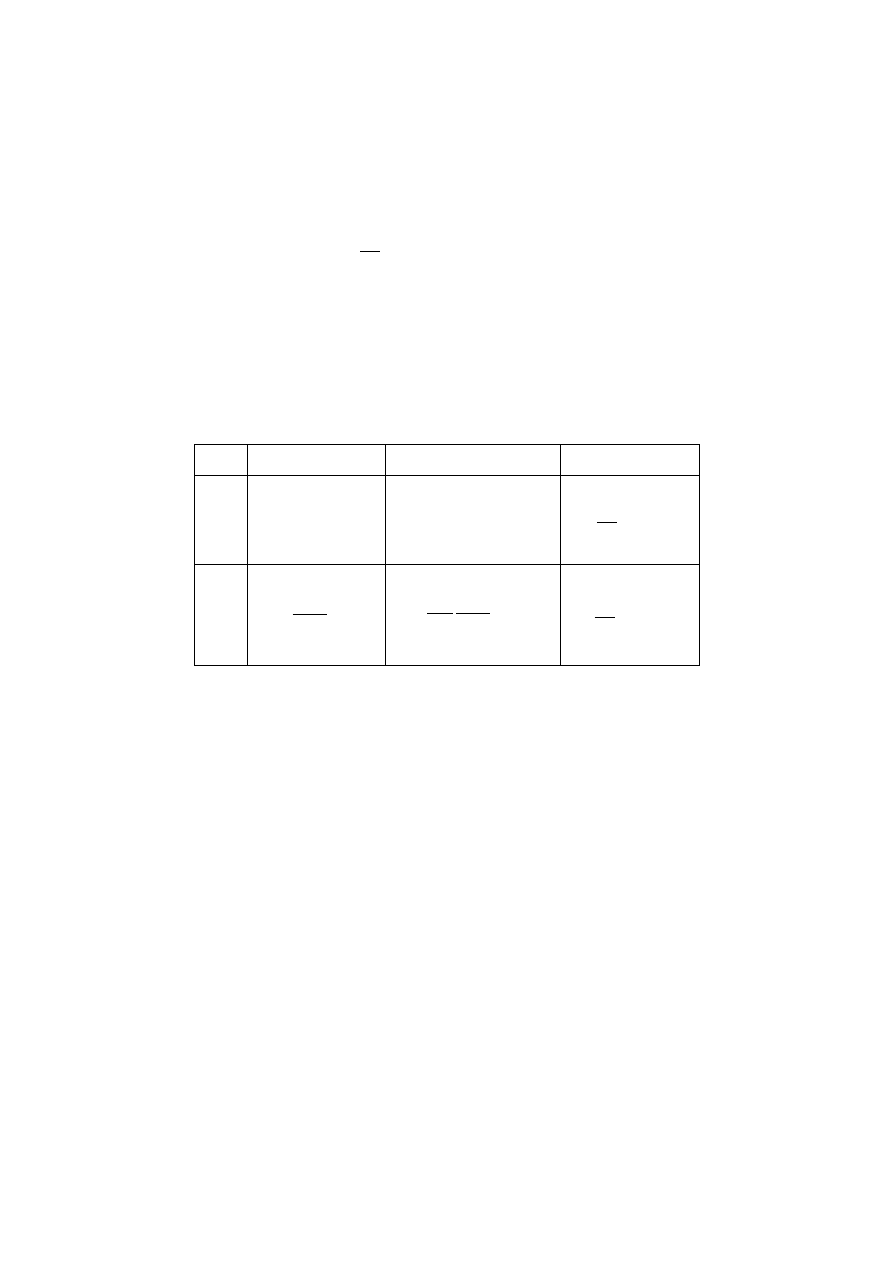
Perwaporacja i separacja…
119
W takim przypadku równanie transportowe na strumień składnika przyj-
muje postać:
)
(
,
,
P
i
N
i
G
i
i
p
p
l
P
J
−
=
. (37)
Równanie (37) wyraża siłę napędową w perwaporacji przez ciśnienie
pary.
W tab. 1 zestawiono wyprowadzone wyżej zależności na stężenia
składników transportowanych w membranie
M
N
i
c
,
oraz
M
P
i
c
,
, w funkcji wła-
ściwości przymembranowych roztworów zewnętrznych.
Tabela 1. Zależności na stężenia składników w membranie oraz strumień permeatu
w ujęciu modelu rozpuszczania-dyfuzji [15]
W praktyce laboratoryjnej proces perwaporacji jest realizowany róż-
nymi metodami. Niezależnie jednak od przyjętego rozwiązania ciekła
nadawa zawsze pozostaje w bezpośrednim kontakcie z jedną stroną mem-
brany, a siłą napędową jest gradient ciśnień parcjalnych składników po obu
stronach membrany. Metody realizacji perwaporacji różnią się sposobem
odbioru permeatu.
4. ZASTOSOWANIE PROCESU PERWAPORACJI
W PERWAPORACJI I PERMEACJI PAR
W procesie perwaporacji i permeacji par używa się gęstych nieporowatych
membran liofilowych, wśród których można wyróżnić [4, 11, 16
−18]:
• membrany obojętne o charakterze hydrofilowym (np. z poliakryloni-
trylu, poli(alkoholu winylowego), poliakryloamidu, octanu celulozy),
• membrany obojętne o charakterze hydrofobowym (np. z polistyrenu,
poli(chlorku winylu), polietylenu, polipropylenu, polidimetylo-silok-
sanu),
• membrany jonowymienne mające charakter hydrofilowy,
Proces
M
N
i
c
,
M
P
i
c
,
J
Permeacja
gazów i
pa
r
N
i
G
i
M
N
i
p
K
c
,
,
=
P
i
G
i
M
P
i
p
K
c
,
,
=
)
(
,
,
P
i
N
i
G
i
i
p
p
l
P
J
−
=
Perwaporacja
N
i
i
M
N
i
N
i
i
M
N
i
c
K
c
c
,
,
,
,
=
γ
γ
=
P
i
G
i
sat
i
P
i
M
P
i
P
i
M
P
i
p
K
p
p
c
,
,
,
,
,
,
=
γ
γ
=
)
(
,
,
P
i
N
i
G
i
i
p
p
l
P
J
−
=
W. Kujawski
120
• membrany z polimerów przewodzących.
Membrany do perwaporacji formowane są także z materiałów
ceramicznych, jak modyfikowana krzemionka czy zeolity [19
−22].
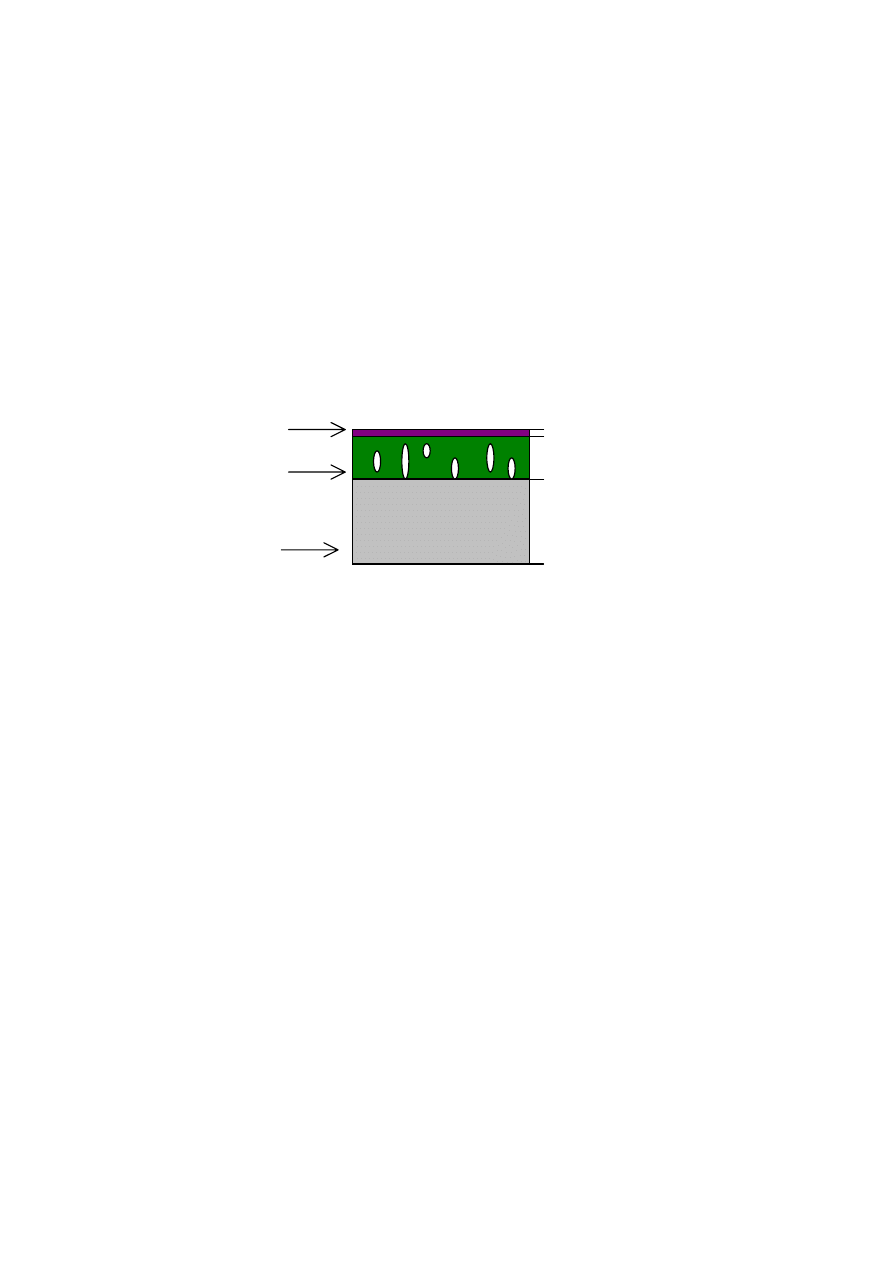
Polimerowe membrany obojętne formuje się jako kompozytowe
membrany asymetryczne, które składają się z warstwy podłoża (włóknina
polimerowa), porowatej warstwy wzmacniającej oraz z cienkiej, gęstej war-
stwy naskórkowej. Warstwa naskórkowa decyduje o właściwościach trans-
portowych i selektywnych membrany. Schematyczna budowa membrany
kompozytowej przedstawiona jest na rys. 3.
naskórek
porowata
warstwa
podłoże
2*10
6
- m
50*10
6
- m
150-200*10
-
-6
m
Rys. 3. Schemat budowy membrany laminowanej
Szybki
postęp badań nad zastosowaniem procesu perwaporacji
w przemyśle nastąpił na początku lat 80. XX wieku, gdy niemiecka firma
Deutsche Carbone AG, GFT (obecnie Sulzer) opracowała kompozytowe
membrany hydrofilowe z naskórkiem z polialkoholu winylowego. Mem-
brany te, o handlowej nazwie PERVAP-1000, zostały zastosowana
w pierwszych przemysłowych instalacjach przeznaczonych do odwadniania
etanolu. Pod koniec XX wieku rozpoczęto także, zakończone sukcesem,
próby zastosowania w instalacjach przemysłowych membran ceramicznych
[22]. W chwili obecnej na świecie pracuje ponad 100 przemysłowych in-
stalacji do perwaporacji, o różnym przeznaczeniu i wydajnościach od 100
do 150 000 l/dzień. Aktualnie, proces perwaporacji jest wykorzystywany
głównie jako tania i efektywna metoda odwadniania różnych rozpuszczalni-
ków [8, 10, 22
−26].
Ogólnie do najważniejszych kierunków zastosowania procesu per-
waporacji należy zaliczyć [4, 8, 10, 17
−36]:
1. odwadnianie ciekłych mieszanin wodno-organicznych, szczególnie zaś:
• usuwanie wody z mieszanin azeotropowych typu woda/EtOH,
woda/i-propanol, woda/pirydyna,
• odwadnianie rozpuszczalników organicznych, np. alkoholi, es-
trów, ketonów, eterów, kwasów karboksylowych, chlorowcopo-
chodnych węglowodorów;

Perwaporacja i separacja…
121
2. usuwanie ciekłych związków organicznych z wody, m.in.:
• usuwanie węglowodorów i ich chlorowcopochodnych z wód
gruntowych i powierzchniowych,
• zatężanie substancji zapachowych, np. aromatów dla przemysłu
spożywczego,
• usuwanie produktów organicznych w procesie ciągłej fermentacji
(etanol, butanol);
3. rozdział mieszanin dwóch lub więcej ciekłych związków organicznych,
w tym:
• rozdział izomerów (np. o-, m-, p-ksylenów),
• rozdział azeotropów (np. metanol-eter metylowo t-butylowy
/MTBE/, metanol-dwumetylowęglan /DMC/, etanol-cyklohek-
san).
7. LITERATURA
[1] Membrany i membranowe techniki rozdziału, A. Narębska (red.), Wydawnictwo
Uniwersytetu Mikołaja Kopernika, Toruń 1997.
[2] M. Mulder, Basic Principles of Membrane Technology (Second Edition), Kluwer
Academic Publisher, Dordrecht, Boston, London 2003.
[3] A. Narębska, E. Buczyło, M. Bodzek, N. Chlubek, Membrany i techniki membranowe
− nazewnictwo polskie, Polimery, 36 (1991) 158.
[4] J. Neel, Introduction to pervaporation, w: R.Y.M. Huang (Ed.), Pervaporation
Separation Processes, Elsevier, Amsterdam 1991, s. 1–109.
[5] K.W. Boddeker, Terminology in pervaporation, J. Membr. Sci., 51 (1990) 259.
[6] P.A. Kober, Pervaporation, perstillation and percrystallization, J. Am. Chem. Soc., 39
(1917), s. 944–948; J. Membr. Sci., 100 (1995), s. 61–64.
[7] R.C. Binning, R.J. Lee, J.F. Jennings, E.C. Martin, Separation of liquid mixtures by
permeation, Ind. Engn. Chem., 53 (1961), s. 45–50.
[8] J.L. Rapin, The Betheniville pervaporation unit
− the first large-scale production plant
for the dehydration of ethanol, R. Bakish (Ed.), Proc. 3
rd
Int. Conf. on Pervaporation
Processes in Chemical Industry, Bakish Materials Corp., Englewood 1989, s. 364–378.
[9] J. Caro, M. Noack, P. Koelsch, Zeolite membranes: from the laboratory scale to
technical applications, Adsorption 11 (2005), s. 215–227.
[10] U. Sander, H. Janssen, Industrial application of vapor permeation, J. Membr. Sci., 61
(1991), s. 113–129.
[11] W. Kujawski, Pervaporation, w: A. Noworyta, A. Trusek-Hołownia (Eds.), Membrane
Separation, Agencja Wydawnicza „ARGIS”, Wrocław 2001, s. 121–145.
[12] R.Y.M. Huang, J.W. Rhim, Separation characteristics of pervaporation membrane
separation processes, w: R.Y.M. Huang (Ed.), Membrane Science and Technology
Series, 1. Pervaporation Membrane Separation Processes, Elsevier, Amsterdam 1991,
s. 111–180.
[13] X. Feng, R.Y.M. Huang, Pervaporation with chitosan membranes. I. Separation of
water from ethylene glycol by a chitosan/polysulfone composite membranes,
J. Membrane Sci. 116 (1996), s. 67–76.
[14] W.Kujawski, Membrane selectivity in pervaporation, Sep. Sci. Technol. 31 (1996),
s. 1555–1571.
[15] J.G. Wijmans, R.W. Baker, The solution-diffusion model: a review, J. Membr. Sci.,
107 (1995), s. 1–21.

W. Kujawski
122
[16] G.H. Koops, C.A. Smolders, Estimation and evaluation of polymeric materials for
pervaporation membranes, R.Y.M. Huang (Ed.), Pervaporation Separation Processes,
Elsevier, Amsterdam 1991, s. 253–278.
[17] W. Kujawski, M. Waczyński, Perwaporacja-membranowa technika separacyjna,
Przemysł Chemiczny, 75 (1996), s. 326–328.
[18] W. Kujawski, Pervaporation and vapor permeation – separation through nonporous
membranes, Polish J. Chem. Technol., 5 (2003), s. 1–7.
[19] A.W. Verkerk, P. van Male, M.A.G. Vorstman, J.T.F. Keurentjes, Properties of high
flux ceramic pervaporation membranes for dehydration of alcohol:water mixtures, Sep.
Purif. Technol., 22–23 (2001), s. 689–695.
[20] A. Urtiaga, E.D. Gorri, C. Casado, I. Ortiz, Pervaporative dehydration of industrial
solvents using a zeolite NaA commercial membrane, Sep. Purif. Technol., 32 (2003),
s. 207–213.
[21] H. Verweij, Ceramic membranes: Morphology and transport, J. Materials Sci., 38
(2003), s. 4677–4695.
[22] M. Kondo, M. Komori, H. Kita, K. Okamoto, Tubular-type pervaporation module with
zeolite NaA membrane, J. Membr. Sci., 133 (1997), s. 133–141.
[23] H. Bruschke, Industrial applications of membrane separation processes, Pure Appl.
Chem., 67 (1995), s. 993–1002.
[24] U. Sander, P.B. Soukup, Practical experience with pervaporation systems for liquid and
vapour separation, J. Membr. Sci., 62 (1991), s. 67–89.
[25] K. Scott (Ed.), Handbook of Industrial Membranes, Elsevier, Oxford 1995.
[26] A. Jonquières, R. Clément, P. Lochon, J. Néel, M. Dresch, B. Chrétien, Industrial state-
-of-the art of pervaporation and vapour permeation in the western countries, J. Membr.
Sci., 206 (2002), s. 87–117.
[27] D.J. O’Brien, L.H. Roth, A.J. McAloon, Ethanol production by continuous
ferementation-pervaporation: a preliminary economic analysis, J. Membr. Sci., 166
(2000), s. 105–111.
[28] W. Kujawski, W. Capała, M. Palczewska-Tulińska, W. Ratajczak, D. Linkiewicz,
B. Michalak, Application of membrane pervaporation process to the enhanced
separation of fusel oils, Chem. Pap., 56 (2002), s. 3–6.
[29] H.L. Fleming, C.S. Slater, Pervaporation, w: W.S. Winston HO, K.K. Sirkon (Eds.),
Membrane Handbook, Van Nostrand Reinhold, New York 1992, III, s. 103–160.
[30] W. Kujawski, Pervaporative removal of organics from water using hydrophobic
membranes. Binary mixtures, Sep. Sci. Technol., 35 (2000), s. 89–108.
[31] U. Hommerich, R. Rautenbach, Design and optimization of combined
pervaporation/distillation processes for the production of MTBE, J. Membr. Sci., 146
(1998), s. 53–64.
[32] G.S. Luo, M. Niang, P. Schaetzel, Separation of ethyl tert-butyl ether-ethanol by
combined pervaporation and distillation, Chem. Eng. J., 68 (1997), s. 139–143.
[33] T. Sano, M. Hasegawa, Y. Kawakami, H. Yanagishita, Separation of methanol/methyl-
-tert-butyl ether mixture by pervaporation using silicalite membrane, J. Membr. Sci.,
107 (1995), s. 193–196.
[34] F. Lipnizki, R.W. Field, P.-K. Ten, Pervaporation-based hybrid process: a review of
process design, applications and economics. J. Membr. Sci., 153 (1999), s. 183
−210.
[35] S. Takizawa, T. Win, Removal of trichloroethylene and trichloromethane using a novel
hollow-fibre gas-permeable membrane, Water Sci. Technol.: Water Supply, 3 (2003),
s. 67–72.
[36] V. Van Hoof, L. Van den Abeele, A. Buekenhoudt, C. Dotremont, R. Leysen,
Economic comparison between azeotropic distillation and different hybrid systems
combining distillation with pervaporation for the dehydration of isopropanol, Sep.
Purif. Technol., 37 (2004), s. 33–49.
Wyszukiwarka
Podobne podstrony:
Ekstrakcja jest operacją służącą do rozdzielenia mieszanin ciał stałych i ciekłych
Techniki rozdzielania mieszanin w biotechnologii
rozdzielanie mieszanin, przemywanie, suszenie
Rozdział mieszanin i roztworów, Biotechnologia, Semestr 1, Chemia ogólna, Egzamin
Demontaż montaż Mikrosilniki rozdziału i mieszania Czujnik jakości powietrza w kabinie
Metody rozdzielania mieszanin, Dokumenty(1)
Metody rozdziału mieszanin chemicznych strącanie, dekantacja,
sposoby rozdzielania mieszanin, dydaktyka, konspekty
nowoczesne metody rozdziału mieszanin PROJEKT
Rozdzial mieszanin
Metody rozdzielania mieszanin
rozdzielenie mieszanin
Rozdzial Mieszaniny Racemicznej
Separacja mieszanin organicznych z użyciem perwaporacji
Mieszaniny i metody rozdzielania
3 Separacja gazow i par,
Podstawy zarządzania wykład rozdział 05
2 Realizacja pracy licencjackiej rozdziałmetodologiczny (1)id 19659 ppt
więcej podobnych podstron