

Roztwór
– homogeniczna mieszanina dwóch lub więcej związków chemicznych. Jeden ze
związków chemicznych (ten w nadmiarze) nazywany jest rozpuszczalnikiem, a drugi
(pozostałe) substancją rozpuszczaną. Roztwory można podzielić ze względu na ich stan
skupienia na gazowe, ciekłe i stałe.
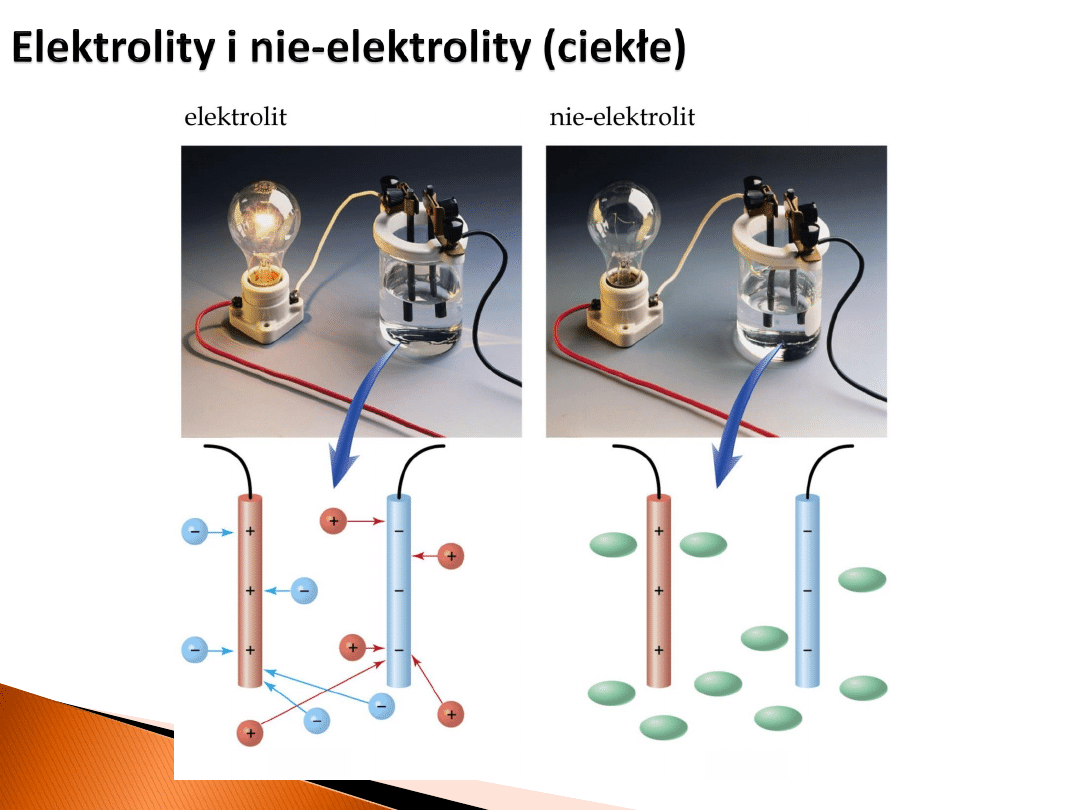
Elektrolit
– to roztwór zdysocjowanych substancji jonowych, lub stopiona substancja
jonowa lub ciało stałe przewodzące jony. W roztworze pojawiają się ruchliwe jony, na
skutek czego może on przewodzić prąd elektryczny.
Elektrolity (również stałe) nie
przewodzą elektronów!
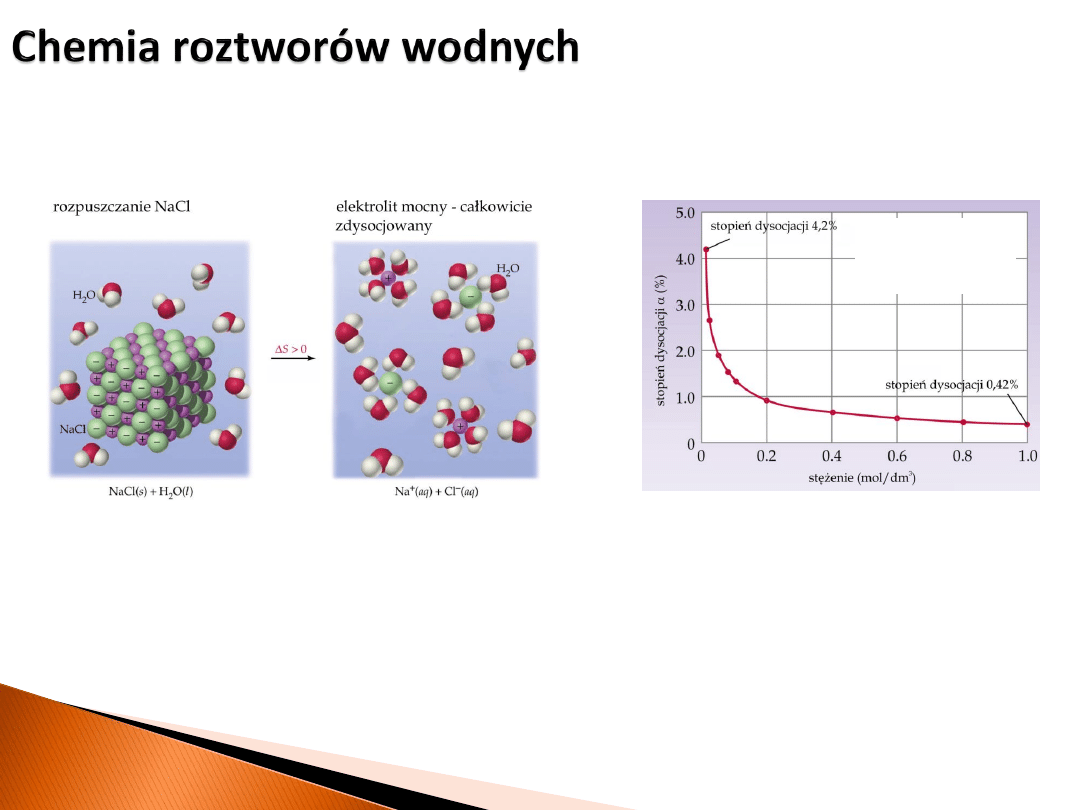
Dysocjacja elektrolityczna
– proces rozpadu cząsteczek związków chemicznych na jony
pod wpływem rozpuszczalnika (np. wody).
Elektrolity mocne
– roztwory, w których substancja rozpuszczona jest całkowicie
zdysocjowana na jony. Przykładowo: roztwory mocnych kwasów, roztwory
wodorotlenków litowców i berylowców, większość soli.
Elektrolity słabe
– roztwory, w których stopień dysocjacji substancji rozpuszczonej jest
silnie zależny od stężenia. Elektrolity słabe charakteryzuje mała wartość stałej dysocjacji.
elektrolit mocny
elektrolit słaby
COOH
CH
3
Prawo rozcieńczeń Ostwalda jako równowaga reakcji dysocjacji elektrolitu słabego:
C)
(25
10
75
,
1
α
1
c
α
αc
-
c
αc
αc
K
COOH]
[CH
]
COO
CH
][
O
H
[
K
K
αc
αc
αc
-
c
)
COO
CH
H
COOH
(CH
O]
COOH][H
[CH
]
COO
][CH
O
[H
K
COO
CH
O
H
O
H
COOH
CH
o
5
2
D
3
3
3
D
a
3
3
2
3
3
3
c
3
3
2
3

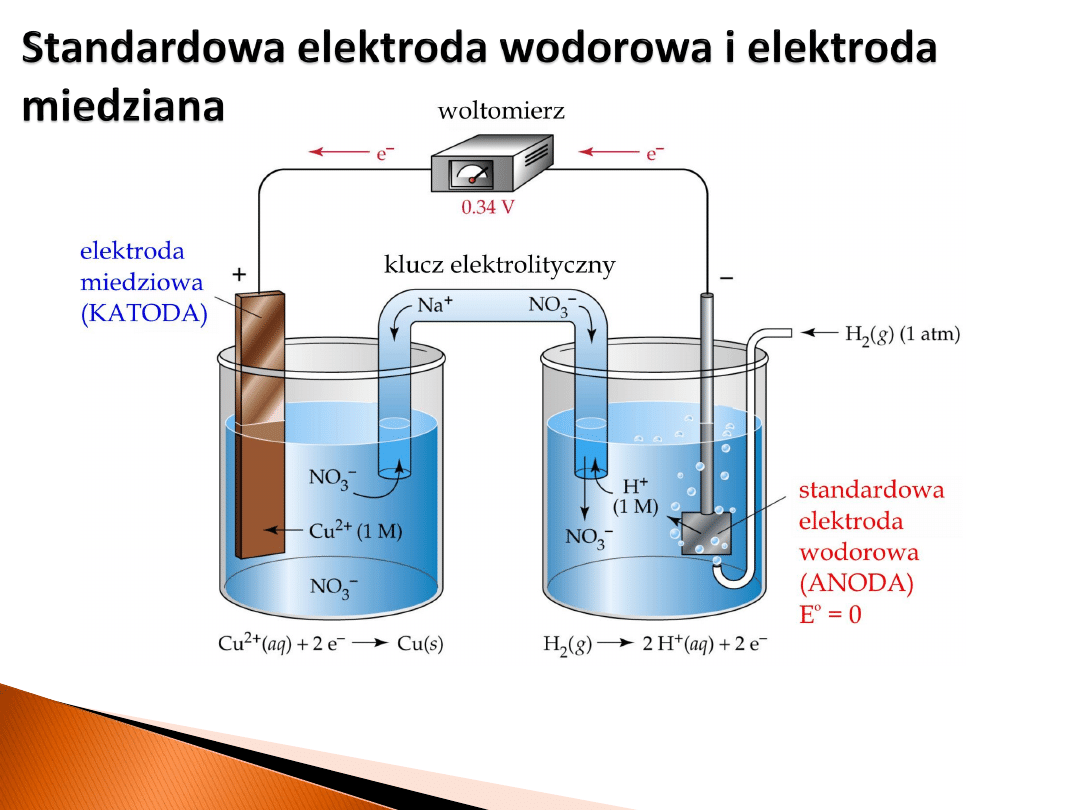
Ponieważ procesom redoks towarzyszy przepływ elektronów. W przypadku, gdy reakcja
redoks zachodzi w roztworze (wodnym) możliwe jest określenie potencjału
elektrycznego (napięcia) towarzyszącemu danej reakcji. Wymaga to jednak określenia
pewnego punktu odniesienia, którym w
elektrochemii
jest
standardowa elektroda
wodorowa
.
Elektrochemia
– dział chemii zajmujący się badaniem elektrycznych aspektów reakcji
chemicznych, np. w procesach towarzyszących przepływowi prądu elektrycznego przez
elektrolit.
Samorzutna reakcja osadzania miedzi
na blaszce cynkowej z roztworu CuSO
4

Elektrodą
(bądź półogniwem) nazywamy taki układ, w którym zapewniono kontakt
elektryczny pomiędzy substancją będącą przewodnikiem elektronowym a substancją
będącą przewodnikiem jonowym. Rozróżnia się trzy rodzaje elektrod (półogniw):
• elektrody pierwszego rodzaju
• elektrody metaliczne
• elektrody gazowe
• elektrody drugiego rodzaju
• elektrody redoks

Elektrody metaliczne
, odwracalne względem kationu, składające się z metalu, który jest
w równowadze z roztworem zawierającym kationy metalu.
Przykładowo elektroda miedziowa to miedź metaliczna będąca w kontakcie z roztworem
zawierającym kationy Cu
2+
. Elektrodę tą zapisuje się w skrócie jako Cu|Cu
2+
. Kation Cu
2+
określa się w tym przypadku jako
jon potencjałotwórczy
. Kreska pionowa w zapisie
oznacza granicę fazową.
Elektrody gazowe
(np. wodorowa, chlorowa zbudowane są z metalu (najczęściej
szlachetnego, np. platyny) zanurzonego w roztworze nasyconym odpowiednim gazem i
zawierającym jony potencjałotwórcze (odpowiednio kationy H
3
O
+
, aniony Cl
–
). Metal
szlachetny nie bierze bezpośrednio udziału w reakcji elektrodowej, stanowi natomiast
rezerwuar elektronów potrzebnych do zajścia reakcji chemicznej.
Przykładowo, elektrodę wodorową zawierającą platynę zapisujemy w skrócie jako
Pt|H
2
,H
3
O
+
.

Tak zwana
standardowa elektroda wodorowa
jest szczególnie istotna w elektrochemii,
ponieważ jej potencjał przyjęto jako równy zero woltów niezależnie od temperatury.
Konstrukcyjnie standardowa elektroda wodorowa zbudowana jest z blaszki platynowej
pokrytej czernią platynową nasyconą wodorem i omywaną gazowym wodorem o
ciśnieniu 100 kPa. Blaszka ta jest zanurzona w roztworze o aktywności jonów
hydroniowych równej jeden. Czasami taką elektrodę określa się jako normalną elektrodę
wodorową.
Elektrody drugiego rodzaju
są to elektrody odwracalne względem anionu tworzącego z
kationem metalu związek trudno rozpuszczalny. Typowo zbudowane są one z metalu
pokrytego warstwą jego trudno rozpuszczalnej soli, będącego w kontakcie z roztworem
zawierającym aniony tej soli. Jedną z najczęściej stosowanych elektrod II rodzaju jest
elektroda chlorosrebrowa
o schemacie Ag|AgCl|Cl
–
.
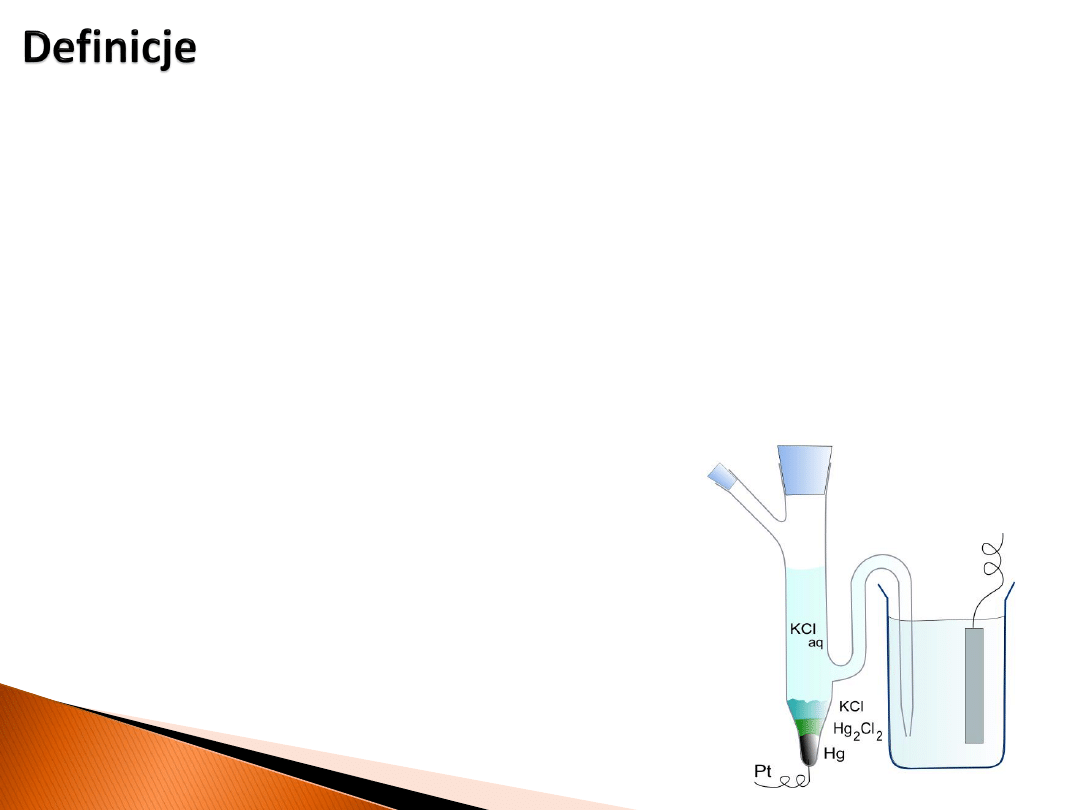
Inną ważną elektrodą II rodzaju jest nasycona
elektroda kalomelowa
o schemacie
Hg|Hg
2
Cl
2
|KCl
nasycony
. Elektroda ta jest jedną z najczęściej stosowanych elektrod
porównawczych, czyli takich których potencjał jest ściśle określony względem
standardowej elektrody wodorowej w danym środowisku.

Elektrody typu redoks
są to elektrody, w których przebiega reakcja utleniania i redukcji
przy udziale elektronów dostarczanych przez fazę metaliczną, która bezpośrednio nie
bierze udziału w reakcji. Fazę metaliczną stanowi zwykle metal szlachetny (np. Pt). Oba
składniki pary redoks znajdują się w roztworze a elektroda jest chemicznie obojętna.
Przykładowo elektroda Pt|Fe
2+
,Fe
3+
zawierająca w roztworze kationy żelaza na dwóch
różnych stopniach utlenienia jest typową elektrodą redoks.

Rozważając
elektrodę
metaliczną
można
wyróżnić
dwa
procesy
zachodzące
równocześnie: przechodzenie atomów, w postaci jonów, z metalu do roztworu oraz
proces przeciwny, wydzielanie jonów z roztworu na powierzchni metalu w postaci
atomowej. W procesach tych biorą udział elektrony metalu a ustalającą się równowagę
można zapisać równaniem:
gdzie M oznacza metal elektrody natomiast
n
określa liczbę elektronów biorących udział
w reakcji. W warunkach izotermiczno-izobarycznych zmiana
entalpii swobodnej
powyższej reakcji dana jest wzorem:
gdzie μ oznacza
potencjał chemiczny
danego składnika (
μ = ΔG/n
).
M
ne
M
n
n
M
M
G

Wykorzystując zależność potencjału chemicznego danego składnika w funkcji
temperatury T:
gdzie:
a – aktywność
, R – stała gazowa (8,314 J·mol
-1
K
-1
), indeks 0 oznacza warunki
standardowe otrzymujemy:
W warunkach izotermiczno-izobarycznych praca maksymalna układu równoważna jest
pracy elektrycznej:
gdzie: F – stała Faradaya (96485 C·mol
-1
)
a
RT ln
0
n
M
M
a
a
RT
G
G
ln
0
n
M
M
nFE
G
|
Formalnie, we wzorach termodynamicznych występuje aktywność danego składnika. W
przypadku niskich stężeń, jest to wielkość równoważna stężeniu.
Aktywność danego składnika roztworu
a
definiuje się jako iloczyn współczynnika
aktywności
f
(wielkości będącej miarą oddziaływań składnika z otoczeniem) oraz
stężenia składnika w roztworze
c
:
a = f·c
Dla małych stężeń współczynnik aktywności jest bliski 1, przez co można używać we
wzorach stężenia (c → 0 to f → 1).

W konsekwencji, otrzymuje się równanie Nernsta:
Jeśli aktywność zastąpimy stężeniem:
Przykładowo dla elektrody miedziowej:
n
n
n
M
M
M
M
M
a
nF
RT
E
a
a
nF
RT
E
E
ln
ln
0
0
|
n
n
M
M
M
c
nF
RT
E
E
ln
0
|
2
2
ln
2
0
|
Cu
Cu
Cu
c
F
RT
E
E

W przypadku elektrody redoks można zapisać:
w konsekwencji:
Przykładowo dla elektrody Pt|Fe
2+
,Fe
3+
:
RED
ne
OX
RED
OX
OX
RED
a
a
nF
RT
E
E
ln
0
|
2
3
2
3
3
2
ln
ln
0
0
,
|
Fe
Fe
Fe
Fe
Fe
Fe
Pt
c
c
F
RT
E
a
a
F
RT
E
E

Potencjał elektrody jest jednak wielkością, której absolutnej wartości nie można
zmierzyć, można natomiast wyrazić ilościowo wielkość potencjału danej elektrody w
stosunku do innej elektrody.
Jako elektrodę odniesienia przyjęto standardową
elektrodę wodorową
, której potencjał
w każdej temperaturze przyjęto jako równy 0 V. W oparciu o to założenie możliwe jest
uszeregowanie potencjałów elektrod.
Uszeregowane wartości E
0
reakcji elektrodowych określa się mianem
szeregu
napięciowego
.
W konwencji zapisuje się każdą reakcję jako reakcję redukcji.
Grupa elektrod metalicznych stanowi podstawę tak zwanego
szeregu napięciowego
metali
.


Wartości ujemne potencjału reakcji elektrodowej, zapisanej w konwencji jako redukcja,
wskazują, że metal należy do grona
metali nieszlachetnych
, dla których entalpia
swobodna procesu opisanego równaniem elektrodowym jest dodatnia.
(Znak potencjału
jest przeciwny do znaku zmiany entalpii.)
Metale, dla których potencjał reakcji elektrodowej jest dodatni określa się mianem
szlachetnych
. Grupa ta jest mniej liczna niż grupa metali nieszlachetnych.
Znak potencjału reakcji elektrodowej pozwala określić kierunek jej zachodzenia.
W termodynamice proces, dla którego ΔG < 0 (E > 0) jest procesem samorzutnym. Gdy
ΔG > 0 (E < 0) to proces nie jest samorzutny, możliwy jest natomiast proces przeciwny.
Na wartość potencjału standardowego wpływa wiele czynników, oprócz bazowej
energii
jonizacji
(energii potrzebnej na oddanie elektronu), konieczne jest uwzględnienie energii
sublimacji (rozdzielenia atomów) oraz wpływu rozpuszczalnika (wody).
Wpływ rozpuszczalnika (
wody
) będzie silnie zależał od wielkości i ładunku jonu. W
szczególności pojawi się proces solwatacji (
hydratacji
), czyli przyłączania cząsteczek
rozpuszczalnika (
wody
).

Wiele reakcji w roztworze wodnym przebiega z transferem zarówno protonów jak
i elektronów. W takim wypadku można wykazać, że potencjał elektrody będzie zależeć
od pH:
gdzie: n
H+
- liczba protonów biorących udział w reakcji elektrodowej.
Potencjał maleje (staje się bardziej ujemny) gdy pH rośnie.
Przykładowo, dla reakcji:
E dla pH = 0 równe jest 1,201 V, a dla pH = 14, E = 0,788 V.
Oznacza to, że w środowisku kwaśnym ClO
4
–
jest silniejszym utleniaczem.
n
pH
n
,
E
E
H
pH
pH
059
0
0
O
H
ClO
2e
2H
ClO
2
3
-
4
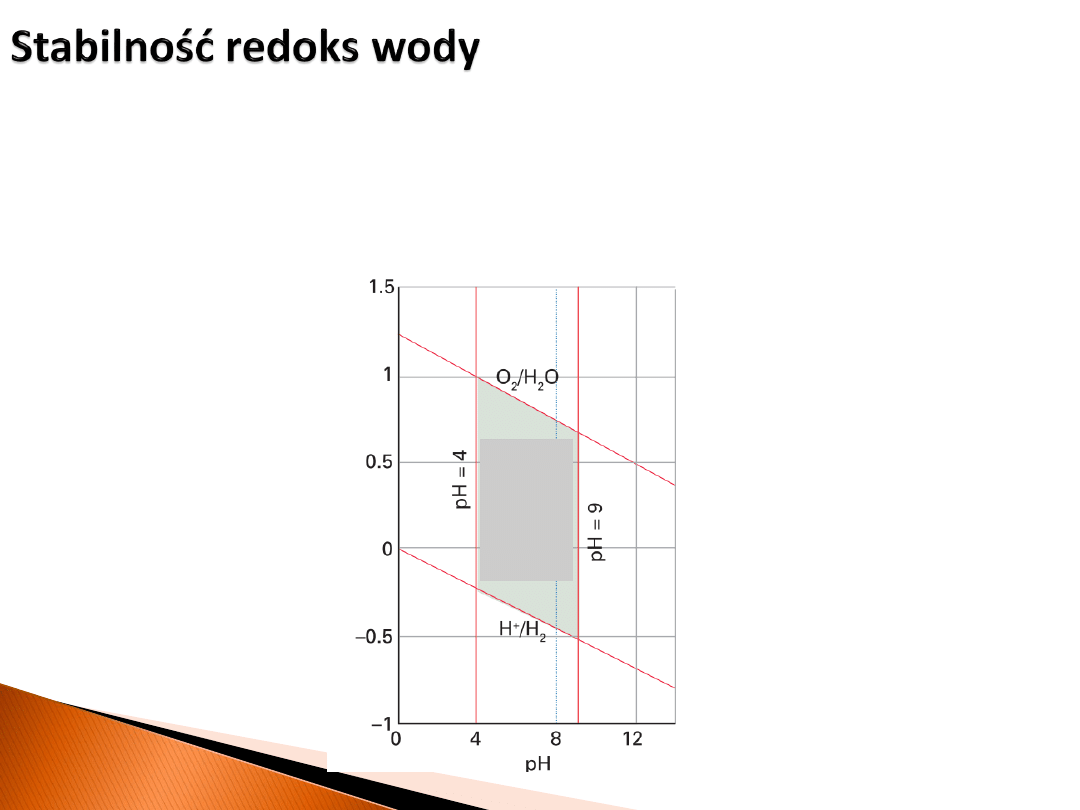
Przyłożenie odpowiedniej wartości napięcia spowoduje rozkład wody.
pH)
(0,059
1,23V
,
2e
2H
1/2O
O
H
pH
0,059
,
1/2H
e
H
2
2
2
E
E
p
ot
e
n
cjał
[V
]
zakres
stabilności
(zakres pH
typowy
dla wód
naturalnych)

Dla metali M o dużym ujemnym potencjale standardowym (np. lit, sód) zachodzi reakcja,
w której woda jest utleniaczem:
W niektórych przypadkach (np. glin) proces ten nie zachodzi ze względu na tworzenie
warstwy pasywacyjnej na metalu.
Woda może też zachowywać się jako reduktor:
OH
1/2H
M
O
H
M
2
2
0,69V
,
4H
O
4Co
O
2H
4Co
2
2
2
3
E
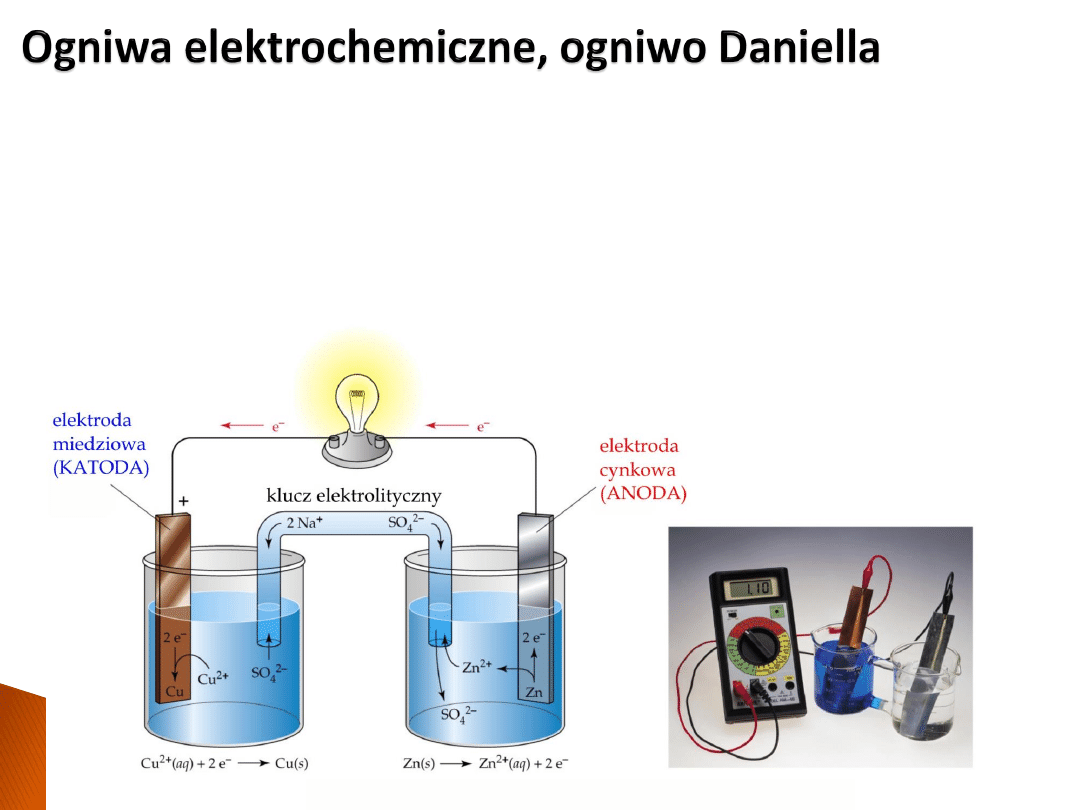
Układ dwóch półogniw nazywa się
ogniwem
(galwanicznym).
W ogniwie elektrodę, na której zachodzi utlenianie nazywamy
anodą
, natomiast na
katodzie
zachodzi proces redukcji.
Ogniwo Daniella:
w konwencji, po prawej stronie piszemy katodę.
Zn|Zn
2+
||Cu
2+
|Cu

Obliczanie siły elektromotorycznej SEM ogniwa Daniella:
a) Zapis reakcji elektrodowych:
b) Ponieważ elektroda miedziowa ma wyższy potencjał, traktujemy ją jako katodę.
Zapisujemy reakcję sumaryczna odejmując od reakcji katodowej anodową.
c) W takim ujęciu SEM dane jest jako:
Z formalnego punku widzenia SEM nie jest tożsama z napięciem (w układzie otwartym),
jednak często te pojęcia są zamiennie używane.
0
2
0
2
Cu
2e
Cu
Zn
2e
Zn
V
1,1
76
,
0
34
,
0
ln
2
ln
2
ln
2
ln
2
0
|
0
|
0
_
0
0
0
_
)
(
)
(
2
2
2
2
2
2
2
2
Zn
Zn
Cu
Cu
Daniella
ogniwa
Cu
Zn
Zn
Cu
Zn
Cu
Daniella
ogniwa
anoda
lewa
katoda
prawa
E
E
E
a
a
F
RT
E
a
a
F
RT
E
a
F
RT
a
F
RT
E
E
SEM
E
E
SEM
Cu
Zn
Cu
Zn
2
2

Zjawiska elektryczne na granicy faz
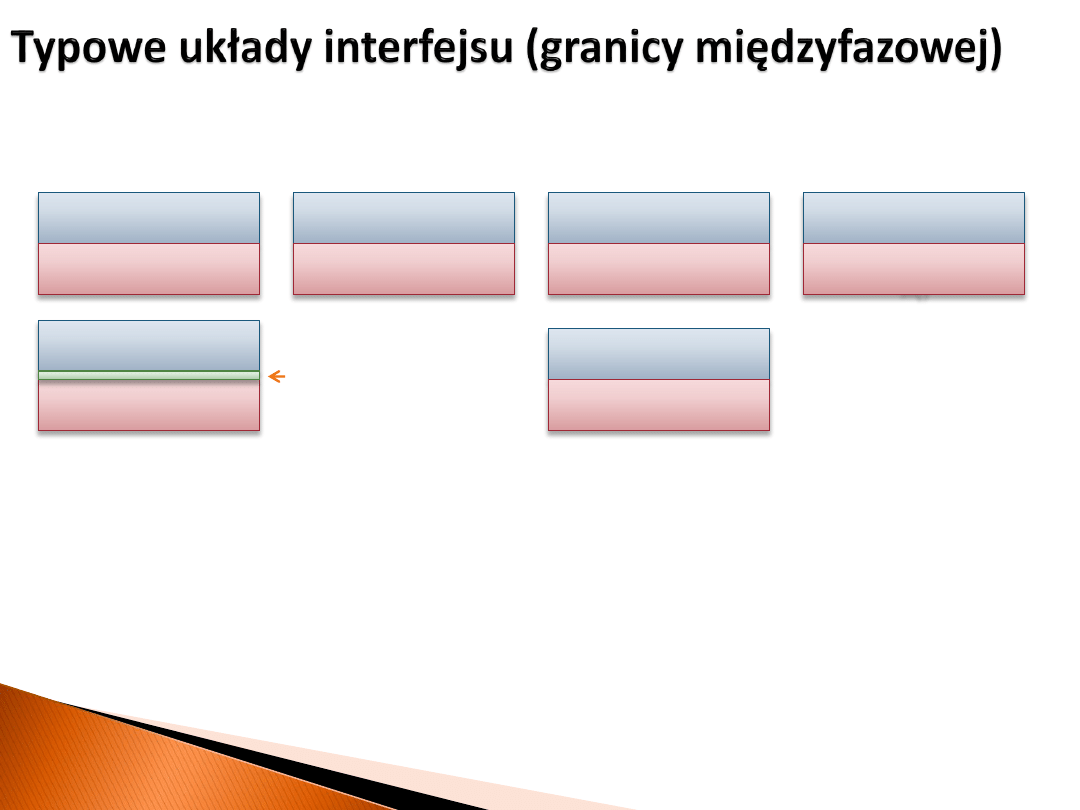
elektrolit ciekły
metal
elektrolit ciekły
stop metali
elektrolit ciekły
półprzewodnik
ciecz
(niemieszająca
się)
ciecz
(niemieszająca
się)
elektrolit ciekły
podłoże
adsorbat (nanocząstki,
warstwa funkcjonalna, itp.)
elektrolit stały
materiał elektrodowy
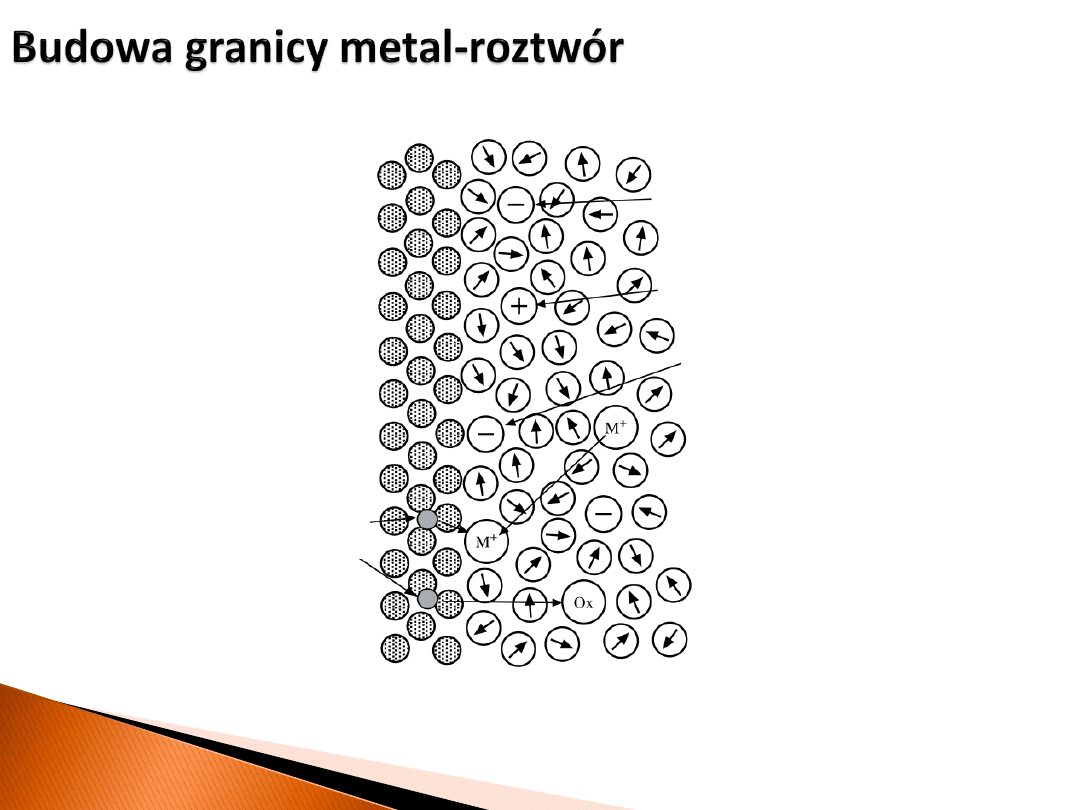
metal
roztwór
elektrony
solwatowany anion
solwatowany kation
zaadsorbowany anion
Zwykle powierzchnia
metalu jest naładowana,
co jest balansowane przez
zaadsorbowane jony
(o znaku przeciwnym).
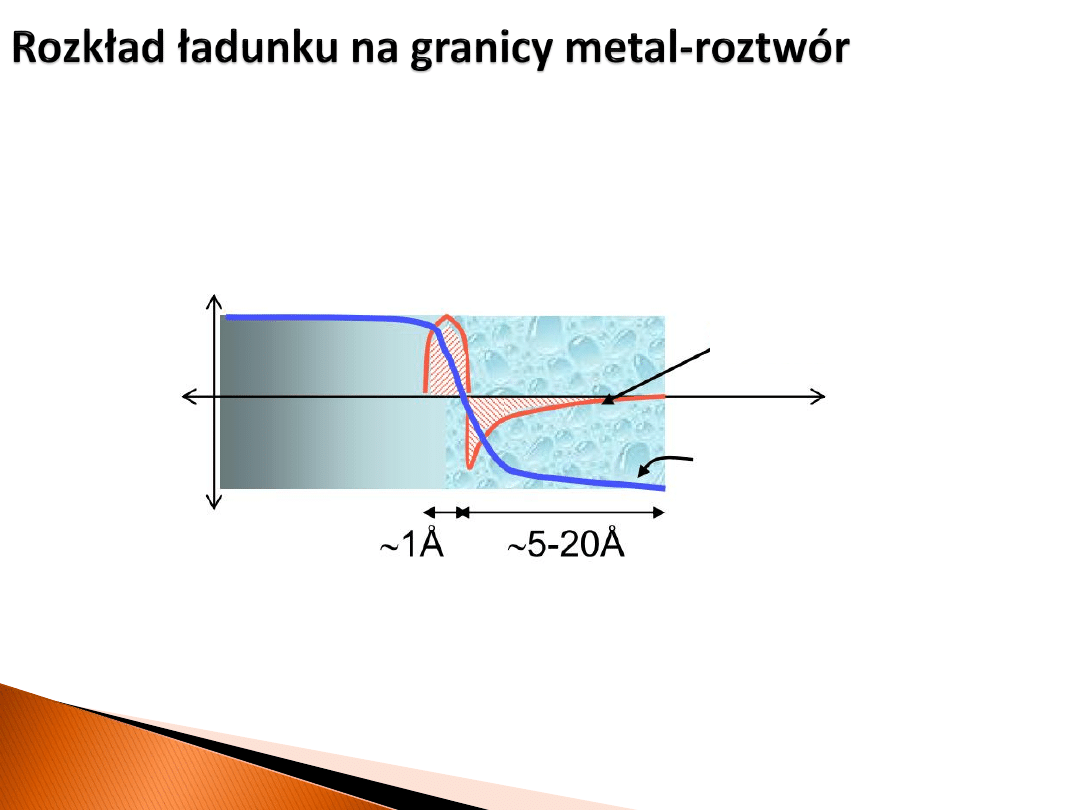
metal
roztwór
ładunek
potencjał
Przypadek, gdy powierzchnia metalu naładowana jest dodatnio.
Różnica potencjału między metalem i roztworem jest rzędu 1 V, co
daje pola elektryczne rzędu 10
9
V/m!
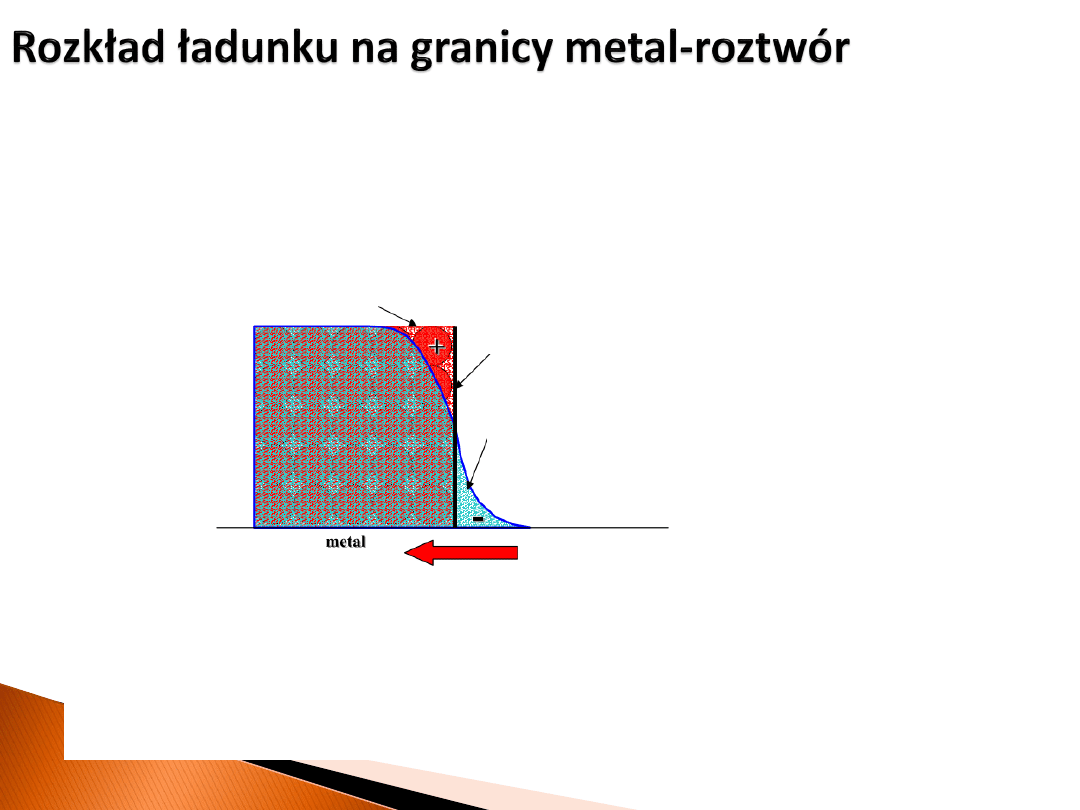
nadmiar ładunku
dodatniego
powierzchnia
dipol na powierzchni
Przypadek, gdy powierzchnia metalu naładowana jest dodatnio.
Wynikły rozkład ładunku: dwie wąskie naładowane strefy o identycznej wielkości
ładunku i przeciwnym znaku określa się mianem
warstwy podwójnej
. Można ją
traktować jako kondensator o bardzo niewielkim rozdzieleniu okładek, a więc o
dużej pojemności.
nadmiar ładunku
ujemnego
metal
roztwór
elektrony
solwatowany anion
solwatowany kation
zaadsorbowany anion
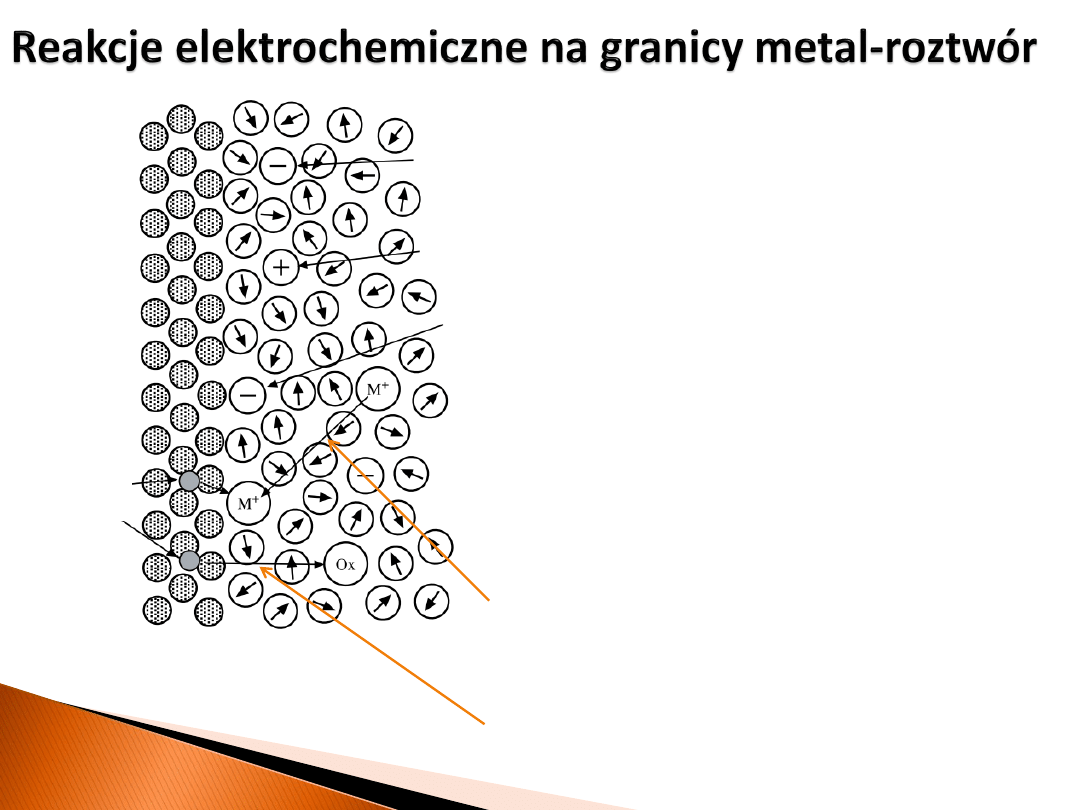
Reakcje elektrochemiczne (przeniesienie ładunku
przez interfejs, a więc przepływ prądu):
1) reakcje przeniesienia jonów
2) reakcje przeniesienia elektronów
𝑀
𝑛+
(𝑟𝑜𝑧𝑡𝑤ó𝑟) + 𝑛𝑒
−
(𝑚𝑒𝑡𝑎𝑙) ↔ 𝑀(𝑚𝑒𝑡𝑎𝑙)
𝑀
(𝑛+1)+
(𝑟𝑜𝑧𝑡𝑤ó𝑟) + 𝑒
−
↔ 𝑀
𝑛+
(𝑟𝑜𝑧𝑡𝑤ó𝑟)
Potencjał Volty ψ
α
(potencjał zewnętrzny)
– wielkość pracy potrzebna aby przenieść
ładunek elektryczny z nieskończoności w bliską okolicę powierzchni danej fazy
α
(wielkość mierzalna).
Potencjał Galvaniego φ
α
(potencjał wewnętrzny)
– wielkość pracy potrzebna aby
przenieść ładunek elektryczny z nieskończoności do wnętrza danej fazy
α
(wielkość
niemierzalna, przynajmniej bezpośrednio).
Potencjał powierzchniowy χ
α
= φ
α
– ψ
α
.
Może być rzędu nawet kilku woltów i z tego
względu nie jest zaniedbywalny. Wielkość ta będzie różna dla różnych powierzchni (np.
danego kryształu), co powoduje, że potencjał zewnętrzny w takim wypadku też będzie
inny.
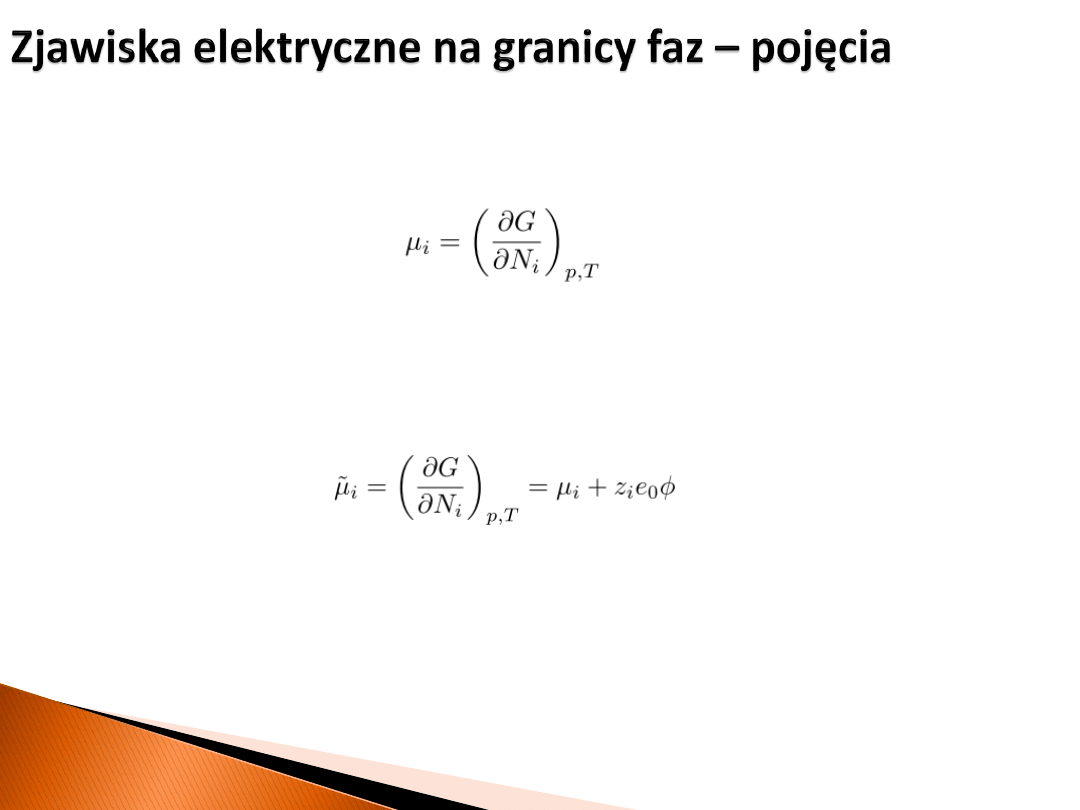
Potencjał chemiczny
z definicji dany jest wzorem:
Potencjał elektrochemiczny
dotyczy cząstek naładowanych. W przypadku, gdy wykonują
one pracę przeciwko potencjałowi wewnętrznemu można zapisać:
W przypadku cząstek nienaładowanych potencjały chemiczny i elektrochemiczny są
identyczne.
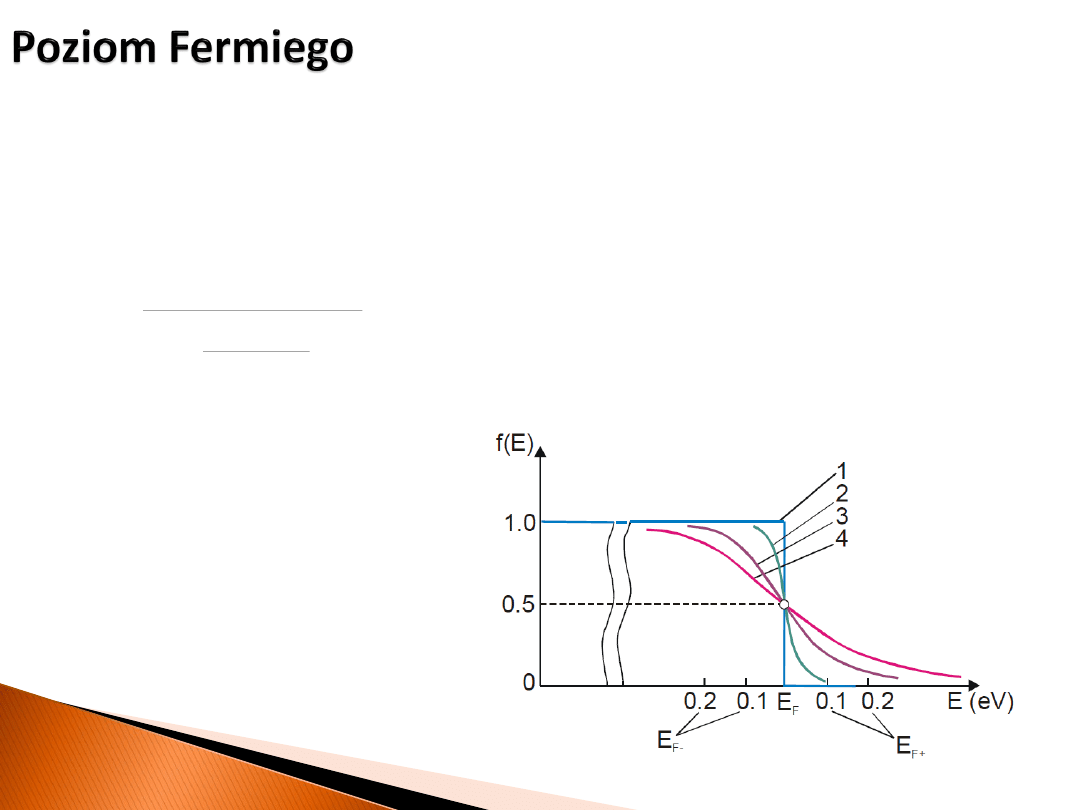
Dla temperatury T = 0 K
potencjał chemiczny elektronów
w metalu równa się
poziomowi
Fermiego E
F
. W temperaturach wyższych różnice są zaniedbywalne. Punktem odniesienia
poziomu Fermiego jest (zwykle) poziom odniesienia w nieskończoności w próżni.
1
)
(
0
,
1
exp
1
)
(
E
f
kT
E
E
E
f
F
1 – 0 K
2 – 300 K
3 – 1000 K
4 – 5000 K
rozkład Fermiego-Diraca
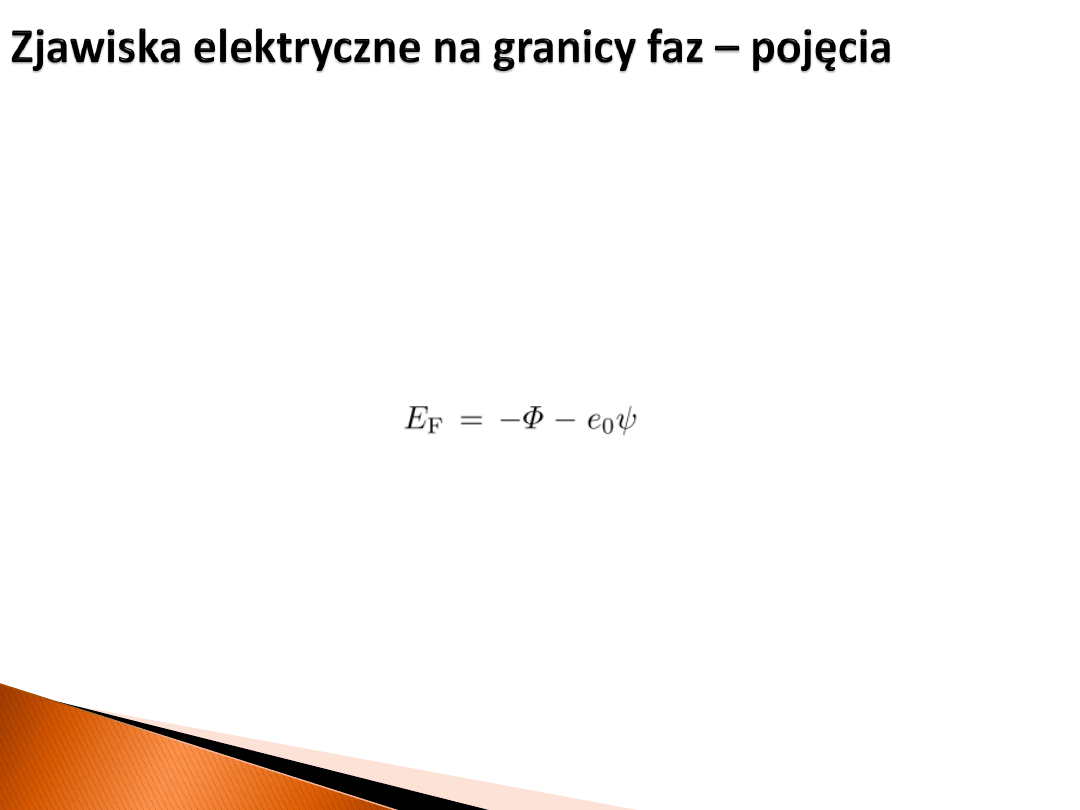
W metalu definiuje się
pracę wyjścia Φ
jako minimalną wartość pracy jaką należy
wykonać aby przenieść jeden elektron z wnętrza na zewnątrz. Konieczne jest do tego
„pokonanie” potencjału powierzchniowego
χ
α
. Praca wyjścia może być różna dla różnych
powierzchni.
Jeśli punk odniesienia umieścimy w nieskończoności w próżni to:
W przypadku standardowych potencjałów elektrod, poziomem odniesienia jest
standardowa elektroda wodorowa. Wybór ten jest arbitralny. Można też wziąć poziom
odniesienia w postaci poziomu w próżni.
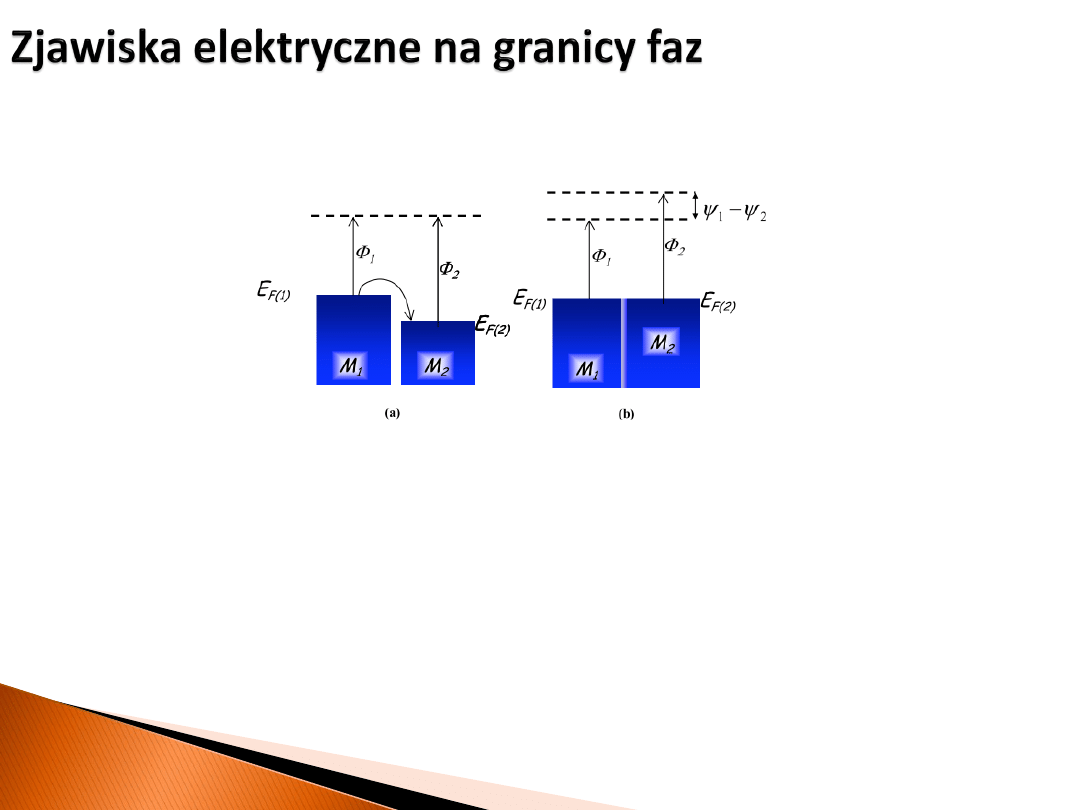
Jeśli zetkniemy dwa metale o różnym poziomie Fermiego (i pracy wyjścia), to poziomy
Fermiego
muszą
się wyrównać. Elektrony przepływają od metalu z niższą pracą wyjścia
to tego z wyższą i tworzy się warstwa dipolowa na granicy faz.
Różnić się też będą ich
potencjały zewnętrzne
.
powierzchnia
próżnia
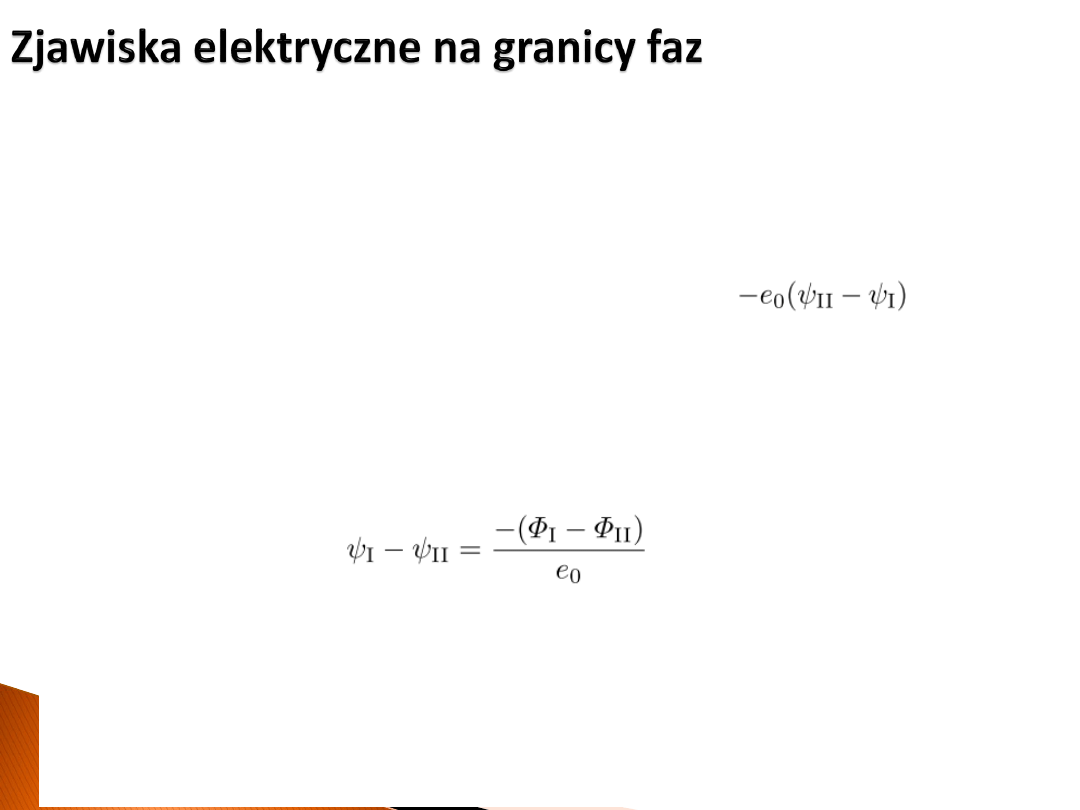
Można przeprowadzić rozumowanie:
1) „Zabieramy” elektron z poziomu Fermiego w metalu 1 do punktu w próżni.
Wykonana praca to praca wyjścia Φ
1
.
2) „Przenosimy” elektron nad metal 2. Wykonana praca to:
3) „Wkładamy” elektron do metalu 2 (na poziom Fermiego) i zyskujemy pracę –Φ
2
.
4) „Przenosimy” elektron do metalu 1, co nie wymaga pracy.
W efekcie:
Co oznacza, że różnica potencjałów zewnętrznych może być bezpośrednio policzona z
wartości pracy wyjścia.
Podobne
rozumowanie
można
przeprowadzić
dla
innego
rodzaju
interfejsu
wprowadzając „pracę wyjścia” dla danej reakcji elektrochemicznej zachodzącej na
elektrodzie.
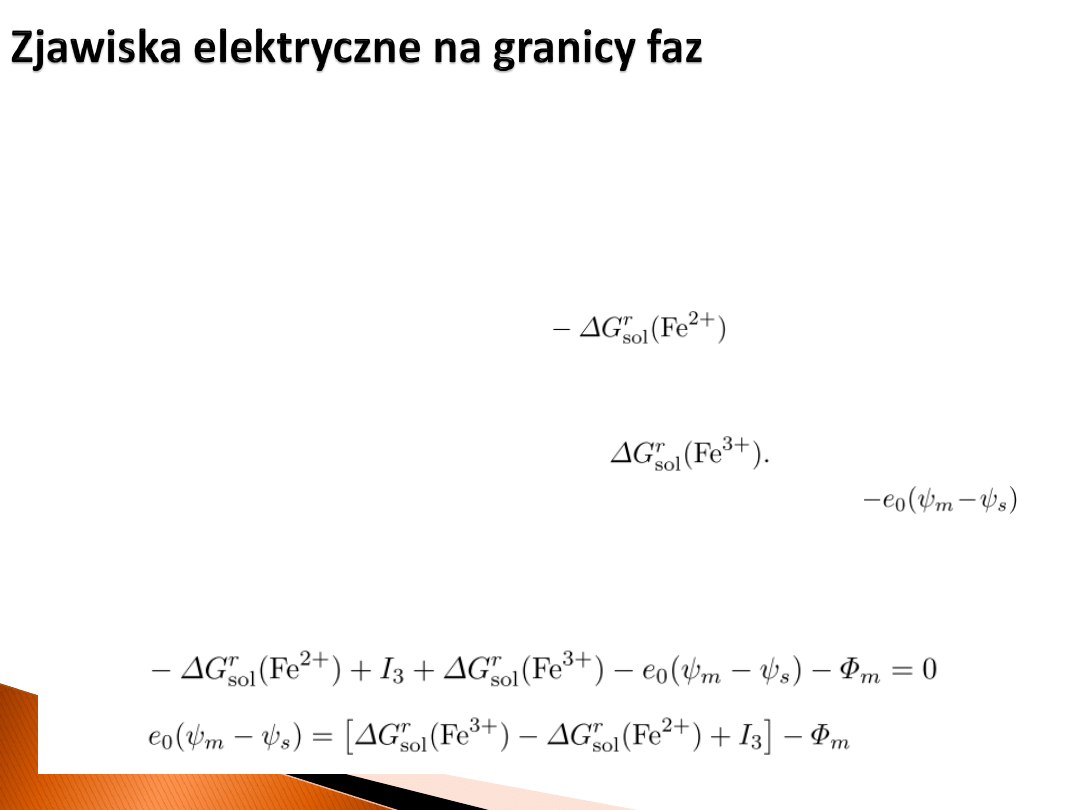
Załóżmy elektrodę typu redoks z metalem
M
i równą ilością kationów
Fe
2+
i
Fe
3+
w
elektrolicie.
„Przenosimy” elektron z roztworu do metalu następująco:
1) „Zabieramy” kation Fe
2+
z roztworu do próżni. Wykonana praca związana jest z
entalpią swobodną solwatowanego jonu (jest to wielkość
mierzalna).
2) Jonizujemy żelazo na +3, wykonują pracę związaną z energią jonizacji I
3
.
3) „Wkładamy” kation Fe
3+
do roztworu zyskując
4) „Przenosimy” elektron (znad roztworu) nad metal, wykonując pracę
5) „Wkładamy” elektron (na poziom Fermiego) do metalu M i zyskujemy pracę –Φ
M
.
Dodając otrzymujemy:
lub:
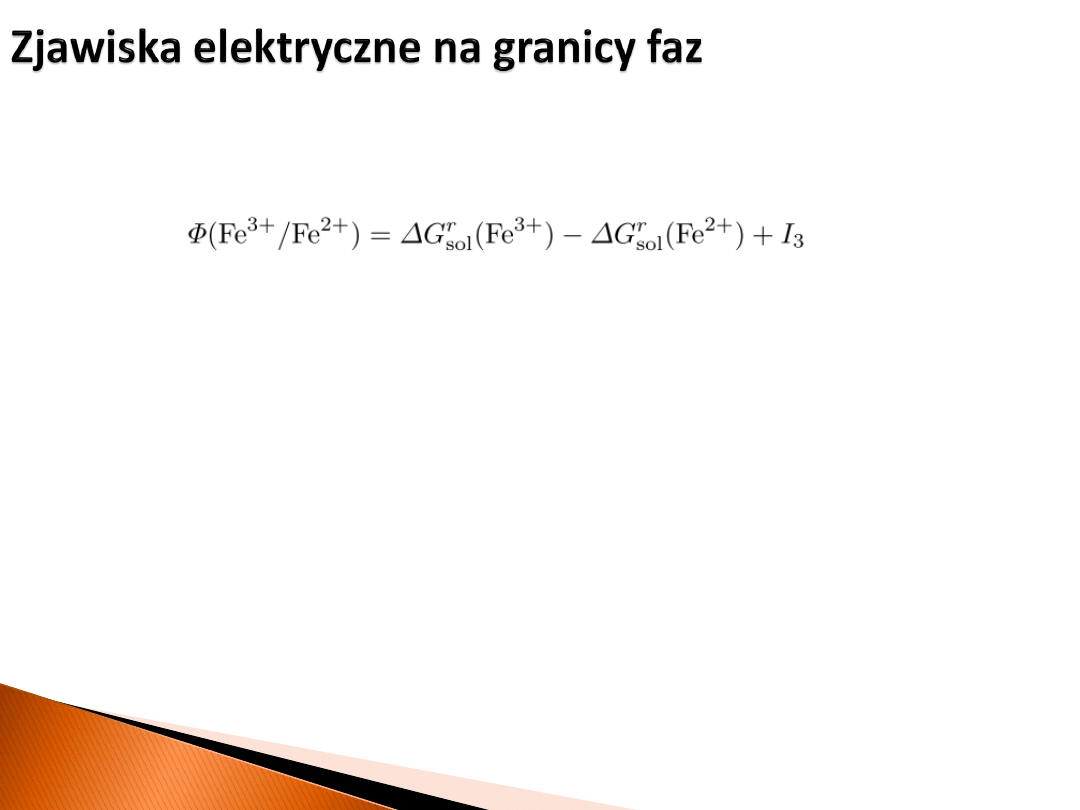
Można zatem zdefiniować „pracę wyjścia” dla pary redoks Fe
3+
/Fe
2+
w roztworze jako:
Wszystkie wielkości (po prawej) we wzorze są mierzalne.
Analogicznie można zdefiniować podobne „prace wyjścia” dla innych elektrod. Nie jest
to jednak konieczne, ponieważ różnica „prac wyjścia” (mierzonych w eV) dwóch reakcji
elektrodowych (w odpowiednich warunkach standardowych) równa się różnicy
„klasycznych” potencjałów standardowych (mierzonych w V).
Obecnie wartość „pracy wyjścia” dla standardowej elektrody wodorowej określa się jako
4,5±0,2 eV (można ją dodać do potencjałów standardowych, otrzymując odpowiednie
„prace wyjścia”). Wartości te podzielone przez ładunek elementarny dają
bezwzględną
skalę potencjałów elektrochemicznych
.

Budowa warstwy podwójnej
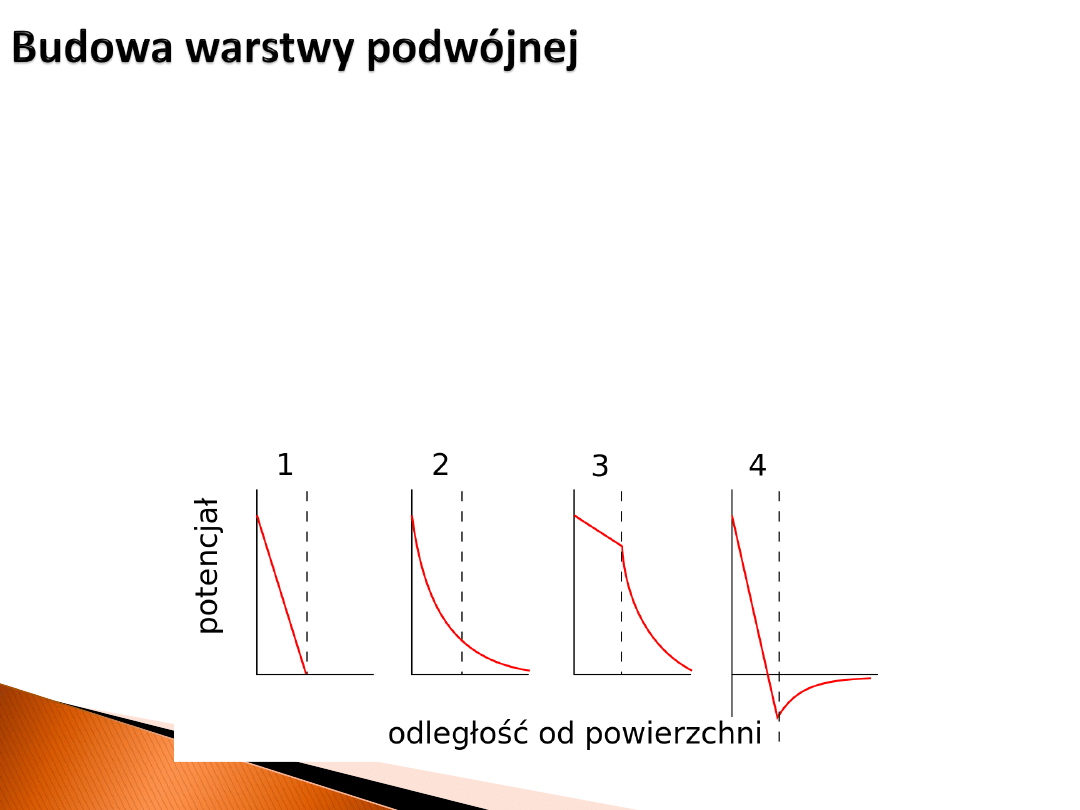
• Historycznie pierwszy model Helmholtza (1) warstwy podwójnej na granicy ciało stałe-
ciecz zakładał adsorpcję na powierzchni przeciwjonów, i w konsekwencji liniowy
spadek potencjału wraz z odległością.
• Gouy i Chapman (2) postulowali istnienie rozmytej „chmury jonów” i nieliniową
zależność potencjału od odległości.
• Stern połączył te dwa model e w jeden (3) i (4).
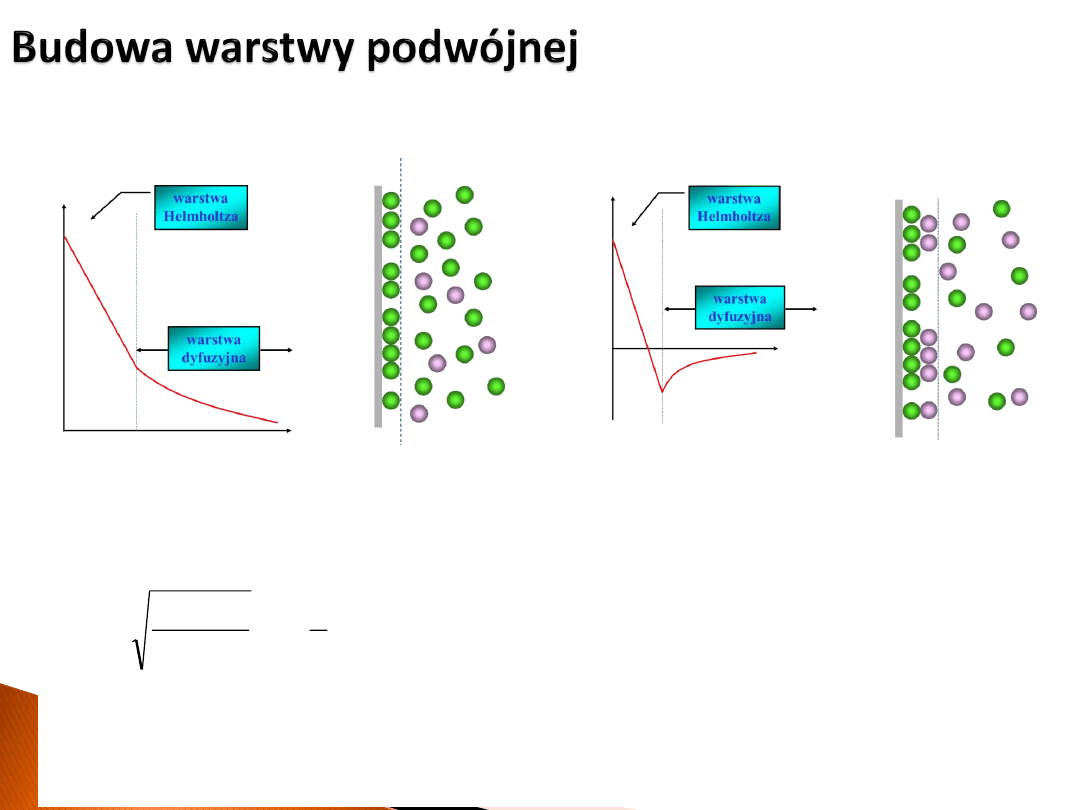
• Typowo warstwa podwójna (obie jej części) ma grubość rzędu nanometrów i zależy
miedzy innymi od siły jonowej
I
elektrolitu. Miarą jej grubości jest długość Debye'a
κ
-1
.
ε
0
- przenikalność elektryczna próżni,
ε
r
- względna przenikalność elektryczna,
k
B
- stała
Boltzmanna,
T
- temperatura,
N
A
- stała Avogadro,
e
- ładunek elementarny,
c
i
-
stężenie jonu
i
,
z
i
– ładunek jonu
i
.
3
4
pot
en
cjał
pot
encjał
odległość
odległość
n
i
i
i
A
B
r
z
c
I
I
e
N
T
k
1
2
2
0
1
2
1
,
2

• Na granicy pomiędzy warstwą Helmholtza a warstwą dyfuzyjną definiuje się Potencjał
elektrokinetyczny
ζ
.
• Istnienie tego potencjału można powiązać z szeregiem tak zwanych zjawisk
elektrokinetycznych:
• Elektroforeza
- ruch naładowanych powierzchni i związanego z nimi materiału (np.
rozpuszczony lub zawieszony w rozpuszczalniku materiał) względem nieruchomej
cieczy spowodowany przyłożonym polem elektrycznym.
• Elektroosmoza
- ruch cieczy względem nieruchomej naładowanej powierzchni
(np. kapilarny lub porowaty korek, membrana) spowodowany przyłożonym polem
elektrycznym (tj. uzupełnienie elektroforezy).
• Potencjał przepływu
- pole elektryczne, które jest wytwarzane kiedy ciecz
przepływa wzdłuż nieruchomej naładowanej powierzchni (tj. odwrotność
elektroosmozy),
• Potencjał sedymentacji
- pole elektryczne jest wytworzone, gdy naładowane
cząsteczki poruszają się względem nieruchomej cieczy (tj. przeciwieństwo
elektroforezy).

Polaryzacja elektrod

Potencjał obliczony z równania Nernsta, jak również siła elektromotoryczna ogniwa są to
parametry odpowiadające warunkowi równowagi bez przepływu prądu elektrycznego.
W przypadku gdy przez elektrodę płynie prąd jest ona polaryzowana, a więc jej potencjał
będzie inny niż równowagowy.
Wyróżnić można trzy podstawowe typy polaryzacji (nadnapięcia) elektrod:
- aktywacyjne,
- omowe,
- stężeniowe.
Ze względu na fakt, że w trakcie pracy (ogniwa) polaryzacja powoduje obniżenie jego
napięcia, alternatywnie używa się sformułowania „straty”.

• Straty aktywacyjne
η
akt
wynikają z kinetyki reakcji elektrodowych i są m. in. zależne od
typu reakcji elektrodowej oraz rodzaju i mikrostruktury materiału elektrodowego.
Straty te są słabo zależne od gęstości prądu. Temperaturowa zależność strat
aktywacyjnych jest w głównej mierze determinowana przez energię aktywacji etapu
limitującego reakcje elektrodowe.
• Straty omowe
η
om
związane są zarówno z jonową rezystancją elektrolitu i elektrod
oraz z elektronową rezystancję elektrod i interkonektorów, jak również
z rezystancją kontaktową na granicach fazowych (np. elektrolit | materiał katodowy).
Straty omowe są proporcjonalne do gęstości prądu, zależą od rodzaju, grubości,
mikrostruktury użytych materiałów oraz od geometrii ogniwa. Temperaturowa
zależność strat omowych determinowana jest mechanizmem przewodzenia w
rozpatrywanym materiale.
• Straty związane z transportem masy i dyfuzją w gazach (jeśli występuje)
η
st
, które w
głównej mierze zależne są od gęstości prądu, typu reagentów oraz od struktury i
mikrostruktury elektrod oraz konstrukcji samego ogniwa.

10
5
5
10
1000
500
500
1000
Straty aktywacyjne
η
akt
można określić na podstawie rozwiązania równania Butlera-
Volmera wyrażającego zależność pomiędzy
η
akt
oraz gęstością prądu wymiany
j
0
, a
obserwowaną gęstością prądu
j
na elektrodzie.
n
– liczba elektronów biorących udział w reakcji
β
– współczynnik wymiany ładunku, 0 <
β
< 1, zwykle około 0,5
Równanie powyższe jest FUNDAMENTALNE dla elektrochemii: opisuje kinetykę reakcji
elektrodowych. Wyprowadzenie równania polega na uwzględnieniu równocześnie
zachodzących na elektrodzie reakcji katodowej i anodowej.
Dla
β
= 0,5:
T
R
F
n
T
R
F
n
j
j
akt
akt
1
exp
exp
0
T
R
F
n
j
j
akt
2
sinh
2
0
2
sinh
x
x
e
e
x

A więc:
Przykładowo, dla
n
= 2,
R
= 8,314 J/mol·K,
T
= 298 K,
j
0
= 1 A/cm
2
:
0
0
1
2
arsinh
2
2
sinh
2
j
j
F
n
T
R
j
j
F
n
T
R
akt
10
5
5
10
3
2
1
1
2
3
1
ln
arsinh
2
x
x
x
10
5
5
10
0.06
0.04
0.02
0.02
0.04
0.06
η
akt
j

0.06
0.04
0.02
0.02
0.04
0.06
10
5
5
10
η
akt
j = j
pol. anodowej
+ j
pol. katodowej
j
0
j
pol. anodowej
j
pol. katodowej

1
10
7
5
10
6
5
10
6
1
10
7
0.4
0.2
0.2
0.4
2
1
1
2
0.02
0.01
0.01
0.02
|
η
akt
| małe (< 0,1 V)
|
η
akt
| duże (> 0,3 V)

Ponieważ , to dla
Uwzględniając tylko pierwszy wyraz szeregu Taylora otrzymujemy zależność liniową:
11
9
7
5
3
]
[
O
1152
35
112
5
40
3
6
arsinh
x
x
x
x
x
x
x
0
2
arsinh
2
j
j
F
n
T
R
akt
1
2
0
j
j
j
j
F
n
T
R
akt
0
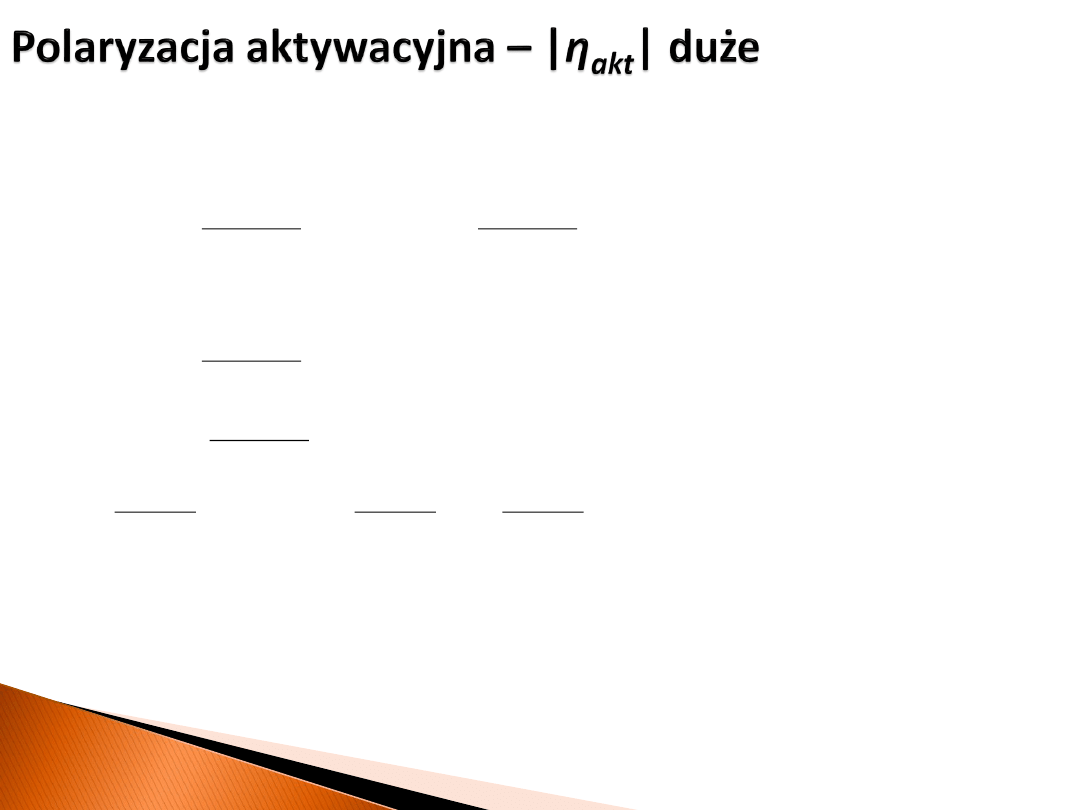
Dla dużych dodatnich wartości
η
akt
w równaniu:
drugi człon można zaniedbać, ponieważ nie wpłynie on znacząco na wynik, a więc:
Równanie to określa się mianem równania Tafela.
Powyższe wyprowadzenie zrobiono dla
POLARYZACJI ANODOWEJ
. Analogiczne
wyprowadzenie można zrobić dla
POLARYZACJI KATODOWEJ ELEKTRODY
:
η
akt
duże
ujemne!
T
R
F
n
T
R
F
n
j
j
akt
akt
1
exp
exp
0
0
0
0
0
ln
ln
)
ln
(ln
ln
ln
exp
j
F
n
T
R
j
F
n
T
R
j
j
F
n
T
R
T
R
F
n
j
j
T
R
F
n
j
j
akt
akt
akt
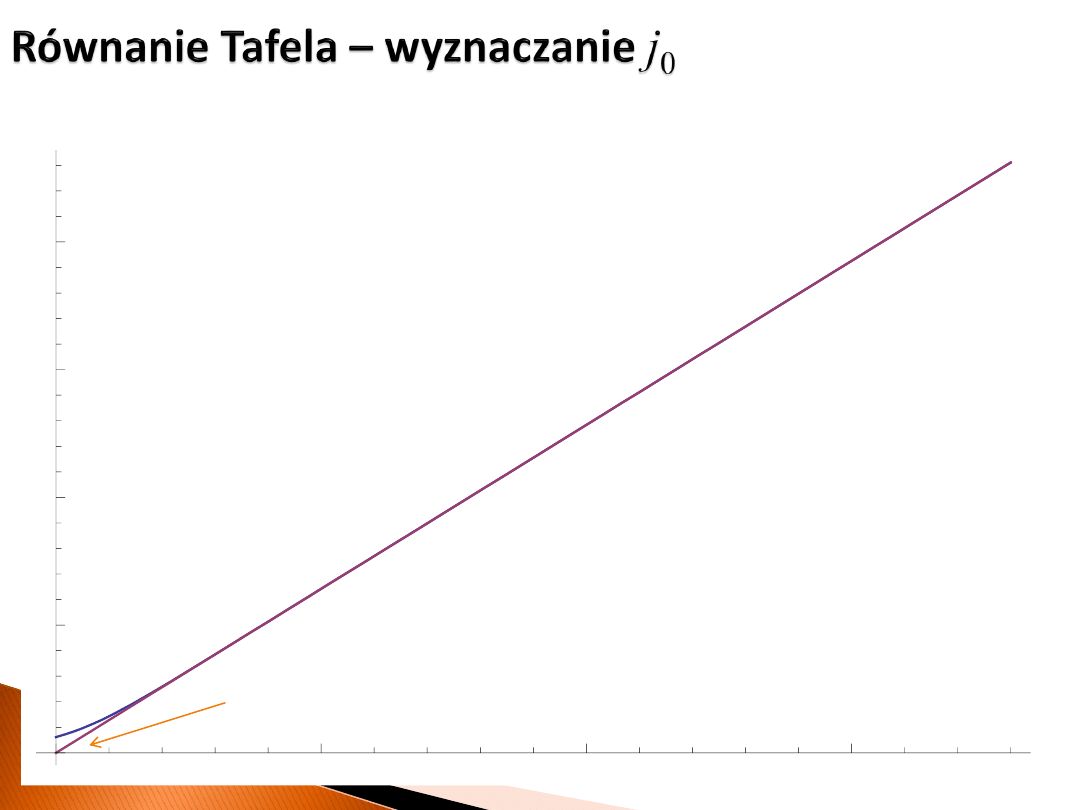
5
10
15
0.1
0.2
0.3
0.4
η
akt
ln j
ln j
0
= 0 → j
0
= 1 A/cm
2
tak jak zostało założone

W trakcie pracy
KATODA
w ogniwie spolaryzowana jest
KATODOWO
, a
ANODA
spolaryzowana jest
ANODOWO
.

Nadpotencjał związany ze stratami omowymi
η
om
można wyrazić w postaci iloczynu
prądu płynącego przez ogniwo oraz sumy całkowitej rezystancji jonowej
R
i
, elektronowej
R
e
i kontaktowej
R
K
ogniwa.
W oparciu o straty omowe definiuje się również rezystancję powierzchniową
ASR
, która
określa znormalizowaną do rozmiarów aktywnej powierzchni działającego ogniwa
wartość (rozpatrywanej) rezystancji:
Rozpatrując oddzielnie anodę i katodę oraz posługując się opornościami właściwymi
ρ
(skorygowanymi o porowatość oraz ewentualną obecność obcych faz) oraz grubościami
elektrolitu, katody i anody, można zapisać odpowiednio:
K
e
i
om
R
R
R
i
R
A
ASR
A
R
l
l
l
j
K
a
a
k
k
e
e
om

Minimalizacja strat omowych np. związanych z elektrolitem może być dokonana dwiema
drogami: poprzez zmniejszenie grubości elektrolitu lub poprzez zastosowanie materiału
o wyższym przewodnictwie jonowym.
W praktyce podaje się wartości ASR wyznaczone dla elektrolitu, anody i katody lub ich
sumę, a wielkości te są kluczowymi parametrami determinującymi efektywność pracy
ogniwa.
2
4
6
8
10
0.01
0.02
0.03
0.04
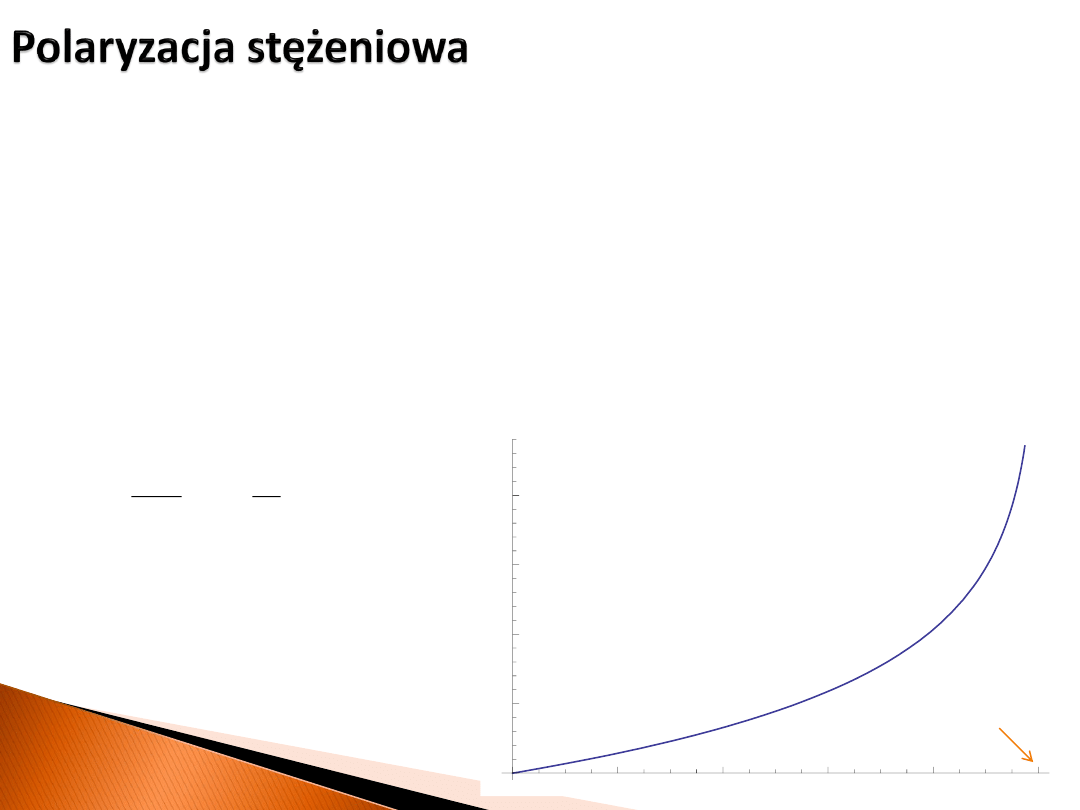
Polaryzacja stężeniowa
η
st
określa straty związane z transportem masy i dyfuzją.
W przypadku gdy dostarczanie reagentów oraz odbiór produktów z elektrody odbywa
się w fazie gazowej, możliwe jest podanie, w oparciu o pierwsze prawo Ficka,
stosunkowo prostej zależności, która je opisuje.
Konieczne jest jednak założenie pomijalnie małego wpływu strat aktywacyjnych, co jest
dość dobrze spełnione w niektórych przypadkach. Nadpotencjał
η
st
wyraża się wówczas
wzorem zawierającym graniczną
gęstość prądu
j
g
:
Zakładając
j
g
= 10 A/cm
2
otrzymujemy:
g
st
j
j
F
n
T
R
1
ln
j
j
g
η
st

Uwzględniając dyfuzję Knudsena w porowatych elektrodach oraz ciśnienia
poszczególnych gazów można wyprowadzić równania opisujące odpowiednio
polaryzację stężeniową anody i katody ogniwa SOFC zasilanego wodorem i powietrzem.
Dyfuzja Knudsena – dyfuzja gazu zachodząca w tak małych naczyniach lub w warunkach
tak niskiego ciśnienia, że średnia droga swobodna cząstek ograniczona jest poprzez
zderzenia ze ściankami naczynia, a nie przez zderzenia z innymi cząstkami. Typowy
przykład to transport w substancjach mikroporowatych.
j
p
p
D
l
F
T
R
j
p
p
D
l
F
T
R
F
T
R
a
O
H
eff
a
a
a
H
eff
a
a
anoda
st
0
)
(
0
)
(
2
2
2
1
2
1
ln
2

k
O
eff
k
k
O
k
O
O
O
katoda
st
p
j
p
p
D
l
F
T
R
p
p
p
F
T
R
2
2
2
2
2
0
)
(
4
exp
ln
4
Przy czym ciśnienia gazów odpowiadają wartościom na wlocie, efektywny współczynnik
dyfuzji na anodzie
D
a(eff)
uwzględnia dyfuzję w układzie H
2
-H
2
O i dyfuzję Knudsena H
2
i
H
2
O, a współczynniki
D
k(eff)
oraz
Δ
O2
dyfuzję zwykłą O
2
-N
2
oraz dyfuzję Knudsena O
2
.
We wzorach pojawiają się również: ciśnienie oraz ciśnienia parcjalne produktów i
substratów (
p
) oraz grubość warstwy porowatej (
l
).

Załóżmy
l
a
= 0.1 cm,
D
a(eff)
= 10
-7
cm
2
/s,
p
= 100 000 Pa:
2
4
6
8
10
0.01
0.02
0.03
0.04
0.05
0.06
η
st
j

Wszystkie opisane powyżej straty polaryzacyjne będą obniżać napięcie pracy ogniwa.
A więc dla
n
= 2,
R
gazowa
= 8,314 J/mol·K,
T
= 298 K,
j
0
= 1 A/cm
2
,
j
g
= 10 A/cm
2
oraz dla
całkowitego oporu ogniwa
R
= 1 Ω o powierzchni
A
= 1 cm
2
wykres napięcia w funkcji
gęstości prądu wygląda (załóżmy również, że
E
Nernsta
= 1 V):
0
2
4
6
8
10
0.2
0.4
0.6
0.8
1.0
E [V]
i [A]
Czy coś jest nie tak?
Nie – w zależności od wzajemnego stosunku R, j
0
i j
g
sumaryczna zależność napięcia od prądu może różnie
wyglądać.
st
om
akt
Nernsta
E
E

j
0
= 1 A/cm
2
, j
g
= 10 A/cm
2
, R = 0.1 Ω
0
2
4
6
8
10
0.2
0.4
0.6
0.8
1.0
j
0
= 10 A/cm
2
, j
g
= 10 A/cm
2
, R = 0.1 Ω
0
2
4
6
8
10
0.2
0.4
0.6
0.8
1.0
j
0
= 0.1 A/cm
2
, j
g
= 10 A/cm
2
, R = 0.1 Ω
0
2
4
6
8
10
0.2
0.4
0.6
0.8
1.0
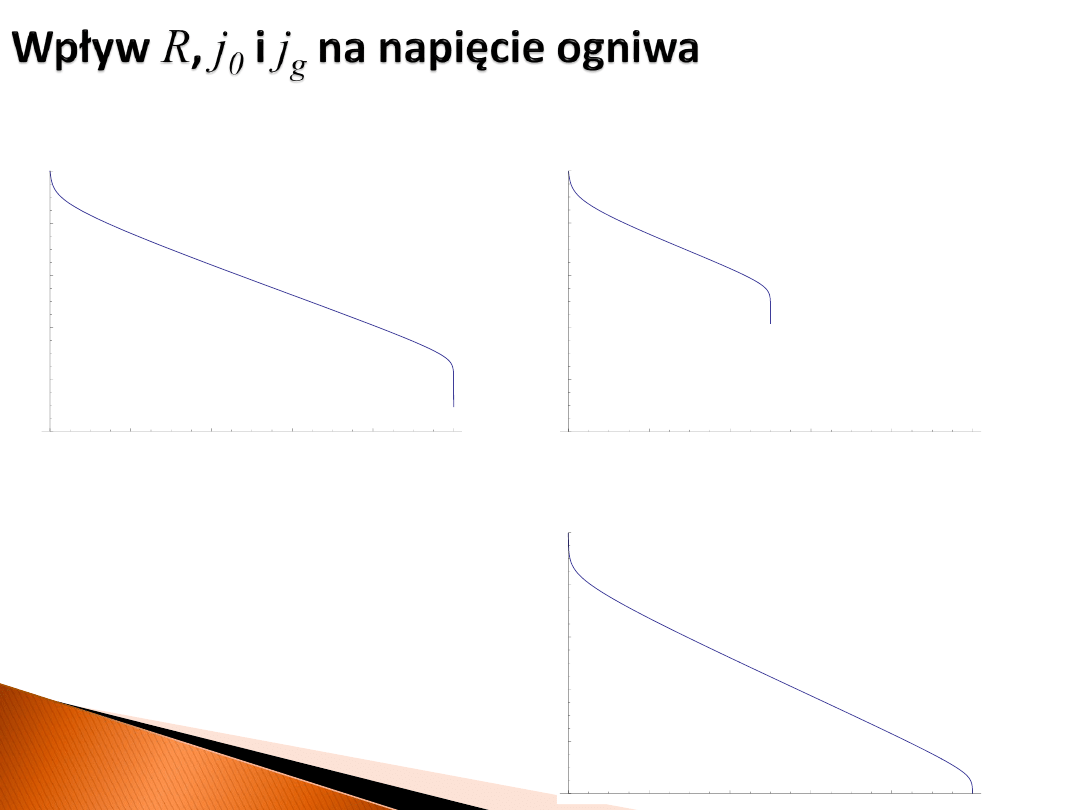
j
0
= 0.01 A/cm
2
, j
g
= 10 A/cm
2
, R = 0.05 Ω
j
0
= 0.01 A/cm
2
, j
g
= 5 A/cm
2
, R = 0.05 Ω
j
0
= 0.001 A/cm
2
, j
g
= 10 A/cm
2
, R = 0.065 Ω
0
2
4
6
8
10
0.2
0.4
0.6
0.8
1.0
0
2
4
6
8
10
0.2
0.4
0.6
0.8
1.0
0
2
4
6
8
10
0.2
0.4
0.6
0.8
1.0
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna wykład 11
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
chemia fizyczna I wykład(1)
chf wykład 6, Studia, Chemia, fizyczna, wykłady
Chemia fizyczna wykład 10
Chemia fizyczna wykład 4
chf wykład 3, Studia, Chemia, fizyczna, wykłady
2015 pyt tren do wykł VII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, ch
Chemia fizyczna wykład 12
chf wykład 8, Studia, Chemia, fizyczna, wykłady
Chemia fizyczna wykład 9
Chemia fizyczna wykład 1
tech.chem. PGd chemia fizyczna wyklady, Technologia chemiczna, Chemia fizyczna, Wykłady, wykłady na
Chemia fizyczna wyklad, Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
Chemia fizyczna (wyklad 3), Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
Chemia fizyczna (wyklad 4), Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
chf wykład 1, Studia, Chemia, fizyczna, wykłady
chemia fizyczna wykład4
pytania treningowe wykład II 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizy
więcej podobnych podstron