
Magazynowanie tlenu w tlenkach
o strukturze perowskitu
(praktyczne wykorzystanie procesów redoks)
Konrad Świerczek

1.
Wprowadzenie
•
Zastosowanie materiałów magazynujących tlen (OSM)
w trójfunkcyjnych konwerterach katalitycznych
•
Potencjalne zastosowania technologii magazynowania tlenu
2.
Tlenki o strukturze perowskitu dla technologii magazynowania tlenu
•
Struktura perowskitu prostego
•
Perowskity z uporządkowaną podsiecią kationową
•
Układ BaLnMn
2
O
5
- BaLnMn
2
O
6
3.
Podsumowanie

• Wyobraźmy sobie następującą reakcję chemiczną:
CeO
2
= CeO
2-δ
+ δ/2O
2
↑
• Równowaga tej reakcji (w wysokiej temperaturze) zależeć będzie od ciśnienia
parcjalnego tlenu w atmosferze otaczającej materiał.
• Można zatem powiedzieć, że CeO
2
jest w stanie oddawać i pobierać tlen,
a wiec go odwracalnie magazynować.
• W praktyce, do magazynowania tlenu znalazł zastosowanie mieszany tlenek
ceru i cyrkonu, a dokładniejszy opis reakcji przedstawia równanie:
Ce
4+
1-x
Zr
4+
x
O
2
= Ce
4+
1-x-y
Ce
3+
y
Zr
4+
x
O
2-y/2
+ y/4O
2
↑
• Zmiana zawartości tlenu związana jest ze zmianą stopnia utlenienia ceru
w materiale. Dodatek cyrkonu zapewnia wysoką stabilność chemiczną.

• Wspomniany materiał znalazł zastosowanie komercyjne w trójdrożnych
(trójfunkcyjnych) konwerterach katalitycznych (pot. „katalizatorach”)
montowanych w układzie wydechowym samochodów z silnikiem
benzynowym.
• Ce
1-x
Zr
x
O
2
(np. Ce
0,5
Zr
0,5
O
2
) określa się jako materiał do magazynowania tlenu
(ang. oxygen storage material, OSM) i pełni on w konwerterze katalitycznym
funkcję katalizatora pomocniczego, którego główną rolą jest buforowanie
zmian ciśnienia parcjalnego tlenu w spalinach.
Przekrój konwertera katalitycznego
1
- spaliny wpływające,
2
- blok katalityczny,
3
- ścianki kanałów,
4
- powiększenie
pojedynczego kanału,
5
- oczyszczone spaliny

Funkcje konwertera TWC (ang. three-way catalyst)
• Redukcja tlenków azotu
2NO
x
→
xO
2
+ N
2
• Utlenianie tlenku węgla
2CO +
O
2
→ 2CO
2
• Dopalanie niedopalonych węglowodorów (HC)
C
x
H
2x+2
+
[(3x+1)/2]O
2
→ xCO
2
+ (x+1)H
2
O
• Kluczowa dla efektywnego zajścia tych
wszystkich reakcji (na głównym katalizatorze
wykonanym z metali szlachetnych) jest
odpowiednia prężność parcjalna tlenu
w spalinach
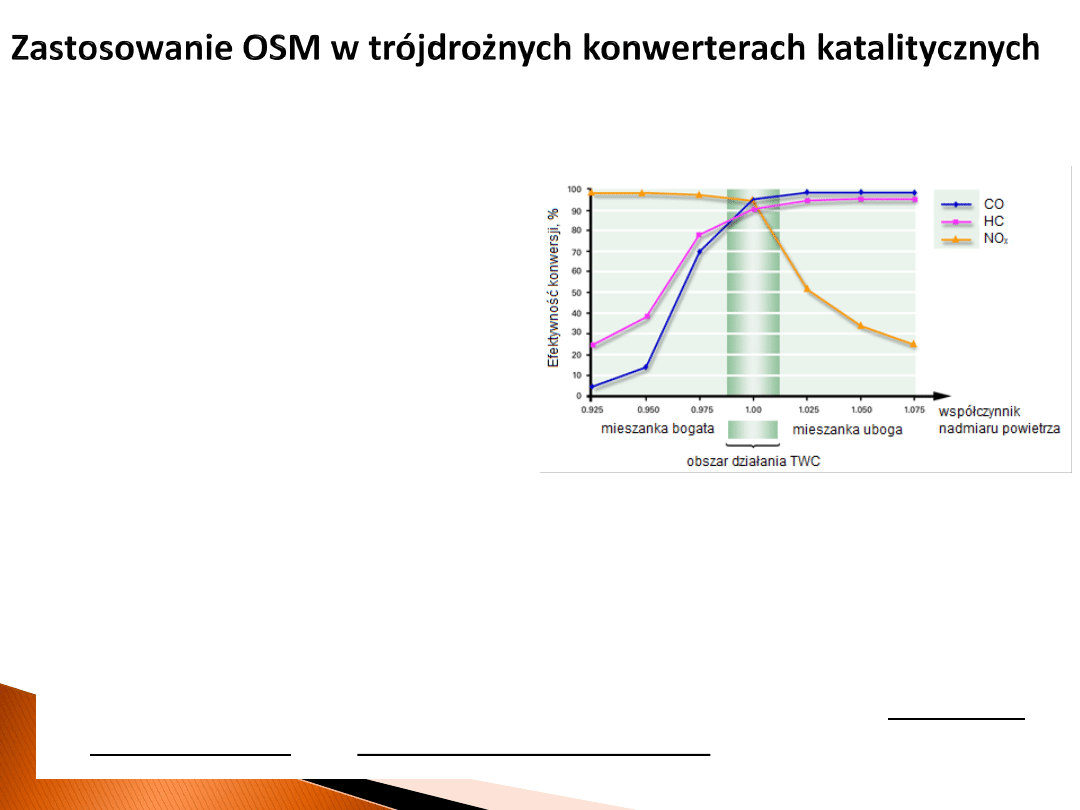
• Katalizator TWC pracuje efektywnie jedynie, gdy ciśnienie parcjalne tlenu
w spalinach jest odpowiednie.
• Skład mieszanki reguluje komputer
w oparciu o dane z sondy (lub wielu
sond) lambda. Przy gwałtownej
zmianie prędkości obrotowej silnika
układ ten jednak nie jest w stanie
odpowiednio szybko zareagować.
• W przypadku niedomiaru tlenu w spalinach (mieszanka bogata, gwałtowne
przyspieszanie) materiał OSM oddaje tlen, co umożliwia zajście reakcji
utleniania niedopalonych węglowodorów oraz CO.
• W przypadku nadmiaru tlenu w spalinach (mieszanka uboga, gwałtowne
hamowanie) materiał OSM pobiera tlen, co umożliwia zajście reakcji redukcji
NO
x
.
Jest oczywistym, że kluczowe parametry materiału OSM to pojemność
magazynowania oraz szybkość redukcji/utleniania.

• Separacja składników powietrza (alternatywnie do stosowanej obecnie
techniki kriogenicznej oraz adsorpcji zmiennociśnieniowej /
zmiennotemperaturowej),
• Produkcja gazu syntezowego,
• Utlenianie anaerobowe,
• Procesy wysokotemperaturowe wymagające tlenu wysokiej czystości,
• Dla czystych technologii węglowych „oxy-fuel” oraz „chemical looping”,
• Fotoelektroliza wody,
• Technologia SOFC,
• Oczyszczanie gazów obojętnych,
• …

• Jaką pojemność (%wag. oraz w μmol-O/g) posiada materiał komercyjny
o składzie Ce
0,5
Zr
0,5
O
2
?
Materiał całkowicie zredukowany będzie miał skład Ce
0,5
Zr
0,5
O
1,75
(Ce
3+
0,5
Zr
4+
0,5
O
1,75
), a więc całkowita, teoretyczne zmiana wynosi 0,25 (mola
tlenu na mol związku).
Masa molowa Ce
0,5
Zr
0,5
O
1,75
to: 0,5·140,12 + 0,5·91,22 + 1,75·16 = 143,67
g/mol. A więc 0,25·16/143,67 =
2,78 %wag.
W innych jednostkach: 10
6
·0,25/143,67 =
1740 μmol-O/g.
• W przeciwieństwie do teoretycznej, odwracalnej pojemności
magazynowania tlenu (ang. oxygen storage capacity, OSC), która zależy
od składu chemicznego, pojemność praktyczna oraz szybkość
redukcji/utleniania zależeć będą też od mikrostruktury materiału
(np. rozwinięcia powierzchni proszku).

Tlenki o strukturze perowskitu
dla technologii magazynowania tlenu
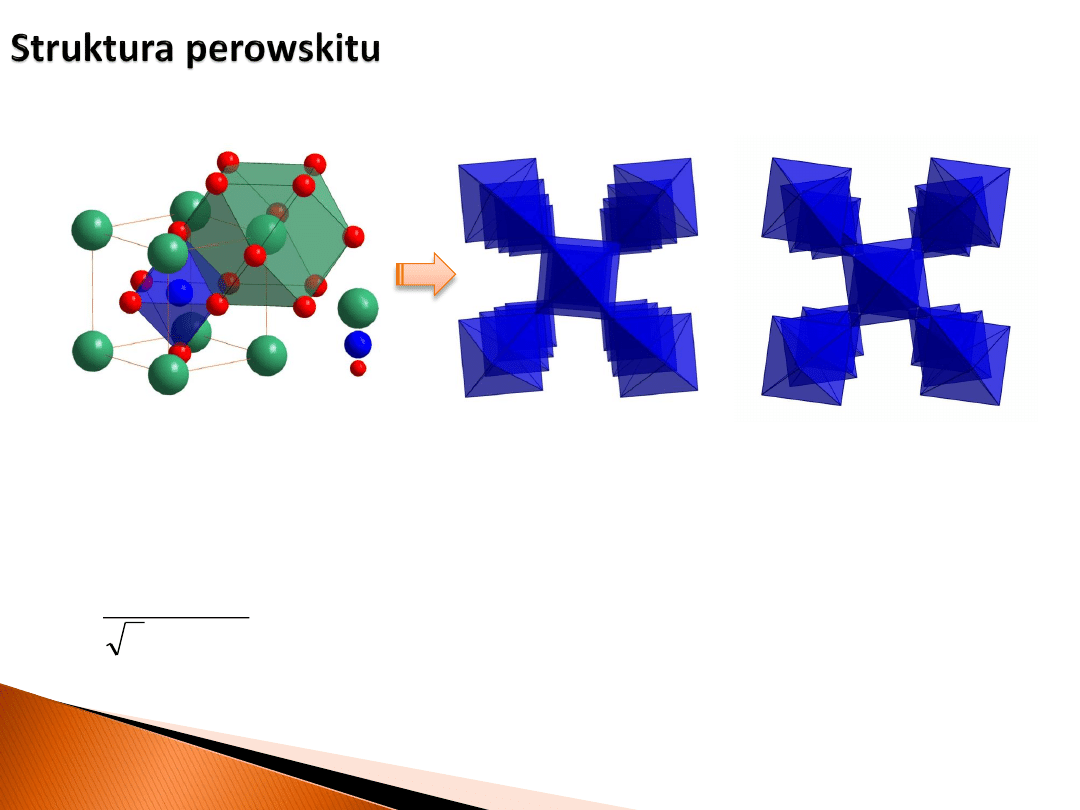
a
0
a
0
c
+
a
0
a
0
c
-
P4/mbm
I4/mcm
struktura regularna Pm-3m
a
0
a
0
a
0
A
B
O
dwa typy rotacji oktaedrów
Parametr dopasowania strukturalnego t Goldschmidta (1926)
O
B
O
A
r
r
r
r
t
2

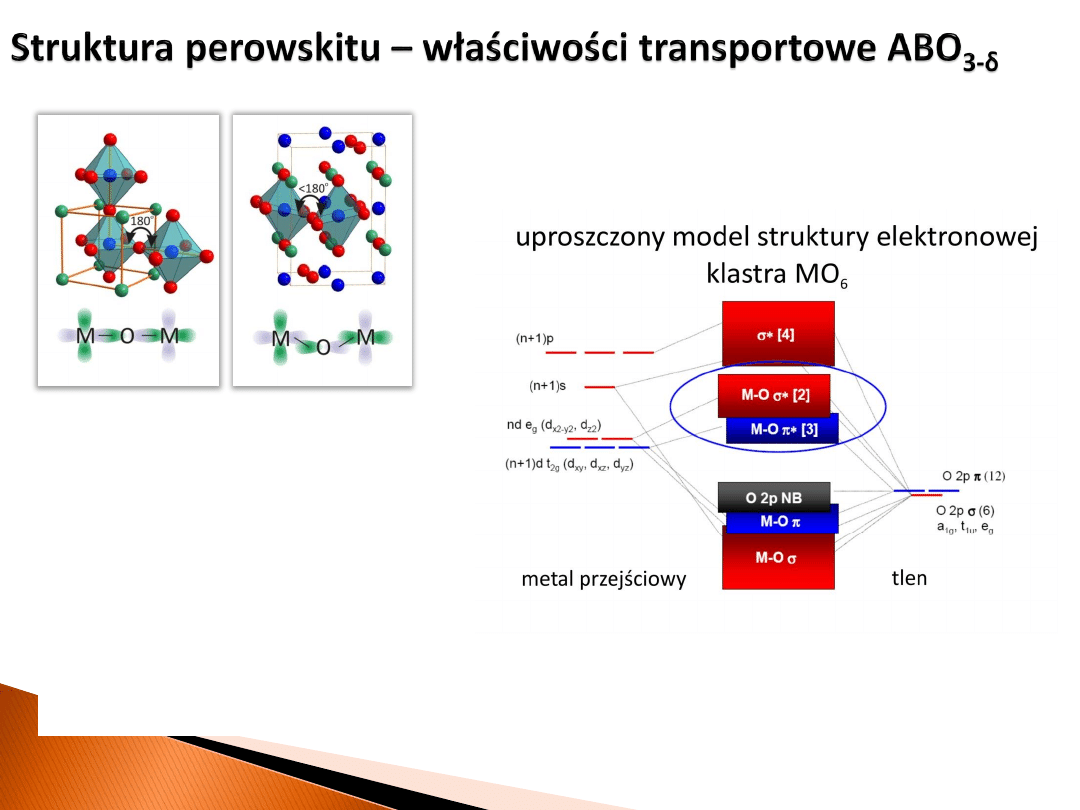
przewodnictwo elektronowe
mechanizm wymiany podwójnej M-O-M
(np. B
3+
-O-B
4+
)
całka wymiany
t
p-d
∼ cos(
p
-
q
)
szerokość pasma jedno-elektronowego
W ∼ cos
2
(
q
)
przewodnictwo jonowe:
mechanizm wakancyjny (δ zwykle ≤ 0.5)
Ba
2
MgWO
6
NdSrMn
3+
Mn
4+
O
6
La
2
CuSnO
6
NaBaLiNiF
6
CaFeTi
2
O
6
BaYMn
2
O
6
G. King, P.M. Woodward, J. Mater. Chem. 20 (2010) 5785
typu
so
li
kamie
n
n
ej
kolu
mn
o
w
e
w
ar
stw
ow
e
podsieć B
podsieć A
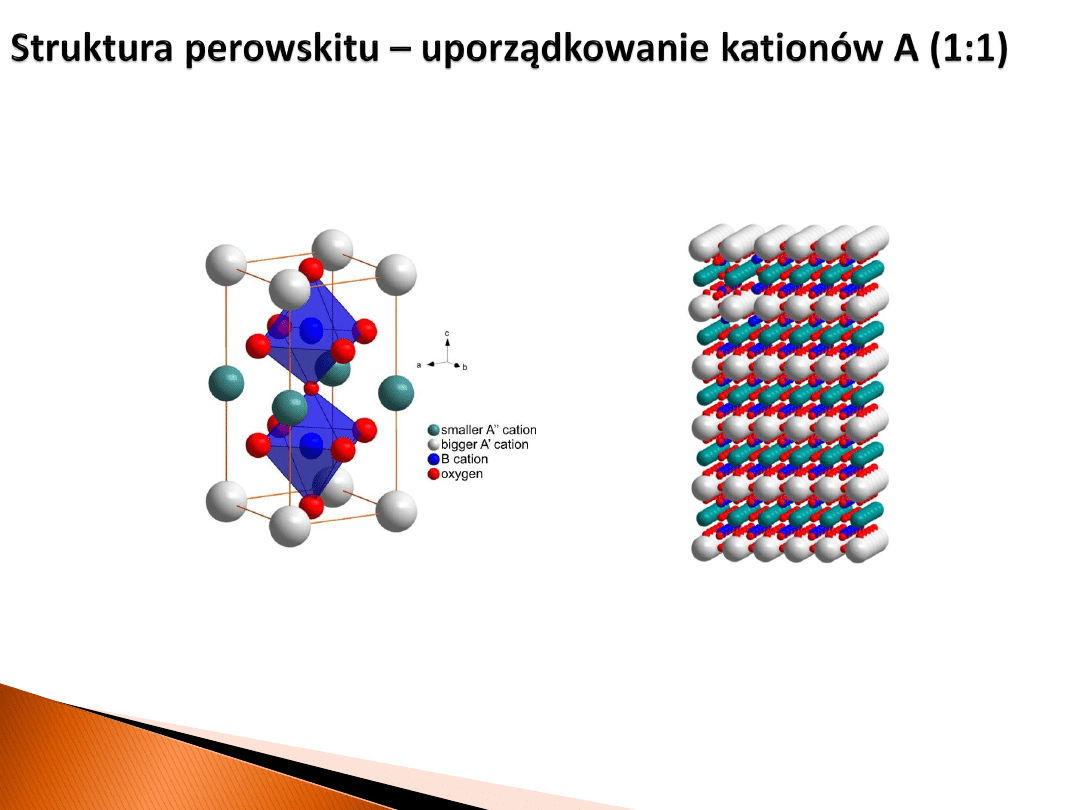
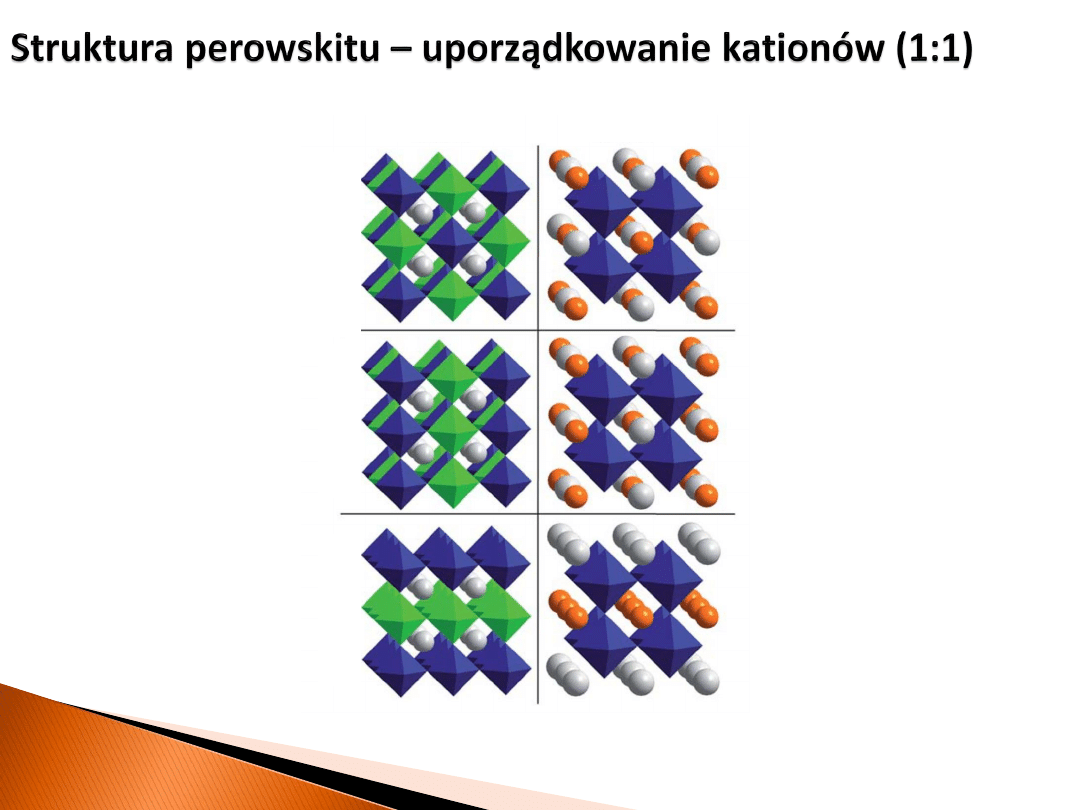
A
2
B
2
O
6
P4/mmm
perowskit podwójny z uporządkowaniem kationów w podsieci A
Przyczyną uporządkowanie jest duża różnica promieni jonowych
pomiędzy kationami A’ i A’’
A’
A’’
B
2
O
6
Ba
Y
Mn
2
O
6
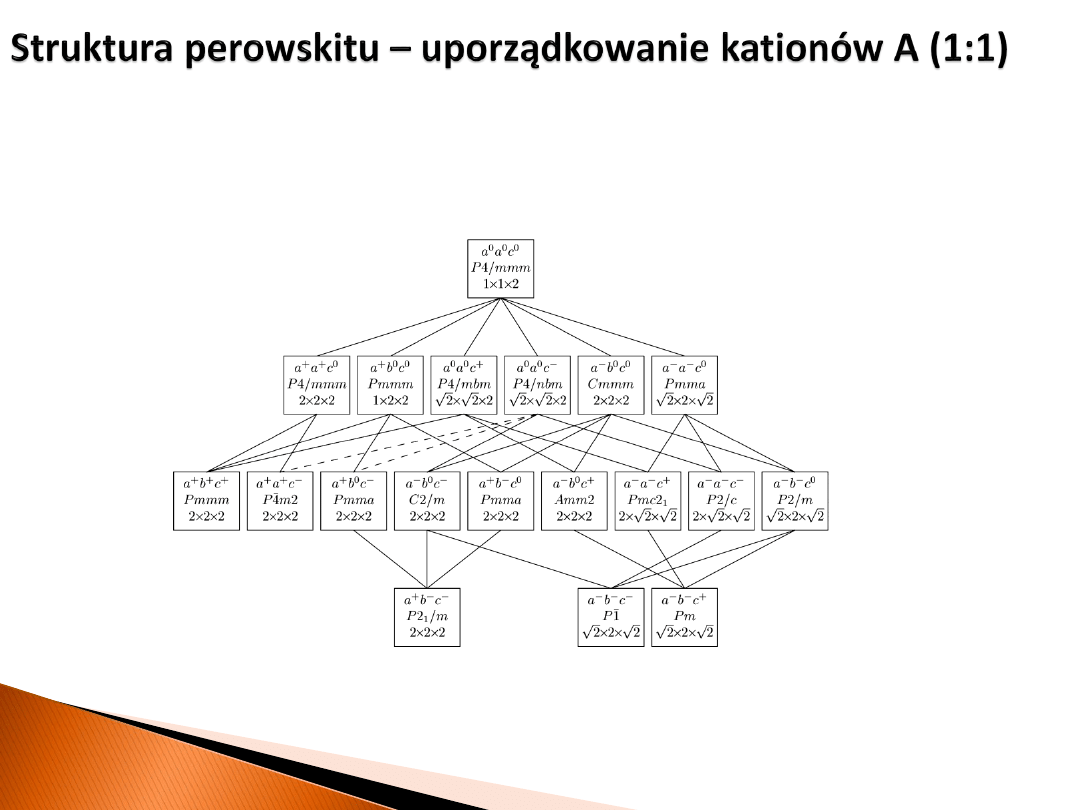
przemiany fazowe w perowskitach podwójnych z uporządkowaniem
kationów w podsieci A
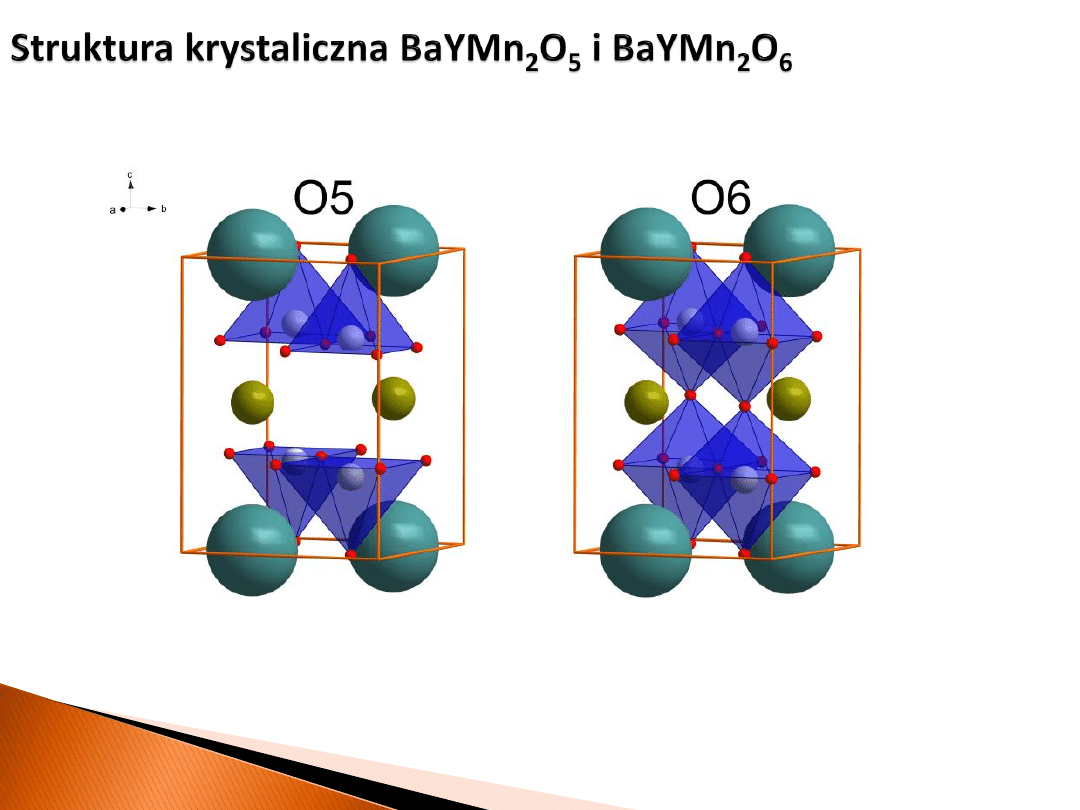
Ba
Mn
Y
Mn
Ba
Tlen jest preferencyjnie usuwany z warstw powiązanych z itrem.
Dla materiałów całkowicie zredukowanych wszystkie pozycje tlenu
są w tych warstwach puste.
M. Karppinen, H. Okamoto, H. Fjellvag, T. Motohashi,
H. Yamauchi, J. Solid State Chem. 177(6) (2004) 21
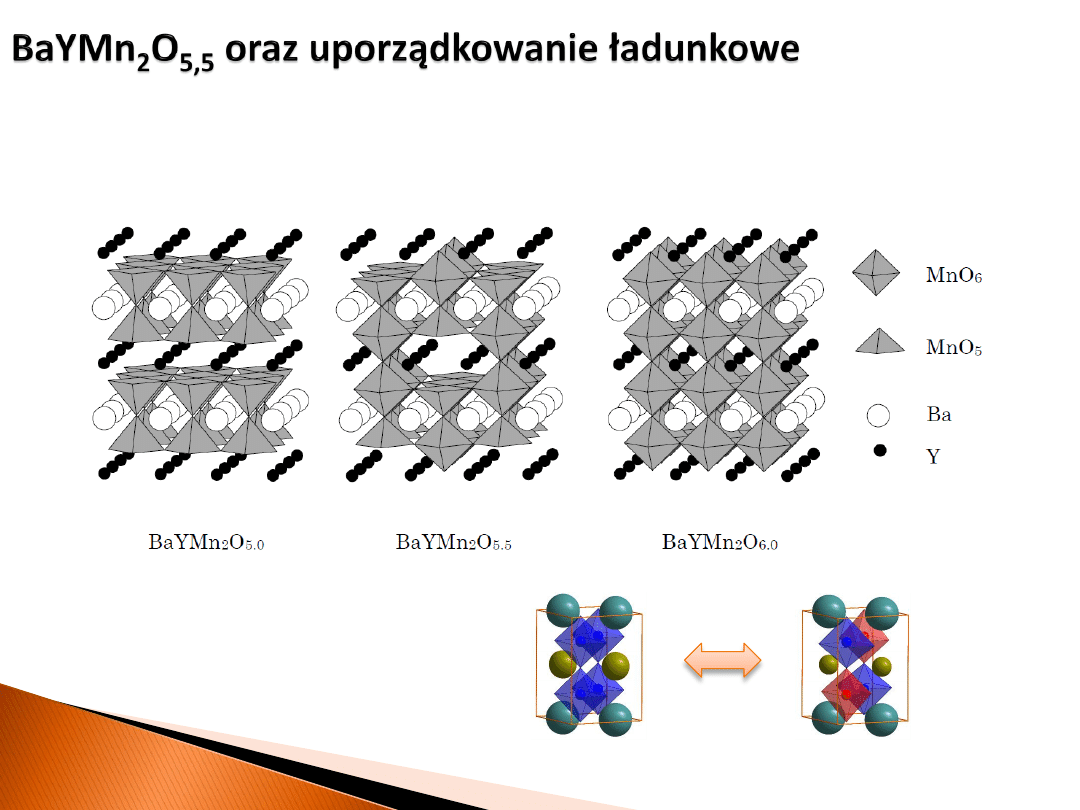
Ogólnie jednak, dla BaYMn
2
O
5+δ
wyróżniamy trzy dobrze zdefiniowane struktury
z określoną niestechiometrią tlenową δ. Dodatkowo, w niskich temperaturach fazy
O5 i O6 wykazują uporządkowanie ładunkowe manganu.
Mn
2+
/
Mn
3+
Mn
3+
Mn
3+
/
Mn
4+
T

• Dość niedawno (2010) odkryto bardzo dobre właściwości tlenku
BaYMn
2
O
5+δ
w aspekcie zdolności do magazynowania tlenu. Możliwa jest
efektywna redukcja materiału do zawartości tlenu O5 w 500 °C w 5 %obj. H
2
w Ar oraz utlenianie do fazy O6 w tej temperaturze w powietrzu.
Proces można powtarzać wielokrotnie (setki razy) bez utraty pojemności.
• Jaką pojemność (%wag. oraz w μmol-O/g) posiada tlenek BaYMn
2
O
5+δ
?
Całkowita, teoretyczna zmiana δ wynosi 1 (mola tlenu na mol związku).
Masa molowa BaYMn
2
O
5
to: = 416,12 g/mol. A więc 1·16/416,12 =
3,85 %wag.
W innych jednostkach: 10
6
·1/416,12 =
2400 μmol-O/g.
• Jaka będzie pojemność Li
2
O? H
2
O? Czy związki te mogą być uważane za
materiały typu OSM?
T. Motohashi, T. Ueda, Y. Masubuchi, M. Takiguchi, T. Setoyama,
K. Oshima, S. Kikkawa, Chem. Mater. 22 (2010) 3192

• Jak dużo tlenu (w porównaniu do np. butli gzowej) można zmagazynować
w BaYMn
2
O
5+δ
materiale?
• Typowa wielkość butli gazowej to 40 l, gdzie pod ciśnieniem 150 atm
magazynuje się ok. 6 m
3
tlenu. Butla z tlenem waży ok. 62 kg.
• Teoretyczna pojemność BaYMn
2
O
5+δ
to 3,85 % wag., zatem 60 kg BaYMn
2
O
5
może pomieścić ok. 2,3 kg tlenu, co stanowi równowartość 71,9 mola O
2
czyli ok. 1,6 m
3
tlenu przy ciśnieniu normalnym.
• Przy czym 62,3 kg BaYMn
2
O
6
to zaledwie ok. 15 dm
3
materiału.
Zmagazynowanie 1,6 m
3
tlenu (pod normalnym ciśnieniem) w zbiorniku
o równoważnej objętości wymagałoby ciśnienia ok. 100 atm!
• Perspektywy: układ Pr
2
O
2
S-Pr
2
O
2
SO
4
posiada teoretyczną pojemność
18,5 %wag.! (Choć nie jest do końca stabilny przy cyklowaniu.)
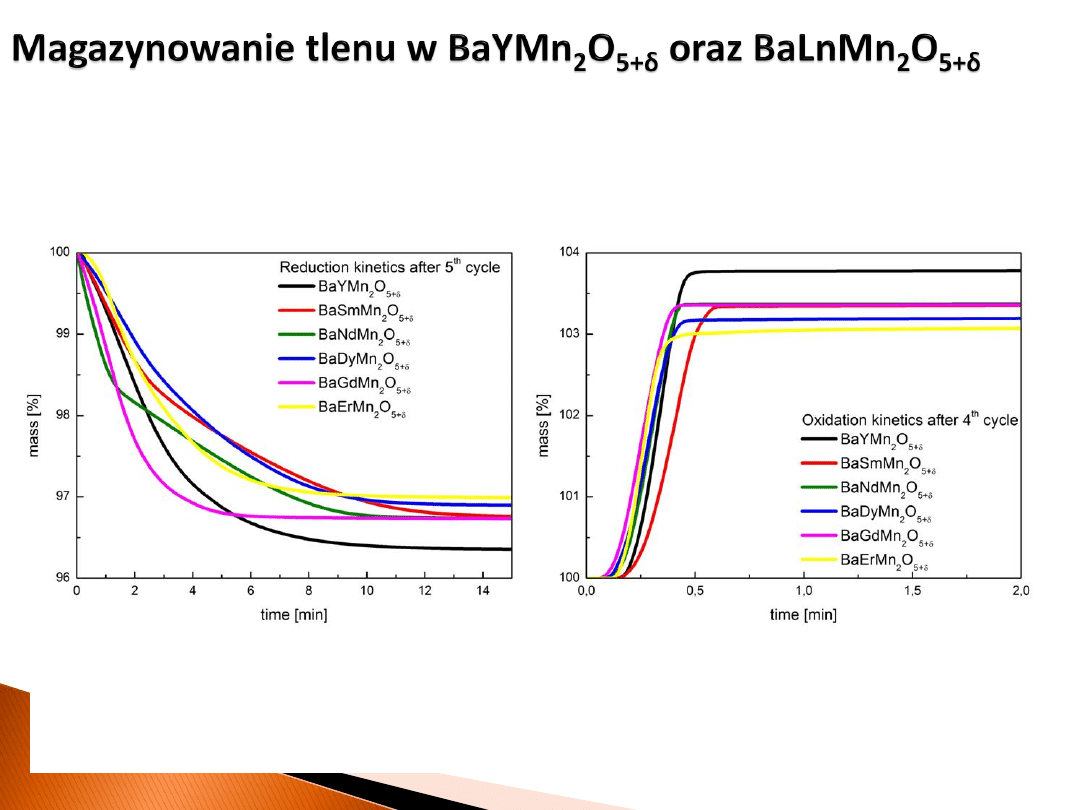
• Wybór kationu Ln ma zasadniczy wpływ na pojemność oraz na szybkość
procesu redukcji i utleniania.
• Znaczne szybsze utlenianie wynika z egzotermicznej natury tego procesu,
dla którego zmiana entalpii jest rzędu 200 kJ/mol.

Pojemność
teoretyczna [%wag.]
Pojemność
rzeczywista [%wag.]
%
BaYMn
2
O
5
3,85
3,79
98,6
BaPrMn
2
O
5
3,42
3,39
99,1
BaNdMn
2
O
5
3,39
3,37
99,4
BaSmMn
2
O
5
3,35
3,35
100,1
BaGdMn
2
O
5
3,30
3,36
101,8
BaDyMn
2
O
5
3,27
3,21
98,1
BaErMn
2
O
5
3,24
3,10
95,8
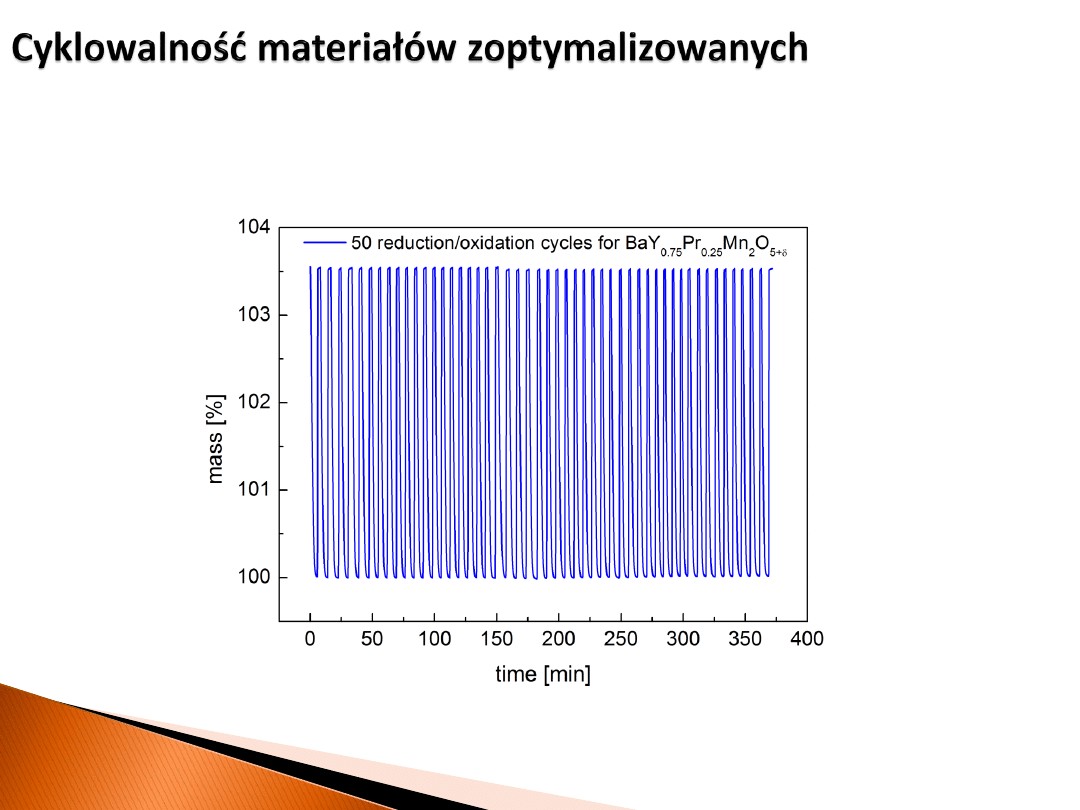
Temperatura 500 °C, cyklowanie pomiędzy powietrzem, a 5 %obj. H
2
w Ar
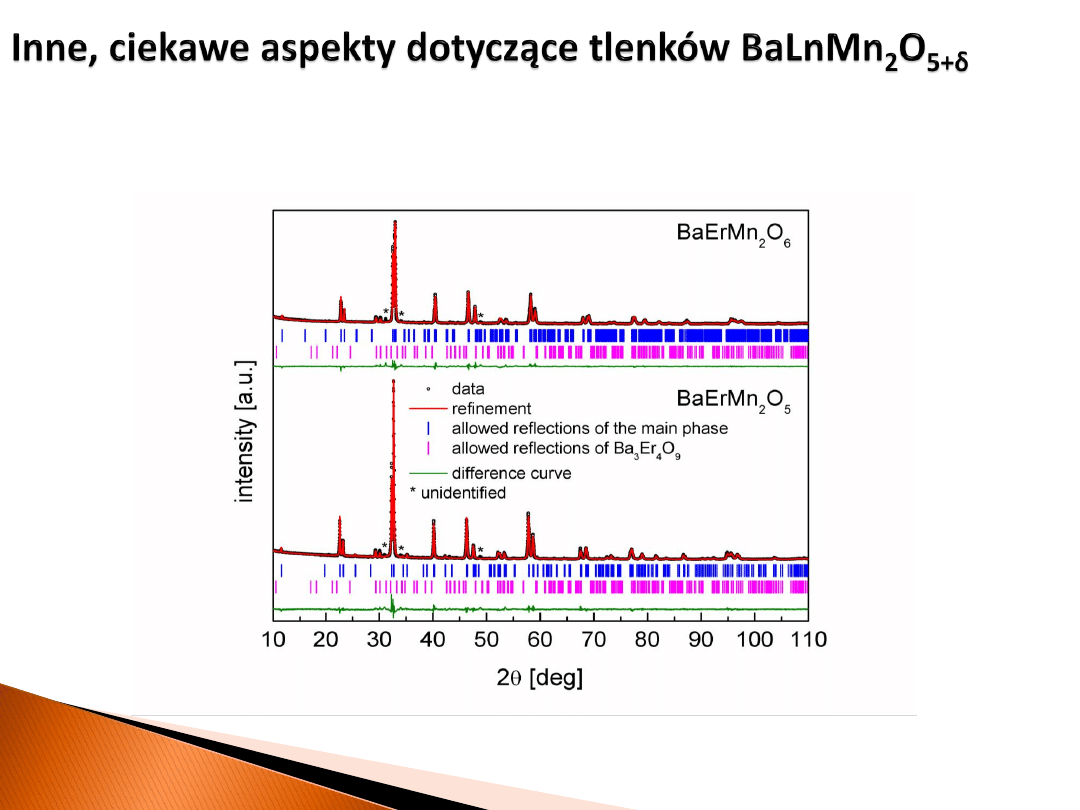
Nowy materiał z serii BaLnMn
2
O
5+δ
zawierający erb
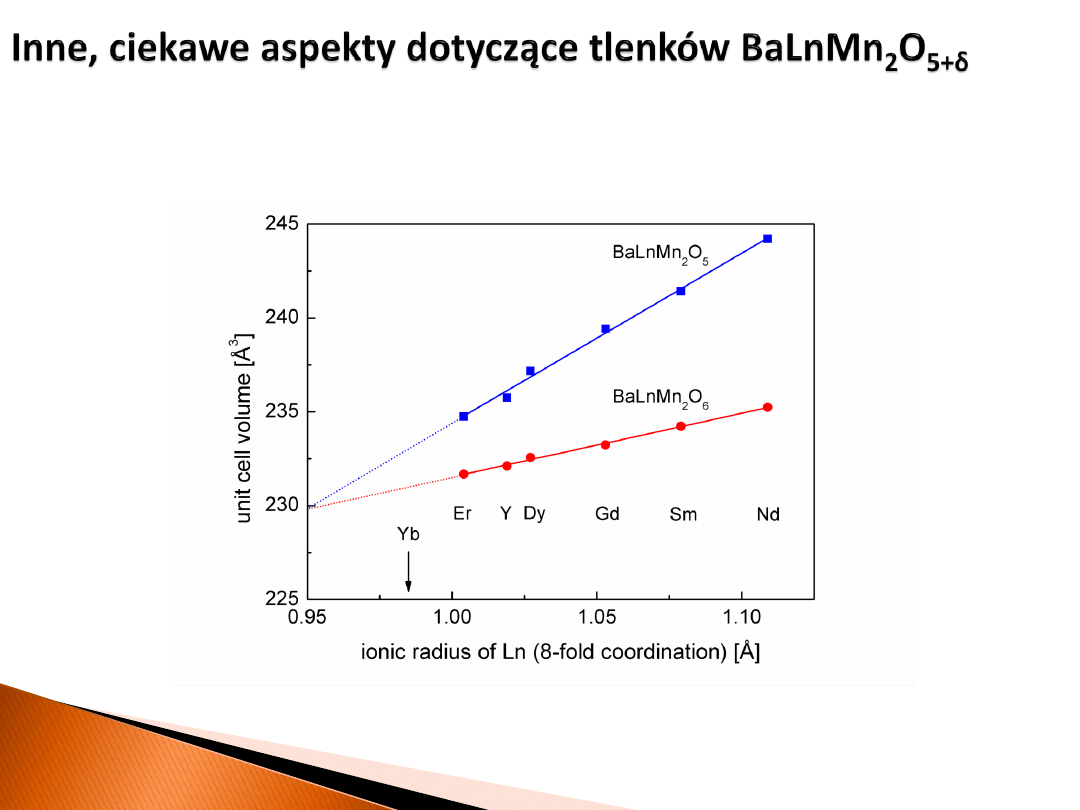
Interesujące zachowanie parametrów strukturalnych

Bogactwo właściwości elektrycznych i magnetycznych faz O6
PM – paramagnetic metal
FM – ferromagnetic metal
AFM(A) – A-type antiferromagnetic metal
COI(CE) – CE-type charge- and orbital-
ordered insulator
AFI(CE) – CE-type antiferromagnetic
insulator

•
BaLnMn
2
O
5+δ
(BaLnMn
2
O
5
-BaLnMn
2
O
6
) stanowią nową grupę potencjalnych
materiałów OSM, których parametry pracy są lepsze, niż obecnie
stosowanych związków na bazie tlenku ceru i cyrkonu.
•
Parametry ich pracy można regulować poprzez modyfikację składu
chemicznego oraz mikrostruktury (rozwinięcia powierzchni ziaren).
•
Dalej poszukiwane są nowe materiały, o lepszych właściwościach
użytkowych. Przykładowo, niektóre perowskity z grupy La
1-x
Sr
x
Co
1-y
Fe
y
O
3-δ
wykazują pojemność praktyczną przekraczającą 4 %wag. Wynika to
z możliwości zmian δ > 0,5 mola na mol związku.
•
Wiele nowych materiałów czeka na odkrycie i przebadanie pod kątem
zdolności do magazynowania tlenu .
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna wykład 11
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
chemia fizyczna I wykład(1)
chf wykład 6, Studia, Chemia, fizyczna, wykłady
Chemia fizyczna wykład 10
Chemia fizyczna wykład 4
chf wykład 3, Studia, Chemia, fizyczna, wykłady
2015 pyt tren do wykł VII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, ch
chf wykład 8, Studia, Chemia, fizyczna, wykłady
Chemia fizyczna wykład 9
Chemia budowlana Wykład 12
Chemia fizyczna wykład 1
tech.chem. PGd chemia fizyczna wyklady, Technologia chemiczna, Chemia fizyczna, Wykłady, wykłady na
Chemia fizyczna wyklad, Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
Chemia fizyczna (wyklad 3), Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
Chemia fizyczna (wyklad 4), Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
chf wykład 1, Studia, Chemia, fizyczna, wykłady
chemia fizyczna wykład4
Chemia fizyczna wykład 7 i 8
więcej podobnych podstron