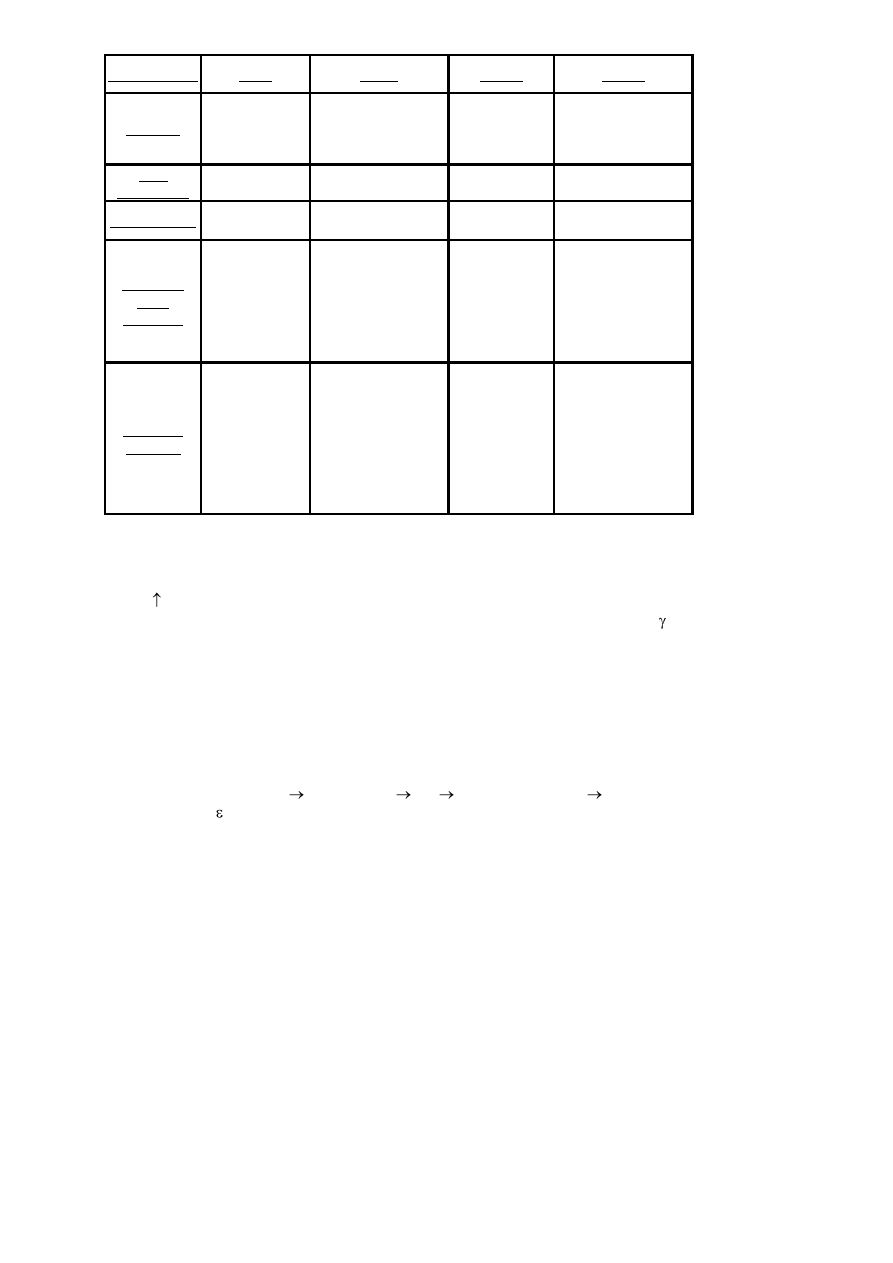
nadwrażliwość
Typ I
Typ II
Typ III
Typ IV
Synonim
Anafilaksja
Cytotoksyczność
(zależna od
przeciwciał),
liza
Kompleksy
immunologiczne
komórkowy
Czas
wystąpienia
Sekundy-minuty
Godziny-dni
Godziny-dni
2-3 dni
Specyficzność
IgE
IgG, IgM
IgG, IgG1
T limfocyty
Mediatory
stanu
zapalnego
Wazoaktywne
produkty
k.tucznych,
bazofili:
histamina, poch.
kw.
arachidonowego
komplement
Cz.ynniki
wazoaktywne,
chemotaktyczne,
cytolityczne
Cytokiny
Przykłady
kliniczne
Anafilaksja
Katar sienny,
Astma
oskrzelowa
Pokrzywka,
Atopowe
zap.skóry
Ch.hemolityczna
noworodów,
Ch.potransfuzyjna
ZespółGoodpasteure‘a
(nephritis)
Myastenia gravis
Ttrombocytopaenia
nephritis,
vasculitis
Choroba
posurowicza
Płuco Farmera
Ch.ziarniniakowe:
TBC, trąd,
sarkoidoza
Nadwrażl.kontaktowa,
Przewl. odrzucanie
przeszczepu
Typ I II III IV
u atopików, przeciwciała przeciw kompleksy immunologiczne uczulone limfocyty
IgE * własnej komórce - odkładają się w tkankach, uwalniają cytokiny
komórka tuczna, (cytotoksyczność) aktywacja dopełniacza, (IFN ), aktywacja
bazofil, *obcej z opłaszczonym napływ granulocytów, makrofagów
degranulacja: antygenem (lek) uszkodzenie tkanki (enzymy test późny
histamina * krwince – liza lisozomalne) po 2-3 dniach
test wczesny (niedokrwistości)
po 15 min reakcje po przetoczeniu
krwi
Choroby autoimmunizacyjne – II i III typ nadwrażliwości
Nieszkodliwe antygeny – pyłki roślin, roztocza kurzu domowego, naskórek zwierząt, pokarmy...
Wychwytywane są przez APC prezentacja Th Th2 pobudzają B (Il-4,10) IgE.
IgE wiążą się z Fc R1 na komórce. Przy powtórnym kontakcie z alergenem – degranulacja!!!
Klinicznie: katar sienny, astma oskrzelowa, atopowe zapalenie skóry, wstrząs anafilaktyczny
Aktywacja komórki tucznej może zajść na drodze nieimmunologicznej (bez IgE) – reakcje
pseudoalergiczne
Typ II : komórki gospodarza opłaszczone przeciwciałem mogą ulec fagocytozie.
Gdy komórka docelowa jest duża uwalniają się enzymy uszkadzające sąsiednie komórki –zespół Goodpasteur,a
pęcherzyca, miastenia...
Pęcherzyca zwykła:
- powstają pęcherze w wyniku utraty łączności pomiędzy komórkami kolczystymi (akantoliza)
- przeciwciała przeciwko strukturom desmosomalnym i antygenom powierzchniowym keratynocytów
– prowadzi to do tworzenia szczelin akantolitycznych
Komórka tarczycy jest pobudzona gdy TSH łączy się z receptorem
w podobny sposób łączy się przeciwciało przeciw receptorowi i pobudza komórki
tarczycy do nadprodukcji hormonu tarczycy choroba Graves-Basedowa-tyreotoksykoza
Prawidłowo witamina jest wchłaniana w kompleksie z czynnikiem wewnętrznym IF wytwarzanym przez
komórki okładzinowe błony śluzowej żołądka
autoprzeciwciała dla IF hamują jego funkcję jako nośnika witaminy B 12
Kompleksy immunologiczne: małe – liza, duże – fagocytoza, średnie – najłatwiej precypitują i odkładają się
w ścianie naczyń, błonie podstawnej kłębków nerkowych
Kompleks immunologiczny aktywuje dopełniacz: zwiększona przepuszczalność, chemotaksja,agregacja płytek,

napływ granulocytów: nie mogąc wchłonąć kompleksów – uszkadzają naczynia
Klinicznie: choroba posurowicza, zap.kłęków nerkowych, pęcherzyków płucnych, reakcja Arthusa
Dopełniacz jest istotny w przetwarzaniu kompleksów immunologicznych
Korzystne funkcje aktywacji C: -zabijanie drobnoustrojów -eliminacja kompleksów -wzmocnienie odpowiedzi imm.
Niekorzystne – aktywacja na dużą skalę: -w posocznicy Gram(-) – LPS dodatkowo aktywuje dopełniacz
C3a C5a – anafilatoksyny – wstrząs, w martwicy tkanek (zawał)
-w odpowiedzi immunologicznej przeciw tkankom gospodarza: autoprzeciwciała w różnych chorobach
Po podaniu surowicy obcogatunkowej, np. antytoksyny przeciw tężcowej końskiej powstają przeciwciała na
białko końskie, które wiążą się z krążącym jeszcze antygenem, tworzą się kompleksy, odkładają w nerkach,
ścianach naczyń.... W miarę wzrostu miana przeciwciał tworzą się duże kompleksy – fagocytowane
Reakcje nadwrażliwości typu IV – aktywacja Th1 , uwolnienie IFN , Il-3, aktywacja makrofagów
..
Powstaje po śródskórnym podaniu tuberkuliny u osoby mającej kontakt z prątkami gruźlicy:
aktywacja pamięciowych Th1, ekspresja cząstek adhezyjnych, nagromadzenie się w skórze monocytów i
limfocytów
Po 48-72 godzinach
Produkty bakteryjne stymulują makrofagi do wydzielania Il-12: aktywacja Th, wydzielanie cytokin, aktywacja
makrofagów do zabijania wewnątrzkomórkowych pasożytów: prątki, pasożyty, grzyby
Pod wpływem utrzymywania się bodźca antygenowego i ciągłego uwalniania cytokin makrofagi różnicują się do
komórek olbrzymich - naciek zapalny w gruźlicy
Nadwrażliwość kontaktowa – reakcja wypryskowa w miejscu ponownego kontaktu z alergenem: chrom, nikiel,
leki, proszki, gumy, talk.....z reguły – hapteny
Hapten tworzy kompleks z białkiem (nośnik) – antygen pełnowartościowy: rozpoznanie przez APC, migrują via
naczynia limfatyczne do węzła chłonnego, gdzie jako splatające się komórki prezentują antygen Th CD4
Faza uczulenia – trwa 10-14 dni
Po ponownym kontakcie – hapten aktywuje komórki pamięci Th CD4 – uwalniają cytokiny, ekspresja
cząsteczek adhezyjnych ICAM-1 – napływ makrofagów, limfocytów CD4, uwolnienie cytokin prozapalnych Il-
1, Il-6 – zaczerwienienie - -odczyn powstaje po 48 godzinach
Autoimmunizacja – występowanie odpowiedzi immunologicznej na własne antygeny – patogeneza wieloczynnikowa,
genetycznie uwarunkowana.
Poziom autoprzeciwciał wzrasta z wiekiem – starzenie się.
Choroby narządowo-swoiste, narzadowo-nieswoiste.
Autoreaktywne T i B występują u osób zdrowych, w chorobie następuje ich selekcja poprzez autoantygen
i indukcja odpowiedzi immunologicznej.
Krzyżowo reagujące antygeny bakteryjne (mimikra antygenowa) i zaburzenia w wytwarzaniu sieci cytokin
mogą prowadzić do autoimmunizacji
Dana osoba może mieć więcej niż jedną chorobę
Można wykryć kilka typów przeciwciał – ma to wartość diagnostyczną i niekiedy prognostyczną
Autoprzeciwciała wykrywamy najczęściej metodą IF, Elisa, westernblot
Choroby z autoimmunizacją
• cechą wspólną jest występowanie w krążeniu autoprzeciwciał skierowanych przeciwko antygenom własnym
gospodarza
• autoprzeciwciała skierowane przeciwko antygenom powszechnie występującym w organizmie gospodarza -
nieswoiste
np. antygeny jądrowe- DNA, białka histonowe
• autoprzeciwciała skierowane przeciwko antygenom swoistym tylko dla określonej tkanki
np. antygen tarczycy- tyreoglobulina
Metody serologiczne służące do oceny reakcji antygen- przeciwciało
•
precypitacja
•
aglutynacja
•
odczyn wiązania dopełniacza
•
immunofluorescencja pośrednia
•
metody radioimmunologiczne
•
metody immunoenzymatyczne
•
immunoblotting
Schemat diagnostyczny: 1. immunofluorescencja pośrednia
•
ludzkie komórki nabłonkowe HEp- 2010

•
metoda ilościowa i jakościowa
•
miano wyjściowe - 1:100
1:320 - słabo dodatni
1:1000 - dodatni
1: 3200 - wysoko dodatni
2. Potwierdzenie WESTERNBLOT
•
służy do jakościowego oznaczenia in vitro przeciwciał klasy IgG przeciwko antygenom jądrowym i
cytoplazmatycznym
•
próbki surowicy przeznaczone do badania rozcieńczone w stosunku 1:50
•
interpretacja wyników - oceniamy pozycję oraz intensywność zabarwienia pasma
•
test Westernblot służy jako test potwierdzający wyniki uzyskane z testu IIF z komórkami HEp- 2010
Regulacja odpowiedzi immunologicznej-w kontroli bierze udział wiele różnych mechanizmów
• Antygen * polisacharydy otoczki indukują tylko IgM, białka odpowiedź humoralną i komórkową * duże
dawki indukują swoistą tolerancję T, T-niezależne tolerancję B * podanie podskórne – odpowiedź
immunologiczna, doustne – może być tolerancja
•
APC – ekspresja MHC kl.I/II + ekspresja cząstek kostymulacyjnych – brak sygnału
• Przeciwciała – IgM – może zwiększyć, IgG – hamuje (szczepionki p/odrze nie podaje się przed 1 rokiem–
matczyne IgG, anty-RhD u matki RH- zapobiega uczuleniu przez płodowe RhD+) kompleksy mogą
hamować lub pobudzać
• Limfocyty – Th1 – faworyzacja komórkowej, Th2- humoralnej,
wzajemna regulacja Th1 i Th2, CD8 – supresja
•
Regulacja idiotypowa – mogą wzmagać lub hamować produkcję przeciwciał
Główny kompleks zgodności tkankowej MHC (major histocompatibility complex) – zespół ściśle sprzężonych genów
kodujących zestawy wysoce polimorficznych cząsteczek antygenowych na powierzchni komórek, zwanych MHC kl.I i MHC kl.II
– u człowieka HLA (human leucocyte antigen)
HLA – kl.I – na wszystkich komórkach jednojądrzastych i płytkach krwi:
HLA – kl.II (D)– na limfocytach, makrofagach, kom. dendrytycznych, aktywowanych T...
biorą udział w stymulacji limfocytów T, mimo licznych genów podobna struktura,
HLA – kl. III – kodują białka dopełniacza, TNF
mimo różnych genów strukturalnie nie wykazują heterogenności, nie biorą udziału w odrzucaniu przeszczepu
Geny HLA I i II wykazują wysoki polimorfizm - istnieje wiele alleli jednego loci
polimorfizm dotyczy gł. rowka wiążącego peptyd
Kompleks MHC (HLA) usytuowany jest na krótkim ramieniu chromosomu 6, dziedziczy się wg praw Mendla
Jeden zestaw haplotypów dziecko otrzymuje od matki, drugi od ojca Można być homozygotą lub heterozygotą
Wszystkie oddziedziczone geny MHC znajdują się na powierzchni komórki
-gł. loci kl. I: A, B, C, także E, F, G (na cytotrofoblaście łożyska-chronią przed NK matki?)
-gł. loci kl. II: DR, DQ, DP (obejmują 6 genów łańcuchów α (A) i 10 β (B): np. DRA,B(1-9) – niektóre geny to pseudogeny, np.
B2
Pewne antygeny częściej występują w określonych populacjach: A1 i B8 40x u rasy białej
Antygeny HLA I i II:
*uczestniczą w prezentacji antygenu *związek z chorobami autoimmunizacyjnymi B 27 – zesztywniające zap.stawów
*dochodzenie ojcostwa – można wykluczyć
Identyfikacja HLA: *test limfocytotoksyczny –kl.I i II *mieszana hodowla limfocytów – kl. II
*metody genetyczne PCR – Kl.I i II (PCR-SSO, PCR-SSP)
Transplantacje kliniczne
organ stan chorobowy
nerka końcowe stadium niewydolności
serce skrajna niewydolność
płuca, płuca+serce nadciśnienie płucne, mukowiscidoza
wątroba marskość, rak, atrezja dr.żółc.
rogówka dystrofia, zapalenie rogówki
trzustka, wys. Langerh. cukrzyca
szpik kostny niedobór immun. białaczka
jelito cienkie rak
skóra oparzenie
Przeszczepy autologiczne i syngeniczne: czas przeżycia nieograniczony. Allogeniczne i ksenogeniczne: odrzucenie w różnym
stopniu
Dobór dawcy i biorcy: -zgodność w układzie ABO -zgodność w układzie HLA -próba krzyżowa (cross-match):

przeciwciała w surowicy biorcy+limfocyty dawcy
Przeżycie narządu zwiększa: *dobra zgodność HLA*świeży narząd*zgodność płci*immunosupresja
Immunosupresja
•
klasyczna: cyklosporyna(hamowanie produkcji cytokin: Il-2, IFN; ekspresji receptora Il-2), sterydy (p/zapalnie), azatiopryna
(proliferacja gł.Tc)
•
nowe leki:
* mykofenolan mofetylu (Cell-Cept) – hamuje proliferację T i B
* takrolimus (Prograf)-podobnie jak CsA
* sirolimus (rapamycyna)
* przeciwciała dla receptora Il-2 (CD25) (Zenapax)
* przeciwciała anty-CD3
•
stosowane są różne układy
Reakcje odrzucania:*nadostre *ostre przyspieszone*ostre*przewlekłe **GvH gratf versus host –przeszczep przeciw biorcy
*nadostre – kilka godzin, niezgodność ABO, przeciwciała przeciwko-HLA, śródbłonkom: kompleksy immunologiczne, aktywacja
dopełniacza: zakrzepy w naczyniach, chemotaksja granulocytów, enzymy lizozomalne, liza komórek, uszkodzenie, martwica
śródbłonków zapobiega ujemny cross-match
*ostre przyspieszone – 24godz., obecność przeciwciał dla antygenów dawcy nie wykrywanych w teście cross-match, reaktywacja
uczulonych CD4, CD8, ADCC zmiany martwicze w naczyniach – ostre odrzucanie naczyniowe
*ostre – 10-30 dni, pierwotna aktywacja CD4, CD8, B, NK, ADCC,cytokiny, nacieki makrofagów, limfocytów - odrzucanie
śródmiąższowe, komórkowe duże dawki glikokortykosterydów, pc antylimfocytarne, antytymocytarne..
*przewlekłe – lata, obecnie najczęstsza postać, wiele czynników (?): nadciśnienie, uczulone limfocyty,przeciwciała, odpowiedź na
słabe antygeny,zakażenie CMV..., złogi Ig, C, nacieki komórkowe, uszkodzenie śródbłonka, ischemia, włóknienie
**GvH gratf versus host –przeszczep przeciw biorcy, kompetentny odpornościowo dawca atakuje upośledzonego odpornościowo
biorcę
50% przeszczepów szpiku, rzadziej skóry, wątroby (serce i nerka nie zawierają limfocytów T – nie ma odpowiedzi)
krew pępowinowa jako źródło komorek progenitorowych – są banki
Przeżycie przeszczepu zależy:
• Czynniki nieimmunologiczne:
* stan biorcy - stan dawcy w momencie pobierania narządu (dobra perfuzja, zgodność płci, wieku..)
• Stopień zgodności dawca—biorca: układ ABO, HLA, cross-match, * idealny dobór – teoretycznie 1/mln, pewne antygeny
występują częściej, lepszy dobór – mniej odrzutów ostrych, mniejsze ryzyko zmian przewlekłych
* obliczanie zgodności: DR –7 punktów, B – 4, A - 1
* antygeny protekcyjne (B: 5,7,18,27,35, DR: 2,3,4) – szybszy rozwój odpowiedzi immunologicznej i odrzucenie
* słabe antygeny HLA i spoza układu HLA, przeciwciała blokujące
• Optymalny schemat immunosupresji – wady: wzrost zakażeń, nowotwory, toksyczność, cena, niezadowalająca skuteczność
• Zapobieganie, rozpoznawanie, leczenie zakażeń – bakteryjne, wirusowe, grzybicze
Transplantacja – problemy,plany
• aspekty prawne:
- 1984 -rozpoznanie zgonu w oparciu o kryteria śmierci mózgowej (pobieranie narządów od zmarłych przy bijącym sercu)
- 1995 – ustawa o pobieraniu i przeszczepianiu komórek, tkanek, narządów (od zmarłych i żywych genetycznie spokrewnionych)
- 1993 – Polstransplant – koordynacja pobierania i przszczepiania
- Centralna Lista Biorców (3000 – nerki) + listy regionalne
- centralna lista Sprzeciwów - 0.05% populacji
• bariery etyczno-obyczajowe- rozpoznanie śmierci, zgoda domniemana, prawo rodziny, komercjalizacja..
• stosunek środowiska medycznego i społeczeństwa – edukacja
• program pobierania narządów w szpitalach terenowych (zgon)
• program pobrań wielonarządowych
• aspekty ekonomiczne – opłacalność całej procedury, etapów, immunosupresji... w porównaniu z efektem leczenia – częstość
powikłań, przeżycie, jakość życia
•
wzrasta zapotrzebowanie na przeszczepy narządów unaczynionych w Europie – 70/mln populacji
•
brak dostatecznej liczby zmarłych dawców – powinno być 30/mln, w Polsce w ok.. 8/mln
•
więcej żywych dawców (nerka, wątroba) – Europa 6/mln, Polska 0,2 Norwegia 17
•
oczekiwanie na przeszczep wydłuża się, wzrasta śmiertelność (serce, noworodki, dzieci)
•
częściej przeszczepy narządów suboptymalnych (starsze osoby, cukrzyca, zaburzenia hemodynamiczne, po zatrzymaniu krążenia)
Przeszczepy komórkowe – hepatocyty, wysepki Langerhansa, komórki nerwowe, chondrocyty, myocyty..
•
bankowanie komórek i tkanek (kostna, chrzęstna, naczynia, ścięgna, skóra, rogówka..)
•
genetyczne tworzenie narządów z ludzkich komórek macierzystych
•
stosowanie implantowanych komór wspomagania serca oraz implantowanego sztucznego serca
•
wytworzenie stanu „tolerancji” na alloprzeszczep (wprowadzenie komórek hemopoetycznych dawcy przed przeszczepem i
wytworzenie stanu chimeryzmu) – cel: obniżenie dawki immunosupresji
Wyszukiwarka
Podobne podstrony:
EŚT 07 Użytkowanie środków transportu
IK Transport a środowisko
Urządzenia transportu pionowego
EKONOMIKA TRANSPORTU IX
Ubezpieczenia związane z transportem drogowym
TRANSPORT GAZU prezentacja
Seminarium 6 Immunologia transplantacyjna farmacja 2
modelowanie procesˇw transportowych
8 Transport ponadnormatywny
INF dec5
transplantologia
Cw 7 IMMUNOLOGIA TRANSPLANTACYJNA
Transport wodny
katastrofy w transporcie kolejowym
BEZPIECZE STWO SYSTEM W INF
więcej podobnych podstron