
Strefa hipergeniczna II – strona 1
Strefa hipergeniczna II
Hydrogeochemia
Tematyka ćwiczeń.
• główne grupy oznaczanych składników chemicznych i parametrów fizykochemicznych wód, sposoby poboru i utrwalania
próbek
• kryteria klasyfikacji i oceny jakości wód (powierzchniowych, podziemnych, pitnych, mineralnych)
• sposoby prezentacji i oceny jakości wyników analiz chemicznych wód (diagramy Pipera, Stiffa, Udlufta, bilans ładunku, błąd
analizy)
Woda jest jedną z najważniejszych substancji wykorzystywanych przez człowieka. Poza oczywistą podstawową funkcją –
wody pitnej, jest stosowana na wiele innych sposobów, np. w hodowli ryb, w basenach, w przemyśle etc. Każde z tych zastosowań
wymaga wody o odpowiedniej jakości, regulowanej stosownymi rozporządzeniami prawnymi. Jakość wody jest oczywiście przede
wszystkim związana z jej składem chemicznym, ale nie tylko – ważne są też inne czynniki, np. woda pitna lub wykorzystywana w
kąpieliskach nie może być zanieczyszczona biologicznie, czy zbyt mętna, stosowana w przemyśle musi mieć odpowiednią
temperaturę itd. Niespełnienie tych wymogów nie musi być związane z niekorzystnym wpływem działalności człowieka, często jest
wynikiem procesów naturalnych.
Na skład chemiczny wód powierzchniowych i podziemnych wpływ ma szereg różnorodnych czynników. Należą do nich:
rzeźba terenu, klimat, geologia rejonu, oraz działalność organizmów wodnych i człowieka. Ponieważ woda przepływając wśród skał,
może reagować z ich składnikami, wśród czynników czysto geologicznych najważniejszy jest właśnie rodzaj skał występujących w
danym rejonie. Np. wody na obszarach zdominowanych przez skały węglanowe zawierają duże ilości wapnia i magnezu, są więc
„twarde” (zwykle smaczniejsze, ale nie najlepiej nadające się do np. prania i powodujące wytrącanie się „kamienia”, czyli CaCO
3
w
wannach czy na grzałkach czajników elektrycznych), a ich pH jest zazwyczaj wysokie. Wody drenujące masywy kwaśnych skał
magmowych są słabiej zmineralizowane (bo kwaśne skały stosunkowo wolno wietrzeją), a wśród kationów jest względnie dużo sodu
i potasu (z wietrzejących skaleni). Wody na obszarach torfowiskowych są kwaśne i zawierają dużo substancji organicznych itd.
Tabela. 1. Ogólna charakterystyka wód podziemnych związanych z obszarami występowania różnych skał.
rodzaj skał mineralizacja
dominujące jony
pH
zawartość SiO
2
granity, ryolity
niska
Na
+
, HCO
3
-
6,3-7,9
średnia-wysoka
gabra, bazalty
średnia Ca
2+
, Mg
2+
, HCO
3
-
6,7-8,5 wysoka
piaskowce wysoka
Ca
2+
, Mg
2+
, Na
+
, HCO
3
-
5,6-9,2 niska-średnia
mułowce, iły wysoka
Na
+
, Ca
2+
, Mg
2+
. HCO
3
-
SO
4
2-
Cl
-
4,0-8,6 niska-średnia
wapienie, dolomity, margle
wysoka
Ca
2+
, Mg
2+
, HCO
3
-
7,0-8,2 niska
łupki metamorficzne, gnejsy niska-średnia
HCO
3
-
, Ca
2+
, Na
+
5,2-8,1 niska
Aby ocenić przydatność wody do określonego celu trzeba zbadać jej skład chemiczny oraz parametry fizykochemiczne i
pewne inne właściwości. Do najważniejszych parametrów fizykochemicznych wody należą temperatura, pH, Eh, przewodność
elektrolityczna, obecność zawiesin, barwa i zapach. Znaczenie pH i Eh zostało omówione w poprzednim konspekcie. Bardzo
użytecznym parametrem, pozwalającym szybko otrzymać użyteczne informacje o wodzie jest przewodność elektrolityczna
właściwa. Za przewodzenie prądu elektrycznego w roztworach wodnych odpowiada przepływ jonów. Jak pamiętamy, czysta
chemicznie woda prawie nie dysocjuje, zatem za zdolność do przewodzenia prądu będzie odpowiadała obecność jonów. Im większe
są stężenia kationów i anionów, tym więcej nośników ładunku, a więc tym mniejsza oporność elektryczna i, co za tym idzie, większe
przewodnictwo. Zatem pomiar przewodności od razu informuje nas o tym czy woda jest słabo czy silnie zmineralizowana. Jednostką
przewodnictwa jest odwrotność ohma – siemens (1 S = 1/
Ω). Jest to bardzo duża jednostka, w związku z tym posługujemy się
zwykle jej podwielokrotnościami – przewodność wody podaje się w mS/cm lub w
µS/cm. Nie ma niestety jednoznacznego
przełożenia przewodności na mineralizację, gdyż wpływa na to wiele różnych czynników. Często przyjmuje się, że przewodność

Strefa hipergeniczna II – strona 2
mierzona w
µS/cm jest mniej więcej równa sumie rozpuszczonych w wodzie kationów i anionów (w mg/dm
3
), co z kolei można w
wielu przypadkach sprowadzić do mineralizacji wody. Inna podawana zależność ma postać:
ΣA = ΣK (w meq/dm
3
) ~ przewodnictwo/100 (w
µS/cm)
Obecność w wodzie zawiesin związana jest z unoszonymi przez nią cząstkami mułu, iłu oraz różnych organicznych i
nieorganicznych substancji koloidalnych. Najdrobniejsze zawieszone w wodzie cząstki wpływają na jej mętność. Parametr ten
wyznacza się porównując badaną wodę z odpowiednio przygotowanymi roztworami zawierającymi zawiesinę koloidalnej
krzemionki i stąd jego wartość podaje się w mg SiO
2
/dm
3
.
Barwa naturalnej wody może być lekko żółtawa, co wiąże się z obecnością rozpuszczonych kwasów organicznych. Mierzy
jest kolorymetrycznie, poprzez porównanie próbki ze skalą wzorców otrzymanych przez rozpuszczenie związków platyny i kobaltu.
Dlatego wynik podawany jest w mg Pt/dm
3
. Z kolei zapach określa się organoleptycznie, oceniając jego charakter (np. roślinny,
gnilny, specyficzny) i moc (np. słabo wyczuwalny, bardzo wyraźny etc.) lub krotność. Krotność oznacza stopień rozcieńczenia
próbki, przy którym zapach przestaje być wyczuwalny. Niektóre rodzaje zapachów – np. gnilne, specyficzne – wykluczają
możliwość wykorzystania wody do celów pitnych.
Składniki mineralne rozpuszczone w wodzie tworzą jej mineralizację. W sposób przybliżony ogólną mineralizację wód
wyznacza się na podstawie masy suchej pozostałości, czyli masy substancji pozostałych po odparowaniu wody (TDS – total
dissolved solids). Na podstawie mineralizacji ogólnej wody podziemne dzielimy na następujące grupy:
- wody
zwykłe (słodkie) – mineralizacja < 500 mg/dm
3
-
akratopegi (wody o podwyższonej mineralizacji) – mineralizacja 500-1000 mg/dm
3
-
wody mineralne (słone) – mineralizacja > 1000 mg/dm
3
.
Przy badaniu składu chemicznego wody ważne są dwie grupy składników. Główne kationy i aniony występują w
największych ilościach, decydując o mineralizacji wody oraz o jej typie hydrogeochemicznym. Z kolei składniki występujące w
podrzędnych lub nawet śladowych ilościach często warunkują możliwość wykorzystania wody do określonego celu – np. jako wody
pitnej. Głównymi kationami występującymi w wodach śródlądowych są Ca
2+
, Mg
2+
, Na
+
i K
+
, natomiast podstawowe aniony to
HCO
3
-
, SO
4
2-
i Cl
-
(zwykle, choć nie zawsze w takiej kolejności).
W podrzędnych ilościach pojawiają się w wodach związki azotu i fosforu. Mają one jednak bardzo duży (korzystny lub
niekorzystny) wpływ na jakość wody, gdyż są niezbędnymi biopierwiastkami wykorzystywanymi przez organizmy wodne, a zatem
wpływają na ich rozwój. Podstawowymi formami, w jakich te pierwiastki występują w wodach są następujące jony: NO
3
-
, NO
2
-
,
NH
4
+
i PO
4
3-
. Ich nadmiar związany np. ze spłukiwaniem do wód nadmiernych ilości nawozów, może prowadzić do eutrofizacji
zbiorników. W przypadku azotu, proporcje różnych jego form pozwalają niekiedy wnioskować o źródłach zanieczyszczenia wód.
Ogólnie przyjmuje się, że w wodach gruntowych zanieczyszczonych odpadami bytowymi bądź hodowlanymi obecność jonów
amonowych, przy braku azotanów i azotynów, wskazuje na zanieczyszczenie świeże, pochodzące z bliskiego ogniska.
Współwystępowanie wszystkich form mineralnych azotu wskazuje na trwałe zanieczyszczenie. Występowanie jedynie azotanów,
przy nieznacznej domieszce azotynów wskazuje na odległe w czasie lub przestrzeni zanieczyszczenie wód podziemnych.
Pozostałe nieorganiczne jony naturalnych wód to mikroskładniki – pojawiają się w stężeniach rzędu ułamków mg/dm
3
do
kilku mg/dm
3
. Należą do nich m.in. Sr
2+
, Ba
2+
, Fe
2+
, Mn
2+
, B
3+
, Al
3+
, Zn
2+
, Cu
2+
, Li
+
, F
-
, Br
-
, I
-
. W jeszcze mniejszych ilościach
występują szczególnie toksyczne pierwiastki, jak As
3+
, As
5+
, Cr
6+
, Cd
2+
, Hg
+
.
Pamiętamy, że w wyniku procesów hydrolizy krzemianów powstaje koloidalna krzemionka lub kwas krzemowy. Można
zatem spodziewać się obecności znacznych ilości Si w wodach – często rzędu kilkudziesięciu a nawet kilkuset mg SiO
2
/dm
3
.
Koncentracje i formy, w jakich krzem występuje zależy od wielu czynników, takich jak pH, temperatura czy stężenia innych jonów
(głównie fluorków).
Badając jakość wód powierzchniowych, czy podziemnych nie można zapomnieć o substancji organicznej, gdyż bardzo
często to właśnie ona jest głównym czynnikiem zanieczyszczającym. Pod tym pojęciem rozumiemy zarówno mikroorganizmy
obecne w wodach, jak również produkty ich metabolizmu oraz rozkładu, a także różnorakie substancje pochodzenia
antropogenicznego. Do tych ostatnich należą np. fenole, węglowodory aromatyczne (BTX – benzen, toluen, ksylen),
wielopierścieniowe węglowodory aromatyczne (WWA), pestycydy i inne. Ze względu na trudności analityczne oraz tak szeroki

Strefa hipergeniczna II – strona 3
wachlarz możliwych substancji, bardzo często szacuje się stopień zanieczyszczenia wód substancjami organicznymi w sposób
uproszczony, wprowadzając pewne umowne wskaźniki. Należą do nich ogólny węgiel organiczny, oraz chemiczne i biochemiczne
zapotrzebowanie na tlen.
Ogólny węgiel organiczny (OWO, albo TOC – total organic carbon) to stężenie węgla organicznego (czyli zawartego we
wszystkich związkach organicznych w wodzie). Podczas jego oznaczania, w celu wyeliminowania węgla nieorganicznego (TIC –
total inorganic carbon) próbkę wody zakwasza się, ponieważ powoduje się tym samym usunięcie węglanów, w głównej mierze
odpowiadających za węgiel nieorganiczny. Wartości OWO wahają się w bardzo szerokich granicach, dochodząc w szczególnych
przypadkach do kilkuset mg/dm
3
.
Chemiczne zapotrzebowanie na tlen (ChZT, albo COD – chemical oxygen demand) oznacza ilość mocnego utleniacza
(dwuchromianu potasu K
2
Cr
2
O
7
lub manganianu(VII) potasu KMnO
4
) niezbędną do rozkładu substancji organicznych występujących
w wodzie. Parametr ten wyznacza się miareczkując próbkę wody dwuchromianem lub nadmanganianem w obecności kwasu
siarkowego i katalizatora, a wynik podaje się w przeliczeniu na tlen cząsteczkowy, czyli w mg O
2
/dm
3
. Aby oszacować ilość
mikroorganizmów w wodzie określa się jeszcze jeden wskaźnik – biochemiczne zapotrzebowanie na tlen (BZT albo BOD –
biochemical oxygen demand). Idea określania tego wskaźnika opiera się na spostrzeżeniu, że organizmy wodne zużywają
rozpuszczony w wodzie tlen. Zatem jego ilość powinna z czasem maleć. Oznaczenie jest dwuetapowe. Mierzy się stężenie tlenu
rozpuszczonego w wodzie przed (tuż po pobraniu próbki).i po pięciodniowej (stąd zwykle BZT
5
) inkubacji w warunkach
laboratoryjnych w ciemności. W takich warunkach ubytek tlenu jest wynikiem zużywania go przez mikroorganizmy wodne. Np. jeśli
początkowe stężenie O
2
w wodzie wynosiło 8,3 mg/dm
3
, a po pięciu dniach spadło do 5,0 mg/dm
3
, to BZT
5
jest równe 3,3 mg/dm
3
.
Poza tlenem, woda zawiera rozpuszczone inne gazy, przy czym najważniejszym z nich jest CO
2
. Wody o znacznej
zawartości tego gazu (500-1000 mg/dm
3
) są nazywane wodami kwasowęglowymi, natomiast jeszcze silniej nasycone CO
2
(powyżej
1000 mg/dm
3
) noszą nazwę szczaw.
Bardzo istotne z punktu widzenia użytkowania wody, szczególnie do celów pitnych, są ponadto wskaźniki biologiczne, a
szczególnie stan bakteriologiczny. Biologiczna ocena jakości wody opiera się na fakcie, że skład i właściwości wody wpływają na
rodzaj i liczebność zamieszkujących ją organizmów. Zwykle wykorzystuje się do tego celu tzw. gatunki wskaźnikowe, które dzieli się
na trzy główne grupy:
-
saprokseniczne – występują tylko w wodach czystych, a unikają zanieczyszczonych
-
saprofilne – występują w wodach czystych, ale w zanieczyszczonych masowo
-
saprobiontyczne – występują tylko w wodach zanieczyszczonych
Zatem badając populacje biologiczne w wodach poprzez szacowanie liczebność i proporcji gatunkowych, można
wnioskować o stanie czystości wód.
Spośród wskaźników mikrobiologicznych, wskazujących na stan bakteriologiczny wody, najczęściej stosuje się ilość
pałeczek okrężnicy (Escherichia coli) w określonej objętości próbki. Można ją też podawać jako miano coli, czyli najmniejszą
objętość wody (w cm
3
), na jaką przypada jedna bakteria okrężnicy.
Sposoby poboru i utrwalania próbek wód
Przy pobieraniu próbek wód do analiz chemicznych i fizykochemicznych musimy zdawać sobie sprawę z faktu, że
właściwości wody ulegają bardzo szybkim zmianom. Zmiany te mogą być związane m.in. z takimi zjawiskami jak:
- zużywanie niektórych składników pokarmowych przez bakterie, glony itp., wydzielanie produktów metabolizmu, reakcje
fotosyntezy;
-
utlenianie organiki, Fe(II), siarczków;
- wytrącanie niektórych składników (CaCO
3
, Fe(OH)
3
, Mg
3
(PO
4
)
2
etc.);
- ulatnianie
się niektórych składników (O
2
, H
2
S, CN
-
, Hg, związków organicznych);
- adsorpcja
CO
2
z powietrza –zmiana pH, przewodnictwa, zawartości CO
2
etc.;
- adsorpcja
na
ściankach naczyń lub zawiesinach;

Strefa hipergeniczna II – strona 4
Z tego względu niektóre oznaczenia powinno wykonywać się od razu, w terenie. Dotyczy to m.in. temperatury, pH, Eh,
przewodności, rozpuszczonego tlenu. W innych przypadkach można wodę analizować po przetransportowaniu do laboratorium, ale
wymaga to odpowiedniego sposobu poboru, przechowywania a w wielu przypadkach również tzw. utrwalania próbek. Zapobieganie
zmianom składu i właściwości próbek obejmuje:
-
odpowiedni dobór i przygotowanie przyrządów i naczyń (np. nie można przechowywać w naczyniach szklanych próbek do
oznaczania śladowych zawartości Si, Al, Na, B, a w plastikowych próbek, w których oznaczane będą niektóre składniki
organiczne – np. WWA);
- sączenie w przypadku próbek przeznaczonych do badania składników rozpuszczonych;
- schładzanie/zamrażanie próbek (wstrzymuje to proces rozmnażania bakterii oraz sprzyja zatrzymaniu substancji lotnych w
próbce – pamiętamy, że rozpuszczalność gazów rośnie ze spadkiem temperatury)
- całkowite napełnianie naczyń – czyli bez powietrza (ogranicza to wstrząsy w trakcie transportu, zapobiega wymianie
składników z powietrzem, spowalnia reakcje redoksowe)
- dodawanie
odpowiednich
środków utrwalających
Rodzaj dodawanych środków utrwalających zależy od tego, jakie oznaczenia chcemy wykonać. Bardzo często może się
więc okazać, że do laboratorium przywozimy kilka różnych naczyń zawierających próbkę tej samej wody, ale utrwaloną w różny
sposób. Do najczęściej stosowanych „utrwalaczy” zaliczamy:
- stężone kwasy (gł. HNO
3
, H
2
SO
4
– oznaczanie metali, N-NH
4
, N
org
, ChZT, fenoli); HNO
3
utrzymuje metale w stanie
rozpuszczonym, H
2
SO
4
działa jako bakteriocyd i tworzy siarczany z lotnymi zasadami (aminy, amoniak);
-
chloroform (oznaczanie N-NO
3
, N-NO
2
, detergentów anionowych, cukrów, WWA, zawiesin);
-
NaOH (oznaczanie CN
-
, fenoli lotnych); tworzy sole sodowe lotnych kwasów;
- HgCl
2
(bakteriocyd – do próbek zawierających biodegradowalne związki organiczne oraz różne formy azotu i fosforu).
Należy pamiętać, że utrwalenia próbki dokonuje się PO pomiarach wstępnych (pH, przewodnictwo itd.)!!. Warto również
podkreślić, że utrwalenie próbki wody pozwala jedynie na niewielką zwłokę w wykonaniu analizy. Większość składników powinno
się oznaczyć przed upływem 24 lub 48 h. Stosunkowo najodporniejsze na zmiany są (oczywiście przy odpowiednim utrwaleniu i
przechowywaniu próbki) tzw. metale ciężkie – w niektórych przypadkach dopuszcza się nawet kilkumiesięczny okres
przechowywania próbek.
Sposoby przedstawiania wyników analiz chemicznych wód
Analizy chemiczne wód przedstawia się w różnych jednostkach. Najczęściej stosuje się mg/dm
3
(mg/L) i
µg/dm
3
(
µg/L),
rzadziej w mg/kg czy
µg/kg. Dla wód mineralnych, zawierających duże ilości rozpuszczonych substancji, często ich ilość wyraża się
w g/dm
3
. W przypadku substancji o szczególnie niskich stężeniach (np. WWA) wykorzystuje się bardzo małe jednostki, jak ng/dm
3
.
Większość składników rozpuszczonych w wodach występuje w formie jonowej. Sumaryczny dodatni ładunek kationów
musi być równoważony przez sumaryczny ładunek ujemny anionów. Z tego względu, do celów prezentowania składu wód oraz ich
klasyfikacji, zawartość (stężenie) każdego kationu i anionu przedstawia się w formie równoważnikowej, uwzględniającej jego masę
molową i wartościowość.
Przykład 1.
Wyniki analizy chemicznej wody zestawione w mg/dm
3
przedstaw w mmol/dm
3
i mval/dm
3
.
Na
+
– 13,70
HCO
3
-
– 79,9
K
+
– 1,18
Cl
-
– 31,2
Ca
2+
– 42,50
SO
4
2-
– 39,0
Mg
2+
– 3,21
NO
3
-
– 1,3
1 mol Na ma masę 22,99 g, czyli 1 mmol Na to 22,99 mg. Zatem jeśli stężenie sodu w wodzie wynosi 13,70 mg/dm
3
, to z proporcji
otrzymujemy:
Strefa hipergeniczna II – strona 5
1 mmol Na – 22,99 mg
x mmol Na – 13,70 mg
x = 0,60 mmol
Stężenie sodu wynosi 0,60 mmol/dm
3
, a ponieważ sód jest kationem jednowartościowym więc 1 mmol = 1 mval, czyli 0,60
mmol/dm
3
= 0,60 mval/dm
3
.
W przypadku wapnia masa molowa wynosi 40,08 g, więc stężenie molowe Ca w tej wodzie to
1,06 mg/dm
3
. Ale wapń jest kationem dwuwartościowym, więc równoważnik jest dwukrotnie większy, czyli 1,06 mg/dm
3
× 2 = 2,12
mval/dm
3
.
W ten sposób przeliczamy wszystkie kationy i aniony otrzymując:
jon mg/dm
3
masa
molowa mmol/dm
3
ładunek mval/dm
3
Na
+
13,70 22,99 0,60
1
0,60
K
+
1,18 39,1 0,03
1
0,03
Ca
2+
42,50 40,08 1,06
2
2,12
Mg
2+
3,21 24,31 0,13
2
0,26
HCO
3
-
79,9 61,02 1,31
1
1,31
SO
4
2-
39,0 96,06 0,41
2
0,82
Cl
-
31,2 35,45 0,88
1
0,88
NO
3
-
1,3 62,00 0,02
1
0,02
Przedstawiając wyniki analizy chemicznej można od razu w prosty sposób sprawdzić jej poprawność. Ponieważ sumaryczny
dodatni ładunek kationów musi być równoważony przez sumaryczny ładunek ujemny anionów, więc suma (mili)równoważników
kationów powinna być (mniej więcej) równa sumie (mili)równoważników anionów. Wyraźna różnica pomiędzy tymi wartościami
może wynikać albo z błędu analitycznego (błędne oznaczenie któregoś ze składników), albo z faktu, że badana woda ma nietypowy
skład chemiczny – zawiera jakieś składniki, których rutynowo się nie oznacza. Ten drugi przypadek ma często miejsce przy
badaniach wód silnie zanieczyszczonych i ścieków.
Przykład 2
Na podstawie bilansu jonowego sprawdź poprawność analizy chemicznej wody z Przykładu 1.
Sumujemy stężenia równoważnikowe kationów i anionów:
ΣK = 0,60 + 0,03 + 0,26 + 2,12 = 3,01
ΣA = 0,88 + 1,31 + 0,82 + 0,02 = 3,03
Widać, że
ΣK ~ ΣA, ale lepiej to wyrazić obliczając błąd analizy (nie powinien on przekraczać 5%):
%
100
⋅
Κ
+
Σ
Κ
−
Σ
=
A
K
A
K
x
w naszym przypadku wynosi on:
x = (3,01+3,03)/3,01-3,03
⋅ 100% = - 0,3%
Czyli błąd analizy jest bardzo mały.
Strefa hipergeniczna II – strona 6
Graficzne sposoby prezentacji składu chemicznego wód
W celu szybkiego zorientowania się w typie hydrogeochemicznym danej grupy wód, ich składy chemiczne często
przedstawia się graficznie – na diagramach kołowych, słupkowych, trójkątnych i innych. Do najpopularniejszych i najczęściej
stosowanych sposobów takiej prezentacji należą diagramy Pipera, Stiffa i Udlufta.
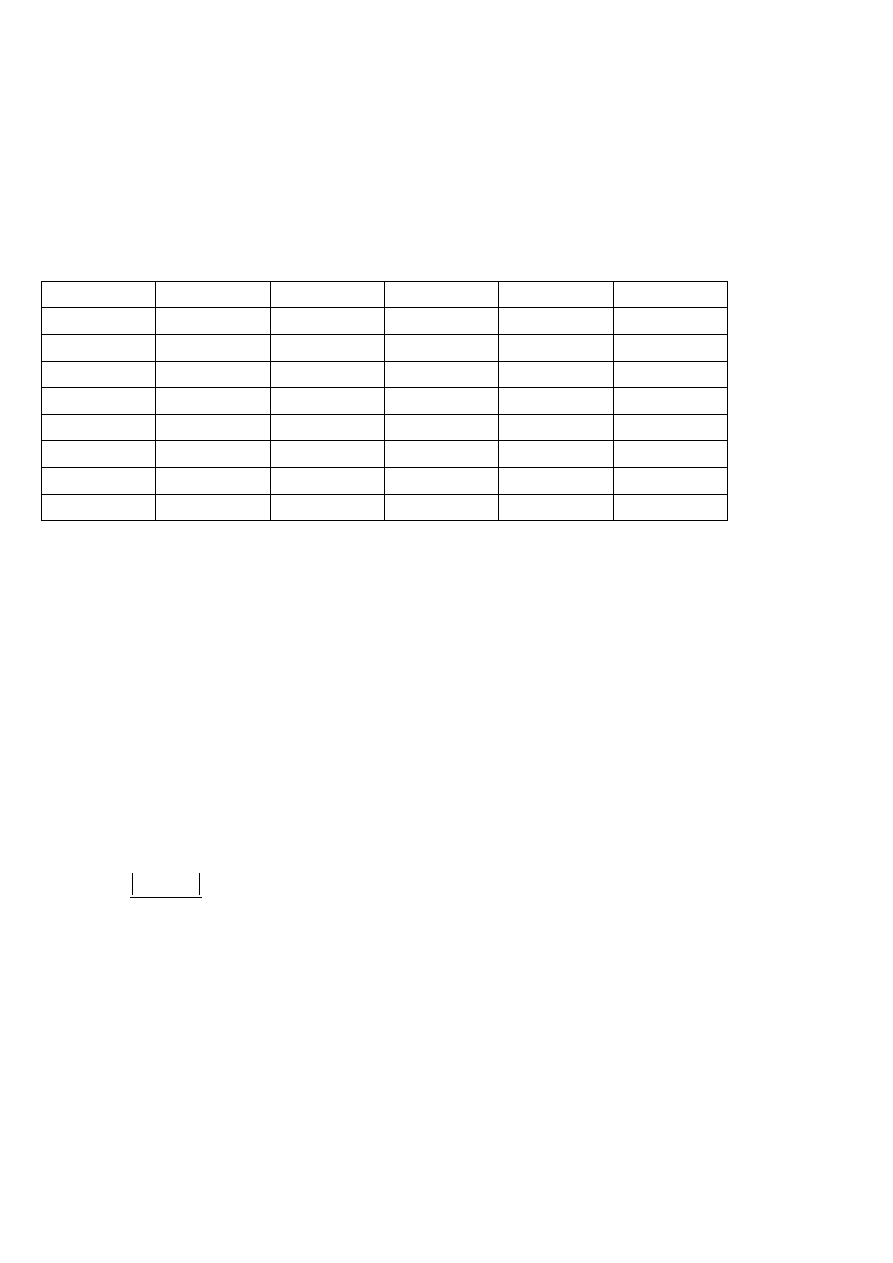
Diagram Pipera składa się z trzech części – dwóch trójkątów i rombu (rysunek 1). Lewy trójkąt podaje względne proporcje
głównych kationów (Ca
2+
, Mg
2+
oraz sumy Na
+
i K
+
), prawy dotyczy anionów (HCO
3
-
+ CO
3
2-
, SO
4
2-
i Cl
-
). Punkty odpowiadające
proporcjom kationów i anionów rzutuje się następnie prostymi na diagram rombowy, uzyskując w ich przecięciu punkt projekcyjny
reprezentujący badaną wodę. Dla pełniejszego zobrazowania jej składu zwykle różnicuje się średnicę kółka w zależności od
mineralizacji wody.
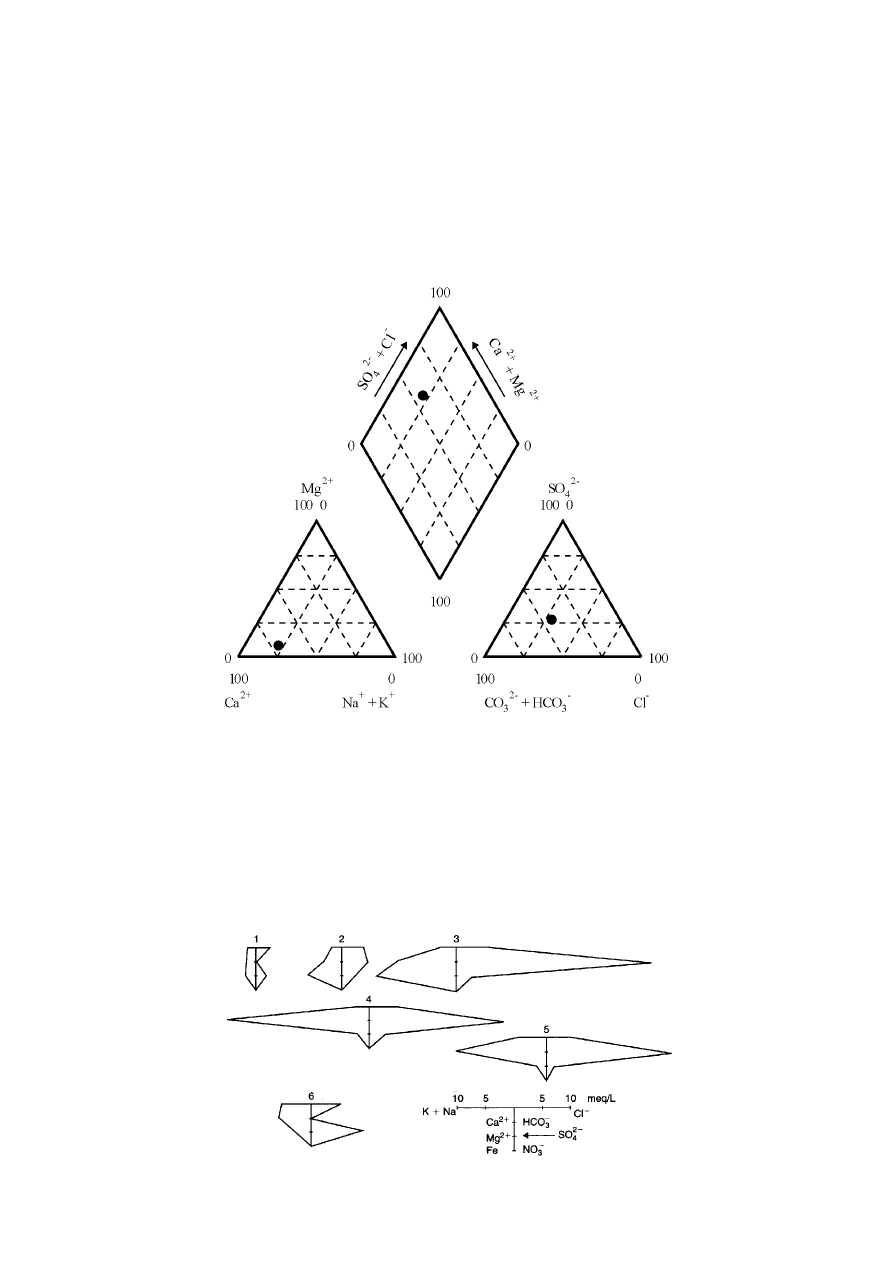
Diagram Stiffa często stosuje się do przedstawiania składu chemicznego wód podziemnych w profilach pionowych. Na tym
wykresie pionową oś pomocniczą (przy profilu wyskalowaną jako głębokość otworu) przecinają cztery (najczęściej) równoległe osie,
dające w efekcie osiem półosi, na których nanosi się stężenia kationów (po lewej stronie osi pionowej) i anionów (po jej prawej
stronie). Zawsze tym samym osiom przyporządkowuje się określone jony, a stężenia, podobnie jak w diagramie Pipera nanosi się w
mval/dm
3
, przypisując pionowej osi pomocniczej stężenie zerowe. W oryginalnej wersji diagramu lewym półosiom przypisuje się
(idąc od góry): Na
+
+ K
+
, Ca
2+
, Mg
2+
i Fe
2+
, zaś prawym półosiom, odpowiednio, Cl
-
, HCO
3
-
, SO
4
2-
i CO
3
-
. Naniesione na półosiach
punkty stężeń łączy się ze sobą otrzymując nieregularny wielobok.
Strefa hipergeniczna II – strona 7
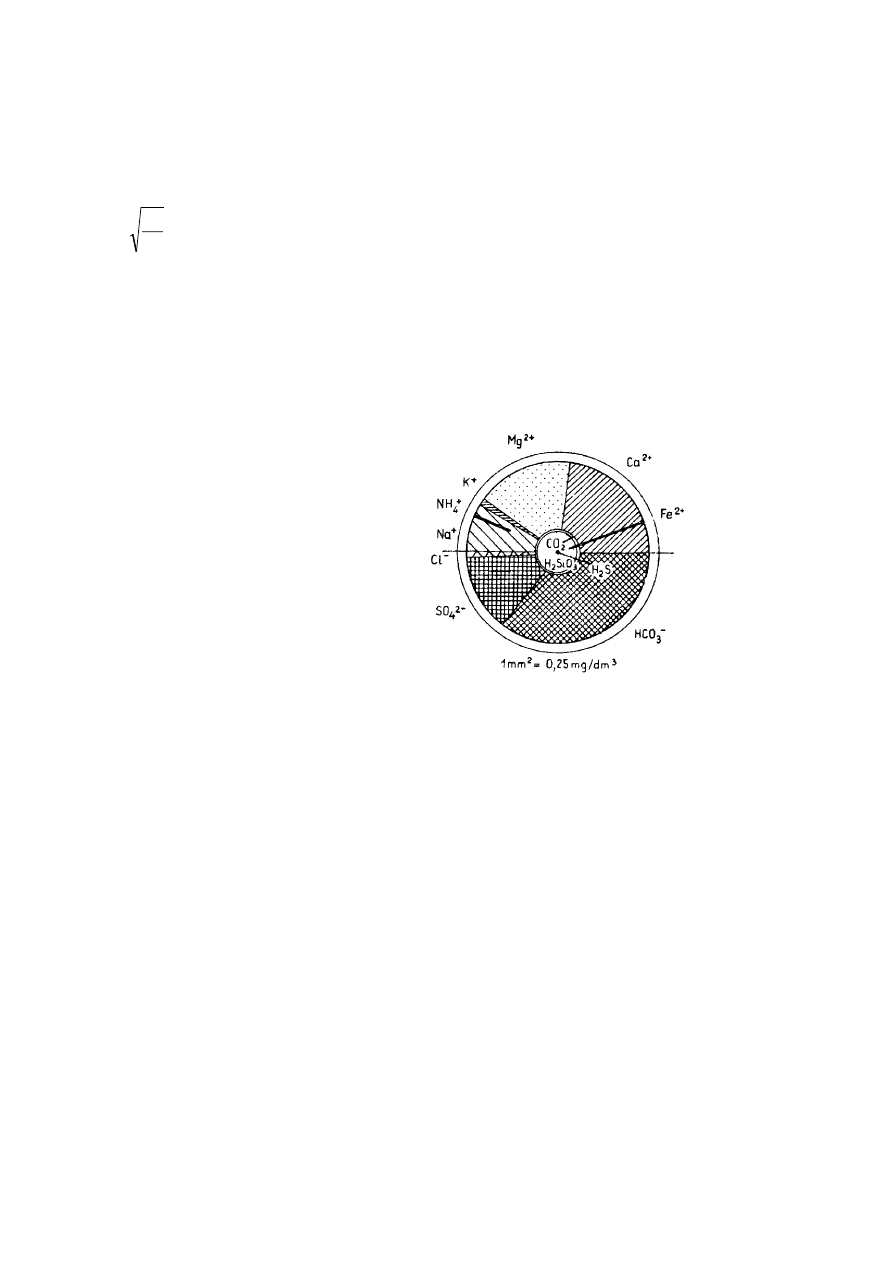
Diagram Udlufta jest wykresem kołowym, uwzględniającym nie tylko główne kationy i aniony, ale również substancje
gazowe rozpuszczone w wodzie. Przy jego sporządzeniu przyjmujemy, że pole koła wyraża sumaryczną ilość składników stałych i
gazowych zawartych w wodzie (M). W zależności od przyjętej skali wykresu, 1 mm
2
powierzchni koła może odpowiadać np. 1, 4, 9,
16 itd. mg/dm
3
sumy tych składników. Przyjmując jednostkową zależność 1 mg/dm
3
= 1 mm
2
otrzymujemy:
M =
Πr
2
stąd:
Π
=
M
r
gdzie:
M – łączna masa składników stałych i gazowych rozpuszczonych w wodzie
r – promień koła [mm] obrazującego skład chemiczny wody
Składniki stałe i nie zdysocjowane zaznacza się w postaci współśrodkowych kół, których promień oblicza się zgodnie z
powyższym wzorem, przyjmując zamiast sumarycznego M masę składników gazowych i niezdysocjowanych. W górnej połowie koła
lub pierścienia przedstawia się wycinkami procenty miligramorównoważników podstawowych kationów, w dolnej połowie
podstawowych anionów.
Twardość
Często wspominaną cechą wody jest jej twardość. Jest to pojęcie umowne określające zużycie mydła w wodzie bez
wytwarzania piany przy skłócaniu. Wiąże się to z obecnością w wodzie rozpuszczonych jonów dwuwartościowych, głównie Ca
2+
,
Mg
2+
, Sr
2+
i Ba
2+
(a także Fe
2+
, Zn
2+
) i trójwartościowych (Al
3+
, Fe
3+
). Jeśli metale te występują w postaci wodorowęglanów,
węglanów lub wodorotlenków, wówczas mówimy o tzw. twardości węglanowej (przemijającej). Zwykle zanika ona w trakcie
gotowania wody:
Ca(HCO
3
)
2
⇒ H
2
O + CO
2
+ CaCO
3
⇓
Gdy w wodzie obecne są siarczany i chlorki tych metali, wówczas mamy do czynienia z twardością niewęglanową
(trwałą). Taka twardość nie zanika w trakcie gotowania, lecz wymaga stosowania specjalnych metod chemicznych. Suma twardości
węglanowej i niewęglanowej daje twardość ogólną.
Jednostkami twardości wody są mval/dm
3
, lub stopnie twardości wg skali niemieckiej (
°N, 1 stopień odpowiada 10 mg CaO
w dm
3
), francuskiej (
°Fr, 1 stopień odpowiada 1 g CaCO
3
w 100 dm
3
), angielskiej (
°Ang, 1 stopień odpowiada 1 g CaCO
3
w 70 dm
3
)
oraz amerykańskiej (
°USA) i WHO (1° = 500 mg CaCO
3
/dm
3
).
W Polsce stosowane są najczęściej mval/dm
3
, stopnie skali niemieckiej lub jednostki WHO. W zależności od twardości
ogólnej wyróżniamy (1 mval/dm
3
= 2,8
°N):
- wodę bardzo miękką;
< 0,5
°N
- wodę miękką;
5-10
°N
- wodę średnio twardą; 10-20
°N
- wodę twardą; 20-30
°N
- wodę bardzo twardą > 30
°N
Strefa hipergeniczna II – strona 8
Twardość wody ma wpływ na możliwości jest wykorzystania. Z wód twardych łatwo wytrąca się kamień, więc nie powinno
się ich wykorzystywać np. w sieciach centralnego ogrzewania. Nie powinno się jej również stosować w gospodarstwie domowym,
gdyż zwiększa użycie mydła i środków piorących, a niekiedy nawet zmienia smak mięsa, kawy i herbaty. Może też powodować
podrażnienia skóry. Z kolei wody zbyt miękkie sprzyjają np. zachodzeniu procesów korozyjnych w rurach wodociągowych oraz
zwiększają ryzyko chorób serca.
Twardość wody można wyznaczyć eksperymentalnie lub obliczyć z wyników analizy chemicznej wody. W takim przypadku
mnoży się stężenia kationów powodujących twardość (podane w mg/dm
3
) przez odpowiednie współczynniki przeliczeniowe (Tabela
..) otrzymując wyniki w mval/dm
3
.
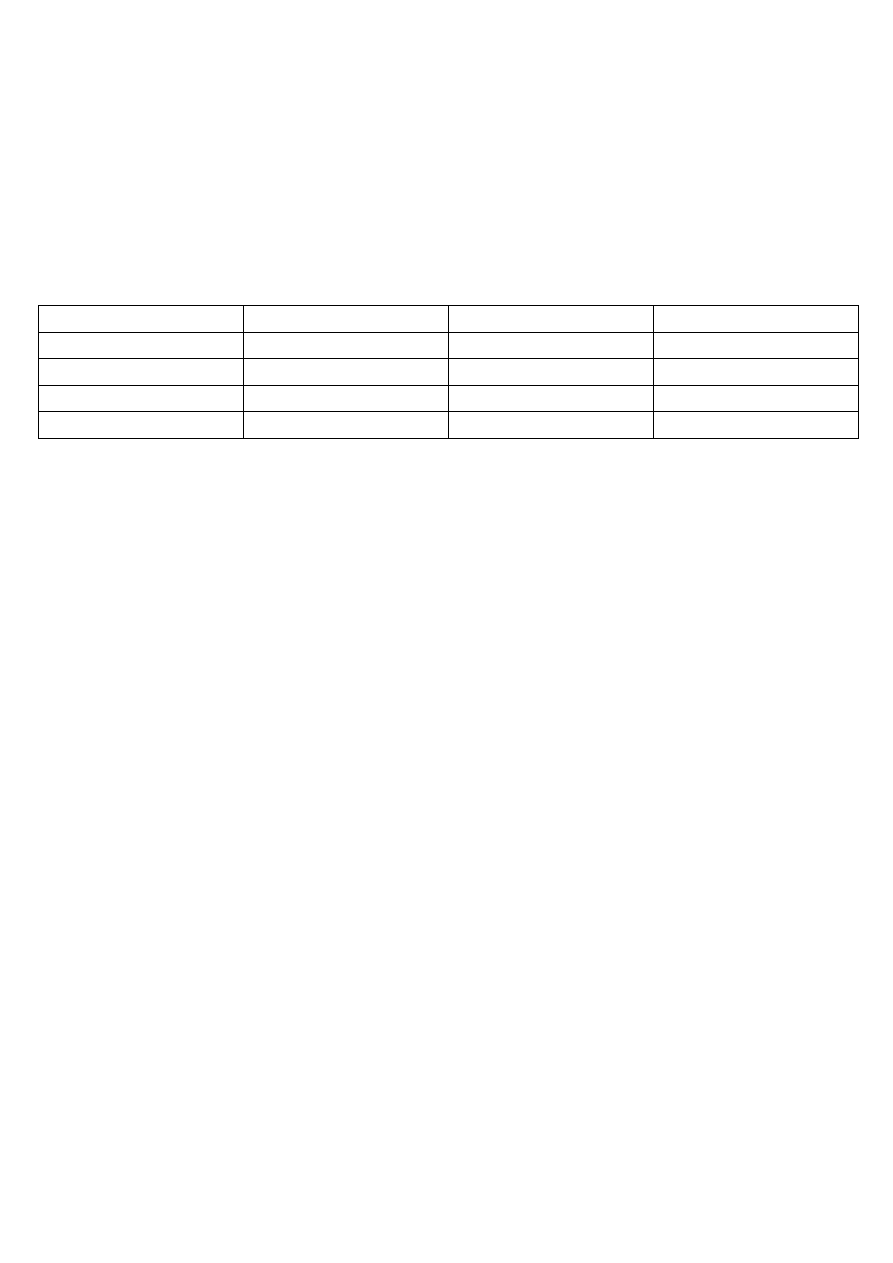
Tabela 1. Współczynniki przeliczeniowe do obliczania twardości wody
Kation Mnożnik Kation Mnożnik
Ca
2+
0,04990
Fe
3+
0,05372
Mg
2+
0,08224
Al
3+
0,1112
Sr
2+
0,02282
Zn
2+
0,03059
Fe
2+
0,03581
Mn
2+
0,07281
Wyszukiwarka
Podobne podstrony:
Konspekt strefa hipergeniczna 1
07 geochemia powierzchni Ziemi strefa hipergeniczna
07 strefa hipergeniczna
5 Strefa hipergeniczna id 3980 Nieznany
Ekonomia konspekt1
BLS 2010 stom [konspekt]ppt
Ekonomia konspekt6
22 Choroby wlosow KONSPEKTid 29485 ppt
konspekt dzieci , ćwicz
farmakoterapia w als, konspekt+RKO2011 farmakoterapia+[CPR+EU]
Ekonomia konspekt9
RKO farmakoterapia [konspekt
śpiączki hiperglikemiczne
Ekonomia konspekt14
więcej podobnych podstron