
Anestezjologia
Anestezjologia
1. Przygotowanie pacjenta do znieczulenia
1.1. Przygotowanie przedoperacyjne
1.2. Przygotowanie psychologiczne
1.3. Przygotowanie farmakologiczne
1.4. Objętość i pH soku żołądkowego
1.5. Przykładowy przebieg premedykacji dorosłej osoby hospitalizowanej
2. Nieopioidowe dożylne środki anestetyczne
2.1. Charakterystyka chemiczna i preparaty
2.2. Mechanizmy działania
2.3. Właściwości farmakokinetyczne
3. Znieczulenie wziewne
3.1. Farmakokinetyka wziewnych środków anestetycznych
3.1.1. Wychwytywanie, dystrybucja i eliminacja
3.1.2. Zapotrzebowanie na środki anestetyczne — MAC
3.2. Wpływ lotnych środków anestetycznych na narządy i układy
4. Środki zwiotczające
5. Postępowanie w chorobach towarzyszących
1

Anestezjologia
1. Przygotowanie pacjenta do znieczulenia
1.1. Przygotowanie przedoperacyjne
Na przygotowanie przedoperacyjne składa się część psychologiczna i farmakologiczna.
W warunkach idealnych wszyscy chorzy powinni być wolni od lęku, w stanie uspokojenia,
lecz nie śpiący i w pełni współpracujący z lekarzem.
1.2. Przygotowanie psychologiczne
Wizyta przedoperacyjna i rozmowa z pacjentem i jego bliskimi ma znaczenie
niefarmakologicznego antidotum przeciwko lękowi.
Problemy do omówienia podczas wizyty przedoperacyjnej
1. Należy przejrzeć razem z pacjentem jego historię choroby (choroby współistniejące,
przewlekle zażywane leki, dawniej przebyte znieczulenia).
2. Należy opisać możliwe metody znieczulenia i związane z nimi zagrożenia.
3. Należy sprawdzić zaplanowaną premedykację i czas jej podania.
4. Należy spisać okoliczności przybycia pacjenta na salę przedoperacyjną.
5. Należy określić przypuszczalny czas trwania operacji i moment powrotu na swoją salę.
6. Należy omówić możliwe sposoby łagodzenia bólu pooperacyjnego:
⎯ analgezja sterowana przez pacjenta,
⎯ opioidy podawane centralnie (Barash, 1996).
1.3. Przygotowanie farmakologiczne
Leki stosowane do farmakologicznego przygotowania przedoperacyjnego podaje się
w warunkach typowych doustnie lub domięśniowo, zanim jeszcze chory opuści swój
pokój, na 1–2 godziny przed przewidywanym wprowadzeniem do znieczulenia.
Cele premedykacji farmakologicznej:
⎯ złagodzenie lęku,
⎯ sedacja,
⎯ amnezja,
⎯ analgezja,
2

Anestezjologia
⎯ zmniejszenie wydzielania śliny w drogach oddechowych,
⎯ zablokowanie odruchowej odpowiedzi autonomicznego układu nerwowego,
⎯ zmniejszenie objętości i podwyższenie pH treści żołądka,
⎯ działanie przeciwwymiotne,
⎯ zmniejszenie zapotrzebowania na środki anestetyczne,
⎯ ułatwienie indukcji znieczulenia,
⎯ zapobieganie odczynom uczuleniowym.
Czynniki decydujące o wyborze i dawce leków służących do premedykacji
Do czynników determinujących wybór leków i ich dawkę należą:
⎯ wiek i masa ciała pacjenta,
⎯ stan ogólny według klasyfikacji ASA,
⎯ stopień lęku,
⎯ tolerancja na środki wpływające depresyjnie,
⎯ działanie premedykacji przed dawniej przebytymi operacjami,
⎯ uczulenie na leki,
⎯ zabieg doraźny czy planowy,
⎯ zabieg w trybie hospitalizacji lub ambulatoryjny.
Osiągnięcie założonych celów farmakologicznej premedykacji chorego umożliwia istnienie
kilku grup leków.
Nie ma optymalnego środka ani zestawu środków, który służyłby premedykacji
farmakologicznej. Na ich wybór może wpływać schemat stosowany w danym ośrodku,
a także osobiste doświadczenie anestezjologa.
W ł a ś c i w a p o r a p o d a n i a l e k u j e s t r ó w n i e w a ż n a j a k s a m j e g o w y b ó r .
W warunkach idealnych konkretne środki dobiera się stosownie do celów premedykacji,
które trzeba jednak przeciwstawić potencjalnym zjawiskom niepożądanym, jakie mogą
im towarzyszyć. Należy pamiętać, że stosowanie leków o działaniu depresyjnym jest
w premedykacji u wielu chorych niepożądane (np. osoby w wieku podeszłym),
a w przypadku innych istnieją przeciwwskazania do ich stosowania (pogorszenie stanu
przytomności, zmiany patologiczne w obrębie czaszki, ciężkie schorzenia płuc,
hipowolemia).
Najpóźniej jeden dzień przed terminem wykonania znieczulenia anestezjolog powinien
zbadać i ocenić pod względem klinicznym stan pacjenta, aby umożliwić ewentualnie
3
Anestezjologia
dalsze postępowanie diagnostyczne oraz terapeutyczne, mające na celu maksymalną
poprawę stanu zdrowia pacjenta przed operacją.
Wizyta przedoperacyjna ma na celu:
⎯ ocenę stanu fizycznego i psychicznego pacjenta,
⎯ ocenę ryzyka znieczulenia ogólnego,
⎯ wybór postępowania znieczulającego,
⎯ poinformowanie pacjenta i uzyskanie jego zgody na znieczulenie,
⎯ zmniejszenie lęku i niepokoju,
⎯ zlecenie premedykacyjne.
Wszystkie te działania mają na celu zmniejszenie ryzyka związanego ze znieczuleniem.
Ocenę oraz wstępne badania związane ze znieczuleniem przeprowadza się zwykle w dniu
poprzedzającym operację. Przedoperacyjna ocena przed znieczuleniem powinna nastąpić
w momencie, który umożliwi dalsze postępowanie lecznicze i czynności przygotowujące
pacjenta do operacji.
Przedoperacyjna ocena zawiera wywiad, badanie przedmiotowe oraz zlecenie badań
przedoperacyjnych. Regułą jest również ocena ryzyka znieczulenia. Uzyskuje się ją na
podstawie danych. Do dyspozycji są także różne kwalifikacje.
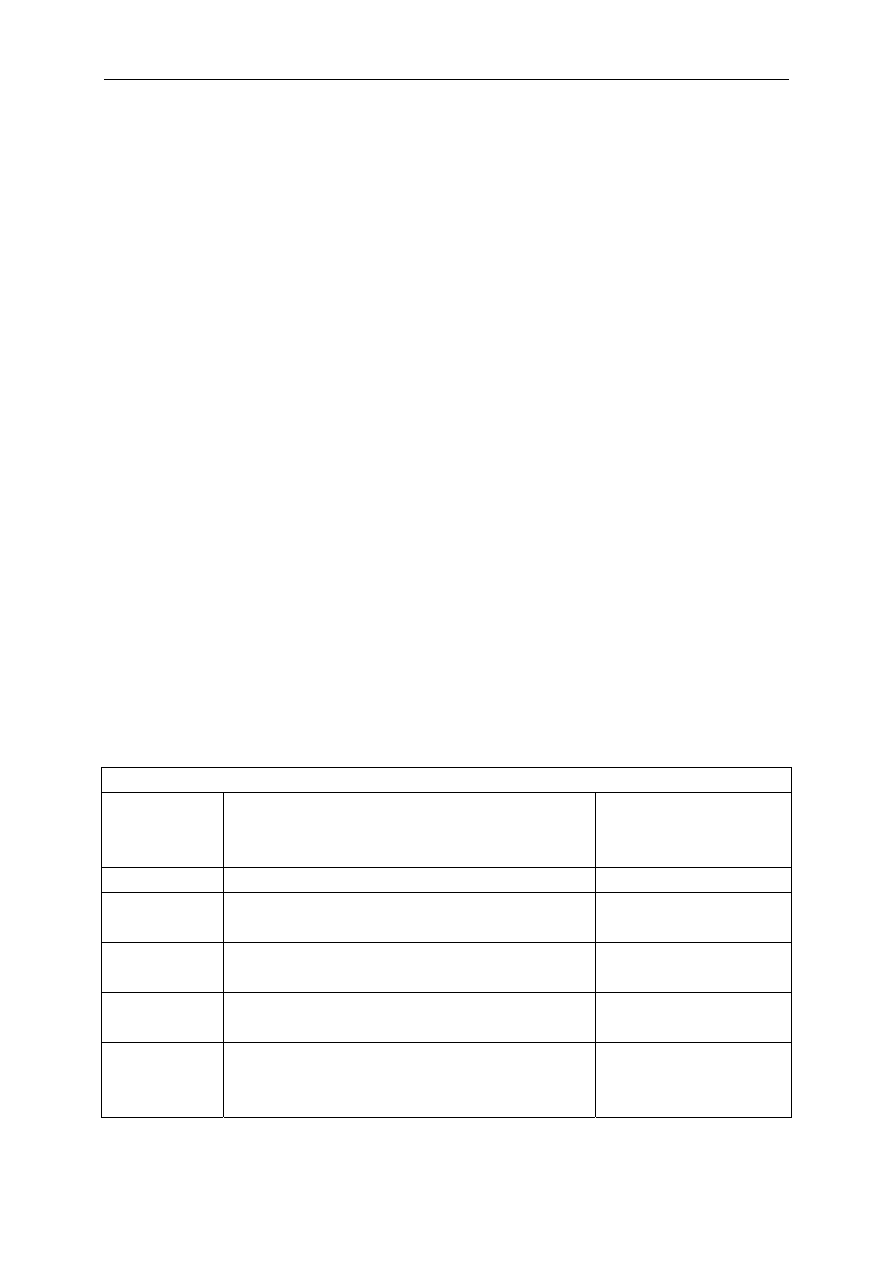
Tabela 1. Najczęściej stosowany schemat podany przez Amerykańskie Towarzystwo
Anestezjologów w ASA
Grupy znieczulenia ogólnego wg ASA
Grupy ryzyka
ASA
Umieralność
okołooperacyjna
do 7 dni po operacji
I
Normalny, zdrowy pacjent
0,06%
II
Pacjent z niezbyt nasiloną chorobą ogólną
przebiegającą bez ograniczenia wydolności
0,47%
III
Pacjent z ciężką chorobą ogólną, ograniczającą
znacznie wydolność
3,39%
IV
Pacjent z ciężką chorobą ogólną, stanowiącą stałe
zagrożenie dla życia pacjenta
23,48%
V Pacjent
umierający. Śmierć może nastąpić w ciągu
24 godzin, niezależnie od tego, czy operacja
zostanie wykonana, czy nie
50,77%
4
Anestezjologia
W operacjach nagłych można schemat rozszerzyć następująco:
VI Przypadki
nagłe w grupie I i II
VII Przypadki
nagłe w grupie III i V
Stosując skalę ASA, trzeba uwzględnić wpływ wielu czynników subiektywnych oraz
takich, które zwykle nie są brane pod uwagę.
Należą do nich:
⎯ rodzaj operacji — największe ryzyko niosą ze sobą operacje związane z otwarciem
dwóch jam ciała, operacje jamy brzusznej, klatki piersiowej i wewnątrzczaszkowej,
⎯ czas trwania operacji — im dłuższa operacja lub im dłuższe znieczulenie, tym większa
jest częstość powikłań,
⎯ doświadczenie operatora,
⎯ wiek pacjenta.
Na podstawie przypisania pacjenta do określonej grupy nie można ściśle przewidzieć
powikłań anestezjologicznych zagrażających życiu. Można jednak oszacować ogólne
ryzyko związane z przewidywanym postępowaniem anestezjologicznym i chirurgicznym.
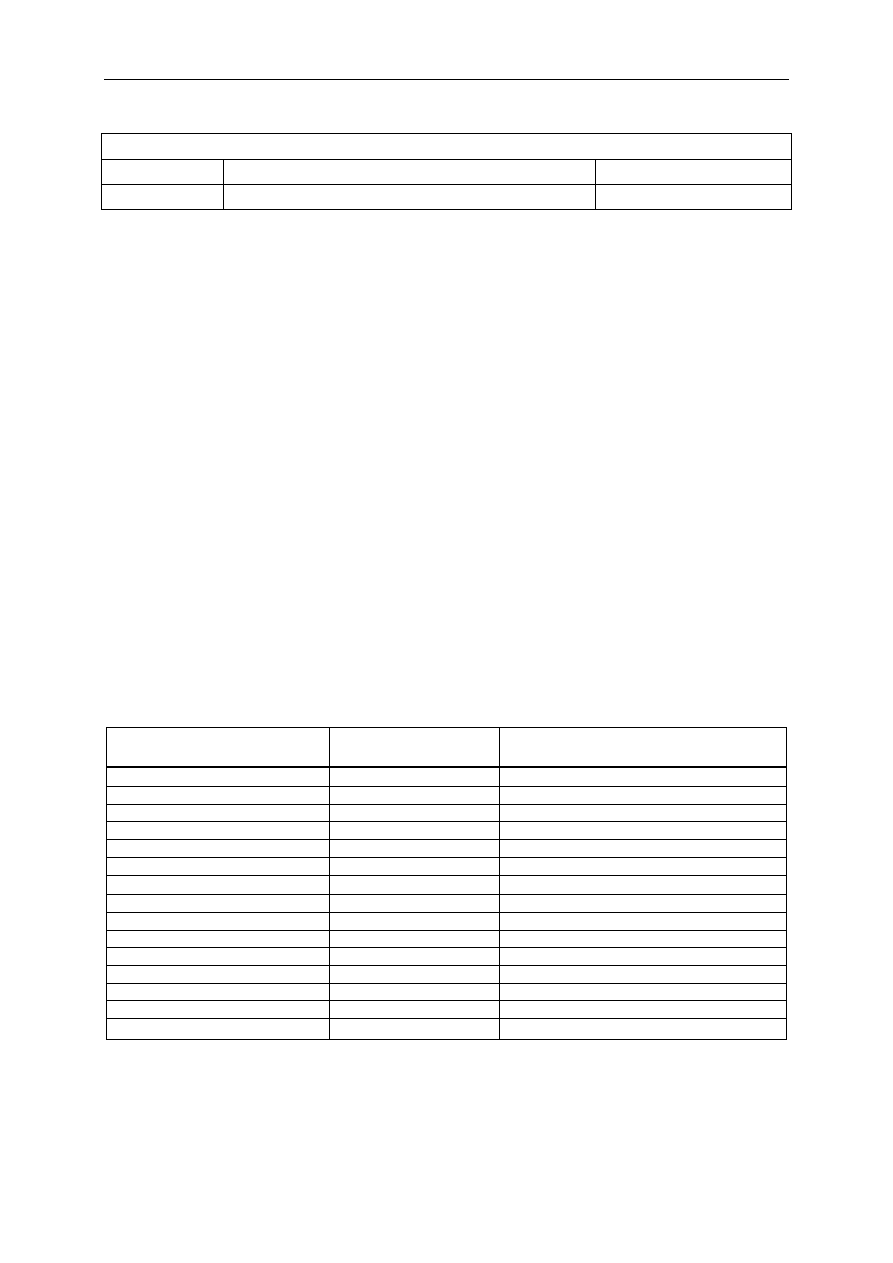
Tabela 2. Leki stosowane do premedykacji farmakologicznej
Lek
Droga podania
Dawka dla osoby dorosłej (mg)
Diazepam
doustnie
5–20
Lorazepam
doustnie, i.m.
1–4
Midazolam
i.m., i.v.
3–5, 1–2,5
Sekobarbital
doustnie, i.m.
50–200
Pentobarbital
doustnie, i.m.
50–200
Morfina
i.m.
5–15
Meperydyna
i.m.
50–150
Cymetydyna
doustnie, i.m., i.v.
150–300
Ranitydyna
doustnie
50–200
Famotydyna
doustnie
20–40
Metoklopramid
doustnie, i.m. , i.v.
5–20
Atropina
i.m.,i.v.
0,3–0,6
Glikopirolan
i.m., i.v.
0,1–0,3
Skopolamina
i.m., i.v.
0,3–0,6
Środki neutralizujące
doustnie
10–30 ml
Benzodiazepiny działają na swoiste receptory w mózgu (reagujące na kwas gamma-
aminomasłowy — GABA) i powodują na tej drodze wybiórcze działanie przeciwlękowe już
5

Anestezjologia
w dawkach, które nie są przyczyną nadmiernej sedacji, osłabienia wentylacji czy
niepożądanych objawów sercowych.
1. Diazepam powoduje szczytowe działanie w 30–60 min po podaniu doustnym.
Ponieważ diazepam jest nierozpuszczalny w wodzie i trzeba go rozpuszczać
w rozpuszczalnikach organicznych, wstrzyknięciu dożylnemu lub domięśniowemu może
towarzyszyć ból.
2. Lorazepam daje intensywną niepamięć, lecz nadmierna sedacja i wydłużenie jego
działania spowodowało, że nie używa się go do krótkich zabiegów operacyjnych ani
w ambulatorium. Efekt szczytowy po podaniu doustnym może wystąpić dopiero
po 2–4 h.
3. Midazolam — po wstrzyknięciu domięśniowym działanie występuje już po 5–10 min,
a efekt szczytowy po 30–60 min, natomiast czas działania jest zwykle krótki.
W odróżnieniu od diazepamu domięśniowe lub dożylne wstrzyknięcie tego środka na
ogół nie powoduje bólu.
Barbiturany działają długo i zapewniają niewielką niepamięć, dlatego — jeśli chodzi
o premedykację — zostały w większości wyparte przez benzodiazepiny.
Butyrofenony — jak droperidol — zapewniają dobre działanie przeciwwymiotne, lecz
mogą powodować ogólne złe samopoczucie (dysforię) u chorych wyznaczonych do
zabiegu, którzy są w stanie uspokojenia i czują się dobrze.
Opioidy stosuje się w premedykacji, gdy istnieje potrzeba zapewnienia analgezji, np.
przed wykonaniem znieczulenia regionalnego, a także wtedy, gdy ból jest skutkiem
choroby chirurgicznej. Anestezjolodzy często sięgają po zestawienie opioidu,
benzodiazepiny i skopolaminy, zwłaszcza u chorych, którzy mogą być w stanie
wyjątkowego niepokoju, np. przed zabiegami kardiochirurgicznymi lub operacją z powodu
nowotworu. Podawanie opioidów jest potencjalnie zagrożone wieloma zjawiskami
niepożądanymi.
Działanie uboczne opioidów podanych w premedykacji:
⎯ depresja oddychania,
⎯ nudności i wymioty,
⎯ hipotensja ortostatyczna,
⎯ opóźnione opróżnianie się żołądka,
⎯ świąd skóry,
⎯ obkurczenie zwieracza żółciowo-dwunastniczego (Oddiego).
6

Anestezjologia
Morfina wywiera szczytowe działanie w ciągu 45–90 min po wstrzyknięciu
domięśniowym. Włączenie morfiny do premedykacji zmniejsza prawdopodobieństwo
niepożądanego przyspieszenia czynności serca wskutek drażnienia chirurgicznego. Często
stosuje się meperydynę (petydynę) w kombinacji z prometazyną. Szczytowe działanie
wstrzykniętej domięśniowo meperydyny jest jednak trudne do przewidzenia.
Fentanyl i jego pochodna alfentanyl — przydatność tych leków do premedykacji jest
ograniczona. Podawanie dożylne lub domięśniowe może być korzystne w premedykacji
do krótkich zabiegów z zakresu chirurgii „jednego dnia”. Ze względu na dużą
rozpuszczalność w tłuszczach, fentanyl dobrze wchłania się przez skórę i błony śluzowe
jamy ustnej i nosa (obecne są w sprzedaży preparaty w postaci plastrów naskórnych—
Durogesic — zapewniające wchłanianie leku ze stałą prędkością, stosowane z myślą
o leczeniu bólu pooperacyjnego i przewlekłego).
1.4. Objętość i pH soku żołądkowego
Ocenia się, że około 40% chorych do planowego zabiegu może być zagrożonych
zachłystowym zapaleniem płuc z powodu niskiego pH soku żołądkowego (poniżej 2,5).
W celu zapobieżenia kwasowemu zapaleniu płuc, grożącemu w wypadku zachłyśnięcia,
podaje się następujące środki:
1. Środki antycholinergiczne, które nie podwyższają w sposób pewny pH soku
żołądkowego, jeśli stosuje się je w dawkach zwykłych dla premedykacji, natomiast
mogą zwiotczać dolny zwieracz przełyku, co sprzyja zarzucaniu (refluksowi)
żołądkowo-przełykowemu.
2. Antagoniści receptora H
2
, podwyższają pH soku żołądkowego, działają na drodze
blokowania indukowanego przez histaminę wydzielania tego soku, zawierającego duże
stężenie jonów wodorowych. Środki te nie wpływają natomiast na objętość soku
żołądkowego.
Cymetydyna — doustne podanie na 1–1,5 h przed operacją podwyższa pH soku
żołądkowego powyżej 2,5 u ok. 80% chorych. Cymetydyna przenika przez łożysko.
Hamuje układy enzymatyczne oksydazy o funkcji mieszanej i zmniejsza przepływ
wątrobowy. W rezultacie może to wydłużać okres połowicznej eliminacji wielu leków.
Ranitydyna — działa silniej i dłużej niż cymetydyna.
7

Anestezjologia
3. Środki zobojętniające podane na 15–30 min przed wprowadzeniem do znieczulenia
niemal u wszystkich chorych podwyższają pH soku żołądkowego powyżej 2,5.
W odróżnieniu od antagonistów receptora H
2
środki zobojętniające działają bez okresu
opóźnienia na pH soku żołądkowego, co oznacza, że zobojętnieniu ulega zawartość
żołądka obecna przed ich podaniem. Skuteczność środków zobojętniających może
w pewnym stopniu zależeć od ruchów pacjenta, które ułatwiają całkowite wymieszanie
się z zawartością żołądka. Zaleca się stosowanie czystych środków zobojętniających,
niezawierających cząsteczek stałych, gdyż w razie zachłyśnięcia się nimi nie dochodzi
do uszkodzenia płuc.
4. Środki gastrokinetyczne zmniejszają objętość soku żołądkowego dzięki relaksacji
zwieracza odźwiernika i przyspieszeniu ruchów żołądka. Wzmagają one równocześnie
napięcie dolnego zwieracza przełyku. Pod ich wpływem nie zmienia się pH soku
żołądkowego. Środki gastrokinetyczne są szczególnie użyteczne wówczas, gdy
w żołądku znajduje się duża objętość płynów wskutek spowolnionego opróżniania
żołądka.
Metoklopramid po podaniu doustnym działa po 30–60 min, podczas gdy
wstrzyknięcie dożylne powoduje efekt już po 3–5 min.
Czynniki opóźniające opróżnianie się żołądka:
⎯ opioidy,
⎯ uraz,
⎯ ciąża,
⎯ ból,
⎯ otyłość,
⎯ lęk,
⎯ cukrzyca.
5. Środki przeciwwymiotne
Droperidol — w małych dawkach 10–15 µg/kg podawanych dożylnie na 5 min przed
zakończeniem operacji może zmniejszyć częstość występowania pooperacyjnych
nudności i wymiotów.
Metoklopramid — podaje się go dożylnie przed końcem operacji. Celowość podawania
środków przeciwwymiotnych:
⎯ przed zabiegami okulistycznymi,
⎯ przed zabiegami ginekologicznymi,
8

Anestezjologia
⎯ u pacjentów, którzy wymiotowali po dawniej przebytych znieczuleniach,
⎯ u osób otyłych.
6. Środki antycholinergiczne
Rutynowe włączanie środków antycholinergicznych jako części premedykacji nie jest
obowiązkowe, lecz bywa wskazane w szczególnych przypadkach.
Wskazania:
⎯ zmniejszenie wydzielania śliny (ma to znaczenie dla zabiegów w obrębie jamy
ustnej, bronchoskopii, intubacji),
⎯ sedacja i niepamięć (szczególnie skopolamina w zestawieniu z morfiną),
⎯ działanie wagolityczne.
Działania niepożądane środków antycholinergicznych:
⎯ działanie toksyczne na ośrodkowy układ nerwowy (splątanie, niepokój ruchowy
w okresie pooperacyjnym, zwłaszcza u osób starszych),
⎯ rozszerzenie źrenic i porażenie mięśni rzęskowych (zwiększenie ciśnienia
śródgałkowego — chorzy z jaskrą),
⎯ zwiększenie fizjologicznej przestrzeni martwej,
⎯ wysuszenie wydzieliny w drogach oddechowych,
⎯ upośledzenie wydzielania potu,
⎯ przyspieszenie czynności serca,
⎯ relaksacja dolnego zwieracza przełyku.
1.5. Przykładowy przebieg premedykacji dorosłej osoby hospitalizowanej
1. Przedoperacyjna wizyta i rozmowa.
2. Doustne podanie benzodiazepiny wieczorem w dzień poprzedzający operację, aby
zapewnić pacjentowi dobry sen.
3. Na 1–2 h przed zabiegiem doustne podanie benzodiazepiny. Podanie wody w ilości do
150 ml może stymulować opróżnianie się żołądka. Jeśli zachodzi potrzeba zniesienia bólu,
dodatkowo lub zamiast benzodiazepiny podaje się domięśniowo opioid.
4. Gdy anestezjolog uważa za potrzebne zapewnienie sedacji i niepamięci, na 1–2 h przed
zabiegiem podaje się domięśniowo skopolaminę.
9

Anestezjologia
5. Jeśli potrzebne jest tylko działanie wysuszające, domięśniowo podaje się glikopirolan (lub
atropinę) przed przewiezieniem chorego na salę operacyjną. Można to też uczynić
dożylnie przed wprowadzeniem do znieczulenia.
6. Doustne podanie antagonisty H
2
metoklopramidu lub obu tych środków łącznie. Przed
operacjami doraźnymi można te leki zastosować dożylnie.
10

Anestezjologia
2. Nieopioidowe dożylne środki anestetyczne
Środki nieopioidowe można wstrzykiwać dożylnie w postaci pojedynczej dawki (bolus)
w celu wprowadzenia do znieczulenia lub też jako ciągły wlew (zwłaszcza propofolu) dla
częściowego lub całkowitego podtrzymania znieczulenia ogólnego.
2.1. Charakterystyka chemiczna i preparaty
1. Roztwory barbituranów mają odczyn zasadowy (pH 10–11), a ich mieszanie
z roztworami kwaśnymi (np. mleczanowy roztwór Ringera albo inne leki) powoduje
wytrącanie się barbituranów jako wolnych kwasów.
2. Diazepam nie jest osiągalny w postaci soli rozpuszczalnej w wodzie. Roztwór zawiera
glikol propylenowy, a mieszanie z roztworami innych leków powoduje wytrącanie.
3. Midazolam jest rozpuszczalny w wodzie (pH 3,5) i można go mieszać z innymi
roztworami.
4. Etomidat (w roztworze z glikolem propylenowym).
5. Propofol trzeba podawać przy użyciu jałowej strzykawki i strzec roztworu przed
zanieczyszczeniem, gdyż roztwór płynny tego leku może spełniać rolę pożywki.
6. Ketamina — w praktyce stosuje się roztwór 1% (1 ml zawiera 10 mg) i 5%
(1 ml zawiera 50 mg).
2.2. Mechanizmy działania
Mechanizmy działania nieopioidowych środków stosowanych do indukcji nie są
wyjaśnione, natomiast proponowane teorie odwołują się do działania na błony
komórkowe (t e o r i e b i o f i z y c z n e ) lub na interakcję z neurotransmitterami (t e o r i e
t r a n s m i t t e r o w e ).
1. Modulacja przekazywania GABA-ergicznego może mieć znaczenie, gdy chodzi
o działanie barbituranów, benzodiazepin, etomidatu i propofolu. Kwas gamma-
aminomasłowy (GABA) jest neurotransmitterem hamującym, a aktywacja
postsynaptycznych receptorów GABA wzmaga k o n d u k t a n c j ę c h l o r k ó w przez
odpowiednie kanały jonowe, co prowadzi do h i p e r p o l a r y z a c j i (hamowania)
neuronu postsynaptycznego.
11
Anestezjologia
2. Ketamina może wchodzić w interakcję z:
⎯ receptorami muskarynowymi w ośrodkowym układzie nerwowym — działając tam
antagonistycznie,
⎯ receptorami opioidowymi — działając na nie agonistycznie (analgezja wskutek
działania na receptory µ, a dysforia wskutek działania na receptory sigma),
⎯ receptorami N-metylo-D-asparaginianowymi (NMDA), które reagują na
L-glutaminian.
3. Flumazenil jest swoistym antagonistą receptorów benzodiazepinowych, natomiast
fizostygmina jest nieswoistym środkiem pobudzającym korę mózgową.
2.3. Właściwości farmakokinetyczne
Działanie nasenne (hipnotyczne) standardowych dawek środków nieopioidowych
używanych do indukcji kończy się z chwilą redystrybucji leku do nieczynnych miejsc
tkankowych. W związku z tym stężenie leku w czynnych miejscach receptorowych ulega
rozcieńczeniu.
Klirens wywiera największy wpływ na stężenie leku w osoczu, podczas gdy zależność
czasowa nabiera znaczenia dopiero pod koniec szybkiego spadku stężenia leku w osoczu,
jaki cechuje fazę dystrybucji.
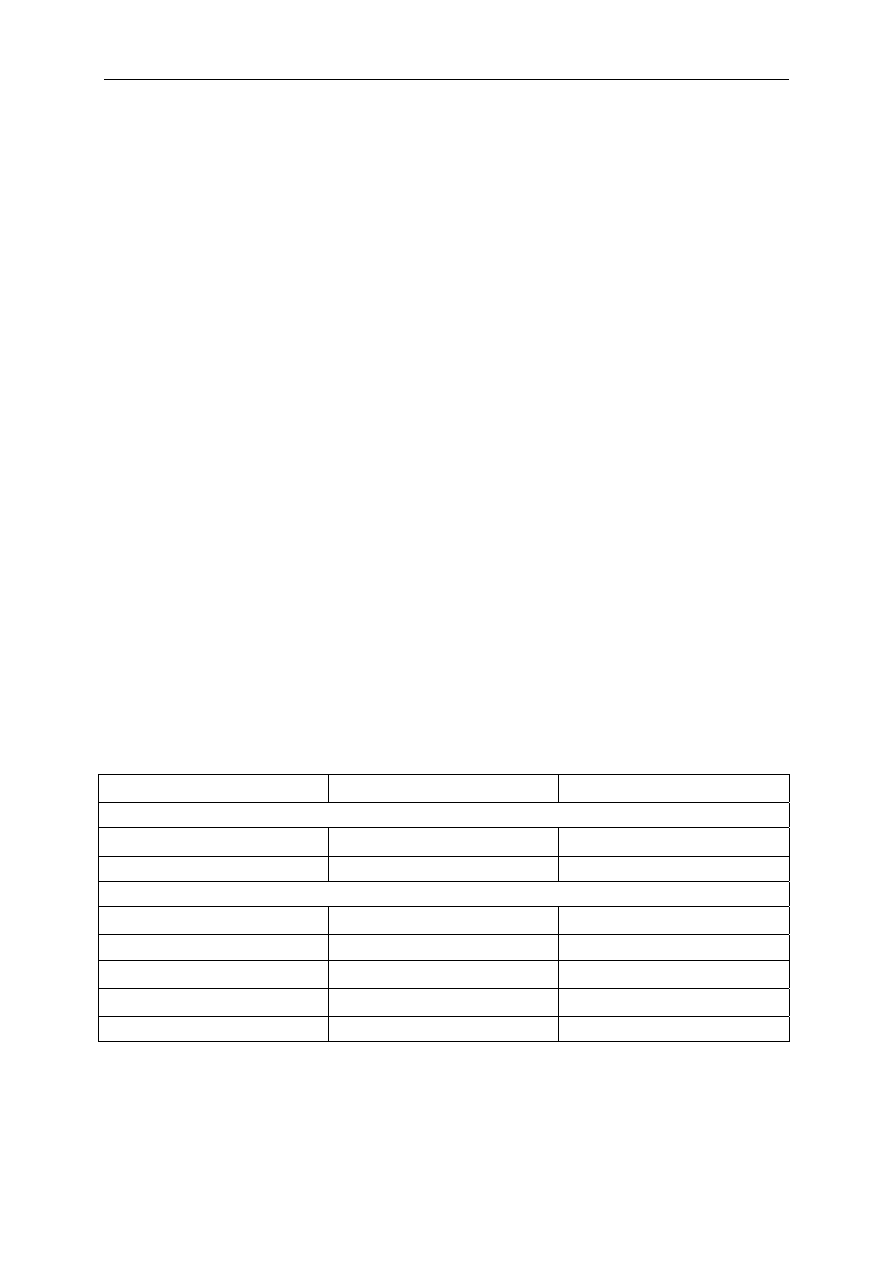
Tabela 3. Anestetyczne dawki leków nieopioidowych, podawane dożylnie
Dawka pojedyncza (bolus)
Ciągły wlew
Barbiturany
Tiopental
3–5 mg kg c.c.
Metoheksital
1,0–1 ,5 mg kg c.c.
0,1–0,3 mg kg c.c./min
Benzodiazepiny
Diazepam
0,3–0,5 mg kg c.c.
Midazolam
0,1–0,2 mg kg c.c.
2–5 µg kg c.c./min
Etomidat
0,2–0,3 mg kg c.c.
Ketamina
1–2 mg kg c.c.
Propofol
1 ,5–2,5 mg kg c.c.
0,1 mg kg c.c./min
12

Anestezjologia
W ą t r o b o w y k l i r e n s m e t o h e k s i t a l u jest znacznie wyższy niż tiopentalu, co
sprawia, że metoheksital działa krócej, jeśli stosuje się go w ponawianych małych
dawkach.
S z y b k i k l i r e n s p r o p o f o l u ułatwia korzystanie z tego leku na drodze ciągłej infuzji
dożylnej dla uzyskania częściowego lub całkowitego podtrzymania znieczulenia ogólnego.
Okres połowicznej eliminacji (T1/2) jest w sposób bezpośredni zależny od objętości
dystrybucji, a odwrotnie proporcjonalny do klirensu. Szeroki zakres T1/2 dla leków
opioidowych jest w głównej mierze wyrazem różnic klirensu.
Redystrybucja (w porównaniu z klirensem) jako przyczyna ustania działania leku
nabiera większego znaczenia, gdy nieaktywne miejsca tkankowe dostępne dla
redystrybucji ulegają wysyceniu pod wpływem dużych dawek pojedynczych, dawkowania
wielokrotnego lub ciągłej infuzji.
Anestetyki wziewne i ich właściwości farmakokinetyczne
Obniżenie przepływu krwi przez wątrobę lub jej procesów metabolicznych, do jakiego
dochodzi pod wpływem wziewnych środków anestetycznych, może opóźniać klirens
i wydłużać T1/2 dużych lub ponawianych dawek nieopioidowych środków stosowanych do
indukcji. Dotyczy to zwłaszcza tych, których usuwanie odbywa się głównie przez wątrobę
(metoheksital, etomidat, ketamina).
Jest mało prawdopodobne, aby klirens środków stosowanych do indukcji zmienił się pod
wpływem nieswoistego pobudzania enzymów metabolizujących leki przez wziewne środki
anestetyczne.
Wiek chorego a farmakokinetyka
U osób w podeszłym wieku potrzebne są niższe dawki nieopioidowych środków
anestetycznych służących do indukcji. Jest to wynik spowolnionego przechodzenia leków
do przedziałów obwodowych lub zmian dystrybucji pojemności minutowej serca do
narządów uczestniczących w eliminacji leków.
Wpływ na układy narządowe
Ośrodkowy układ nerwowy
Poza obniżeniem stanu przytomności klinicznie korzystne działanie leków nieopioidowych
polega na zmniejszeniu przepływu krwi przez mózg, obniżeniu zapotrzebowania
13
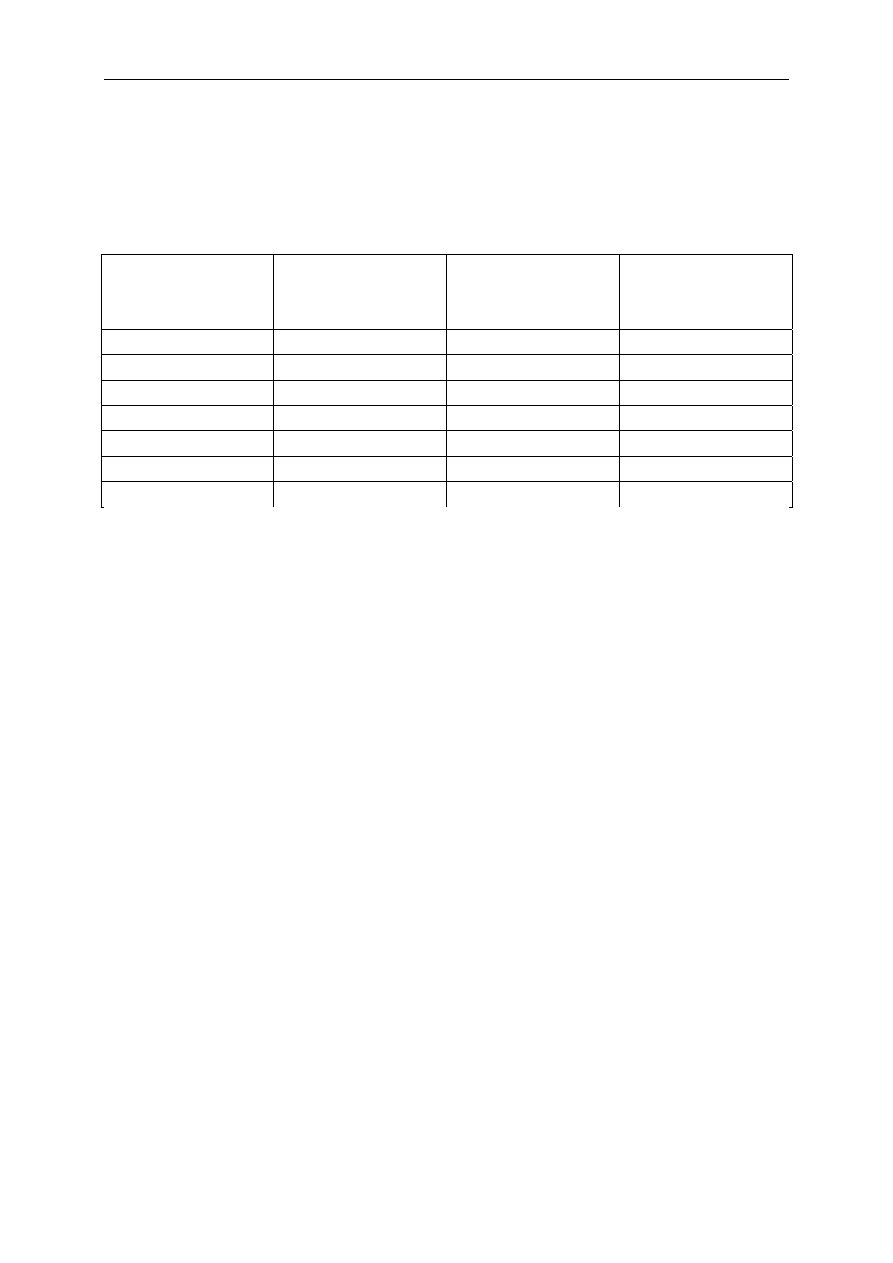
Anestezjologia
tlenowego mózgu, spadku ciśnienia śródczaszkowego (ICP), a także na wzbudzeniu
wzorca snu w elektroencefalogramie.
Tabela 4. Działanie nieopioidowych anestetyków dożylnych na ośrodkowy układ nerwowy
Przepływ mózgowy
Zapotrzebowanie
metaboliczne mózgu
na tlen
Ciśnienie
Tiopental
– –
– –
– –
Metoheksital
– –
– –
– –
Diazepam –
–
–
Midazolam –
–
–
Etomidat
– –
– –
– –
Ketamina +
+
+
+
Propofol
– –
– –
– –
Tiopental i etomidat mogą powodować maksymalny spadek zapotrzebowania tlenowego
dla potrzeb metabolicznych mózgu (płaska krzywa EEG), co uważa się za nieodzowny
element ochronnego działania leków na mózg. Podobne zjawisko w EEG dają duże dawki
metoheksitalu, który jednak nie jest zalecany ze względu na możliwość późniejszego
występowania drgawek trudnych do opanowania.
Tiopental w małych dawkach nie wpływa na somatosensoryczne potencjały wywołane.
Etomidat może zmieniać ich kształt tak, że przypominają one niedokrwienie.
Ketamina zwiększa przepływ mózgowy i nie jest polecana u chorych zagrożonych
podwyższeniem ciśnienia śródczaszkowego. Ketamina wywołuje znieczulenie
zdysocjowane. Jest to rodzaj stanu kataleptycznego, w którym pacjent traci kontakt
z otoczeniem. Stan ten przebiega z analgezją (tzn. działanie przeciwbólowe) i amnezją.
Działanie przeciwbólowe dotyczy w większym stopniu bólów somatycznych niż trzewnych.
Pod wpływem ketaminy występują często dziwaczne, częściowo budzące strach sny
i halucynacje wzrokowe, których nasilenie można osłabić przez podanie benzodwuazepin.
Ketamina jest jedynym anestetykiem dożylnym, który pobudza krążenie, tzn. zwiększa
się częstość akcji serca oraz ciśnienie tętnicze.
Wpływ na oddychanie
Wszystkie omawiane leki cechują się depresją wentylacji. Ujawnia się to wtedy, gdy
środki nieopioidowe stosuje się jako sedacyjne lub nasenne u osób oddychających
spontanicznie.
14
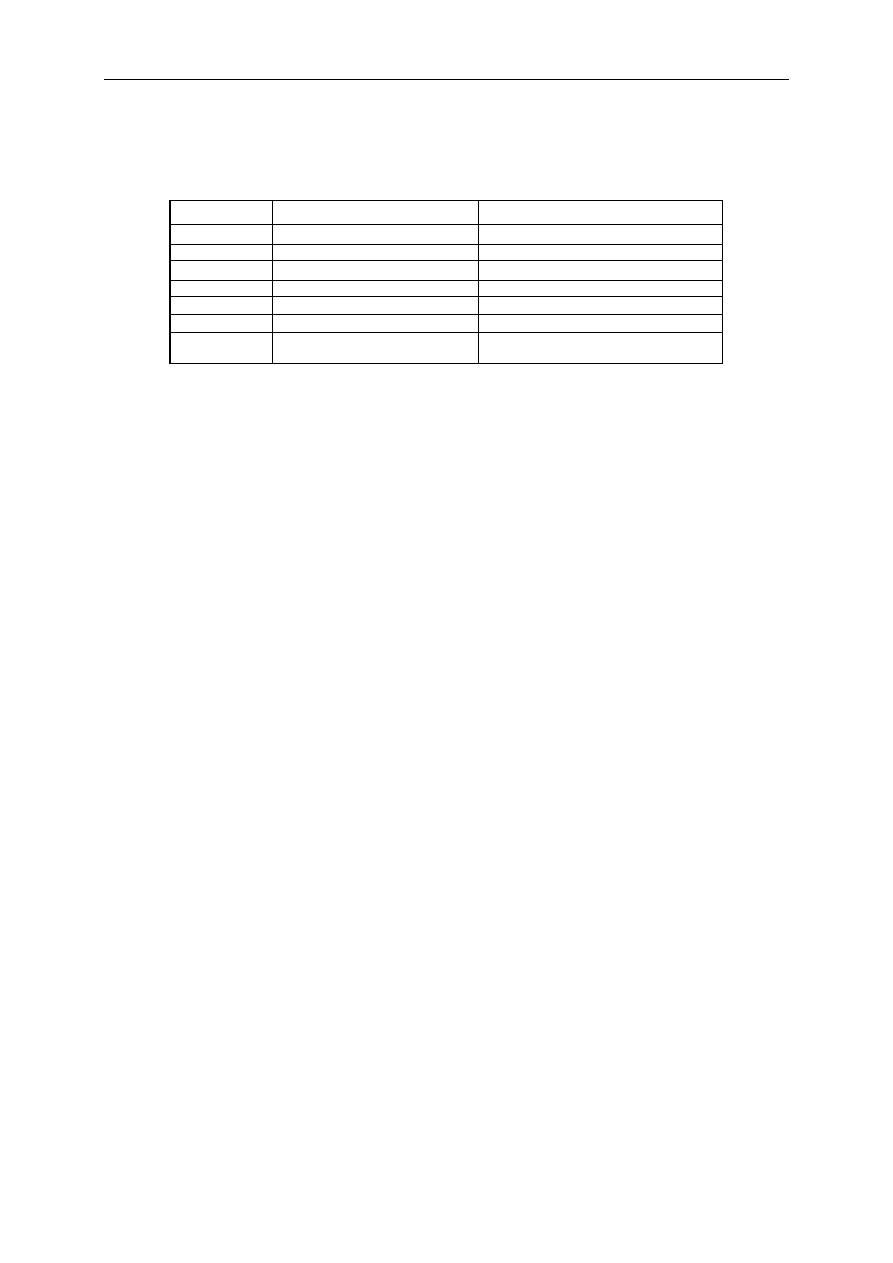
Anestezjologia
Tabela 5. Działanie nieopioidowych anestetyków dożylnych na wentylację
Osłabienie wentylacji
Opór dróg oddechowych
Tiopental
+ +
0
Metoheksital
+ +
0
Diazepam
+
0
Midazolam
+
0
Etomidat
+
0
Ketamina
0
– –
Propofol
+ +
0
Dożylne podanie środka nieopioidowego do indukcji może spowodować bezdech. Z tego
względu trzeba zawsze dysponować sprzętem koniecznym do wspomagania wentylacji
płuc. Wprowadzenie do dróg oddechowych przyrządów u osoby płytko znieczulonej,
u której drogi oddechowe są w stanie hiperreaktywności (wskutek astmy, a także
u palaczy tytoniu), może prowadzić do skurczu oskrzeli. Błędne jest przypisywanie takiej
reakcji wzmożeniu wrażliwości dróg oddechowych pod wpływem tiopentalu.
Metoheksital powoduje większą częstość czkawki i kaszlu w porównaniu z innymi
nieopioidowymi środkami służącymi do indukcji.
Uprzednie podanie opioidów jako premedykacji wzmaga depresyjne działanie na oddech
nieopioidowych środków użytych do indukcji znieczulenia ogólnego.
Ketamina zwiększa wydzielanie w drogach oddechowych, a jej działanie
sympatykomimetyczne uznaje się za przyczynę rozszerzenia oskrzeli (co u chorych
z astmą może usuwać skurcz oskrzeli).
Działanie na układ krążenia
Wszystkie służące do indukcji środki nieopioidowe wywierają działanie depresyjne lub
pobudzające na układ sercowo-naczyniowy.
Hipowolemia nasila hipotensyjne działanie barbituranów, benzodiazepin i propofolu.
Ketamina wywiera działanie pobudzające na ośrodkowy współczulny układ nerwowy, co
powoduje wzrost ciśnienia tętniczego, przyspieszenie czynności serca i wzmożenie
kurczliwości mięśnia sercowego.
15
Anestezjologia
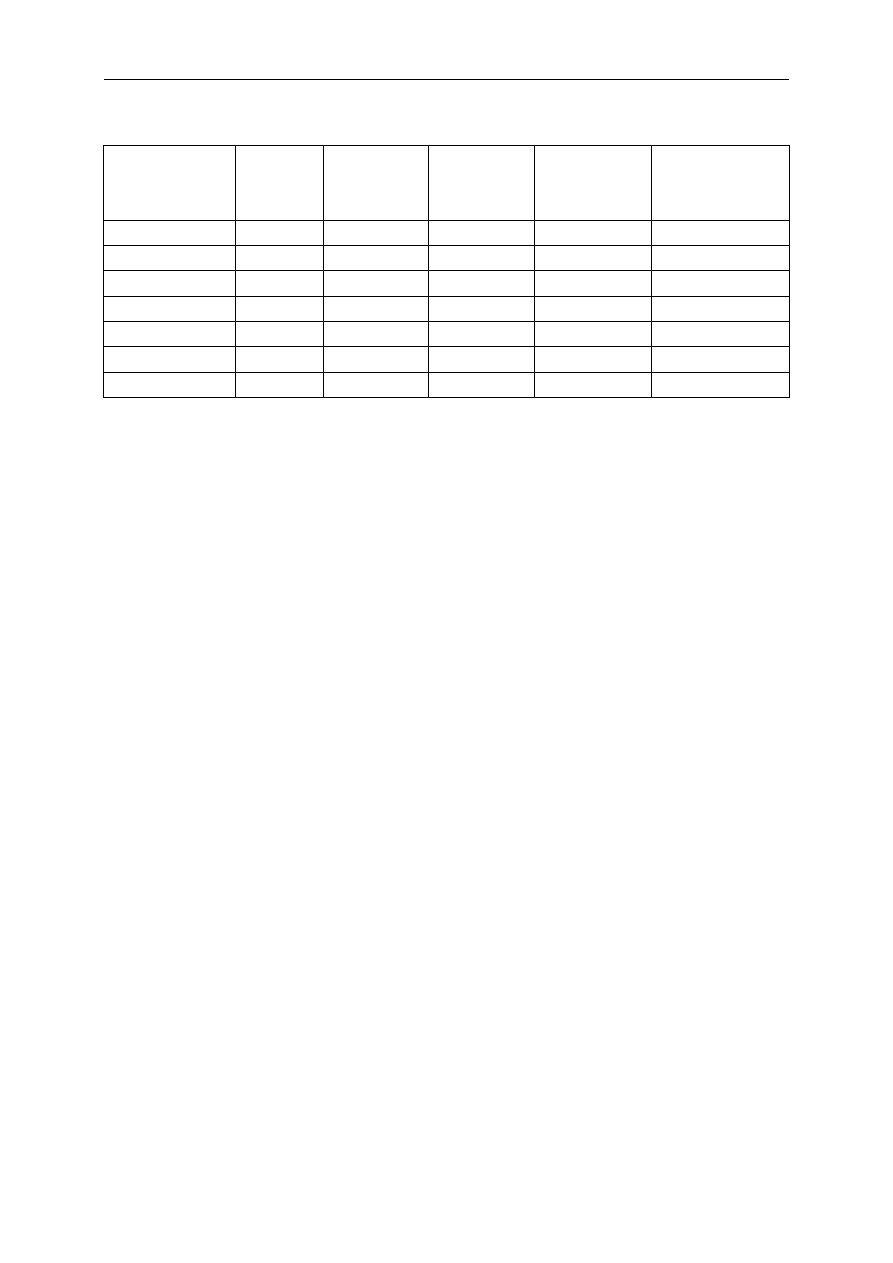
Tabela 6. Działanie nieopioidowych anestetyków dożylnych na układ krążenia
Średnie
ciśnienie
tętnicze
Czynność
serca
Pojemność
minutowa
serca
Opór naczyń
w dużym
krążeniu
Rozszerzenie żył
Tiopental –
+
–
0/+ +
Metoheksital – ++ –
?
+
Diazepam 0/–
–/+ 0 –/+
+
Midazolam 0/–
–/+ 0/– 0/–
+
Etomidat
0
0
0
0
0
Ketamina
++
++
+
+
0
Propofol –
+
0/–
– +
Zwiększone zapotrzebowanie mięśnia sercowego na tlen, do jakiego wiedzie ketamina,
jest niekorzystne u osób z chorobą wieńcową. U ciężko chorych może istnieć
upośledzenie czynności autonomicznego układu nerwowego i ketamina działa wówczas
często depresyjnie na układ krążenia. Korzystne jest stosowanie ketaminy do indukcji
dożylnej (1–2 mg kg c.c.) w przypadkach hipowolemii lub przy współistnieniu
niewydolności serca, gdyż jest to jedyny ze środków służących do indukcji, który pobudza
układ sercowo-naczyniowy.
Etomidat (0,2–0,3 mg/kg c.c. dożylnie) powoduje najmniejsze niekorzystne zmiany
w układzie krążenia spośród wszystkich nieopioidowych leków służących do indukcji.
Środek ten można uznać za alternatywny dla ketaminy, gdy chodzi o indukcję
znieczulenia u chorych z hipowolemią.
Benzodiazepiny podawane dożylnie w celu indukcji znieczulenia (diazepam w dawce
0,3–0,5 mg/kg c.c., midazolam w dawce 0,1–0,2 mg/kg c.c.) wywierają umiarkowane
działanie depresyjne na serce i obwodowe łożysko naczyniowe. Opioidy mogą wzmagać
spadek ciśnienia tętniczego powodowany przez benzodiazepiny (jako wyraz rozszerzenia
naczyń).
Barbiturany (tiopental w dawce 3–5 mg/kg
c.c., metoheksital w dawce 1,0–1,5 mg/kg
c.c.) wywierają silniejsze niż benzodiazepiny działanie na układ krążenia, gdy stosuje się
je dożylnie w celu indukcji znieczulenia. Zasadnicze działanie tiopentalu polega na
obniżeniu pojemności minutowej serca.
Propofol (1,5–2,5 mg/kg
c.c.) prowadzi do spadku ciśnienia tętniczego — podobnie jak
tiopental.
16

Anestezjologia
3. Znieczulenie wziewne
Rola środków wziewnych do znieczulenia ogólnego zmienia się w miarę częstszego
stosowania środków dożylnych (opioidy, benzodiazepiny) jako leków wspomagających,
dzięki czemu obniża się zapotrzebowanie na dawkę środków wziewnych i zmniejsza ich
działanie niepożądane. Wziewnymi środkami anestetycznymi o największym znaczeniu są
dziś: podtlenek azotu (N
2
O) oraz lotne środki anestetyczne z grupy fluorowanych
węglowodorów, jak:
⎯ halotan,
⎯ enfluran,
⎯ izofluran,
⎯ sewofluran,
⎯ desfluran.
3.1. Farmakokinetyka wziewnych środków anestetycznych
3.1.1. Wychwytywanie, dystrybucja i eliminacja
Indukcja (wprowadzenie) znieczulenia następuje wtedy, gdy w mózgu powstaje
dostateczne ciśnienie parcjalne środka anestetycznego. Mózg jest końcowym etapem
ciągu gradientów stężenia, dotyczących ciśnienia parcjalnego środka anestetycznego.
Ciąg ten rozpoczyna się od stężenia anestetyku podawanego z aparatu do znieczulenia.
Z a d a n i e m z n i e c z u l e n i a w z i e w n e g o j e s t u t r z y m a n i e o p t y m a l n e g o
i s t a ł e g o c i ś n i e n i a p a r c j a l n e g o a n e s t e t y k u w m ó z g u , o c e n i a n e g o n a
p o d s t a w i e p ę c h e r z y k o w e g o c i ś n i e n i a p a r c j a l n e g o (
P
A
). Dysponując
możliwością klinicznego pomiaru i monitorowania
P
A
,
anestezjolog jest w stanie sterować
głębokością znieczulenia.
Szybkość indukcji znieczulenia zależy od prędkości zwiększania się P
A
. Podczas
indukcji krew powracająca do płuc i tkanek ma niższe ciśnienie parcjalne (wychwytywanie
przez tkanki) niż istniejące w pęcherzykach. W rezultacie dochodzi do wychwytywania
środka anestetycznego z pęcherzyków, wskutek czego powstaje różnica ciśnień
parcjalnych między powietrzem wdychanym a pęcherzykami.
17

Anestezjologia
Rozpuszczalność (współczynnik podziału) środków anestetycznych we krwi i tkankach
decyduje o czasie potrzebnym dla uzyskania równowagi pomiędzy obydwiema fazami.
Rozpuszczalność krew–gaz decyduje o wychwytywaniu z pęcherzyków do krwi, a więc
o szybkości indukcji.
Rozpuszczalność mózg–krew decyduje o czasie koniecznym dla uzyskania wyrównania
ciśnień parcjalnych pomiędzy krwią a mózgiem.
Zjawisko stężania — im wyższe jest ciśnienie parcjalne w powietrzu wdechowym (P
i
),
tym szybciej wzrasta ciśnienie parcjalne w pęcherzykach płucnych (P
A
).
Zjawisko drugiego gazu — podanie dużych stężeń podtlenku azotu przyspiesza
wychwytywanie równolegle występujących w mieszaninie oddechowej gazów (izofluran,
tlen).
Wychodzenie ze znieczulenia oznacza odwrócenie gradientów stężenia, istniejących
podczas indukcji. W przeciwieństwie do indukcji znieczulenia, szybkość wychodzenia ze
znieczulenia może zależeć od metabolicznej przemiany wziewnego środka
znieczulającego. Proces wychodzenia ze znieczulenia jest najszybszy po krótko
działających środkach wziewnych, które są słabo rozpuszczalne we krwi i w tkankach.
3.1.2. Zapotrzebowanie na środki anestetyczne — MAC
MAC to minimalne stężenie pęcherzykowe wziewnego środka anestetycznego pod
ciśnieniem jednej atmosfery, które zapobiega ruchom 50% tak znieczulonych osób
w odpowiedzi na bodźce bólowe (cięcie chirurgiczne). MAC jest odbiciem stężenia
anestetyków w mózgu, ponieważ P
A
pozostaje w równowadze z mózgiem. W warunkach
klinicznych konieczne jest zapewnienie MAC 1,2–1,3, aby zapobiec ruchom u co najmniej
95% chorych. Łączenie kilku wziewnych środków anestetycznych ma działanie addycyjne
na MAC (obniżenie MAC o 1% na każdy 1% podtlenku azotu).
Porównanie wpływu wziewnych środków znieczulających na różne układy narządowe
polega na ocenie jednakowej skuteczności MAC dla poszczególnych środków.
MAC zmienia się pod wpływem różnych czynników fizjologicznych i farmakologicznych.
18
Anestezjologia
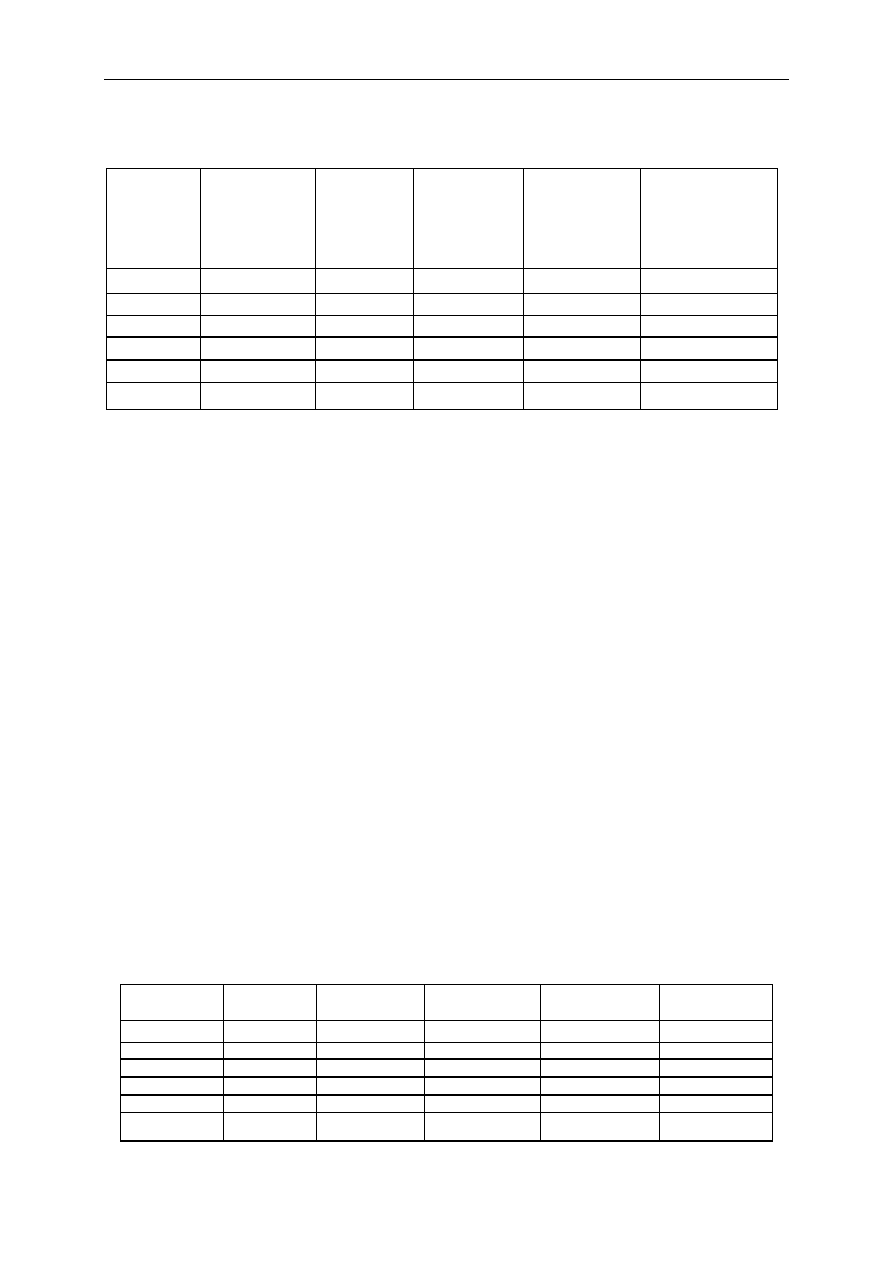
Tabela 7. Charakterystyka fizyczna anestetyków wziewnych
Masa
cząsteczkowa
(g)
Punkt
wrzenia
(
0
C)
Ciśnienie
parcjalne
w 20°C
(mm Hg)
Konieczność
stabilizatora
chemicznego
Granica
palności
N
2
O
44
–88
Nie ma
Halotan
197,4
50,2
241
Tak
Nie ma
Enfluran
184,5
56,5
175
Nie
Nie ma
Izofluran
184,5
48,5
238
Nie
Nie ma
Sewofluran
200
58,5
160
11%w O
s
Desfluran
168
23,5
664
Nie
20,8% w O
2
Gradienty stężeń wytwarzanych podczas znieczulenia ogólnego
Podawane > Wdychane > Pęcherzykowe > Tętnicze > Mózgowe
(P
i
)
(P
A
)
(P
a
)
(P
br
)
Oznacza to, że ciśnienie parcjalne anestetyku w mieszaninie wdychanej powoduje
przepływ anestetyku wg ww. gradientu stężeń, czyli od parownika, poprzez układ
okrężny aparatu do znieczulenia (gdzie ciśnienie parcjalne jest największe), do
pęcherzyków płucnych, krwi tętniczej tkanek oraz punktu docelowego mózgu.
Odwrotna sytuacja ma miejsce podczas wybudzania pacjenta po przeprowadzonym
znieczuleniu, kiedy to zamknięcie parownika i zaprzestanie podawania anestetyku
wziewnego powoduje odwrócenie gradientu stężeń. Oznacza to, że od tego momentu
anestetyk będzie wypłukiwał się z organizmu chorego i dyfundował z mózgu (gdzie jest
go wtedy najwięcej) oraz pozostałych tkanek (o różnym stopniu nasycenia anestetykiem)
do krwi żylnej, następnie do pęcherzyków płucnych, w końcu zostaje wydalony do układu
okrężnego aparatu do znieczulenia lub do atmosfery.
Tabela 8. Współczynniki rozdziału w temperaturze 37°C
krew : gaz
mózg : krew
mięśnie : krew
tłuszcz : krew
olej : gaz
N
2
O
0,47
1,1
1,2
2,3
1,4
Halotan
2,3
2,9
3,5
60
224
Enfluran
1,91
1,4
1,7
36
98,5
Izofluran
1,4
2,6
4,0
45
90,8
Sewofluran
0,6
1,7
3,1
47,5
53,4
Desfluran
0,42
1,3
2,0
27,2
18,7
19

Anestezjologia
Tabela 9. Zapotrzebowanie anestetyczne (MAC) na anestetyki wziewne
MAC (%)
% MAC
przy 60–70%
N
2
O
104
Halotan
0,77
0,29
Enfluran
1,70
0,60
Izofluran
1,15
0,50
Sewofluran
1,71
0,66
Desfluran
6,0
2,83
Czynniki wpływające na zapotrzebowanie anestetyczne (MAC)
Obniżenie MAC:
⎯ postępujący wiek,
⎯ hipotermia,
⎯ inne środki wpływające depresyjnie na OUN (opioidy, benzodiazepiny),
⎯ spadek poziomu neurotransmitterów w OUN (środki przeciw nadciśnieniu),
⎯ ostre zatrucie alkoholem etylowym,
⎯ alfa
2
-agoniści (klonidyna),
⎯ ciąża.
Podwyższenie MAC:
⎯ hipertermia,
⎯ przewlekłe nadużywanie alkoholu etylowego,
⎯ zwiększenie stężenia neurotransmitterów w OUN (inhibitory monoaminooksydazy).
Bez wpływu na MAC:
⎯ czas trwania znieczulenia,
⎯ płeć,
⎯ PaCO
2
21–95 mmHg.
3.2. Wpływ lotnych środków anestetycznych na narządy i układy
Ośrodkowy układ nerwowy
Lotne środki anestetyczne powodują swoiste dla danego środka i zależne od jego dawki
z w i ę k s z e n i e p r z e p ł y w u k r w i p r z e z m ó z g wskutek rozszerzania przez nie
naczyń mózgowych.
20

Anestezjologia
Podtlenek azotu rozszerza naczynia mózgowe, lecz jego niewielkiej sile działania
odpowiada umiarkowany wzrost przepływu mózgowego.
Zwiększenie przepływu mózgowego pod wpływem lotnych środków anestetycznych ma
tendencje do normalizacji w miarę upływu czasu. Dla przykładu, przepływ mózgowy
ulega normalizacji po 2 h podawania halotanu.
Lotne środki anestetyczne o b n i ż a j ą z a p o t r z e b o w a n i e m ó z g u n a t l e n , przy
czym zjawisko to jest najsilniejsze przy stosowaniu izofluranu (przy ok. 2 MAC izofluranu
EEG staje się płaskie). Przepływ mózgowy, przy którym EEG wykazuje cechy
niedokrwienia, jest niższy dla izofluranu niż dla halotanu, co sugeruje ewentualny efekt
ochronny izofluranu na mózg. Izofluran zapewnia lepszą zależność pomiędzy
zapotrzebowaniem tlenowym mózgu a przepływem krwi przez mózg, co może stanowić
wyjaśnienie mniejszego stopnia wzrostu przepływu mózgowego pod wpływem tego
środka.
U chorych z obniżoną podatnością śródczaszkową, powodowany przez leki wzrost
przepływu mózgowego prowadzi do równoległego zwiększenia objętości krwi w mózgu
i wzrostu ciśnienia śródczaszkowego. Lotne środki anestetyczne m o g ą z m i e n i a ć
w y t w a r z a n i e i r e a b s o r p c j ę p ł y n u m ó z g o w o - r d z e n i o w e g o , lecz — podobnie
jak w odniesieniu do przepływu krwi przez mózg — zmiany te z czasem normalizują się.
W obecności umiarkowanej hipokapni izofluran rzadziej prowadzi do potencjalnie
groźnych skoków ciśnienia śródczaszkowego niż enfluran lub halotan.
Tylko enfluran wyzwala zależną od dawki iglicową aktywność EEG, nasilającą się pod
wpływem hipokapni.
Lotne środki anestetyczne i podtlenek azotu zmniejszają amplitudę i wydłużają okres
utajenia korowych komponentów somatosensorycznych potencjałów wywołanych.
Układ oddechowy
1. Objętości oddechowe i częstość oddychania — lotne środki anestetyczne prowadzą do
swoistej dla danego środka i zależnej od dawki depresji wentylacji, co objawia się
podwyższeniem PaCO
2
.
21

Anestezjologia
Spadek objętości oddechowej nie zostaje w pełni zrównoważony przyspieszeniem
oddychania (szybkie i płytkie oddychanie, charakterystyczne dla stanu znieczulenia),
wobec czego dochodzi do pogorszenia wentylacji pęcherzykowej.
Zastąpienie części działania anestetyku lotnego podaniem podtlenku azotu sprawia, że
PaCO
2
przy takim samym łącznym MAC mniej wzrasta niż gdy podaje się sam lotny
środek anestetyczny.
2. Wpływ na mięśnie międzyżebrowe i przeponę — utrata czynności mięśni
międzyżebrowych pod wpływem narastających dawek lotnych środków anestetycznych
powoduje charakterystyczny tor wentylacji (zapadanie się klatki piersiowej
i uwydatnianie brzucha, gdy podczas wdechu opuszcza się przepona), towarzyszący
głębokiemu znieczuleniu ogólnemu.
3. Chemiczne sterowanie oddychaniem — lotne środki anestetyczne prowadzą do
zależnego od dawki spadku odpowiedzi wentylacyjnej na dwutlenek węgla, natomiast
odpowiedź wentylacyjna na hipoksemię jest zablokowana już przez subanestetyczne
stężenia tych leków (0,1 MAC). Brak zwiększenia wentylacji — mimo niedotlenienia
krwi tętniczej — oznacza, że podczas znieczulenia ogólnego nie można polegać na tym
ważnym klinicznym objawie hipoksji.
Wspomaganie wentylacji płuc w celu przeciwdziałania — powodowanemu przez środek
anestetyczny — zwiększeniu PaCO
2
ma wartość ograniczoną, gdyż przy obniżeniu
PaCO
2
o ok. 5 mmHg dochodzi do bezdechu.
Stymulacja chirurgiczna zwiększa wentylację w dostatecznym stopniu, aby doszło do
obniżenia PaCO
2
o ok. 5 mmHg.
4. Średnica dróg oddechowych — lotne środki anestetyczne skutecznie obniżają opór
dróg oddechowych na drodze rozszerzenia oskrzeli. Wszystkie lotne środki
anestetyczne są równie skuteczne u chorych z astmą.
5. Hipoksyczne obkurczenie płucnego łożyska naczyniowego — wydaje się, że lotne
środki anestetyczne w dawkach stosowanych klinicznie nie wpływają na zjawisko
odwracania przepływu krwi od pęcherzyków gorzej wentylowanych lub
niewentylowanych.
22

Anestezjologia
Układ krążenia
1. Hemodynamika — lotne środki anestetyczne prowadzą do swoistego dla konkretnego
środka i zależnego od dawki spadku ciśnienia tętniczego, co jest spowodowane
zmniejszeniem pojemności minutowej serca (halotan i enfluran) lub zmniejszeniem
oporu naczyń obwodowych w dużym krążeniu (izofluran).
Przyspieszenie czynności serca podczas podawania izofluranu jest wyrazem
zachowania aktywności baroreceptorów w odpowiedzi na spadek ciśnienia tętniczego.
Minimalna lub nieobecna zmiana częstości pracy serca, mimo powodowanego przez
halotan spadku ciśnienia tętniczego, przemawia za upośledzeniem przez ten środek
aktywności baroreceptorów.
Dystrybucja pojemności minutowej serca zmienia się pod wpływem środków
anestetycznych, przy czym wzmaga się przepływ do mózgu (halotan), do mięśni
szkieletowych (izofluran) i skóry, zmniejsza natomiast — do nerek, wątroby
i przewodu pokarmowego.
Zastąpienie części działania lotnego środka anestetycznego podaniem podtlenku azotu
sprawia, że spadek ciśnienia tętniczego jest mniejszy przy takim samym łącznym MAC
w porównaniu z sytuacją po podaniu samego tylko lotnego anestetyku.
Podtlenek azotu wywiera słabe działanie sympatykomimetyczne, co objawia się
wzrostem oporu naczyniowego w dużym i małym krążeniu. Dodany do wysokich
dawek opioidu podtlenek azotu może spowodować spadek ciśnienia tętniczego
i pojemności minutowej serca.
2. Zaburzenia rytmu serca, zmiany przewodnictwa oraz interakcja z innymi lekami —
izofluran i enfluran, rzadziej niż halotan, powodują zaburzenia rytmu, gdy w osoczu
istnieje podwyższone stężenie adrenaliny. Zaburzenia rytmu serca powodowane przez
adrenalinę zdarzają się rzadziej u dzieci niż u osób dorosłych.
Lotne środki anestetyczne wywierają bezpośrednie działanie depresyjne na węzeł
zatokowo-przedsionkowy. Przewodzenie w sercu przez zwykłe szlaki ulega mniejszemu
zaburzeniu pod wpływem izofluranu niż po enfluranie lub halotanie.
Depresja mięśnia sercowego powodowana przez lotne środki anestetyczne może się
nasilać, gdy równocześnie podaje się blokery kanału wapniowego i antagonistów
receptorów beta-adrenergicznych.
23

Anestezjologia
3. Krążenie wieńcowe — izofluran w większym stopniu niż inne lotne środki anestetyczne
może powodować zaburzenie w ścisłej zależności pomiędzy przepływem wieńcowym
a zapotrzebowaniem mięśnia sercowego na tlen. Indukowane przez izofluran
rozszerzenie tętniczek śródsierdziowych — zwłaszcza gdy zmniejszone jest ciśnienie
perfuzyjne w krążeniu wieńcowym, a w krytycznych punktach anatomicznych tętnic
wieńcowych istnieją zwężenia — może spowodować odwrócenie przepływu od
obszarów mięśnia sercowego zaopatrywanych przez zależne od ciśnienia krążenie
oboczne (zjawisko „podkradania” w tętnicach wieńcowych).
Działanie lotnych środków anestetycznych na nerki jest wyrazem przede wszystkim
zmian w przepływie krwi przez nerki. Typowe jest pogorszenie przepływu nerkowego pod
wpływem anestezji, obniżenie przesączania kłębkowego i ilości wydalanego moczu.
Lotne środki anestetyczne mają wewnętrzne działanie relaksujące mięśnie
i potencjalizują działanie niedepolaryzujących środków zwiotczających. Potencjalizacja
działania niedepolaryzujących środków zwiotczających jest najsilniejsza po zastosowaniu
izofluranu i enfluranu, średnia po halotanie, a najsłabsza przy użyciu podtlenku azotu.
Wszystkie lotne środki anestetyczne powodują relaksację macicy i mogą doprowadzać do
pogorszenia przepływu krwi przez macicę u kobiet ciężarnych. Leki te przechodzą też
u kobiet ciężarnych przez łożysko i wywierają na płód podobne działanie jak na matkę.
24

Anestezjologia
4. Środki zwiotczające
Leki, które w sposób swoisty pierwotnie zaburzają fizjologiczną sekwencję przenoszenia
nerwowo-mięśniowego, noszą nazwę środków zwiotczających (środków blokujących
przenoszenie nerwowo-mięśniowe). Środki zwiotczające nie są anestetykami i nie wolno
stosować ich w celu zniesienia ruchów mięśni szkieletowych u chorych niedostatecznie
znieczulonych. Decyzja o włączeniu środków zwiotczających podczas znieczulenia
ogólnego oparta jest na wielu czynnikach.
Czynniki decydujące o wykorzystaniu środków zwiotczających podczas znieczulenia
ogólnego:
1. Rodzaj zabiegu:
⎯ lokalizacja anatomiczna,
⎯ ułożenie pacjenta.
2. Metoda znieczulenia:
⎯ wziewne czy dożylne,
⎯ zapewnienie drożności dróg oddechowych (maska czy intubacja dotchawicza),
⎯ sposób prowadzenia wentylacji (spontaniczna czy kontrolowana).
3. Czynniki związane z pacjentem:
⎯ budowa ciała (szczupły czy otyły),
⎯ stan fizyczny wg klasyfikacji ASA,
⎯ wiek.
Fizjologia i farmakologia
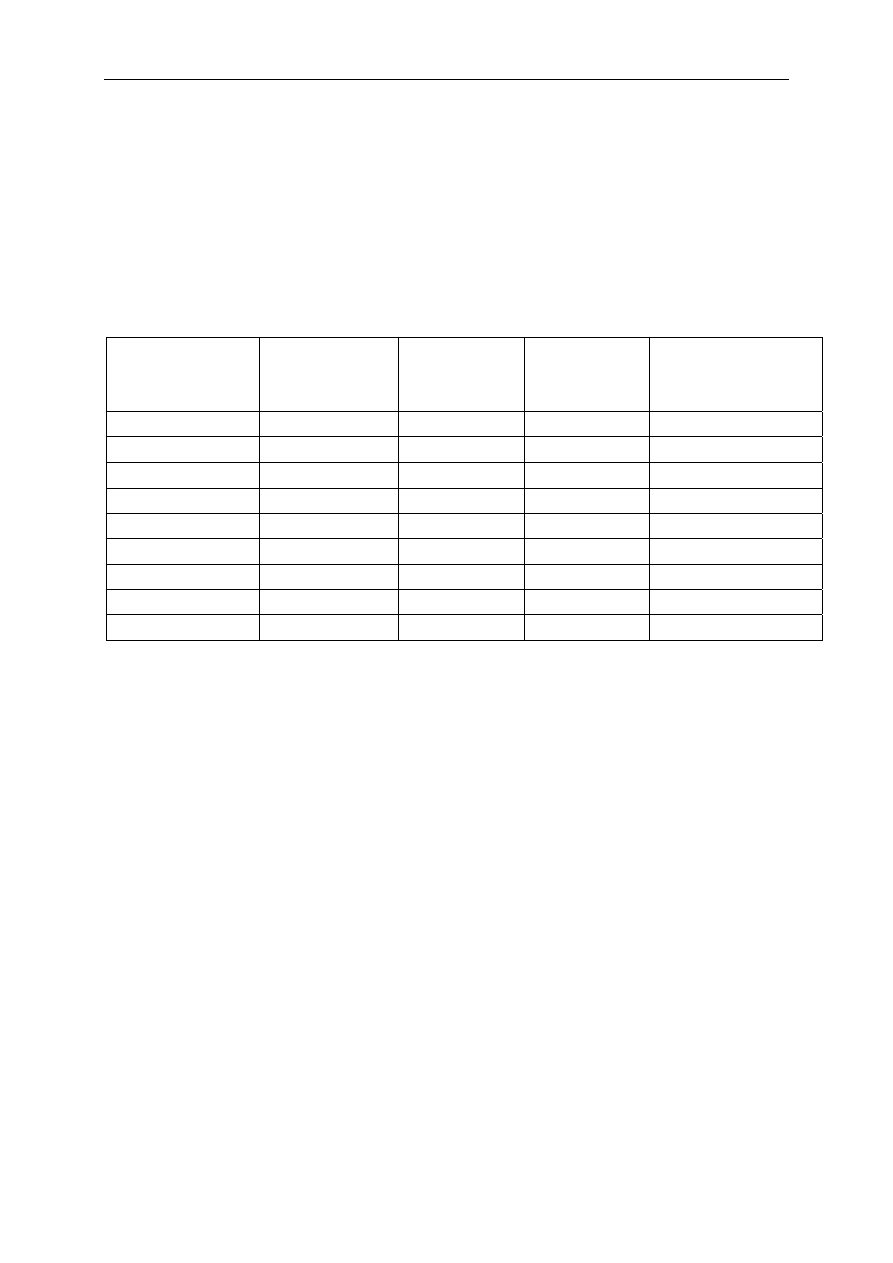
Proces skurczu mięśnia szkieletowego rozpoczyna się w złączu nerwowo-mięśniowym
(NMJ) od uwolnienia acetylocholiny (ACh).
25

Anestezjologia
receptory acetylocholinowe
pęcherzyki acetylocholiny
fałdy złącza
zakończenie nerwu
błona podstawowa
szczelina synaptyczna
acetylocholinesteraza
Rysunek 1. Schemat złącza nerwowo-mięśniowego
Pod względem anatomicznym złącze nerwowo-mięśniowe jest synapsą łączącą
presynaptyczną błonę zakończenia nerwu ruchowego z postsynaptyczną błoną włókna
mięśnia szkieletowego.
Uwalnianie acetylocholiny
Miejsca uwalniania ACh z zakończenia nerwu zlokalizowane są na wypustkach błony
nerwu w bliskim sąsiedztwie fałdów błony synaptycznej, co sprzyja szybkiej aktywacji
receptora. Aktywacja postsynaptycznego receptora nikotynowego wymaga
równoczesnego zajęcia dwóch jednostek alfa receptora przez Ach.
40 A
85 A
ll
ll
ll
110 A
Rysunek 2. Nikotynowy receptor acetylocholinowy
Nikotynowy receptor acetylocholinowy składa się z pięciu podjednostek
glikoproteinowych, ukształtowanych jako kanał jonowy. Na podjednostkach alfa znajduje
się miejsce rozpoznawania agonistów i antagonistów.
ACh ulega — pod wpływem acetylocholinesterazy — hydrolizie do choliny (ponownie
wykorzystywanej do syntezy nowego ACh) i do octanu.
26

Anestezjologia
Zjawiska postsynaptyczne
Skurcz mięśnia szkieletowego następuje wtedy, gdy indukowane przez ACh zmiany
przepuszczalności błony komórki mięśniowej umożliwiają ruch sodu do jej wnętrza
w stopniu wystarczającym, aby obniżyć ujemny ładunek śródkomórkowy (depolaryzacja)
i spowodować wyzwolenie potencjału czynnościowego. Propagacja potencjału
czynnościowego inicjuje uwalnianie wapnia z siateczki sarkoplazmatycznej do
sarkoplazmy, gdzie aktywacja trifosforanu adenozyny w miozynie powoduje sprzężenie
włókienek mięśniowych o typie pobudzenie–skurcz.
Zjawiska presynaptyczne
Receptory presynaptyczne odgrywają rolę regulacyjną w uwalnianiu ACh, co znajduje
wyraz w zanikaniu elektromiogramu przy wyższych częstościach stymulacji.
Farmakologia złącza nerwowo-mięśniowego
Środki blokujące złącze nerwowo-mięśniowe dzieli się na:
⎯ depolaryzujące (naśladujące działanie ACh w miejscach wiązania),
⎯ niedepolaryzujące (współzawodniczące z ACh w miejscach wiązania), czyli
kompetycyjne.
Klasyfikacja środków zwiotczających
Depolaryzujące:
1. Sukcynylocholina.
Niedepolaryzujące:
Długodziałające:
1. d-Tubokuraryna.
2. Metokuryna.
3. Pankuronium.
4. Doksakurium (Doxicurium).
5. Pipekuronium.
Średniodługodziałające:
1. Atrakurium.
2. Wekuronium.
Krótkodziałające:
1. Miwakurium.
2. Rokuronium.
27

Anestezjologia
Środki depolaryzujące (sukcynylocholina)
Sukcynylocholina (SCh) cieszy się nadal wielką popularnością, gdyż jest jedynym
dostępnym środkiem blokującym złącze nerwowo-mięśniowe o szybkim początku
działania i działaniu krótkotrwałym.
Farmakologia sukcynylocholiny — SCh ulega szybkiemu metabolizmowi (okres
połowicznej eliminacji ocenia się na 2–4 min) pod wpływem cholinesterazy osoczowej
(pseudocholinesterazy) rozpada się do choliny i sukcynylomonocholiny.
Charakterystyka blokady depolaryzacyjnej
1. Obniżenie amplitudy skurczu.
2. Brak zanikania przy stymulacji ciągłej (tężcowej).
3. Jednakowe obniżenie amplitudy wszystkich skurczów po bodźcu poczwórnym
(stosunek > 0,7).
4. Brak potencjalizacji potężcowej.
5. Drgania pęczkowe.
6. Antagonistyczne działanie niedepolaryzujących środków zwiotczających.
7. Nasilanie przez środki antycholinesterazowe.
Charakterystyka niedepolaryzacyjnej blokady nerwowo-mięśniowej
1. Obniżanie amplitudy kolejnych skurczów.
2. Zanikanie podczas stymulacji ciągłej (tężcowej).
3. Stosunek < 0,7 po bodźcu poczwórnym.
4. Brak drgań pęczkowych.
5. Antagonistyczne działanie środków antycholinesterazowych.
6. Zasilanie przez inne niedepolaryzujące środki zwiotczające.
Działanie uboczne sukcynylocholiny
1. Bradykardia (zwłaszcza u dzieci, u dorosłych częściej po drugiej dawce).
2. Odczyny uczuleniowe.
3. Drgania pęczkowe.
4. Bóle mięśniowe (nie jest pewne, czy tylko jako skutek drgań pęczkowych).
5. Zwiększenie ciśnienia śródżołądkowego (równoważone przez jeszcze znaczniejszy
wzrost siły skurczu dolnego zwieracza przełyku).
6. Zwiększenie ciśnienia śródgałkowego (nie zawsze łagodzone metodami
farmakologicznymi).
7. Zwiększenie ciśnienia śródczaszkowego.
28
Anestezjologia
8. Przejściowy wzrost stężenia potasu w osoczu (zwykle o 0,5–1,0 mEq/l, ale nasilany
przez zabiegi połączone z odnerwieniem, oparzenia i rozległe urazy).
9. Wyzwalanie nadcieplności złośliwej (wczesnym objawem może być skurcz żwaczy).
Zastosowanie kliniczne
Głównym wskazaniem do podania SCh jest umożliwienie intubacji dotchawiczej
(1–1,5 mg/kg c.c. dożylnie). Dzieci są nieco bardziej oporne na działanie SCh niż osoby
dorosłe i zaleca się u nich podawanie większych dawek (prekuraryzacja nie jest konieczna
u dzieci poniżej 10 roku życia, ponieważ rzadko dochodzi u nich do drżeń mięśniowych).
Środki niedepolaryzujące
Działanie na złącze nerwowo-mięśniowe — niedepolaryzujące środki blokujące złącze
nerwowo-mięśniowe ulegają związaniu z receptorami postsynaptycznymi (muszą się
związać z jedną z podjednostek alfa) w sposób współzawodniczący (kornpetycyjny), co
prowadzi do blokady nerwowo-mięśniowej. Nadmiar ACh, do jakiego dochodzi po podaniu
środka antycholinesterazowego, może przesunąć równowagę w kierunku przywrócenia
przenoszenia nerwowo-mięśniowego.
Tabela 10. Typowe dane farmakokinetyczne dla niedepolaryzujących środków zwiotczających
Objętość dystrybucji
(1 l/kg c.c.)
Klirens
(ml/kg c.c./min)
Okres eliminacji
połowicznej (min)
d-Tubokuraryna
0,3–0,6
1–3
90–350
Metokuryna
0,4
1,3
220
Pankuronium
0,3
1–2
100–130
Ooksikurium
0,2
2,5
95
Pipekuronium
0,3
2,4
140
Atrakurium
0,2
5,5
20
Wekuronium
0,4
4,5
110
Miwakurium
0,2
75
2,2
Rokuronium
0,3
4,0
130
Odmienności farmakokinetyczne, stwierdzane na podstawie pomiaru stężenia
niedepolaryzujących środków zwiotczających w osoczu, zależą od podanej dawki.
Wszystkie niedepolaryzujące środki zwiotczające cechują się objętością dystrybucji, która
jest w przybliżeniu równa objętości płynu pozakomórkowego.
29
Anestezjologia
Początek i czas działania
Aczkolwiek szczytowe stężenie niedepolaryzujących środków zwiotczających w osoczu
występuje w ciągu 1–2 min po wstrzyknięciu, wystąpienie maksymalnej blokady osiąga
się dopiero po upływie 5–7 min, co zależy od pojemności minutowej serca, odległości
mięśni szkieletowych od serca i przepływu krwi przez ten mięsień.
Tabela 11. Porównawcze dane farmakologiczne niedepolaryzujących środków zwiotczających
ED
95
(mg/kg c.c.)
Początek
działania (min)
Współczynnik
ustępowania
(min)
T90
(min)
d-Tubokuraryna
0,51
6
25–35
70–90
Metokuryna
0,28
5
30–40
80–90
Pankuronium
0,07
5–7
25
60
Doksakurium
0,025
10–14
–
80–100
Pipekuronium
0,05–0,06
5–6
30–40
80–90
Atrakurium
0,2
5–6
10–15
30
Wekuronium
0,05
5–6
10–15
30
Miwakurium
0,08
3–6
6–8
25
Rokuronium
0,3
3–4
10–15
30
Interakcje lekowe
Interakcje lekowe dotyczące środków zwiotczających
1. Lotne środki anestetyczne — zależna od dawki potencjalizacja wszystkich środków
zwiotczających.
2. Środki znieczulenia miejscowego — potencjalizują działanie wszystkich środków
zwiotczających.
3. Niedepolaryzujące środki zwiotczające — zależnie od zestawienia występuje
działanie addycyjne lub synergiczne.
4. Środki zwiotczające niedepolaryzujące i depolaryzujące — odpowiedź zależy od
sekwencji ich podania. Środek niedepolaryzujący zastosowany przed SCh osłabia
blokadę depolaryzacyjną, natomiast zastosowany po SCh — potencjalizuje ją.
5. Antybiotyki — aminoglikozydy i polimyksyny potencjalizują działanie środków
zwiotczających.
6. Środki przeciwdrgawkowe — powodują oporność na niedepolaryzujące środki
zwiotczające.
30

Anestezjologia
Antagonizowanie blokady nerwowo-mięśniowej
Farmakologia środków antycholinesterazowych
Zasada farmakologiczna wzmaganego lekowo antagonizmu w stosunku do środków
zwiotczających polega na osłabianiu wpływu leków działających na zasadzie
współzawodniczenia, gdy zwiększa się stężenie ACh w złączu nerwowo-mięśniowym.
Hamowanie acetylocholinesterazy przez środki antycholinesterazowe (neostygmina,
edrofonium, pirydostygmina) prowadzi do zwiększenia ilości ACh, docierającej do
receptora.
Środki antycholinesterazowe mogą też wywierać działanie presynaptyczne.
Farmakokinetyka środków antycholinesterazowych zależy od klirensu nerkowego.
Farmakodynamika — czas od początku działania edrofonium do efektu szczytowego
(1–2 min) jest znacznie krótszy niż dla neostygminy (7–11 min) lub pirydostygminy.
Powrót aktywności nerwowo-mięśniowej jest wyrazem spontanicznego ustępowania
działania wzmacnianego (przyspieszanego) pod wpływem środków
antycholinesterazowych.
Rekuraryzacja jest mało prawdopodobna, dopóki czas działania środka
antycholinesterazowego jest dłuższy niż środka zwiotczającego.
Czynniki wpływające na powrót funkcji
Dawka wybranego środka antycholinesterazowego i czas do skutecznego ustąpienia
zwiotczenia jest wprost proporcjonalny do intensywności blokady w chwili podjęcia
działań odwracających ją.
Przy intensywnej blokadzie nerwowo-mięśniowej neostygmina okazuje się skuteczniejsza
niż edrofonium lub pirydostygmina. Ze względu na zjawisko pułapu nie ma wielu zalet
zwiększania dawki neostygminy ponad 0,07 mg/kg c.c.
Przywracanie aktywności nerwowo-mięśniowej jest szybsze po małych dawkach środków
antycholinesterazowych podanych niemowlętom i dzieciom niż u osób dorosłych.
Działanie na układ krążenia
Środki antycholinesterazowe powodują silne drażnienie układu przywspółczulnego, czemu
można zapobiec, podając równocześnie lek antycholinergiczny.
31

Anestezjologia
Po podaniu środków antycholinesterazowych występuje ślinotok, zwiększenie perystaltyki
jelit (co może mieć znaczenie po wykonanym zespoleniu jelitowym), nudności i wymioty.
Dawkowanie:
Neostygnina — 0,04 mg/kg c.c.,
Edrofonium — 0,25 mg/kg c.c.
32

Anestezjologia
5. Postępowanie w chorobach towarzyszących
Choroby towarzyszące wymagają szczególnego postępowania w okresie przed operacją
i w czasie jej trwania. Wymagana jest ścisła współpraca anestezjologa i chirurga oraz
konsultantów z innych dziedzin. Dotyczy to:
1) chorób układu krążenia,
2) chorób układu oddechowego,
3) chorób wątroby,
4) chorób nerek,
5) zaburzeń gospodarki wodno-elektrolitowej oraz równowagi kwasowo-zasadowej,
6) zaburzeń hormonalnych,
7) chorób układu nerwowego,
8) zaburzeń krzepnięcia krwi.
1. Choroby układu krążenia
Ocena przedoperacyjna
Choroby układu krążenia, zależnie od stopnia ciężkości, zwiększają znacznie ryzyko
związane ze znieczuleniem i operacją. Najgroźniejsze dla życia powikłania ze strony
układu krążenia to:
⎯ zawał mięśnia sercowego,
⎯ niewydolność serca lub obrzęk płuc wywołany przyczyną związaną z sercem,
⎯ wstrząs kardiogenny,
⎯ zaburzenia rytmu serca, przede wszystkim częstoskurcze komorowe,
⎯ zatorowość płucna,
⎯ nagła śmierć sercowa.
Mogą wystąpić również inne istotne powikłania, takie jak:
⎯ nadciśnienie tętnicze,
⎯ hipotonia,
⎯ zaburzenia rytmu serca.
W tych wypadkach z reguły koniecznością jest wykonanie przed znieczuleniem konsultacji
kardiologicznej, która sugeruje sposób znieczulenia, stosowanie w okresie
okołooperacyjnym metod nadzoru oraz leków.
Przydatne są również skale oceny pacjenta, takie jak klasyfikacja NYHA — polega to na
ocenie stanu serca i wynikającego z niego rokowania. Stan serca oceniany jest na
33
Anestezjologia
podstawie ogólnej oceny przyczyn, zmian anatomicznych i patofizjologii schorzenia
układu krążenia.
Klasyfikacja NYHA
Klasa I — choroba serca nieograniczająca sprawności fizycznej.
Klasa II — choroba serca ograniczająca sprawność fizyczną w niewielkim stopniu; bez
dolegliwości spoczynku. Zwykły wysiłek wywołuje uczucie zmęczenia, kołatanie serca,
duszność lub ból dławicowy. Rokowanie jest dobre po podjęciu leczenia.
Klasa III — choroba serca ograniczająca sprawność fizyczną w znacznym stopniu, bez
dolegliwości spoczynku; niewielki spoczynek fizyczny. Wywołuje uczucie zmęczenia,
kołatanie serca, duszność i ból dławicowy. Rokowanie jest dobre po podjęciu leczenia.
Klasa IV — choroba serca uniemożliwiająca prowadzenie zwykłej aktywności fizycznej.
Objawy niewydolności serca lub dławica piersiowa występują w spoczynku. Każdy stopień
aktywności fizycznej nasila dolegliwości. Rokowanie —mimo leczenia — jest wątpliwe.
Wskaźnik ryzyka krążeniowego
Jest to wskaźnik opracowany przez Goldmana, określający ryzyko operacyjne
u pacjentów z chorobami serca, którzy mają zostać poddani operacji niezwiązanej
z chirurgią serca.
Tabela 12. Skala Goldmana
Wskaźnik ryzyka krążeniowego wg Goldmana
Kryterium Liczba
punktów
Wiek >70 rok życia
5
Zawał serca przebyty w ciągu ostatnich 6 miesięcy 10
Rytm cwałowy (III ton) lub nadmierne wypełnienie żył szyjnych
11
Istotne zwężenie zastawki aortalnej
3
Rytm pozazatokowy lub pobudzenia przedwczesne nadkomorowe
7
Pobudzenia przedwczesne komorowe >5/min
7
Zły stan ogólny lub jedno z poniższych kryteriów:
⎯ PaO
2
< 60 mmHg lub PaCO
2
> 50 mmHg,
⎯ K
+
< 3,0 lub HCO
3-
< 20 mmol/l,
⎯ mocznik > 50 mg/dl lub kreatynina > 3 mg/dl; nieprawidłowe stężenia
AspAT,
⎯ objawy przewlekłego schorzenia wątroby,
⎯ konieczność stałego leżenia w łóżku z przyczyn niekardiologicznych
3
Rodzaj zabiegu operacyjnego:
Śródotrzewnowy, klatki piersiowej, aorty
3
34

Anestezjologia
Zabieg operacyjny ze wskazań nagłych 4
Maksymalna liczba punktów
53
2. Choroby układu oddechowego
Obok chorób układu krążenia stanowią najważniejszy czynnik ryzyka powikłań
płucnych. W okresie śródoperacyjnym są przyczyną poważnych powikłań, jak
niedrożność dróg oddechowych, ciężki kurcz oskrzeli, odma opłucnowa lub obrzęk
płuc. Natomiast w okresie pooperacyjnym występuje często niedodma, zapalenie płuc
i ostra niewydolność oddechowa. Te powikłania występują szczególnie często po
operacjach klatki piersiowej oraz w jamie brzusznej. Przedoperacyjną diagnostykę
pulmonologiczną przeprowadza się w celu rozpoznania i oceny zagrożeń oraz ustalenia
dalszego postępowania. Pooperacyjne powikłania płucne stanowią drugą pod
względem częstości występowania (po powikłaniach krążeniowych) przyczynę
śmiertelności okołooperacyjnej. Związane są z rodzajem i ciężkością układu
oddechowego, lokalizacją, czasem trwania i ciężkością operacji chirurgicznej oraz
współistniejącymi chorobami pozapłucnymi.
Klasyfikacja chorób płuc
Obturacyjne choroby płuc — charakteryzują się nieprawidłową szybkością
przepływu wydechowego. Ograniczenia przepływu mogą być strukturalne lub
czynnościowe.
Przewlekła obturacyjna choroba płuc (POChP) to utrudnienie przepływu powietrza,
które można przypisać rozedmie płuc („różowy dmuchacz” — pink puffer) lub
przewlekłemu zapaleniu oskrzeli („siny sapacz” — blue bloater).
Rozedma — polega na nieprawidłowym, trwałym powiększeniu przestrzeni
powietrznych obwodowo od oskrzelików końcowych, prowadzi do zmniejszenia
elastyczności płuc z następowym przedwczesnym zapadaniem się dróg oddechowych
przy większych niż normalnie objętościach płuc podczas wydechu.
Przewlekłe zapalenie oskrzeli — definiuje się jako występowanie kaszlu co najmniej
przez dwa miesiące w każdym z dwóch kolejnych lat u osoby, u której nadmierna
ilość wydzieliny nie jest spowodowana innymi chorobami (najczęściej czynnikiem
wyzwalającym jest palenie papierosów).
35

Anestezjologia
Astma oskrzelowa określana jest jako epizodycznie zmienne utrudnienie przepływu
przez drogi oddechowe, jest to choroba zapalna, w której złożone mediatory
komórkowe i chemiczne prowadzą do zwiększenia napięcia błony mięśniowej dróg
oddechowych, obrzęku błony śluzowej, nadmiernego wydzielania śluzu i zwiększonej
reaktywności dróg oddechowych na rozmaite bodźce, w tym oziębienie i wysuszenie
powietrza, zakażenie, leki i narażenia zawodowe.
Mukowiscydoza powoduje wydzielanie bardzo gęstego śluzu i potu o nieprawidłowym
składzie, w wyniku czego dochodzi do obturacji dróg oddechowych, zwłóknienia
i zwiększonej podatności na zakażenia. Zmiany późne obejmują powstanie rozstrzeni
oskrzeli z hipoksemią, retencją dwutlenku węgla i niewydolnością oddechową.
Mechanizm powstawania hipoksemii w chorobach obturacyjnych polega głównie na
lokalnych zaburzeniach stosunku wentylacji do perfuzji (zaburzenia stosunku V/Q).
Duszność — główny objaw — ma podłoże wieloczynnikowe, w znacznej mierze
związana jest jednak z obciążeniem mięśni oddechowych.
Restrykcyjne choroby płuc charakteryzują się zmniejszeniem podatności płuc, mogą
być zewnątrz- lub wewnątrzpochodne. Opór w drogach oddechowych jest zwykle
prawidłowy, zmniejsza się natomiast objętość płuc.
Wewnątrzpochodne
Obrzęk płuc występuje wtedy, gdy w tkance śródmiąższowej płuc i pęcherzykach
płucnych gromadzi się płyn. Mechanizm powstawania obrzęku jest hydrostatyczny,
kardiogenny (np. zastoinowa niewydolność serca) lub niekardiogenny (zespół ostrych
zaburzeń oddechowych — ARDS, poprzednio określany jako zespół zaburzeń oddychania
dorosłych). W ARDS płyn bogatobiałkowy przesiąka przez błonę podstawną włośniczek do
podścieliska i pęcherzyków. Zespół ten jest często związany z posocznicą,
zachłyśnięciem, urazem i wielokrotnymi przetoczeniami krwi.
Śródmiąższowe choroby płuc powodują zapalenie i (lub) zwłóknienie tkanki
śródmiąższowej, pęcherzyków lub łożyska naczyniowego. Zwłóknienie naczyń
krwionośnych może prowadzić do nadciśnienia płucnego i serca płucnego. Przykładowe
jednostki chorobowe to sarkoidoza, przewlekłe alergiczne zapalenie pęcherzyków
płucnych z nadwrażliwości i zwłóknienie popromienne.
Zewnątrzpochodne
Choroby opłucnej — zwłóknienie bądź wysięki.
36

Anestezjologia
Deformacje ścian klatki piersiowej — kifoskolioza, klatka szewska, zmiany pourazowe
lub blizny po oparzeniach.
Ucisk przepony u osób otyłych — występuje w przypadku wodobrzusza lub ciąży albo
z powodu założenia haków podczas zabiegu operacyjnego.
Podobnie jak w przypadku chorób obturacyjnych, pierwotną przyczyną hipoksemii
w stanach restrykcyjnych są zaburzenia stosunku V/Q (wentylacji do perfuzji). Przyczyny
zaburzeń płucnych są często różnorodne, zdarzają się także zaburzenia mieszane —
z komponentą zarówno obturacyjną, jak i restrykcyjną. Ustalenie prawidłowego
rozpoznania wymaga starannego zebrania wywiadu i badania fizykalnego. Różnicowanie
choroby obturacyjnej i restrykcyjnej umożliwiają testy czynnościowe płuc, stosowane
także do monitorowania reakcji pacjenta na znieczulenie.
37

Anestezjologia
Bibliografia
1. Anestezjologia, 2001: (red.) A. Kübler, Wydawnictwo Medyczne Urban & Partner,
Wrocław.
2. Anestezjologia i Intensywna Terapia, 1999–2004.
3. Barach P. G., Cullen B. F., Stoelting R. K., 1996: Podręcznik anestezjologii klinicznej,
PZWL, Warszawa.
4. Dobrogowski J., Wordliczek J., 2004: Medycyna bólu, PZWL, Warszawa.
5. Hurford W.E., 2003: Intensywna terapia.
6. Larsen R., 2003: Anestezjologia, Wydawnictwo Medyczne Urban & Partner, Wrocław.
7. Rybicki Z., 1994: Intensywna terapia dorosłych, Novus Orbis. Gdańsk.
38

Anestezjologia
Literatura podstawowa
1. Plantz S. H., J. N. Adler, 2000: Medycyna ratunkowa, Wydawnictwo Medyczne
Urban & Partner, Wrocław.
Literatura dodatkowa
1. Kamiński B., Dziak A., 1996: Doraźna pomoc lekarska, PZWL, Warszawa.
2. Medycyna Intensywna i Medycyna Ratunkowa, kwartalnik Urban & Partner,
1998–2004.
39
Document Outline
- Anestezjologia
Wyszukiwarka
Podobne podstrony:
1 modulid 9465 Nieznany (2)
ModulIII cz3 kompleksy i osady Nieznany
ModulIII cz3 kompleksy i osady Nieznany
Gor±czka o nieznanej etiologii
02 VIC 10 Days Cumulative A D O Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
45 sekundowa prezentacja w 4 ro Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
Mechanika Plynow Lab, Sitka Pro Nieznany
katechezy MB id 233498 Nieznany
2012 styczen OPEXid 27724 Nieznany
metro sciaga id 296943 Nieznany
Mazowieckie Studia Humanistyczn Nieznany (11)
cw 16 odpowiedzi do pytan id 1 Nieznany
perf id 354744 Nieznany
DO TEL! 5= Genetyka nadci nieni Nieznany
Opracowanie FINAL miniaturka id Nieznany
3 Podstawy fizyki polprzewodnik Nieznany (2)
więcej podobnych podstron