
Dokończenie wykładu o
roślinach GM dla st
zaocznych WOiAK

Lód nie tworzy się przypadkowo, tylko w jądrze kondensacji ,
którym mogą być poszczególne gatunki bakterii, najczęściej
Pseudomonas syringae.
Na bazie tej obserwacji powstały produkty komercyjne używane
do zapobiegania zamarzaniu:
- Frostban TN (nazwa rodzajowa bakterii nie mającej
genów
zdolności do tworzenia kryształów
lodu na liściach)
- Blightbau® zmniejszaj. zasięg zarazy ogniowej (fire
blight), konkurencja do E. amylovora przez
P. fluorescens
.
- Snomax® wytwarzający śnieg przy -3 C zamiast -10 C
Bakterie INA+ (ice nucleating active) stanowią ca. 1% populacji
lub mniej, chociaż wartość ta może się znacznie różnić zależnie
od miejsca i pory roku. Kompleks białkowy powoduje tworzenie
kryształów lodu nieco poniżej temperatury zamarzania, co
uszkadza rośliny lub powoduje ich śmierć w temperaturze w
której w sytuacji inne przeżywają.
Bakterie transgeniczne w kontroli zamarzania
u truskawki i ziemniaka (Acta Hortic. 2000;
179-189)
ich podstawowymi zaletami są:
- zwiększone plonowanie
-
zmniejszone zużycie środków chemicznych
-
zmniejszone zanieczyszczenie gleby i
środowiska
- oddziaływanie prozdrowotne w wyniku
zmniejszonej zawartości pestycydów i/lub toksyn
[Vasil J., Plant Biotechnology 2002 and beyond; Kluwer
Publ.]
Pierwsza generacja (1995-2005)
transgenicznych odmian roślin
uprawnych
Odporność na herbicydy
Odporność na owady
Odporność na wirusy
W wytwarzaniu tych odmian dokonał się duży
postęp. Wiele z nich jest obecnie sprawdzanych w
doświadczeniach polowych i badaniach klinicznych.
Odmiany te dadzą konsumentom dużo korzyści
bezpośrednich.
[Vasil J., Plant Biotechnology 2002 and beyond; Kluwer
Publ.]
Druga generacja (2005-2015)
transgenicznych odmian roślin
uprawnych
Odporność na herbicydy, szkodniki i patogeny;
tolerancja na suszę, zasolenie, metale ciężkie i
temperaturę; poprawiona wartość odżywcza (białka,
tłuszcze, witaminy, składniki mineralne); poprawiona
zdolność przechowalnicza owoców i warzyw; poprawiony
smak i zapach; eliminacja alergenów; szczepionki, białka
dla medycyny ludzkiej; farmaceutyki; fitoremediacja
Zakończenie sekwencjonowania genomów Arabidopsis i ryżu;
sekwencjonowanie innych (Brassica, Lotus, kukurydza, Medicago,
topola, jęczmień, pszenica, pomidor, ziemniak, soja, sosna) jest
zaawansowane. Syntenia odkryta w genomach zbóż ułatwi
znalezienie ważnych genów. Odkrycie i charakterystyka genów
Karłowatości/Zielonej Rewolucji (jak Rht u pszenicy, sd u ryżu i
niewrażliwości na GA) umożliwi wysokie plonowanie przez
manipulowanie
relacjami
owoc/nasiona/wielkość/liczebność.
Ostatnio wykazano, że wprowadzenie kilku genów głównych
biorących udział w fotosyntezie typu C4 z kukurydzy do ryżu
znacząco zwiększyło wydajność fotosyntezy i liczbę nasion oraz
zwiększyło tolerancję na stres.
Trzecia generacja transgenicznych
roślin uprawnych (2015 i później).
Sekwencjonowanie genomu/hodowla molekularna.
Zmiana architektury rośliny; kształtowanie czasu
kwitnienia, jakości, wielkości, oraz liczby owoców i
nasion; poprawa wydajności fotosyntetycznej i
przyswajania składników pokarmowych;
wykorzystanie heterozji i apomiksji.
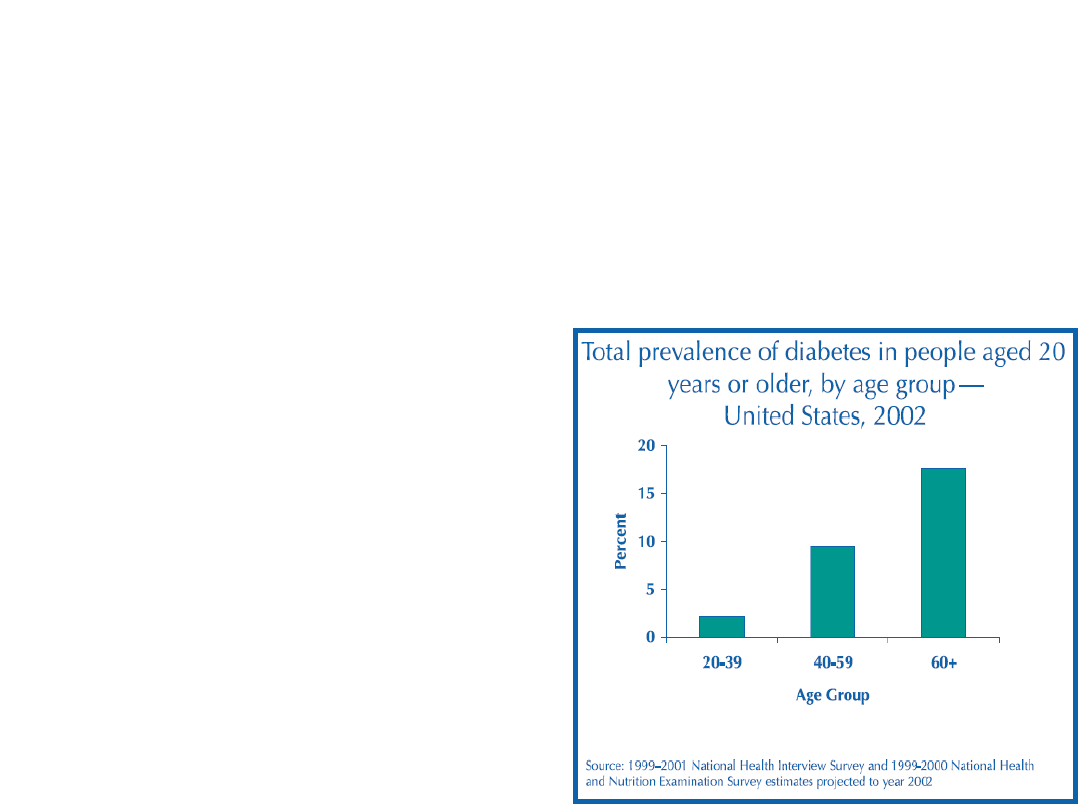
WHO szacuje, że liczba
chorych na świecie wzrośnie
z 177 mln (2004) do ponad
330 mln (w 2030).
Niektóre dane dotyczące
Niektóre dane dotyczące
cukrzycy
cukrzycy
Koszty wynikające z tego
schorzenia (USA, 2002)
• ogólne (bezpośrednie i
pośrednie):
$
132 mld
• bezpośrednie koszty medyczne:
$ 92 mld
• koszty pośrednie: $ 40 mld
(niedyspozycja,
utrata pracy, przedwczesna
śmierć)
[National Health Interviev Survey
and 1999-2000 National Health
and Nutrition Survey]

Frederick Banting
Chronologia
1922 Banting i Best użyli insulinę wolową
do człowieka
1923 Eli Lilly wyprodukował komercyjne
ilości insuliny wołowej
1926 Nordisk uzyskało wyłączność do
produkcji insuliny w Danii jako działalność
non profit
1946 Nordisk tworzy Isophane® insulinę
wieprzową Neutral Protamine Hagedorn
czy insulinę NPH
1950 Nordisk komercjalizuje insulinę NPH
1953 Novo tworzy insuliny wieprzowe i
wołowe Lente® przez dodanie cynku dla
przedłużonego działania insuliny
1973 Wprowadzenie czystego
monokpomponentu (MC) insuliny
INSULIN
INSULIN
A
A
–
–
od wczoraj do dzisiaj
od wczoraj do dzisiaj
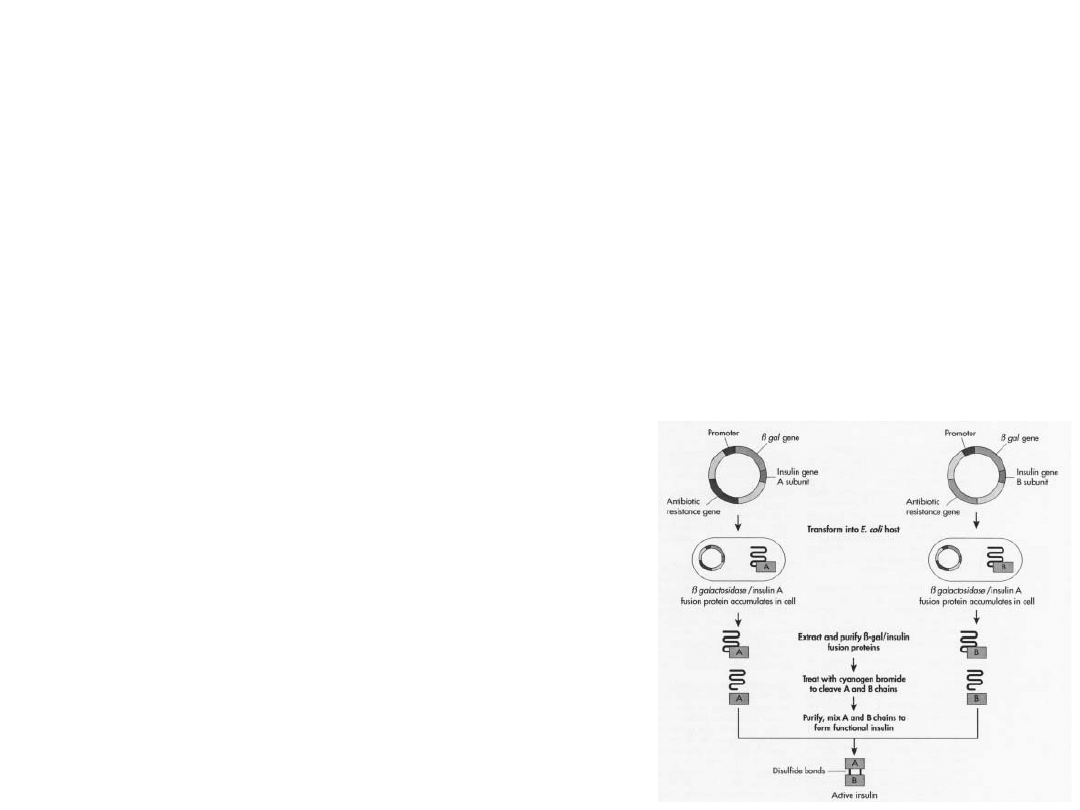
Chronologia –
zastosowanie
konstrukcji genetycznych
1978 Genentech wytwarza
insulinę
ludzką w bakterii Escheria coli używając
modyfikacji genetycznej
1982 Dopuszczenie insuliny ludzkiej
Genentech
1983 Eli Lilly produkuje insulinę ludzką
Humulin® z modyfikacji genetycznej
1985 Axel Ullrich sekwencjonuje
receptor insuliny ludzkiej
1996 Lilly Humalog® "lyspro" ulepszone
wersje insuliny
2004 Dopuszczenie analoga insuliny
"glargine" Aventis Lantus®
2001
Wprowadzenie na rynek w Polsce
„Gensuliny” przez firmę Bioton
INSULIN
INSULIN
A
A
–
–
od wczoraj do dzisiaj
od wczoraj do dzisiaj

BIOREA
BIOREA
K
K
TOR
TOR
Y
Y
O OBJĘTOŚCI
O OBJĘTOŚCI
PONAD
PONAD
160 000 L
160 000 L
PORÓWNANIE EFEKTYWNOSCI PRODUKCJI W BIOREAKTORACH
FIRMY „Bioton” :
Proces inicjacji- bioreaktor o objętości 5 l
Wzrost skali - bioreaktor o objętości 150 l
150 l kultury wystarcza na zainicjowanie produkcji w 2-3
bioreaktorach o objętości 1500 l, co daje 1 kg of insuliny surowej

Efekty ekonomiczne i społeczne
wprowadzenia na rynek w Polsce
rekombinowanej insuliny ludzkiej
przez firmę „Bioton” S.A.
• Oszczędności budżetu państwa w
refundacji leków 131 mln/rocznie (od
2004r)
• Pozytywny wpływ na bilans płatniczy
państwa
• Przychody budżetu państwa z tytułu
podatków
• Nowe miejsca pracy
• Zapotrzebowanie rynku insuliny w Polsce
ca. 400 mln PLN/rocznie

Carthamus tinctorius
Carthamus tinctorius
-
-
produkuje
produkuje
insulinę
insulinę
Krokosz barwierski ma kilka zalet technologicznych stawianych
roślinom wytwarzającym farmaceutyki
Jadalna szczepionka – dla Trzeciego Świata
Wytwarzanie insuliny w krokoszu pozwoli na zmniejszenie kosztów
produkcji insuliny o 70% oraz redukcję kosztów preparatu o 40%
Ta technologia wytwarzania insuliny będzie wymagała ca 80 mln $
kapitału inwestycyjnego na wyprodukowanie 1,000 kg insuliny
Insulina produkowana obecnie
wymaga
250
mln
$
kapitału
inwestycyjnego
dla
zdolności
produkcyjnej 1,000 kg
łatwość w zwiększaniu skali
produkcji przez dobieranie areału
uprawy oznacza, że ten sposób
wytwarzania insuliny ma istotne
zalety

INSULINA WYTWARZANA PRZEZ
INSULINA WYTWARZANA PRZEZ
KROKOSZ BARWIERSKI
KROKOSZ BARWIERSKI
c.d.
c.d.
SemBioSys – komercyjna
produkcja insuliny w krokoszu jest
pod względem chemicznym, strukturalnym i funkcjonalnym
równocenna z wymogami US dla insuliny zwierzęcej
Badania kliniczne - prawdopodobnie w końcu 2007 lub na
początku 2008
Insulina produkowana przez krokosz powinna się znaleźć na
rynku na początku 2010.
Insulina w genetycznie zmodyfikowanym krokoszu jest
gromadzona w nasionach
Podstawą produkcji są typowe zasady uprawy z
uwzględnieniem integralności produkcji izolacji
Insulina produkowana przez krokosz powinna uzupełnić
zwiększające się zapotrzebowanie na ten produkt oraz
zredukować
koszty
wytwarzania
w
porównaniu
z
dotychczasowymi

Biofarming
• Nowa gałąź produkcji rolniczej
polegająca na pozyskiwaniu z roślin GM
specyfików na potrzeby profilaktyki,
terapii i przemysłu farmaceutycznego
• Wysoki reżim technologiczny oraz
kontrola jakości na wszystkich etapach
oraz specjalna infrastruktura w zakresie
obrotu, składowania i dystrybucji

Wątpliwości ogólne podnoszone w
dyskusji nad stosowaniem odmian
GM w rolnictwie
• filozoficzne
– czy manipulowanie genami
polegająca na ingerowaniu w informacje
genetyczną nie narusza naturalnego porządku
rzeczy;
• technologiczne
– czy geny pochodzące z bardzo
oddalonych taksonów mogą funkcjonować w
roślinach nie oddziałując na inne ważne cechy;
• ekologiczne
– czy odporność na szkodniki nie
spowoduje wzrostu ich zjadliwości;
• środowiskowe
– czy zmiany w zapisie
genetycznym roślin uprawnych nie spowodują
zagrożenia dla środowiska za sprawą efektów
niekontrolowanych i niezamierzonych;

Wątpliwości ogólne podnoszone w
dyskusji nad stosowaniem odmian
GM w rolnictwie c.d.
• ekonomiczne
– obawa, aby firmy
biotechnologiczne kontrolując jednocześnie w
materiał nasienny i środki ochrony roślin nie
zbudowały niebezpiecznie monopolistycznej
pozycji w produkcji żywności;
• polityczne
– czy innowacyjność
technologiczna powinna podlegać
demokratycznej kontroli;
• osobiste
– czy konsumpcja żywności GM
stanowi zagrożenie dla mojego zdrowia.

Zalety produkcji białek
rekombinowanych w roślinach:
• pozyskiwanie materiału na szeroką skalę przy niskich
kosztach produkcji
• niższe koszty od technologii przemysłowych wykorzystujące
fermentację lub inne systemy bioreaktorowe
• duża łatwość zwiększania skali
• występowanie eukariotycznych szlaków biosyntezy białek,
pozwalające na uzyskanie prawidłowego produktu
białkowego,
• minimalizacja zanieczyszczenia białek toksynami lub
patogenami ludzkimi takimi jak wirus HIV czy wirus żółtaczki
• etap oczyszczania rekombinowanych białek w niektórych
przypadkach może być pominięty; tkanki roślinne mogą być
wykorzystane jako jadalne szczepionki
• możliwość skierowania białek do określonych przedziałów
wewnątrzkomórkowych np. chloroplastów, gdzie mają
większą stabilność
• ilość rekombinowanych białek syntetyzowanych przez
rośliny stwarza możliwość ich produkcji na masową,
przemysłową skalę.

Niektóre stwierdzenia ogólne
dotyczące historii odmian GM
• Dynamiczny rozwój upraw transgenicznych w
ostatnim dziesięcioleciu świadczy o tym, że
opłacalność jest faktem. Z pewnością
producenci nowych jakościowo odmian
odnotowali korzyści, natomiast ci, którzy
utracili rynek - ponieśli straty.
• Również oczywista wydaje się ocena, że
biotechnologia przyczynia się do pogłębienia
procesów globalizacyjnych.
• W ocenie wpływów na środowisko można z
całą stanowczością stwierdzić, że do dzisiaj
nie ma udokumentowanych efektów
negatywnych.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
Dokonczenie wykladu z dnia0
Rośliny przyprawowe wykłady, ROŚLINY PRZYPRAWOWE I LECZNICZE
WYKLAD 7 ROSLINY, biologia, fizjologia roślin
wykład 1 rośliny ozdobne
PROPEDAUTYKA ROLNICTWA dokończenie wykładu z dnia 24
rosliny ozdobne wykłady, Rośliny ozdobne
entomologia wykłady!!!!!!!!!!!!!!!!!!!!!1, Rośliny - Ogrodnictwo, entomologia
Innowacje dokończenie wykładu 2
dokonczenie wykladu org.usług.w.gastr.z 06.02.2011, GWSH, organizacja usług w gastronomii
dokończenie wykładu 1
Rośliny przyprawowe i lecznicze WYKŁADY, ROŚLINY PRZYPRAWOWE I LECZNICZE
Wykład8 morfogeneza roślin
Fizjologia roślin wykłady, Biologia, fizjologia roślin
hodowla kolos - wyklady, sem. 4, Hodowla roślin
wykład 6 fizj roślin, biologia, fizjologia roślin
wyklad 4 fizj roślin, biologia, fizjologia roślin
Wykład 3 ZATRUCIA ROŚLINAMI I GRZYBAMI
więcej podobnych podstron