
Oczyszczanie enzymów

CHROMATOGRAFIA
Michaił Siemionowicz Cwiet / na rysunku obok/
rosyjski botanik i chemik pracował na początku
XX wieku na Uniwersytecie Warszawskim, a
później na Politechnice Warszawskiej, i właśnie tu
w 1905 roku opracował metodę rozdziału
substancji chemicznych, którą nazwał
CHROMATOGRAFIĄ. Cwiet uzyskał rozdzielenie
pigmentów roślinnych, w tym chlorofilu,
wyodrębniając je na podstawie ich różnych barw
(z greckiego chromatos = kolor). Dzisiaj termin
chromatografia używany jest do opisania
wszystkich procesów, w których rozdzielenie
mieszaniny substancji na poszczególne składniki
następuje w wyniku różnej prędkości ich migracji.

Typy chromatografii stosowane w
biotechnologii enzymatycznej:
Chromatografia żelowa /zwana również filtracją żelową,
chromatografią rozmiarów wykluczających, czy sączeniem
molekularnym/ – rozdział następuje w wyniku różnicy w rozmiarach
cząsteczek enzymu
Chromatografia jonowymienna – rozdział następuje w wyniku
różnicy w ładunku wypadkowym odmiennych cząsteczek enzymu
Chromatografia powinowactwa – rozdział następuje w wyniku różnic
powinowactwa enzymów do specyficznych grup chemicznych
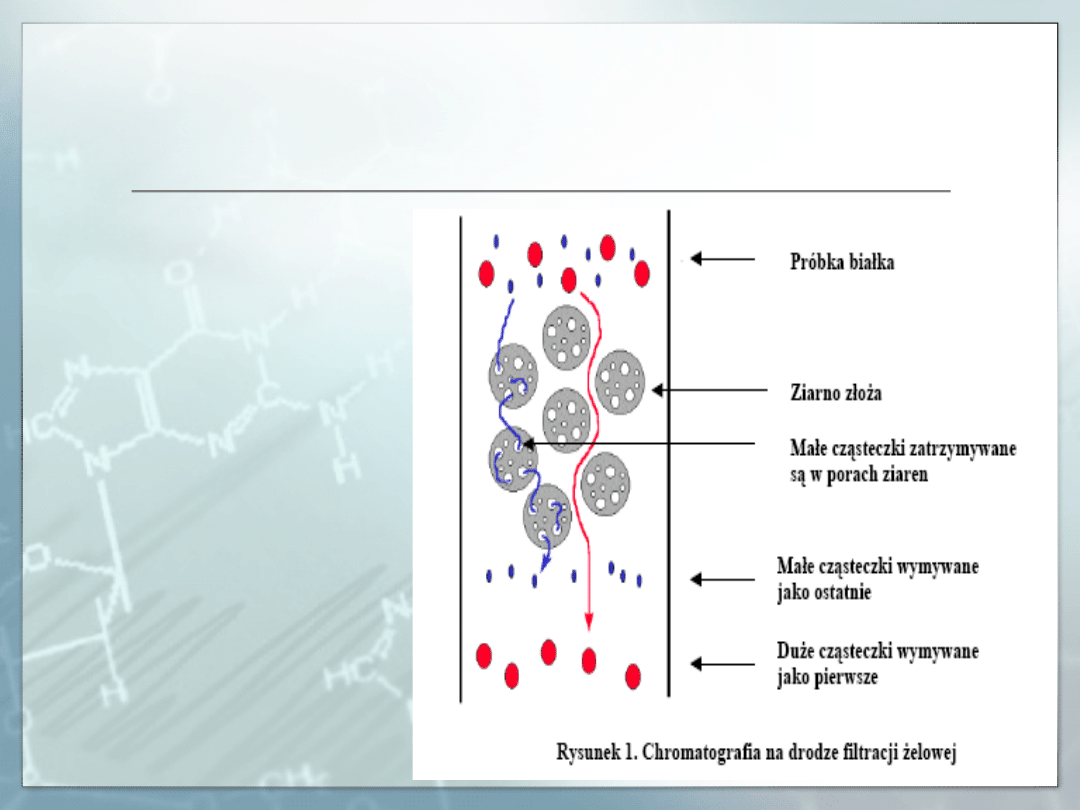
Chromatografia na drodze filtracji żelowej.
W filtracji żelowej:
Kryterium rozdziału
makrocząsteczek jest
ich wielkość;
Większe cząsteczki
wymywane są z
kolumny jako pierwsze;
Mniejsze cząsteczki
wymywane są z
kolumny jako ostatnie.

Ważne pojęcia:
Eluent – rozpuszczalnik stosowany do wymywania (elucji)
składników mieszaniny z kolumny chromatograficznej;
Eluat – roztwór wypływający z kolumny chromatograficznej,
czyli eluent wraz z rozpuszczonymi w nim składnikami
rozdzielanej chromatograficznie mieszaniny.
Wypełnienia do filtracji żelowej różnią stopniem usieciowania,
co prowadzi do odmiennej porowatości, a co za tym idzie, innego
zakresu działania dla różnych objętościowo enzymów.
Do najbardziej popularnych i odpowiadających szerokiemu
zakresowi
działania należą wypełnienia o nazwach handlowych:
Sephadex – dekstran poprzecznie sieciowany z epichlorohydryną
w warunkach alkalicznych;
Sephacryl – allilodekstran sieciowany N,N’ -
metylenobisakrylamidem

Przykłady wypełnień do filtracji żelowej
:
Nazwa handlowa
(producent)
Rodzaj wypełnienia
Zakres M
cz
(Da)
Biogel (Bio-Rad)
Ultrogele (LKB)
Fractogel (Merck)
Sephadex
(Pharmacia)
Sepharose
(Pharmacia)
Sephacryl
(Pharmacia)
Glycophase (Pierce)
poliakrylamid (typ P)
agaroza (typ A)
agaroza/poliakrylamid
agaroza
polimery winylowe
(różne rodzaje)
dekstran (różne
rodzaje)
agaroza
sieciowana agaroza
sefakryl/ bisakrylamid
powierzchnia
z modyfikowanego szkła
100 – 400 000
1 000 – 150 x 10
6
60 000 – 1,3 x
10
6
25 000 – 20 x 10
6
100 – 50 x 10
6
50 – 600 000
10 000 – 40 x 10
6
10 000 – 40 x 10
6
5 000 – 1 x 10
6
1 000 – 350 000
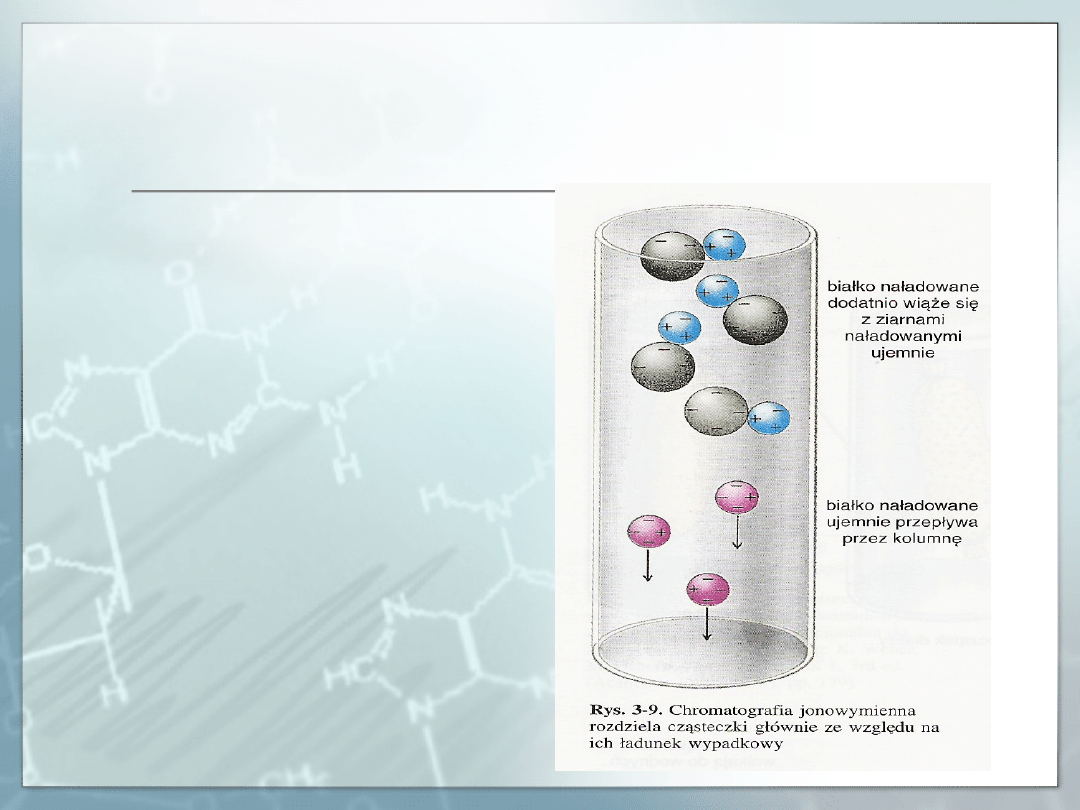
Chromatografia jonowymienna.
W chromatografii
jonowymiennej:
Kryterium rozdziału jest
ładunek wypadkowy
odmiennych cząstek
enzymów
Wyróżniamy kolumny
anionitowe (wymieniacze
anionów) i kationitowe
(wymieniacze kationów)
Kationity najczęściej
zawierają grupy – SO
3
H, –
COOH, – OH, – PO
3
H
2
Anionity zawierają grupy
NH
3+
Cl
-
oraz (-CH
2
-N
+
(CH
3
)
3
-
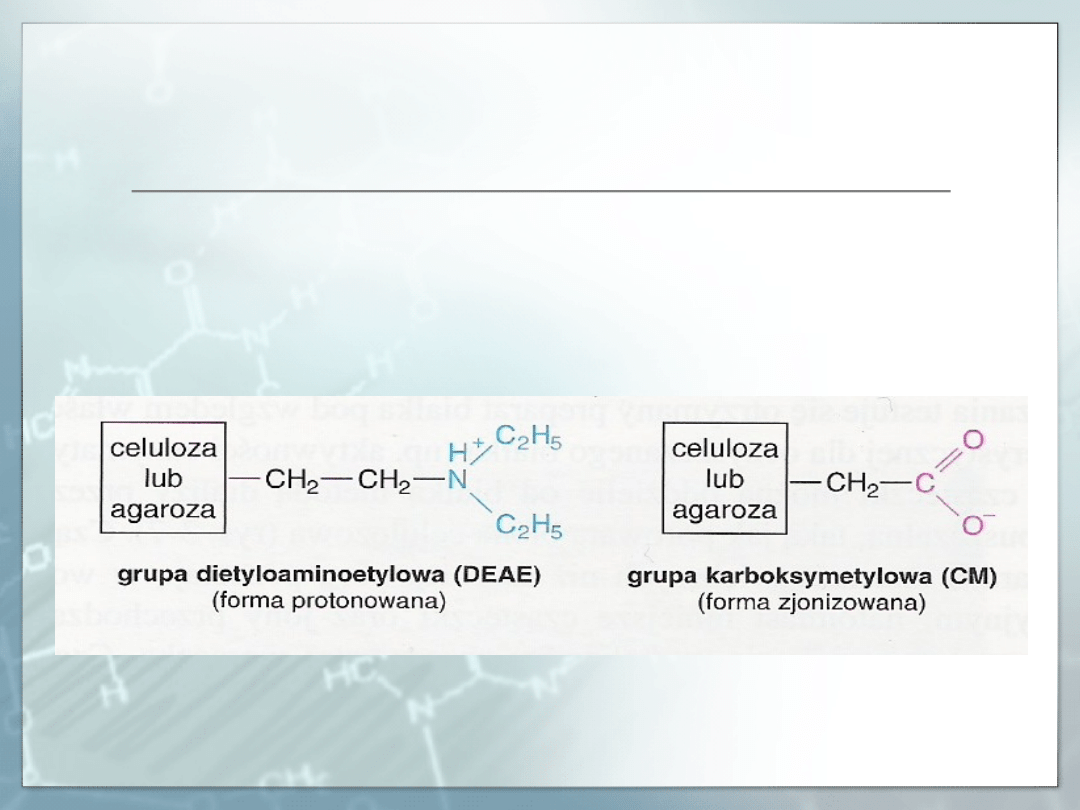
☺Białka naładowane ujemnie (białka anionowe) można rozdzielać
chromatograficznie na kolumnach wypełnionych dodatnio
naładowaną dietyloamnioetylocelulozą (DEAE-celulozą).
☺Białka naładowane dodatnio można rozdzielać na kolumnie z
ujemnie naładowaną karboksymetylocelulozą (CM-celulozą).
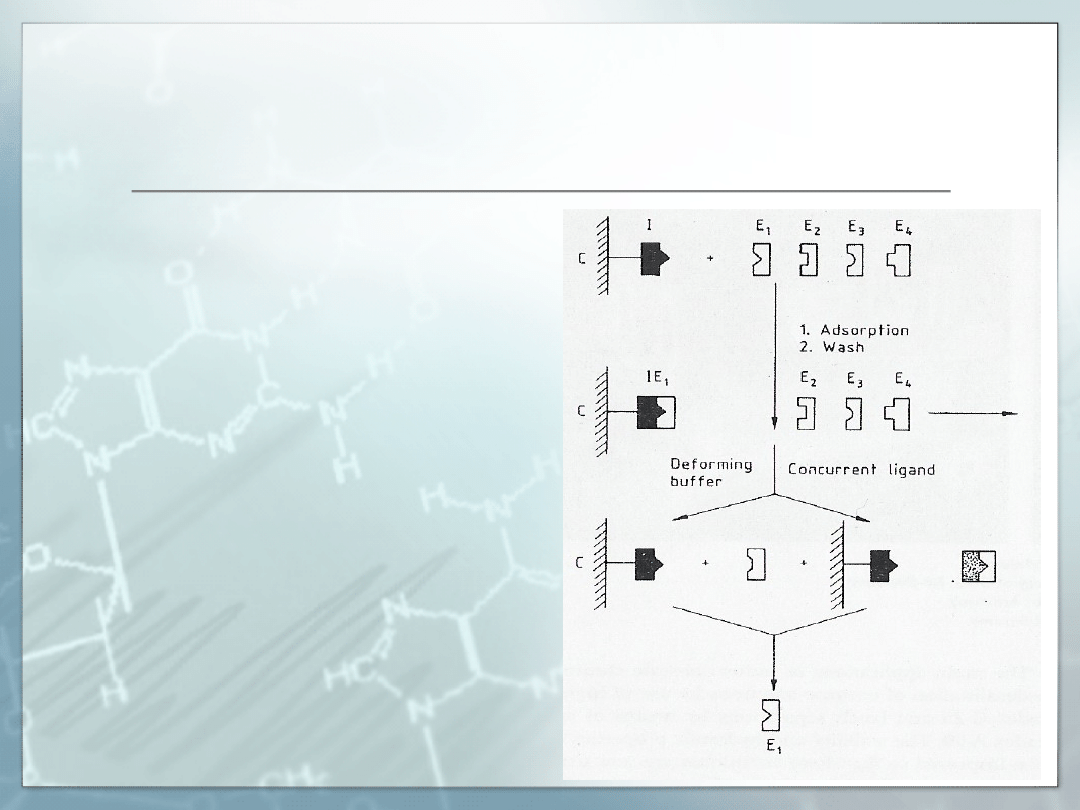
Chromatografia powinowactwa
.
W chromatografii powinowactwa:
Oczyszczany enzym jest specyficznie i
odwracalnie adsorbowany na efektorze
połączonym z nierozpuszczalną matrycą
Efektorami mogą być:
Analogi substratów
Inhibitory enzymów
Barwniki
Chelaty metali
Przeciwciała
K R Y S T A L I Z A C J A
K R Y S T A L I Z A C J A

Nagroda Nobla w dziedzinie chemii
James Summer (USA)
Hohn Northrop (USA)
Wendell Stanley (USA)
Otrzymywanie czystych enzymów i krystalizacja enzymów
Otrzymywanie czystych enzymów i krystalizacja enzymów

jedna z najdawniej stosowanych technologii oczyszczania
produktu, była kiedyś w stanie całkowicie zaspokoić
zapotrzebowania producentów i odbiorców
teoria i historia krystalizacji białek jest dobrze
udokumentowana już od ponad 100 lat
do substancji o małej masie, czyli do małych, globularnych
białek

Cele procesu krystalizacji
tworzy warunki do określenia struktury krystalograficznej
(morfologicznej) enzymu
służy uzyskiwaniu gotowego enzymu jako produktu
handlowego na rynku
umożliwia również świadome, planowe projektowanie
nowych leków

Metody krystalizacji enzymów
masowa (wielkoskalowa) fermentacja
agregacja pod wpływem soli

masowa (wielkoskalowa) fermentacja
izomeraza glukozy
subtylizyna
oksydaza alkoholowa
celulaza
Przykłady enzymów poddawanych
procesowi krystalizacji właśnie tą metodą
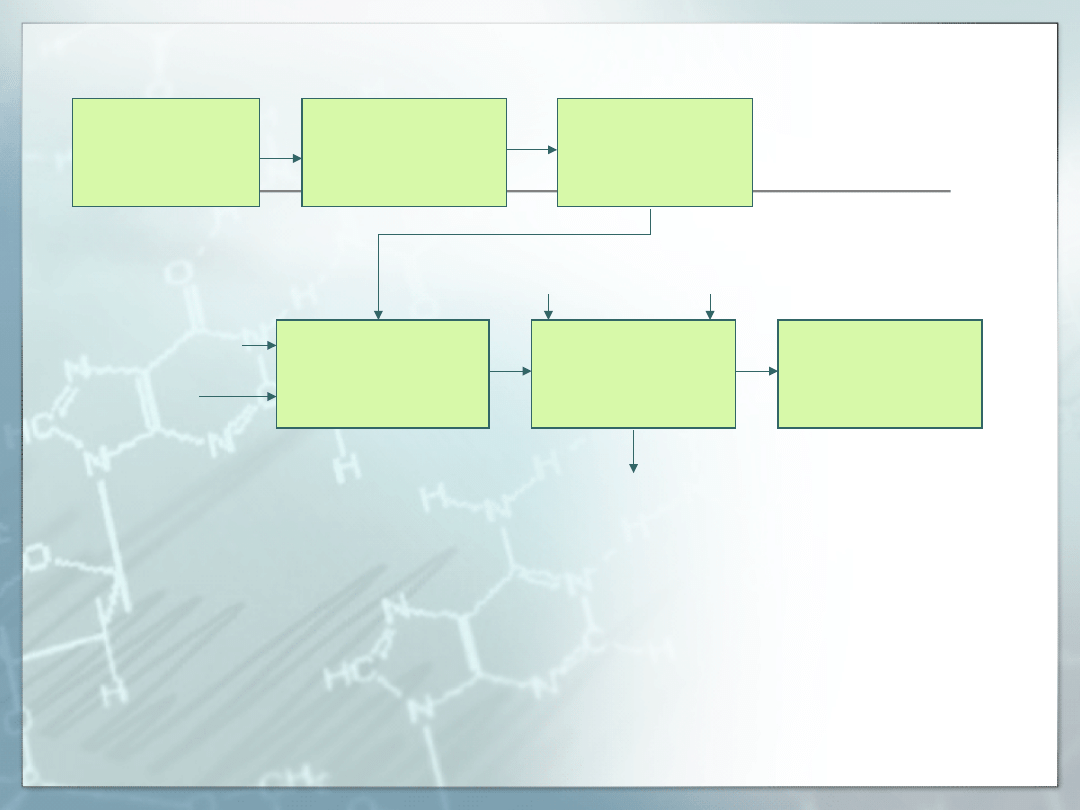
fermentac
ja
separacja
komórek
ultrafiltra
cja
zatężanie
krystalizacj
a
kryształ
zaszczepiając
y
sól
prasa
filtracyjna
produkt
końcowy
woda do
przemywania rozpuszczalnik
ług odpadkowy
Etapy procesu krystalizacji jednego z
enzymów używanych w przemyśle

Warunki podczas krystalizacji
enzymu na przemysłową
skalę
czystość produktu
korzystna wydajność procesu
łatwość uzyskiwania kryształów enzymów
możliwie najkrótszy czas trwania procesu
W rezultacie otrzymujemy kryształ enzymu o
regularnych kształtach, rozmiarze i żądanej
morfologii.

Czynniki mające wpływ na
proces krystalizacji enzymów
stopień zasolenia
stężenie
wartość pH
temperatura
ciągle zmieniająca się obecność domieszek
i zanieczyszczeń różnego typu
mieszanie
obecność zarodków krystalizacji
Kontrola podczas całości
trwania procesu poprzez
środek strącający taki jak np. sól
temperatura
wartość pH
Enzymy tj. m.in. celulaza
oraz subtylizyna były już
sprawdzane w krystalizacji
w warunkach wyższego
tempa wzrostu
temperatury
.
Zarysowywuje się tutaj
znaczny wpływ
temperatury prowadzenia
procesu na otrzymywanie
konkretnej morfologii
danego kryształu.
Zmiana warunków krystalizacji podczas
trwania tegoż procesu, prowadzi do wzrostu
kryształu, osiągając jego przeróżne formy
morfologiczne

S u b t y l i z y n a
bioaktywny enzym typu proteaz
(enzymy z grupy hydrolaz, które
dokonują hydrolizy wiązań
peptydowych) o skutecznym działaniu
keratolitycznym
stabilizowana z wykorzystaniem
nowoczesnych technik krystalizacji jest
odporna na rozkład hydrolityczny
dzięki specjalnemu, skomplikowanemu
procesowi (krystalizacji i pokrywania),
enzym ulega stabilizacji, umieszczony
w zapewniającym wilgoć środowisku
żelowym, pozostaje nieaktywny. Z
chwilą nałożenia żelu na skórę,
odzyskuje aktywność i rozpuszcza
materiał organiczny zalegający między
martwymi komórkami skórnymi
.

agregacja pod wpływem soli
(*)
(*)
Badania naukowe dla Ministerstwa Nauki i Informatyzacji (W-wa), prowadzone przez
Instytut Chemii Fizycznej PAN (W-wa), „Kalorymetryczne badania odddzływań białek z
elektrolitami” r.2004.
podanie termodynamicznej charakterystyki procesu wsalania
(salting-in) i wysalania (salting-out), dla białek (lizozym,
albumina) przy użyciu jedno- i dwuwartościowych soli.
wyznaczenie entalpii wsalania tych białek przy różnych
stężeniach stosowanych soli
wyznaczenie stałe równowagi
określenie zależności liczby miejsc wiążących jony na
powierzchni badanego białka, od stężenia soli
określenie stężenie białek i różnych jonów (Na
+
, K
+
, Li
+
, NH
4+
,
Mg
2+
, Cl
-
, SO
42-
), charakterystyczne dla rozpoczęcia procesu
agregacji

podanie korelację tych danych z szeregiem Hofmeistera
określenie entalpowych współczynników oddziaływań
McMillana-Mayera charakterystyczne dla procesu wsalania
jak i wysalania (lizozym-sól, lizozym-lizozym)
wskazanie zgodnie przebieg zmian entalpii wysalania i
pozornych molowych objętości wraz ze zmianą stężenia
stosowanych soli
w kinetycznych badaniach przy użyciu metody rozpraszania
światła (Dynamic Light Scattering) NMR, wskazano istnienie
zależności procesu aglomeracji białek od czasu
Są to pierwsze przeprowadzone w tak szerokim
zakresie badania termodynamiczne procesów
wsalania i wysalania małych, globularnych białek.

Bazy danych zawierające informacje dotyczące
warunków krystalizacji białek
Crystal TB (Online Bio Database)
http://www.fqs.pl/?a=product_view&id=41

Chemiczna analiza procesu oczyszczania
enzymu,
KONTROLA PROCESU OCZYSZCZANIA
Masa cząsteczkowa –
Elektroforeza na żelu,
pozwala na ocenę
mobilności mieszaniny w
zależności od ciężaru
cząsteczkowego (pH>7)
Western Blotting –
Prowadzona również
elektroforeza, ale do
wizualizacji są
wykorzystywane
przeciwciała (udział
kofaktorów)

E L E K T R O F O R E Z A
E L E K T R O F O R E Z A

Cele procesu elektroforezy
służy do izolacji oczyszczonych enzymów w skali
laboratoryjnej
Wykorzystywane procedury
elektroforeza strefowa
izotachoforeza
porowatość gradientowa
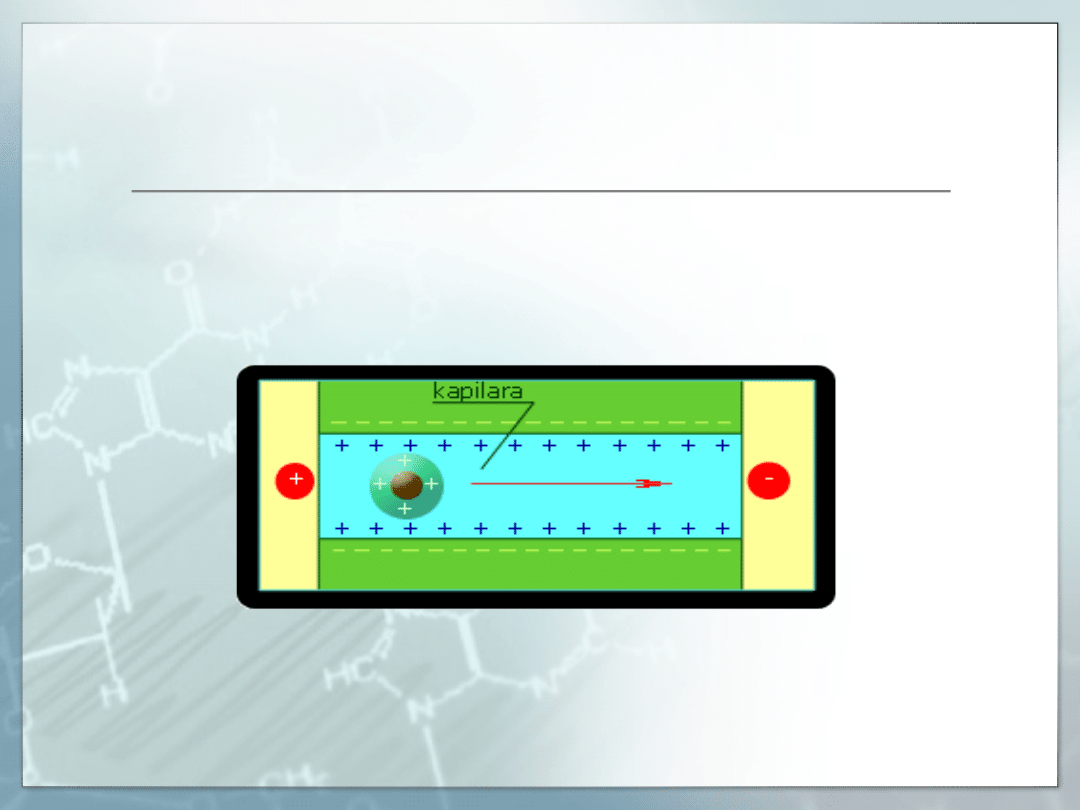
Proces elektroforezy

elektroforeza strefowa
Strefowa elektroforeza kapilarna (ang. CZE) to najprostsza i
najczęściej stosowana technika w której mechanizm
separacji opiera się na różnicy w stosunku ładunku do
masy cząsteczek. Stosowania najczęściej do protein,
peptydów i leków.

izotachoforeza
Podstatawowa różnica pomiędzy elektroforeza kapilarną a
izotachoforezą, tkwi w sposobie realizacji rozdzielania
substancji w polu elektrycznym.
W elektroforezie strefowej stosowany
jest jeden elektrolit wypełniający cały układ analityczny, zaś
w izotachoforezie wykorzystuje się różne układy buforowe.

M E T O D Y
M E T O D Y
M E M B R A N O W E
M E M B R A N O W E

Selektywne membrany
zagęszczanie mleka,
serwatki, soków owocowych
i warzywnych
oczyszczanie i zagęszczanie
koncentratów białek, np. jaj
oczyszczanie i zagęszczanie
preparatów po ultrafiltracji
(produkcja enzymów,
antybiotyków, koncentratów
białek)
koncentracja i oczyszczanie
enzymów, antybiotyków
Zastosowania metod
membranowych
do odsalania roztworu
Wykorzystywane techniki
Diafiltracja
–
– stężenie zanieczyszczeń spada dzięki filtracji
wody
Dializa
–
– zanieczyszczenia na zasadzie dyfuzji przenikają do
czystego rozpuszczalnika jakim jest woda
Elektroliza
–
– wykorzystuje ruchy jonów w polu elektrycznym

F O R M U Ł O W A N I E
F O R M U Ł O W A N I E
P R O D U K T U
P R O D U K T U

Unikanie i zminimalizowanie
strat aktywności enzymu,
podczas
transportu
przechowywania
użytkowania danego preparatu enzymatycznego

Polepszanie stabilności poprzez
przeciwdziałanie głównym
przyczynom dezaktywacji
enzymów
denaturacja
proteoliza

Unikanie dezaktywacji poprzez
dodanie odwracalnego inhibitora
unikanie warunków utleniających
unikanie obecności aktywnych gatunków
( org. mikrobiologicznych) z gotowego preparatu
enzymatycznego

Produkt powinien być
zabezpieczony przed
kontaminacją, poprzez
unikanie powstawania osadów lub formowaniu się mgiełek
(zamgleń)
minimalizacja powstawania drobinek pyłu lub aerozoli
optymalizacja kryteriów estetycznych, takich jak kolor i
zapach
Procesy używane do usunięcia
domieszek i nieczystości
odpowiedzialnych za m.in.
wytrącanie osadów
diafiltracja
adsorpcja
chromatografia
krystalizacja
ekstrakcja

Procesy produkcji najbardziej
odpornych na ścieranie granulek
zaawansowane ścinanie powierzchni granulek do bardziej
gładkiej
pokrywanie sprayem złoża zawiesinowego

Unieszkodliwianie odpadów
Pozostałości po procesach oczyszczania muszą być wcześniej
unieszkodliwiane, chemicznie lub termicznie dezaktywowane, aby
zapewnić pewną sytuację iż żywe mikroorganizmy nie dostaną się
do środowiska, co może spowodować ich niebezpieczne
gromadzenie się.

B i b l i o g r a f i a
B i b l i o g r a f i a
1.
Enzymes in industry. Production and
Applications; Wolfgang Aehle; WILEY-VCH 2004
2.
Enzyme Biotechnology ; Alan Wiseman ; ELIS
HORWOOD LTD. 1975
3.
Biochemia ; Lubert Stryer ; PWN 1999 r.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
Wyklady z oczyszczalni, Studia Inżynieria Środowiska, Oczyszczanie ścieków
Wykład 6 Zastosowanie enzymów
PYTANIA Z WYKŁADU OCZYSZCZANIE WODY
Wykład 3 Wytwarzanie enzymów
opracowanie - scieki, PWr, IS, Oczszczanie ścieków, Wykład oczyszczanie ścieków
wykład 5 oczyszczanie gazów
wykład 8 Oczyszczanie ścieków,ETAP 2 złoża biologiczne
Rewelacyjne opracowanie wszystkich zagadnień, PWr, IS, Oczszczanie ścieków, Wykład oczyszczanie ście
wyklad 1 oczyszczony[1]
wyklad 6 oczyszczony[1]
wyklad 5 oczyszczony[1]
hydraulika reaktorów, Inżynieria Środowiska, Przydomowe oczyszczalnie ścieków, projekt, Przydomowe o
Enzymologia wykłady ściąga
EnzymologiaTZ wyklad 4
Wyklad 1 z enzymologii, Studia, Przetwórstwo mięsa - Semestr 1, Enzymologia, Wykłady
więcej podobnych podstron