Wykład XV
Inżynieria genetyczna

Inżynieria genetyczna
Pod tym pojęciem rozumie się zabiegi
prowadzące do powstania nowych,
dziedzicznych właściwości organizmu.

Polegają na wprowadzeniu do komórek
biorcy ściśle określonych fragmentów
DNA (heterologicznych = obcych) w celu
wywołania trwałej zmiany w cechach
biorcy.
W tym celu inżynieria genetyczna stosuje
rekombinacje i klonowanie, a które
znalazły wiele zastosowań praktycznych
w biologii i medycynie i często zabiegi te
określa się również jako biotechnologia.

Rozwój genetyki molekularnej oraz
inżynierii genetycznej spowodował,
że bariery powstałe w wyniku
milionów lat ewolucji,
uniemożliwiające swobodne
krzyżowanie się pomiędzy
gatunkami zostały przełamane.
Stało się możliwe przenoszenie
genów z organizmów
eukariotycznych do
prokariotycznych, ze zwierząt do
roślin, od człowieka do bakterii, itd.

KLONOWANIE DNA
W klasycznym ujęciu klon rozumiemy jako
potomstwo 1 komórki z podziału
mitotycznego, ale w inżynierii genetycznej
i biotechnologii znaczy również populacje
identycznych odcinków DNA, czyli
powielone fragmenty DNA.
Klonowanie DNA może odbywać się na
dwóch poziomach:
- in vivo
- in vitro

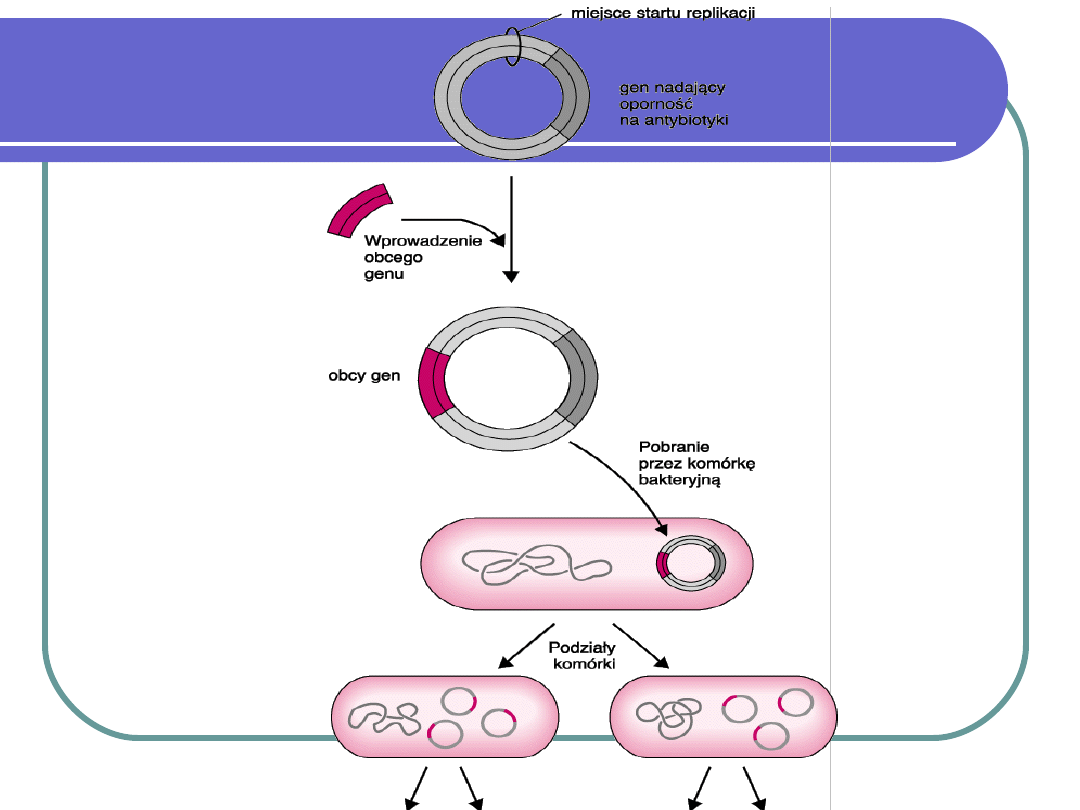
Klonowanie DNA in vivo
polega na wprowadzeniu wybranego
odcinka DNA do szybko dzielących
się komórek, aby jednak nie uległo
ono lizie konstruuje się wektory
(„czysty DNA” zostałby rozłożony w
komórce biorcy).
Nośnikiem transgenu mogą być
cząsteczki DNA lub RNA
bakteriofagów lub DNA plazmidowy.
WEKTORY – DNA plazmidów lub
DNA i RNA wirusów + DNA
heterologiczmny. Bakteriofagi jak i
plazmidy mają właściwość
osłabiania ściany
i błony komórkowej w celu
uczynienia jej przepuszczalnej dla
cząstek DNA bakteriofagowego i
plazmidowego.
Wektor

wektory
-wektory bakteryjne – plazmidowe,
klonowanie fragmentów do 10 kpz
-wektory wirusowe: DNA fagów
(najczęściej są to fagi lambda – bardzo
wydajne gdyż można pakować w nie
duże odcinki DNA, do 18 - 25 kpz);
retrowirusy –RTV; adenowirusy – ADV
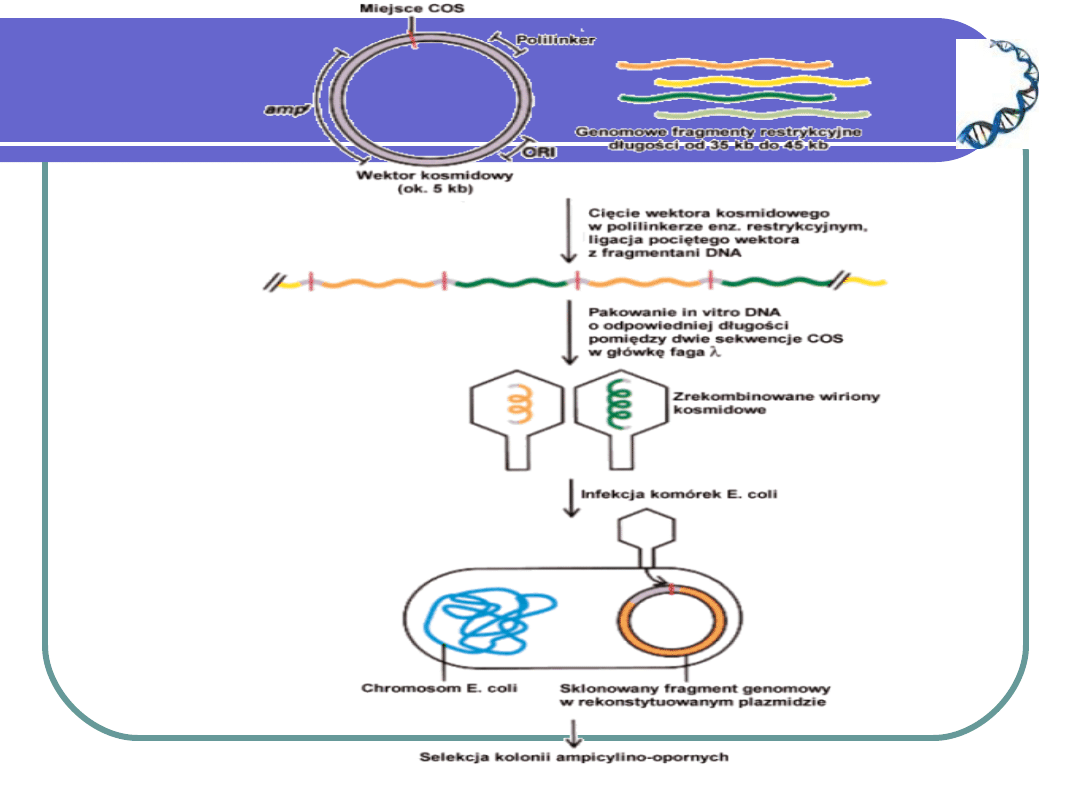
- kosmidy: plazmid bakteryjny +
sekwencja cos faga lambda (35-45 kpz)

WEKTORY ADENOWIRUSOWE
WEKTORY ADENOWIRUSOWE – ADV infekują
szeroki zakres komórek, w tym także komórki nie
dzielące się; nie integrują się z genomem
gospodarza; uzyskuje się wysoki poziom ekspresji
wprowadzanego genu, ale krótkotrwały.
WEKTORY RETROWIRUSOWE
WEKTORY RETROWIRUSOWE – RTV wbudowują
się w genom, stąd uzyskujemy długotrwałą
ekspresję transgenu, jednak integracja z
genomem może być przypadkowa, co wiąże się z
możliwością mutacji inercyjnych; wektory RTV
można wprowadzać tylko do komórek dzielących
się (błona jądrowa uniemożliwia integrację).

FAGI LAMBDA
– to najczęściej stosowane w inżynierii genetycznej
fagowe wektory. W całości fag ten nie nadaje się na
wektor gdyż posiada zbyt wiele miejsc
restrykcyjnych, dlatego też wycina się ok. 30% jego
genomu, natomiast pozostawia się sekwencje cos.
Fagi lambda posiadają cząsteczki DNA o długości
ok. 50 kpz, zawierają ok. 40 genów w cząsteczce,
budowa cząsteczki – liniowa, na końcach sekwencje
cos – 12-sto nukleotydowe, jednoniciowe, lepkie
końce wzajemnie komplementarne – dlatego u
bakterii fagi te stają się koliste. Właściwości te
wykorzystuje się przy konstrukcji tzw. kosmidów.
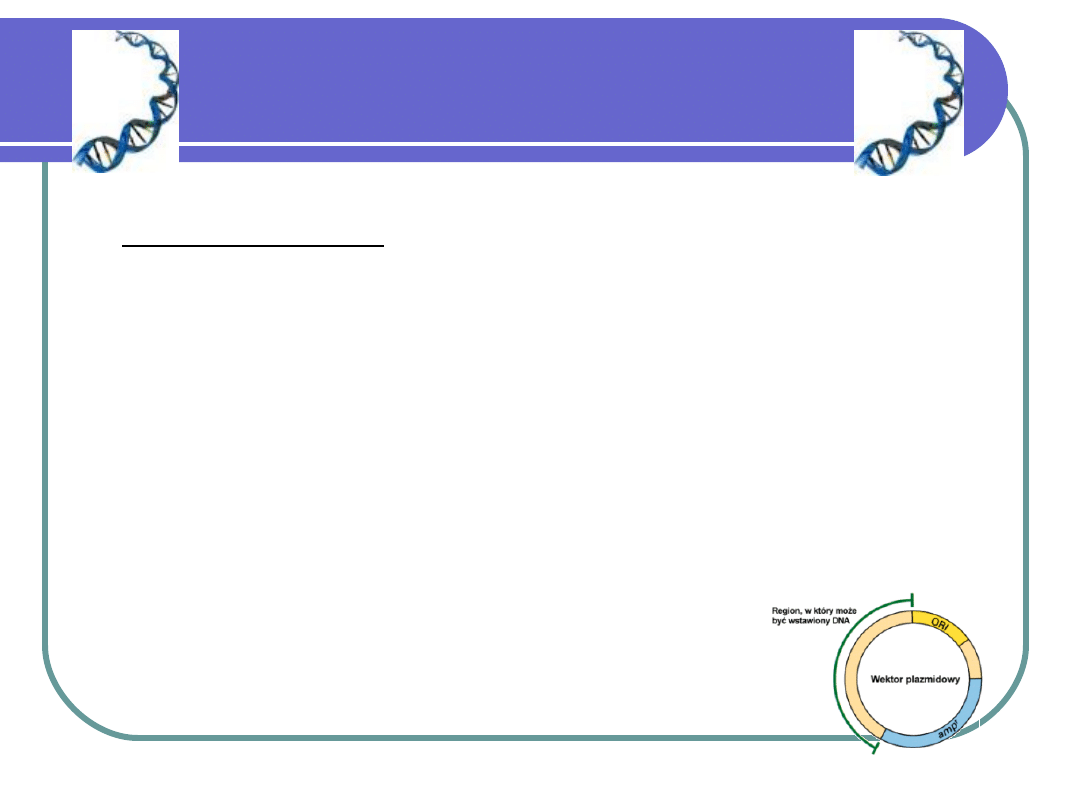
Prawidłowo skonstruowany
wektor powinien posiadać:
Sekwencje odpowiedzialne za inicjację
replikacji (tzw. ori)
Markery – geny odpowiedzialne za łatwo
wyróżnialne cechy fenotypowe (np.
oporność na antybiotyk, zdolność syntezy
określonego enzymu, zdolność świecenia
w odpowiednich warunkach) – geny te
nazywamy też genami reporterowymi
Polilinkery - odcinki DNA zawierające
sekwencje rozpoznawane przez różne
rodzaje restryktaz, co pozwala na łączenie
z wektorem fragmentów DNA strawionego
różnymi enzymami

Konstrukcja wektorów
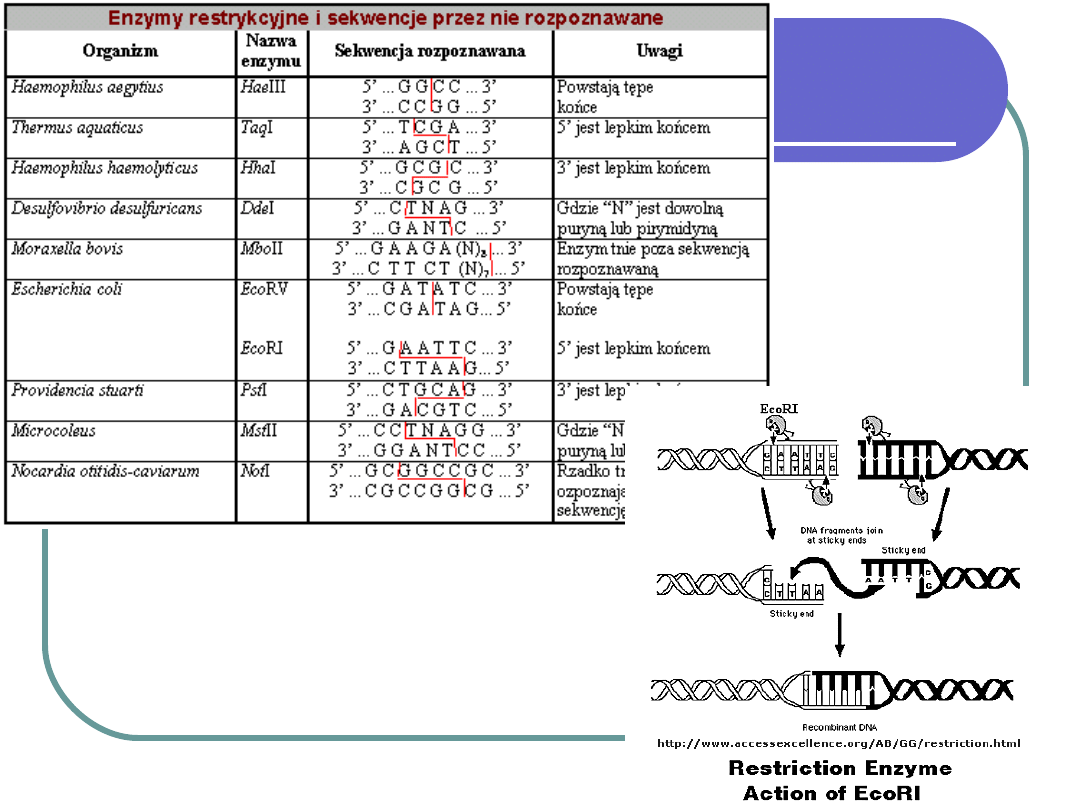
Konieczne narzędzie to enzymy
restrykcyjne = endonukleazy restrykcyjne
= restryktazy → pozwalają wyizolować
pożądany fragment DNA;
restryktazy przecinają cząsteczkę DNA w
obrębie rozpoznanej sekwencji
powstają zawsze te same ilości określonych
fragmentów z danego genu;
w wyniku cięcia powstają lepkie końce (1-
no niciowe), które ligaza łączy
komplementarnie do siebie.
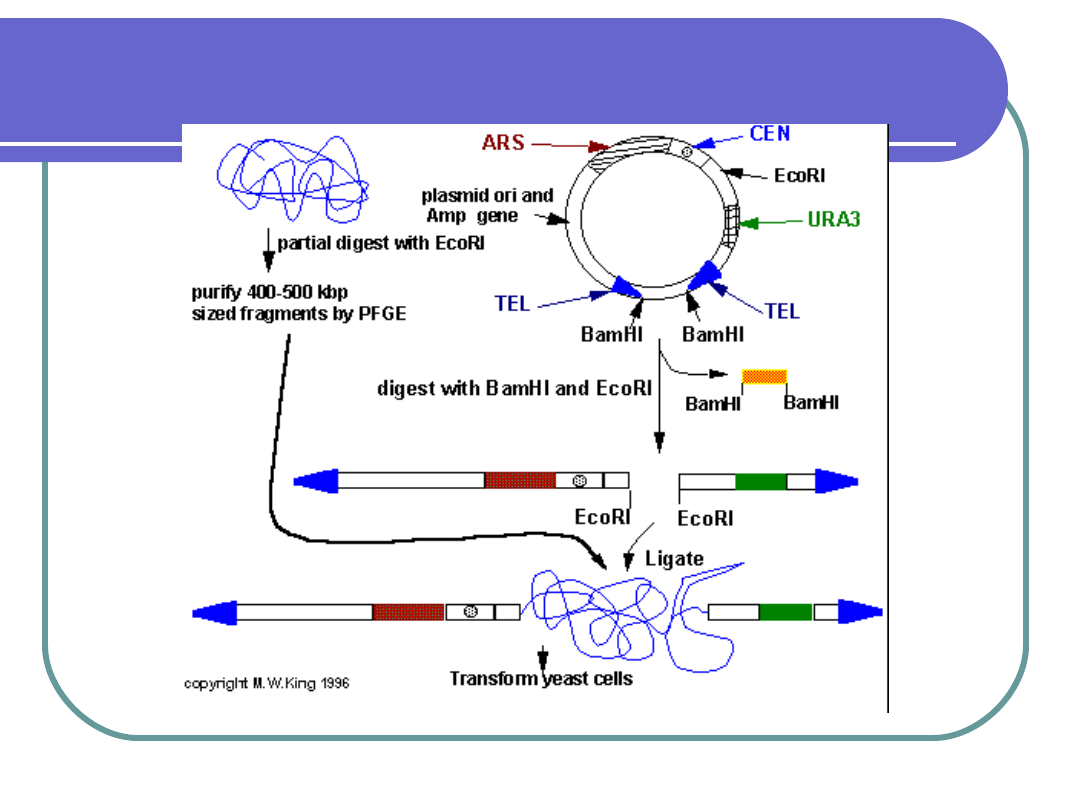
Konstrukcja wektorów

Powielanie (amplifikacja) DNA w
żywych komórkach czyli klonowanie
in vivo - wymaga czasu, musimy
uzyskać wiele pokoleń komórek,
aby osiągnąć pożądaną ilość kopii
DNA.

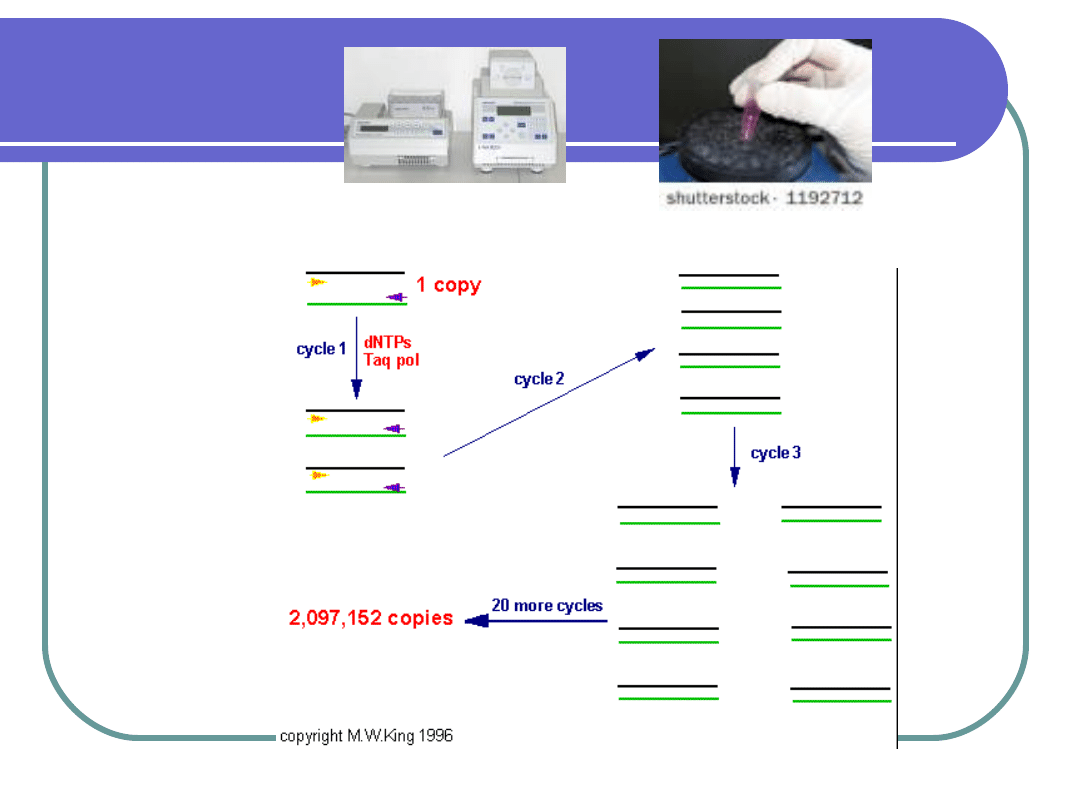
KLONOWANIE DNA IN VITRO
Jest wydajniejszą metodą, która daje
możliwość uzyskanie licznych kopii
DNA w krótkim czasie w warunkach
in vitro – w probówce.
Metoda ta to łańcuchowa reakcja
polimerazy PCR (Polymerase Chaim
Reaction)
opracowana w 1986 roku przez Kary
Mullisa, USA (Nagroda Nobla – 1993).

Łańcuchowa reakcja polimerazy
oparta jest na cyklicznych zmianach
temperatury.
PCR przeprowadza się w specjalnie
skonstruowanych aparatach, tzw.
termocyklerach.
Jest to urządzenie,
które umożliwia szybką
zmianę temperatur mieszaniny
reakcyjnej.

ETAPY AMPLIFIKACJI DNA
in vitro czyli PCR
1. Izolacja DNA
2. Oczyszczanie DNA
3. PCR:
-denaturacja DNA: wstępna i
właściwa
-przyłączanie starterów
-elongacja i elongacja
końcowa
4. Analiza produktu PCR
PCR

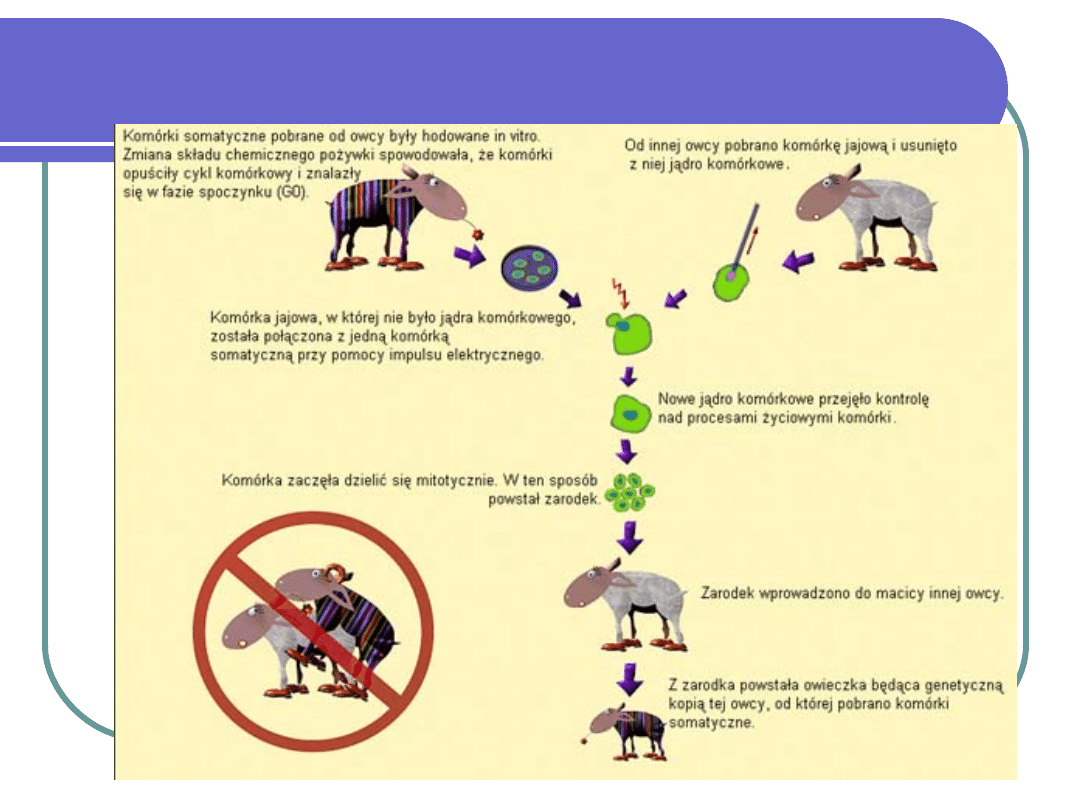
KLONOWANIE CAŁYCH
ORGANIZMÓW
polega na wytworzeniu kopii całego
organizmu wielokomórkowego na podstawie
materiału genetycznego znajdującego się w
DNA pojedynczej komórki somatycznej.
Jądro komórki somatycznej wprowadza się
do komórki, która wcześniej została
pozbawiona własnego jądra komórkowego, z
niej rozwija się zarodek, a z niego dojrzały
organizm.

W 1996 roku po raz pierwszy w
historii udało się sklonować ssaka-
owcę, którą nazwano Dolly. Do dziś
stworzono klony wielu innych
gatunków ssaków, m. in. myszy,
świń i krów.

Nie miała ojca, ale za to aż trzy
matki.
Jedna dała materiał genetyczny, druga -
komórkę jajową (a dokładniej - samą
cytoplazmę bez jądra), trzecia nosiła Dolly w
macicy, jako tzw. matka zastepcza.
"Główna matka", dawczyni materiału
genetycznego (uzyskanego z wymienia) w
chwili urodzenia się Dolly od dawna już nie żyła.
Imię zawdzięcza Dolly Parton,
amerykańskiej piosenkarce o
obfitym biuście.
Jak sklonowano owcę Dolly?

DOLLY STARA OD URODZENIA - 1999
rok
dokładne badania wykazały, że komórki
Dolly są starsze niż ona sama – o całe
sześć lat! Dlaczego?
Wiek komórki wyznaczają telomery
Pierwowzór Dolly, owca rasy Finn Dorset
miała 6 lat w momencie, kiedy pobierano
od niej komórkę do sklonowania.
To właśnie dlatego Dolly w momencie
urodzenia miała sześć lat.

DOLLY – WIERNA KOPIA MATKI?
(1999 rok)
W jądrze komórki znajduje się ok. 99,9%
informacji genetycznej, pozostałe 0,1% znajduje
się w mitochondriach.
Jaką informację genetyczną i od kogo zawierały
komórki Dolly?
OWCA 1 – rasy Finn Dorset – dawczyni
jądra komórkowego komórki somatycznej
(wymienia),
OWCA 2 – owca rasy Scottish Blackface-
dawczyni komórki jajowej, to jej
mitochondria znaleziono w komórkach
Dolly

CELE KLONOWANIA
ZWIERZAT
→
REPRODUKCJA (głównie powielanie
zwierząt transgenicznych)
oraz jako źródło KOMÓREK
MACIERZYSTYCH

Embrionalne komórki macierzyste
(potencjalnie mogą przekształcać się
w każdy rodzaj komórek)
w ten sposób będzie można w
przyszłości leczyć wiele
nieuleczalnych dzisiaj schorzeń,
jak choroba Alzheimera,
Parkinsona, cukrzycę, czy
uszkodzenia rdzenia kręgowego.
Przeciwnicy podkreślają problemy
etyczne jakie wiążą się z tymi
badaniami.

Istnieje potencjalna możliwość
odtworzenia przedstawicieli gatunków
zagrożonych wymarciem lub
wymarłych metodą klonowania i ich
reintrodukcja do środowiska
naturalnego
Czternaście sklonowanych świń
Sklonowane dzikie koty mają 'zwykłe'
potomstwo
Snuppy - pierwszy sklonowany pies
-
04.08.2005
16.04.2005
Mięso i mleko ze sklonowanej krowy jest b
- 12.04.2005
09.02.2005
Po raz pierwszy sklonowano owady
05.11.2004
Coraz bliżej sklonowania naczelnych
25.10.2004
Klonowanie mamuta-przywracanie gat.
wymarłych

GMO
ORGANIZMY MODYFIKOWANE
GENETYCZNIE

Organizmy zmodyfikowane
genetycznie (inaczej organizmy
transgeniczne)
to rośliny, zwierzęta i drobnoustroje
których geny zostały celowo zmienione
przez człowieka.
GMO - ORGANIZMY
DO GENOMU, KTÓRYCH WPROWADZONO
NOWY, HETEROLOGICZNY GEN,
PRZEKAZYWANY NASTĘPNYM
POKOLENIOM, ZGODNIE Z PRAWAMI
GENETYKI.

Organizmy zmodyfikowane
genetycznie (GMO)
*zawierają
wstawione
obce
geny
mogące pochodzić od nawet znacznie
odległych ewolucyjnie gatunków,
*w naturze geny te nie miałyby
możliwości wniknięcia do genomu
rośliny.
*Ogólniej, GMO to organizmy poddane
inżynierii genetycznej, w wyniku której
nastąpiły u nich takie zmiany w
genomie, jakie nie zdarzyłyby się w
wyniku rozmnażania czy rekombinacji.

Dotychczas uzyskano bardzo wiele
zmienionych genetycznie roślin, które
mogą służyć do produkcji żywności -
są to m.in. żyto, ziemniaki, buraki
cukrowe, kukurydza, pomidory, soja,
dynia, papryka, winogrona i banany,
Najwięksi producenci GMO: USA,
Kanadza, Argentyna, Brazylia, Chile,
Australia i Meksyk.

GMO to nie tylko owoce czy warzywa
-
organizmy transgeniczne lub
wytwarzane przez nie substancje
mogą stanowić także surowce do
produkcji dodatków bądź składników
żywności (maltodekstryna, lecytyna,
skrobia).
Modyfikowane rośliny mogą być także
wykorzystywane jako pasza lub jej
składnik w karmieniu trzody chlewnej
czy drobiu.

MODYFIKACJA GENOMU ROŚLIN W
CELU UZYSKANIA NOWYCH
KORZYSTNYCH CECH:
- tolerancja na herbicydy
- odporność na choroby wirusowe
- oporność na owady szkodniki
- oporność na zakażenia grzybicze
- jakość produktu

GMO
podwyższenie
trwałości
przechowywanych
podwyższenie tolerancji na zimno i
zamarzanie,
zmiana spektrum lipidów pod kątem
nasycenia kw. tłuszczowych,
zmiana proporcji cukru do skrobi w
różnych tk. roślinnych,
zmiany w składzie aminokwasów

Podwyższenie plonów
Zmniejszenie zanieczyszczenia
środowiska (herbicydami, środkami
ochrony roślin)
Podniesienie jakości produktów
Spadek cen produktów spożywczych
Tanie źródło białek
wykorzystywanych w medycynie

Metodyka transgenizacji komórek
roślinnych
Zastosowanie maja dwie metody:
bezpośrednie wprowadzenie DNA
do
protoplastów
przez
wstrzeliwanie
transformację za pośrednictwem
wektorów plazmidowych

TRANSGENIZACJA
BEZPOŚREDNIA
1. WSTRZELIWANIE DNA
wykorzystuje się w niej efekt
balistyczny przez zastosowanie
specjalnych działek, zwanych strzelbą
genetyczną, albo armatką genetyczną.
DNA przeznaczony do przeniesienia
opłaszcza się na mechanicznych
nośnikach z metali szlachetnych i
„wstrzeliwuje” do komórek
przeznaczonych do transformacji

Transformacja za pośrednictwem
wektorów plazmidowych
Agrobacterium
Do ich konstrukcji wykorzystuje się duże
plazmidy (Ti i Ri) bakterii z rodzaju
Rhizobium i
Agrobacterium (A. tumefaciens i A.
rhizogenes),
które posiadają naturalną zdolność do
wprowadzania swojego DNA do roślin.
Plazmidy te zawierają zakodowaną informację
o białkach niezbędnych do zaatakowania
rośliny.


Odporność na choroby powodowane
przez grzyby i bakterie
Odporność na grzybice i choroby
bakteryjne uzyskuje się poprzez
wprowadzenie transgenu kodującego
enzymy - hitynaza, glukanaza,
które niszczą ich ścianę komórkową.
Inny transformowany gen, koduje
osmotynę - białko wiążące się z błoną
komórkową powodując jej zniszczenie.

ROŚLINY OPORNE NA OWADY
CECHY TE OSIĄGNIĘTO
POPRZEZ:
- WPROWADZENIE GENU
KODUJĄCEGO INHIBITOR
PROTEAZ SERYNOWYCH
- WPROWADZENIE GENU
KODUJĄCEGO TOKSYNĘ
BACILLUS THURINGIENSIS
Rośliny transgeniczne
Zagrożenia:
-wbudowanie transgenów do
bakterii przewodu
pokarmowego ----- oporność na
antybiotyki
-przekazanie genu oporności na
herbicydy innym roślinom ----
katastrofa ekologiczna

-zmiana właściwości rośliny
transgenicznej poprzez
przypadkowe wbudowanie
transgenu, który uaktywni inne
geny lub je zinaktywuje
Rośliny transgeniczne są b. dobrze
przebadane, lepiej niż nowe
gatunki i odmiany nietransgeniczne
wprowadzane na
rynek

Ż
ywność GMO nie jest niezdrowa
„Według dzisiejszej wiedzy,
żywność zawierająca organizmy
genetycznie zmodyfikowane nie jest
dla zdrowia szkodliwa, ale
oczywiście wybór należy do
konsumenta”

GMO-zwierzęta
Pierwsze doniesienie o udanej próbie
transgenizacji pojawiło się w 1980r.
Była to mysz z genem wzrostu
szczura, i do tej pory służy jako
przykład doświadczenia modelowego.
Transgenizacja myszy była
przeprowadzona metodą
mikroiniekcji do przedjądrzy.

Transgenizacja zwierzat
hodowlanych
ma na celu głównie uzyskanie zwierząt o
pożądanych cechach w hodowli:
szybciej rosnące (zwiększenie masy ciała),
o wyższej wydajności mlecznej,
poprawa zdrowotności przez wprowadzenie
genów odporności lub tolerancji na
określone choroby
zastosowaniu ich do produkcji białek,
enzymów, innych substancji wykorzystanych
w przemyśle farmaceutycznym (jako
bioreaktory).

Uzyskanie szybszego wzrostu
zwierząt hodowlanych.
Modyfikacje polegające na
wprowadzeniu genów produkujących
hormon wzrostu.
W ten sposób modyfikowane były
głównie ryby: karpie, łososie, ale także
zwierzęta gospodarskie,
świnie, króliki, owce.

Produkcja białek heterologicznych o znaczeniu
terapeutycznym dla człowieka w gruczole
mlecznym zwierząt transgenicznych
Modyfikowane w tym celu są głównie krowy, kozy,
owce, gdyż pożądane białka wytwarzane są w
gruczołach mlecznych i wydzielane z mlekiem.
Produkowana jest antytrombina - ludzki enzym -
czynnik krzepliwości krwi, pozwala na kontrolę
powstawania zakrzepów,
produkcja antytrypsyny - stosowanej w leczeniu
rozedmy płuc, erytropoetyny - leczenie anemii.

Zwierzęta transgeniczne w
produkcji związków leczniczych
Króliki wykorzystywane są m.in. do
produkcji związków takich jak:
interleukina, czynnik IGF1, ludzki hormon
wzrostu, alfa-glukozydaza, czy białko C
biorące udział w krzepnięciu krwi.
Z mleka kóz uzyskuje się ludzką
antytrombinę.

Zwierzęta transgeniczne
Zagrożenia
Możliwość krzyżowania
i przekazywania transgenów
Potencjalne zaburzenie równowagi
ekosystemu i spadek bioróżnorodności
Problemy natury etycznej
Brak akceptacji społeczeństwa
dotyczącej badań na organizmach
zwierzęcych

Terapia genowa
leczenie polegające na wprowadzeniu obcego
genu do komórek.

-
Mechanizmy działania wprowadzonego
DNA mogą być następujące:
zmuszenie komórki do produkcji białka
kodowanego przez wprowadzony gen
produkcja białek potrzebnych, których w
organizmie brakuje lub występują w
niedomiarze (np. w defektach
metabolicznych, takich jak hemofilia)
produkcja białek prowadzących do
śmierci komórki (
) - potencjalne
zastosowanie do terapii
przeciwnowotworowych
hamowanie lub modulację ekspresji genów

Terapia genowa - zespół SCID (
Severe
Combined Immuno Deficiency) - ciężki
złożony niedobór immunologiczny
- to
, o sposobie dziedziczenia
recesywnym spowodowany
w
obrębie
RAG-1 lub RAG-2 (tzw.
agammoglobulinemia typu szwajcarskiego) bądź
sprzężonym z
, w którym dochodzi do
nieprawidłowego różnicowania
i braku
i
Może także występować jako cecha nabyta, niezwiązana z
predyspozycją genetyczną.
Charakteryzuje się poważnym upośledzeniem
i
z następową
podatnością za
,
i
.
Choroba nieleczona doprowadza do śmierci przed
ukończeniem 1 roku życia.
W terapii stosuje się przeszczep szpiku kostnego. Ponadto w
kilkunastu przypadkach zadziałała
.

W sierpniu
na łamach pisma Science
dr Steven A. Rosenberg z amerykańskiego
Narodowego Instytutu Raka
poinformował o 2 przypadkach czerniaka
złośliwego, które ustąpiły w 100% pod
wpływem terapii genowej,
która polegała na izolacji limf. T od chorych,
ich namnożeniu, oraz wprowadzeniu do nich
poprzez retrowirus genu umożliwiającego
rozpoznanie komórek nowotworowych.
Tak modyfikowane limfocyty T były
podawane chorym.
Pełen efekt leczniczy uzyskano jednak tylko
u 2 z 17 pacjentów poddanych temu typowi
leczenia

Terapia genowa
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
Wyszukiwarka
Podobne podstrony:
15 inzynieria genetyczna
15 16(90) Inżynieria wymagańid 16100 ppt
inżynieria genetyczna
Inzynieria genetyczna roslin i jej wykorzystanie w rolnictwie
bioetyka inzynieria genetyczna
Obliczenia cw 2, studia, materiały od roku wyżej, Inżynieria genetyczna, inżynieria
rozwi-zania, inżynieria genetyczna, inż genetyczna, Inzynieria genetyczna - zagadnienia
ZAGADNIENIA DO KOLOKWIUM 2, Genetyka, Inżynieria genetyczna
SPRAWOZDANIE Z BIOLOGII KOMÓRKI I INŻYNIERII GENETYCZNEJ I
Inżynieria genetyczna
egzamin z Genetyki i Inzynierii genetycznej
ożyhar, inżynieria genetyczna, wykład 5
Inzynieria genetyczna Sprawpzdanie VI i VII NAAASZEE
egzamin (11), pwr biotechnologia(I stopień), VI semestr, Inżynieria genetyczna - wykład, Egzamin
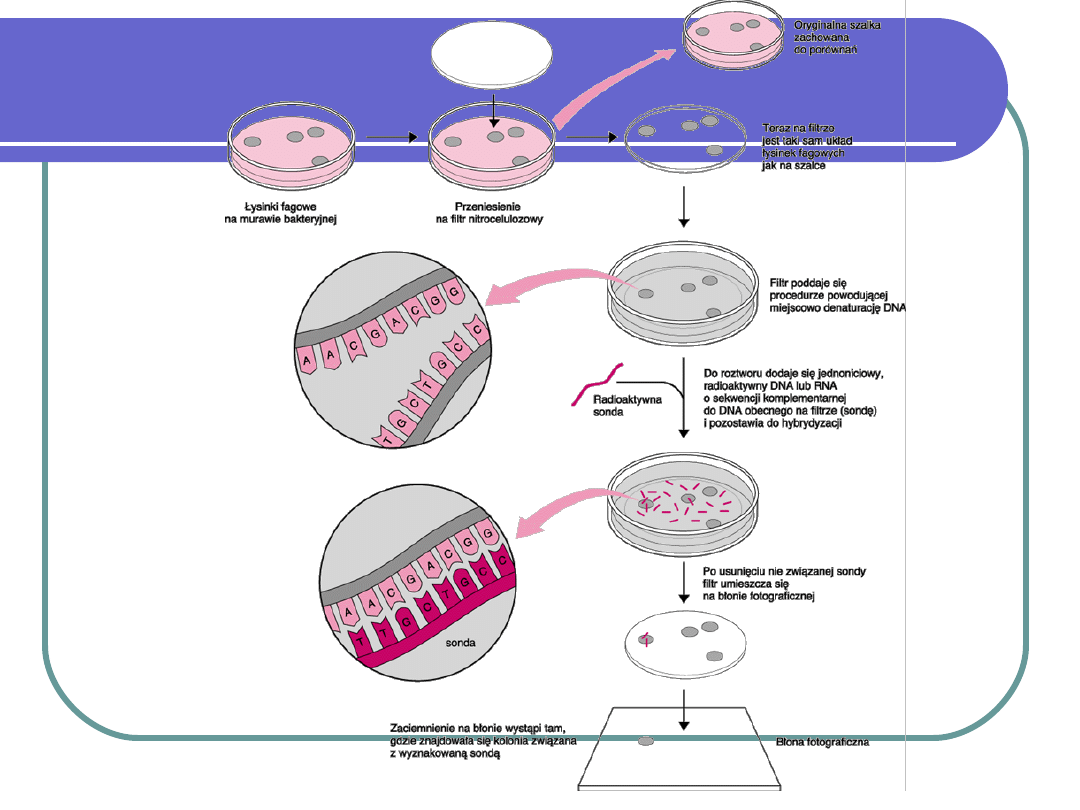
IG.7 - Detekcja zakażeń w hodowlach komórkowych techniką PCR, Genetyka, Inżynieria genetyczna
wykłady mówione kumulacja inzynieria-genetyczna, Biol UMCS, V semestr, Inżynieria genetyczna
Zadanie - trawienie, inżynieria genetyczna, laboratorium, [3]
więcej podobnych podstron