
VII
.
Leki oryginalne i odtwórcze

Koszt wprowadzenia nowego
leku
do obrotu
500-700 mln USD

KONCEPCJA LEKU
KONCEPCJA LEKU
GENERYCZNEGO
GENERYCZNEGO
1.
SEKWENCJA CZASOWA
2.
PODOBIEŃSTWO ZASADNICZE
3.
DAWKOWANIE
4.
INFORMACJA O LEKU
5.
BIORÓWNOWAŻNOŚĆ

1.
1.
SEKWENCJA CZASOWA
SEKWENCJA CZASOWA
•
produkt leczniczy innowacyjny
Produktem leczniczym oryginalnym
(innowacyjnym) jest produkt dopuszczony
do obrotu w oparciu o pełną dokumentację,
tj. dane chemiczne, biologiczne,
toksykologiczno-farmakologiczne i kliniczne
•
wygaśnięcie patentu
Generic: available for common
use; not protected by the trademark
registration

Zagadnienie niezmienności
jakości
w czasie
•
wprowadzenie do obrotu
(początek gwarantowanego terminu
ważności)
•
shelf-life
(gwarantowany termin ważności)
•
expiry date
(koniec gwarantowanego terminu
ważności)
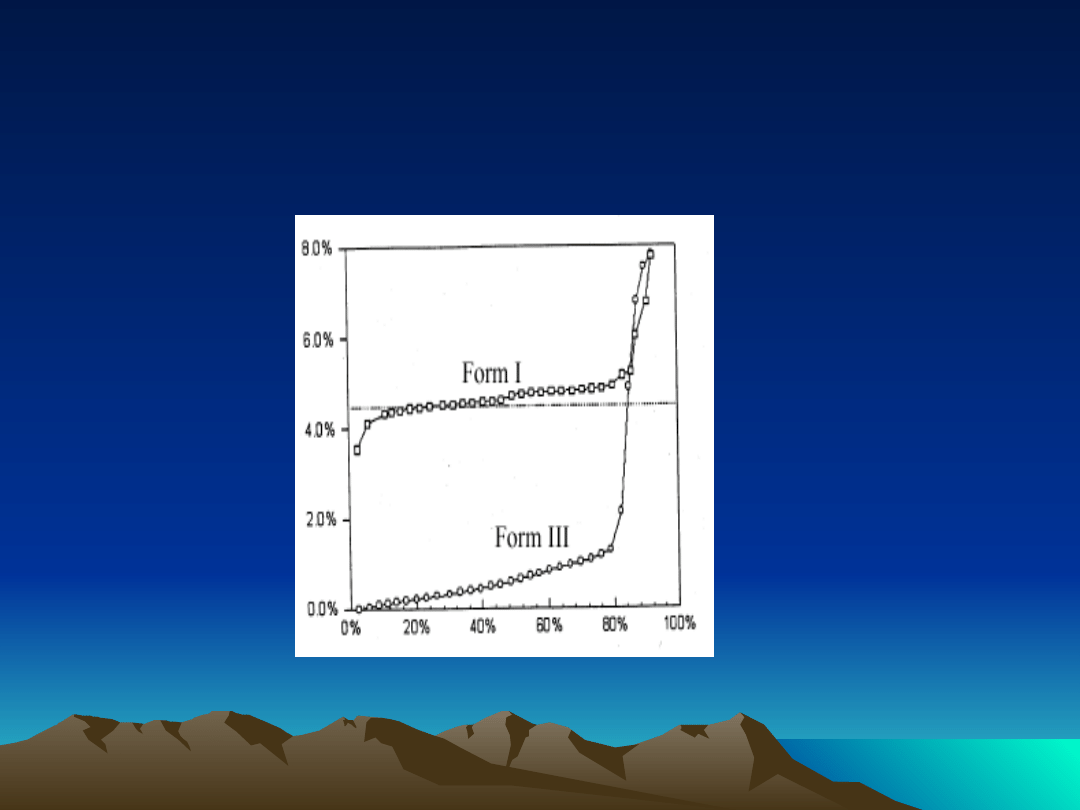
Wpływ polimorfizmu na
Wpływ polimorfizmu na
higroskopijność a tym samym na
higroskopijność a tym samym na
produkt leczniczy
produkt leczniczy
Absorpcja wilgoci przez fluorochinolon (US Patent
5,985,893)
Relative
Humidity
W
e
ig
h
t
G
a
in
%
w
/
w

2.
2.
P
P
ODOBIEŃSTWO
ODOBIEŃSTWO
ZASADNICZE
ZASADNICZE
Produkt leczniczy jest zasadniczo
podobny do produktu oryginalnego
jeżeli spełnia kryteria takiego
samego składu jakościowego i
ilościowego substancji czynnej,
biorównoważności i o ile nie różni
się od produktu leczniczego
oryginalnego bezpieczeństwem i
skutecznością terapeutyczną

Uogólniając:
Generalnie przyjmuje się, że dla
produktów szybko uwalniających
substancję czynną pojęcie
zasadniczego podobieństwa można
rozszerzyć na różne formy doustne
(tabletki i kapsułki) zawierające tę
samą substancję czynną

Wątpliwości co do zasadniczego
podobieństwa mogą wynikać z
zastosowania innych substancji
pomocniczych i metod
wytwarzania, które mogą
wpływać na bezpieczeństwo i
skuteczność terapeutyczną

Zmiany substancji pomocniczych w
produktach leczniczych są możliwe
pod warunkiem:
– Identyfikacji różnic
– Charakterystyki różnic
– Zachowania bezpieczeństwa
stosowania
Code of Federal Regulations Title 21, Volume 5, Part 300 to 499, Revised as
of April 1, 1999

Odmiany (alternatives)
farmaceutyczne
•
Zawierają tę samą część aktywną
(active moiety), ale różnią się formą
chemiczną: (ester, sól)
lub postacią farmaceutyczną czy też
mocą

DRUG MASTER FILE - DMF
Zawiera poufną dokumentację
przedstawioną przez wytwórcę
substancji czynnej potwierdzającą
spójność i powtarzalność procesu
wytwarzania oraz odpowiednią
jakość wytworzonej substancji

DRUG MASTER FILE - DMF
Substancje czynne:
Nowe
chronione patentem
Znane
opisane w Farmakopei
Europejskiej
opisane w farmakopei kraju
członkowskiego
opisane w farmakopei kraju
trzeciego

•
Forma chemiczna substancji
aktywnej i substancji
pomocniczych
•
Odmiany polimorficzne
•
Formy amorficzne
•
Formy solwatowane
•
Zanieczyszczenia
•
Postać leku

•
Forma chemiczna substancji
aktywnej i substancji pomocniczych
•
Odmiany polimorficzne:
zdolność leku do występowania jako dwie
(lub więcej) fazy krystaliczne o różnym
uporządkowaniu
i / lub konformacjach molekuły w sieci
krystalicznej
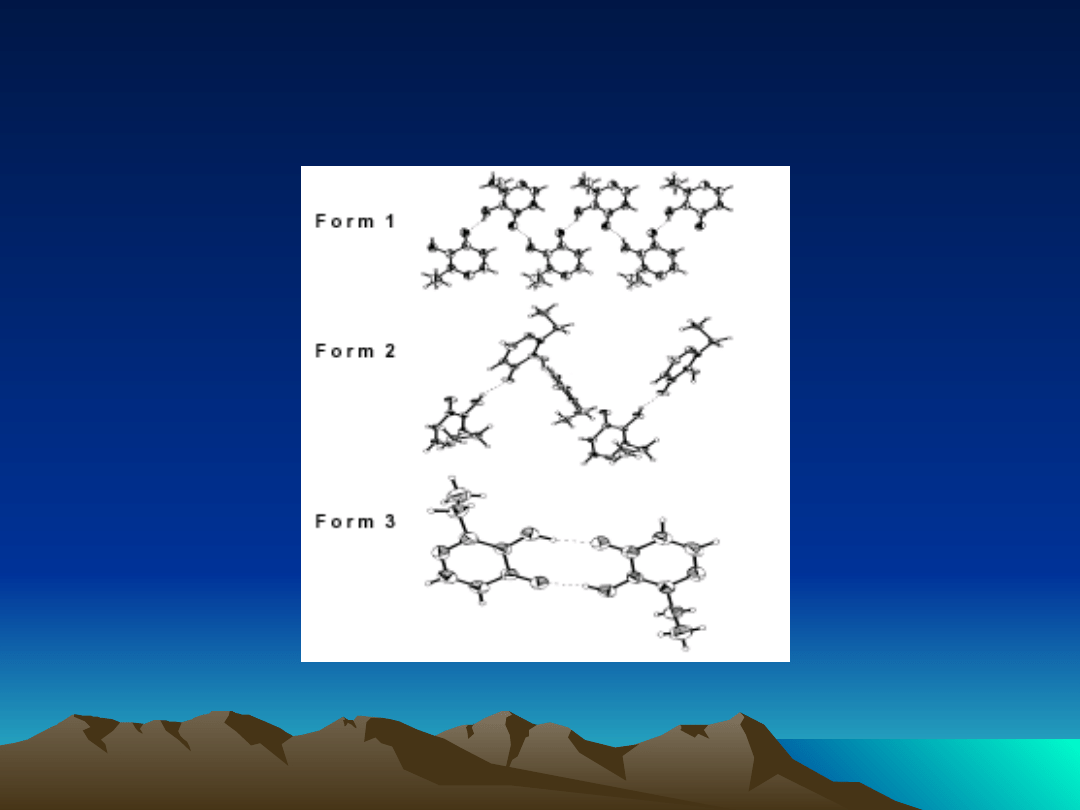
Różne upakowanie w sieci
Różne upakowanie w sieci
Ethyl
Malt
ol
Polimorfizm konformacyjny
Polimorfizm konformacyjny
Probucol

Wła
Wła
ś
ś
ciwo
ciwo
ś
ś
ci
ci
form
form
polimorficznych
polimorficznych
Formy polimorficzne substancji
farmaceutycznych mogą mieć
różne właściwości chemiczne i
fizyczne
– temperatura topnienia
– reaktywność chemiczna
– rozpuszczalność
– szybkość uwalniania
– właściwości optyczne i elektryczne
– prężność pary
– gęstość

Wła
Wła
ś
ś
ciwo
ciwo
ś
ś
ci na które ma
ci na które ma
wpływ polimorfizm
wpływ polimorfizm
•
Barwa związków
•
Stabilność (światło)
•
Działanie leków
•
Moc substancji wybuchowych
•
Jakość żywności
– Ziarninowanie margaryny
– Wykwity na czekoladzie

Potencjalny wpływ
Potencjalny wpływ
na
na
właściwości produktu
właściwości produktu
leczniczego
leczniczego
•
Stabilność
•
Uwalnianie
•
Biodostępność

Jak rozpowszechniony jest
Jak rozpowszechniony jest
polimorfizm
polimorfizm
?
?
Szacunkowo – 1 spośród 3 związków
•
Sulfonoamidy
60% związków
•
Barbiturany 70% zwiazków
•
Steroidy
60% zwiazków
50% wytworzonych związków z
powyższych grup nie było w najbardziej
stabilnej formie polimorficznej

Leki które wykazuj
Leki które wykazuj
ą
ą
polimorfizm
polimorfizm
Drug
Polymorph
Other form (solvates,
etc)
Ampicillin
Barbital
Benoxaprofen
Cephaloridine
Codeine
Cortisone
Cortisone AcO
Flucortolone
Nicotinamide
Sulphaguanidi
ne
Sulphametazi
ne
Sulphapyridin
e
Testosterone
Tolbutamide
Cimetidine
Propranolol
Piroxicam
Trimethoprim
1
6
2
4
3
2
8
2
7
4
2
6
3
3
4
2
3
3
1
2
1
19
1
1

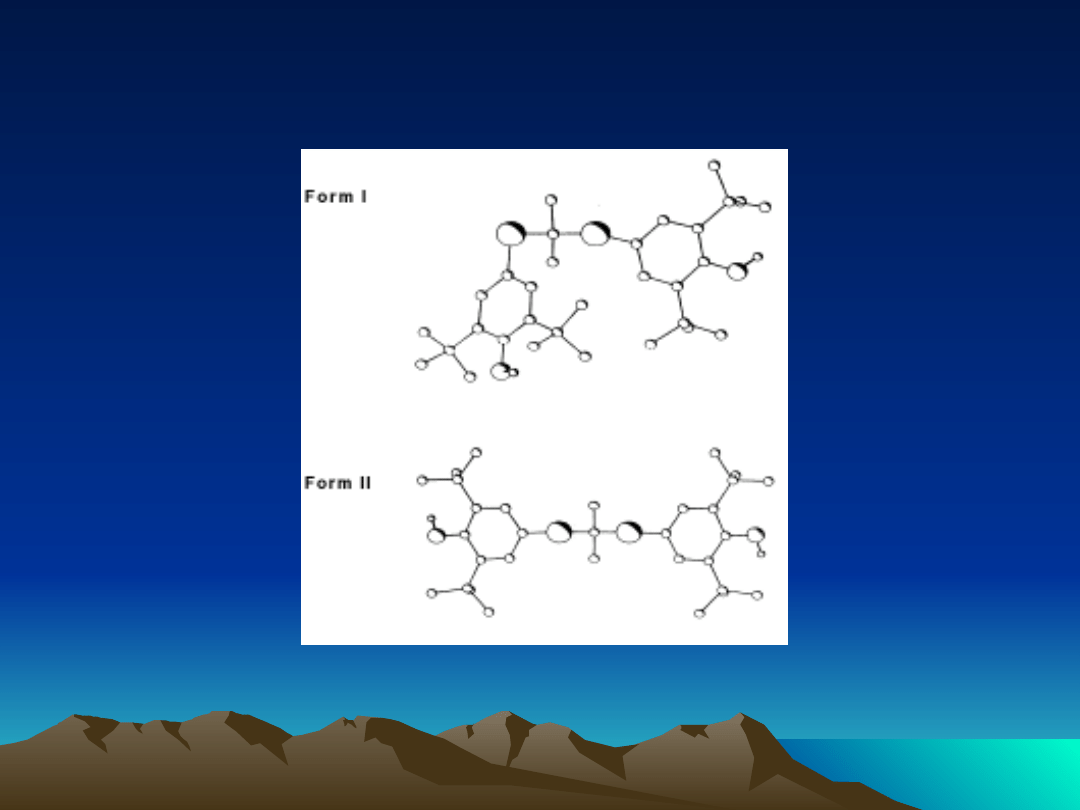
Kwas t
Kwas t
i
i
enylowy
enylowy
(Selacryn)
(Selacryn)
Zachowanie form polimorficznych podczas
mieszania w wodzie w temperaturze
pokojowej i podwyższonej
Time of
stirring
Polymorph
Temperat
ure
15
minutes
5 hours
7 hours
1 hour
B
B
A
A
RT
RT
RT
90-100
0
C
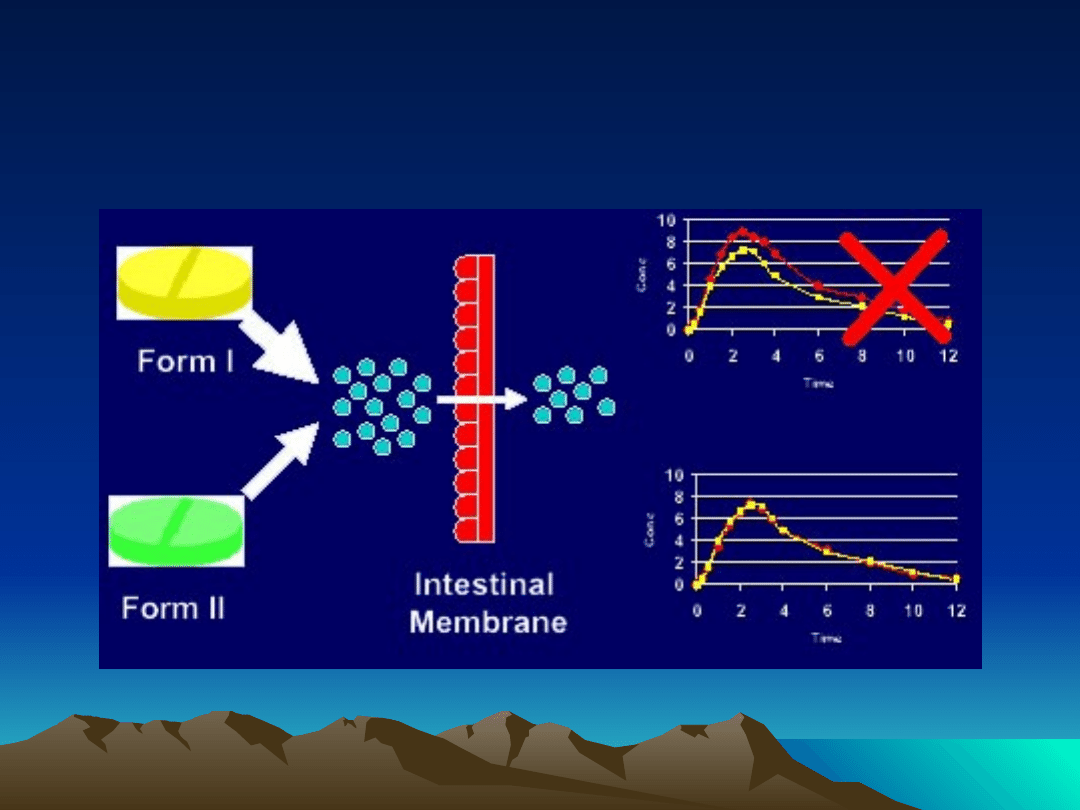
Wpływ polimorfizmu na
Wpływ polimorfizmu na
biodostpność
biodostpność

Zatwierdzono wiele leków
generycznych sporządzonych w
oparciu o substancję aktywną w
formie fizycznej różnej niż ta dla leku
referencyjnego
– warfaryna
– famotydyna
– ranitydyna

•
Formy amorficzne
Stan nieuporządkowania

Konwersja form
Konwersja form
polimorficznych podczas
polimorficznych podczas
procesu wytwarzania
procesu wytwarzania
•
Mielenie / mikronizacja
•
Granulacja na mokro
•
Inter-konwersja pomiędzy formami nie
hydratowanymi i hydratowanymi, lub
pomiędzy różnymi hydratami
•
Suszenie strumieniem powietrza
•
Formy amorficzne

•
Formy solwatowane
Stałe krystaliczne addukty zawierające
stechiometryczną lub niestechiometryczną ilość
wody wbudowanej w strukturą krystaliczną
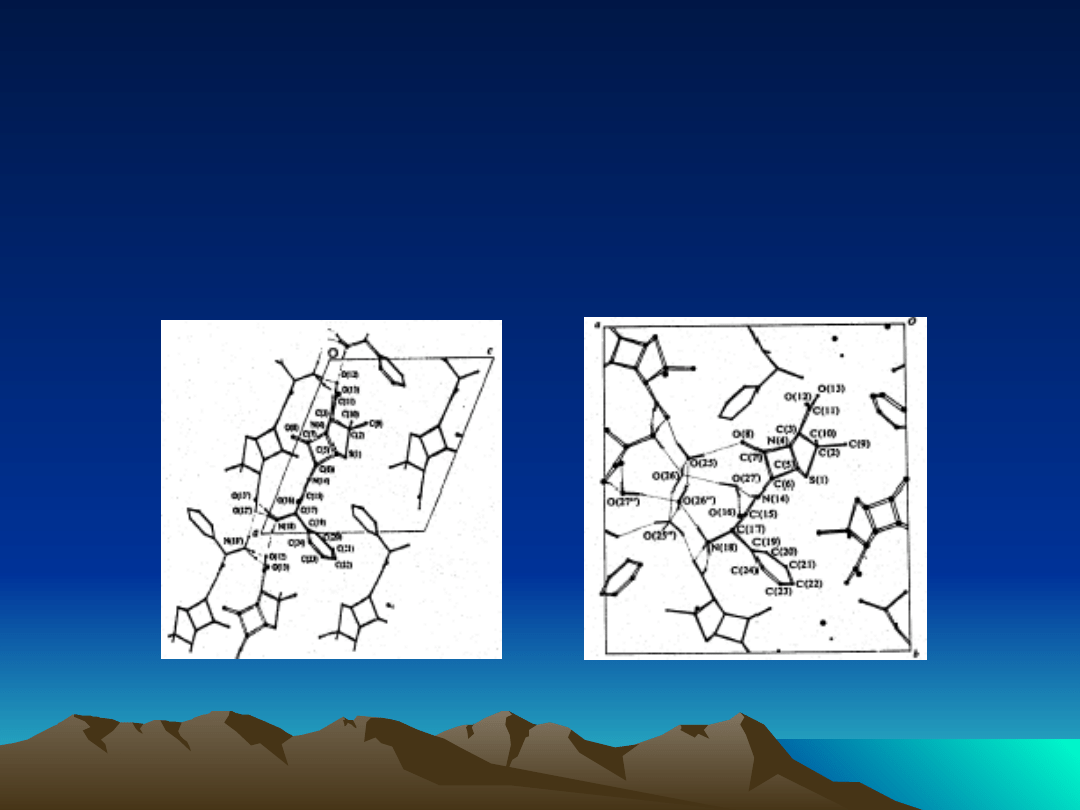
Sol
Sol
watomorfizm
watomorfizm
Ampicillin:
Anhydrate
Trihydrate

Wiele leków zostało zatwierdzonych z
substancją czynną inaczej
hydratowaną lub solwatowanych niż
w lekach odnośnikowe
– terazosyny chlorowodorek
– ampicilina
– cefadroxil

Zanieczyszczenia
Liczba zanieczyszczeń
Zawartość (ilość) zanieczyszczeń
Natura zanieczyszczeń
Zmienność zanieczyszczeń

Zanieczyszczenia substancji
czynnej (ICH)
Maksymalna dawka dzienna
≤
2g/dzień
Próg raportowania
0.05%
>
2g/dzień
0.03%

I
I
≤ 2g/dzień
Próg identyfikacji
0.10%
> 2g/dzień
0.05%

Próg
kwalifikacji
≤ 2g/dzień
0.15%
> 2g/dzień
0.05%

Suma zanieczyszczeń
Suma zanieczyszczeń
Enalapril substancja
Ph.Eur.
1%
Enalapril substancja USP
nie podaje
Enalapril tabletki
USP
5%

Zmienność zanieczyszczeń –
Zmienność zanieczyszczeń –
badania stabilności –
badania stabilności –
równoważność terapeutyczna
równoważność terapeutyczna
Krople/nos
Product
Medyczny 1
Product
Medyczny 2
Product
Medyczny
3
W
momencie
dopuszczen
ia
0.1%
0.3%
0.1%
Z końcem
terminu
waż.
2,1%
5.5%
5.5%

Pozostałości rozpuszczalników w
substancjach czynnych
I klasa - należy unikać, kancerogenne. Zgrażające
środowisku: benzen, czterochlorek węgla, 1,2-
dichloroetan, 1,1-dichloroetan, 1,1,1-trichloroetan
II klasa – ilość należy ograniczać, nie genotoksyczne.
kancerogenne u zwierząt, neurotoksyczne,
teratogenne: acetonitryl, chlorobenzen, chloroform,
etc.
III – o niskim potencjale toksyczności dla ludzi: kwas
octowy, aceton, anizol, etc.
IV klasa – rozpuszczalniki o nieustalonej toksyczności:
Izooktan, eter izopropylowy, kwas trifluorooctowy

3. DAWKOWANIE
3. DAWKOWANIE
•
Ustala się w badaniach
klinicznych
•
Odstępy czasowe w dawkowaniu

4. INFORMACJA O LEKU
4. INFORMACJA O LEKU
•
Charakterystyka Środka
Farmaceutycznego
•
Ulotka dla pacjenta
(wskazania, przeciwwskazania,
interakcje, działania
niepożądane)

5. BIORÓWNOWAŻNOŚĆ
5. BIORÓWNOWAŻNOŚĆ
ROWNOWAŻNOŚĆ TERAPEUTYCZNA
ROWNOWAŻNOŚĆ TERAPEUTYCZNA
Produkty lecznicze są
terapeutycznie równoważne jeżeli
zawierają tę samą substancję
czynną lub formę aktywną i
klinicznie wykazują tę samą
skuteczność i bezpieczeństwo

Biodostępność
Biodostępność
Szybkość i zakres do jakiego substancja
czynna lub forma aktywna jest
wchłaniana z formy farmaceutycznej i
staje się dostępna w miejscu działania
leku
Biodostępność oznacza szybkość i zakres
do jakiego substancja aktywna lub
forma aktywna jest dostarczana z formy
farmaceutycznej do krwioobiegu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
Wyszukiwarka
Podobne podstrony:
Leki oryginalne i generyczne różnice i podobieństwa
Leki oryginalne i generyczne
Leki oryginalne a generyczne
LEKI GENERYCZNE A LEKI ORYGINALNE
Leki oryginalne i generyczne różnice i podobieństwa
15 Leki moczopdne, Dokumenty Oryginalne
13 Leki inotropowe, Dokumenty Oryginalne
14 LEKI STOSOWANE W ASTMIE OSKRZELOWEJ, Dokumenty Oryginalne
Leki w fizjot 2 akt
88 Leki przeciwreumatyczne część 2
leki ratownik medyczny
Leki wpływające na czynność skurczową macicy
Leki 4
więcej podobnych podstron