1
Stała równowagi chemicznej
Stała równowagi chemicznej
Ogólnie można napisać, że dla reakcji:
dD + eE fF + lL
Stała w stanie równowagi wyniesie:
e
E
d
D
l
L
f
F
C
C
C
C
C
K
e
E
d
D
l
L
f
F
P
p
p
p
p
=
K
e
E
d
D
l
L
f
F
X
X
X
X
X
K
p
i
- ciśnienie cząstkowe reagentów
C
i
- stężenie reagentów w mol/dm
3
X
i
- stężenie reagentów w ułamkach molowych

2
„Gdy w roztworze doskonałym panuje stan
równowagi
chemicznej
w
określonej
temperaturze, to iloraz iloczynu stężeń
(ciśnień) produktów reakcji do iloczynu
stężeń
(ciśnień)
substratów
reakcji
podniesionych odpowiednio do potęg, których
wykładniki
odpowiadają
współczynnikom
stechiometrycznym równania reakcji, ma
wartość stałą”.
PRAWO DZIAŁANIA MAS
PRAWO DZIAŁANIA MAS
Stała równowagi chemicznej określana jest w
chemii pod nazwą : prawo działania mas.
Wartości stałych równowagi zmieniają się od
bardzo dużych do bardzo małych wartości.
np. K = 9,39 10
9
dla reakcji syntezy siarkowodoru
K = 2,38 10
-3
dla reakcji syntezy amoniaku
3
WARTOŚĆ STAŁEJ RÓWNOWAGI = const, dla stałej
temperatury. Każda zmiana temperatury z T
1
na T
2
powoduje zmianę stałej równowagi K
1
na K
2
zgodnie z
równaniem zwanym izobarą vant Hoffa:
2
1
1
2
r
2
1
r
2
1
T
T
T
-
T
R
Q
T
1
-
T
1
R
Q
ln
=
K
K
gdzie: Q
r
- ciepło reakcji
R - stała gazowa
K
1
- stała równowagi w temp.
T
1
K
2
- stała równowagi w temp.
T
2
Stała równowagi chemicznej
Stała równowagi chemicznej

4
Jeśli równowaga układu reakcyjnego zostanie
zakłócona, to reakcje chemiczne zostają wznowione i
zostanie osiągnięty nowy stan równowagi.
PRZESUNIĘCIA STANU
PRZESUNIĘCIA STANU
RÓWNOWAGI CHEMICZNEJ
RÓWNOWAGI CHEMICZNEJ
„Jeżeli na układ znajdujący się w stanie
równowagi działa jakiś czynnik zewnętrzny,
to powoduje on naruszenie stanu równowagi
w taki sposób, który częściowo osłabia
działanie tego czynnika”.
Kierunek takich przesunięć określa zasada (reguła)
LE CHATELIERA- reguła przekory.
5
Reguła przekory
Reguła przekory
/Reguła Le Chateliera i Brauna/
/Reguła Le Chateliera i Brauna/
H < 0 - reakcja egzotermiczna
3H
2
+ N
2
2NH
3
równowaga
T=const.
H > 0 - reakcja endotermiczna
A. Podwyższamy temperaturę wznawia bieg
reakcja rozkładu NH
3
(endotermiczna)
wpływ
wpływ
temperatury
temperatury
Ogólnie: podwyższenie temp. sprzyja reakcjom
podwyższenie temp. sprzyja reakcjom
endotermicznym, a obniżenie – egzotermicznym
endotermicznym, a obniżenie – egzotermicznym
.
B. Obniżamy temperaturę wznawia bieg reakcja
syntezy NH
3
(egzotermiczna)
6
Reguła przekory
Reguła przekory
/Reguła Le Chateliera i Brauna/
/Reguła Le Chateliera i Brauna/
wpływ
wpływ
ciśnienia
ciśnienia
v maleje
3H
2
+ N
2
2NH
3
równowaga
p=const.
V rośnie
A. Zwiększamy ciśnienie układ reaguje
zmniejszeniem objętości (równowaga przesuwa się
w prawo) tworzenie NH
3
B. Zmniejszamy ciśnienie układ reaguje
zwiększeniem objętości (równowaga przesuwa się
w lewo) rozpad NH
3
wpływ zmiany
wpływ zmiany
stężenia
stężenia
3H
2
+ N
2
2NH
3
A. Doprowadzenie substratu równowaga w
prawo
C. Doprowadzenie produktu równowaga w lewo
B. Odprowadzenie produktu równowaga w prawo
7
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
zajmuje się badaniem
szybkości reakcji
szybkości reakcji
oraz mechanizmami reakcji, a więc
obejmuje
zagadnienia
szybkości
dochodzenia układu do stanu równowagi.
8
SZYBKOŚĆ REAKCJI
SZYBKOŚĆ REAKCJI
CHEMICZNEJ
CHEMICZNEJ
Reakcja:
Ag
+
+ Cl
-
AgCl
; przebiega bardzo
szybko
do
wyczerpania
jednego z substratów
WIĘKSZOŚĆ REAKCJI PRZEBIEGA
Z SZYBKOŚCIĄ, KTÓRĄ MOŻNA
MIERZYĆ
Reakcja:
H
2
+ 0,5O
2
H
2
O
; w temp. otoczenia
i bez katalizatora przebiega bardzo wolno
SZYBKOŚĆ REAKCJI CHEMICZNEJ
jest to
ubytek stężenia substratów reakcji lub przyrost
stężenia produktów reakcji w nieskończenie
małym odstępie czasu:
dt
dC
dt
dC
V
x
s
gdzie:V-szybkość
reakcji
chemicznej,
C
S
-stężenie substratów,
C
X
-stężenie produktów,
t-czas reakcji.
9
SZYBKOŚĆ REAKCJI
SZYBKOŚĆ REAKCJI
CHEMICZNEJ
CHEMICZNEJ
Jakie
czynniki
decydują
o
szybkości
reakcji
chemicznej?
1.
Stężenie
substratów
2.
Temperatura
3.Obecność
katalizatora
(katalizatory
dodatnie i ujemne)
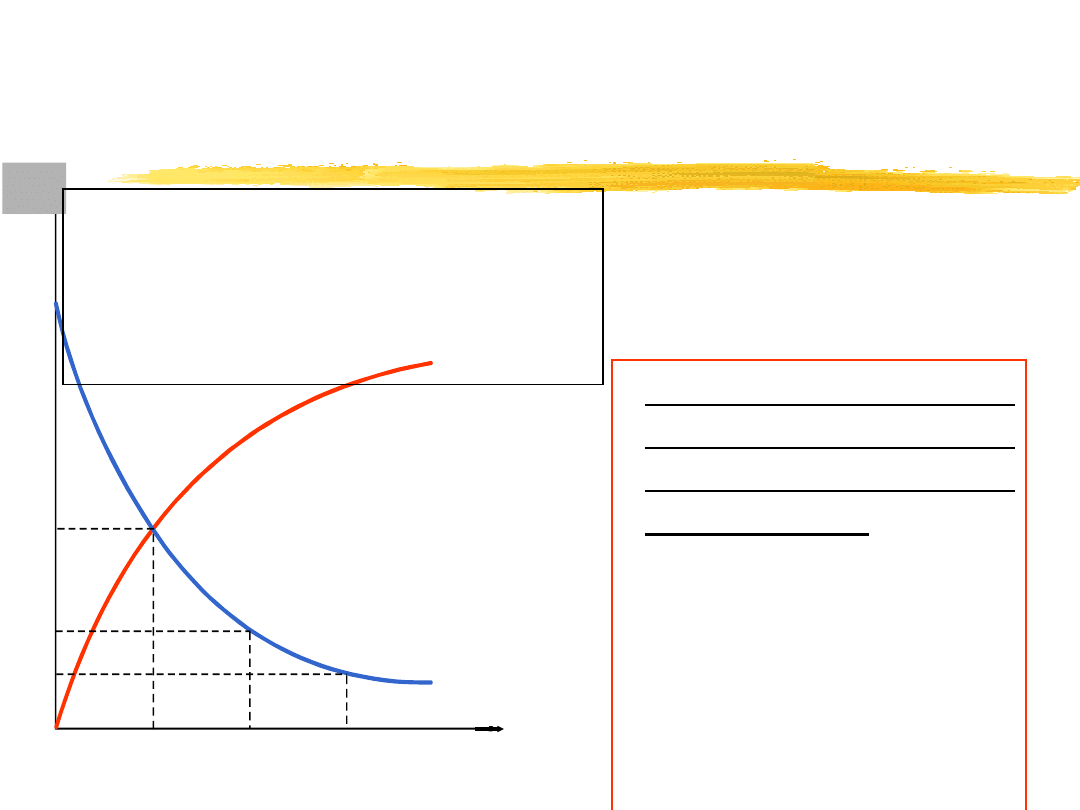
C
s
C
s
,C
x
Zmiana
stężenia
substratów (C
S
) i stężeń
produktów (C
X
) w czasie
(t) przebiegu reakcji.
C
X
t
t
2t
3t
C
s
C
s
/
2
C
s
/
4
C
s
/
8

10
Jeżeli reakcja ma postać:
aA + bB + ............. = IL + mM + .................
to szybkość reakcji wyniesie:
.....
C
C
k
v
b
B
a
A
gdzie:C
A
, C
B
-
stężenia substratów
a,b
-
współczynniki
stechiometryczne
k
-
STAŁA
SZYBKOŚCI
REAKCJI
Równanie opisujące zależność szybkości reakcji
od stężenia reagentów nazywamy:
RÓWNANIEM KINETYCZNYM REAKCJI
k – szybkość reakcji gdy stężenia substratów
równe są jedności: gdy C
A
= C
B
= ... = 1, to
k =
VStała szybkości reakcji k
nie zależy od
stężenia reagentów.

11
Równanie kinetyczne
reakcji
Sumę wykładników potęgowych w równaniu
kinetycznym na szybkość reakcji nazywamy
rzędem reakcji
:
a + b + ... = n
rząd reakcji
Rząd niekatalizowanych reakcji wynosi na ogół:
n = 0 – 3; a katalizowanych n = 1 – 2.
Zależność szybkości reakcji od stężenia
substratów jest zatem funkcją potęgową:
n
s
)
(C
k
V
C
S
- stężenie substratów

12
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
REAKCJI CHEMICZNYCH
REAKCJI CHEMICZNYCH
CZĄSTECZKOWOŚĆ
reakcji
jest
liczbą
cząsteczek uczestniczących jednocześnie w
tworzeniu
cząsteczki
produktu
–
limituje
szybkość reakcji chemicznej.
Wyróżniamy reakcje: jednocząsteczkowe,
dwucząsteczkowe, trójcząsteczkowe, itd.
A
PRODUKTY
np.:
Br
2
2 Br
A
C
k
V
REAKCJE JEDNOCZĄSTECZKOWE
W reakcji bierze udział jedna cząsteczka substratu:
Szybkość reakcji jednocząsteczkowych:

13
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
REAKCJI CHEMICZNYCH
REAKCJI CHEMICZNYCH
2
A
B
A
C
k
V
C
C
k
V
W
równaniach
tych,
stężenie
substratu
występuje
w
drugiej
potędze.
Szybkość reakcji dwucząsteczkowych:
REAKCJE DWUCZĄSTECZKOWE
W utworzeniu produktu biorą udział dwie
cząsteczki substratu:
A + B
PRODUKTY
2A
PRODUKTY
np.:
H
2
+ Cl
2
2 HCl
2 HI
H
2
+ I
2

14
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
REAKCJI CHEMICZNYCH
REAKCJI CHEMICZNYCH
REAKCJE TRÓJCZĄSTECZKOWE
Reagują ze sobą trzy cząsteczki substratu:
np.: H
2
SO
3
+ I
2
+ H
2
O
H
2
SO
4
+ 2 HI
2 NO + O
2
2 NO
2
A + B + C
PRODUKTY
3A
PRODUKTY
2A + B
PRODUKTY
3
A
B
2
A
C
B
A
C
k
V
C
C
k
V
C
C
C
k
V
Szybkość reakcji trójcząsteczkowych:
Suma wykładników
potęgowych wynosi
trzy
15
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
REAKCJI CHEMICZNYCH
REAKCJI CHEMICZNYCH
Teoretycznie
: szybkość reakcji jednocząsteczkowej
jest proporcjonalna do pierwszej potęgi stężenia
substratów;
dwucząsteczkowej
–
do drugiej potęgi;
trójcząsteczkowej
–
do trzeciej potęgi.
RZĘDOWOŚĆ REAKCJI:
RZĘDOWOŚĆ REAKCJI:
Suma wykładników potęgowych w równaniu na
szybkość reakcji, do której należy podnieść stężenia
substratów by doświadczalnie wyznaczona szybkość
reakcji była zgodna z wyliczoną z równania
kinetycznego.
Praktycznie
:
Rzeczywista cząsteczkowość – RZĘDOWOŚĆ
RZĘDOWOŚĆ
REAKCJI
REAKCJI
– nie zawsze jest zgodna z pozorną
(teoretyczną) cząsteczkowością.
16
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
REAKCJI CHEMICZNYCH
REAKCJI CHEMICZNYCH
REAKCJE PIERWSZEGO RZĘDU
REAKCJE PIERWSZEGO RZĘDU
:
Reakcje, dla których doświadczalnie wyznaczona
szybkość reakcji jest proporcjonalna do pierwszej
potęgi stężenia substratu.
s
C
k
V
1;
n
REAKCJE DRUGIEGO RZĘDU:
REAKCJE DRUGIEGO RZĘDU:
Reakcje, dla których doświadczalnie wyznaczona
szybkość reakcji jest proporcjonalna do pierwszej
potęgi stężenia dwóch substratów lub do
kwadratu stężenia jednej substancji reagującej.
2
s
C
k
V
2;
n

17
Analogicznie dla
n
= 3
:
3
s
C
k
V
Dla reakcji
n-tego
rzędu
:
n
s
C
k
V
k
k
b
2
a
1
C
....
C
C
k
V
lub
gdzie: a + b + ... + k = n
rzędowość.
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
CZĄSTECZKOWOŚĆ I RZĘDOWOŚĆ
REAKCJI CHEMICZNYCH
REAKCJI CHEMICZNYCH
Występują również reakcje rzędu zerowego.
Wówczas szybkość reakcji nie zależy od stężenia
substratu:
k
V
18
Wpływ temperatury na
szybkość reakcji
chemicznych
SZYBKOŚĆ
REAKCJI
CHEMICZNYCH
SZYBKOŚĆ
REAKCJI
CHEMICZNYCH
ROŚNIE ZE WZROSTEM TEMPERATURY,
ROŚNIE ZE WZROSTEM TEMPERATURY,
co wiąże się ze wzrostem stałych szybkości
stałych szybkości
reakcji
reakcji
(k).
np.
chcąc
przeprowadzić
reakcję
syntezy wody z wydajnością 15% należy
go prowadzić:
w temp. 20C
-
54 miliardy lat;
w temp. 500C
-
50 minut;
w
temp.
700C
-
przebiega
wybuchowo.

19
Empiryczna reguła van’t
Hoffa:
Jeżeli = 3, a temperatura wzrośnie o 100
o
to
szybkość reakcji wzrośnie 3
10
razy.
Współczynnik temperaturowy szybkości reakcji
jest to liczba wskazująca ile razy wzrasta
szybkość reakcji po podwyższeniu temperatury o
10 stopni.
Podwyższenie temperatury o 10 stopni powoduje
zwiększenie szybkości reakcji 2-4 razy.
Współczynnik
temperaturowy
szybkości
Współczynnik
temperaturowy
szybkości
reakcji:
reakcji:
T
10
T
k
k
gdzie: k
T+10
- stała
szybkości reakcji w
temp. T+10
k
T
- stała szybkości
reakcji w temp. T
20
Współczynnik temperaturowy szybkości reakcji
zależy od temperatury, przy czym zbliża się do
jedności
gdy
temperatura
dąży
do
nieskończoności:
gdy
T
to
1
Empiryczna reguła van’t
Hoffa:
Można obliczać K w różnych
temperaturach.
10
1
T
2
T
k
k
2
1
lg
T
T
T
k
k
lg
1
1
2
2
1
k
1
, k
2
– stałe szybkości reakcji w temp. T
1
i
T
2
.
Ilościowo zależność ta wygląda następująco:

21
Teoria zderzeń aktywnych –
równanie Arrheniusa
Wg
kinetycznej
teorii
materii
reakcje
chemiczne zachodzą w wyniku zderzeń
cząsteczek substratów (np. dwóch).
Nie wszystkie zderzenia są jednak efektywne,
tzn. prowadzą do powstania produktów reakcji.
Przyjmuje się, że efektywne są tylko te
zderzenia, w których biorą udział cząsteczki
obdarzone energią wyższą od początkowej,
równą lub większą od wartości E zwaną:
ENERGIĄ AKTYWACJI
ENERGIĄ AKTYWACJI
ENERGIA AKTYWACJI
ENERGIA AKTYWACJI przedstawia zatem
najmniejszą
energię
jaką
muszą
mieć
cząsteczki substratów, aby mogły wejść w daną
reakcję:
E > E
E > E
śr.
śr.
22
Teoria zderzeń aktywnych
– równanie Arrheniusa
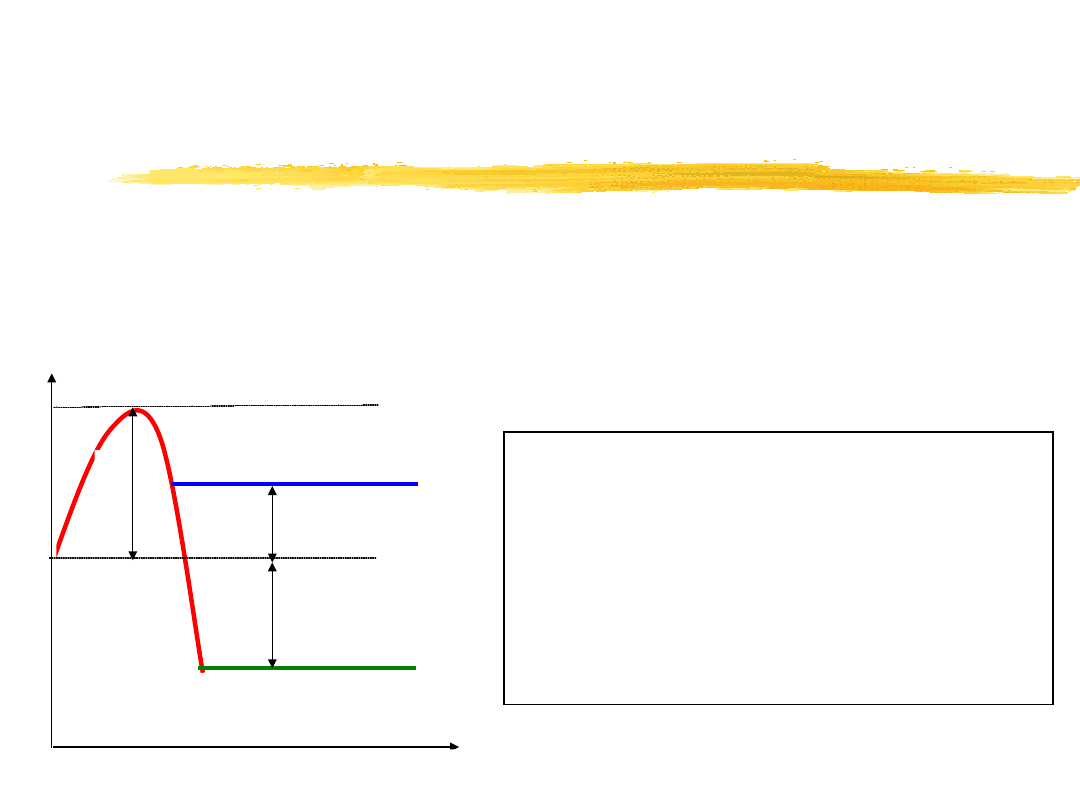
Cząsteczka substratu o przeciętnej energii musi zatem przed
wejściem w reakcję uzyskać pewien nadmiar energii, na skutek
zderzeń z innymi cząsteczkami. Przejście cząsteczki ze stanu
energii zbliżonej do początkowej do stanu energii aktywacji dla
reakcji endotermicznej i egzotermicznej przedstawia rysunek:
H
1
H
2
E
s
E
Energi
a
E
p
E
p
Współrzędna
reakcji
E – energia aktywacji
E
s
– energia substratów
E
p
– energia produktów
H
1
– ciepło reakcji
endotermicznej
H
2
– ciepło reakcji
egzotermicznej
23
Teoria zderzeń aktywnych
– równanie Arrheniusa
Teoria zderzeń aktywnych pozwala śledzić
zmiany
szybkości
reakcji
w
funkcji
temperatury.
RT
E
lnZ
k
ln
e
Z
k
o
RT
E
o
Jest to tzw. równanie ARRHENIUSA
równanie ARRHENIUSA
Z
o
– ogólna liczba
zderzeń,
E – energia aktywacji,
R – stała gazowa,
T – temperatura
k - stała szybkości
reakcji
Wg PRAWA PODZIAŁU ENERGII
PRAWA PODZIAŁU ENERGII
MAXWELLA-BOLTZMANA
MAXWELLA-BOLTZMANA
liczba zderzeń
aktywnych cząsteczek (Z=k) wynosi:
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
4 Statyka Kinetyka
10 wykad Statyka kinetyka chemiczna[F 2006]
Statyka Kinetyka
4 Statyka Kinetyka
kinetyka i statyka zadania do spr teoria
energetyka kinetyka statyka
Kinetyka Chemiczna
06 Kinetyka reakcji enzymatycznych
Łancuchy kinetyczne
4 Badanie kinetyki reakcji zmy Nieznany (2)
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
04 Kinetyka reakcji chemicznych i kataliza
więcej podobnych podstron