
Seminarium + Ćwiczenie
III Rok Wydział Lekarski
1

O czym porozmawiamy….
I. Cytometria przepływowa –
narzędzie badawcze i
diagnostyczne
II. Patofizjologia komórki - proliferacja
III. Patofizjologia komórki - apoptoza
2

I. Cytometria przepływowa -
- narzędzie badawcze i
diagnostyczne
3

• Cytometria przepływowa
– Mierzy właściwości optyczne przepływających
komórek (żywych lub utrwalonych)
• Przepływowe sortowanie komórek
– Oddziela komórki różnych populacji na
podstawie odmiennych właściwości optycznych
ang. Fluorescence-Activated Cell
Sorting (FACS)
Co to jest cytometria?
4

Komórki w zawiesinie
przepływają pojedynczo
przez oświetloną komorę,
rozpraszając światło i
emitując fluorescencję;
wielkości rozproszenia
światła i fluorescencji są
rejestrowane i
przetwarzane
komputerowo.
Fluid
Fluid
y
y
ka
ka
Opt
Opt
yk
yk
a
a
Ele
Ele
k
k
troni
troni
ka
ka
Podstawy cytometrii przepływowej
5
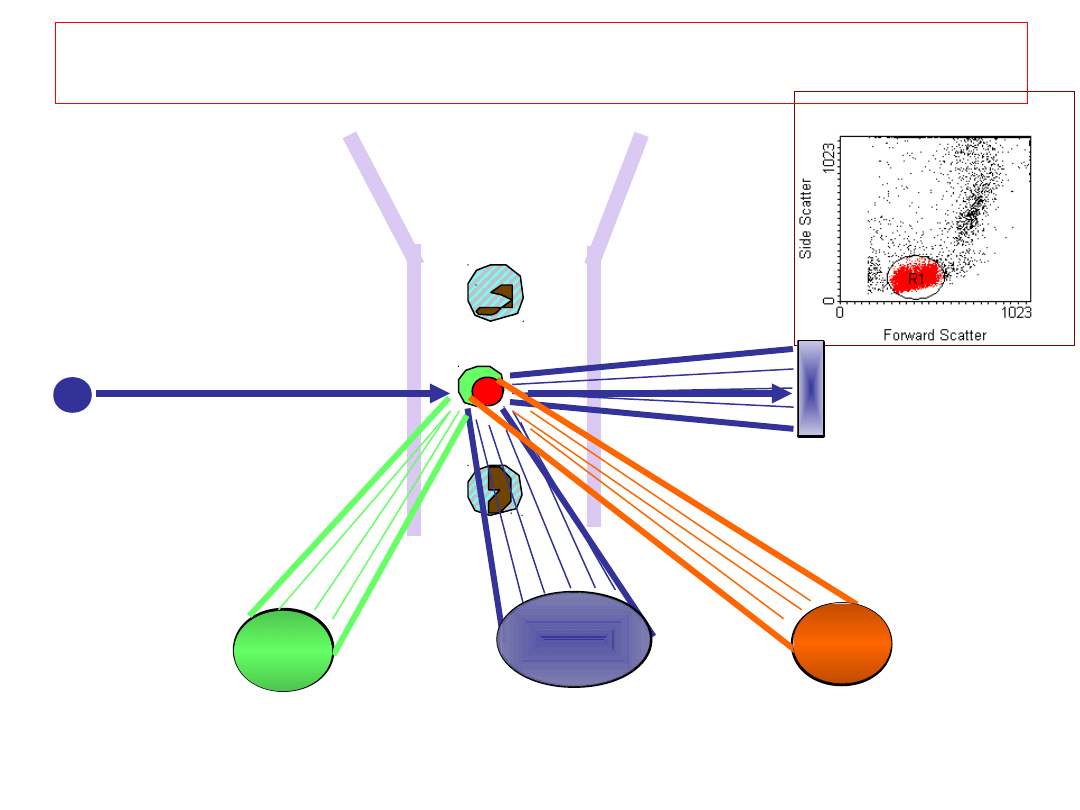
Detektor
FSC
(10
o
)
Detektor SSC (90
o
)
Laser
Detektor FL1
(fl. zielona)
Detektor FL2
(fl. pomarańczowa)
Jak to działa?
6
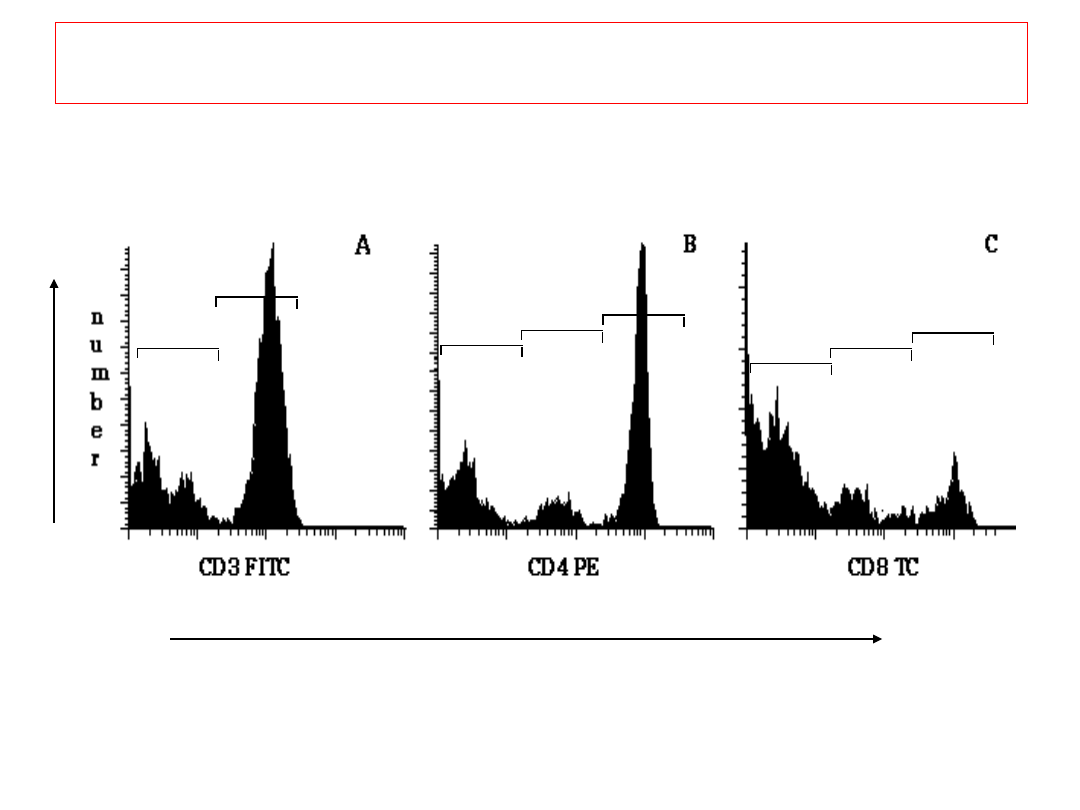
CD3
+
CD3
-
CD4
+
CD4
L
O
CD4
-
CD8
+
CD8
in
t
CD8
-
Natężenie fluorescencji
Wynik analizy: HISTOGRAM
7
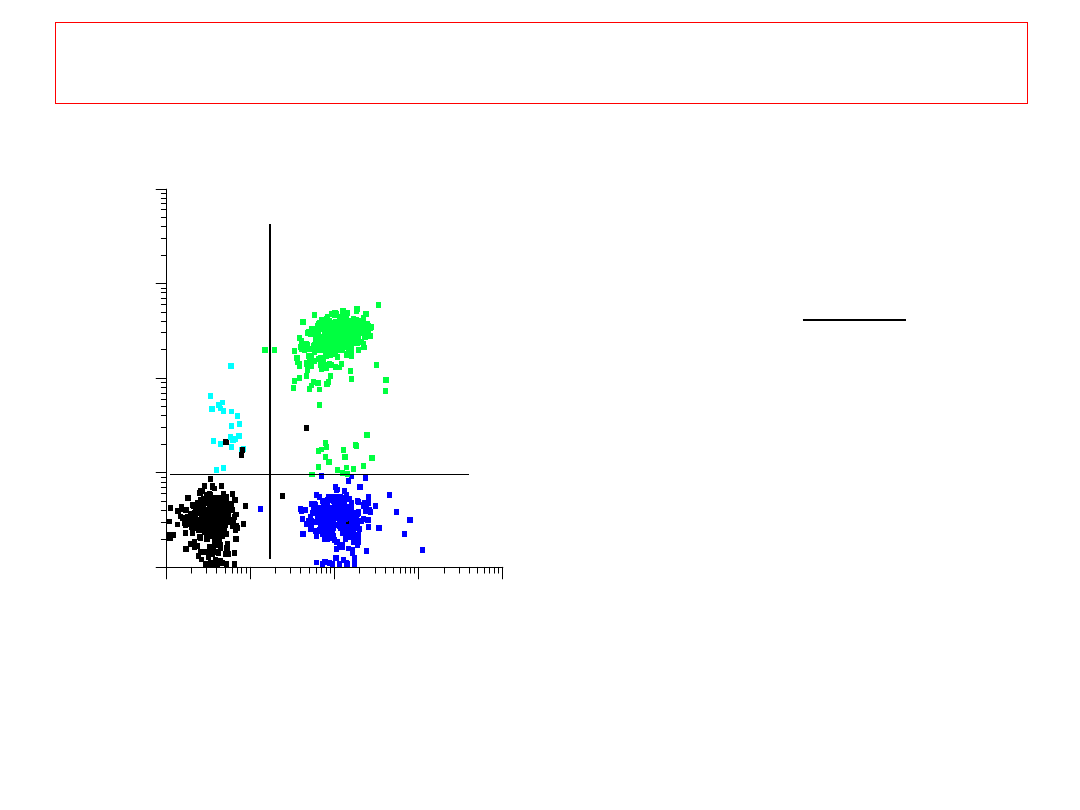
10
1
10
2
10
3
10
4
CD3 -->
1
0
1
1
0
2
1
0
3
1
0
4
C
D
4
-
->
FL1-CD3
F
L
2
-C
D
4
kolor
CD3
-
CD4
-
czarny
CD3
+
CD4
-
niebieski
CD3
-
CD4
+
błękitny
CD3
+
CD4
+
zielony
50%
5%
25%
20%
ANALIZA KWADRANTOWA
Wynik analizy: DOT PLOT
8

• Analiza
proporcji komórek
w mieszaninie
(immunofenotypizacja)
• Wykrywanie
rzadkich komórek
• Ocena niektórych
właściwości
czynnościowych badanych komórek
Zastosowania cytometrii przepływowej
9
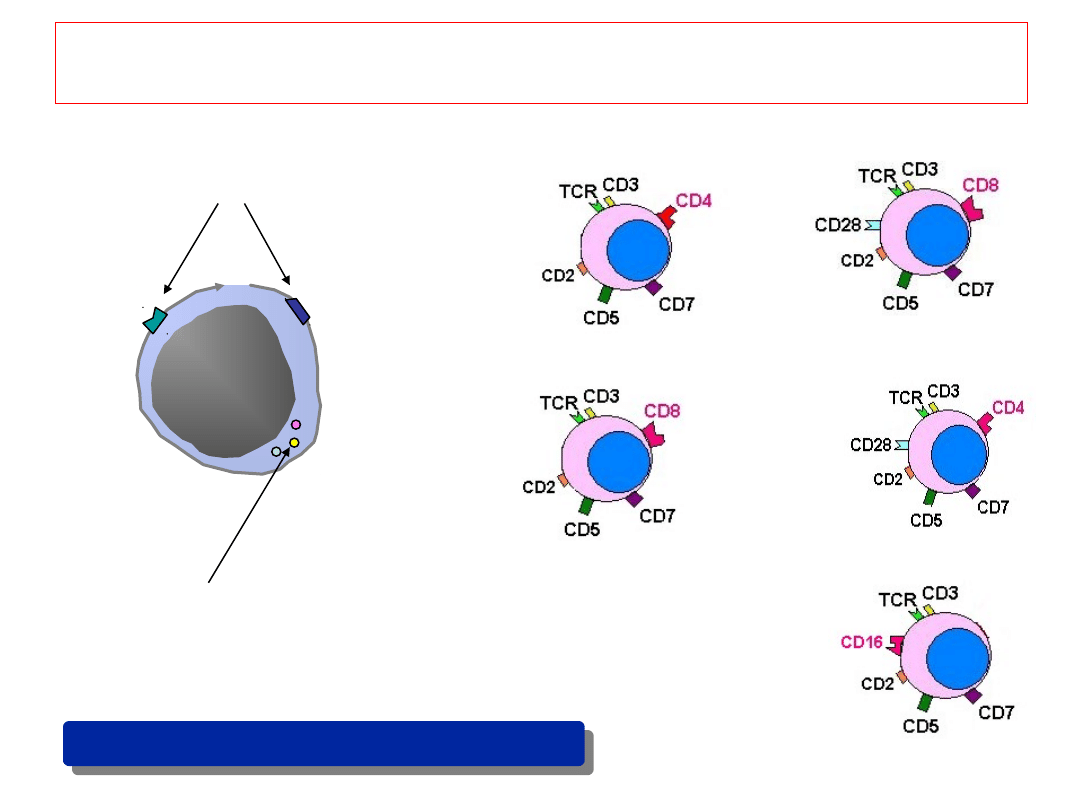
CD # = cluster of differentiation
CD2
CD4
Markery powierzchniowe
Markery cytoplazmatyczne
Immunofenotypizacja
10
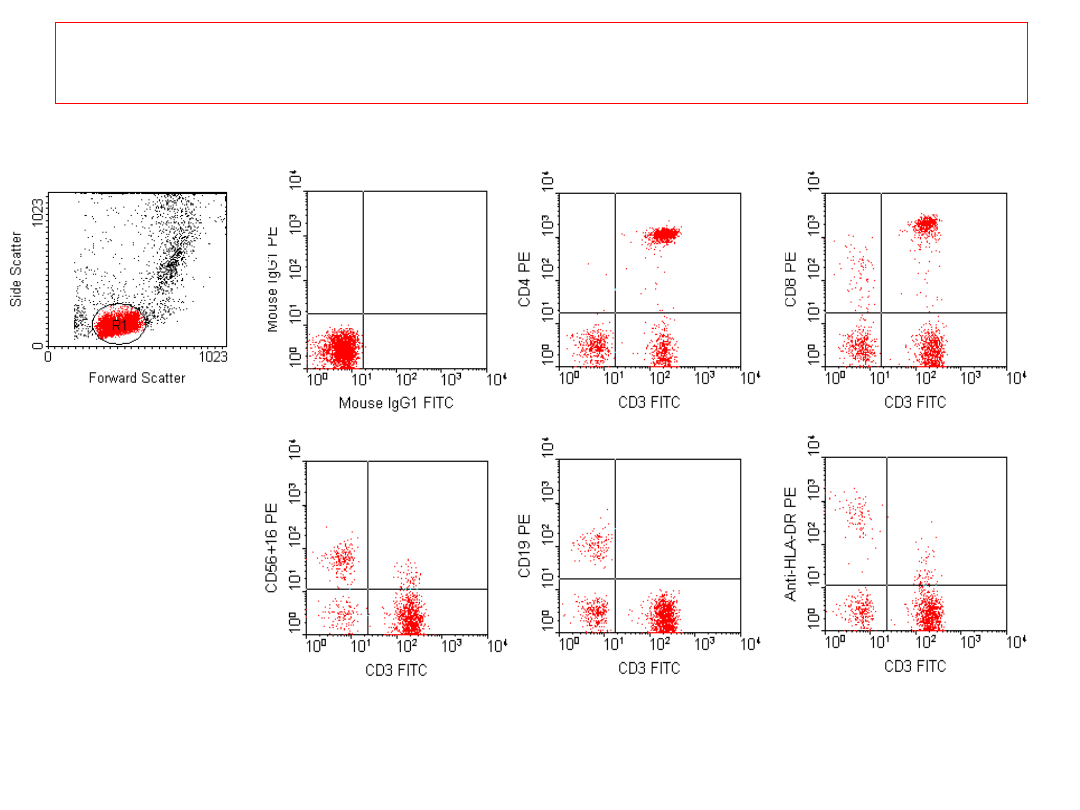
Subpopulacje limfocytów krwi
obwodowej
11
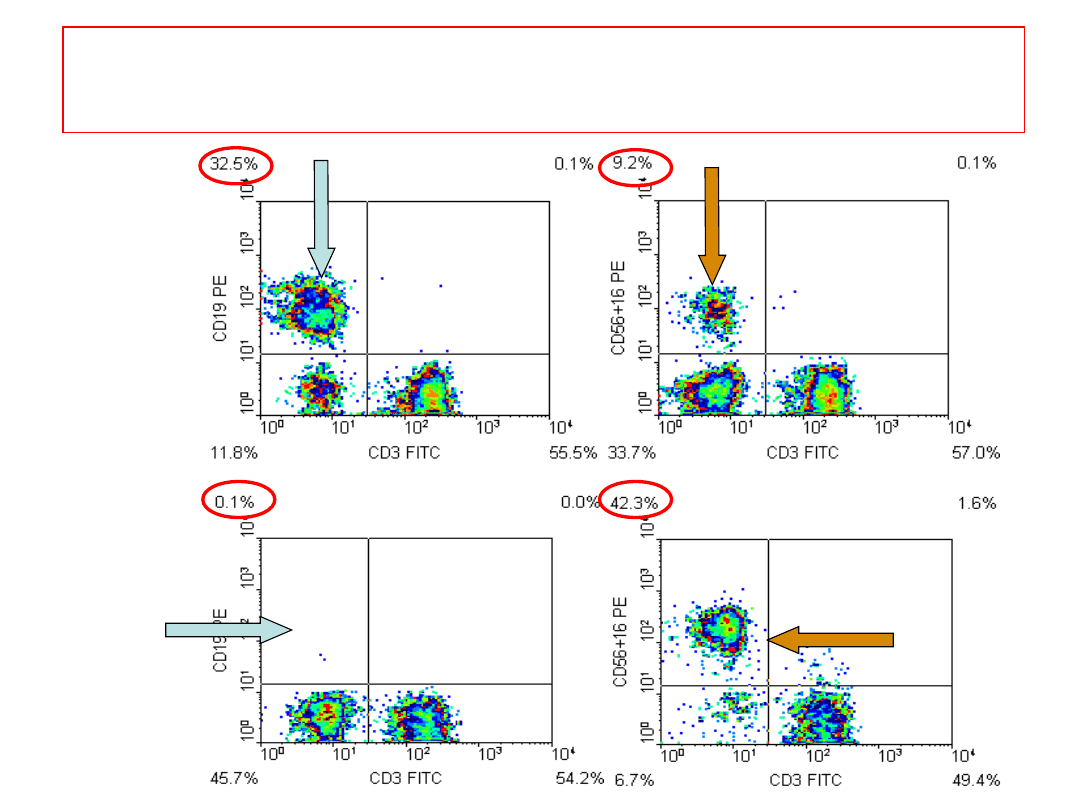
PRZYKŁAD: Zaburzenia składu subpopulacji
limfocytów krwi obwodowej
Osoba 1
Osoba 2
12
DCFH-DA
DCF
DCF
DCFH-DA
DCFH-DA
DCF
DCF
H
H
2
2
2
2
H O
H O
NEUTROFIL
Testy czynnościowe – wybuch tlenowy
13
Obrazki z testu fagocytozy
FITC-bakterie
NEUTROFIL
Testy czynnościowe – fagocytoza
14

• podejrzenie
niedoboru odporności
wrodzonej i nabytej
(zaburzenia proporcji populacji komórek i/lub ich
właściwości)
• w tym
AIDS
• podejrzenie
nowotworu hematologicznego
(pojawienie się komórek o swoistym fenotypie)
• monitorowanie przebiegu choroby nowotworowej i jej
remisji
• podejrzenie
choroby resztkowej
(wykrywanie bardzo
rzadkich komórek)
• zaburzenia
krzepnięcia
– podejrzenie zaburzeń
płytkowych
• zaburzenia
erytropoezy
(retikulocytoza)
• bezpłodność
Kiedy i kogo kierować na badania
diagnostyczne?
15

• Materiałem do badań techniką cytometrii
przepływowej może być:
– Pełna krew (pobrana na EDTA lub heparynę,
bardzo dobrze wymieszana i przechowywana
nie dłużej niż kilka godzin)
– Popłuczyny oskrzelowe (bronchial lavage)
– Docelowo – inne płyny biologiczne, jak płyn
mózgowo-rdzeniowy, mocz
– Osocze lub surowica (cytokiny)
Jakie warunki powinien spełniać
materiał biologiczny?
16

Cytometria przepływowa umożliwia m.in.:
• ocenę liczby receptorów na/w komórkach,
• ocenę
proliferacji
komórek,
• ocenę nasilenia różnych faz procesu
apoptozy
– mitochondrialnej,
– błonowej,
– efektorowej,
• ocenę aktywności niektórych enzymów,
• ocenę „sygnału wapniowego”,
• kariotypowanie
• sortowanie bardzo czystych (>99%) populacji żywych komórek
itd..
Możliwości cytometrii przepływowej są
ogromne…
17

są dwa procesy regulujące liczbę komórek
w organizmie: proliferacja i apoptoza,
pozostające w równowadze…
18

II. Patofizjologia komórki -
- proliferacja
19

•
zapotrzebowania na nowe komórki:
• wzrost organizmu,
• reakcja na stymulację,
• wysiłek fizyczny,
• praca umysłowa,
• odpowiedź immunologiczna;
• obecności czynników wzrostowych
• prawidłowej transdukcji sygnałów
• właściwości środowiska:
• podłoże (białka macierzy
międzykomórkowej)
• substancje odżywcze
• tlen
• braku/obecności błędów w samych
komórkach
(DNA)
Zdolności podziałowe komórek zależą
od:
20

Uszkodzone lub zużyte komórki są eliminowane
i zastępowane przez nowe, bez zmiany
wielkości/objętości tkanki lub narządu….
Przewaga śmierci komórek nad proliferacją
prowadzi do reorganizacji/zaniku tkanki.
Do przyczyn należą:
• czynniki toksyczne
• endogenne czynniki hamujące proliferację, np. IL-10, TGFβ
• nadmierna indukcja apoptozy
• niedobór substancji pokarmowych
• niedobór czynników wzrostowych
Fizjologia patofizjologia
21

• Zaburzenia wzrostu narządu/tkanki np
.:
• karłowatość,
• niedorozwój (hipo- lub aplazja) narządu;
• Utrudnione gojenie się ran i innych ubytków
tkankowych:
• zaburzenia czynności „ze zużycia” (niezależnie od
wieku osobniczego),
• marskość wątroby, nerki,
• wtórne niedobory endokrynologiczne,
• niedobory immunologiczne;
• Starzenie się (także przedwczesne).
Konsekwencje
niedoborów
proliferacji
komórek:
22

1. Prowadzi do rozwoju nowotworów;
(niekontrolowanego rozplemu (namnażanie) populacji
komórek przekraczającego zapotrzebowanie organizmu)
2. Przyczynia się do rozwoju wielu chorób;
(
reumatoidalne zapalenie stawów, kłębuszkowe zapalenie
nerek, łuszczyca, przewlekłe choroby układu krążenia –
niedokrwienie, rozrost prostaty)
Do przyczyn należą:
- nadmierna, niekontrolowana proliferacja
- brak lub obniżenie apoptozy
Konsekwencje
przewagi proliferacji
komórek nad eliminacją:
23
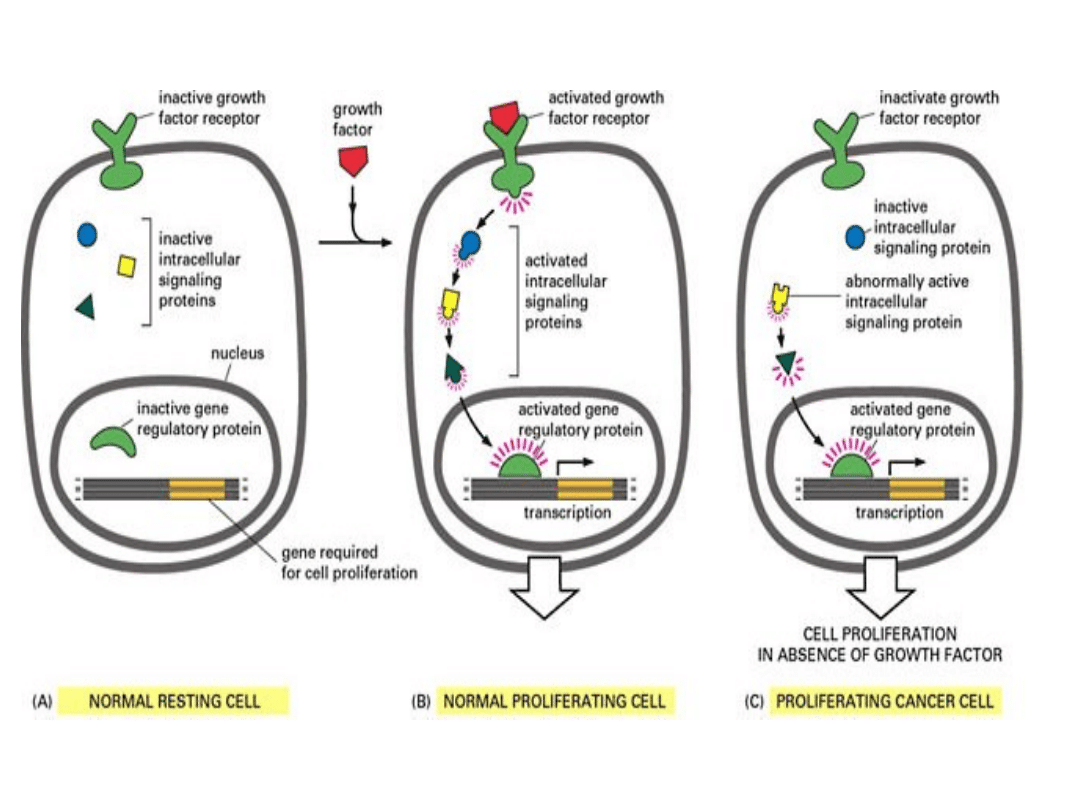
24
• W komórkach
przygotowujących się
do podziału (faza G0)
od:
– wykrywania błędów w
DNA i ich reperacji,
– inicjacji apoptozy w
przypadku niemożności
naprawienia mutacji,
– oceny długości
telomerów.
• W trakcie cyklu
podziałowego od:
– decyzji o kontynuacji
lub zatrzymaniu cyklu
w „punktach
kontrolnych”,
– prawidłowego rytmu
syntezy i degradacji
protoonkogenów, a
zwłaszcza cyklin.
G
0
Prawidłowa kontrola nad proliferacją
komórek zależy od:
25
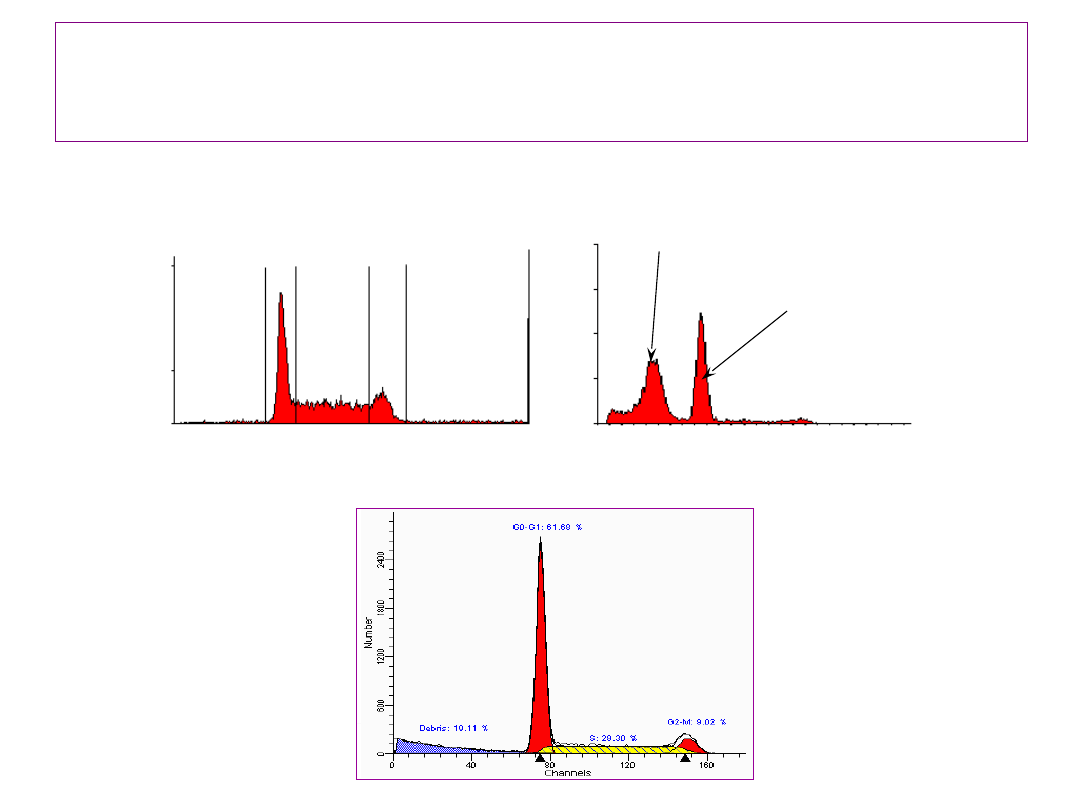
Cytometryczna ocena cyklu
komórkowego na podstawie analizy
zawartości DNA…
Fluorescence Intensity
PI - Fluorescence
#
o
f
E
v
e
n
ts
G
0
– G
1
G
2
- M
S
Apoptotic cells
Normal G
1
/G
0
cells
#
o
f
E
v
e
n
ts
26

• metody mikroskopowe (zliczanie,
wizualizacja stadiów podziału),
• znakowanie DNA (barwniki
fluorescencyjne, 3H-TdR, BrdU),
• znakowanie antygenów związanych z
proliferacją (PCNA, cykliny),
• „dividing cells’ tracing”,
Metody stosowane do oceny
proliferacji komórek:
27

• jedyna obecnie dostępna cytometryczna metoda
wieloparametrowej oceny proliferacji komórek i
ich fenotypu (CFSE),
• pozwala na analizę parametrów podziału
nieuchwytnych dla innych technik,
• długotrwałe, przyżyciowe znakowanie komórek,
• nietoksyczność (brak interferencji z
czynnościami życiowymi komórek i
mechanizmami podziału),
• proporcjonalny spadek zawartości znacznika po
każdym podziale,
• dostępne barwniki: CFSE,
dividing cells’ tracing
28
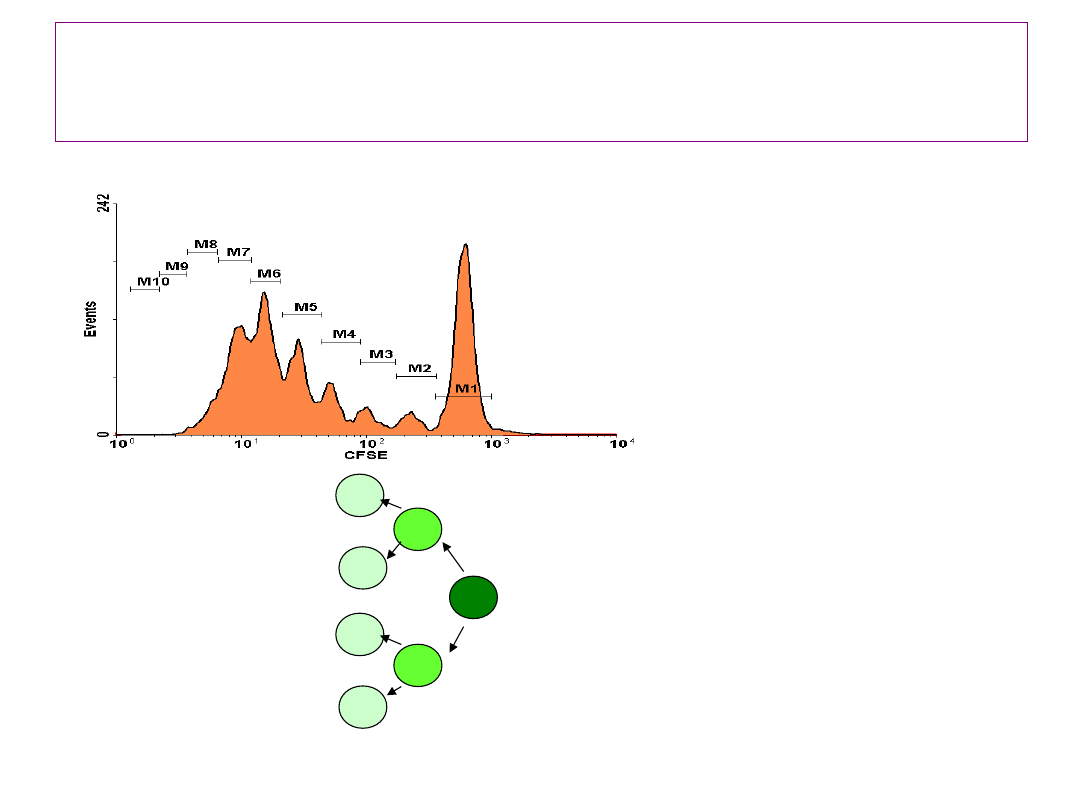
• Analiza
bezpośrednia :
• liczba cykli
podziałowych,
• liczba komórek w
kolejnych pokoleniach,
• fenotyp dzielących się
komórek;
• Analiza pośrednia
(obliczenia):
• charakterystyczna
liczba podziałów,
• czas pojedynczego
cyklu,
• liczba efektywnych
prekursorów,
• czas G
0
G
1
CFSE: carboxyfluorescein diacetate succinimidyl ester
2 1 0
Zasada metody oceny proliferacji z
użyciem cell division tracer (DCT)
29
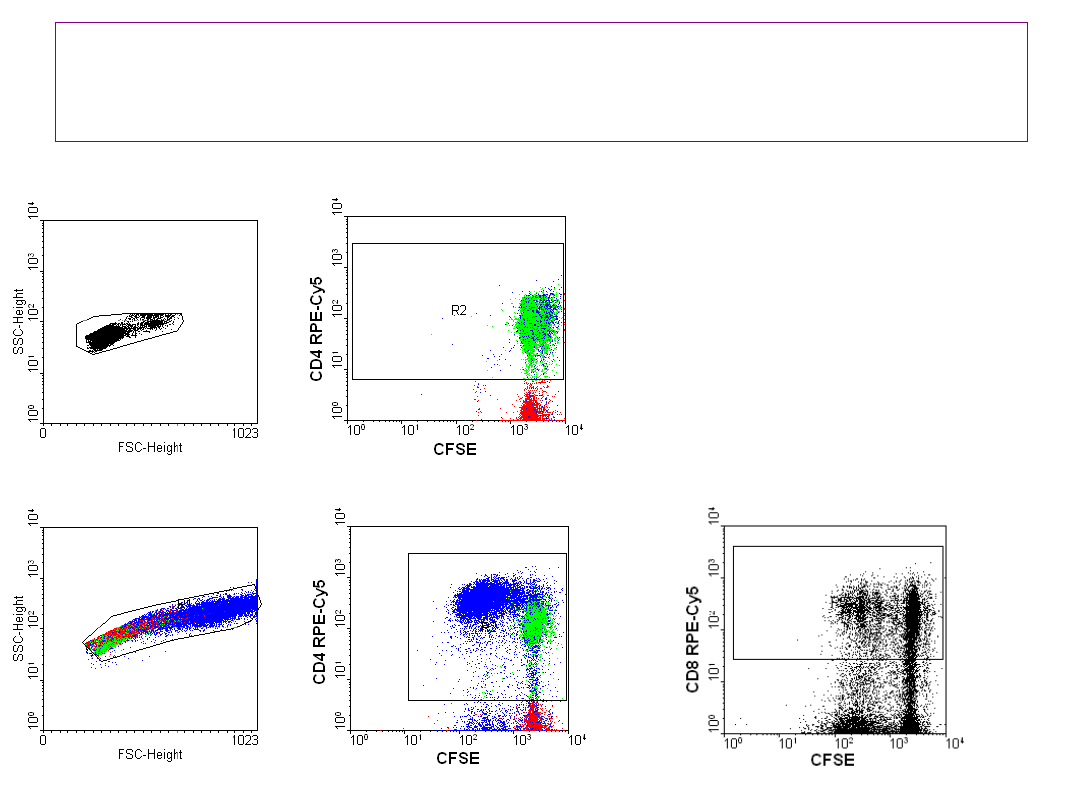
Metoda DCT umożliwia ocenę proliferacji
limfocytów o określonym fenotypie
30
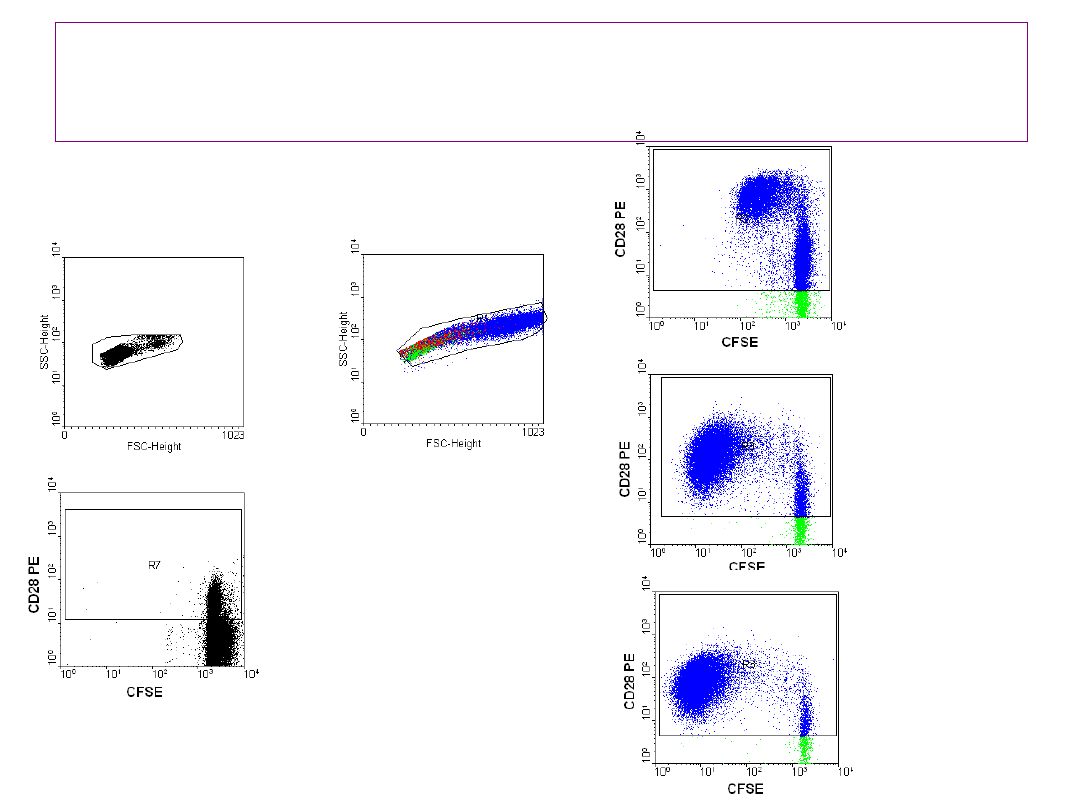
Bez stymulacji
Stymulacja
3 dzień
5 dzień
7 dzień
Metoda DCT umożliwia badanie kinetyki
proliferacji komórek
31
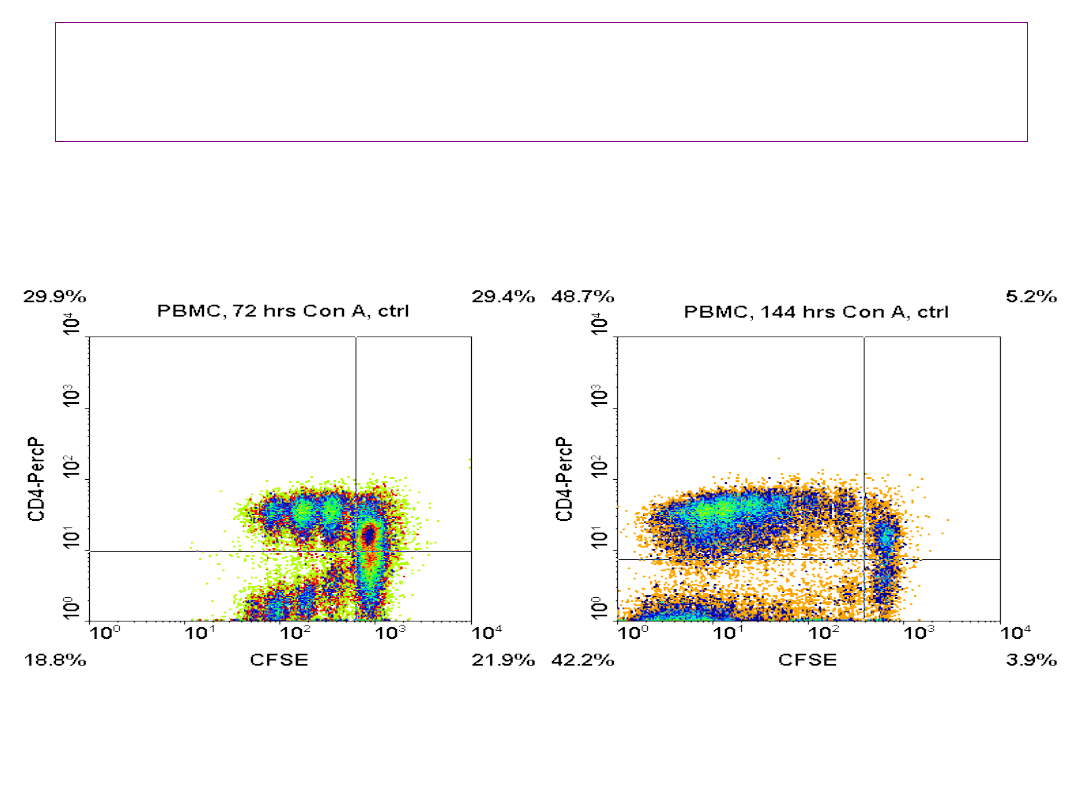
Fenotypowanie powierzchni komórek
dzielących się – stymulowanie
konkanawaliną A
32

III. Patofizjologia komórki -
- apoptoza
33

34

Początki apoptozy
Po raz pierwszy opisana w 1972r:
Apoptosis: a basic biological phenomenon with
wide ranging implications in tissue kinetics.
(Br.J.Cancer 1972 26:239)
Obecnie: programowana
śmierć komórki
35

Długość życia komórki
W organizmie znajduje się około 210 typów
komórek.
NARODZINY
RÓŻNICOWANIE
FUNKCJA
ŚMIERĆ
Neutrofile:
- krążące: 6 – 7 godzin,
- w tkance: 4 dni
Czerwone krwinki:
- 120 dni
36

Apoptoza a nekroza
NEKROZA
–
bierny, kataboliczny proces degeneracyjny;
–konsekwencja działania na komórkę czynników
uszkadzających jej funkcję w sposób nieodwracalny;
–proces niespecyficzny, którego obraz zależy od
rodzaju uwolnionych enzymów;
–powstałe produkty rozpadu komórki wywołują
odpowiedź
komórek należących do układu odpornościowego i
fagocytozę
prowadzącą do usuwania pozostałości martwych
komórek.
APOPTOZA
- proces czynny, często związany z aktywacją genów;
– szereg specyficznych zmian morfologicznych i
biochemicznych
37

Liza komórki
Tworzenie się pęcherzyków przez
otaczanie błoną komórkową
fragmentującej cytoplazmy
(ang. blebbing)
Powstawanie ciałek
apoptotycznych przez odrywanie
się pęcherzyków od komórki
macierzystej
Pęcznienie cytoplazmy i
mitochondriów,
Pęcznienie i dezintegracja
organelli komórkowych
Obkurczanie się cytoplazmy i
kondensacja chromatyny
Agregacja chromatyny przy błonie
jądrowej,
Fragmentacja cytoplazmy i
segregacja organelli komórkowych
Utrata integralności błony
komórkowej
Zmiana symetrii błony komórkowej
przy zachowaniu jej integralności
Grupy sąsiadujących
komórek
Pojedyncze komórki
NEKROZA
APOPTOZA
ZMIANY MORFOLOGICZNE
38

Proces pasywny,
niezależny od ATP,
przebiega również w 4
0
C
Aktywny proces zależny od ATP,
Nie przebiega w 4
0
C
Cięcie DNA w miejscach
przypadkowych
Cięcie DNA na mono i
oligonukleosomy
Proces przypadkowy i
nieuporządkowany przez
kaskady specyficznych
enzymów
Aktywacja kinaz białkowych i
fosfataz,
Wypływ cytochromu c i AIF z
mitochondriów
Zaburzenia funkcji
transporterów,
kanałów jonowych
Translokacja fosfatydyloseryny do
wewnętrznej warstwy błony
komórkowej
NEKROZA
APOPTOZA
ZMIANY BIOCHEMICZNE
39

Fagocytoza przez
makrofagi
Dotyka całych grup
komórek w tkance
Odczyn zapalny
Brak odpowiedzi zapalnej
Wywołana przede
wszystkim przez czynniki
patogenne: wirusy
wywołujące lizę komórki,
hipotermia, hipoksja,
ischemnia, trucizny
metaboliczne
Indukowana przez:
1. Zmianę fizjologiczną (spadek
poziomu czynników
troficznych i wzrostowych,
zmiany w dopływie hormonów
2. Działanie toksyn (zewnętrznych
czynników uszkadzających,
toksyn komórkowych np. ROS)
NEKROZA
APOPTOZA
W pojedynczych komórkach
rozsianych w tkance
prawidłowej
Fagocytoza przez rezydujące
komórki żerne (układ nerwowy –
mirkoglej)
oraz wędrujące makrofagi
ODPOWIEDŹ TKANKOWA
40
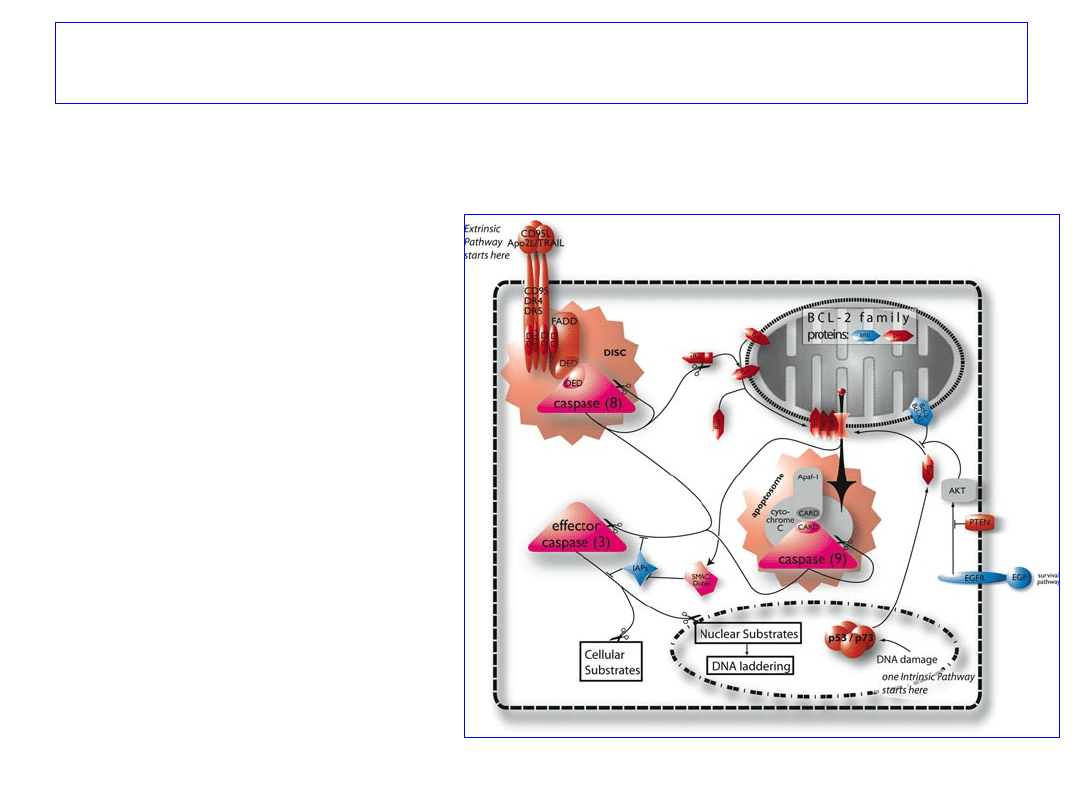
Ścieżki prowadzące do apoptozy
1. Z wykorzystaniem
receptorów śmierci
2. Mitochondrialna
Elementem obu ścieżek
aktywacja
KASPAZY 3
41
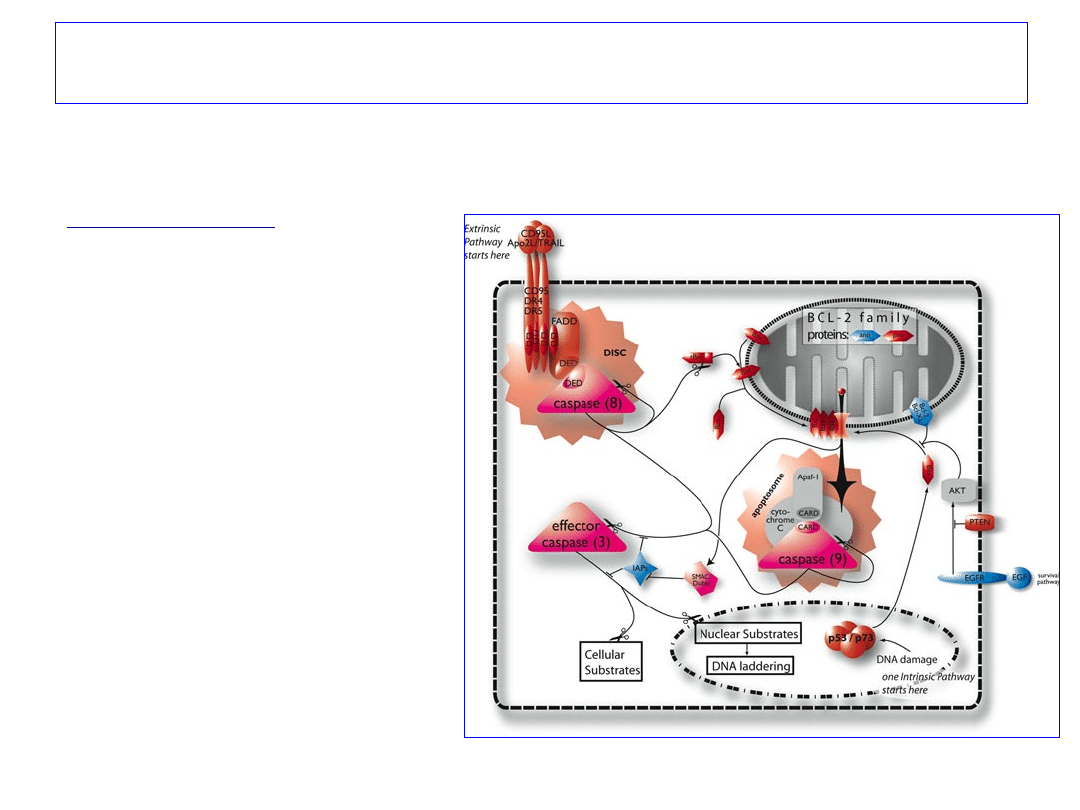
Ścieżka wykorzystująca receptory
śmierci
CD95 i TNFR1
1.Związanie przez CD95
ligandu (CD95L) powoduje
tworzenie kompleksu
pośredniczącego w
przekazywaniu sygnału
prowadzącego do apoptozy
2.
FADD
pośredniczy w
wiązaniu
kaspazy 8
42
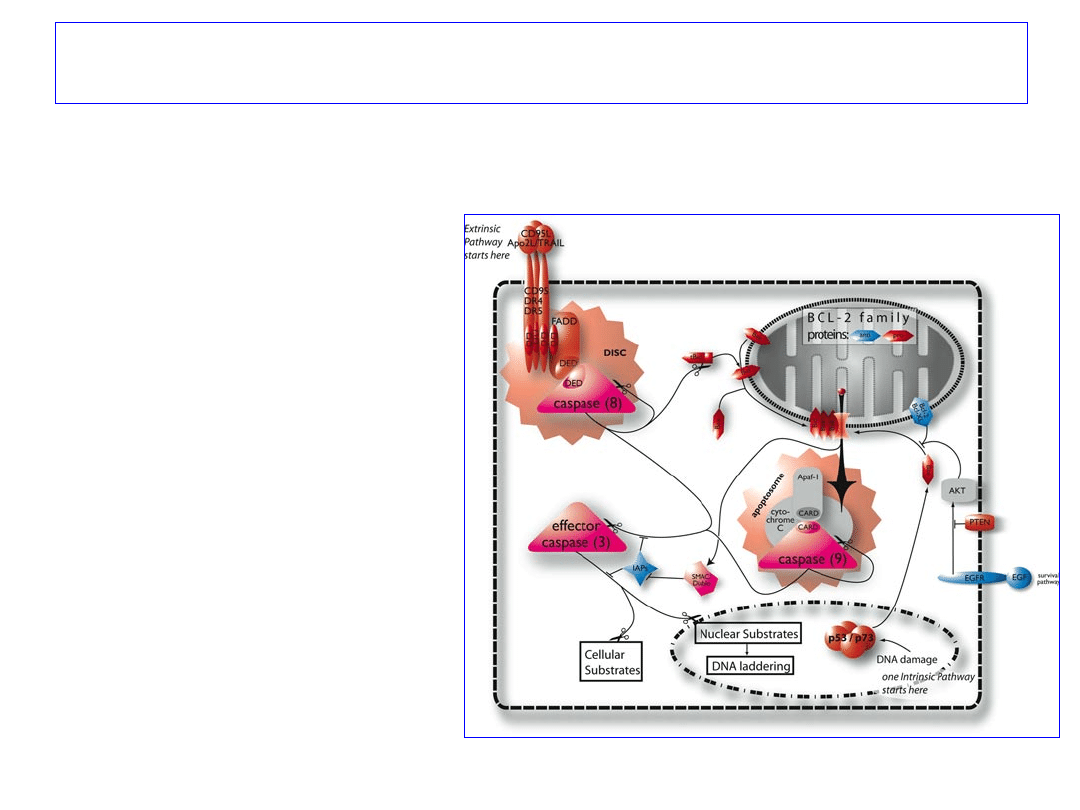
Ścieżka mitochondrialna
1. Uszkodzenia DNA i
sygnały wewnątrzkomórkowe;
2.
Końcowym etapem jest
formacja
APOPTOSOMU:
- cytochrom c,
- Apaf-1
,
-
prokaspaza 9.
43
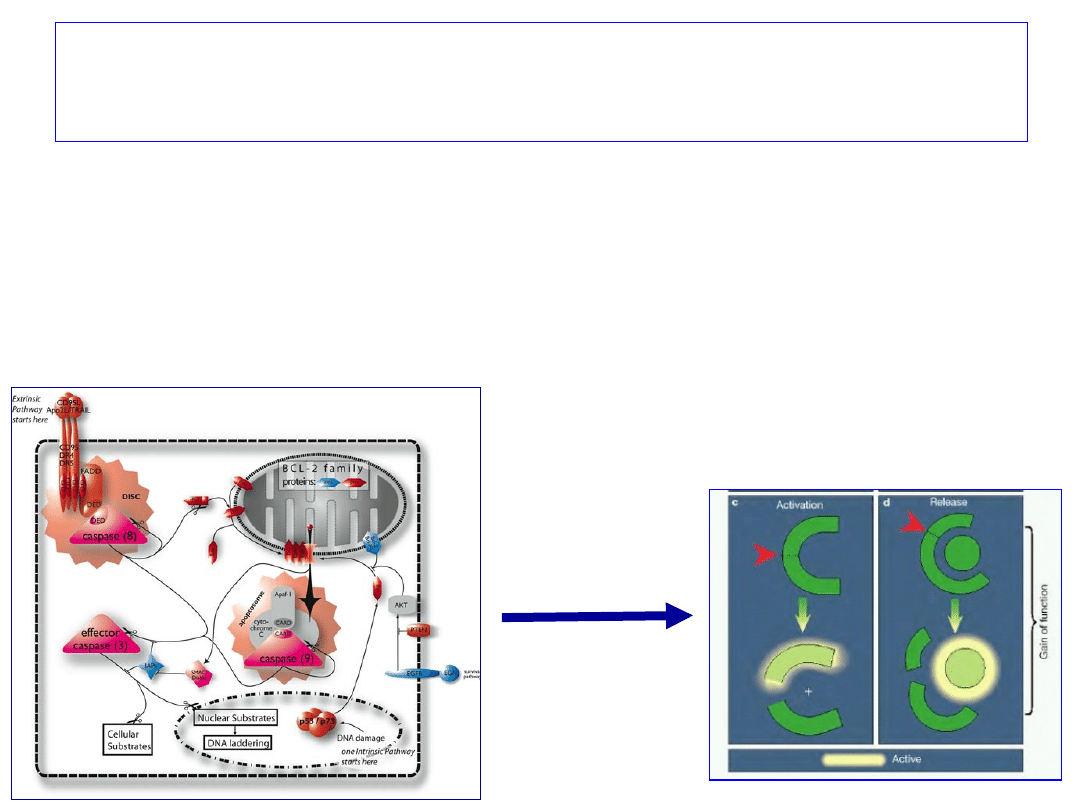
Kaspazy
są kluczowymi enzymami w
apoptozie
Proteazy cysteinowe, dzielone na:
- kaspazy inicjatorowe (8, 9, 10, 12)
(od momentu aktywacji kaspazy następuje ciecie i aktywacja
kolejnych kaspaz w kasadzie enzymatycznej);
- kaspazy efektorowe (3, 6, 7)
(tną białka jądrowe i szkieletu komórkowego)
44
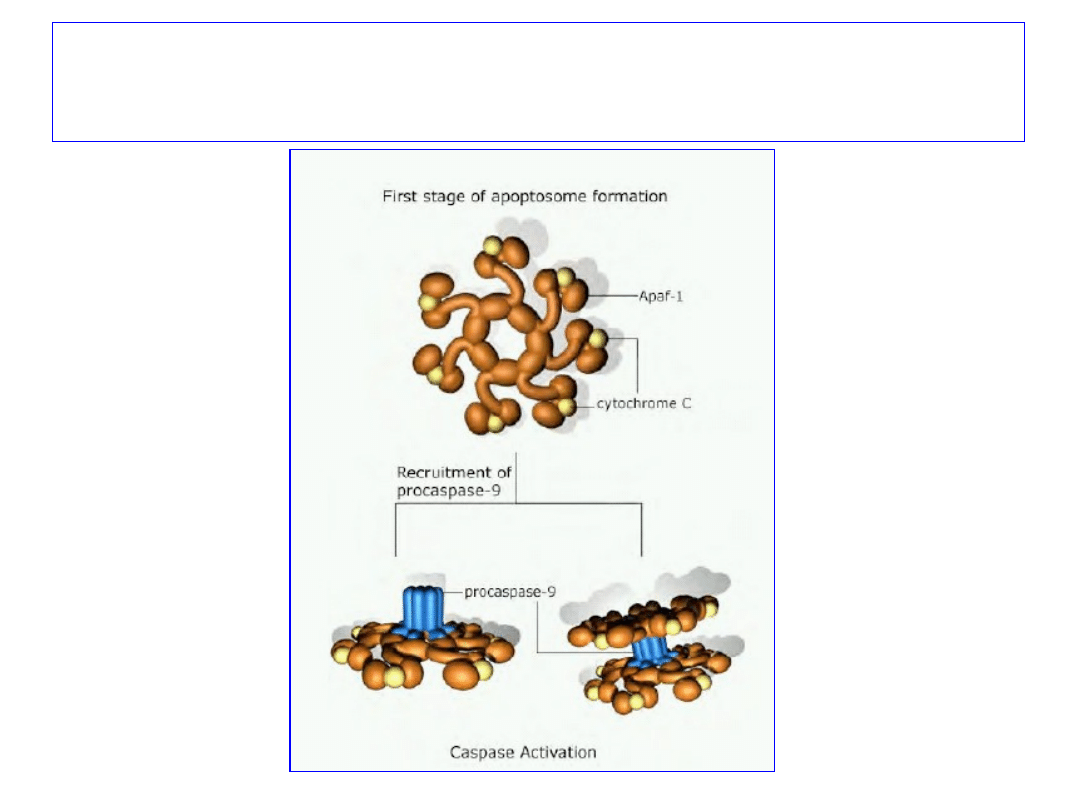
Aktywacja kaspaz prowadzi do
utworzenia apoptosomu
45
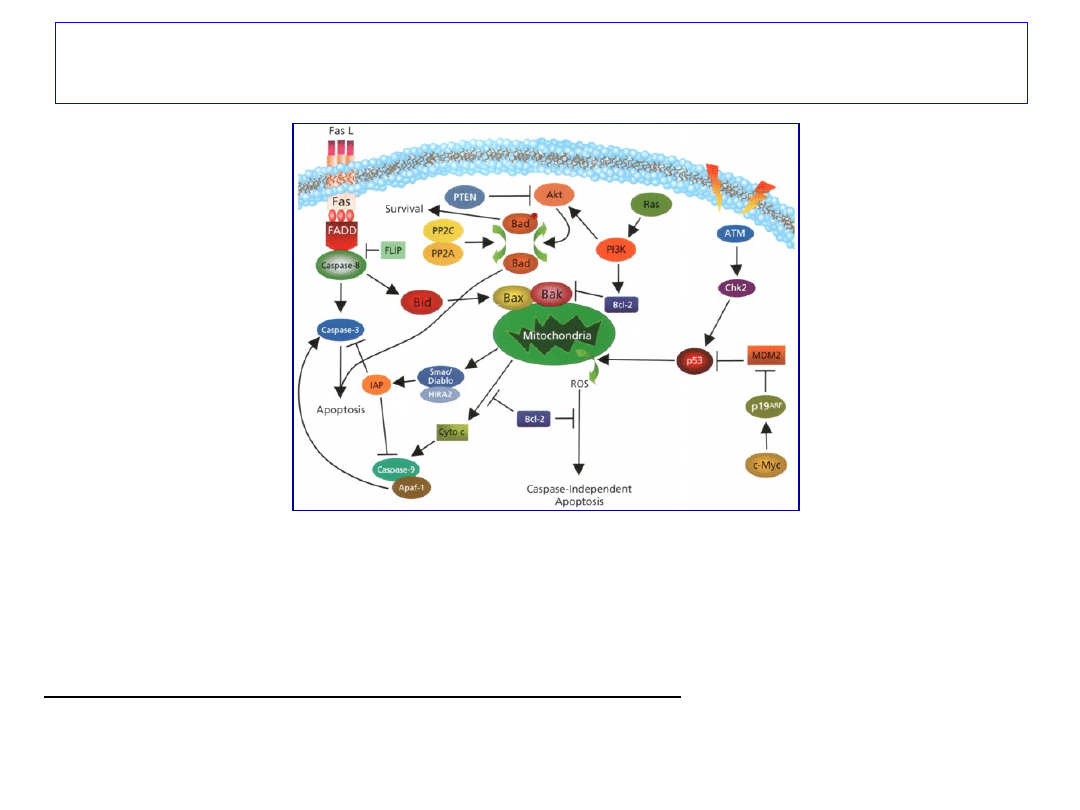
Rodzina białek Bcl
Pro:
Bax
Bik
Bad
Bid
Bim
Smac/Diabl
o
PTEN
PP2
p53
Anty:
Rodzina
Bcl:
Bcl-2
Bcl-X
IAP
Akt
Około 12 różnych białek, które zapewniają zachowanie struktury
mitochondrium,
zapobiegają uwalnianiu cytochromu c i blokują aktywację kaspazy 9
Możliwe mechanizmy działania białek Bcl:
-tworzenie porów w błonie mitochondrium i oddziaływanie z białkami
mitochondrium
-heterodimeryzacja białek
-bezpośrednia regulacja kaspaz
-oligomeryzacja – tworzenie selektywnych kanałów jonowych
46
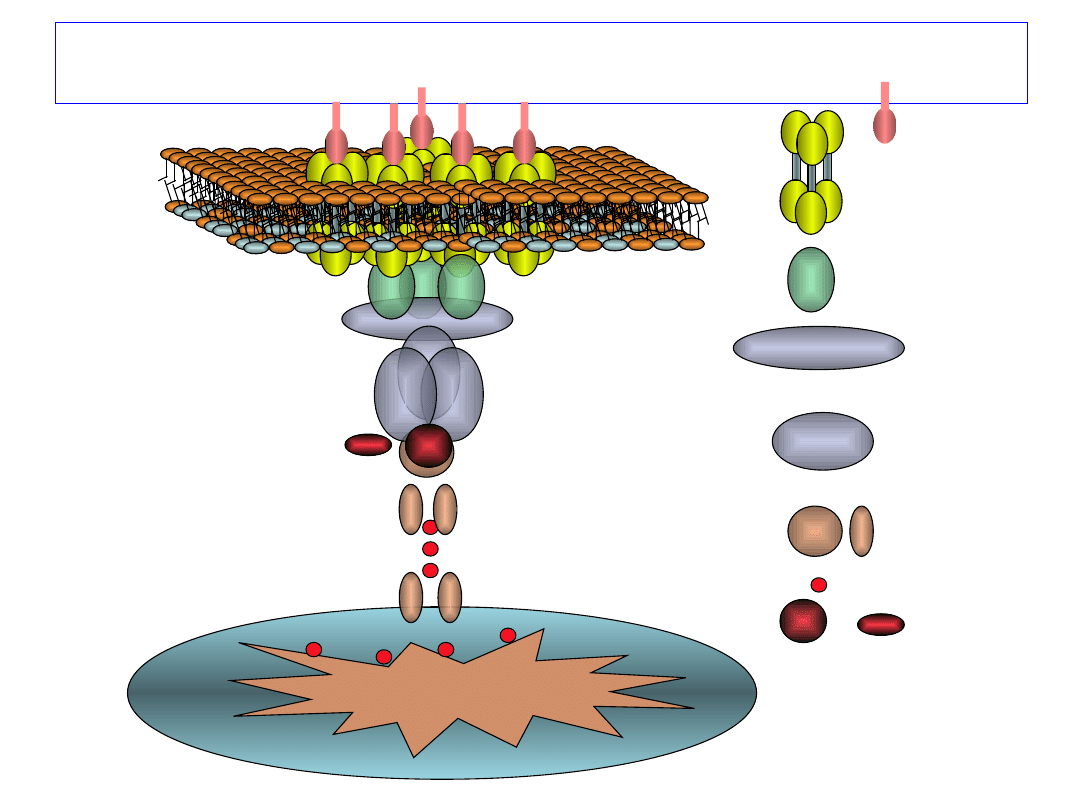
Faza indukcji apoptozy
FAS
(CD95)
FAS-L
FADD
PROKASPAZA 8
KASPAZA 8 (FLICE)
BID
Cytochrom C
Mitochondrium
JMW ‘2004
KASPAZA 3
47
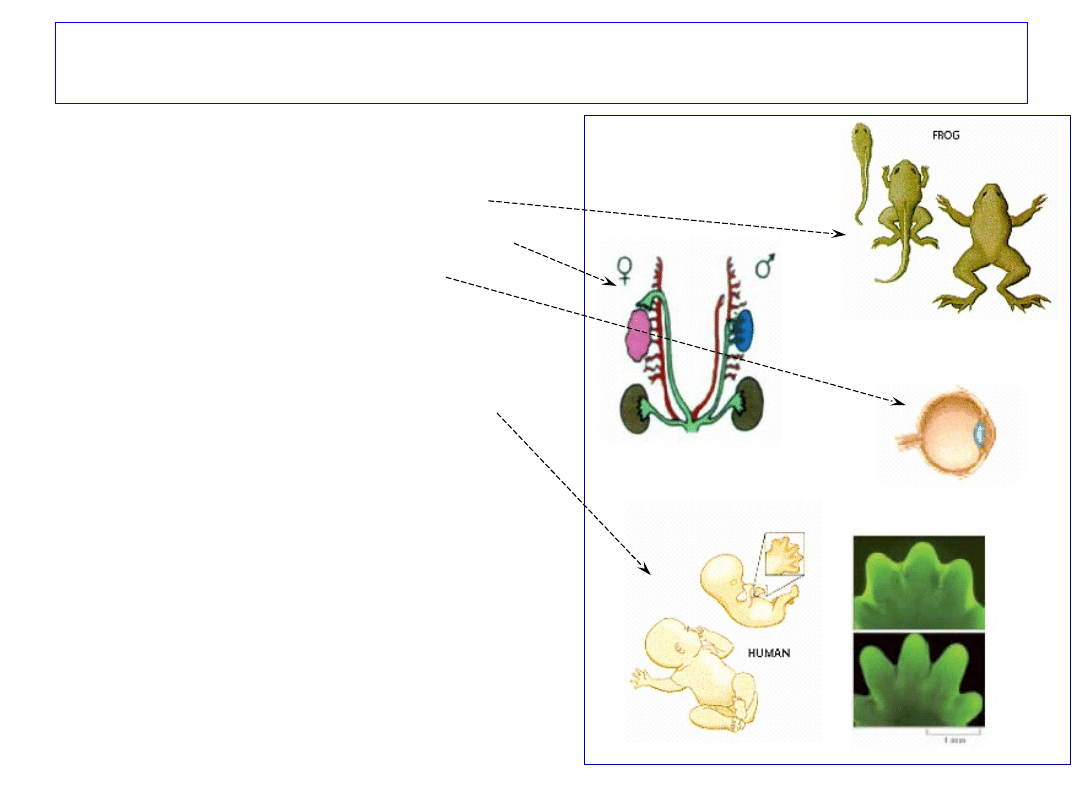
Znaczenie apoptozy
1. Rozwój i morfogeneza:
-
utrata ogona przez kijankę
- tworzenie organów płciowych
- soczewka oka
- wczesny etap rozwoju układu
nerwowego (około 50% neuronów ginie)
- tworzenie palców stóp i rąk
2. Homeostaza w organizmie
48

Fizjologiczne „zastosowania” apoptozy
• Usuwanie komórek „nadmiarowych” lub uszkodzonych
bez wylania skladników cytoplazmy do otoczenia
• Embriogeneza
• Rozwój układu nerwowego ( optymalizacja sieci neuronów)
• Rozwój kończyn (usuwanie błon pławnych)
• Rozwój układu moczo-płciowego
• Odpowiedź immunologiczna
• Usuwanie komórek zainfekowanych przez wirusy
• Usuwanie komórek transformowanych nowotworowo
• Apoptoza limfocytów T zależna od aktywacji (AICD)
• Eliminacja komórek efektorowych po usunięciu antygenu
• Wymiana („obrót”) komórek w dojrzałych tkankach
• Usuwanie „starych”, „zużytych” komórek
49

Patologiczny
nadmiar
apoptozy
• AIDS (apoptoza limfocytów CD4+)
• Choroby neurodegeneracyjne (apoptoza neuronów)
• Choroba Alzheimera
• Choroba Parkinsona
• Stwardnienie boczne zanikowe
• Retinitis pigmentosa
• Padaczka
• Choroby infekcyjne
• Zapalenie płuc wywołane P. aeruginosa (apoptoza nabłonków)
• Zapalenia jelit (apoptoza nabłonków)
• Choroby hematologiczne (apoptoza prekursorów szpikowych)
• Anemia aplastyczna
• Zespół mielodysplastyczny
• Niedobór dehydrogenazy glukozo-6-fosforanu
• Uszkodzenia tkanek
• Zawał serca
• Udar mózgu
• Choroba niedokrwienna nerek
50

Patologiczne
zahamowanie
apoptozy
• Nowotwory
• Rak okrężnicy
• Glejak, neuroblastoma
• Rak prostaty
• Hepatoma
• Białaczki (zwłaszcza B-CLL) i chłoniaki
• Choroby autoimmunizacyjne
• Myastenia gravis obniżona ekspresja FAS na
tymocytach
• Toczeń układowy podwyższona ekspresja bcl-2 w
limfocytach T
• Choroby zapalne
• Dychawica oskrzelowa apoptoza EOZYNOFILÓW w oskrzelach
• Infekcje wirusowe
• Adenowirusy (rola w kancerogenezie?)
• Bakulowirusy
51
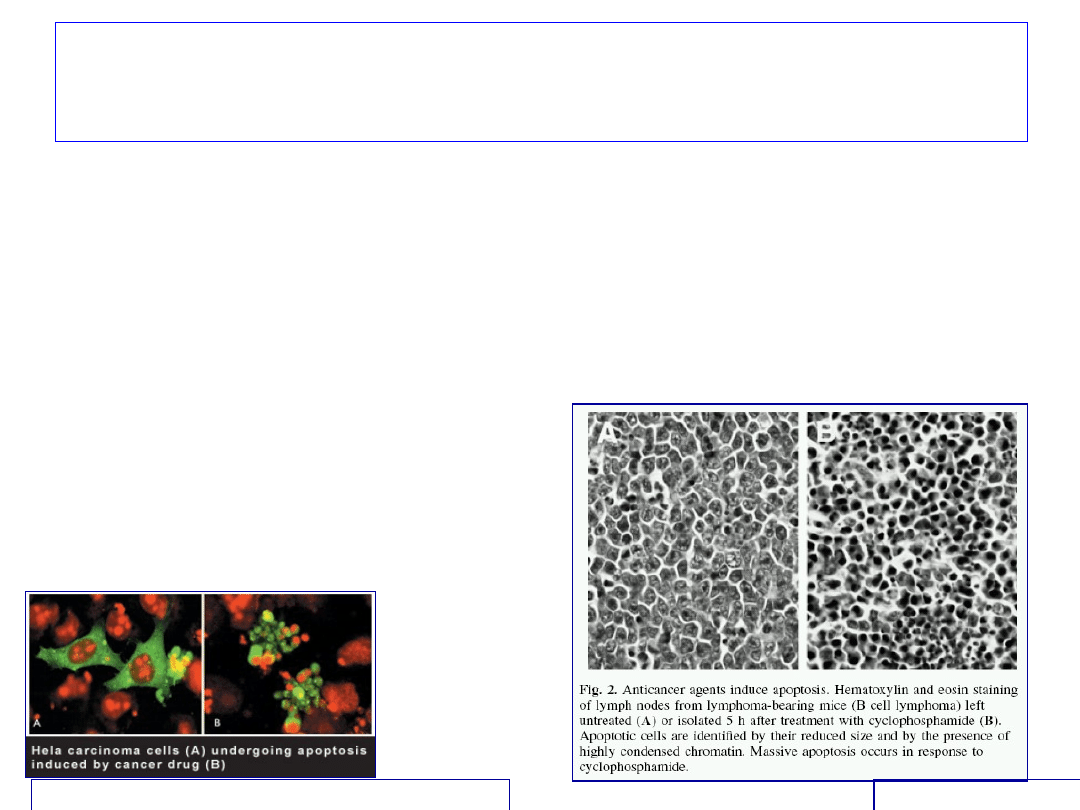
Zaburzenia apoptozy w komórkach
nowotworowych
• Nadekspresja Bcl-2 (mutacja, translokacja)
• redukcja normalnie przebiegającej apoptozy
• redukcja apoptozy pod wpływem uszkodzeń
Leki przeciwnowotworowe powodują apoptozę
zmienionych chorobowo
komórek
Carcinogenesis 2000
Institute of Molecular and Cell Biology, Singapore
52
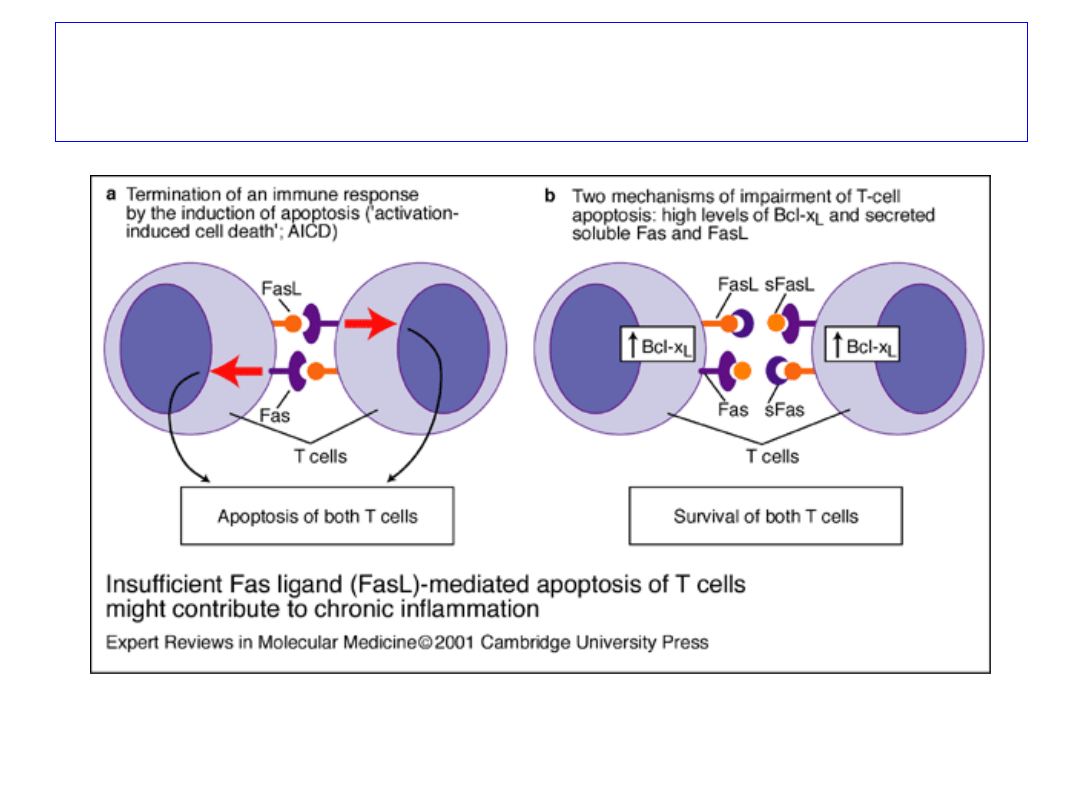
Zaburzenia apoptozy zaktywowanych
limfocytów T może prowadzić do procesów
chorobowych
53
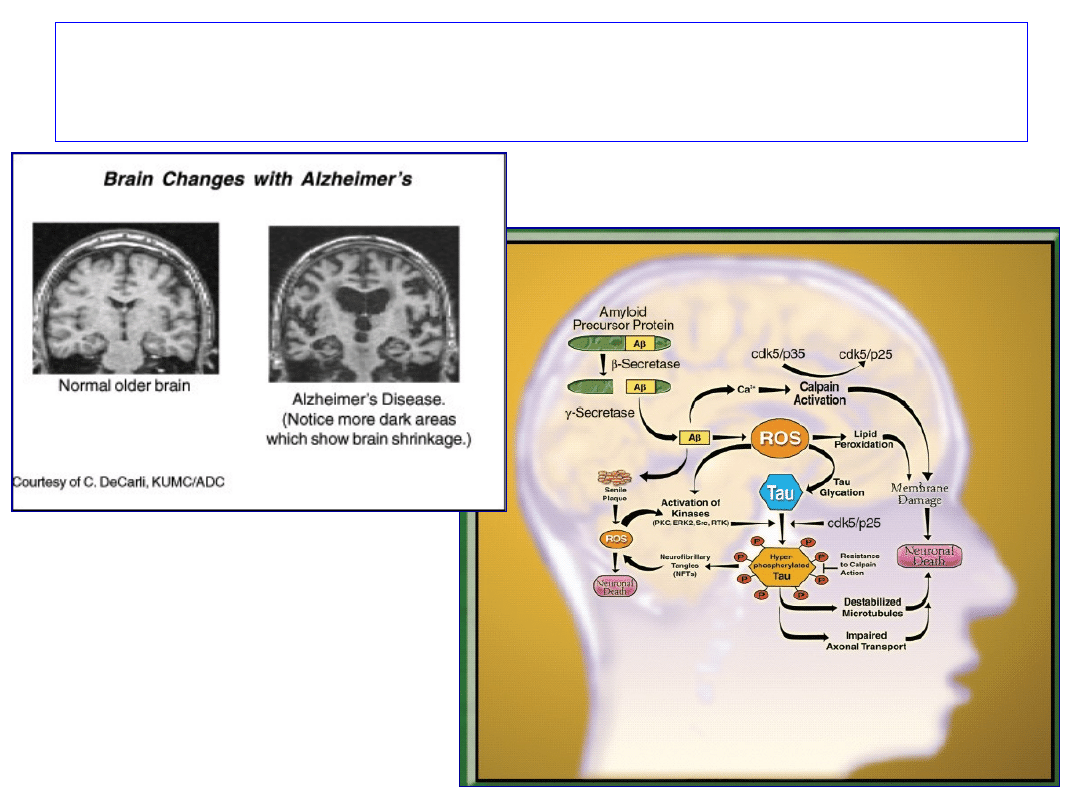
Zaburzenia apoptozy w komórkach
nerwowych osób z chorobą
Alzheimer’a
54
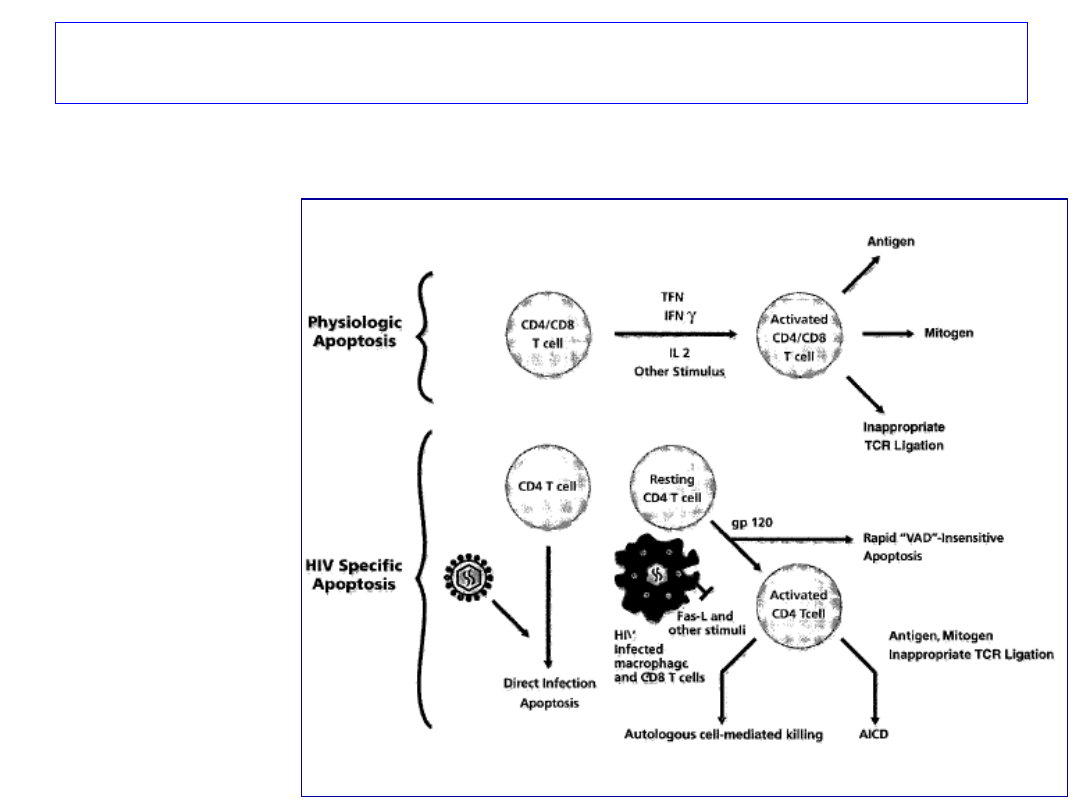
HIV
Infekcja wirusem HIV związana jest z postępującym ubytkiem
ilości limfocytów CD4, a w konsekwencji zaburzeniami odporności.
55
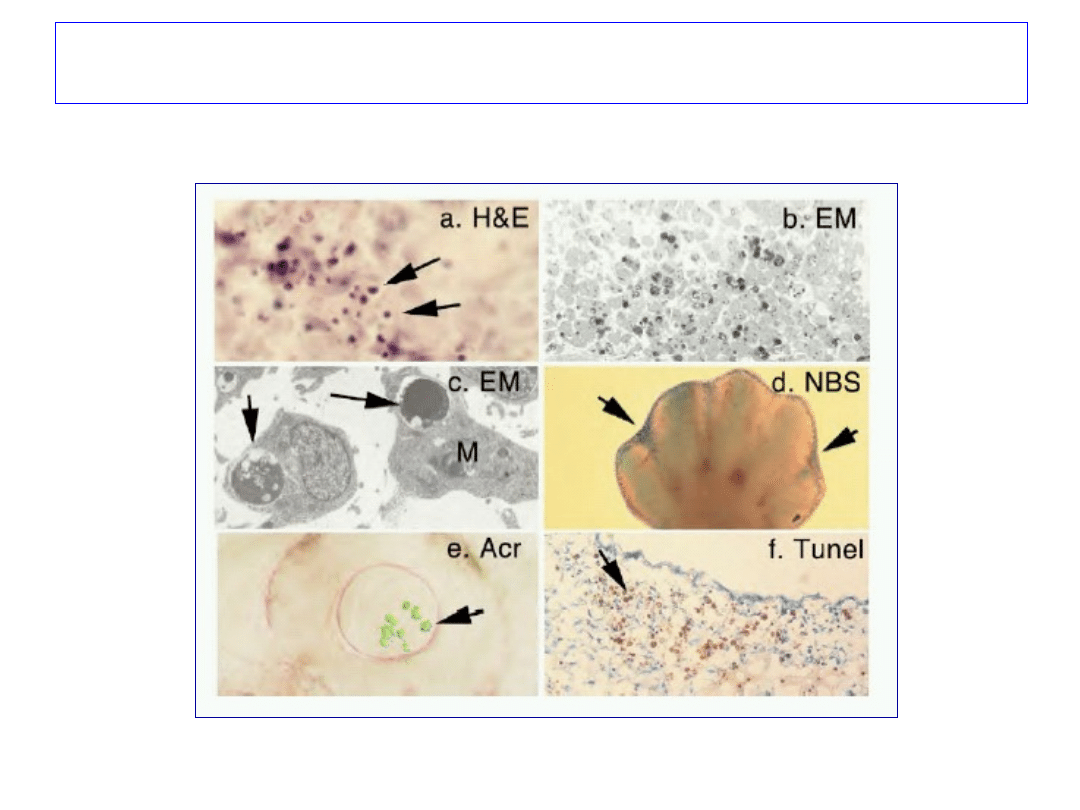
Metody badania apoptozy
56
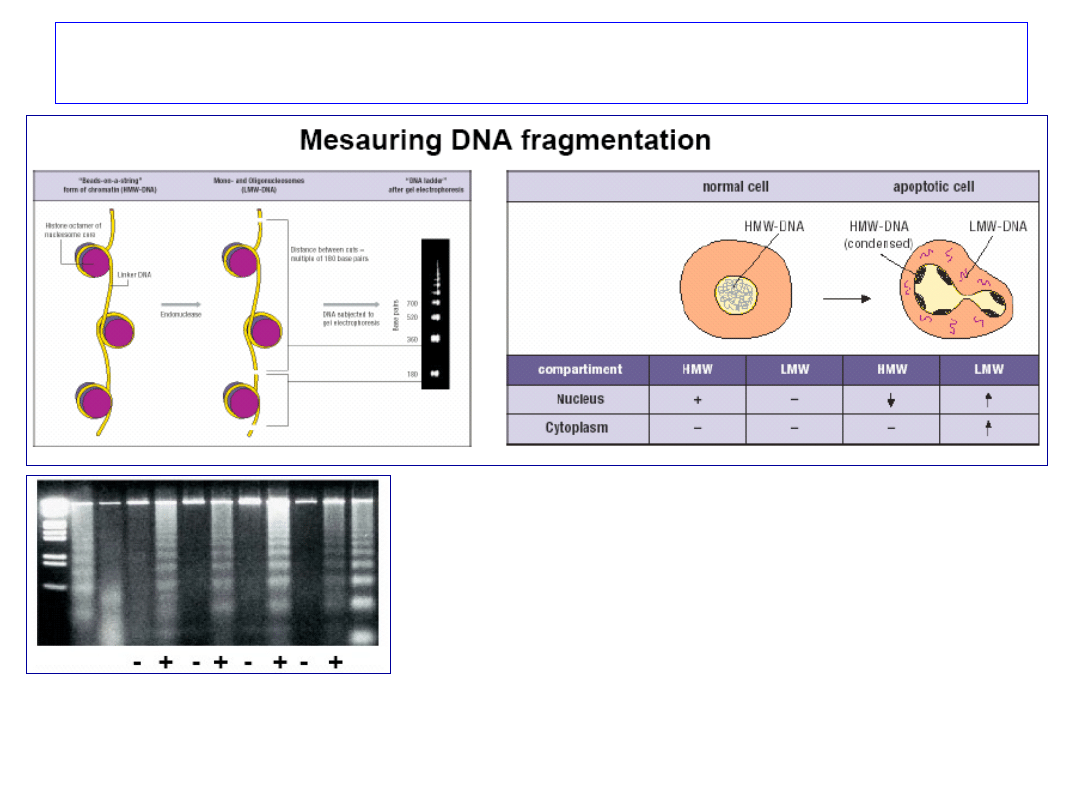
Apoptoza – fragmentacja DNA
57
Pomiar fragmentacji DNA
58
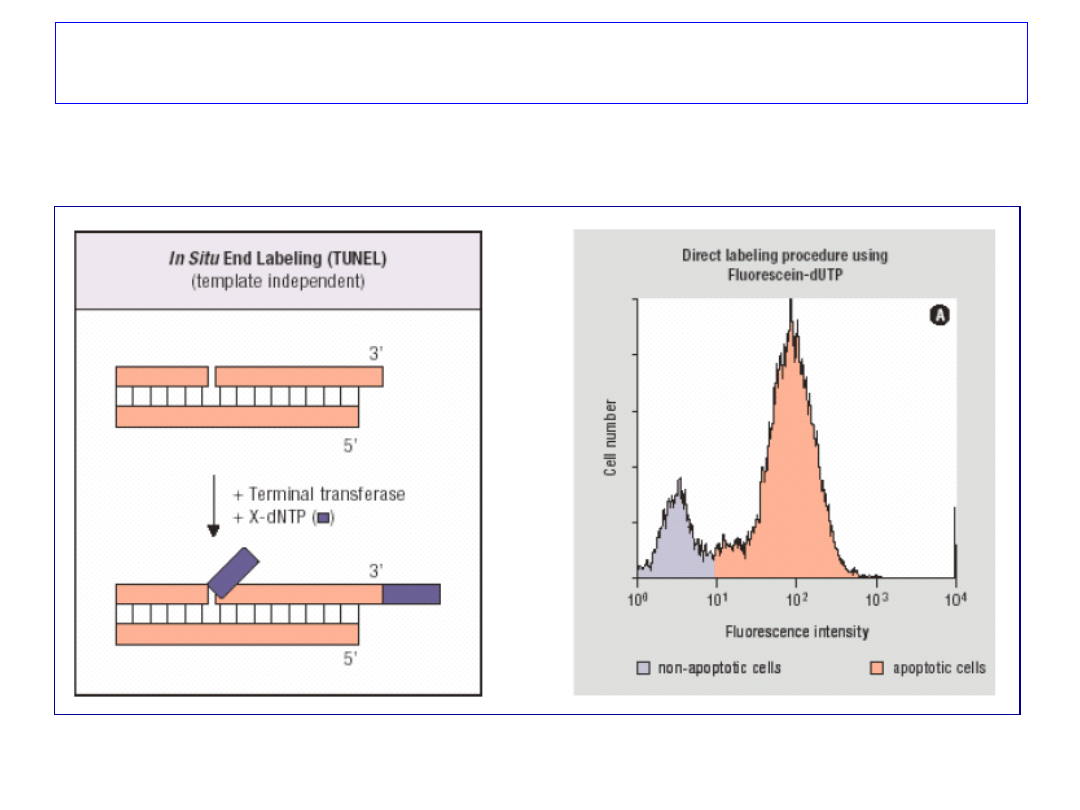
Metody cytometryczne stosowane do
oceny apoptozy komórek
• zmiana struktury powierzchniowej – Aneksyna V,
• zmiana potencjału mitochondriów – JC-1,
• pomiar ilości DNA – ocena fazy sub-G1.
59
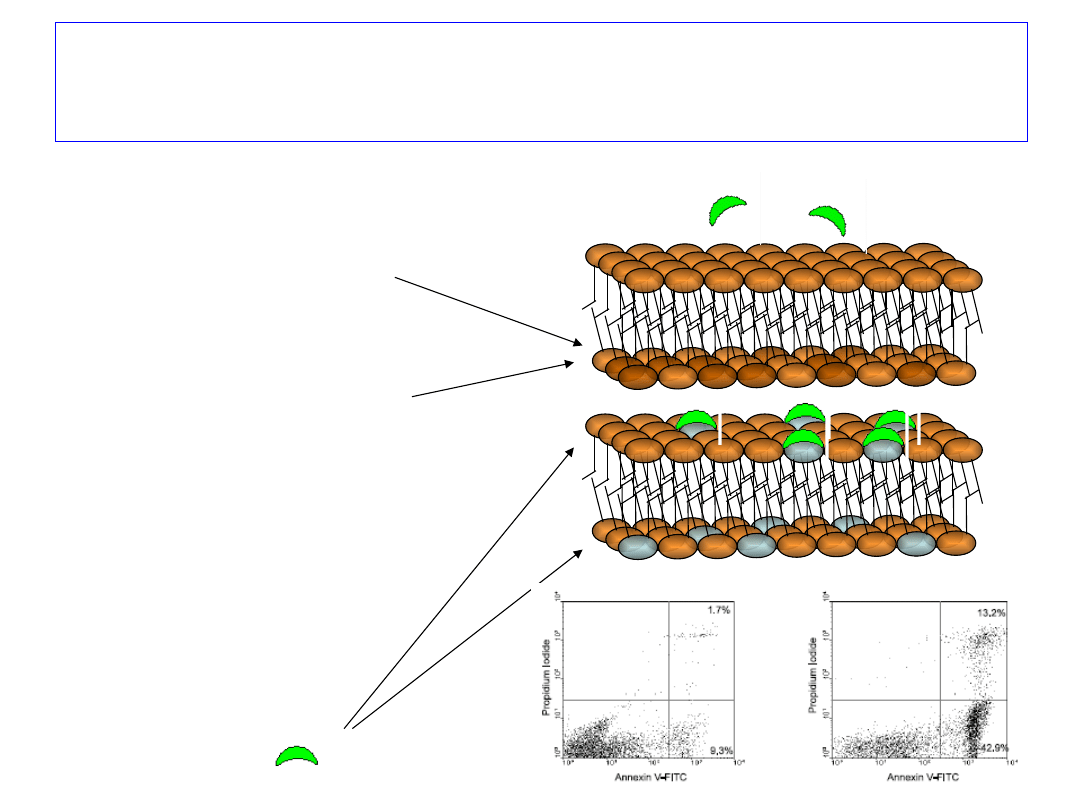
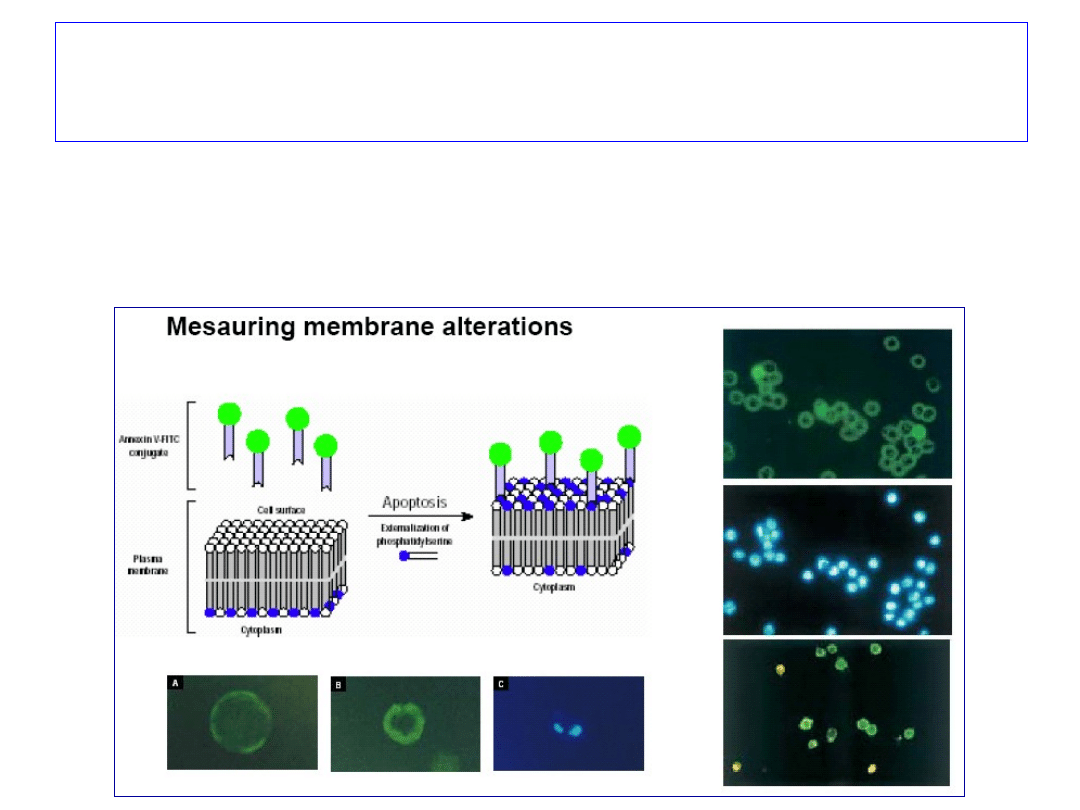
Wykrywanie apoptozy – utrata symetrii
błony komórkowej
• błona komórkowa jest
asymetryczna,
• fosfatydyloseryna (PS)
występuje w
wewnętrznej
(cytoplazmatycznej)
warstwie błony,
• utrzymanie asymetrii
błony wymaga energii
(ATP) i aktywności
enzymów (flipaz),
• w komórkach
apoptotycznych PS
migruje na zewnątrz
błony
• PS wiąże białka z grupy
ANEKSYN
60

Badanie mitochondrialnego potencjału
błonowego
Utrata mitochondrialnego potencjału błonowego (ΔΨ) jest
pierwszym etapem wewnątrzpochodnej drogi apoptozy.
JC-1, lipofilowy, kationowy barwnik fluorescencyjny łatwo
penetruje przez błony komórkowe.
Monomery JC-1 (emitujące zieloną fluorescencję) przy
wysokim ΔΨ wchodzą do matrix mitochondrium i przy
odpowiednim stężeniu tworzą agregaty JC-1 – emitujące
czerwoną fluorescencję.
Utrata ΔΨ utrudnia akumulację JC-1 i agregaty nie mogą być
tworzone. Efektem takich właściwości JC-1 jest fakt, że
komórki apoptotyczne wykazują tylko fluorescencję
monomerów (zieloną), rozrzuconych po cytoplazmie.
61
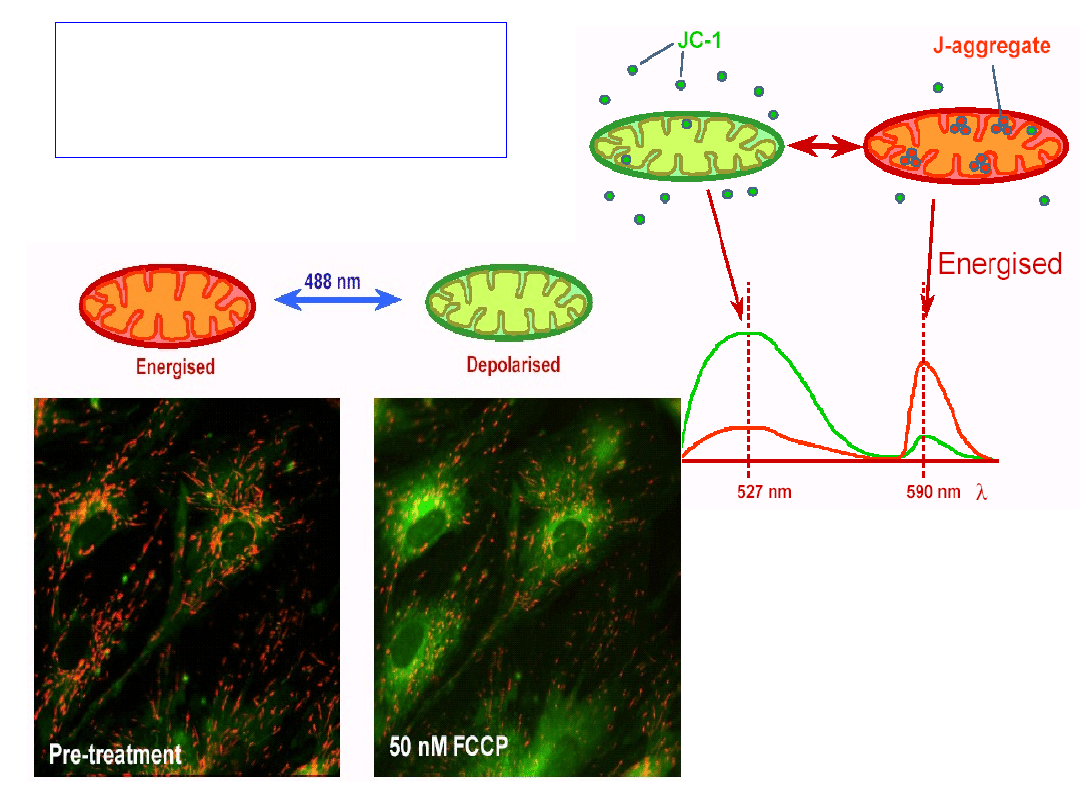
From Per O.G.
Arkhammar,
BioImage A/S,
2000
Akumulacja JC-1
w
mitochondriach
62

1. Ocena proliferacji limfocytów T z krwi
obwodowej – pod wpływem stymulacji z
jednoczesną oceną fenotypu dzielących
się komórek.
2. Ocena podatności na apoptozę komórek
nowotworowych linii MOLT4 – mierzona
oceną spadku potencjału
mitochondrialnego.
Co będzie przedstawione na
ćwiczeniach?
63
Omówienie wyników
64
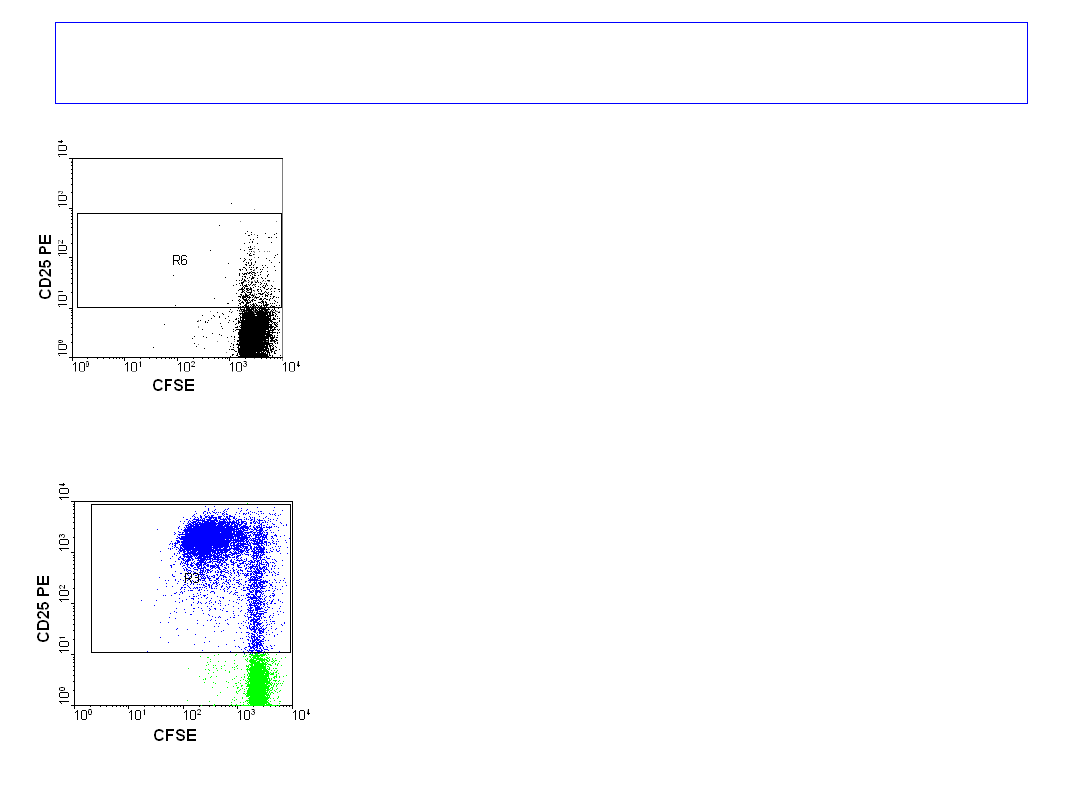
Badanie proliferacji
limfocytów T krwi obwodowej
znakowanych CFSE,
hodowanych przez 72 godziny,
bez stymulatora i ze stymulatorem.
Barwienie przeciwciałami anty-
CD25
PE i anty- CD4 RPE Cy5
po 3 dniach.
3 dzień
3 dzień
Omówienie wyników - proliferacja
65
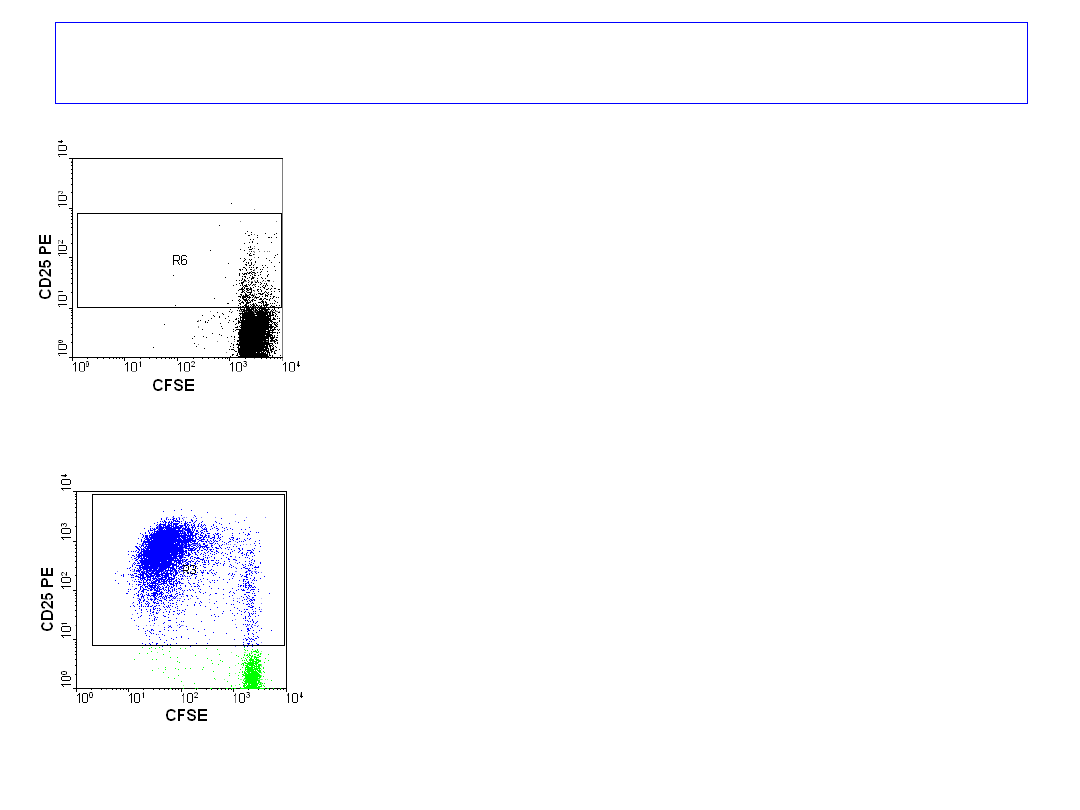
Badanie proliferacji
limfocytów T krwi obwodowej
znakowanych CFSE,
hodowanych przez 4 dni,
bez stymulatora i ze stymulatorem.
Barwienie przeciwciałami anty-
CD25
PE i anty- CD4 RPE Cy5
po 4 dniach.
4 dzień
4 dzień
Omówienie wyników - proliferacja
66
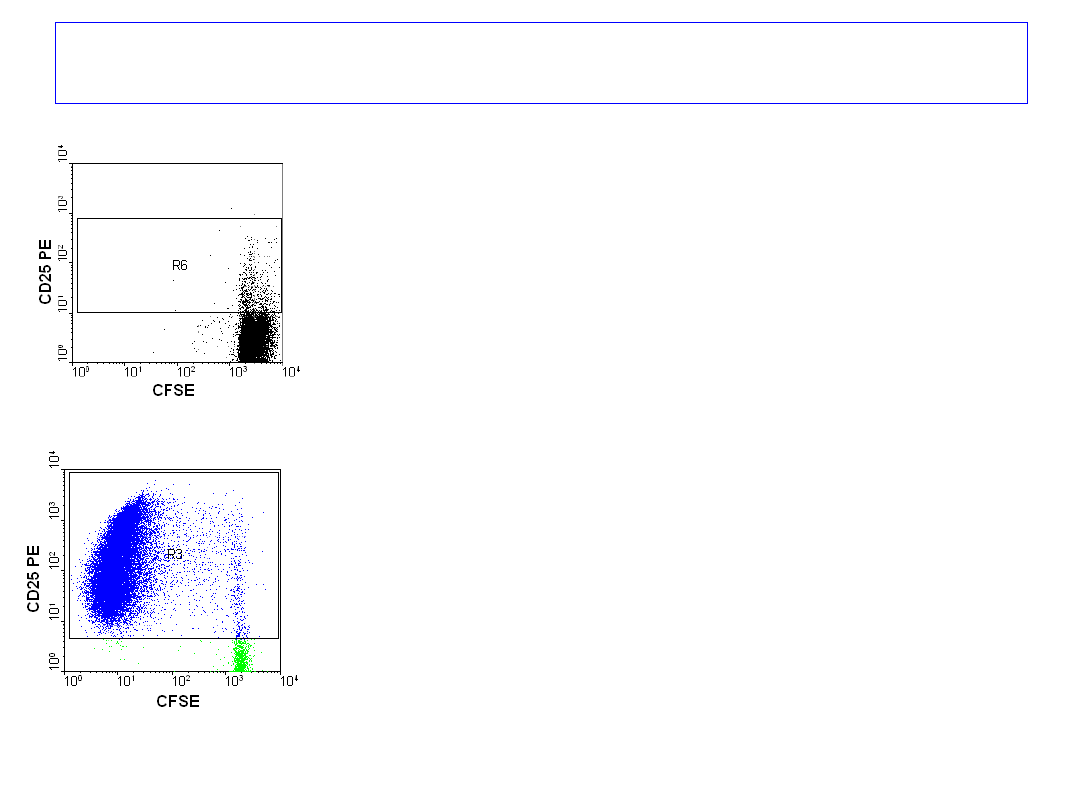
Badanie proliferacji
limfocytów T krwi obwodowej
znakowanych CFSE,
hodowanych przez 6 dni,
bez stymulatora i ze stymulatorem.
Barwienie przeciwciałami anty-
CD25
PE i anty- CD4 RPE Cy5
po 6 dniach.
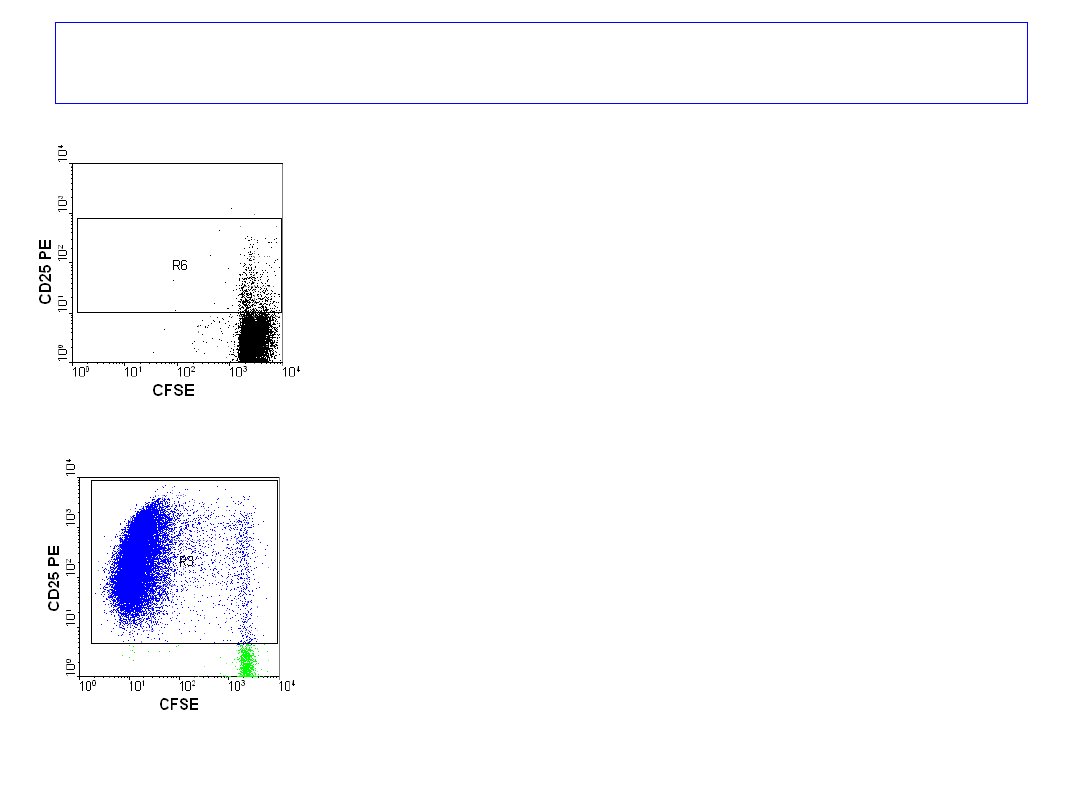
6 dzień
6 dzień
Omówienie wyników - proliferacja
67
Badanie proliferacji
limfocytów T krwi obwodowej
znakowanych CFSE,
hodowanych przez 7 dni,
bez stymulatora i ze stymulatorem.
Barwienie przeciwciałami anty-
CD25
PE i anty- CD4 RPE Cy5
po 7 dniach.
7 dzień
7 dzień
Omówienie wyników - proliferacja
68
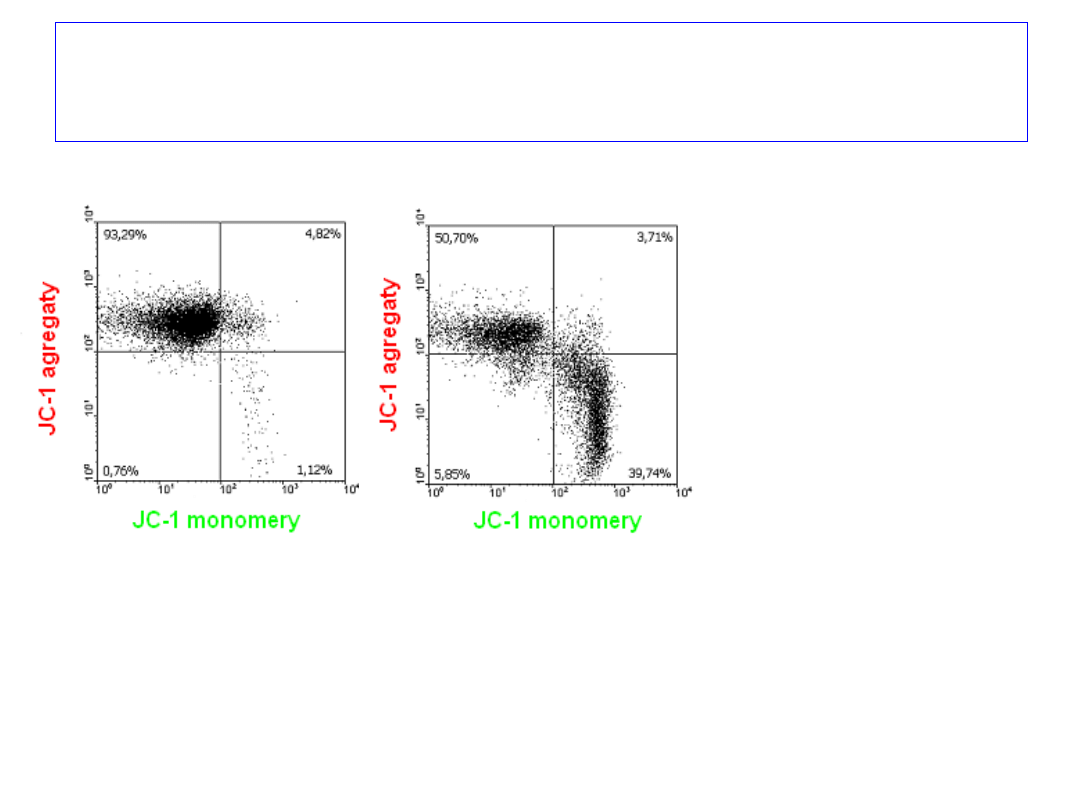
Detekcja JC-1 odbywa się
na dwóch kanałach –
zielonym
dla
monomerów, i
czerwonym
– dla
agregatów.
Apoptoza (depolaryzacja
mitochondriów) jest
reprezentowana jako
przesunięcie w dół i/lub w
prawo na wykresie.
Reprezentatywna
analiza
mitochondrialnego
potencjału
błonowego JC-1 w
komórkach Jurkat
inkubowanych z
kamptotecyną
(inhibitor
topoizomerazy).
Analiza potencjału mitochondrialnego
metodą cytometrii przepływowej
69
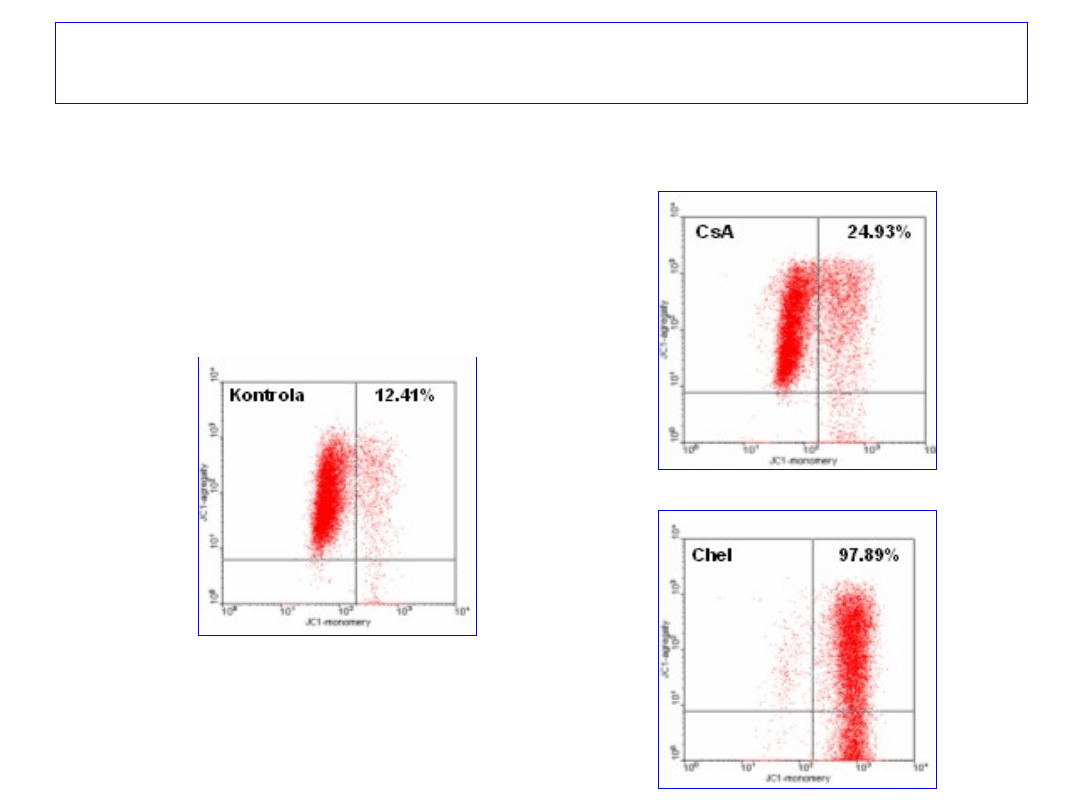
Omówienie wyników - apoptoza
70
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
Wyszukiwarka
Podobne podstrony:
Cytometria przepływowa
cytometria przepływowa
Podstawy cytometrii przeplywowej oznaczanie subpopulacji komorek
Cytometria przepływowa wprowadzenie
Cytometria przeplywowa i laser 4520
Cytometria przepływowa w diagnostyce niedoborów odporności
W02b Patofizjologia zaburzeń proliferacji komórek
06 Patofizjologia zaburzeń proliferacji komórek
Komórki dendrytyczne – subpopulacje i oznaczanie za pomoca cytometrii przepływowej
Patofizjologia zaburzeń proliferacji komórek
Budowa cytometru przepływowego
Wykład 3 Patofizjologia zaburzeń proliferacji komórek
Cytometria przepływowa
CWICZENIE 8 III rs zaburzenia w krazeniu zator zakrzepica krwotok
Cytometria przepływowa
cytometria przepływowa
więcej podobnych podstron