
CYTOMETRIA PRZEPŁYWOWA
I LASEROWA CYTOMETRIA SKANINGOWA W MEDYCYNIE
Cytometr przepływowy (flow cytometer, FC) FACSCalibur pozwala na pomiar
intensywności czterech kolorów fluorescencji wzbudzonych światłem jednego (argon laser,
488 nm) lub dwóch laserów (red diode laser, 635 nm) oraz pomiar światła rozproszonego
w komórkach umieszczonych w zawiesinie i zabarwionych fluorochromami lub
przeciwciałami sprzężonymi z fluorochromami. Pomiar w FC opiera się na założeniu,
że intensywność emitowanej fluorescencji wywołanej iluminacją komórki światłem lasera
o długości fali zbliżonej do maksimum absorpcji dla danego fluorochromu jest wprost
proporcjonalna do ilości składnika komórki znakowanego tym fluorochromem. Pomiar
światła rozproszonego, mierzonego w przedłużeniu promienia lasera (forward scatter) i pod
kątem 90
o
do promienia lasera (side scatter), pozwala na analizę odpowiednio wielkości
komórki i ziarnistości cytoplazmy. Jest to pomiar jakościowy i ilościowy. Zaletą cytometrii
przepływowej jest możliwość szybkiego, obiektywnego i zautomatyzowanego pomiaru
pojedynczych komórek w dużych populacjach komórkowych, wykrywanie śladowych
subpopulacji, równoległa ocena kilku parametrów komórki (analiza wieloparametrowa)
i opcja sortowania komórek. Niedogodnością FC jest brak możliwości korelacji wyników
pomiarów fluorescencji z morfologią komórek oraz technika przygotowania materiału
do badań wymagająca izolacji z tkanki pojedynczych komórek.
W medycynie FC są wykorzystywane m.in. do immunofenotypowania, analizy
i sortowania komórek hematopoetycznych, oceny oporności wielolekowej, ploidii, replikacji
DNA, struktury chromatyny, zawartości RNA, zawartości białek, ekspresji antygenów
(powierzchniowych, cytoplazmatycznych, jądrowych), właściwości błon cytoplazmatycznych
(potencjał, przepuszczalność), aktywności enzymów, stężenia Ca
+2
, apoptozy, pH i wielu
innych.
Wprowadzenie systemów komputerowej analizy obrazu (image analysis system)
umożliwiło wykonywanie pomiarów w skrawkach histologicznych bez potrzeby izolacji
pojedynczych komórek, analizę parametrów morfologicznych komórek i jądra komórkowego,
wizualizację badanych komórek i ich selekcję do pomiaru. Pomiar w analizatorze obrazu jest
czasochłonny i praktycznie nie daje możliwości przeprowadzenia analizy ilościowej.
Laserowy cytometr skaningowy (laser scanning cytometer, LSC) jest połączeniem FC
i systemu komputerowej analizy obrazu. LSC mierzy cztery kolory fluorescencji (zieloną,
pomarańczową, czerwoną i bliską podczerwieni) wzbudzoną jednym (argon laser, 488 nm)
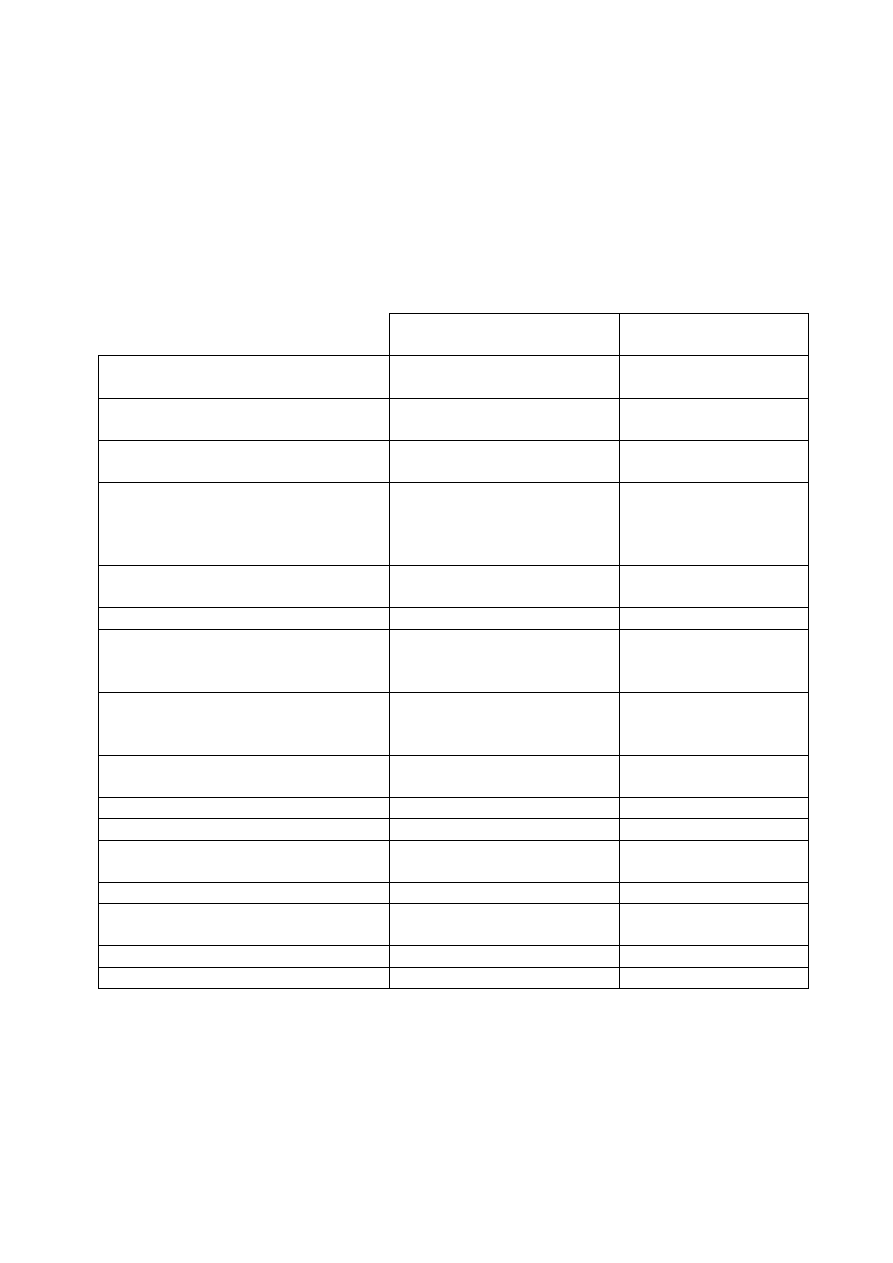
lub dwoma laserami (he-ne laser, 633 nm) oraz intensywność światła rozproszonego
w komórkach umieszczonych na szkiełku podstawowym i zabarwionych fluorochromami.
Pomiar odbywa się z szybkością do 100 komórek/sekundę, z czułością (sensitivity)
i dokładnością (accuracy) porównywalną z uzyskiwanymi w nowoczesnych FC. Porównanie
właściwości oraz możliwości FC i LSC przedstawiono w tabeli poniżej.
Porównanie właściwości oraz możliwości FC i LSC
Cecha
Cytometr przepływowy (FC)
Laserowy cytometr
skaningowy (LSC)
Barwienie i pomiar komórek
w zawiesinie
na szkiełku
podstawowym
Analiza wielu parametrów
fluorescencyjnych komórki
tak
tak
Korelacja fluorescencji z morfologią
komórek
możliwa przy użyciu sortera
tak
Analiza parametrów związanych z
przestrzenną dystrybucją
fluorochromu w komórce (np. jądro
versus cytoplazma)
nie
tak
Analiza maksymalnej intensywności
fluorescencji na danym obszarze
nie
tak (max pixel)
Liczba pomiarów danej komórki
jeden
wielokrotne
Wielokrotny pomiar tych samych
komórek celem oznaczenia zmian
fluorescencji w czasie (kinetyka)
nie
tak
Wielokrotne pomiary tych samych
komórek sekwencyjnie zabarwionych
różnymi fluorochromami
nie
tak
Utrata komórek w trakcie barwienia
duża
(zależna od liczby wirowań)
minimalna
(< 5%)
Archiwizacja zmierzonego materiału
nie
tak
Pomiar w skrawkach histologicznych
nie
tak
Analiza parametrów fluorescencji w
zależności od topografii skrawka
nie
tak
Automatyczna analiza miejsc FISH
praktycznie niemożliwa
tak
Pomiar światła rozproszonego
forward scatter
side scatter
forward scatter
Sortowanie komórek/chromosomów
tak
nie
Szybkość pomiaru
do 10 000 komórek/s
do 100 komórek/s
Zasada pomiaru fluorescencji komórek w LSC jest podobna do FC, z tym że pomiar
komórek w LSC odbywa się na szkiełku podstawowym, a w FC w zawiesinie. Oba
urządzenia pozwalają na pomiar zintegrowanej wartości fluorescencji, światła rozproszonego
i czasu. LSC umożliwia równoczesny pomiar fluorescencji w dwóch różnych

kompartmentach komórki, tj. na obszarze jądra komórkowego i osobno na obszarze
cytoplazmy. Jednym z parametrów rejestrowanych w trakcie pomiaru w LSC jest położenie
komórki na szkiełku podstawowym, co jest podstawą korelacji parametrów fluorescencji
z morfologią komórek. Komórki po pomiarze w LSC mogą być zabarwione innymi
fluorochromami, ponownie poddane pomiarowi, a wyniki pomiarów połączone w jeden plik.
Ponieważ rejestrowana jest pozycja każdej komórki na szkiełku, zatem po wykonaniu
pomiaru w skrawku histologicznym możliwe jest odtworzenie mapy geograficznej preparatu
i analiza parametrów fluorescencji komórek zlokalizowanych na określonym obszarze
zmierzonego skrawka (np. tylko w tej części preparatu, która zawiera utkanie nowotworowe).
Przygotowanie preparatów do pomiaru w LSC jest proste. Komórki już raz
przytwierdzone do szkiełka podstawowego nie ulegają przemieszczaniu i nawet wielokrotne
płukanie i ponowne barwienie powoduje utratę jedynie minimalnej liczby komórek (< 5%).
Zastosowania LSC częściowo pokrywają się z zastosowaniami FC. Zwraca uwagę
użycie LSC do pomiarów fluorescencji w preparatach histologicznych oraz możliwości
analizy przestrzennej dystrybucji fluorochromu, która może służyć do wykrywania
translokacji białek z jądra do cytoplazmy, np. translokacji NF-kB, p53, p21 lub białek
pośredniczących w przekazywaniu sygnałów.
prof. dr hab. Elżbieta Urasińska
Zakład Patomorfologii
Wyszukiwarka
Podobne podstrony:
Cytometria przepływowa
cytometria przepływowa
Podstawy cytometrii przeplywowej oznaczanie subpopulacji komorek
Cytometria przepływowa wprowadzenie
Cytometria przepływowa w diagnostyce niedoborów odporności
1 Ćwiczenie 1 Cytometria przepływowa zaburzenia proliferacji i apoptozy
Komórki dendrytyczne – subpopulacje i oznaczanie za pomoca cytometrii przepływowej
Budowa cytometru przepływowego
Cytometria przepływowa
Cytometria przepływowa
cytometria przepływowa
Podstawy cytometrii przeplywowej oznaczanie subpopulacji komorek
Cytometria przepływywa
Budowa cytometru przepływowego
SWOBODA PRZEPŁYWU UE
Układy wodiociągowe ze zb przepł końcowym i hydroforem
Laser i jego zastosowanie
Swobodny przepływ kapitału w UE
więcej podobnych podstron