
Synteza polimerów
przewodzących
RODZAJE POLIMERÓW PRZEWODZĄCYCH
poliacetyl
en
NH
( )
n
( )
n
Polifenylen
CH CH
( )
n
Polifenylen
Winylen
S
( )
n
Politiofen
S
CH CH
( )
n
Politienylen
Winylen
N
R
( )
n
Polipirol
N
R
CH CH
( )
n
Polipyrylen
Winylen
O
( )
n
Polifura
n
O
CH CH
( )
n
Polifurylen
Winylen
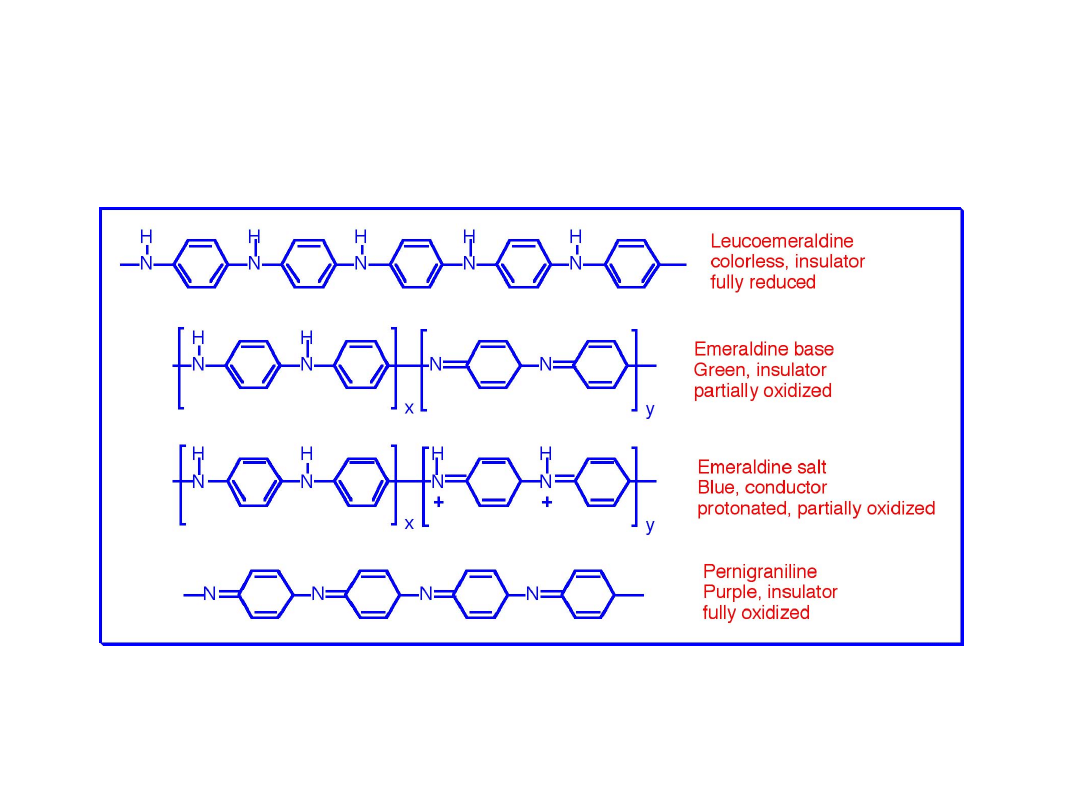
Polianilina
Poliaromaty
Poliheteroaromaty
(aromat + winyl)
(aromat + wolna para e
-
)

Poliacetylen
Prawdopodobny
mechanizm
polimeryzacji
Acetylenu
HC
CH
WCl
6
/ Bu
4
Sn
polyacetylene
acetylene
WCl
6
CH
3
CH
2
CH
2
CH
2
WCl
5
Bu
4
Sn
Bu
3
SnCl
Bu
4
Sn
Bu
3
SnCl
CH
3
CH
2
CH
2
C
WCl
4
H
H
H
3
CH
2
CH
2
CH
2
C
CH
3
CH
2
CH
2
CH
3
"Metal carbene"
C WCl
4
CH
3
CH
2
CH
2
H
HC
CH
C WL
n
H
7
C
3
H
HC CH
HC
CH
CH
WL
n
H
7
C
3
HC
CH
C
WL
n
C
3
H
7
H
HC CH
C
C
H
C
3
H
7
H
CH
WL
n
C
C
H
H
HC
C
C
H
C
3
H
7
WL
n
C
H
C
H
C
3
H
7
H
C
C
C
C
3
H
7
H
H
H
HC
HC WL
n
HC CH
etc.
WL
n
H
termination
Polyacetylene
Nierozpuszczalny
Nietopliwy
rozciągliwy
Metalocy
kl
metal-karben
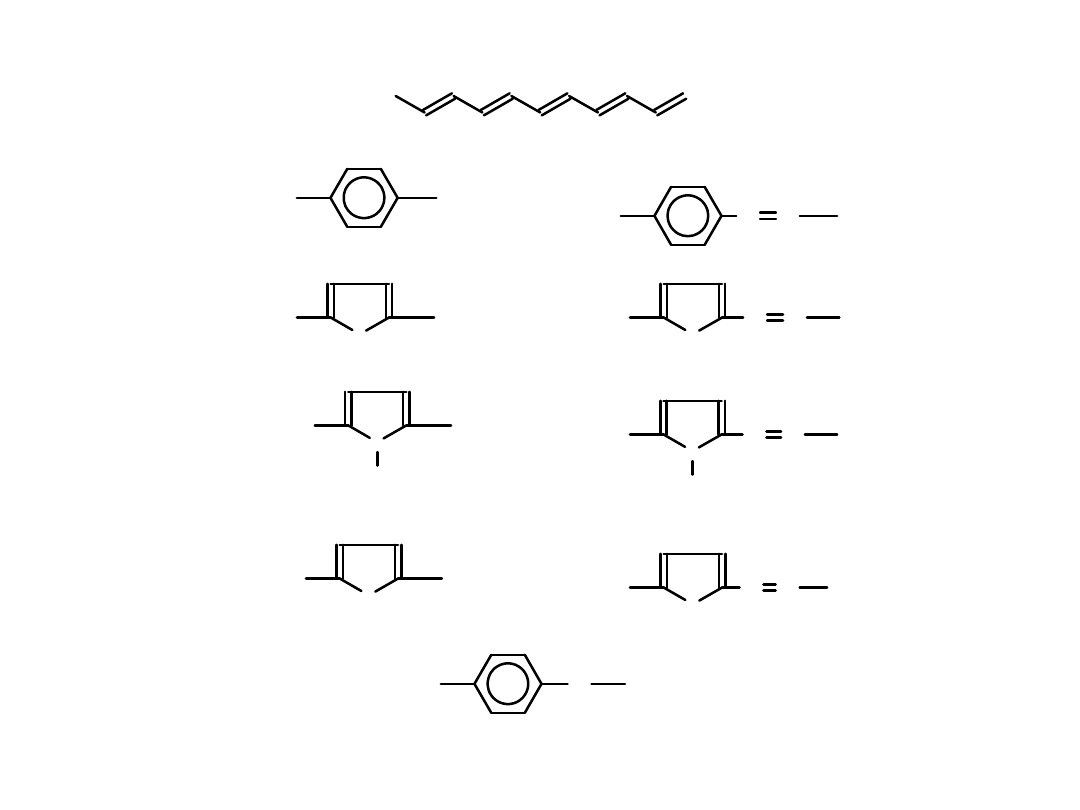
Poprawienie rozpuszczalności Poliacetylenu
(poprzez wprowadzenie podstawników)
RC
CH
WCl
6
etc.
etc.
R
R
R
R
R
T. Masuda et. al.
with improved solubility
WCl
6
+ C
6
H
5
C
CH
+
etc.
Ph
Ph
Ph
etc.
1
x
200
C. C. Han & T. J . Katz
Organometallics 1982, 1, 1093
Organometallics 1985, 4, 2186
Olefin Metathesis
ring-opening polymerization
WCl
6
+
PhC CH
etc.
WLx
Ph
Ph
Ph
etc.
Lx
W
Ph
Ph
Ph
Ph
Ph
Ph
W
etc.
Ph
Ph
Ph
WL
x
etc.
Ph
Ph
Ph
WL
x
H
5
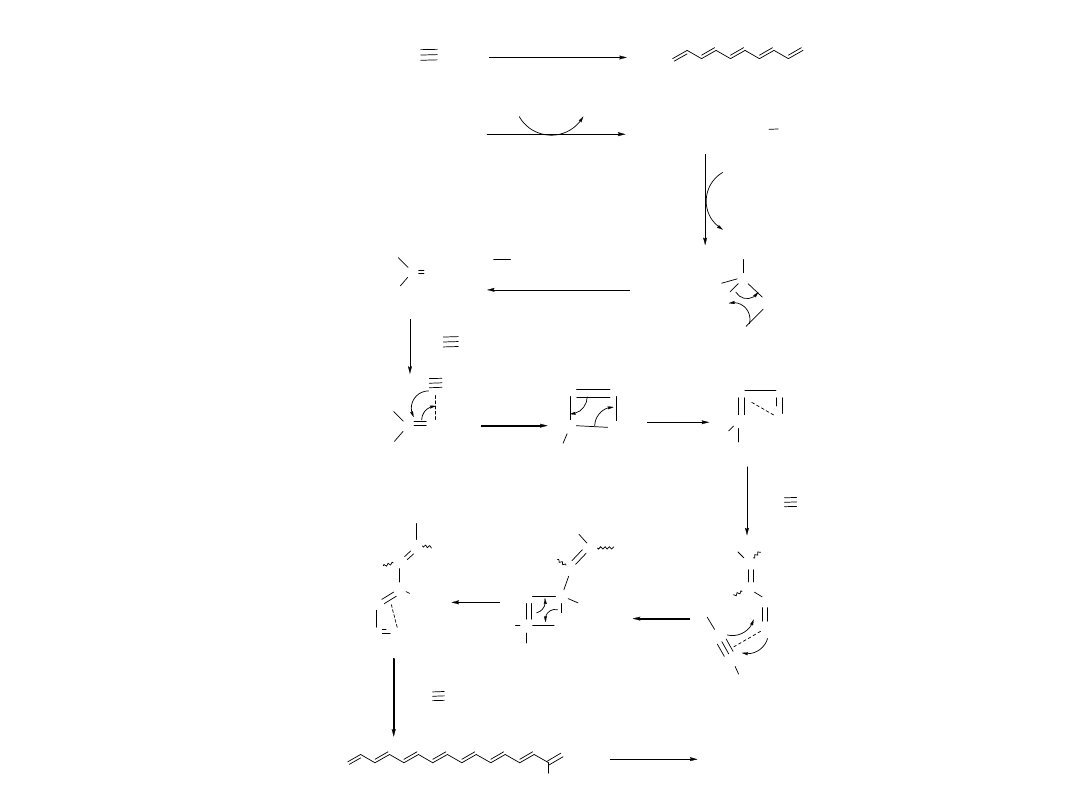
Metoda Durham
(poprzez przetwarzalny
prekursor)
X
X
Ring-opening
olefin metahesis
polymerization
X
X
n
retro-cyclization
X
X
n
I
2
doping
10 S/cm
+
Cyclization
t
1/2
20 h at 20
o
C
very un stable
difficult in handling
10
-7
S/cm
too much " stability gain "
both products form
conjugated systems
(X = -CF
3
, -COOMe)
Cyclooctatetraene
XC CX
Feast et. al.
1. Polymer, 21, 595 ( 1980 )
2. J . Phys. Colloq. C3, Suppl. 6, 44 : C3 -148 ( 1983 )
3. Polymer, 25, 395 ( 1984 )
Bardzo niestabilny
trudny do używania
Oba produkty
aromatyczne bardziej
stabilne
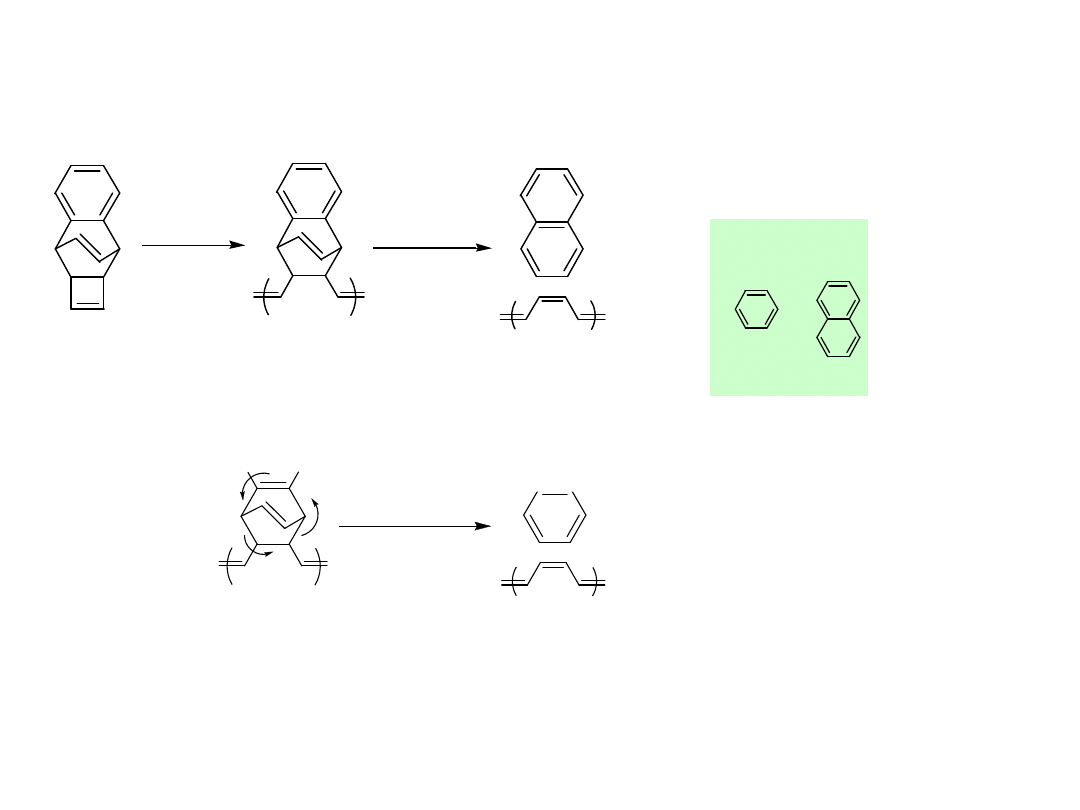
ROMP
n
n
£G
70
o
C
stable at RT
easier in handling
" less stability gain "
Resonance
Energy (Kcal/mol)
36
60
X
X
n
retro-cyclization
X
X
n
t
1/2
20 h at20
o
C)
dla 2-go
pierścienia:
24 kcal/mol
Ustabilizowanie przetwarzalnego
prekursora
Bardzo niestabilny
trudny do używania
Stabilny w
temperaturze
pokojowej
Mniejszy zysk
z
aromatyzowani
a
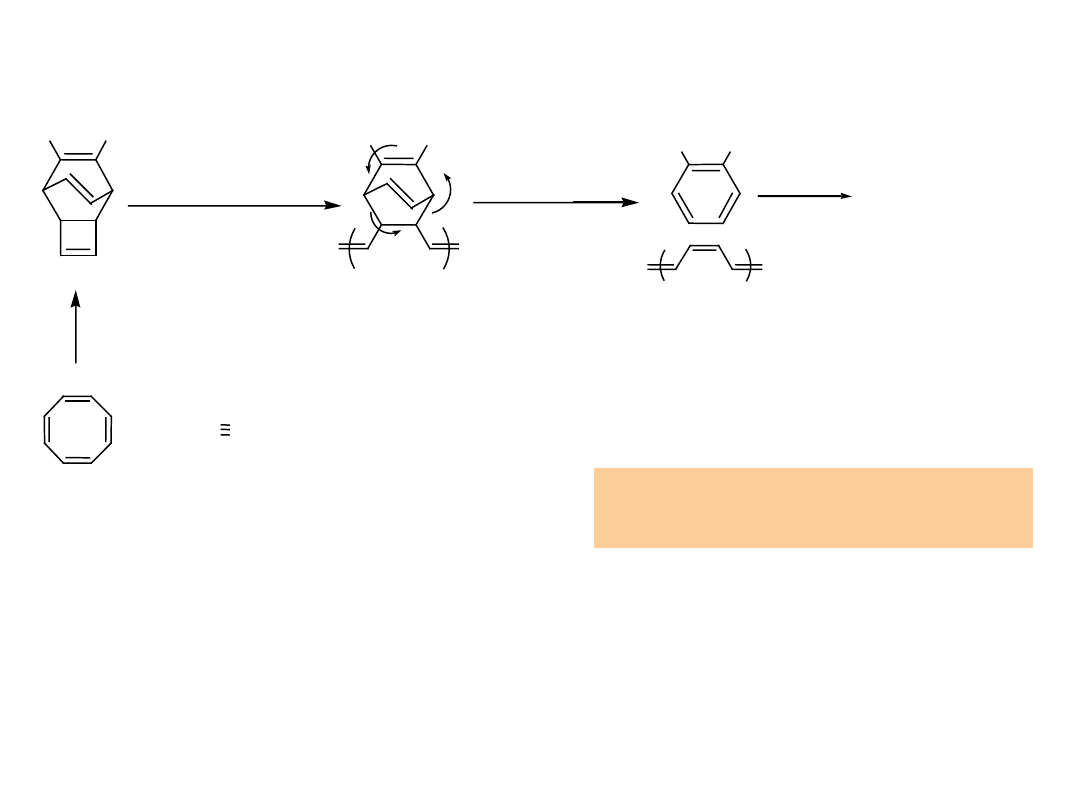
Alternatywne Metody Otrzymywania
Poliacetylenu
Cl Cl Cl Cl Cl
- HCl
¡µ
pyrolytic elimination
PVC
poly(vinylchloride)
C. S. Marvel et. al. J ACS, 61, 3241 ( 1939 )
Cl
2
Cl
Cl
Cl
Cl
poly(1,4-butadiene)
- HCl
KNH
2
/ NH
3 (liq)
East German patent 50, 954 ( 1966 )
CA 66 : 86117 r
Cl Cl Cl Cl Cl
Cl
Dehydrochlorowanie
Oba sposoby dają słabo przewodzący polimer
Defekty koniugacji
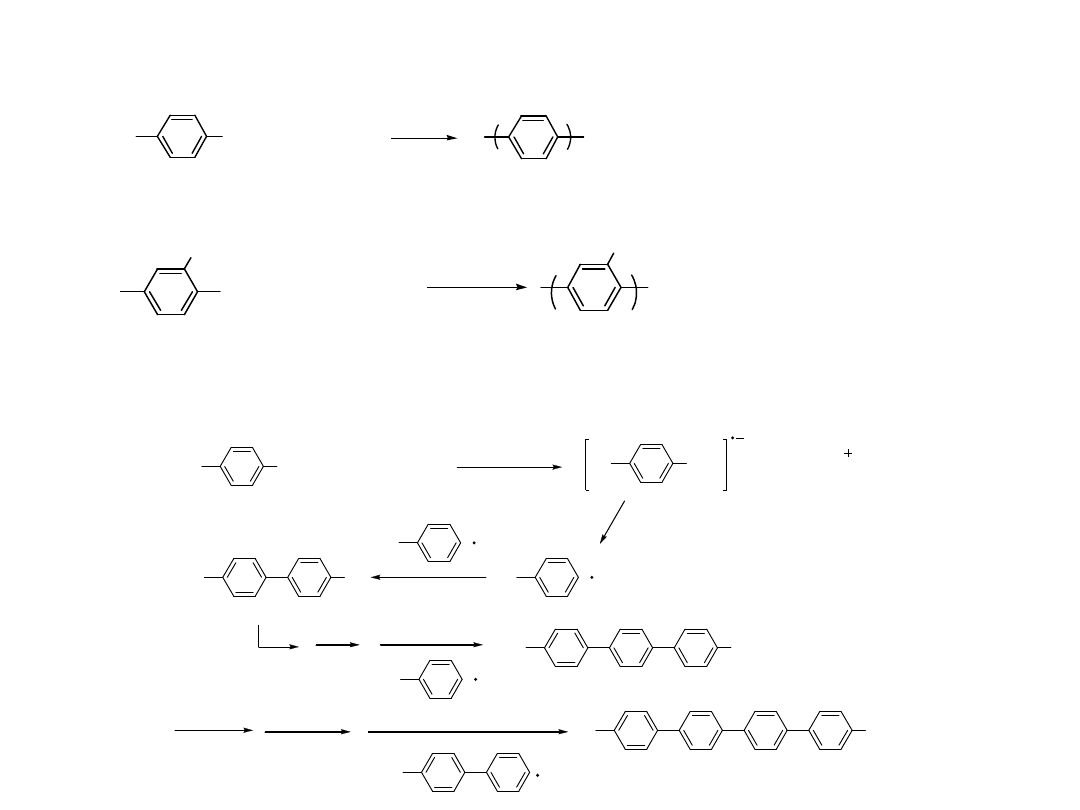
Synteza Poli(p-fenylenu)
(PPP)
Cl
Cl
+ Na
n
+
NaCl
Wurtz -Fittig Reaction
G. Gold finger et. al.
J . Polym. Sci., 4, 93 ( 1949 )
J . Polym. Sci.,16, 589 ( 1955 )
I
I
R
+
Cu
R
n
Ullmann reaction
S. Ozasa et. al. Bull. Chem. Soc. J pn., 53, 2610 ( 1980 )
• Otrzymuje się niewielkie masy cząsteczkowe i struktury
nieregularne
Cl
Cl
+
Na
Cl
Cl
+
Na
Cl
Cl
Cl
+
NaCl
Na
Cl
Cl
Cl
or
Cl
Cl
Cl
Cl
Polimeryzacja Redukcyjna
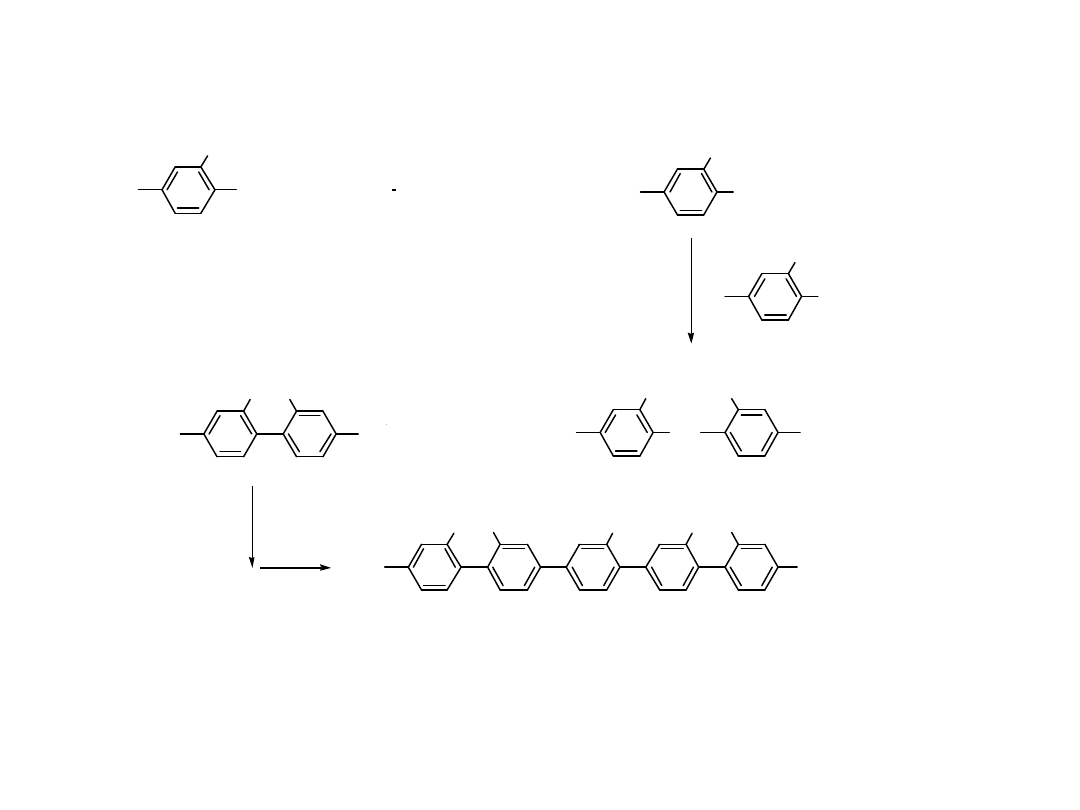
I
I
R
+
Cu
I
CuI
R
Oxidative
addition
I
CuI
R
I
Cu
R
I
R
+
CuI
2
Reductive
elimination
I
R
I
R
etc.
R R
etc.
R R
R
Utleniają
ca
addycja
Redukują
ca
eliminacj
a
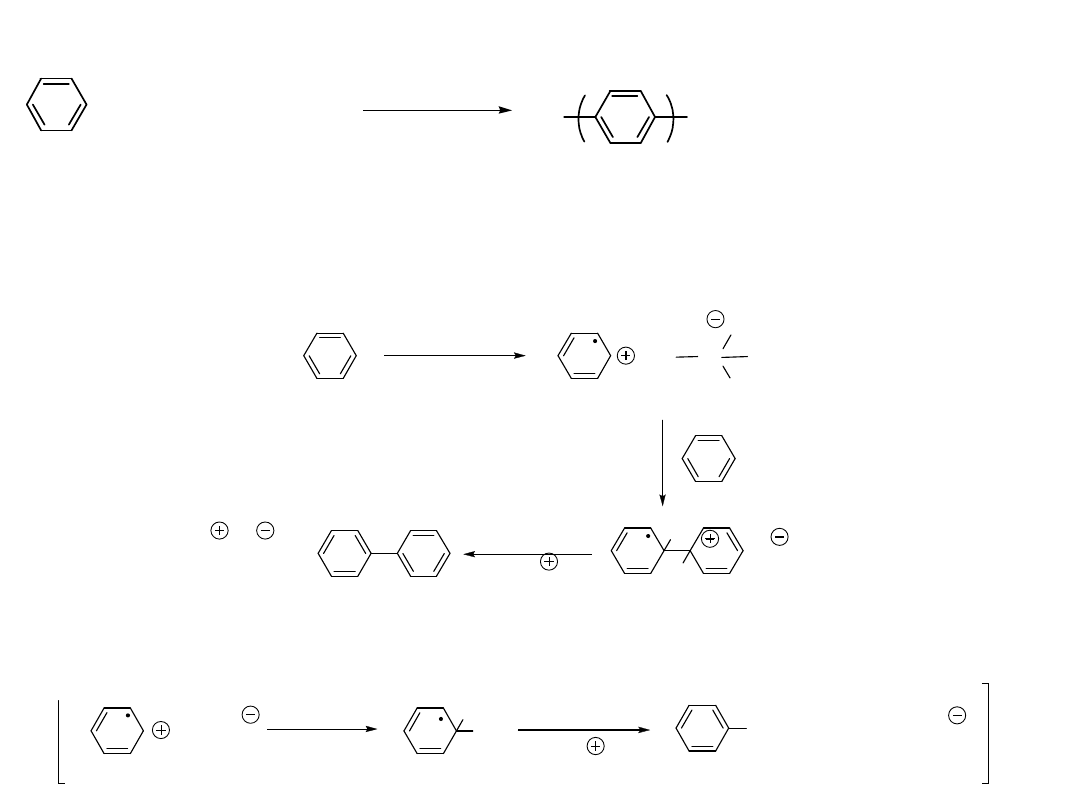
+ CuCl
2
/ AlCl
3
n
P. Kovacic et. al. J ACS 85, 454 ( 1963 )
CuCl
2
AlCl
3
Cl Al
Cl
Cl
Cl
+
CuCl
Radical
cation
H
H
AlCl
4
AlCl
3
CuCl
2
- 2H
+
2 HAlCl
4
+
CuCl
Use of AlCl
3
help reduce the following side-reaction
+ Cl
Cl
H
+ CuCl + Cl
- H
CuCl
2
Cl
Polimeryzacja Utleniająca
Najbardziej ekonomiczna i często
stosowana Utleniacze: CuCl
2
, MnO
2
,
MoCl
5
, FeCl
3
Kwasy Lewisa jako
katalizatory: AlCl
3
, AlBr
3
Zastosowanie AlCl
3
pomaga zmniejszyć udział
reakcji pobocznej
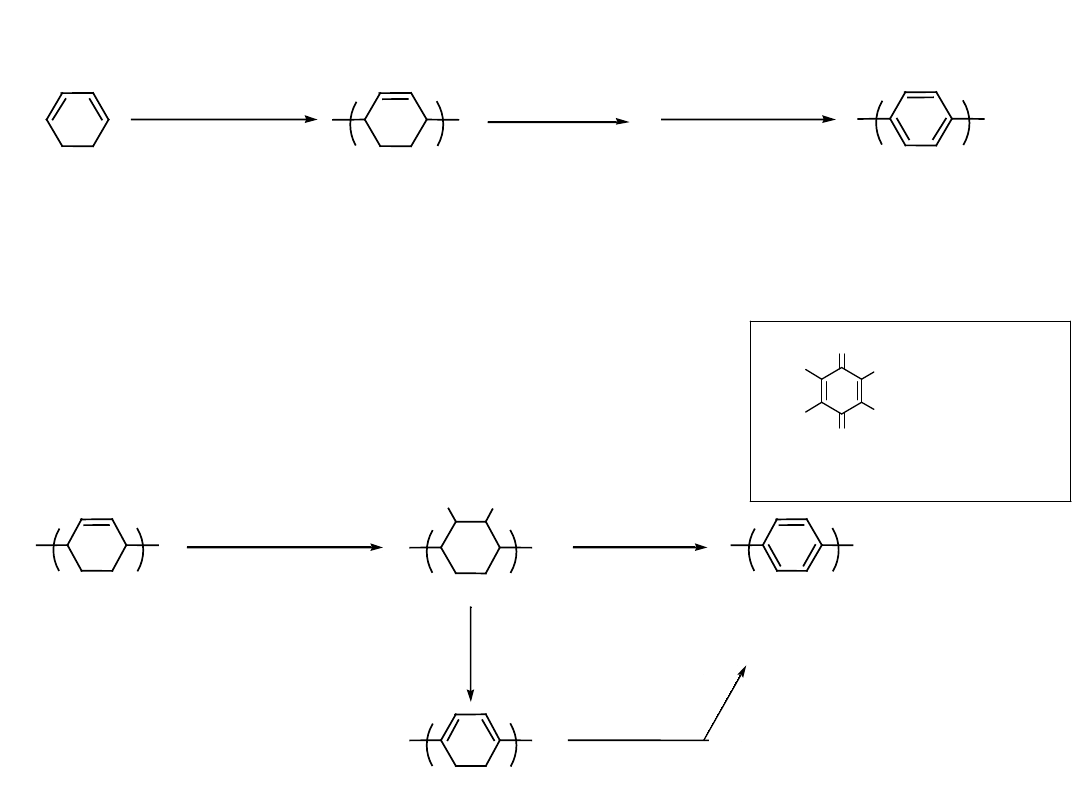
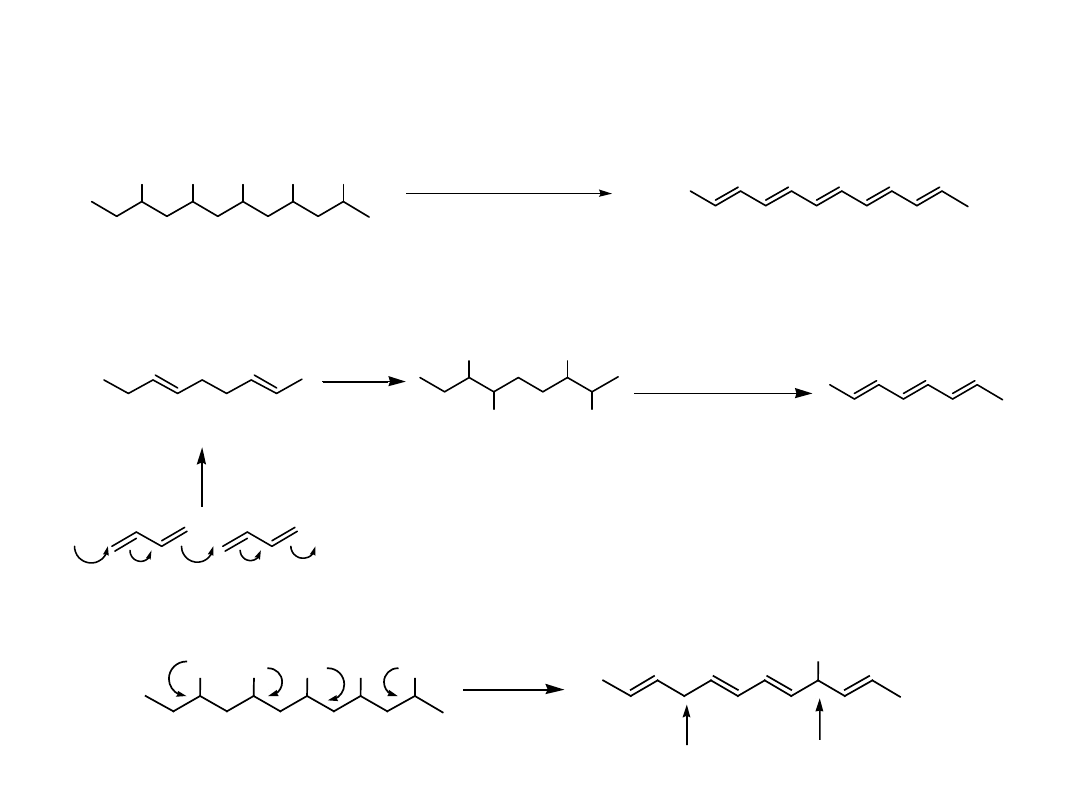
n
n
Ziegler catalyst
MW = 5000 - 10,000
poly(1,3-cyclohexadiene)
450
- H
2
G
kJ
chloranil
xylene
C. S. Marvel et. al.
JACS 81, 448 ( 1959 )
J. Polym. Sci. A3,1553 ( 1965 )
aromatization
O
Cl
Cl
O
Cl
Cl
p-chloranil
( tetrachloro-1,4-benzoquinone )
Oxidant
n
n
n
( Cl
2
, Br
2
)
300 - 380
- 2 HX
- H
2
n
- H
2
X
2
kJ
G
X
X
-2 HX
Reakcja Łańcuchowa Katalizowana
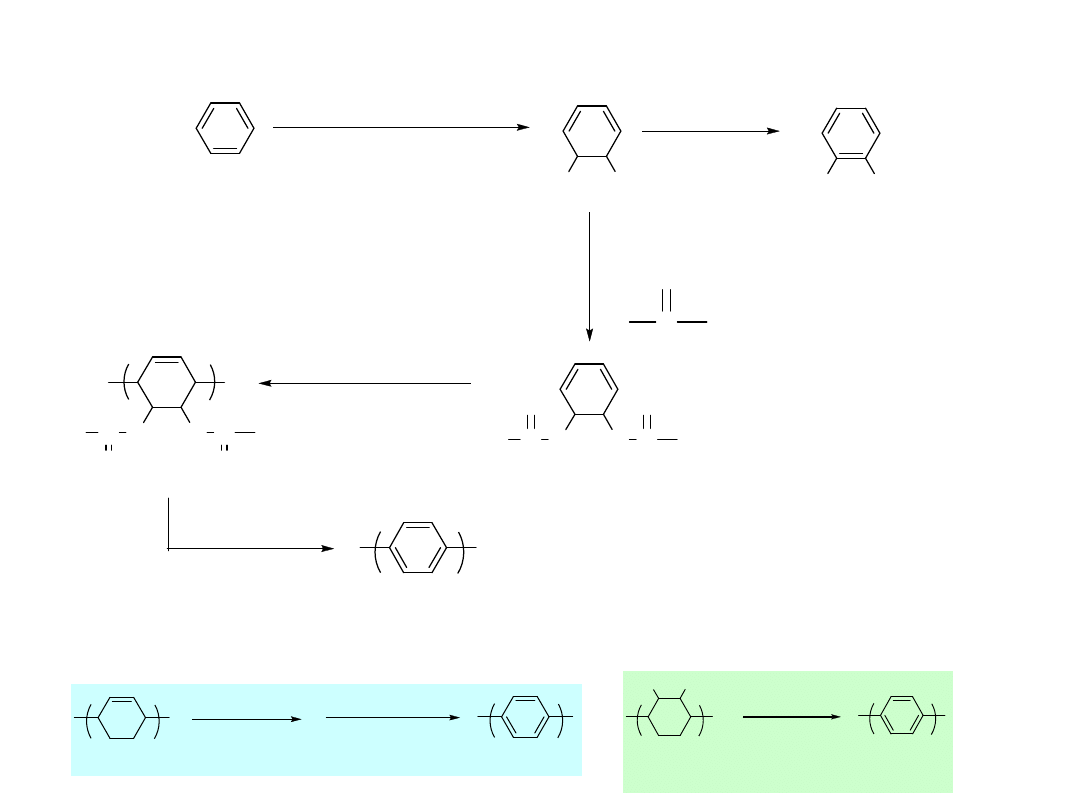
n
n
450
℃
chloranil
xylene
aromatization
- H
2
n
n
300 - 380
- 2 HX
- H
2
℃
X
X
HO
OH
HO
OH
pseudomonas putida
Base
C
O
Cl
R
O
O C
C
R
O
O
R
R =OCH
3
, CH
3
, Ph
( for improving solubility )
O
O C
C
R
R
O
O
n
radical chain
polymerization
highly soluble ; easily processible
DP =600-1000 ( degree of polymerization )
220
℃
n
( t
1/2
=30 sec for R =OMe)
Ballard et. al. J CS, CC 954 (1983 )
Obniżenie temperatury aromatyzacji poprzez dekarboksylację
Dobrze rozpuszczalny: łatwo
przetwarzalny DP = 600-1000)
(stopień polimeryzacji)
(polepsza
rozpuszczalność)
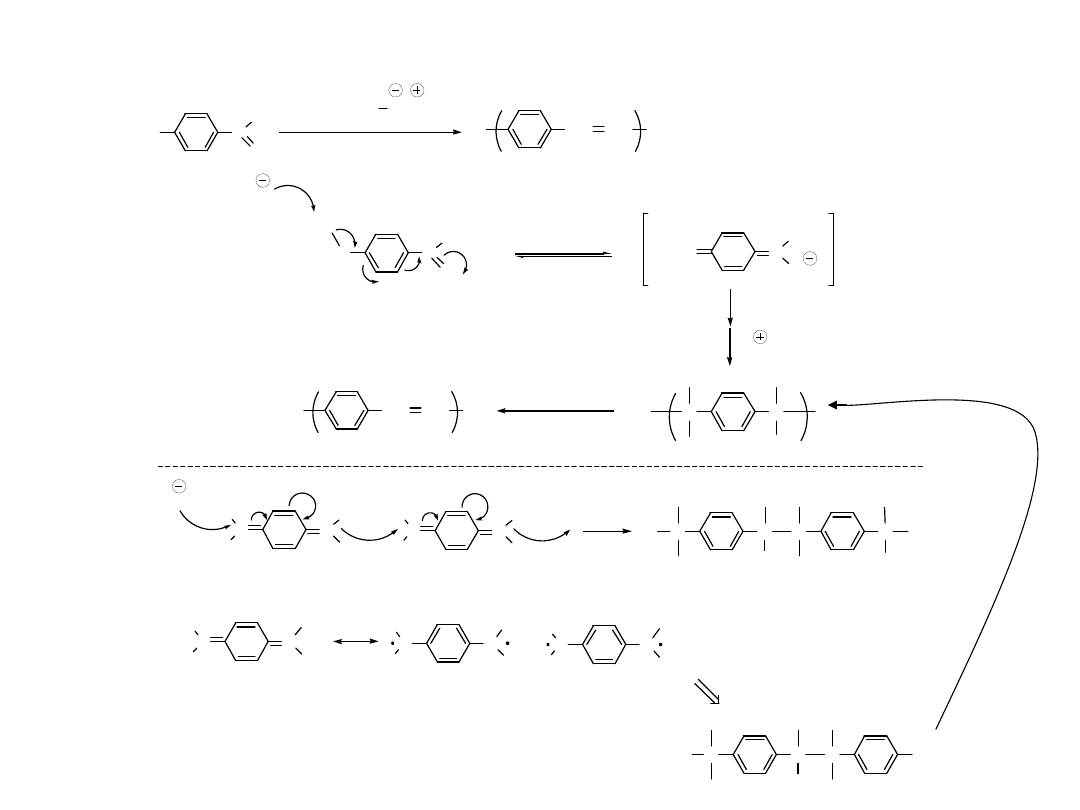
Synteza Polifenyleno-Winylenu
(PPV)
H
3
C
C
O
H
CH CH
n
(CH
3
)
3
C O K
DMF
G. Kossmehl et. al.
Makromol. Chem. 182,3419 ( 1981 )
H
2
C
C
O
H
H
B
H
2
C
C
O
H
H
C
C
OH
H
H
H
n
- H
2
O
CH CH
n
C
C
OH
H
H
H
Nu
C
C
OH
H
H
H
C
C
OH
H
H
H
Nu
C
C
OH
H
H
H
etc.
C
C
OH
H
H
H
C
C
OH
H
H
H
C
C
OH
H
H
H
C
C
OH
H
H
H
C
H
H
etc.
etc.
or
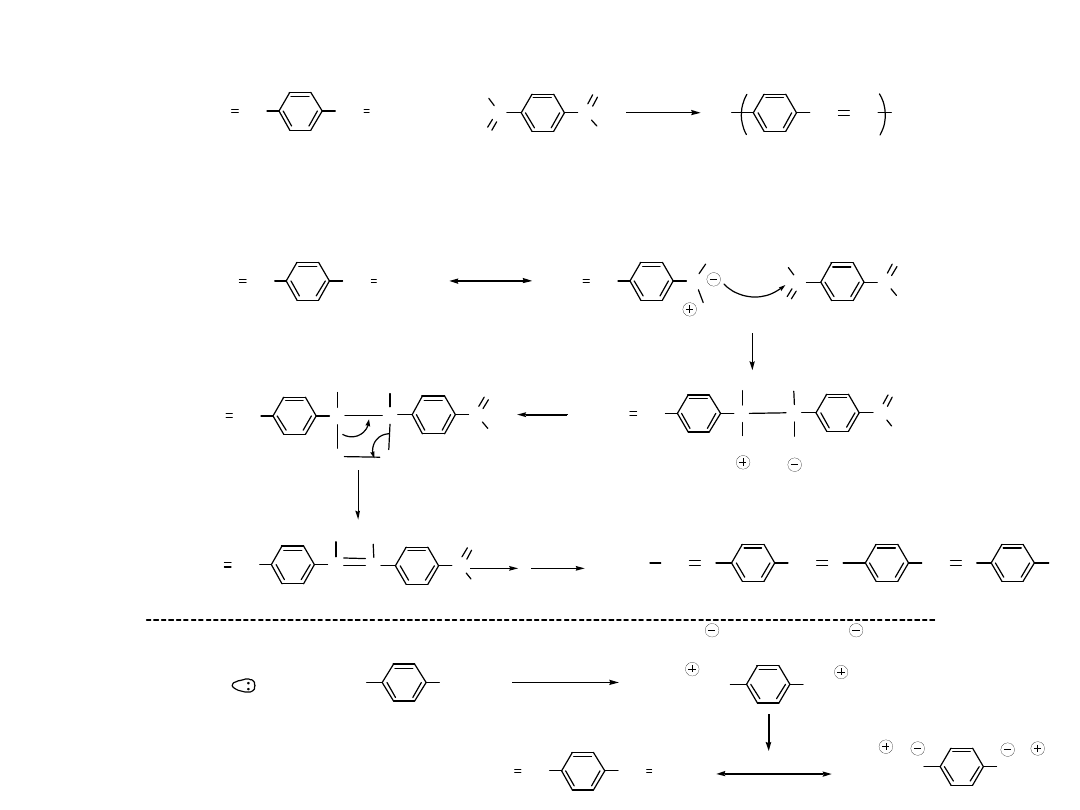
Kondensacja Wittinga
Ph
3
P CH
CH PPh
3
+
C
C
O
H
O
H
CH CH
n
R. N. McDonald et. al. J ACS 82,4669 ( 1960 )
G. E. Wnek et. al. Polymer 20,1441 ( 1979 )
Ph
3
P CH
CH PPh
3
Ph
3
P CH
C
PPh
3
H
C
C
O
H
O
H
Ph
3
P CH
C
PPh
3
H
C
C
O
H
H
OH
Ph
3
P CH
C
Ph
3
P
H
C
C
O
H
H
O
Ph
3
P CH
C
H
C
C
O
H
H
etc. CH C
H
CH C
H
CH C
H
etc.
Ph
3
P
BrH
2
C
CH
2
Br
triphenyl phosphine
Ph
3
P H
2
C
CH
2
PPh
3
Br
Br
Base (like LiBu)
Ph
3
P HC
CH PPh
3
Ph
3
P CH
CH PPh
3
Phosphorus ylide (phosphorus-stabilized carbanion)
15
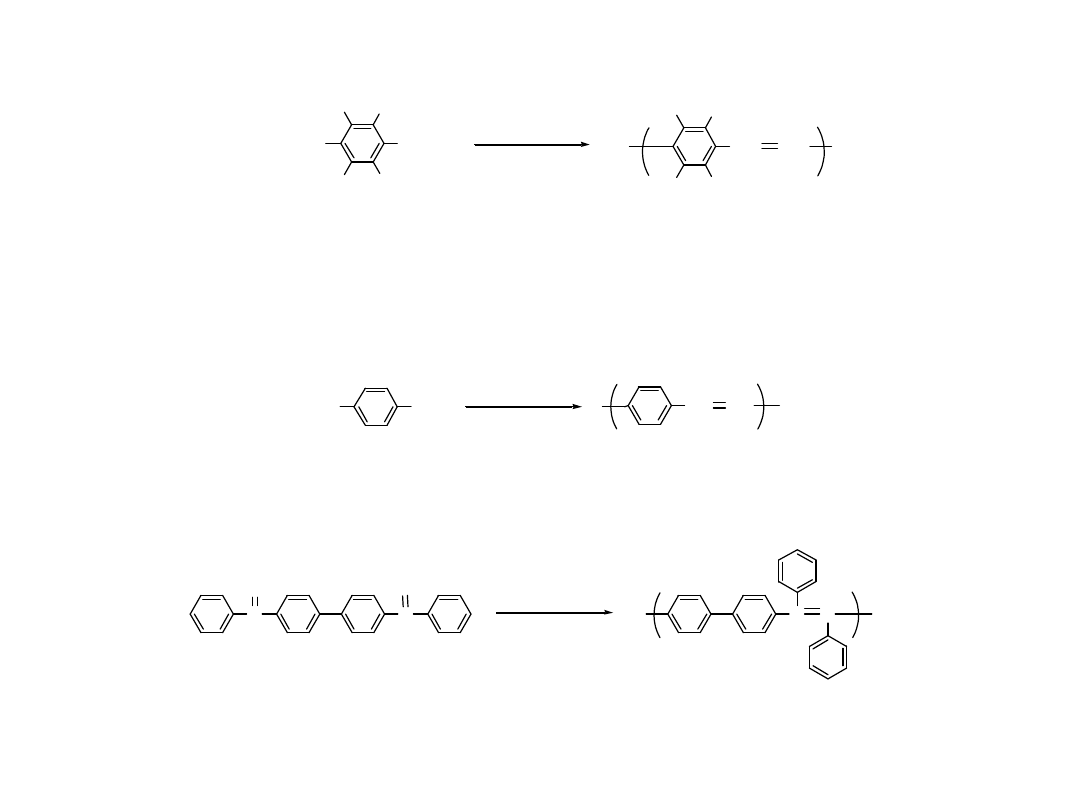
Dehalogenacja
Cl
Cl
3
C
CCl
3
Cl
Cl
Cl
- Cl
2
Cl
CCl
Cl
Cl
Cl
CCl
n
M. Ballester et. al. J ACS 88, 957 ( 1966 )
Kondensacja McMurry’ego (TiCl
3
/LiAlH
4
)
OHC
CHO
- "O
2
"
CH CH
n
L. Rajaraman et. al. Curr. Sci. 49 (3), 101 ( 1980 )
C
O
C
O
- "O
2
"
C C
n
Feast et. al. Polymer Commum. 24,102 ( 1983 )
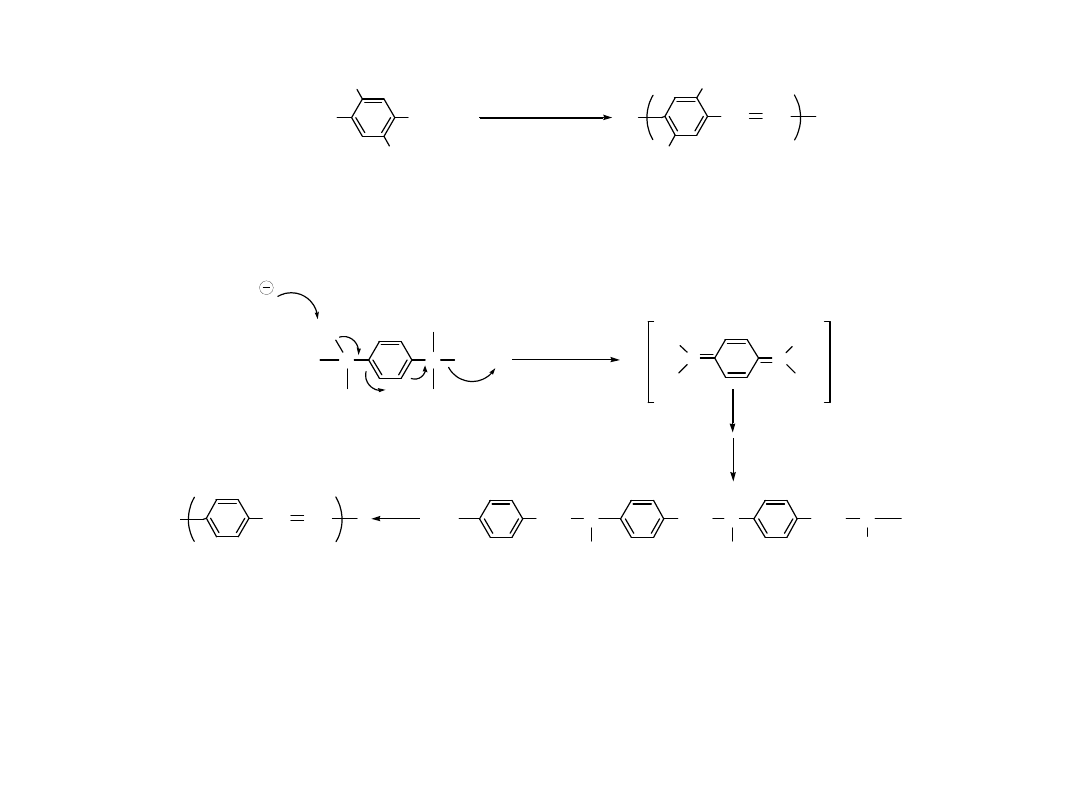
ClH
2
C
R
R
CH
2
Cl
NaH/DMF
-HCl
CH CH
n
R
R
( R = H, CH
3
, OCH
3
)
H. H. Horhold et. al. Makromol. Chem. 131, 165 ( 1970 )
C
C
H
H
C
C
H
H
H
Cl
H
Cl
H
H
Cl
etc.
CH
2
H
C
CH
2
Cl
H
C
Cl
CH
2
H
C
Cl
CH CH
n
Dehydrohalogenacja Halogenków Benzylowych
-HCl
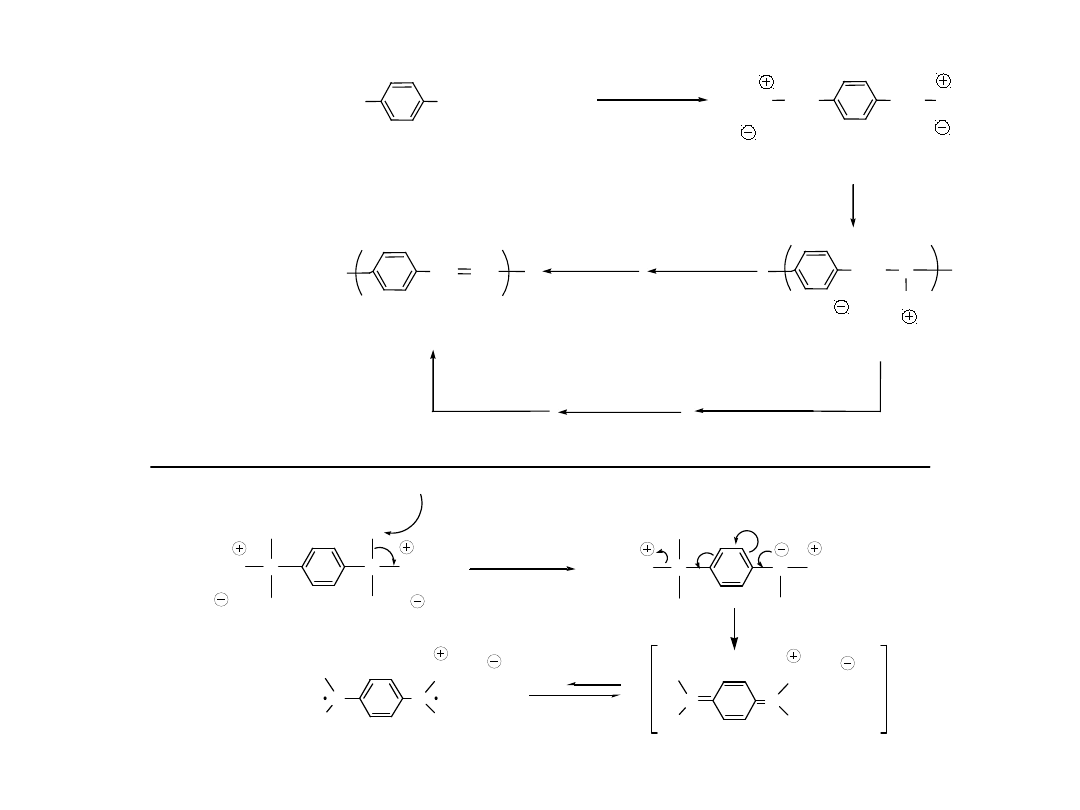
ClH
2
C
CH
2
Cl
+
SMe
2
H
2
C
CH
2
Me
2
S
SMe
2
Cl
Cl
bissulfonium salt
NaOH
CH CH
n
CH
2
H
C
n
SMe
2
Cl
G
Casting
sulfonium polyelectrolyte
£G
Casting
dialysis
-NaCl
- low MW molecules
+
NaCl
R. A. Wessling et.al.
J . Polym. Sci. Polym. Symp.,72, 55( 1986 )
U. S. Patent 3,706, 677 ( 1972 )
U. S. Patent 3,401, 152 ( 1968 )
Poprzez Prekursor - Siarczek Polieletrolitu
- SMe
2
- HCl
C
C
Me
2
S
SMe
2
Cl
Cl
H
H
H
H
NaOH
C
C
Me
2
S
SMe
2
H
H
H
C
C
SMe
2
H
H
H
Cl
quinone dimethane
C
C
SMe
2
H
H
H
Cl
diradical
Initiates the polymerization of quinone dimethane
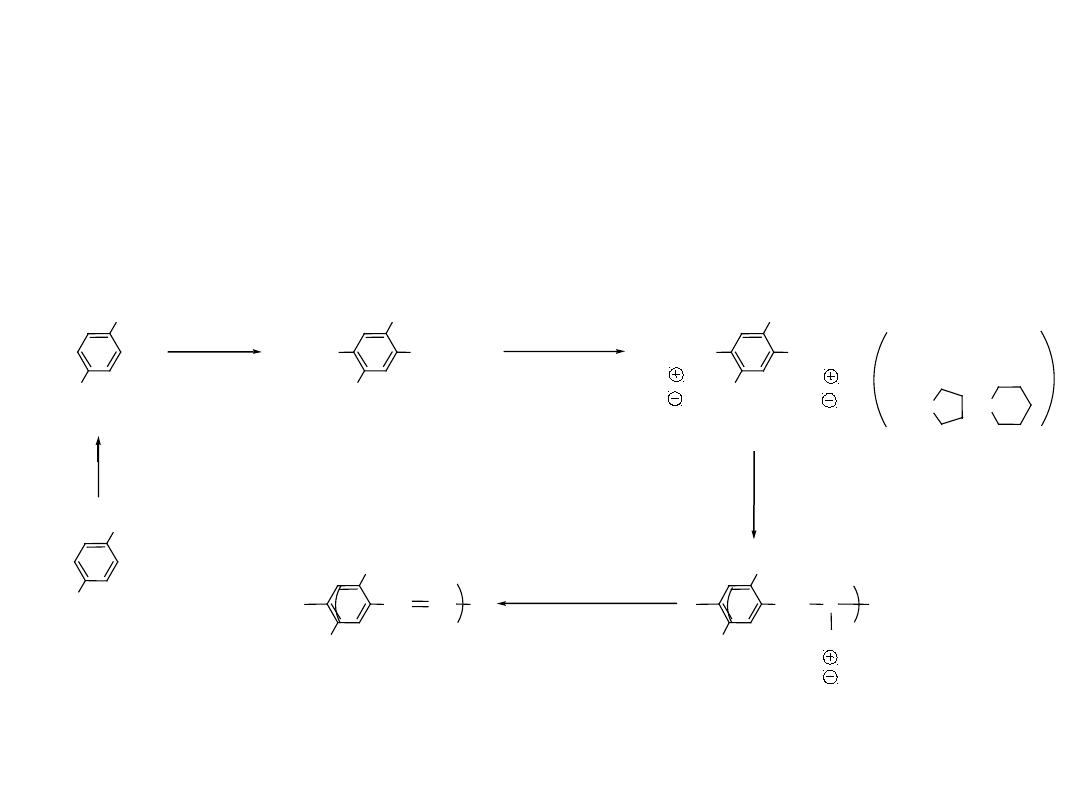
Material-P37.cdx
01/05/28
Poly(dialkoxyphenylene vinylene)
OR
RO
OR
RO
ClH
2
C
CH
2
Cl
OR
RO
R
2
SH
2
C
CH
2
SR
2
Cl
Cl
OH
HO
(OR = OMe, OEt, OBu)
NaOH
SR
2
=
SMe
2
, SEt
2
S
S
CH
2
Cl
H
C
SR
2
n
G
-
SR
2
-
HCl
CH CH
n
I
2
, 50 S cm
-1
(Stable)
Unorientable
Unstable Solution
Gel, Precipitation
OR
RO
OR
RO
200 - 250
o
C
,
Łagodny utleniacz
Sół bisiarczku
siarczek
polielektr
olitu
RX
NaO
H
CH
2
O
HCl
SR
2
Poli(dialkoksyfenylen winylen)
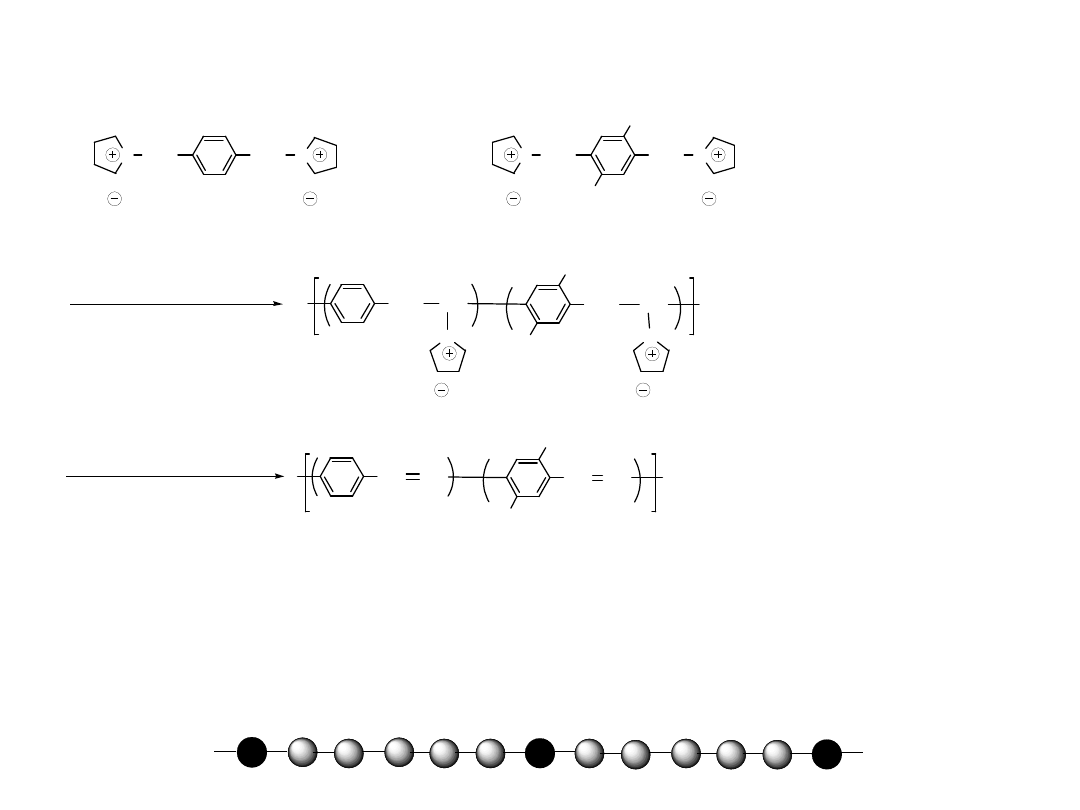
Material-P 39.cdx
01/05/28
Processible Copolymers
H
2
C
CH
2
S
S
Cl
Cl
+
r
OR
RO
H
2
C
CH
2
S
S
Cl
Cl
(1+r) NaOH/H
2
O
0
o
C, N
2
CH
2
CH
S
OR
RO
CH
2
CH
S
Cl
Cl
1-x
x n
Stable Solution
1.Dialysis
2.Casting
3. £G
I
2
Dopable
Orientable
Stable
CH CH
OR
RO
CH CH
1-x
x
n
Polymer Communciations 261, 28 (1987)
C.C. Han, R.W. Lenz, and F.E. Karasz
good electroluminescent materials
+
+
+
Kopolimery przetwarzalne
Stabiln
y
roztwór
Domieszkowaln
y Orientowalny
Stabilny
Materiał o dobrych
właściwościach
elektroluminescencyjnych
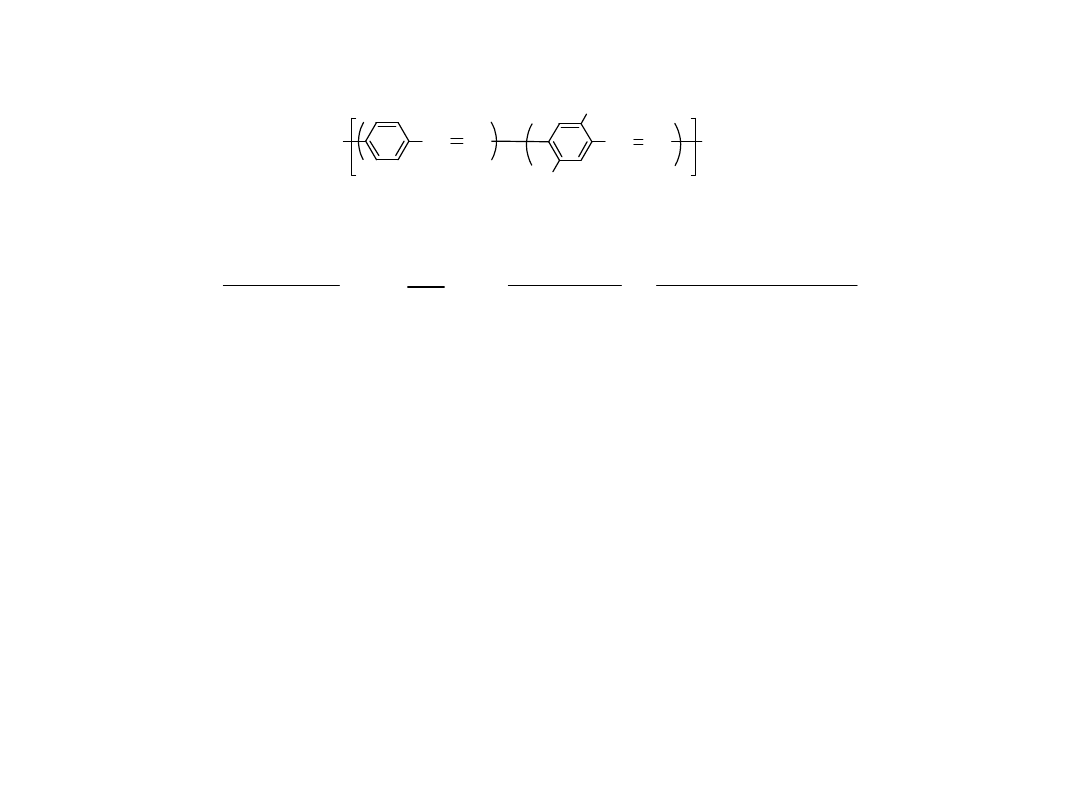
Kopolimery
Orientowalne
CH CH
R
R
CH CH
1-x
x
n
Polymer
X
Draw Ratio
(L/Lo)
Conductivity (Scm
-1
)
(Doped with I
2
)
Homopolymers
PPV
PDMPV
Copolymers
(R = OMe)
(R = OEt)
0%
100%
13%
12%
13%
1
1
4
1
10
1
13
1
< 10
-5
51
27
428
12
500
8.3
694
Polymer Communciations 261, 28 (1987)
C.C. Han, R.W. Lenz, and F.E. Karasz
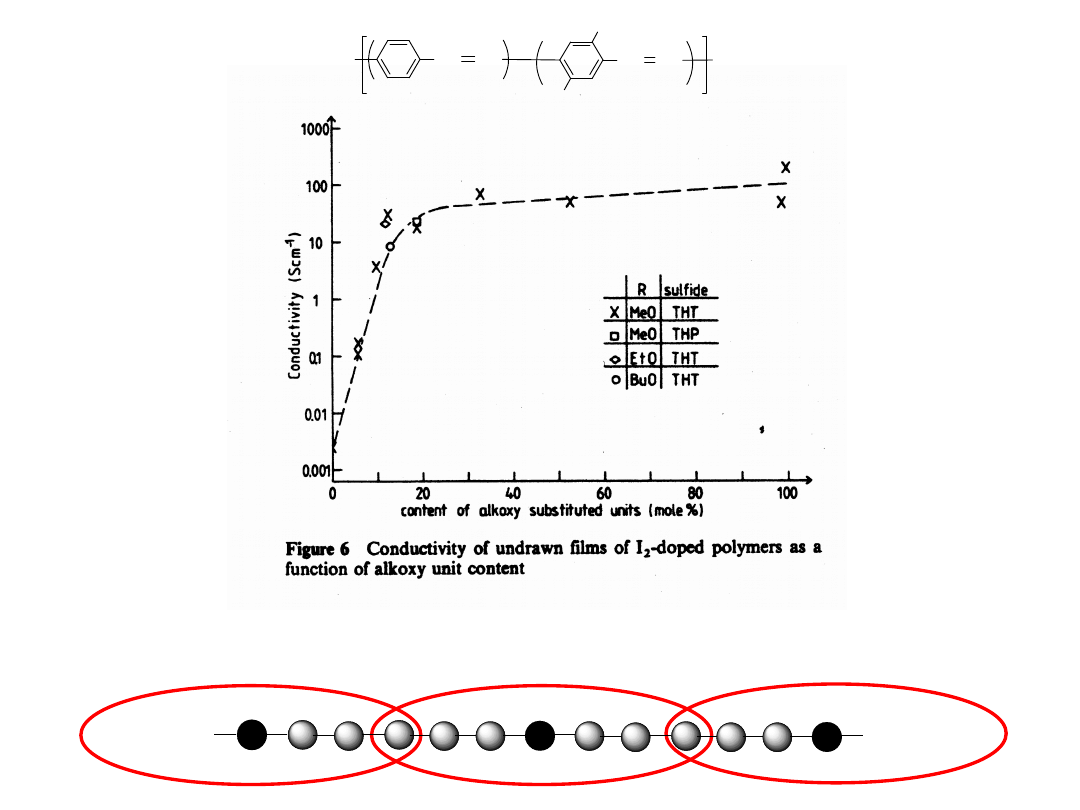
Polymer, 30, 1041 (1989)
R. W. Lenz, C. C. Han and M.
Lux
CH CH
R
R
CH CH
1-x
x
n
+
+
+
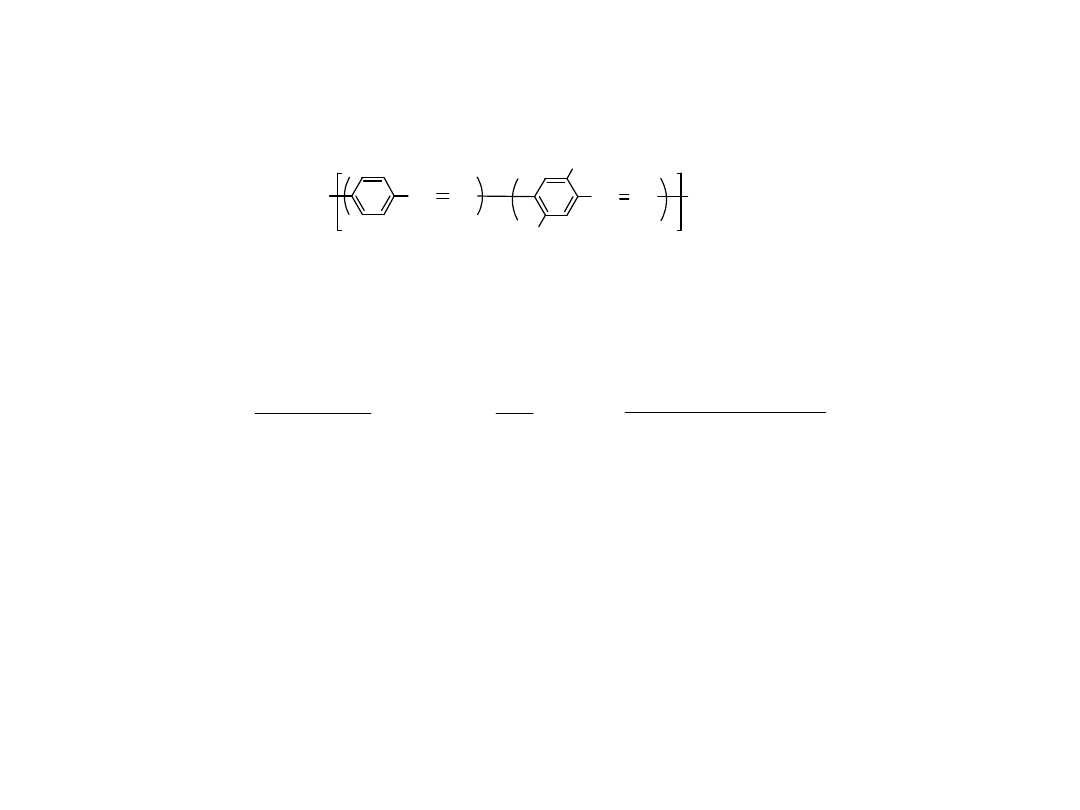
CH CH
R
R
CH CH
1-x
x
n
Polymer
X
Conductivity (Scm
-1
)
(Doped with I
2
)
PPV
PDMPV
Copolymers
0
1
< 10
-5
< 10
-5
0.1
0.3
(R = Me)
(R = Me)
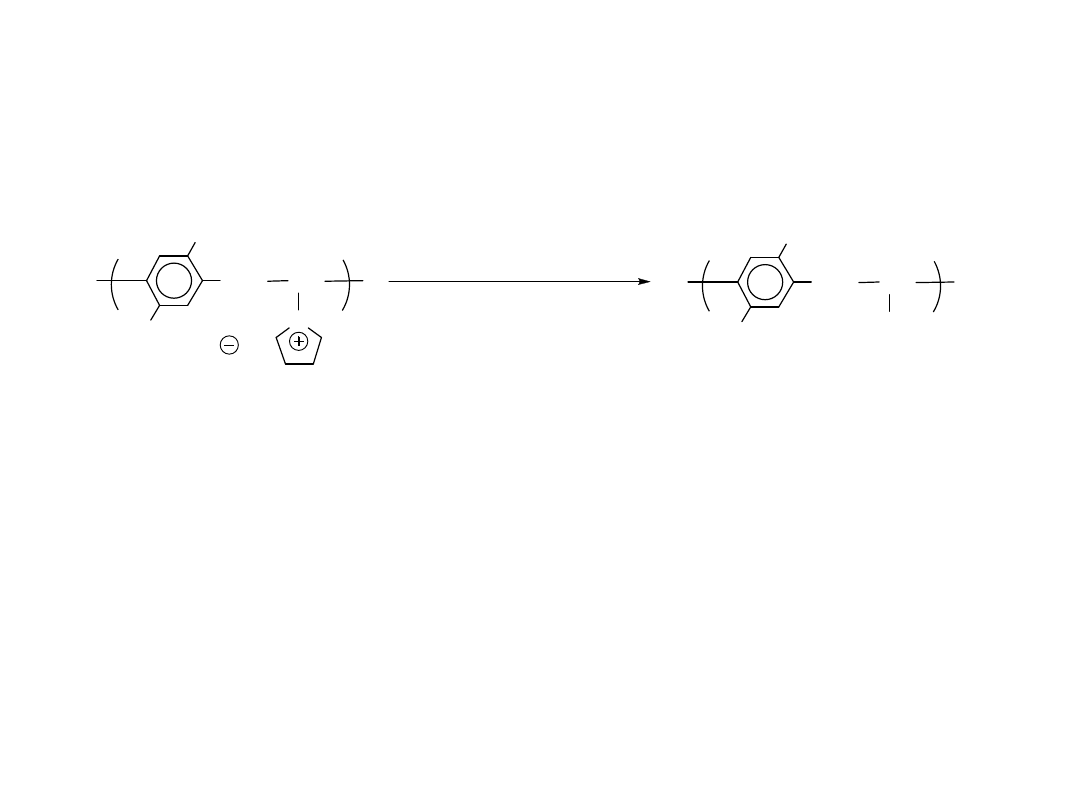
Polimerowy Prekursor
Niejonowy
CH
2
OBu
BuO
CH
S
Cl
n
CH
2
OBu
BuO
CH
OBu
n
BuOH/Pyridine
RoomTemperature
Soluble, Stable
Elastomer, Tg =2.6
o
C
1
HNMR, TGA, GPC
C. C. Han, R. L. Elsenbaumer
Mol. Cryst. Liq. Cryst. 1990, 189, 183
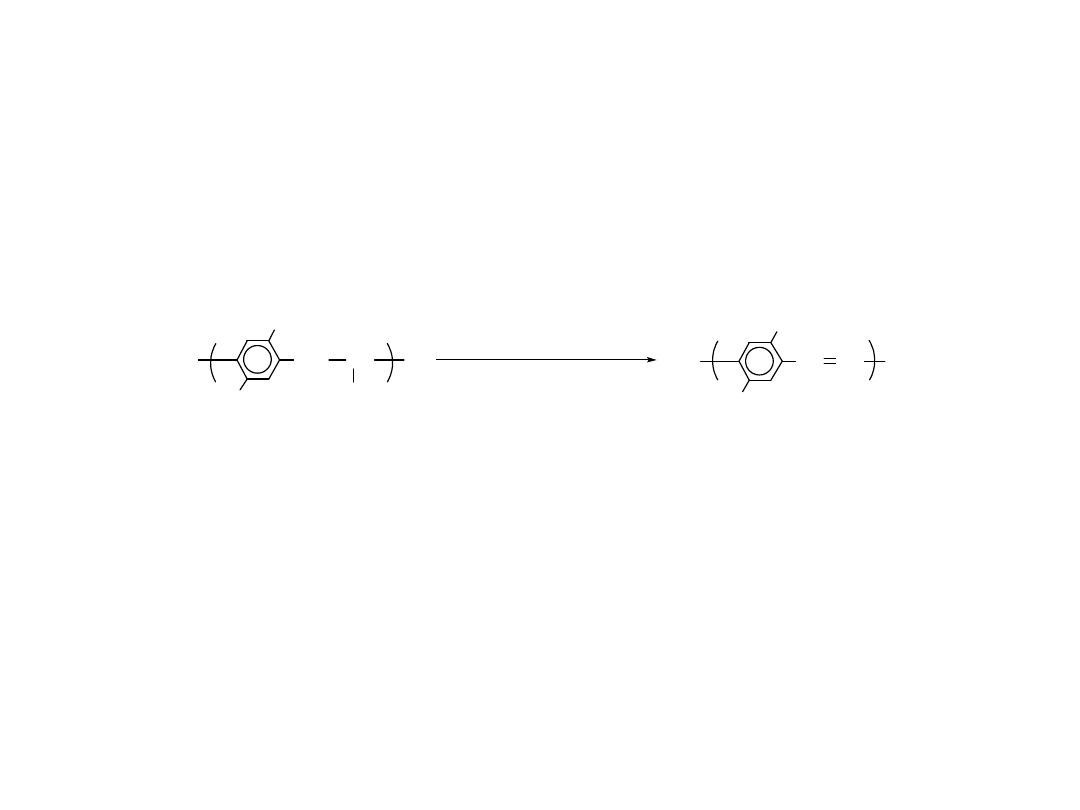
Eliminacja
Termiczna
CH
2
OBu
BuO
CH
OBu
n
CH
OBu
BuO
CH
n
£G
250 - 300
o
C
I
2
, 1 Scm
-1
Insoluble

Eliminacja Nie-
Termiczna
CH
2
OBu
BuO
CH
OBu
n
CH
OBu
BuO
CH
Soluble
I
2
, 14 Scm
-1
H
+ BuOH
+
H
Butanol Scavengers
CH
OBu
BuO
CH
+ Butanol Adducts
Butanol Scavengers
Me
3
SiCl
Me
3
SiBr
Me
3
SiI
Me
2
SiCl
2
(CH
3
CO)
2
O
(CF
3
CO)
2
O
¡ì¡ì
¡ì
¡ì
¡ì
¡ì
¡ì
¡ì
¡ì
¡ì
¡ì
¡ì
C. C. Han, R. L. Elsenbaumer
Mol. Cryst. Liq. Cryst. 1990, 189, 183
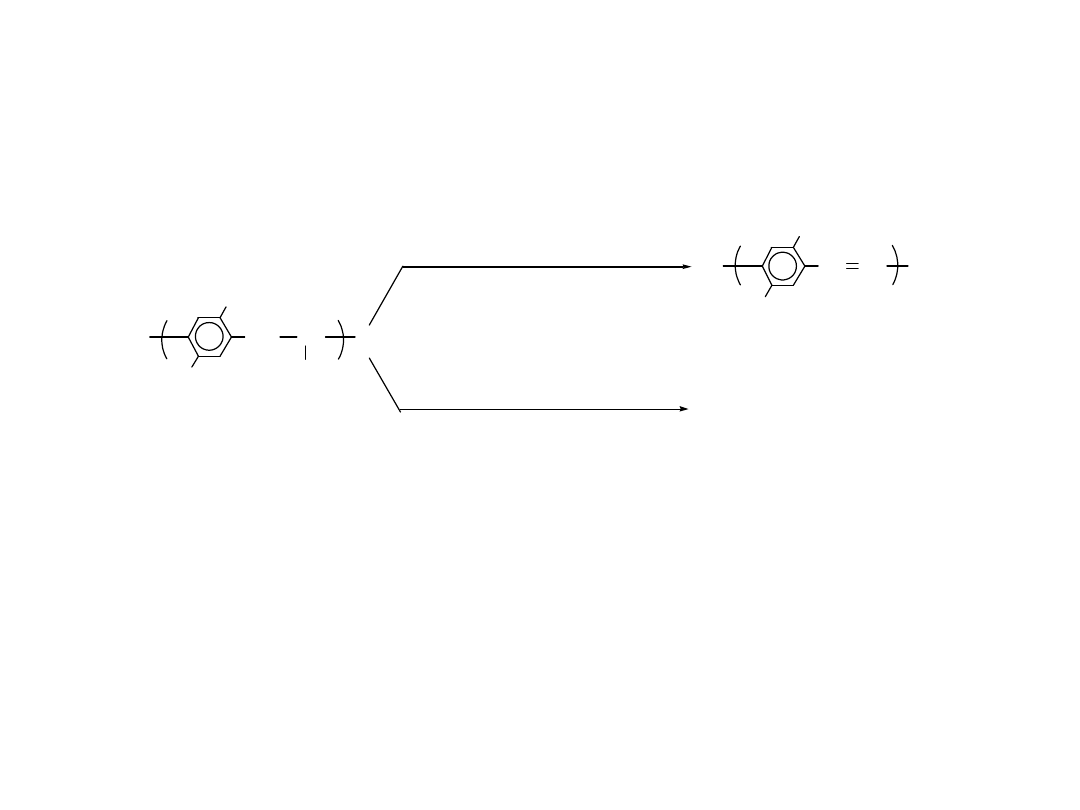
Równoczesna eliminacja i
domieszkowanie
CH
2
OBu
BuO
CH
OBu
n
CH
OBu
BuO
CH
n
H
+
, Solvent
Weak Acid
H
+
, Solvent
Strong Acid
Neutral Polymer Solution
Doped Polymer Solution
C. C. Han, R. L. Elsenbaumer
Mol. Cryst. Liq. Cryst. 1990, 189, 183
CH
2
OMe
MeO
CH
OMe
n
CH
2
CH
OMe
n
S
Weak Acid
Strong Acid
Neutral Polymer
Doped Polymer
Weak Acid
Strong Acid
Neutral Polymer
Doped Polymer
Równoczesna eliminacja i
domieszkowanie
REAKCJE POLIMERYZACJI
REAKCJE POLIMERYZACJI
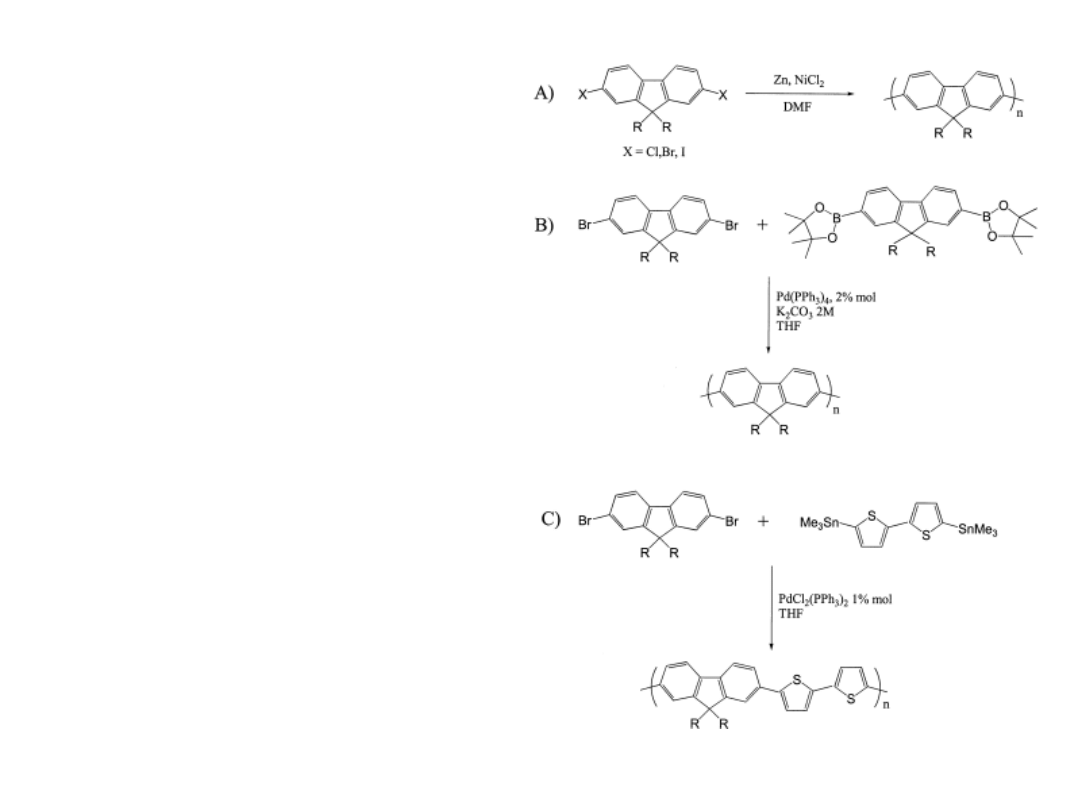
N
Br
Br
B
O
O
N
B
O
O
N
*
*
n
+
(a)
(a) Pd(PPh
3
)
4
, 2M KOH, aliquat 336, dioxane,
50°C, 4 d.
Reakcja Suzuki
M
w
=5.600, M
n
=2.700,
N
Br
Br
N
*
*
n
(b)
Reakcja Yamamoto
(b) Ni(COD)
2
, COD, bpy, DMF, toluene, 80°C, 4 d
Wydajność > 90%
Wysoka masa cząsteczkowa
Rozpuszczalny w CHCl
3
, THF, ...
J. Ostrauskaite, P. Strohriegl, Macromol. Chem. Phys., accepted for publication
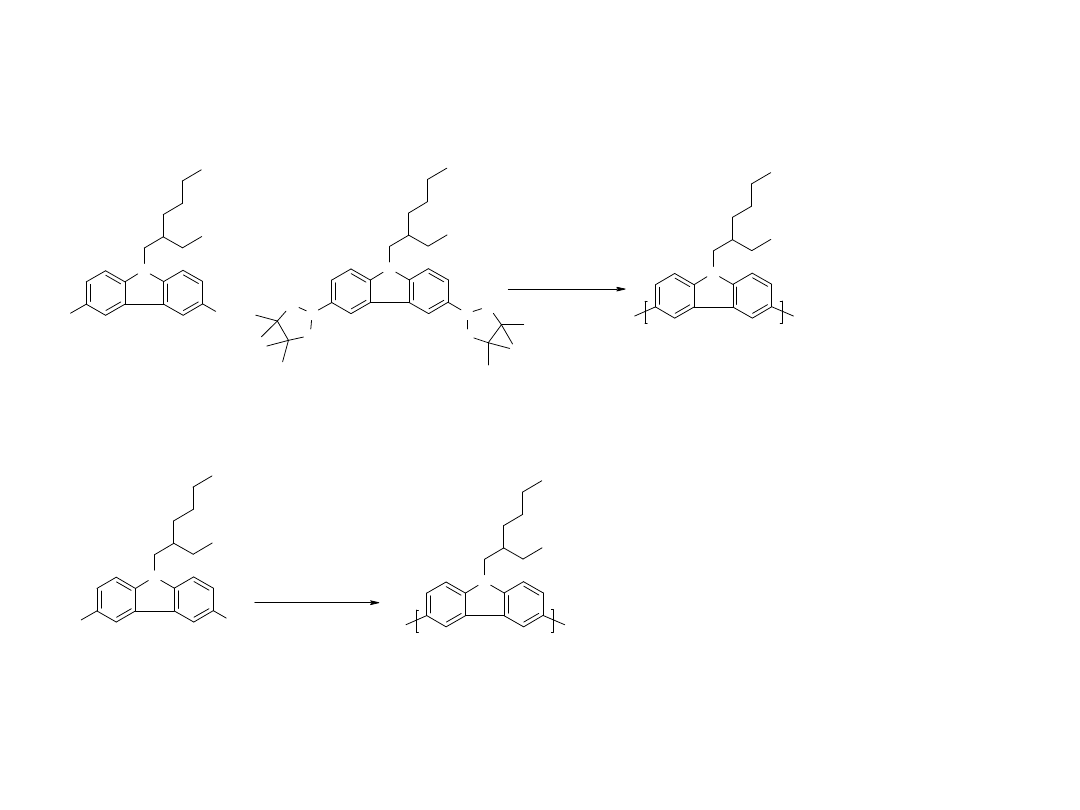
Synteza
polifluore
nu
Inne
przykłady
kopilimerów
naprzemienn
ych
polifluorenu
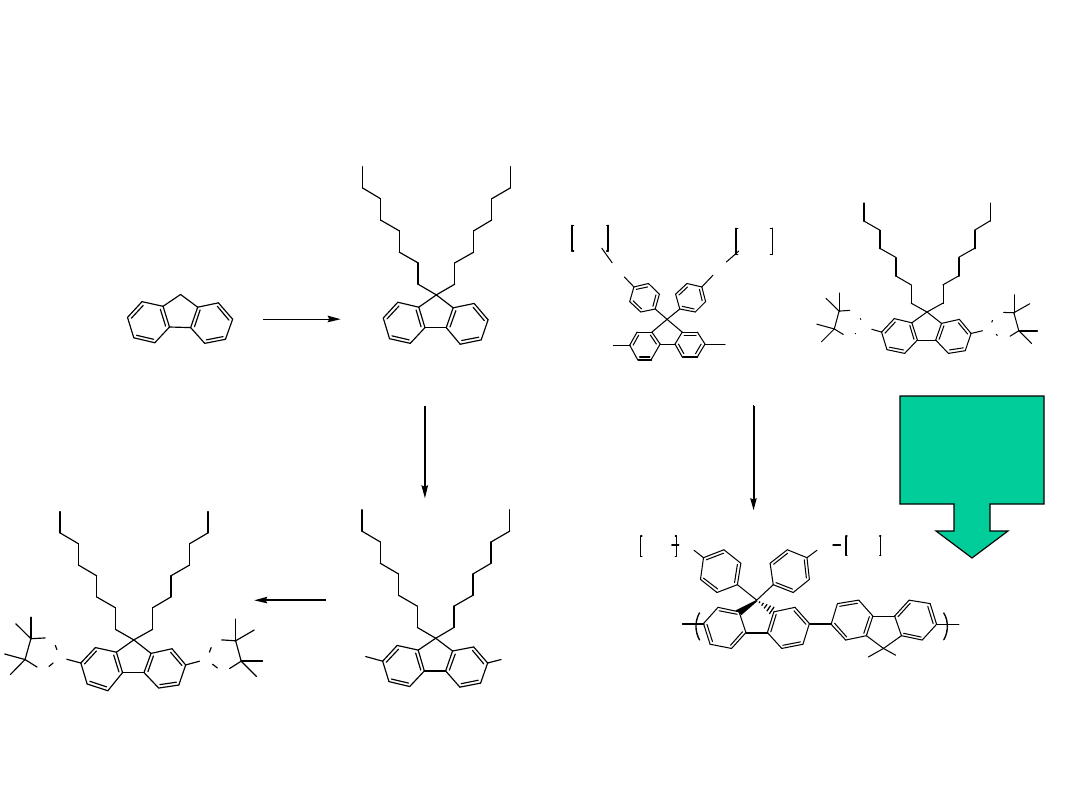
Synteza dendrytycznych polifluorenów
(X=1, 2)
O
O
Br
GX
XG
Br
B
B
O
O
O
O
K
2
CO
3
+
Toluene
Aliquate
Pd (PPh
3
)
4
O
O
GX
XG
C
8
H
17
C
8
H
17
n
Dendritic polyfluorene
Br
Br
B
B
O
O
O
O
n-octyl-Br
THF
FeCl
3
/ Br
2
CHCl
3
Reakcja
Suzuki

o
o
o
o
o
o
n
PF-G1
Struktura dendrytycznych polifluorenów (X=1, 2)
o
o
o
o
o
o
o
o
o
o
o
o
o
o
n
PF-G2
(rozpuszczalność)
Struktury
Dendrytyczne
Pierwsza
generacj
a
Druga
generacj
a
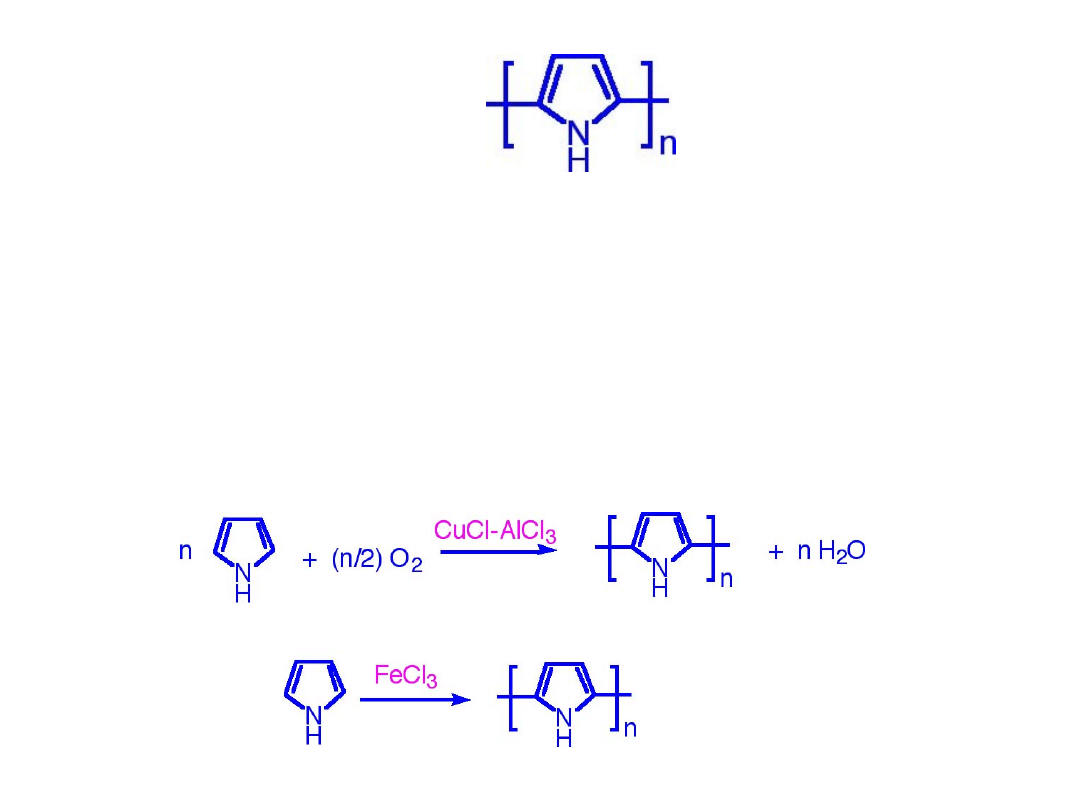
Polipirol
• Otrzymywany w wyniku chemicznego
bądź elektrochemicznego utleniania
pirolu
• Mechanizm: utleniająca kondensacja
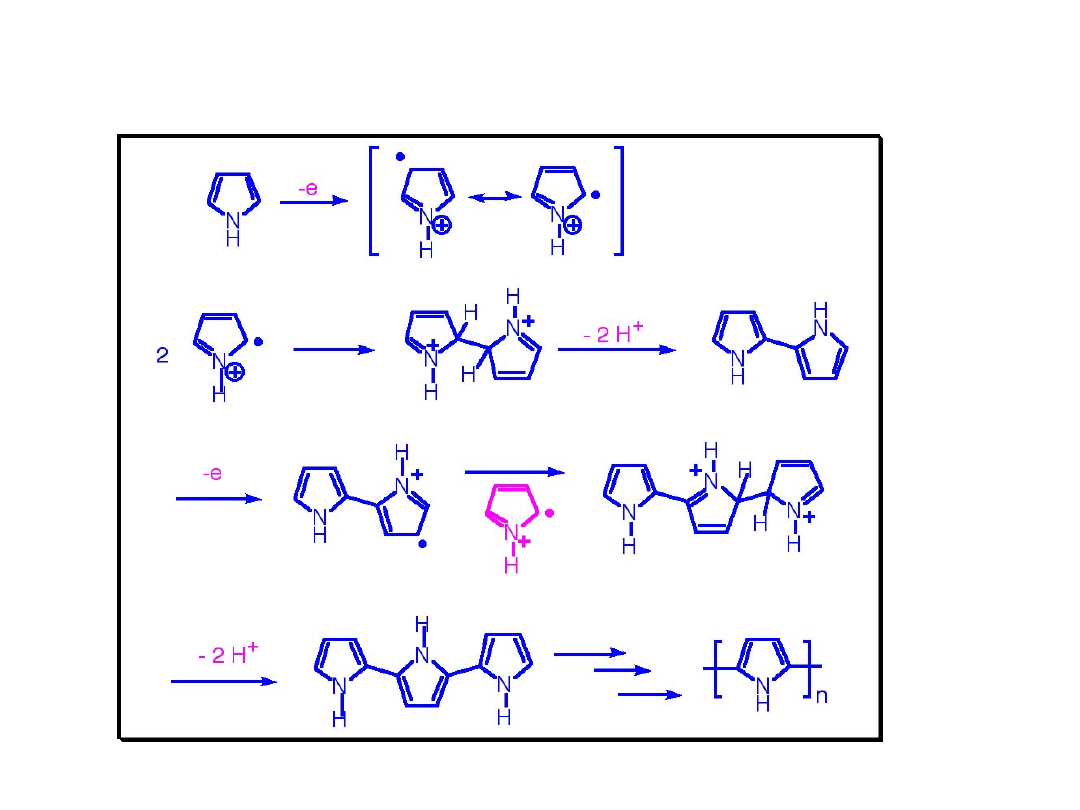
Proponowany mechanizm polimeryzacji elektrochemicznej
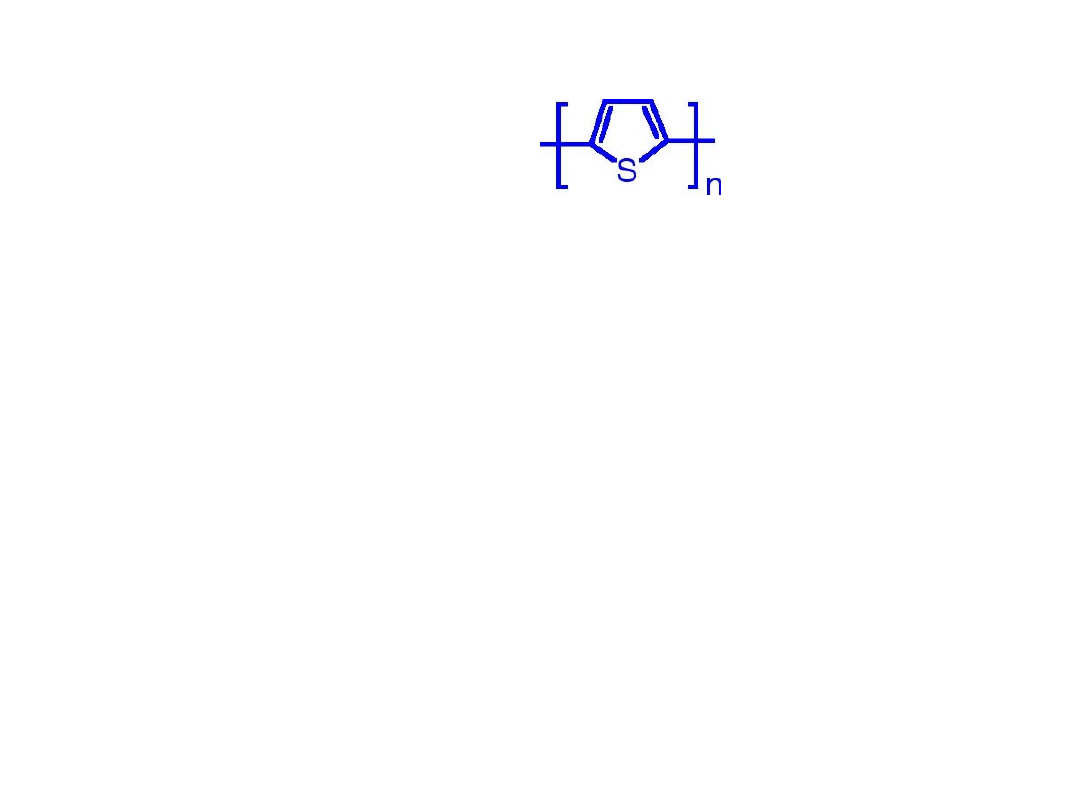
Politiofen
• Bardzo stabilny termicznie i
odporny na działanie środowiska
• Otrzymywany na drodze
polimeryzacji elektrochemicznej
tiofenu
• Można go również otrzymać w
wyniku reakcji chemicznych
katalizowanych różnymi metalami
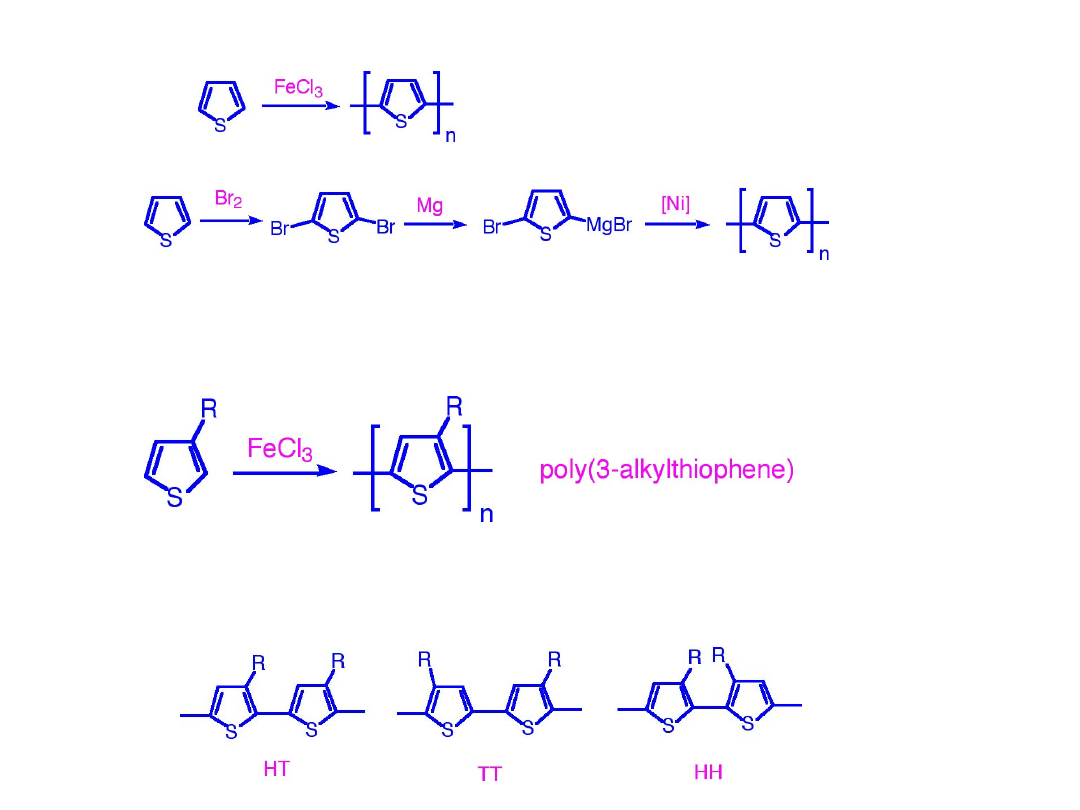
Rozpuszczalność i właściwości przetwórcze poprawia się
poprzez podstawienie w pozycji 3 łańcuchem alkilowym lub
alkoksylowym
Można otrzymać 3 typy połączeń
head-to-head (HH)
,
head-to-tail (HT)
, or
tail-to-tail (TT)
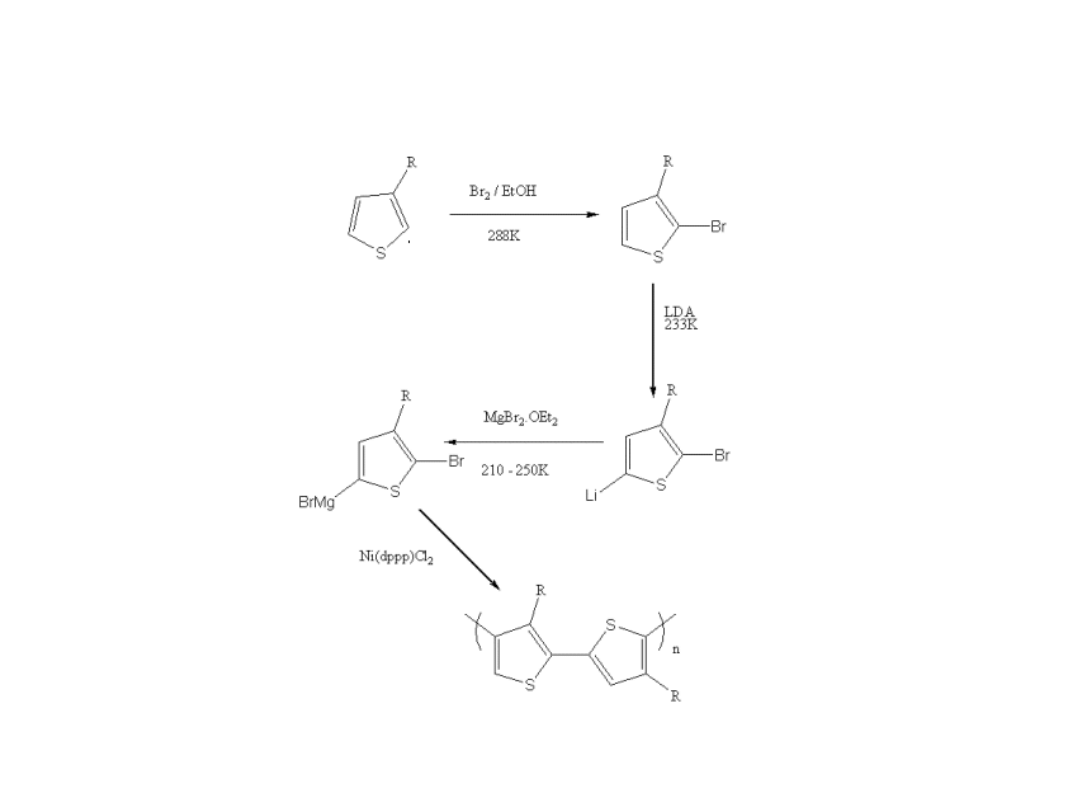
Synteza Regioregularnego
Politiofenu
McCulloch
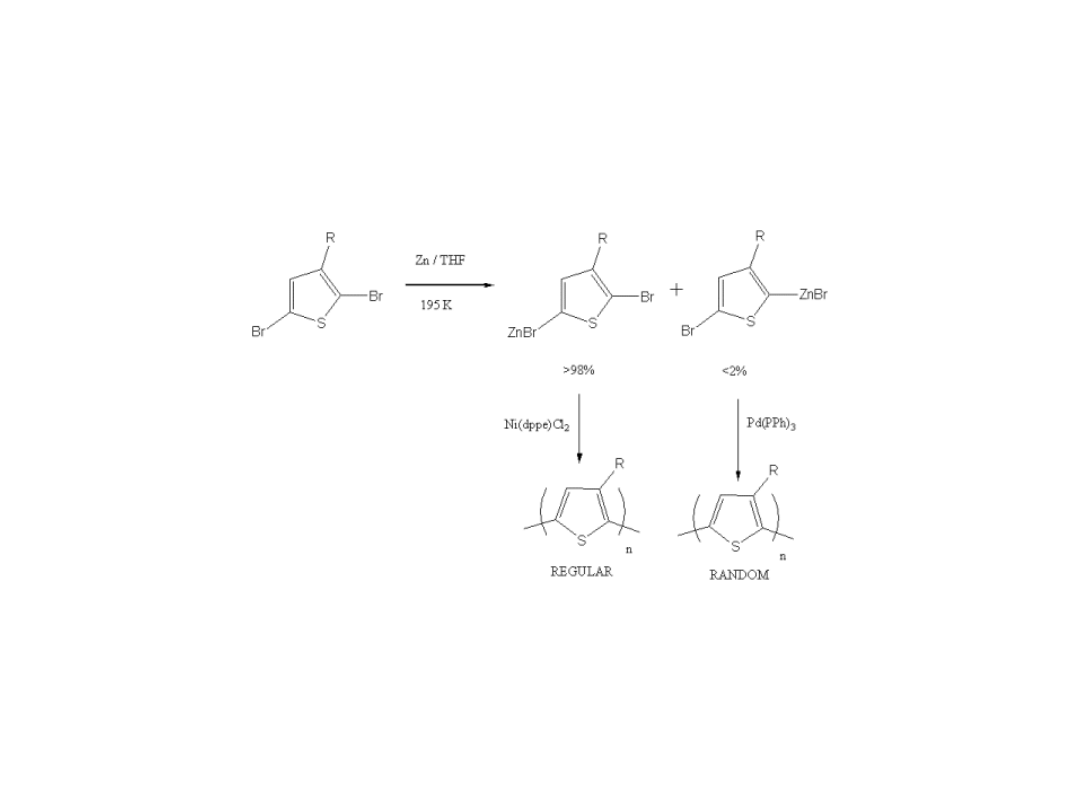
Synteza Regioregularnego
Politiofenu
Reike
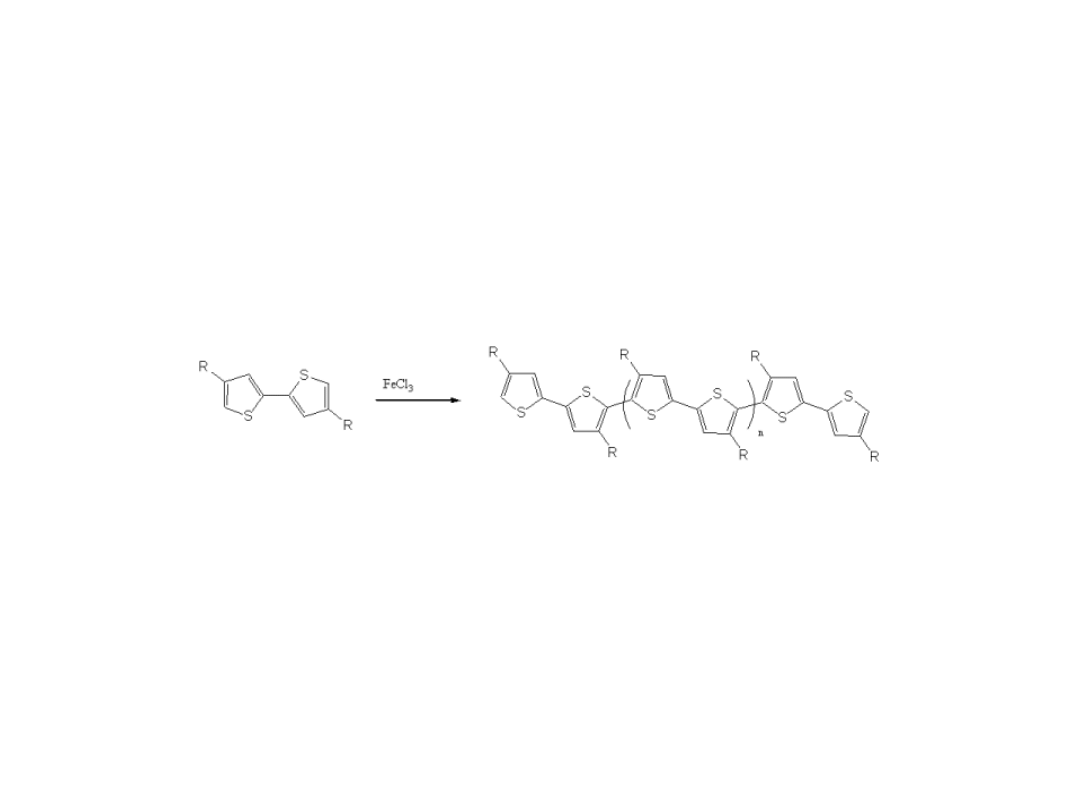
Synteza Regioregularnego
Politiofenu
Zagórska
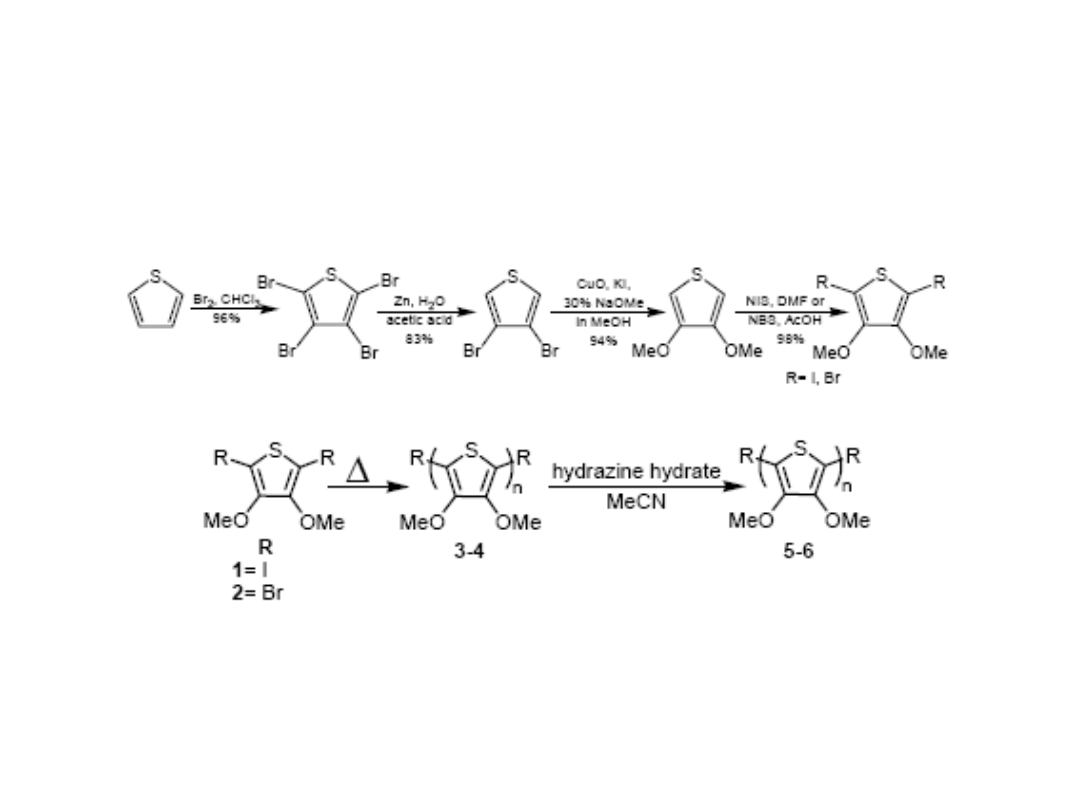
Synteza poli(dialkoksy
tiofenów)
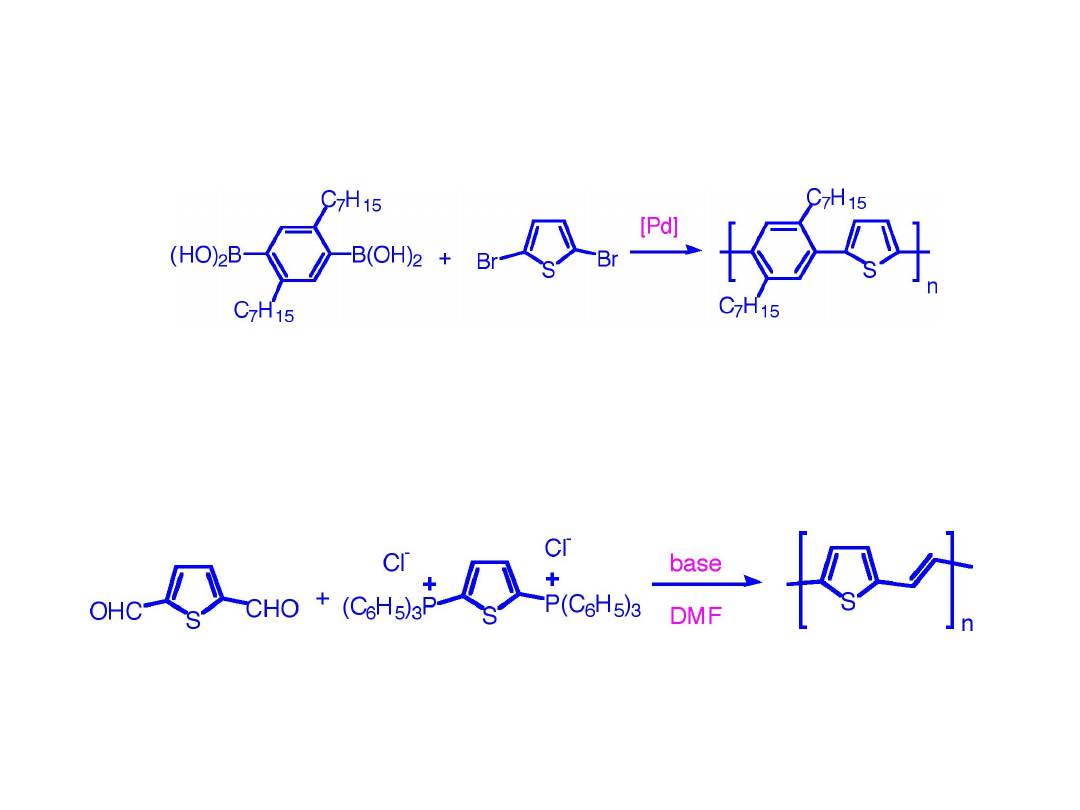
Synteza kopolimerów tiofenu
Synteza poli(tiofeno-winylenu)

Przewodnictwo politiofenów i polipiroli
domieszkowanych w różny sposób
Materiał
Politiofen
Poli(3-metylotiofen)
Poli(3-etylotiofen)
Poli(3-butylotiofen)
Poli(3-heksylotiofen)
Poli(3-heksylotiofen)
Polipirol
Polipirol
Polipirol
Polipirol
Domieszka
SO
3
CF
3
-
PF
6
-
PF
6
-
I
2
PF
6
-
I
2
FeCl
3
I
2
Br
2
Cl
2
(S cm
-1
)
10-20
510
270
4
30
11
3-200
2-8
5
0.5

Polianilina
• Polimer przewodzący, który można
otrzymać w środowisku wodnym i
niewodnym
• Może być otrzymana
elektrochemicznie lub na drodze
chemicznej kondensacji utleniającej
• Może być domieszkowana kwasem
• Występuje w wielu formach:
leukoemaraldyny, emaraldyny, soli
emaraldyny, pernigraniliny
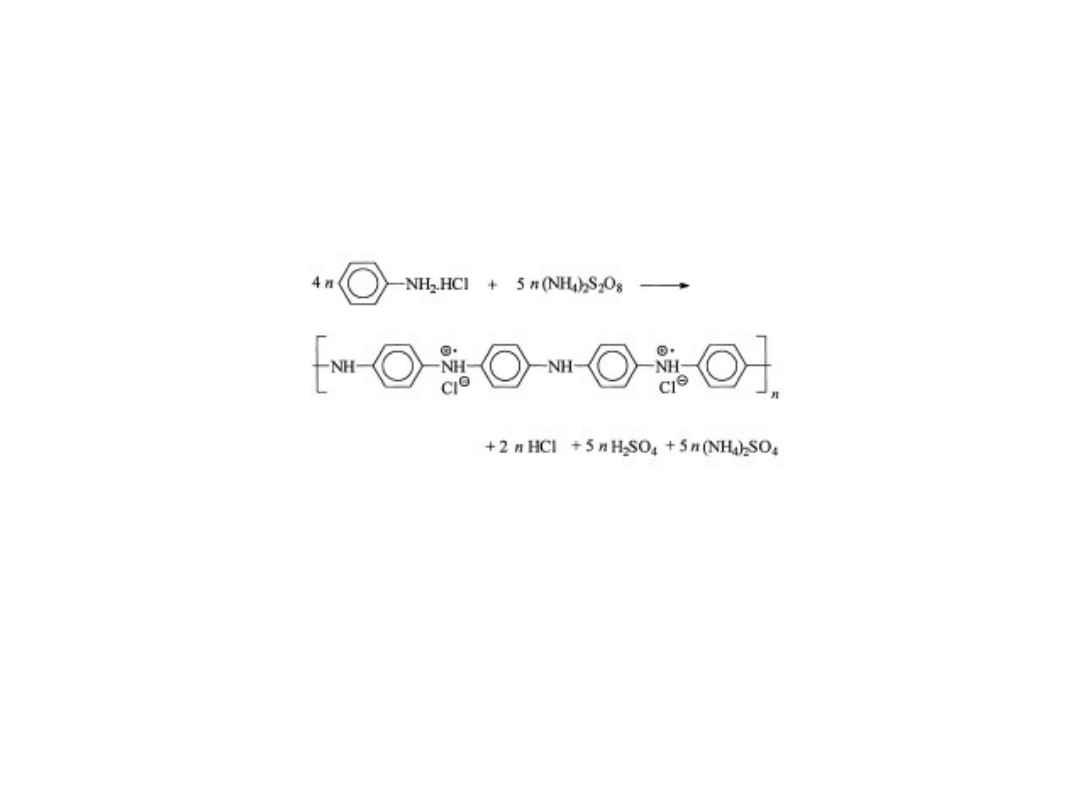
Synteza chemiczna
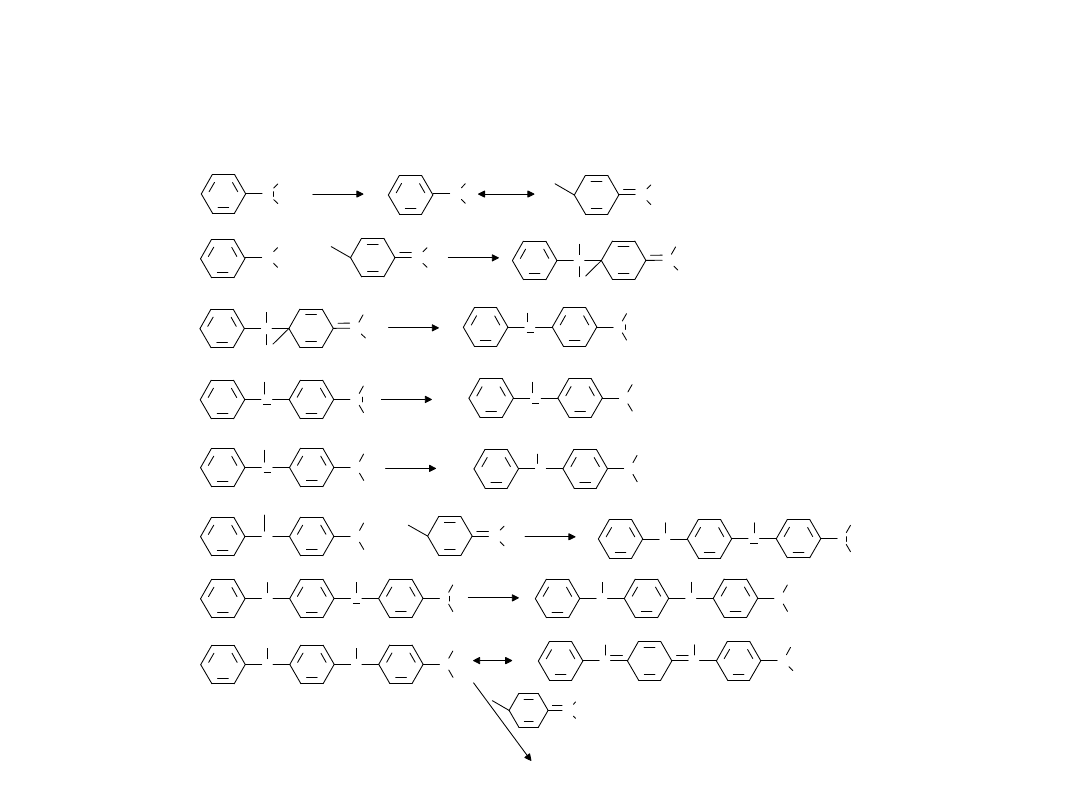
Schemat procesu elektrochemicznej polimeryzacji aniliny
.
.+
+
.
+
+
+
+
+
- 2H+
- e-
.+
.+
- e-
.+
.+
.+
.+
+
.
+
- 2H+
.+
.+
- 2e-
.+
.+
.+
.+
.+
.+
POLIMER
.
+
N
N
H
H
N
H
N
H
N
H
H
N
H
H
N
H
N
H
N
H
H
N
H
H
N
N
H
N
H
N
H
H
H
N
H
.+
N
H
N
H
N
H
H
N
+
N
H
H
N
H
H
N
H
H
N
H
H
N
H
H
N
H
H
N
H
H
N
H
H
N
H
H
N
N
H
H
H
H
N
N
H
H
H
N
N
H
H
H
N
N
H
H
H
N
N
H
H
H
H
+
+
H
H
- e-
.+
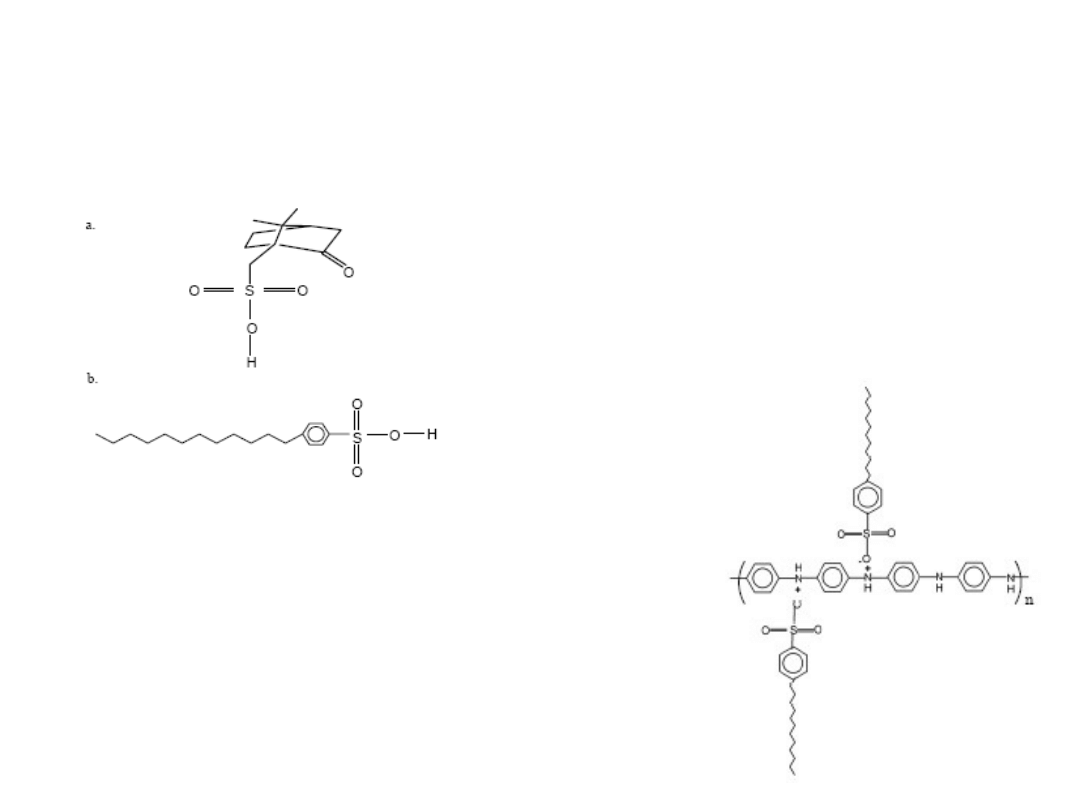
Polianilina rozpuszczalna
Kwas kamforo-sulfonowy
Kwas p-dodecylo-
benzeno-
sulfonowy

Przewodnictwo Polianiliny
domieszkowanej różnymi
kwasami
Medium
Kwas 5-Sulfosalicylowy
Kwas Benzeno sulfonowy
Kwas p-Tolueno sulfonowy
Kwas Solny
Kwas Siarkowy
(S cm
-1
)
0.2-1.0
2.0
5.0
2.0
1.2

Polimery przewodzące
otrzymywane na skalę
przemysłową
Polianilina
CORRPASSIV
®
– preparat
do ochrony antykorozyjnej
ORMECON
TM
– preparat do
pokryć antystatycznych
Baytron
®
P – Firma
Bayer
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
Wyszukiwarka
Podobne podstrony:
06 Podstawy syntezy polimerówid 6357 ppt
TSP cz2, studia, nano, 2rok, 4sem, technologie syntezy polimerów, wykład
Labo2, Technologia syntezy polimerów
06 Podstawy syntezy polimerówid 6357 ppt
Synteza polimerów z u¿yciem enzymów
synteza wielkocząsteczkowej żywicy epoksydowej - sprawozdanie, chemia i technologia polimerów
18 Przewodzące kompozyty polimerowe eko noszą zachowanie recyklingu poliwęglanu pokruszony mikrocząs
Wpływ AUN na przewód pokarmowy
właściwości polimerów
3 Przewodnictwo elektryczne
W10A Polimery biostabilne
Patologia przewodu pokarmowego CM UMK 2009
Wpływ stresu na motorykę przewodu pokarmowego ready
Krwawienie z przewodu pokarmowego lub zagrażające powikłania oraz dyskomfort pacjenta w zakresie hig
8a Syntezy prostych aminokwasów
więcej podobnych podstron