POLITECHNIKA WROCŁAWSKA
Wydział Chemiczny
CHEMIA NIEORGANICZNA – PODSTAWY
WYKŁAD
ZWIĄZKI
KOMPLEKSOWE
A
B
B
B
B
B
B
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
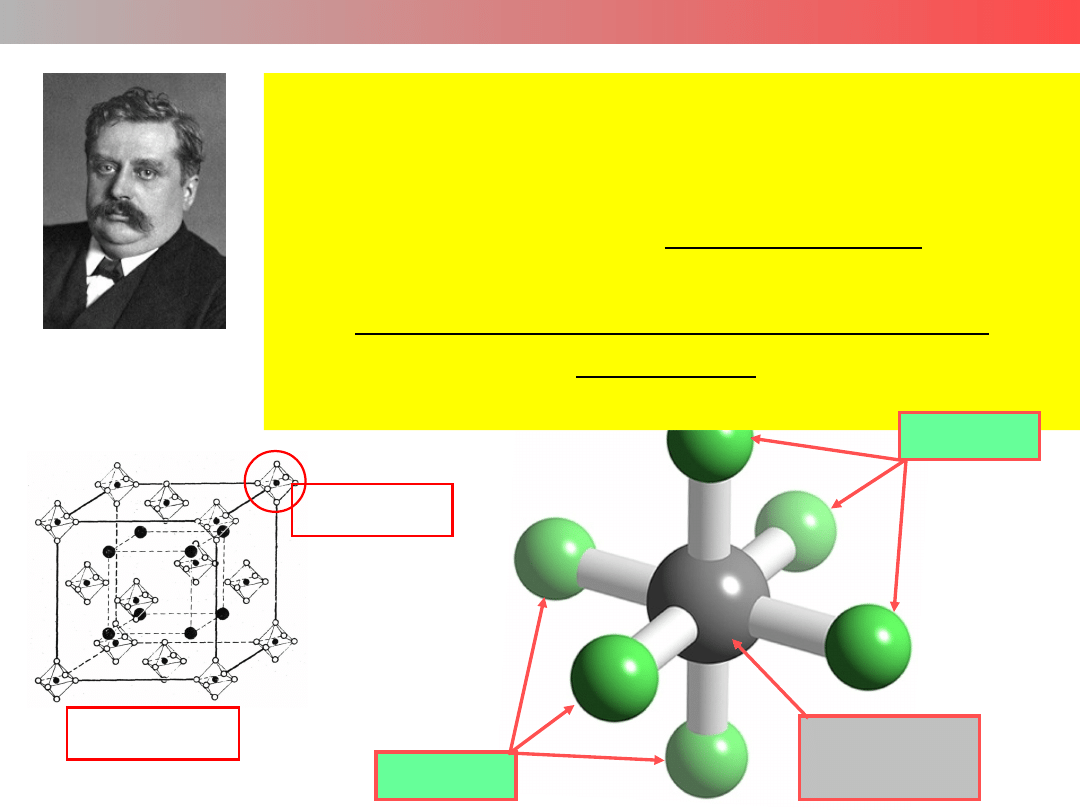
Związek lub jon kompleksowy to połączenie
w którym z atomem (jonem) A
związana jest większa liczba
innych atomów (jonów, grup) B
niż to wynika z ładunku lub stopnia
utlenienia
atomu (jonu) A.
K
2
[PtCl
6
]
[PtCl
6
]
2−
Atom (jon)
centralny
Ligandy
Ligandy
Alfred Werner
1866-1910
Nobel 1913
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
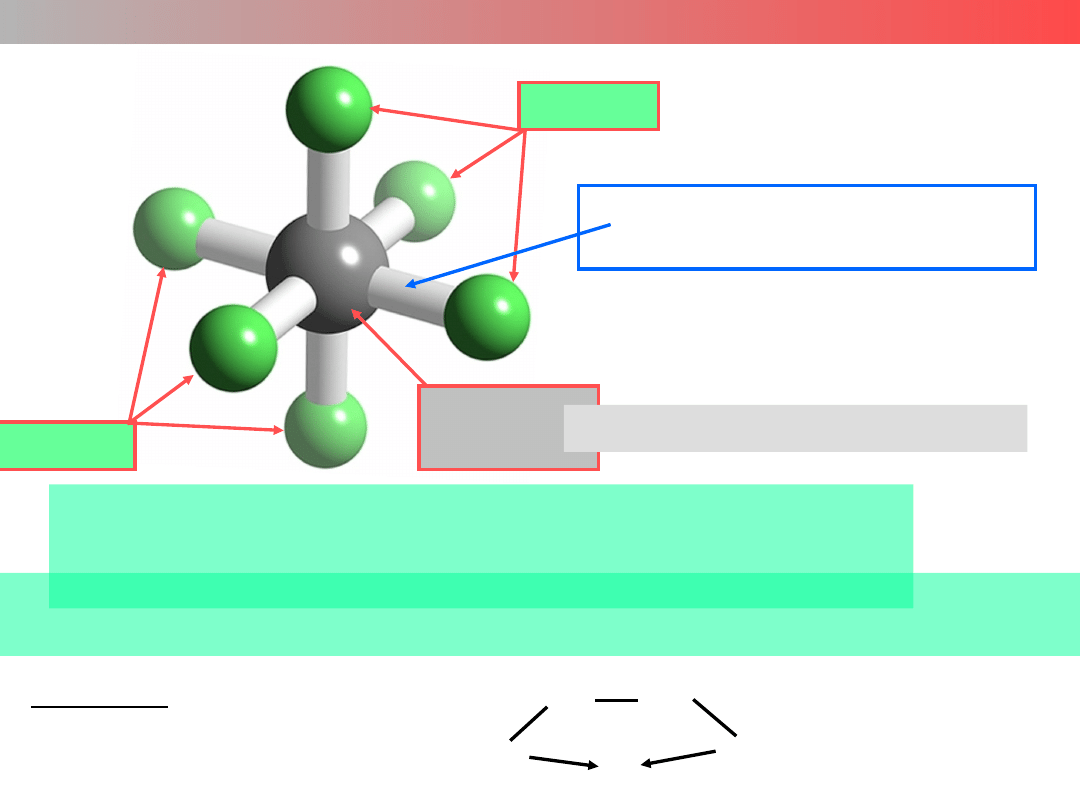
Pt
IV
Cl
Cl
Cl
Cl
Cl
Cl
Atom (jon)
centralny
Ligandy
Ligandy
– głównie jony metali, metale
– obojętne cząsteczki lub aniony z wolną parą
elektronową,
:NH
3
, H
2
O:, :CO, NO: lub :Cl
–
,
:CN
–
, :OH
–
– cząsteczki organiczne z wieloma grupami posiadającymi
wolne pary elektronowe (ligandy wielokleszczowe)
Przykład: etylenodiamina
:NH
2
CH
2
CH
2
H
2
N:
M
Liczba wiązań metal-ligand
liczba koordynacyjna (LK)
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
NOMENKLATURA (nazewnictwo)
ZWIĄZKÓW KOMPLEKSOWYCH
Atom
centr.
L
4
L
1
L
2
L
3
L-ligandy
[kation]
n+
[cząsteczka]
[anion]
n-
NOMENKLATURA KOORDYNACYJNA
WZÓR:
[
jednostki koordynacyjnej
]
Atom
centr.Ligandy anionowe alfabet.
Ligandy obojętne alfabet.
[
]
[Ni(CO)
4
]
[CoCl(NH
3
)
5
]
2+
[PtCl
6
]
2–
[CoBrCl(H
2
O)
2
(NH
3
)
2
]
+
Alfabetycznie wg. symboli we
wzorze
NAZWA:
[
jednostki koordynacyjnej
]
ligandy (wszystkie) alfabetycznie
atom
centralny
-u
-i
-
an
(
st. utl. atomu
centralnego
lub ładunek
jedn. koord.
)
wg. nazwy
binarnej
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
NAZWY wybranych LIGANDÓW:
H
2
O - akwa
NH
3
- amina
CO - karbonyl CN
–
- cyjano
OH
–
- hydrokso
NO - nitrozyl
NCS
–
- tiocyjanianoSH
–
- merkapto
PRZYKŁADY:
chlorek
penta
amina
chloro
kobaltu(III)
związek binarny (sól)
[Co
Cl
(NH
3
)
5
]
Cl
2
chlorek
penta
amina
chloro
kobaltu(2+)
[Co
4
(CO)
12
]
dodeka
karbonyl
tetra
kobalt(0)
heksa
cyjano
żelazian(II) żelaza(III)
związek binarny (sól)
Fe
4
[Fe
(CN)
6
]
3
[Co
(NH
3
)
6
]
[Cr
(CN)
6
]
3
związek binarny (sól)
heksa
cyjano
chromian(II)
heksa
amina
kobaltu(III)
[Pt
Cl
2
(NH
3
)
2
]
di
amina
di
chloro
platyna(II)
„cisplatyna”
[
(NH
3
)
5
Cr-
OH
-Cr
(NH
3
)
5
]Cl
5
chlorek
μ-hydrokso
bis(penta
amina
chromu(III))
[SnCl
3
]
–
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
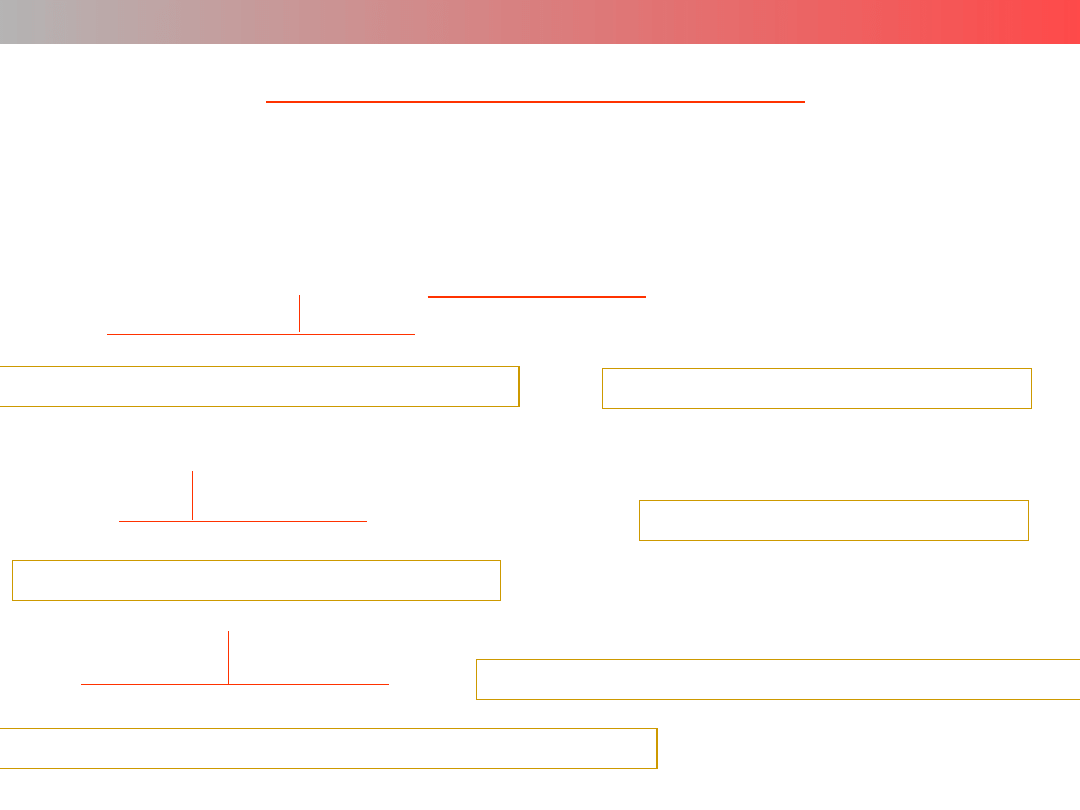
Liczba koordynacyjna (LK) – struktura kompleksu
LK = 2
struktura liniowa
[Au(CN)
2
]
–
[Ag(CO)
2
]+
[Ag(NH
3
)
2
]+
LK = 3
struktura trójkątna
[HgI
3
]
–
struktura piramidy trygonalnej
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
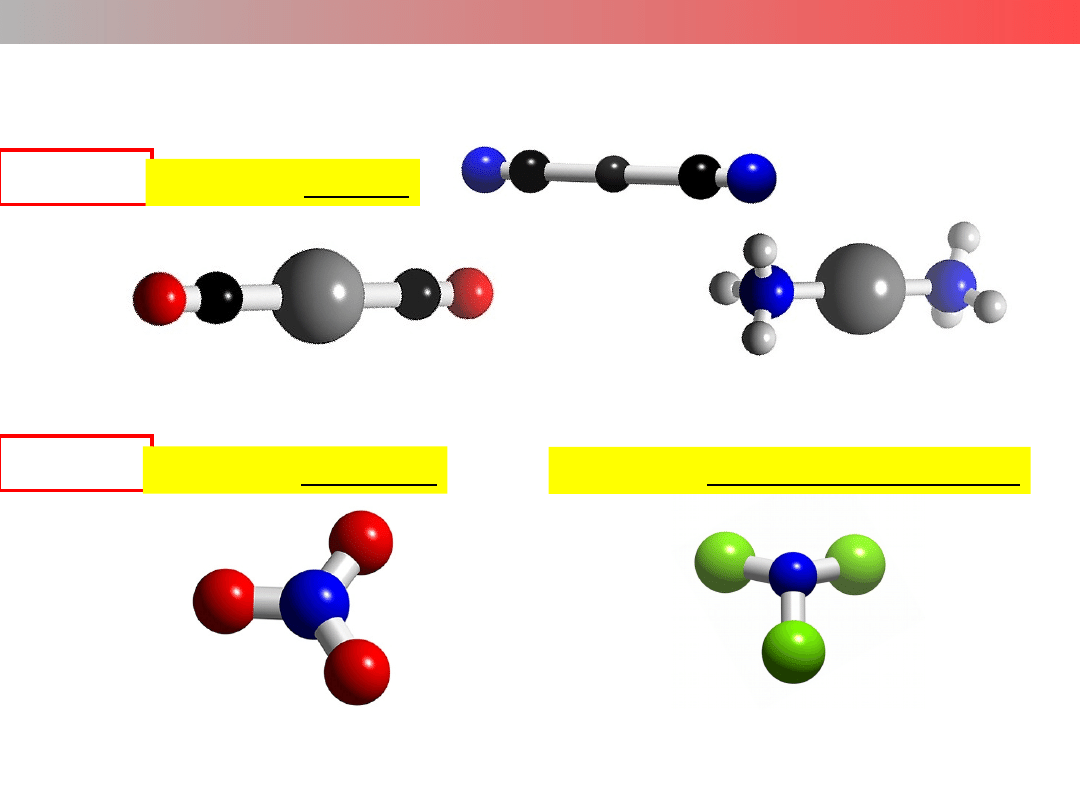
Liczba koordynacyjna (LK) – struktura kompleksu
LK = 4
struktura tetraedryczna
[FeCl
4
]
–
struktura kwadratowa
[PtCl
4
]
–
[Pt(NH
3
)
4
]
2+
[Ni(CO)
4
]
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
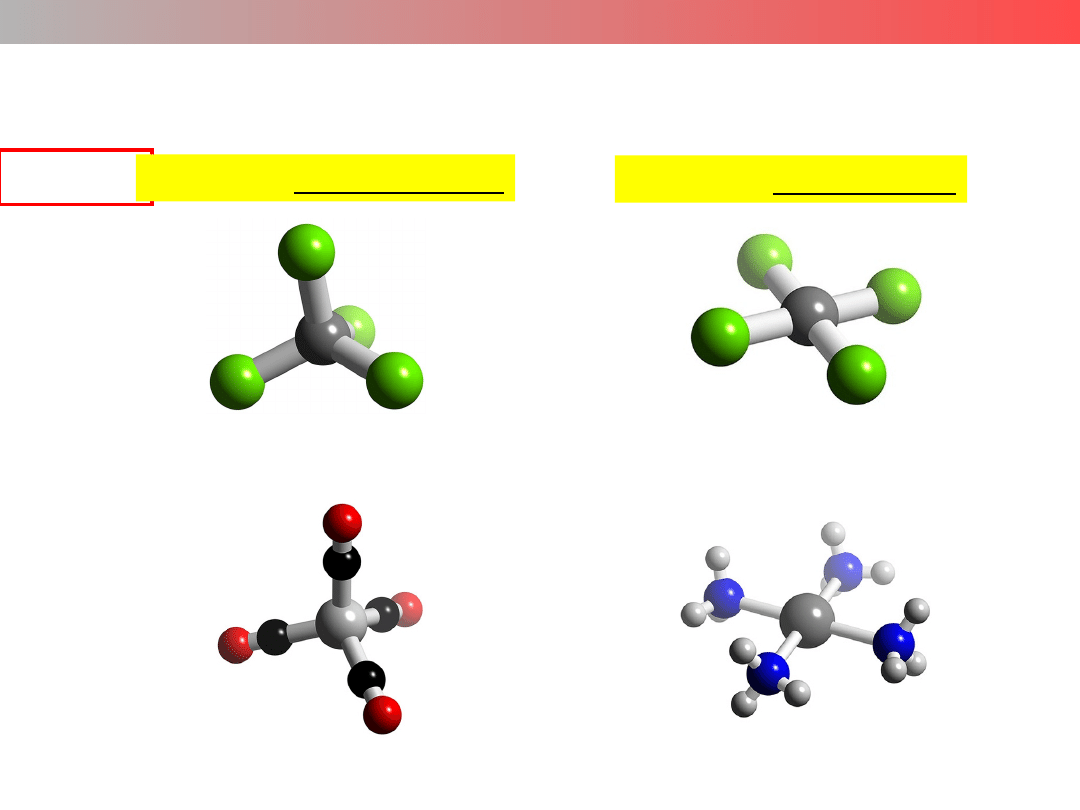
Liczba koordynacyjna (LK) – struktura kompleksu
LK = 5
struktura bipiramidy trygonalnej
[Fe(CO)
5
]
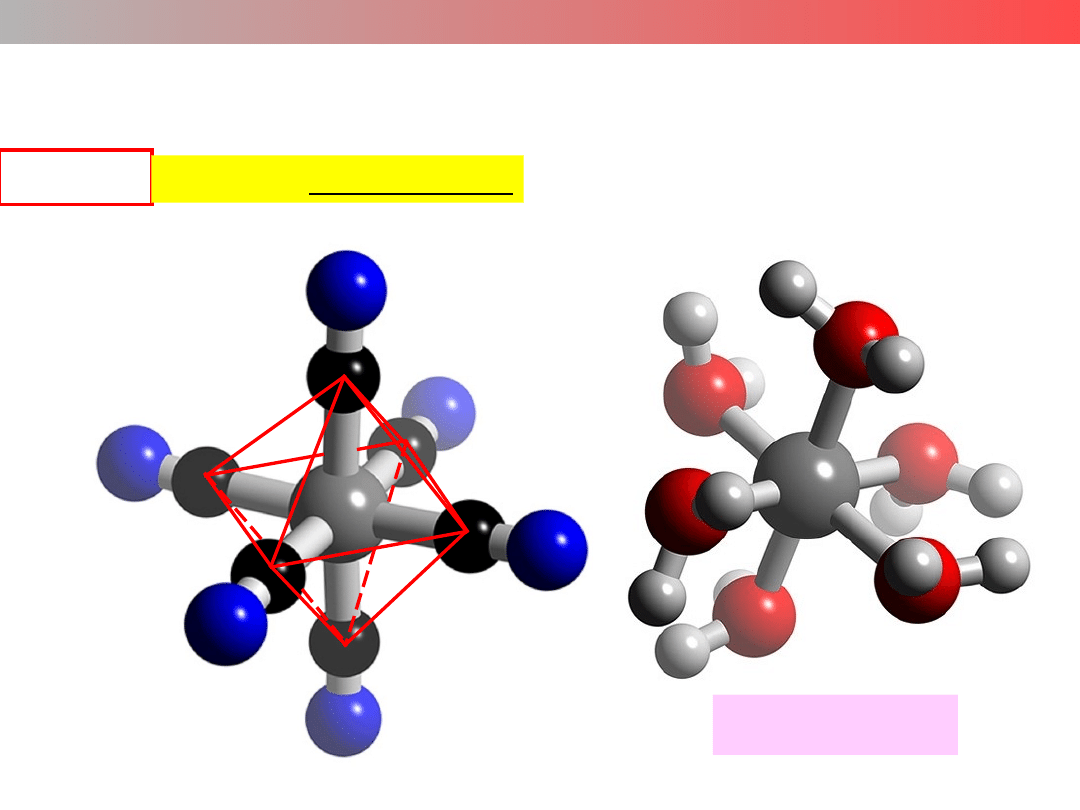
[Fe(CN)
6
]
3–
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
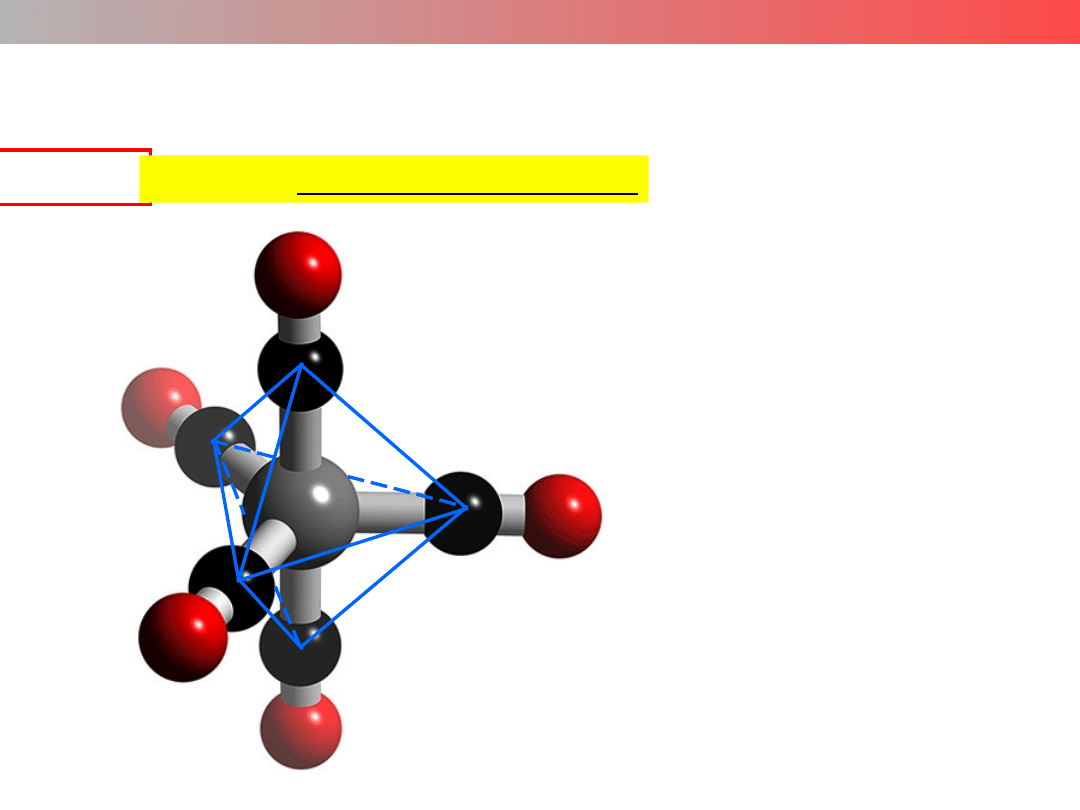
Liczba koordynacyjna (LK) – struktura kompleksu
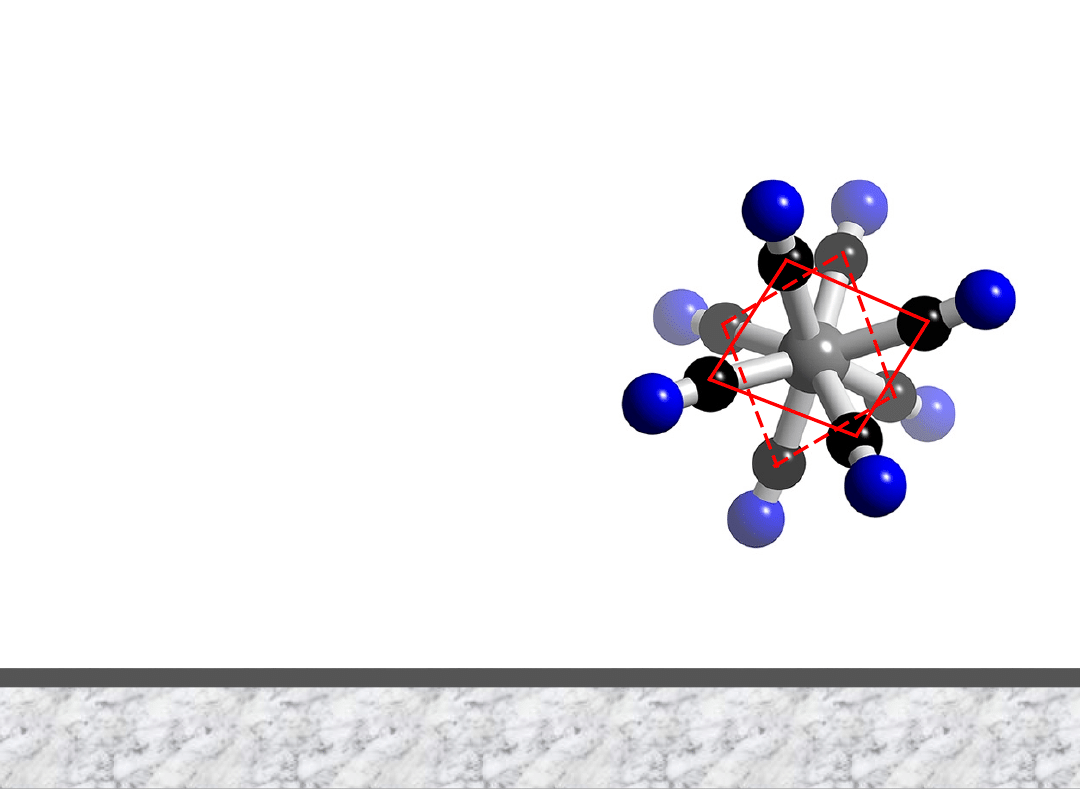
LK = 6
struktura oktaedryczna
[Co(H
2
O)
6
]
2+
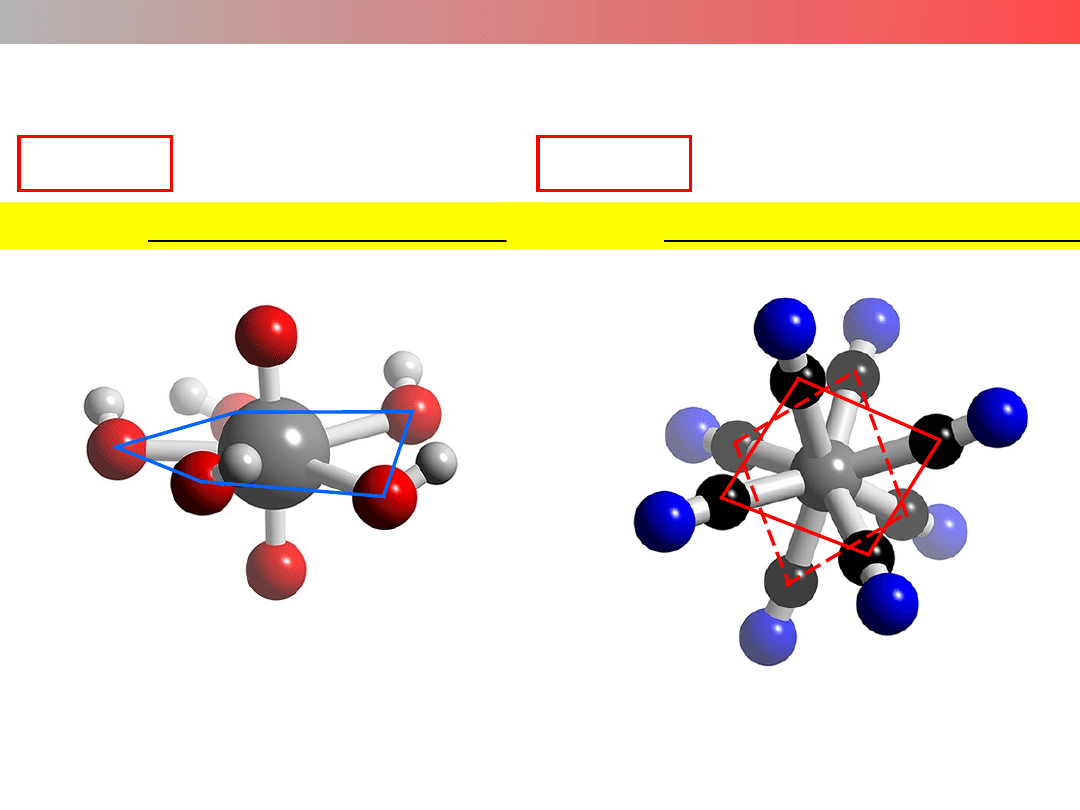
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
Liczba koordynacyjna (LK) – struktura kompleksu
LK = 7
struktura bipiramidy pentagonalnej
[UO
2
(OH)
5
]
LK = 8
struktura antypryzmatu kwadratowgo
[Mo(CN)
8
]
3–

Wykład 9 – ZWIĄZKI KOMPLEKSOWE
IZOMERIA ZWIĄZKÓW KOMPLEKSOWYCH
1. Izomeria strukturalna
a) izomeria jonowa
[CoBr(NH
3
)
5
]SO
4
i [Co(SO
4
)(NH
3
)
5
]Br
b) izomeria solwatacyjna
[Cr(H
2
O)
6
]Cl
3
i [CrCl
2
(H
2
O)
4
]Cl·2H
2
O
c) izomeria koordynacyjna
[Co(NH
3
)
6
][Cr(CN)
6
] i [Cr(NH
3
)
6
][Co(CN)
6
]
d) izomeria koordynacyjna
[Cr(SCN)(H
2
O)
5
]
2+
i [Cr(NCS)(H
2
O)
5
]
2+
jon pentaakwa(tiocyjanian-
S
)chromu(III) jon pentaakwa(tiocyjanian-
N
)chromu(III)
mer
B
B
B
A
A
A
fac
B
B
B
A
A
A
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
IZOMERIA ZWIĄZKÓW KOMPLEKSOWYCH
2.
Stereoizomeria
a) izomeria geometryczna
Cl
Cl
py
py
Pt
Cl
py
py
Cl
Pt
Cl
Ru
Cl
Ph
3
P
PPh
3
PPh
3
Ph
3
P
Cl
Ru
PPh
3
Ph
3
P
Cl
PPh
3
Ph
3
P
cis
trans
cis
trans
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
IZOMERIA ZWIĄZKÓW KOMPLEKSOWYCH
b) izomeria optyczna

Wykład 9 – ZWIĄZKI KOMPLEKSOWE
M + L ⇆ ML
K
1
=
[ML]
[M] [L]
= β
1
ML + L ⇆ ML
2
K
2
=
[ML
2
]
[ML] [L]
β
2
= K
1
· K
2
REAKCJA
STAŁA
TRWAŁOŚCI
SKUMULOWANA
STAŁA TRWAŁOŚCI
M + 2L ⇆ ML
2
=
[ML
2
]
[M] [L]
2
ML
k-1
+ L ⇆ ML
k
K
k
=
[ML
k
]
[ML
k-1
] [L]
β
k
= Π K
n
M + kL ⇆ ML
k
=
[ML
k
]
[M] [L]
k
n=1
k
Równowagi tworzenia kompleksów
RÓWNOWAGI CHEMICZNE
W ROZTWORACH KOMPLEKSÓW
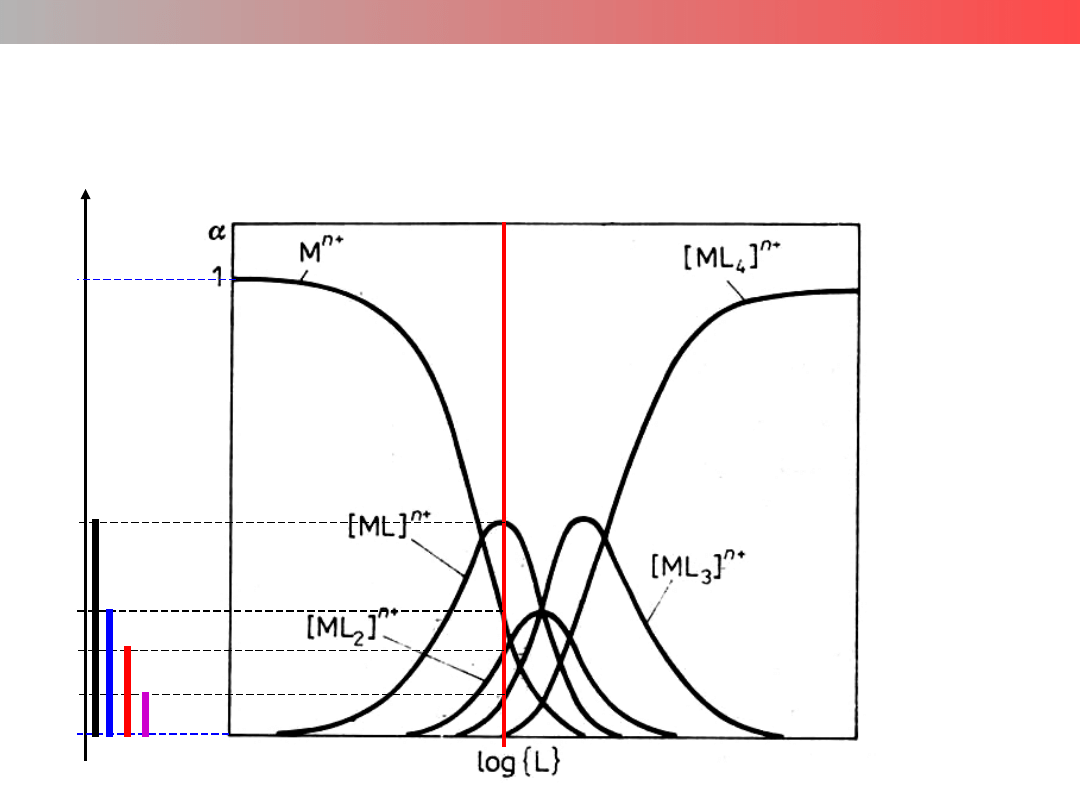
Krzywe podziału (specjacji)
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
RÓWNOWAGI CHEMICZNE
W ROZTWORACH KOMPLEKSÓW
% M
100
0
46
28
18
8
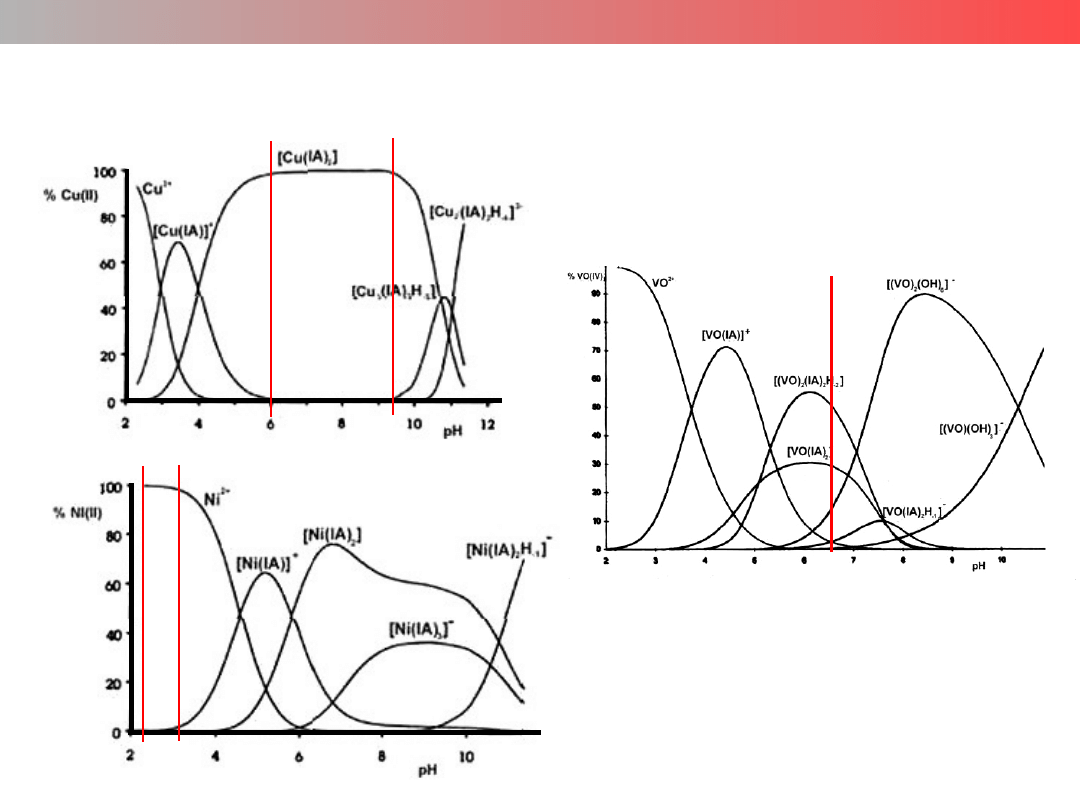
Krzywe podziału (specjacji)
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
tylko jedna
forma kompleksu
brak kompleksowania
współistnienie pięciu
form kompleksowych
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
WYBRANE PROBLEMY OBLICZENIOWE
W CHEMII ZWIĄZKÓW KOMPLEKSOWYCH
β
k
= Π K
n
M + kL ⇆ ML
k
=
[ML
k
]
[M] [L]
k
n=1
k
Podział (specjacja) metalu pomiędzy różne formy
Ułamek molowy metalu
w formie kompleksu
ML
n
x
n
=
[ML
n
]
c
M
c
M
–
stężenie
całkowite metalu
c
M
= [M] + [ML] + [ML
2
] + . . . [ML
k
]
[ML
n
] = β
n
· [M]·[L]
n
x
n
=
[ML
n
]
c
M
=
β
n
· [M]·[L]
n
[M] + β
1
· [M]·[L] + . . . β
k
· [M]·[L]
k
=
β
n
· [L]
n
1 + β
1
· [L] + . . . β
k
· [L]
k
x
n
=
[ML
n
]
c
M
?
x
M
= ?

Wykład 9 – ZWIĄZKI KOMPLEKSOWE
WYBRANE PROBLEMY OBLICZENIOWE
W CHEMII ZWIĄZKÓW KOMPLEKSOWYCH
Ułamek molowy metalu
nieskompleksowanego
M
x
M
=
[M]
c
M
β
k
= Π K
n
M + kL ⇆ ML
k
=
[ML
k
]
[M] [L]
k
n=1
k
Podział (specjacja) metalu pomiędzy różne formy
c
M
–
stężenie
całkowite metalu
c
M
= [M] + [ML] + [ML
2
] + . . . [ML
k
]
x
M
=
[M]
c
M
=
[M]
[M] + β
1
· [M]·[L] + . . . β
k
· [M]·[L]
k
=
1
1 + β
1
· [L] + . . . β
k
· [L]
k
x
M
=
[M]
c
M

Wykład 9 – ZWIĄZKI KOMPLEKSOWE
Obliczyć stężenie wolnych jonów Sn+, jeżeli w 1,0 dm
3
1,0 M NaCl
rozpuszczono 0,65 g SnCl
2
, a pH tego roztworu wynosiło 4,0.
Stałe twardości kompleksów Sn(II) + Cl- wynoszą:
log
1
= 1,51
log
2
= 2,24
log
3
= 2,03
log
4
= 1,48
Masa molowa SnCl
2
= 189,6 g/mol
Rozwiązanie:
c
Sn
= 3,45·10
–3
[L] ≈ c
Cl
= 1,0
<<
=
1
1 + β
1
· [L] + . . . β
k
· [L]
k
x
M
=
[M]
c
M
3
48
,
1
03
,
2
24
,
2
51
,
1
4
4
3
3
2
2
1
M
10
90
,
2
5
,
344
1
10
10
10
10
1
1
L
L
L
L
1
1
x
x
M
=
x
M
=
[M]
c
M
[M] = x
M
·
c
M
=
2,90 · 10
–3
· 3,45 · 10
–3
= 1,00 · 10
–5
M
Gdyby cały metal przeszedł
w kompleks [SnCl
4
]
2-
to stężenie
liganda zmalało by o
4·3,45·10
-3
= 0,0138 →1,38%
M
10
45
,
3
00
,
1
6
,
189
65
,
0
c
3
pocz
)
II
(
Sn
c
M
Założenie: stężenie wolnego
ligandu jest stałe,
równe początkowemu
Stężenie początkowe SnCl
2
:
WYBRANE PROBLEMY OBLICZENIOWE
W CHEMII NIEORGANICZNEJ
Oblicz pH ze stężenia lub aktywności jonów H
+
dla 1 dm
3
roztworu zawierającego 0,020 mola Na
2
SO
4
i
0,020 mola HCl.
a · B = 3,0; A = 0,51
Elektrolity – aktywność, wsp. aktywności, siła jonowa
a) pH na podstawie stężenia
c
HCl
= 0,020 = [H
+
]pH = –log 0,020 = 1,70
b) pH na podstawie aktywnościpH = –log a
H+
a
i
= c
i
· f
i
aktywność
stężenie
molowe
współczynnik
aktywności
1 + a B I
√
ln f
i
=
A z
i
2
I
√
I
– siła jonowa
I = ½ ∑
c
i
· z
i
2
I
= 1/2 (0,040 · 1
2
+ 0,020 · 2
2
+ 0,020 · 1
2
+ 0,020 · 1
2
=
0,080
Na
+
SO
4
2–
H
+
Cl
–
WYBRANE PROBLEMY OBLICZENIOWE
W CHEMII NIEORGANICZNEJ
Oblicz pH ze stężenia lub aktywności jonów H
+
dla 1 dm
3
roztworu
zawierającego 0,020 mola Na
2
SO
4
i 0,020 mola HCl.
Elektrolity – aktywność, wsp. aktywności, siła jonowa
ln f
i
=
A z
i
2
I
1 + a B I
√
√
a · B = 3,0; A = 0,51
I
= 0,080
0780
,
0
283
,
1
1442
,
0
283
,
0
1
1442
,
0
080
,
0
0
,
3
1
080
,
0
1
51
,
0
I
B
a
1
I
Az
=
y
log
2
2
i
H
H
y
= 10
-0,0780
= 0,836
H
a
H
c
H
y
= · = 0,020 · 0,836 = 0,0167
pH = - log 0,0167 = 1,78
WYBRANE PROBLEMY OBLICZENIOWE
W CHEMII NIEORGANICZNEJ
Oblicz stężenia molowe jonów w 0,010 M roztworze
H
2
CO
3
. Oblicz pH tego roztworu.
pKa1 = 6,04, pKa2 = 9,75
Elektrolity – kwasy wieloprotonowe
Dysocjacja H
2
CO
3
:
I stopień H
2
CO
3
⇆
H
+
+ HCO
3
-
II stopień HCO
3
–
⇆
H
+
+ CO
3
2–
Jony obecne w roztworze: H
+
, HCO
3
−
, CO
3
2−
Obliczamy [H
+
] i [HCO
3
]
−
- zaniedbujemy II stopień dysocjacji – [H
+
] ≈ [HCO
3
−
]
[H
2
CO
3
]
[H
+
]
· [HCO
3
−
]
K
a1
=
= 9,1·10
−7
=
[H
+
]
· [H
+
]
0,010 – [H
+
]
≈
[H
+
]
2
0,010
[H
+
]= 9,54·10
−5
=
[HCO
3
−
]
[HCO
3
−
]
[H
+
]
· [CO
3
2−
]
K
a2
=
= 2,7·10
−10
[HCO
3
−
]
[HCO
3
−
]
· [CO
3
2−
]
=
[CO
3
2−
] = 2,7·10
−10
Obliczamy [CO
3
]
2−
WYBRANE PROBLEMY OBLICZENIOWE
W CHEMII NIEORGANICZNEJ
Ogniwo składa się z elektrody cynowej zanurzonej w roztworze
SnCl
2
, o stężeniu 0,0100 mol/dm
3
, oraz elektrody platynowej
zanurzonej w roztworze o pH = 4,00 omywanej gazowym
wodorem pod ciśnieniem 101 kPa. Ile wynosi SEM tego
ogniwa?
Elektrochemia – Ogniwa
V
136
,
0
E
Sn
/
Sn
o
2
Sn
2+
+ 2e Sn
V
195
,
0
c
log
2
0592
,
0
136
,
0
c
ln
F
2
RT
E
E
2
2
2
2
Sn
Sn
o
Sn
/
Sn
Sn
/
Sn
2H
+
+ 2e H
2
V
237
,
0
)
10
0
,
1
(
log
2
0592
,
0
c
log
2
0592
,
0
E
2
4
2
H
H
/
H
2
redukcja
utlenianie
Pt, H
2
H
+
Sn
2+
Sn
SEM = E
prawe
– E
lewe
= -0,195 – (-0,237) = + 0,042 V
Obliczamy potencjały półogniw
Schemat ogniwa:
utlenianie
redukcja
WYBRANE PROBLEMY OBLICZENIOWE
W CHEMII NIEORGANICZNEJ
Do 200 cm
3
10,00% roztworu HCl o gęstości 1,050 kg/dm
3
dodano 13,076 g metalicznego cynku. Obliczyć pH
otrzymanego roztworu. Założyć, ze cynk uległ
całkowitemu roztworzeniu.
M
Zn
= 65,38 M
HCl
= 36,46
Stechiometria np. roztwarzanie metali w kwasach
mola
,
,
,
cm
/
g
,
cm
5760
0
46
36
10
0
050
1
200
n
3
3
pocz
HCl
Obliczamy początkową liczność HCl i Zn:
masa
roztw.
masa HCl
mola
2000
,
0
38
,
65
076
,
13
n
pocz
Zn
Obliczamy liczność przereagowanego HCl:
Zn + 2HCl = ZnCl
2
+ H
2
1 : 2
mola
4000
,
0
2000
,
0
2
n
2
n
Zn
.
reak
HCl
Obliczamy końcową liczność, stężenie jonów H
+
(kwasu) i pH:
mola
1760
,
0
4000
,
0
5760
,
0
n
.
kon
HCl
3
H
dm
/
mol
8800
,
0
200
,
0
1760
,
0
c
0555
,
0
8800
,
0
log
pH
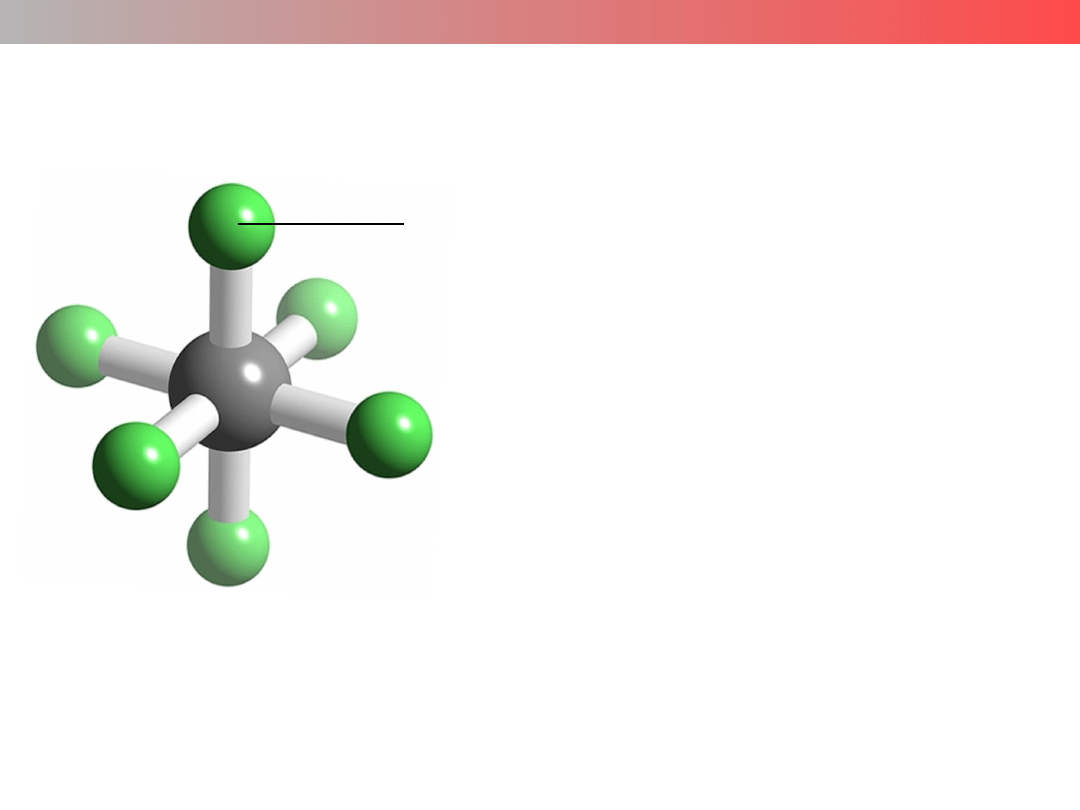
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
TEORIA POLA KRYSTALICZNEGO
w CHEMII KOORDYNACYJNEJ
M
L
L
L
L
L
L
Założenie: Ligandy traktuje się jedynie jako
punktowe, ujemne ładunki elektryczne
mające wpływ na energie orbitali d.
Teoria Pola Krystalicznego wyjaśnia m. in.:
– różnice w trwałości kompleksów
– barwy kompleksów
– właściwości magnetyczne kompleksów
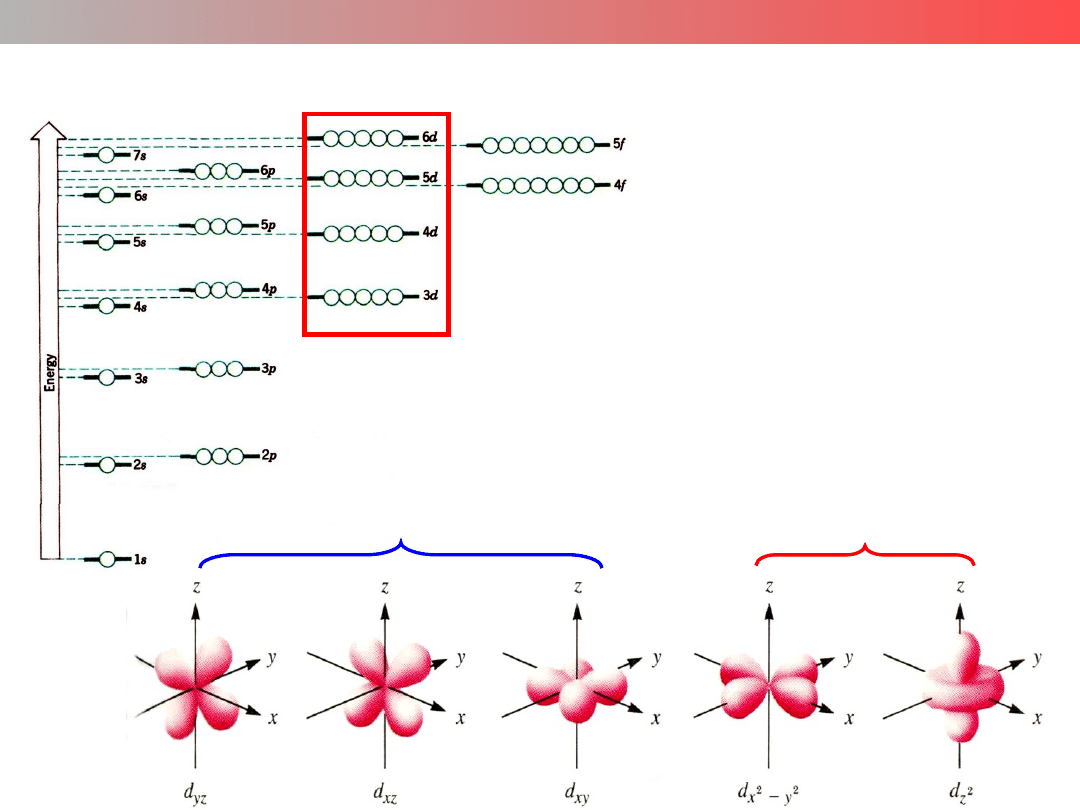
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
Diagram energetyczny orbitali atomowych
Metale przejściowe –
pierwiastki d-elektronowe
Orbitale
d
orbitale "leżą" na osiach
orbitale "leżą" pomiędzy osiami
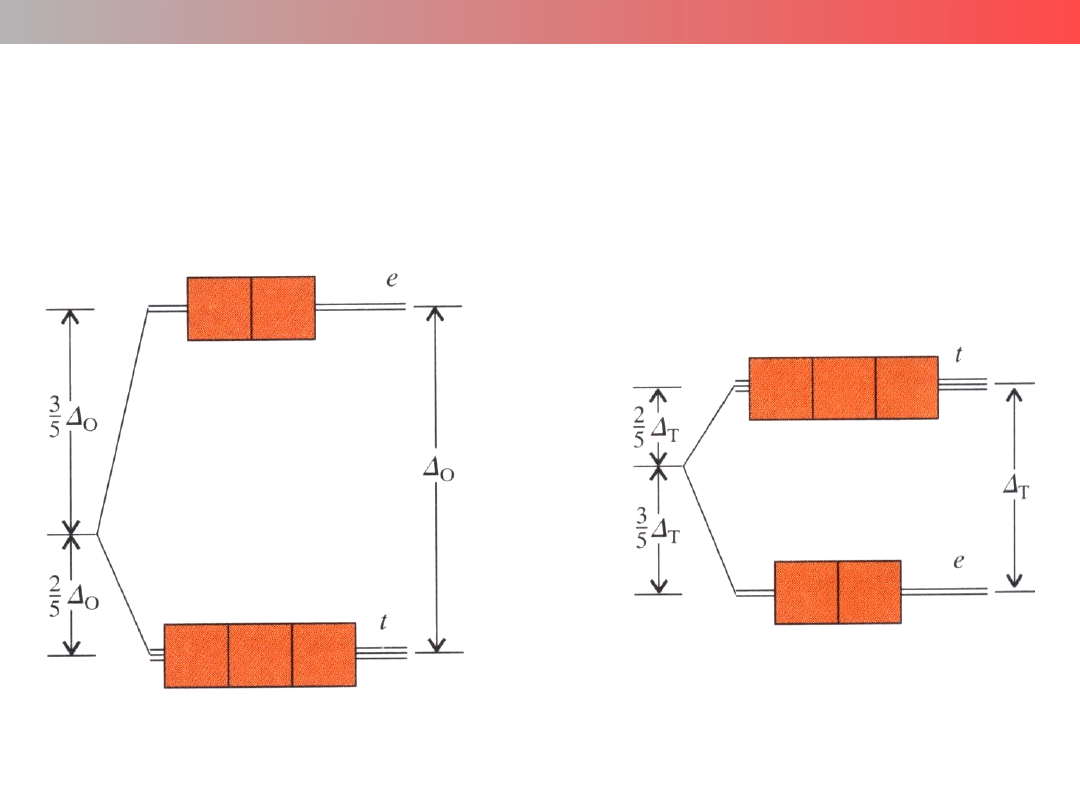
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
Orbitale d
w polu oktaedrycznym O
h
Orbitale d
w polu tetraedrycznym T
d
Δ
o
> Δ
t
Δ
o
≈ 9/4Δ
t
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
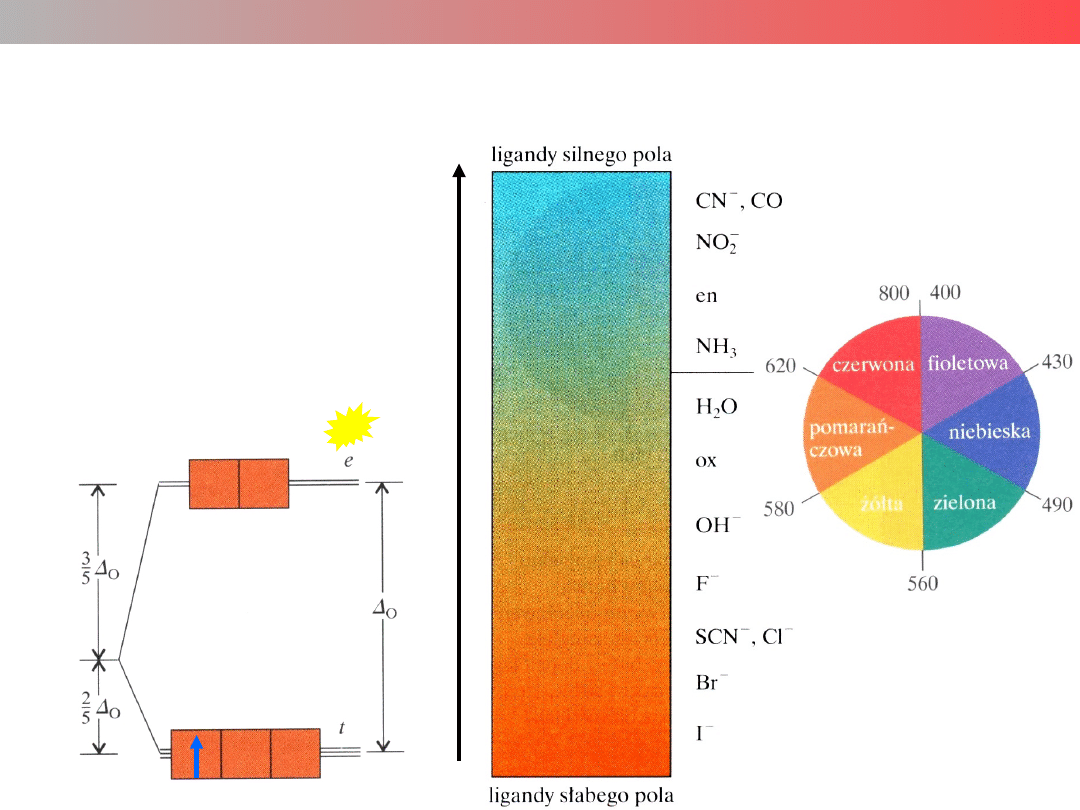
Szereg spektrochemiczny ligandów
Wielkość parametru Δ
zależy od rodzaju ligandów
Parametr Δ wyznacza się
poprzez pomiar wielkości
kwantów
absorbowanych podczas
przejścia elektronu z poziomu
t na poziom e (dla pola O
h
)
hν = Δ
o
ν
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
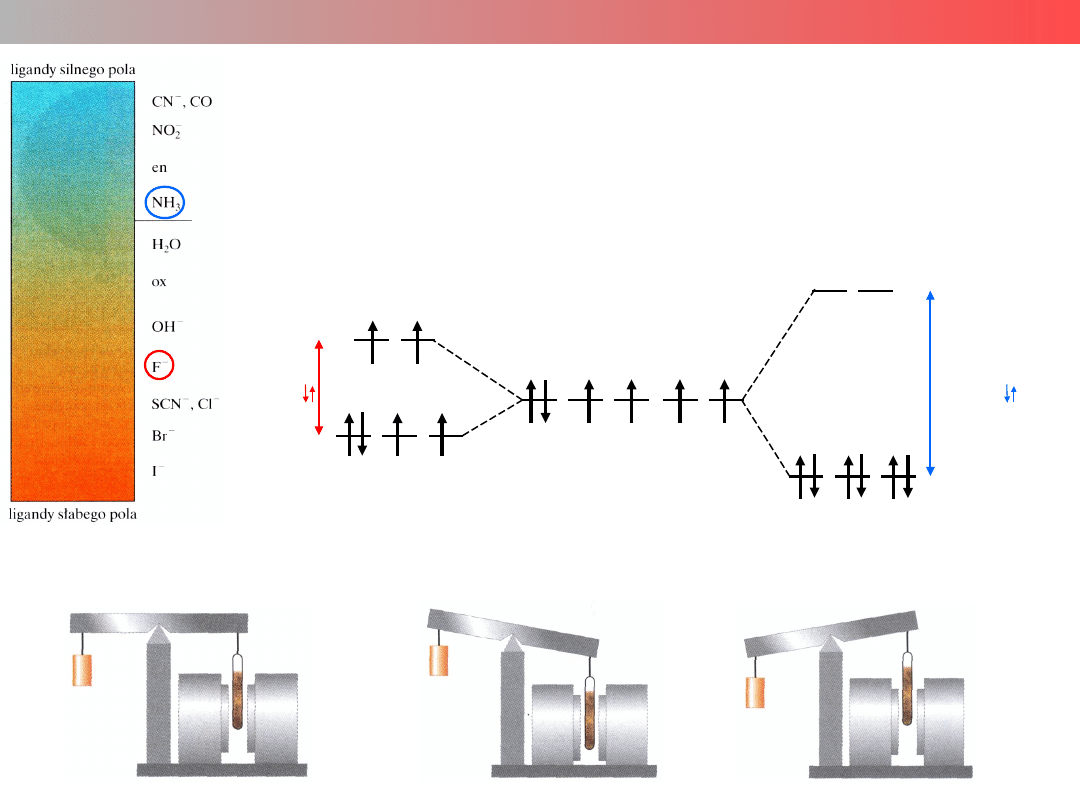
Kompleksy wysoko- i nisko-spinowe
Rodzaj ligandów (poprzez parametr Δ) ma wpływ na
obsadzenie elektronami rozszczepionych poziomów d, co
wywołuje różnice we właściwościach magnetycznych
kompleksów.
[CoF
6
]
3−
[Co(NH
3
)
6
]
3+
Co
3+
- d
6
S = 4·1/2 =
2
S =
0
Badanie właściwości magnetycznych substancji
paramagnetyk
diamagnetyk
brak pola mgt.
paramagnetyk
diamagnetyk
Δ<E
Δ>E
Wykład 9 – ZWIĄZKI KOMPLEKSOWE
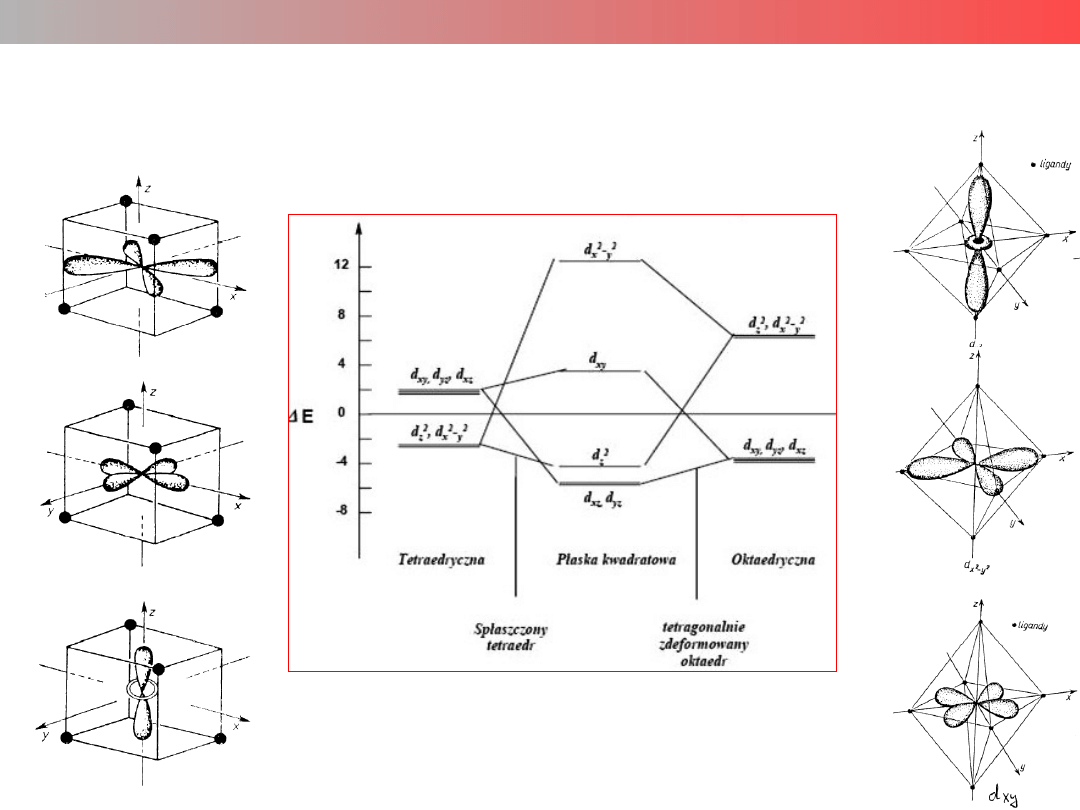
Rozkład energetyczny orbitali d w kompleksach o różnej symetyrii
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
09 4 Związki kompleksowe zadania do lekcji nr 1
EDG 09 wzory dokumentów komplet
download Zarządzanie Produkcja Archiwum w 09 pomiar pracy [ www potrzebujegotowki pl ]
09 AIDSid 7746 ppt
09 Architektura systemow rozproszonychid 8084 ppt
TOiZ 09
Wyklad 2 TM 07 03 09
09 Podstawy chirurgii onkologicznejid 7979 ppt
Wyklad 4 HP 2008 09
09 TERMOIZOLACJA SPOSOBY DOCIEPLEŃ
09 Nadciśnienie tętnicze
wyk1 09 materiał
KOMPLEKSY POLAKOW wykl 29 03 2012
Niewydolność krążenia 09
09 Tydzień zwykły, 09 środa
więcej podobnych podstron