
WISH and in situ hybridization to cells
In plant cells, the analysis of the gene
expression at the transcription level using
FISH is limited by the cell wall, which makes it
almost impossible for the probes to penetrate
the whole cell,
but just try to cut semithin section of the
pollen tube.
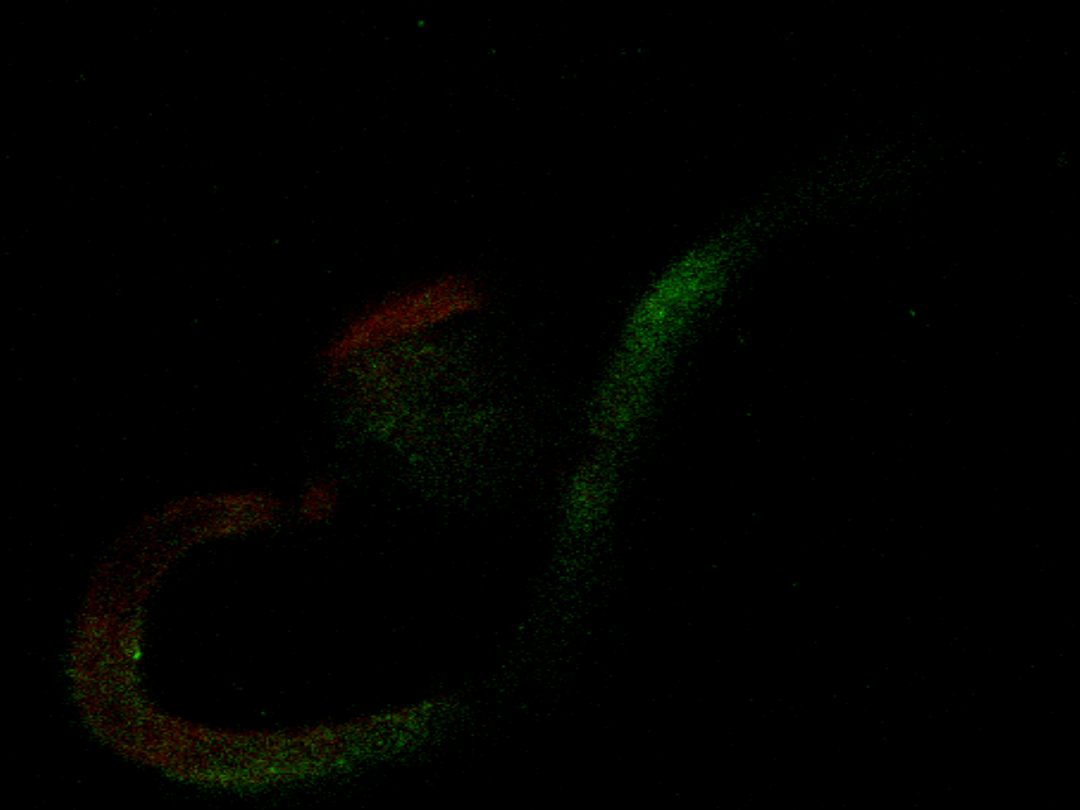
CRT mRNA in pollen grain and pollen tube
Some optical section only will be showed (of all 85)
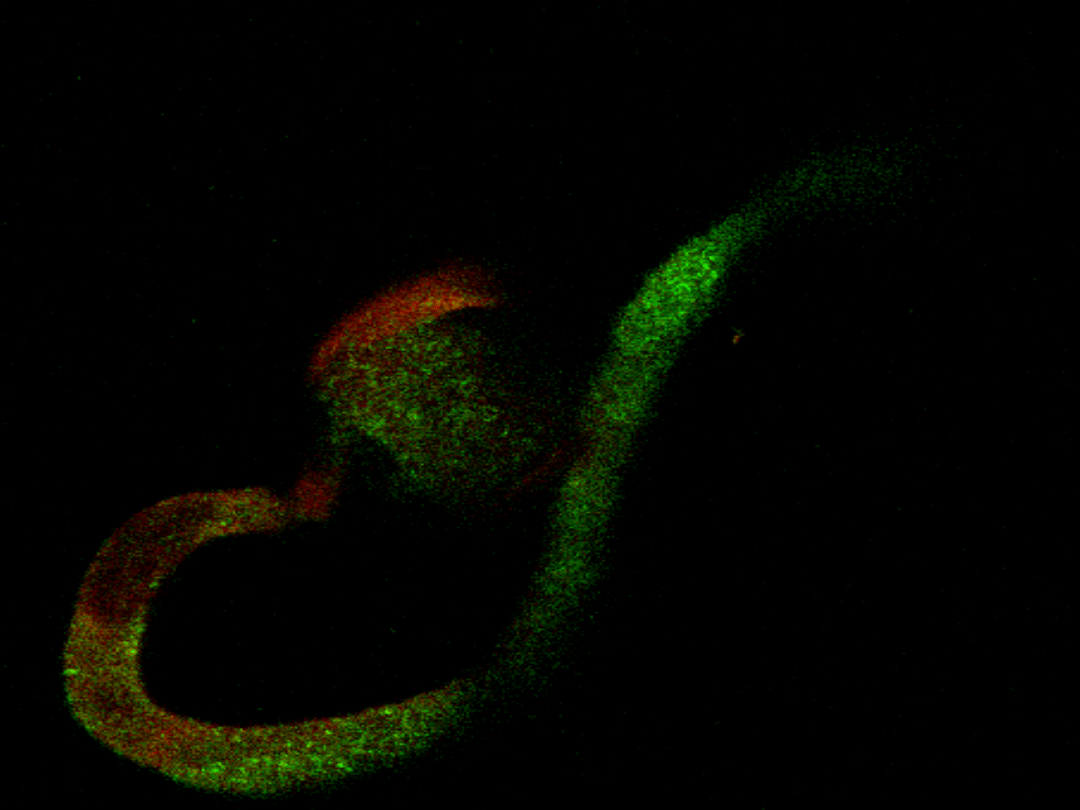
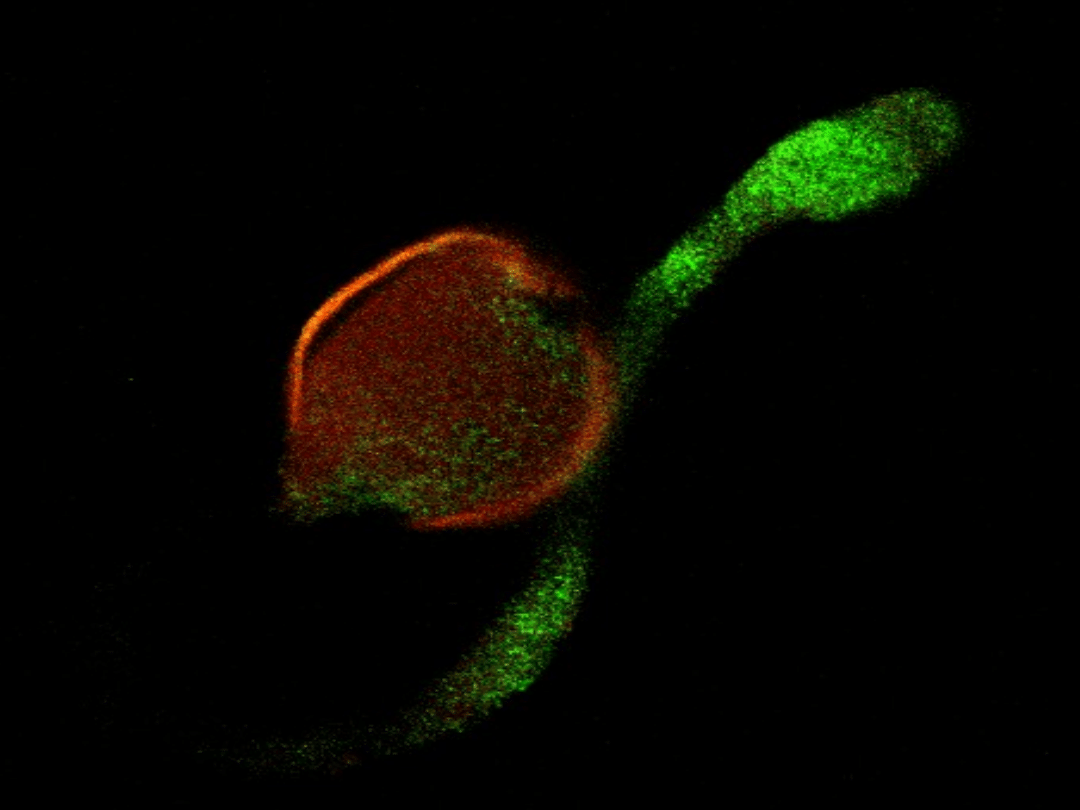
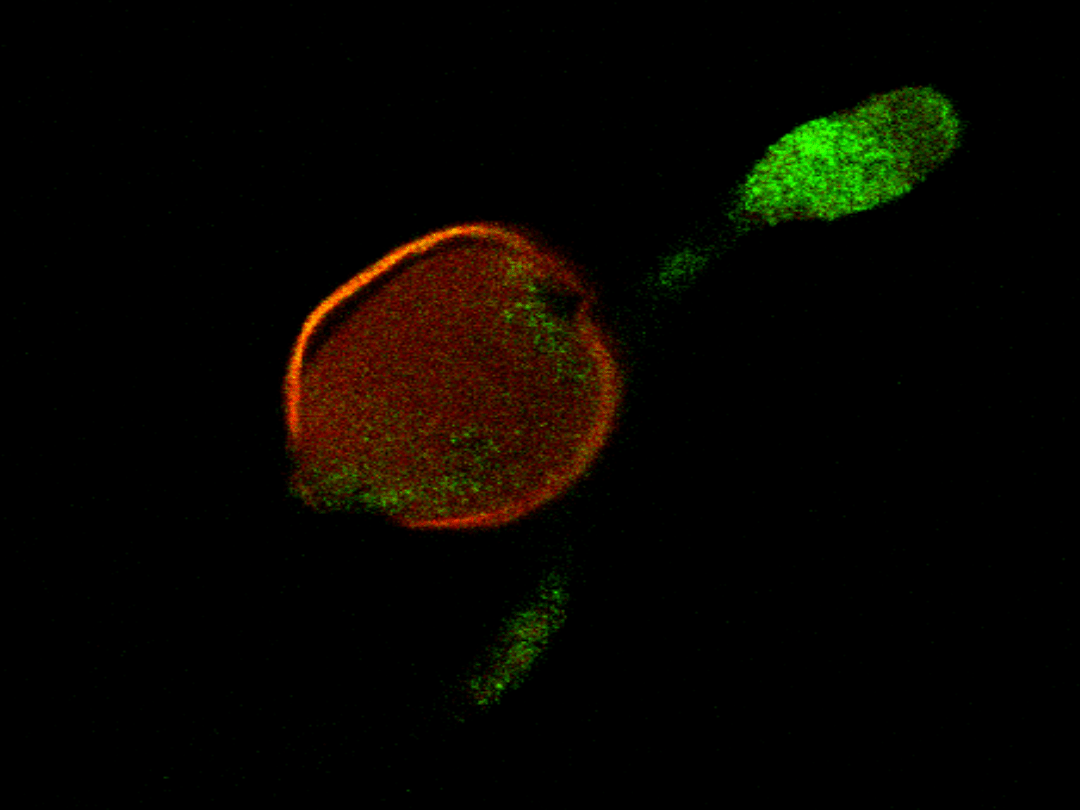
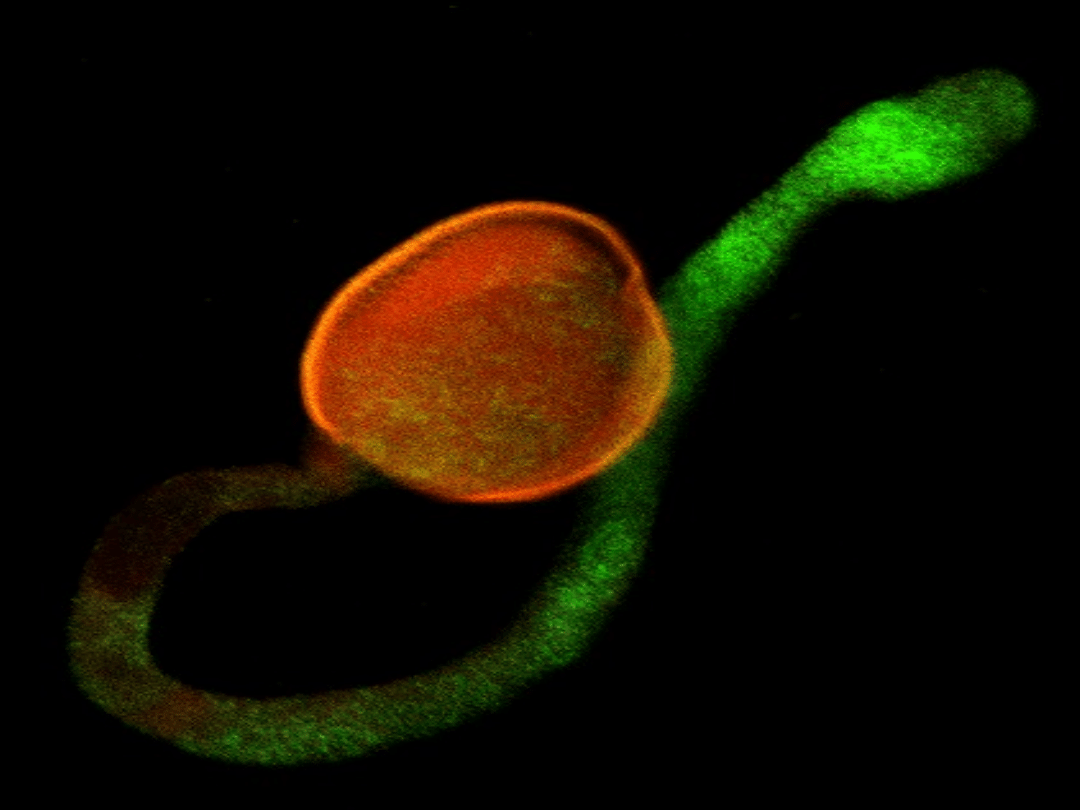
Image projection





18 S rRNA
18S
rDNA
18S rDNA
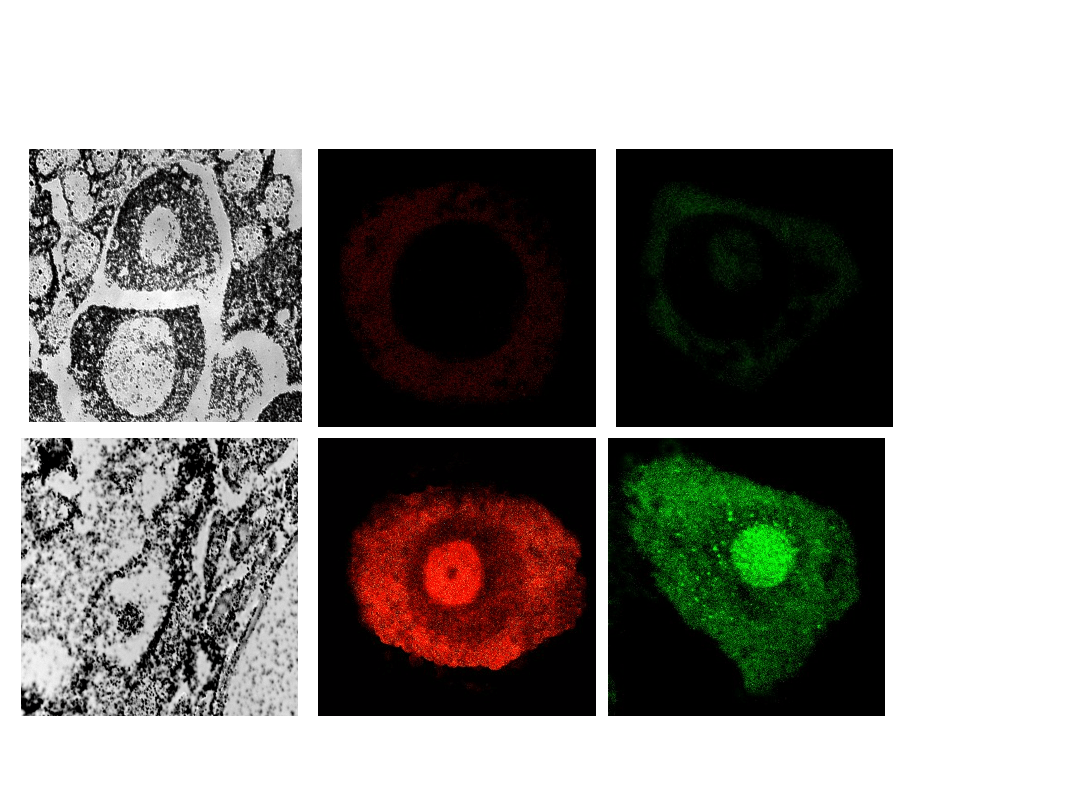
FISH on the sections
Whoole cell FISH –
enzymatic
digestion C+P, Triton X
100
18 S rRNA
18 S rRNA
Long 1200 nt
RNA probe
18S
rDNA
DNA oligo
probe 31 nt
Meiocytes
18 S rRNA
18S
rDNA
18S rDNA
18 S rRNA
18 S rRNA
18S
rDNA
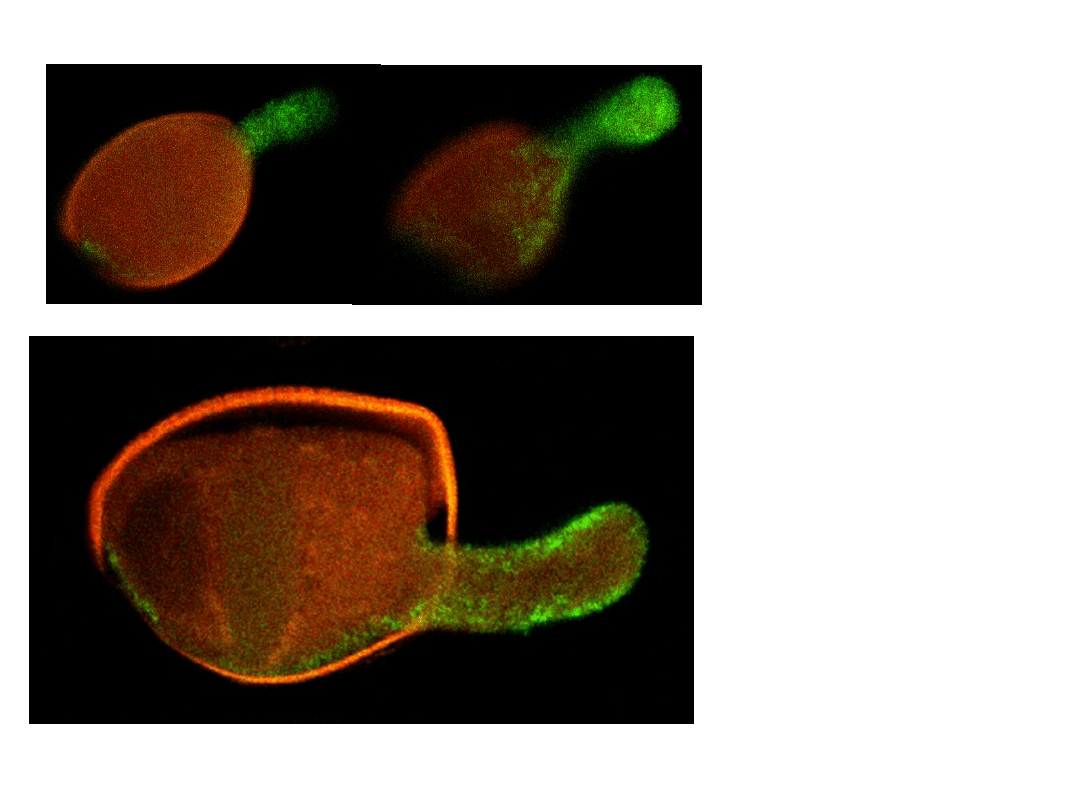
CRT mRNA
CRT mRNA
Long 1500 nt
RNA probe
DNA oligo
probe 30 nt

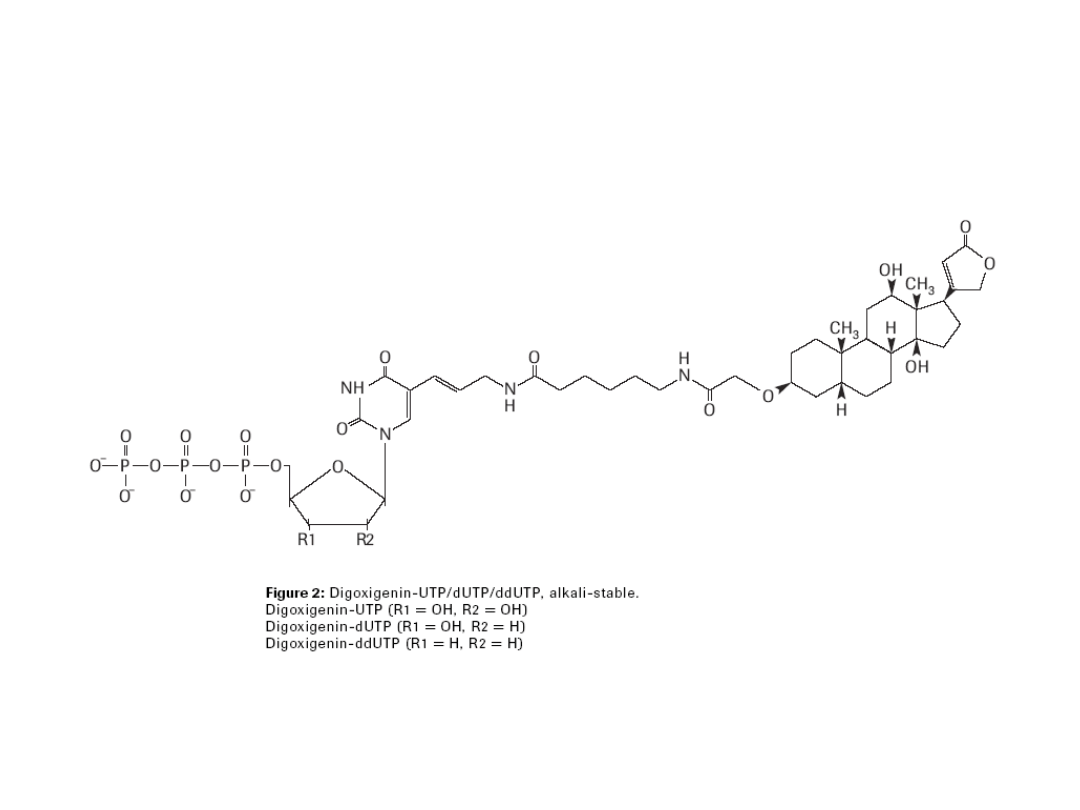
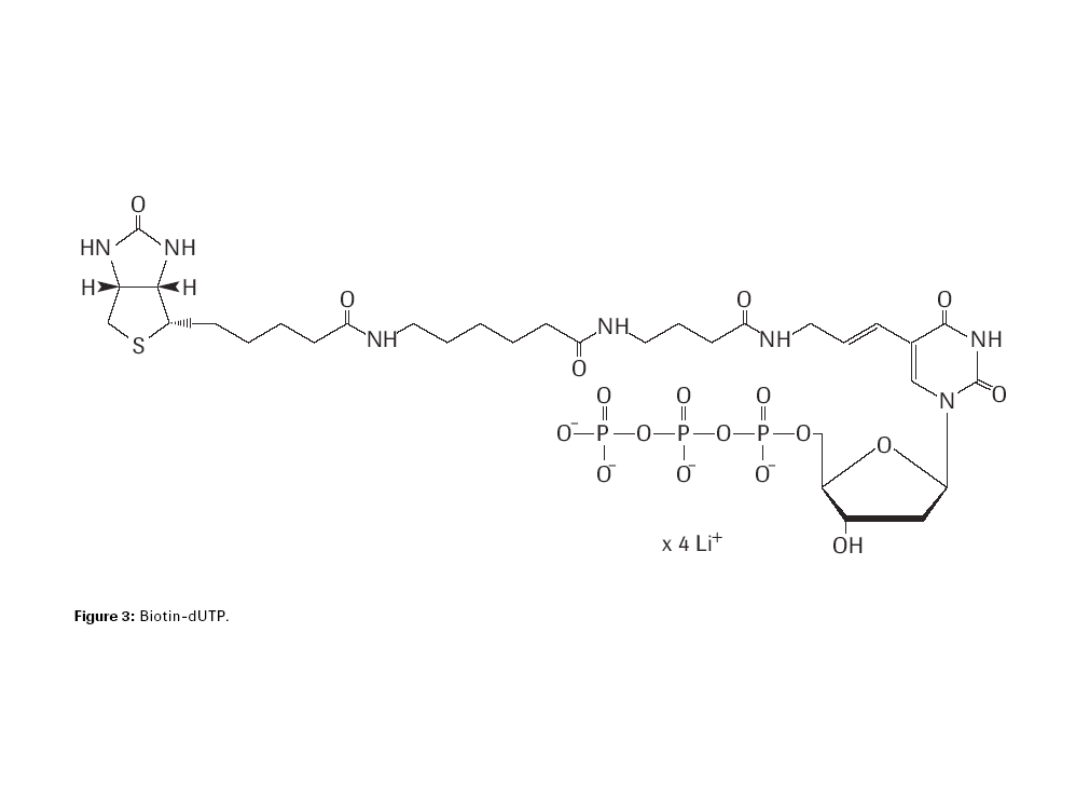
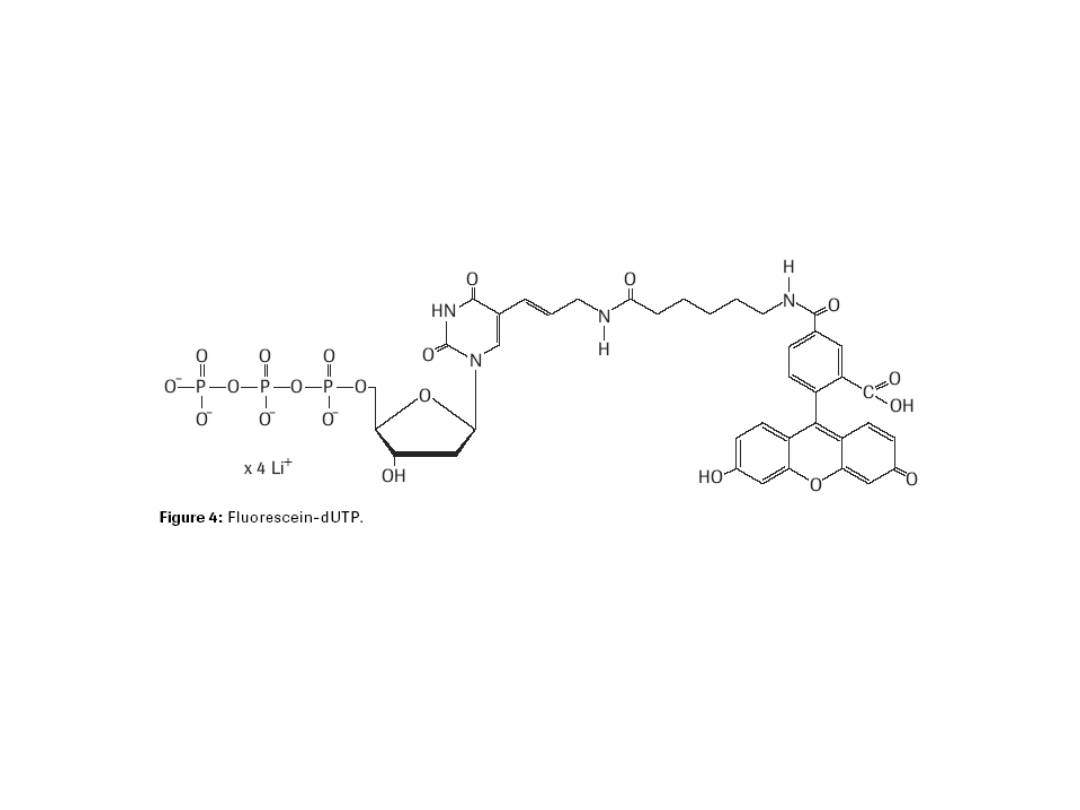
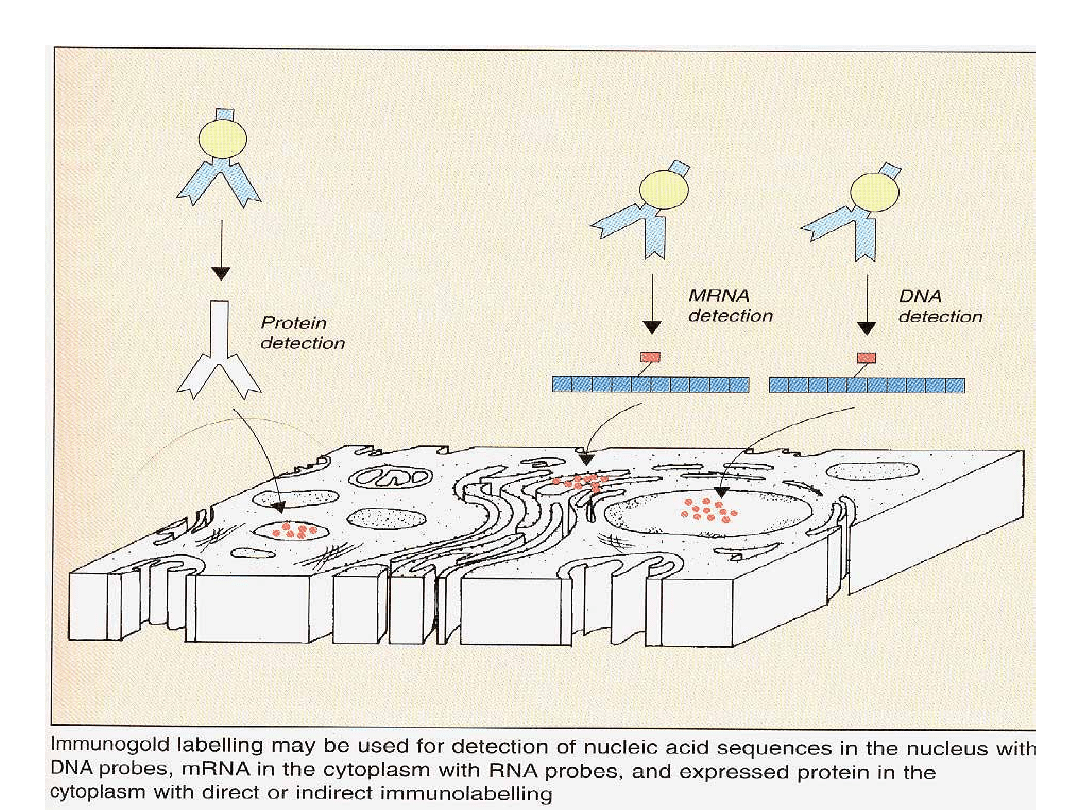
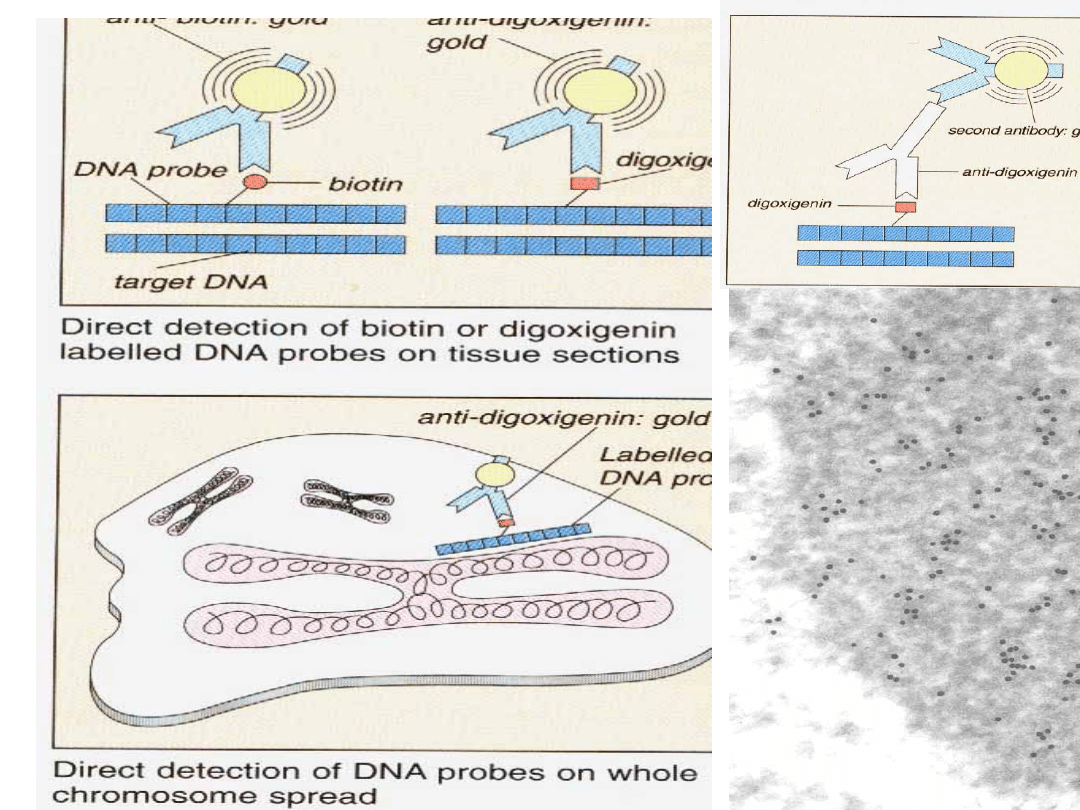

Techniką FISH można identyfikować kilka
różnych sekwencji DNA, stosując różne fluorochromy
emitujące fluorescencję o odmiennej długości fali.
In situ
i in vivo
detekcja of DNA
i RNA:
Inne metody in situ
takie jak np.
in situ nick translacja
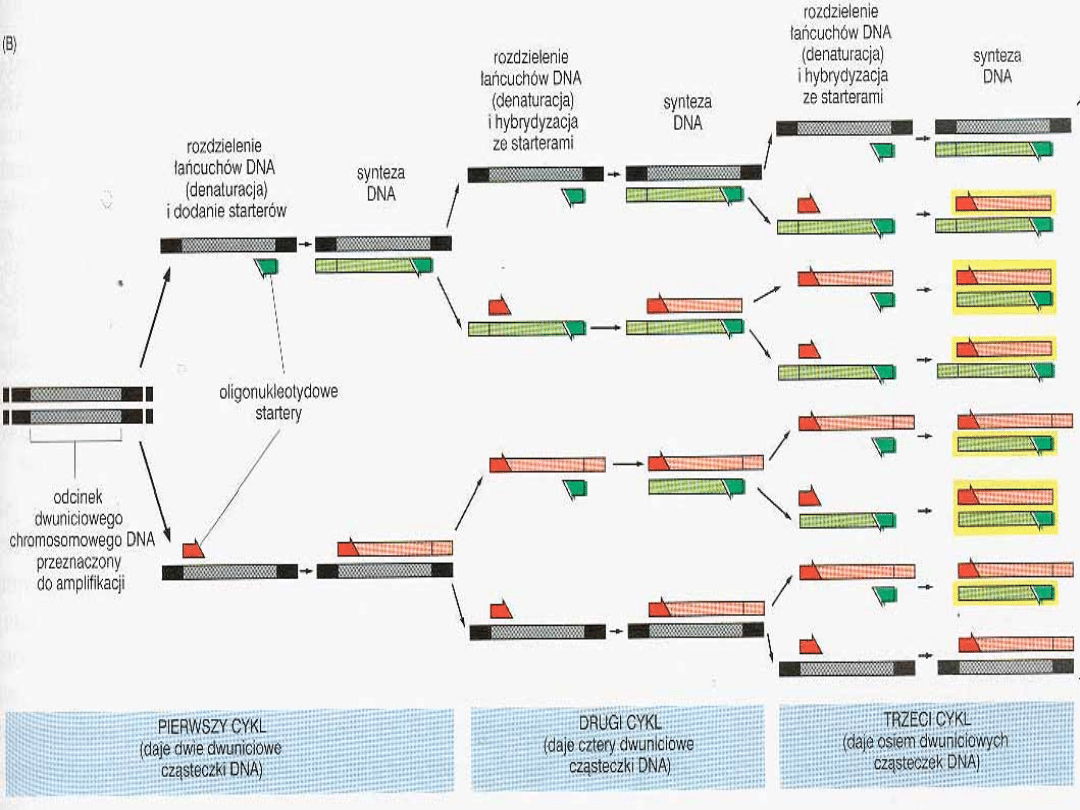
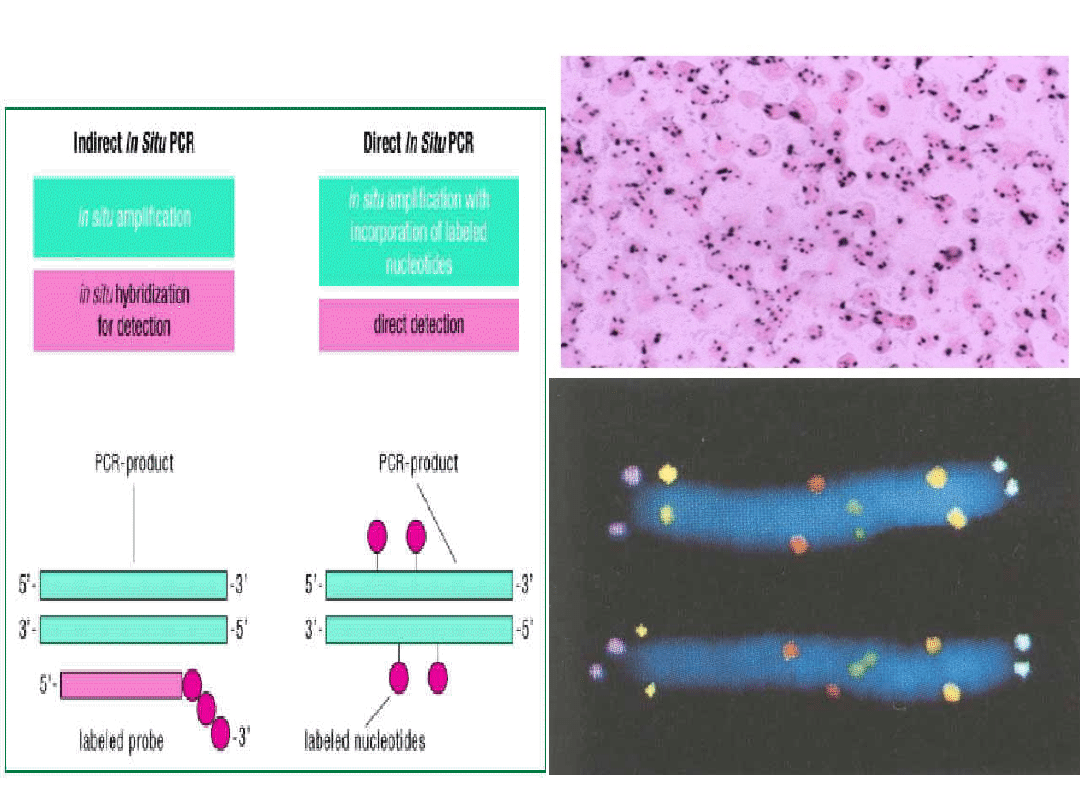
In situ PCR
i in situ RT PCR

Wykład:
Współczesne metody badań żywych komórek.
meduza Aequoria victoria
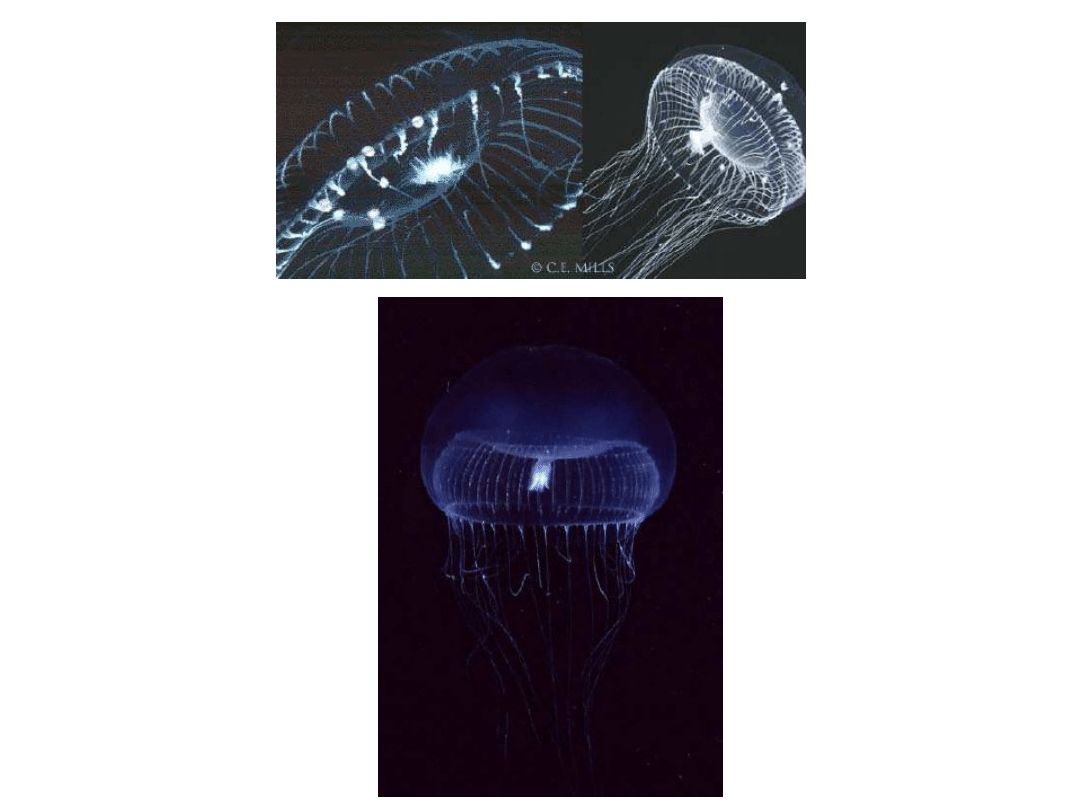

Białko (238 aminokwasów) zostało wyizolowane w latach 60-tych
Gen został sklonowany w 1992 roku

Białka GFP – green fluorescent protein
Białko o strukturze ß – can , w
kształcie cylindra
o średnicy 3 nm i długości 4 nm,
w jego wnętrzu jest struktura
α – heliks
,
natomiast w środku cylindra znajduje się
chlorofor
,
na końcu β-can są
helikalne segmenty
Odporne na denaturację
Mogą być przyłączane do innych białek dzięki
elastyczności końców
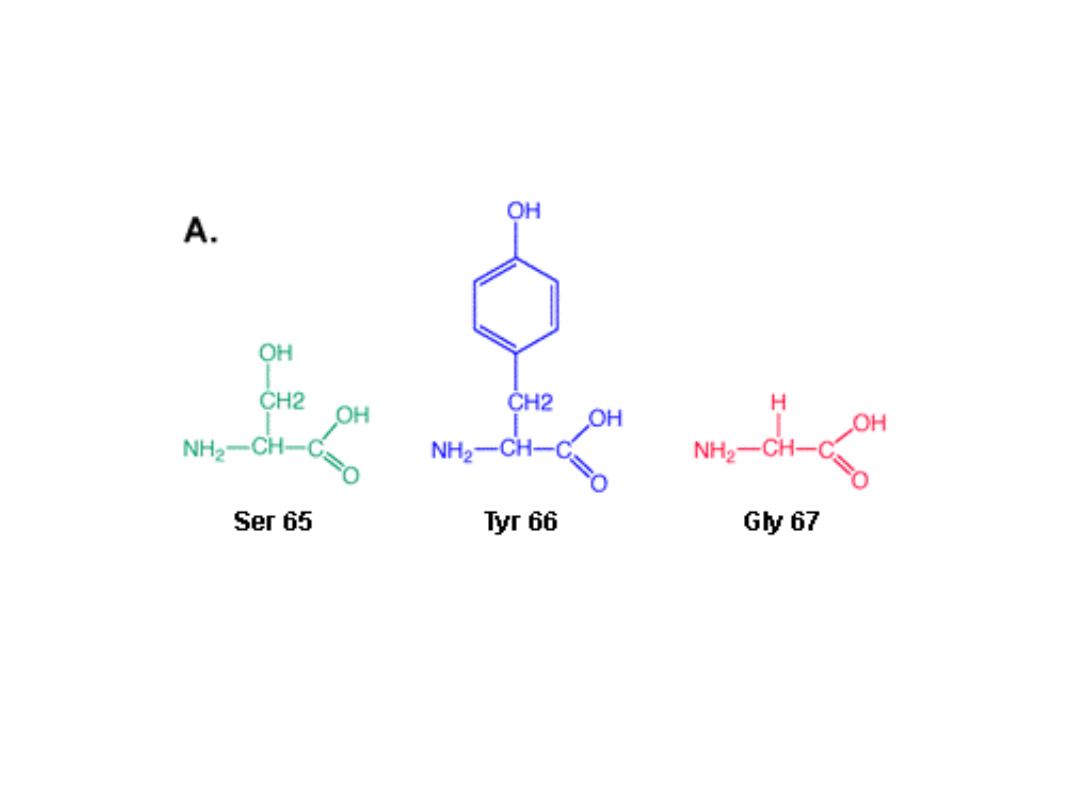
Białko GFP zbudowane jest z 238 aminokwasów,
z których trzy odgrywa zasadniczą rolę w fluorescencji.
Są to
Ser65, Tyr66 oraz Gly67
.
(Czasem seryna zastępowana jest podobną do niej
treoniną
).
Taki tripeptyd można by zapewne znaleźć
w sekwencji aminokwasowej wielu innych białek,
jednak żadne z nich nie wykazuje zdolności fluorescencyjnych!
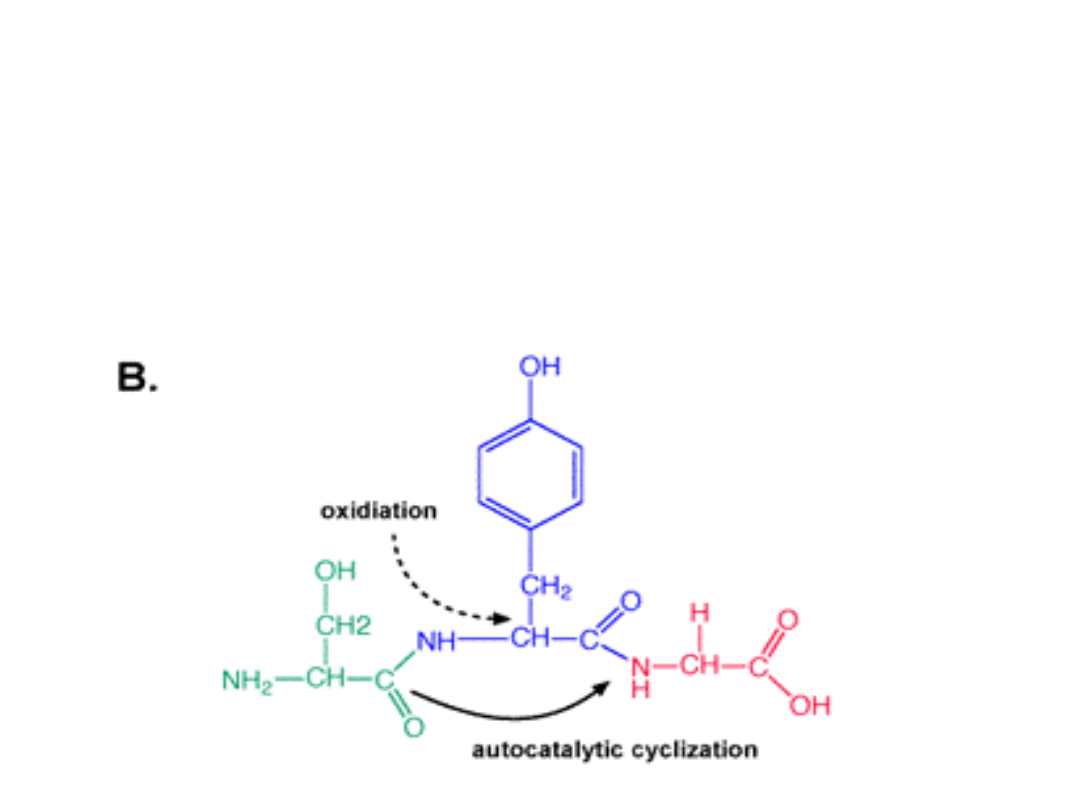
Wynika to z faktu, iż grupa chromoforowa GFP
(
Ser65- dehydroTyr66 – Gly67
) ulega cyklizacji.
Glicyna wiąże się z Seryną tworząc
zamknięty
pierścień
.
Następuje spontaniczna
dehydratacja
.
Tyrozyna dodatkowo zostaje poddana oksydacji.
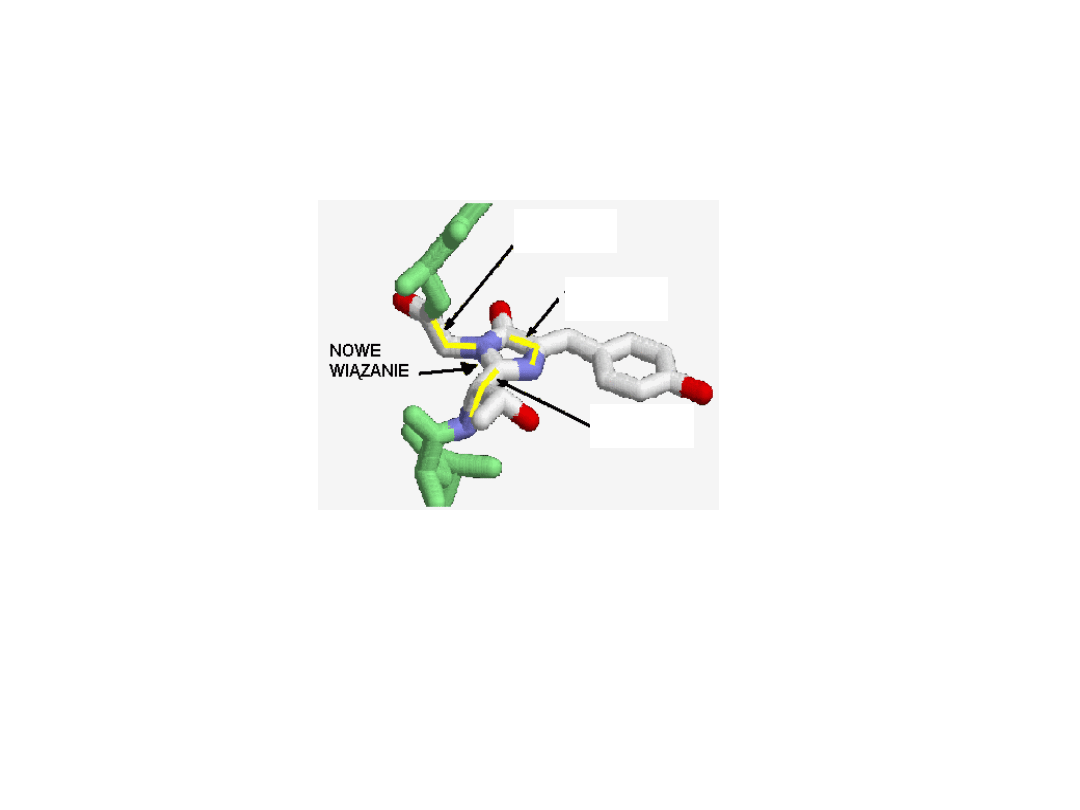
Tlen z otaczającego środowiska atakuje wiązania tworzone przez
tyrozynę i uformowane zostają podwójne wiązania tworzące
fluorescencyjny chromofor
.
Dzieje się to w trakcie
auotoaktywacji chromoforu
, która nie
wymaga obecności żadnych kofaktorów ani składników
enzymatycznych,
jest jednak wrażliwa na podwyższenie temperatury.
Najwolniejszym etapem aktywacji, decydującym o szybkości
całego procesu jest oksydacja tyrozyny trwa około 2 godzin.
Seryna
Tyrozyna
Glicyna

Użyteczne mutanty GFP
• Re-aranżacja genu kodującego GFP pod względem
preferowanych kodonów u ssaków, roślin itp. – ok. 20
krotny wzrost syntezy białek GFP u gospodarza
• GFP mutanty mogą wzbudzane do świecenia w różnych
długościach fali i fluoryzować w różnych kolorach:
daje to możliwość jednoczesnego badania kilku białek
w jednej komórce.
Niektóre mutanty GFP uzyskują znacznie szybszą
formacje fluorofory in tp dziki GFP.

Białko GFP wzbudzane jest światłem o dł. fali 395 – 475 nm
Służą do znakowania białek, a tym samym do
ich zobaczenia w mikroskopie fluorescencyjnym
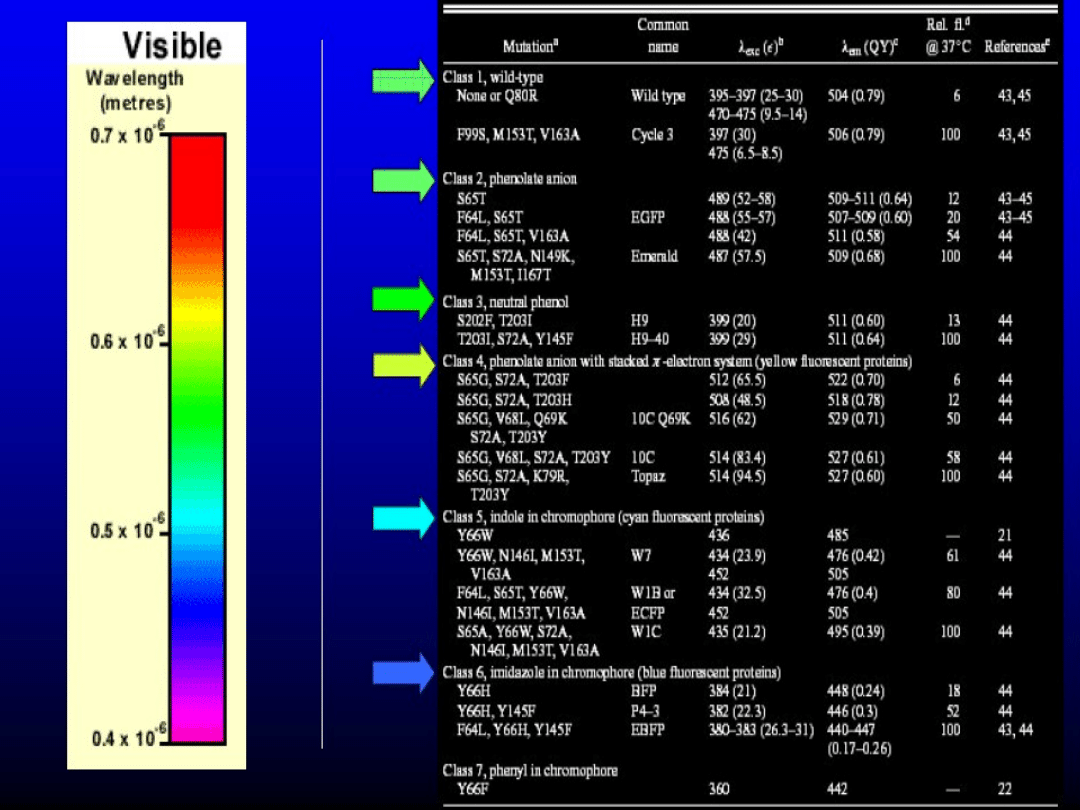
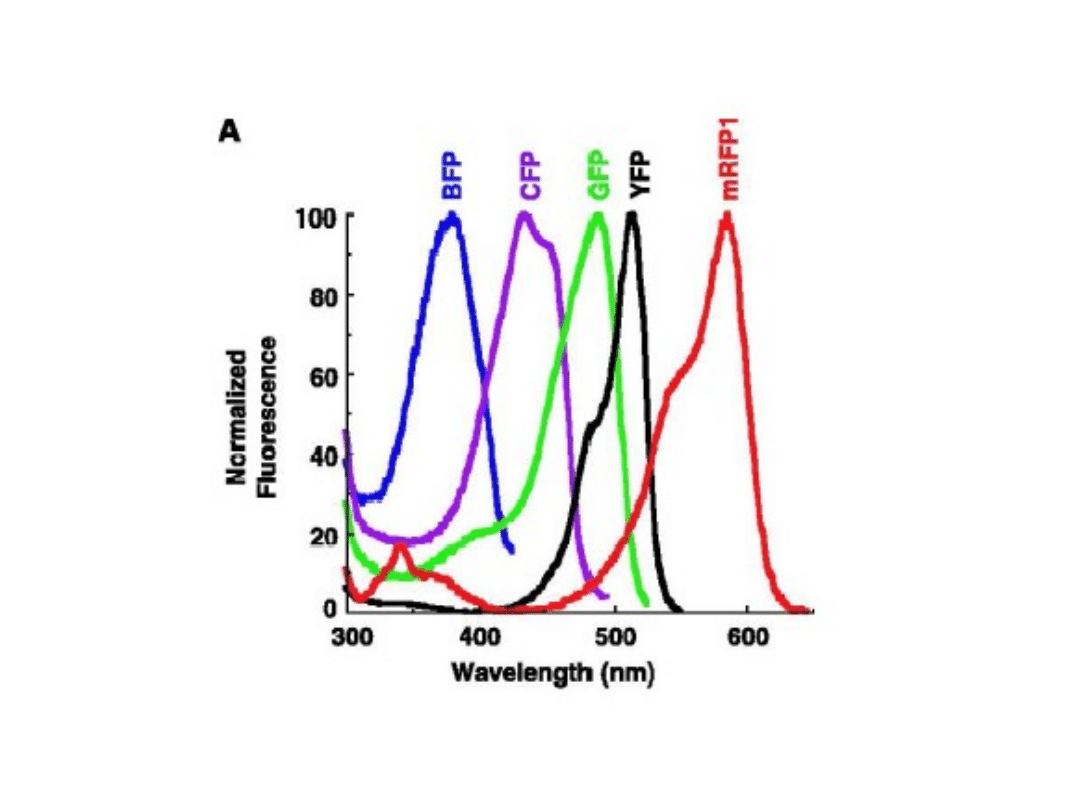

Gen GFP został wyizolowany
i stał się powszechnie używanym
narzędziem w biologii molekularnej.
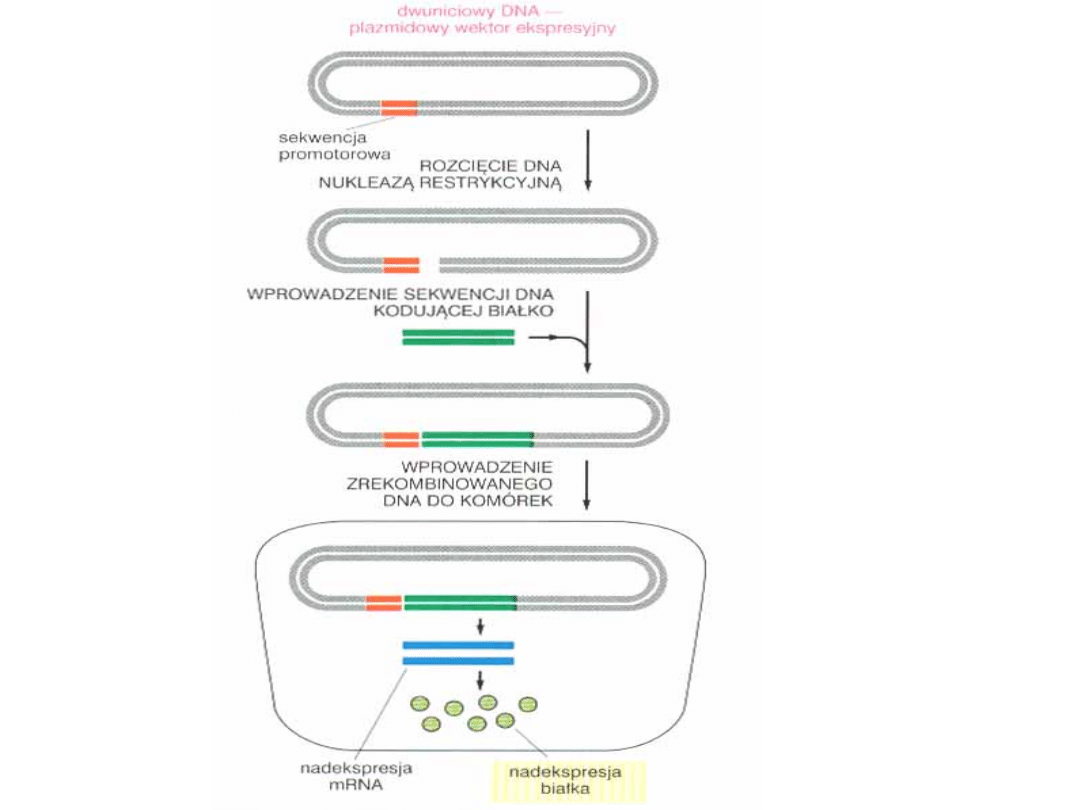

Problemy związane z nadekspresją białek GFP i białek fuzyjnych:
- toksyczność nadekspresji
- poziom endogennego białka, a białka fuzyjnego,
co właściwie badamy?
Cook i wsp. 2004
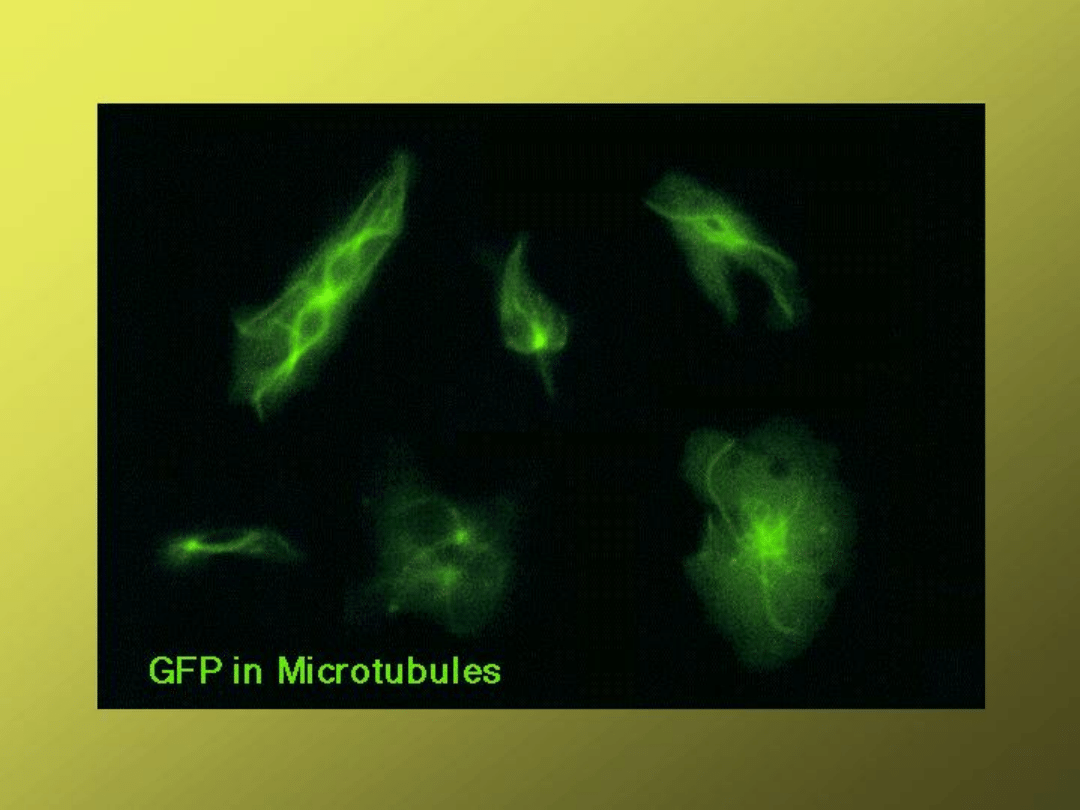
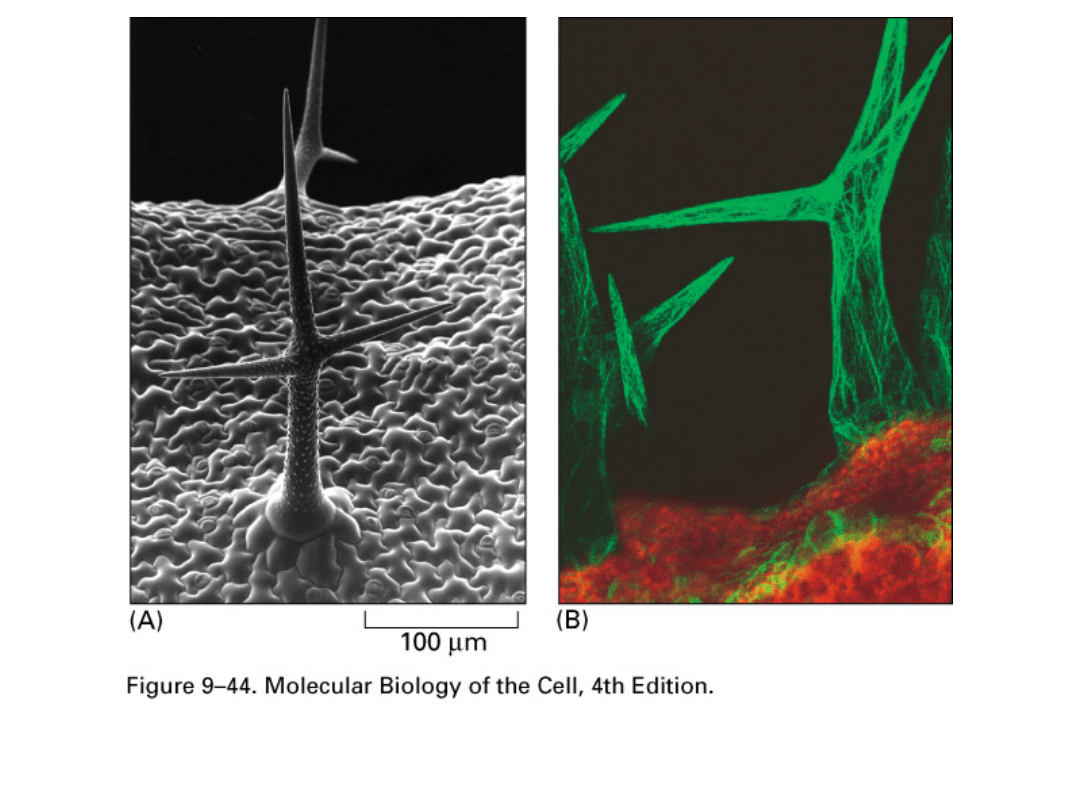
GFP fluorescence tagging (B) of actin in Arabidopsis
trichomes (hairs on upper leaf surfaces; SEM shown in
A).
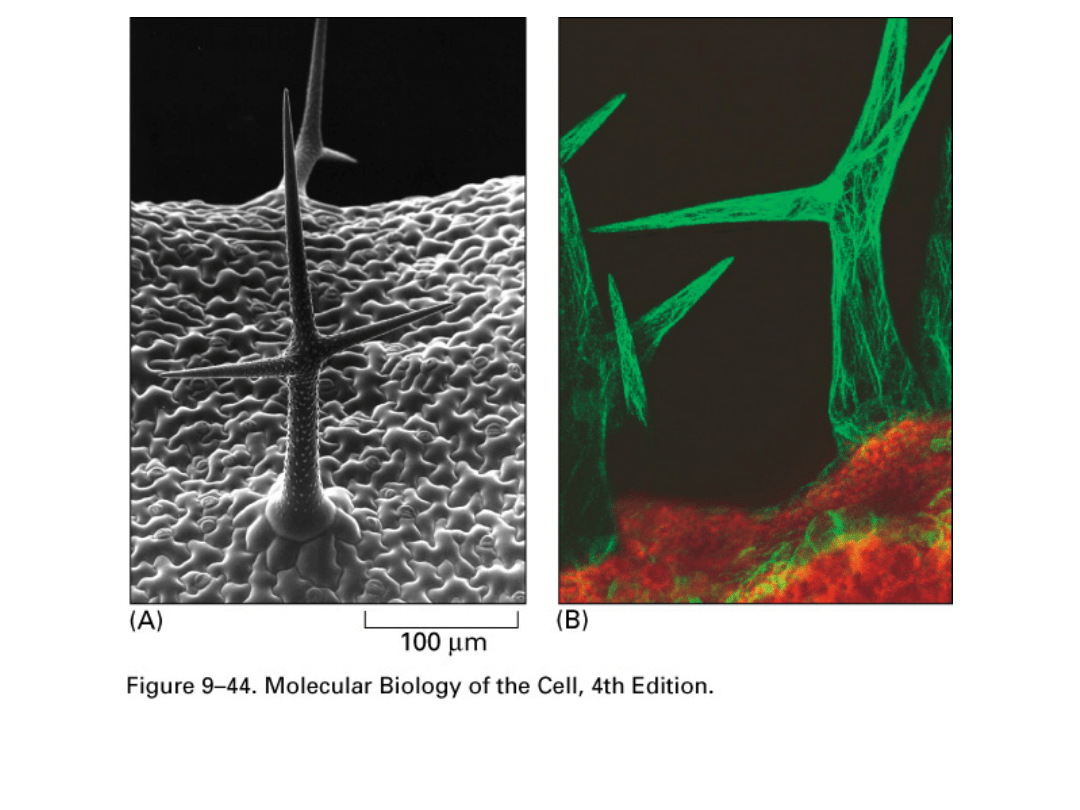
GFP fluorescence tagging (B) of actin in Arabidopsis
trichomes (hairs on upper leaf surfaces; SEM shown in
A).

Królik albinos „Alba”
2000 rok we Francji
Biały z różowymi oczami
488 nm
509 nm

Fuzja małych ciał z większymi
Oddzielenie od większych ciał dwóch
mniejszych
Interakcje pomiędzy dwoma ciałami
Ruchy ciał jądrowych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
Wyszukiwarka
Podobne podstrony:
Biol kom cz 1
Biol kom cz 6
Biol kom cz੠2
Biol kom cz 5
Biol kom cz 2
Biol kom cz 1
Biol mol kom cz 3
Sp asp proc kom cz VII 2010
Test biol kom, biologia komórki(3)
BIOL.KOM pytania chyba Witaliński, biologia uj, biologia II, biologia komorki, egz
Biol KOM zaliczenie
Organella Biol Kom
Kult uwar kom cz VIII 2010
Kult uwar kom cz II 2010
biol kom wyklad 2103, Chemia środków bioaktywnych (umcs), BIOLOGIA KOMÓRKI
Kultura a kom cz I 2010
Biol KOM zaliczenie id 87300
Pare pytań z egzaminu na biol kom
biol kom pyt 11
więcej podobnych podstron