
Węglowodory –
charakterystyka alkanów

Węglowodory są najprostszą pod względem
budowy grupą związków organicznych, których
cząsteczki zawierają wyłącznie atomy węgla i
wodoru.
Są to związki z którymi mamy praktycznie do
czynienia codziennie. Weglowodorami są:
•paliwa (benzyna, olej napędowy)
•gaz spalany w kuchenkach gazowych
•gaz w butlach gazowych
•parafina z której zrobione są świece
•acetylen wykorzystywany do spawania i cięcia
metali
•itp.

Węglowodory ze względu na budowę szkieletu
węglowego dzielimy na;
•węglowodory łańcuchowe
•węglowodory cykliczne
Węglowodory łańcuchowe mogą mieć łańcuchy proste
lub rozgałęzione o czym wspomniano wcześniej.
Łańcuchy węglowe mogą być:
•nasycone tzn. atomy węgla połączone są tylko za
pomocą wiązań pojedynczych (-C-C-)
•nienasycone tzn. atomy węgla połączone są za
pomocą wiązań podwójnych (-C=C-) lub potrójnych.
Wiązania wielokrotne (podwójne i potrójne) mogą
występować w różnych ilościach.
Budowa cząsteczek alkanów.
Węglowodory nasycone są to związki, w których
między atomami węgla występują wyłącznie
wiązania pojedyncze. Węglowodory nasycone
nazwano alkanami.
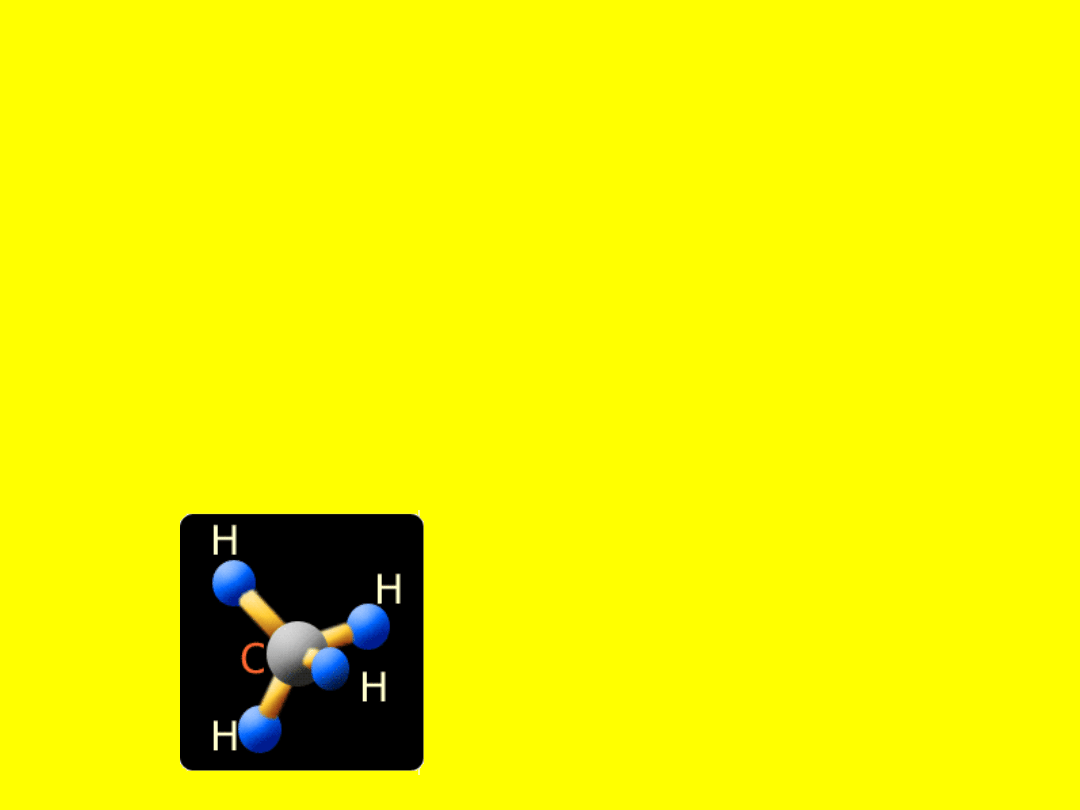
Najprostszym alkanem jest metan CH
4
. Cząsteczka
metanu składa się z jednego atomu węgla i czterech
atomów wodoru. W cząsteczce każdy z czterech
atomów wodoru połączony jest z atomem węgla
wiązaniem kowalencyjnym, to znaczy poprzez
wspólną parę elektronową.
Model cząsteczki
metanu

Metan występuje wszędzie tam, gdzie następuje
rozkład substancji organicznych bez dostępu tlenu,
a więc w błocie, bagnach jeziorach.
Kolejnym węglowodorem zawierającym dwa atomy
węgla jest etan C
2
H
6
. Podobnie jak w metanie
również w cząsteczce etanu wszystkie wiązania są
wiązaniami kowalencyjnymi, tj. wiązanie węgiel-
węgiel i wiązanie węgiel-wodór.
Model cząsteczki etanu

Szereg
homologiczny
Związki chemiczne należące do tej samej grupy
klasyfikacyjnej, różniące się między sobą o stałą
grupę atomów (dla alkanów jest nią grupa -CH
2
-) lub
jej wielokrotność, tworzą szereg homologiczny.
Poszczególne człony tego szeregu nazywamy
homologami.
Etan, propan, butan i wyższe węglowodory nasycone
są homologami metanu i należą do jednego szeregu
homologicznego.
Poszczególne związki szeregu homologicznego
wykazują podobne właściwości chemiczne, a różnią
się właściwościami fizycznymi, np. stanem skupienia.
Alkany to węglowodory nasycone o ogólnym wzorze
C
n
H
2n+2

Szereg homologiczny alkanów.
Wzór alkanu
Nazwa alkanu
Stan skupienia
CH
4
metan
gaz
C
2
H
6
etan
gaz
C
3
H
8
propan
gaz
C
4
H
10
butan
gaz
C
5
H
12
pentan
ciecz
C
6
H
14
heksan
ciecz
C
7
H
16
heptan
ciecz
C
8
H
18
oktan
ciecz
C
9
H
20
nonan
ciecz
C
10
H
22
dekan
ciecz
C
16
HH
34
heksadekan
ciało
stałe

Otrzymywanie alkanów
Dla celów przemysłowych alkany uzyskuje się z
ropy naftowej lecz istnieje również wiele metod ich
syntezy.
Metodą syntezy możemy otrzymać różne alkany,
dobierając odpowiednie warunki i stosują
odpowiedni katalizator:
nC + (n+1) H
2
C
n
H
2n+2
Inna metodą jest otrzymywanie tych związków z
gazu wodnego
nCO + (2n+1) H
2
C
n
H
2n+2
+ nH
2
O

Właściwości fizyczne alkanów
Właściwości fizyczne alkanów są różne.
Właściwości fizyczne alkanów są zależne od liczby
atomów węgla w cząsteczce. Alkany posiadające:
•od 1 do 4 atomów węgla - są gazami (gaz ziemny)
•od 5 do 17 atomów węgla - są cieczami (benzyny)
•więcej jak 18 atomów węgla - są ciałami stałymi
(parafina)
Niektóre właściwości alkanów zmieniają się
stopniowo, np. stopniowo rośnie temperatura
wrzenia i gęstość.
Wszystkie alkany są nierozpuszczalne w wodzie,
natomiast dobrze w rozpuszczalnikach
organicznych. Dobrze się palą, dlatego
wykorzystywane są jako paliwa.

Spalanie
alkanów
Wszystkie alkany są substancjami palnymi dlatego
maja one znaczenie jako surowce energetyczne. W
zależności od warunków mogą one ulegać
całkowitemu lub częściowemu spalaniu.
Przykład: spalanie metanu (reakcja z tlenem z
powietrza)
CH
4
+ 2O
2
--> CO
2
+ 2H
2
O
Przy niedostatecznym dostępie powietrza produktem
reakcji jest tlenek węgla (czad) - CO - sina trucizna.
2CH
4
+ 3O
2
--> 2CO + 4H
2
O
lub
CH
4
+ O
2
--> C + 2H
2
O
Podobnie spalają się pozostałe alkany.

Chemiczne właściwości
alkanów.
Alkany mają trwałe wiązania przez co mają one małą
aktywność. Tej właściwości chemicznej zawdzięczają
używaną nazwę parafiny. Pochodzi ona od słów
parum affinis, co oznacza mało aktywny. Są one
odporne na działanie kwasów, zasad czy utleniaczy i
reduktorów. Reagują jedynie z fluorowcami a proces
ten zachodzi dopiero po naświetleniu mieszaniny
światłem o dużej energii.
CH
4
+ Cl
2
--> CH
3
Cl + HCl
CH
3
Cl + Cl
2
--> CH
2
Cl
2
+ HCl
Reakcję chemiczną, w której atom wodoru w
cząsteczce jest zastąpiony innym atomem lub grupą
atomów nazywamy reakcją
podstawienia
(substytucji).

Reakcja ta prowadzi do powstania nowych
produktów zwanych fluorowcoalkanami
(halogenoalkanami).
Halogenoalkany to pochodne alkanów, w których
atom (atomy) wodoru został podstawiony atomem
fluorowca (halogenem).
Podobnie jak alkany są nierozpuszczalne w wodzie,
same zaś są doskonałymi rozpuszczalnikami farb ,
tłuszczów i lakierów. W przeciwieństwie do
alkanów są aktywne chemicznie
Document Outline
Wyszukiwarka
Podobne podstrony:
WYKLAD5.DOC, Nitrowanie węglowodorów alifatycznych (alkanów)
Nanorurki węglowe charakterystyka i zastosowanie w medycynie
Klasa II, Zasady żywienia - Podział na grupy produktów spożywszych i ich charakterystyka, PRODUKTY Z
OTRZYMYWANIE I CHARAKTERYSTYKA NANOKOMPOZYTÓW POLIMEROWYCH PBT NANORURKI WĘGLOWE
Węglowodory alifatyczne charakterystyka
7 Biomateriały charakterystyka; bioceramiczne i weglowe
9 Ch organiczna WĘGLOWODANY
charakterystyka kuchni słowackiej
Najbardziej charakterystyczne odchylenia od stanu prawidłowego w badaniu
Charakterystyka rozwoju motorycznego
W08 Patofizjologia zaburzeń gospodarki węglowodanowej
Kryteria charakteryzujące czystość uszlachetnionego pierza gęsiego i kaczego
Charakterystyka programu
charakterystyka kuchni ukraińskiej
Węglowodory analityka
Zarządzanie Kryzysowe charakterystyka powiatu czluchowskiego
więcej podobnych podstron