
CHEMIA
CHEMIA
ORGANICZNA
ORGANICZNA
Dr Jolanta
Dr Jolanta
Piekut
Piekut
Podział węglowodorów
Podział węglowodorów

J. Bryłka, R. Świsłocka, W. Lewandowski, „Repetytorium z chemii
nieorganicznej i organicznej”, Wydawnictwa Politechniki
Białostockiej, Białystok 2002 (podręcznik).
Hart Harold: Chemia organiczna - krótki kurs. 2006
Białecka-Florjańczyk Ewa: Chemia organiczna / Ewa Białecka-
Florjańczyk, Joanna Włostowska. 2005
Marzec Halina: Chemia organiczna : przewodnik do ćwiczeń dla
kierunków przyrodniczych. 2005
McMurry John: Chemia organiczna.
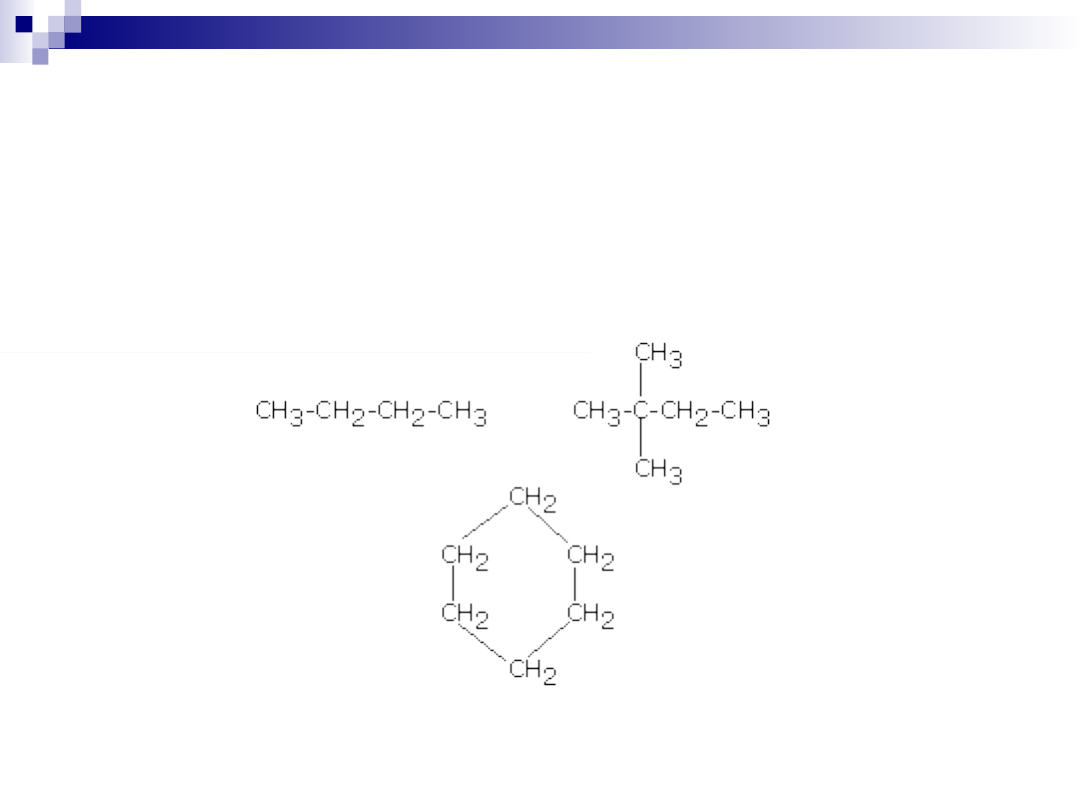
Podstawowym pierwiastkiem w połączeniach organicznych jest
węgiel. Atomy węgla posiadają zdolność łączenia się pomiędzy sobą
w nawet bardzo długie łańcuchy. Te z kolei mogą być proste lub
rozgałęzione, a poza tym łańcuch może ulec zamknięciu tworząc
pierścień.
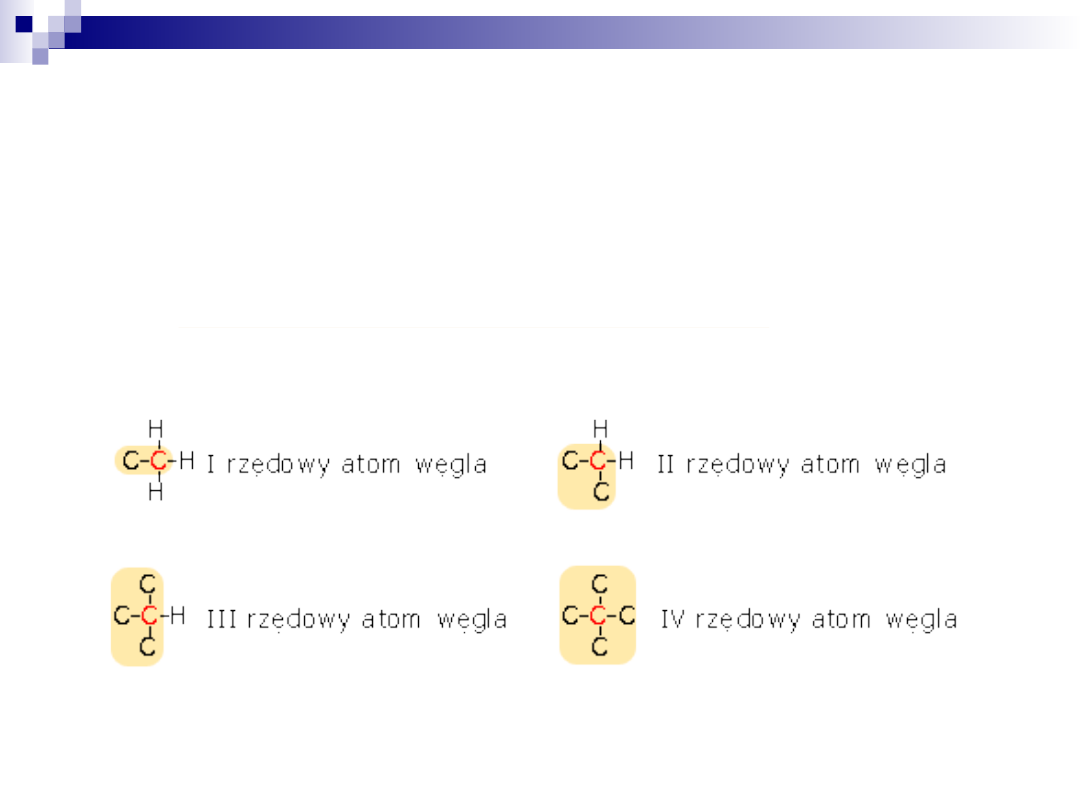
Ze zdolnością łączenia się atomów węgla pomiędzy sobą
wiąże się zagadnienie rzędowości atomu węgla.
•atom węgla połączony tylko z jednym atomem węgla określa się
jako węgiel pierwszorzędowy
•połączony z dwoma atomami węgla - drugorzędowy
•połączony z trzema atomami węgla jako trzeciorzędowy
•atom węgla połączony z czterema atomami węgla nosi nazwę
czwartorzędowego
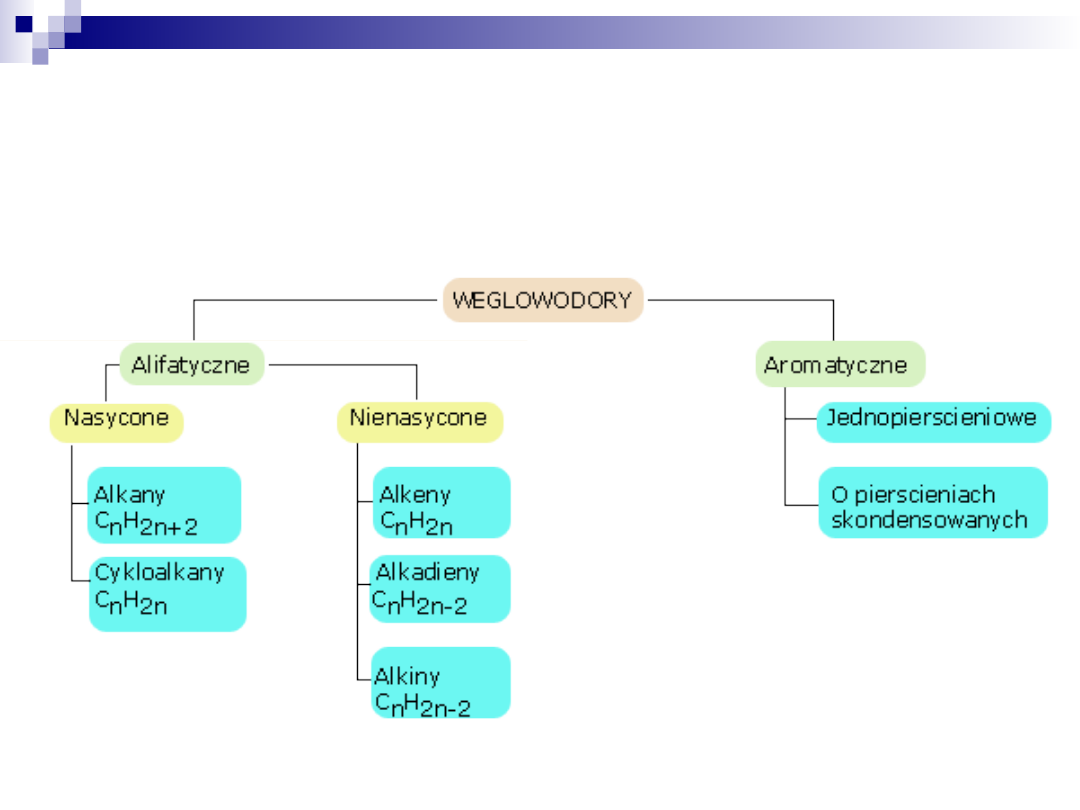
Podstawową grupą połączeń organicznych są związki zbudowane z
atomów węgla i wodoru, nazywane węglowodorami.
Węglowodory ze względu na budowę szkieletu węglowego dzielimy
na dwie główne klasy: węglowodory alifatyczne i węglowodory
aromatyczne. Węglowodory alifatyczne z kolei dzielą się na alkany,
alkeny, alkiny oraz ich analogi pierścieniowe (cykloalkany itd.)
Same węglowodory są substancjami macierzystymi wszystkich
związków organicznych, które nazywane są pochodnymi
węglowodorów.
Pochodne są to związki, powstałe wskutek podstawienia
pojedynczych atomów wodoru przez inne atomy lub grupy atomów,
które noszą nazwę podstawników. Przykład - CH
3
COOH jest pochodną
CH
4
(metan). Jeden atom wodoru w CH
4
został podstawiony grupą
atomów (-COOH).
Inne przykłady:C
2
H
5
Cl, C
3
H
7
OH, C
4
H
9
NO
2
, C
2
H
5
CHO, itd.
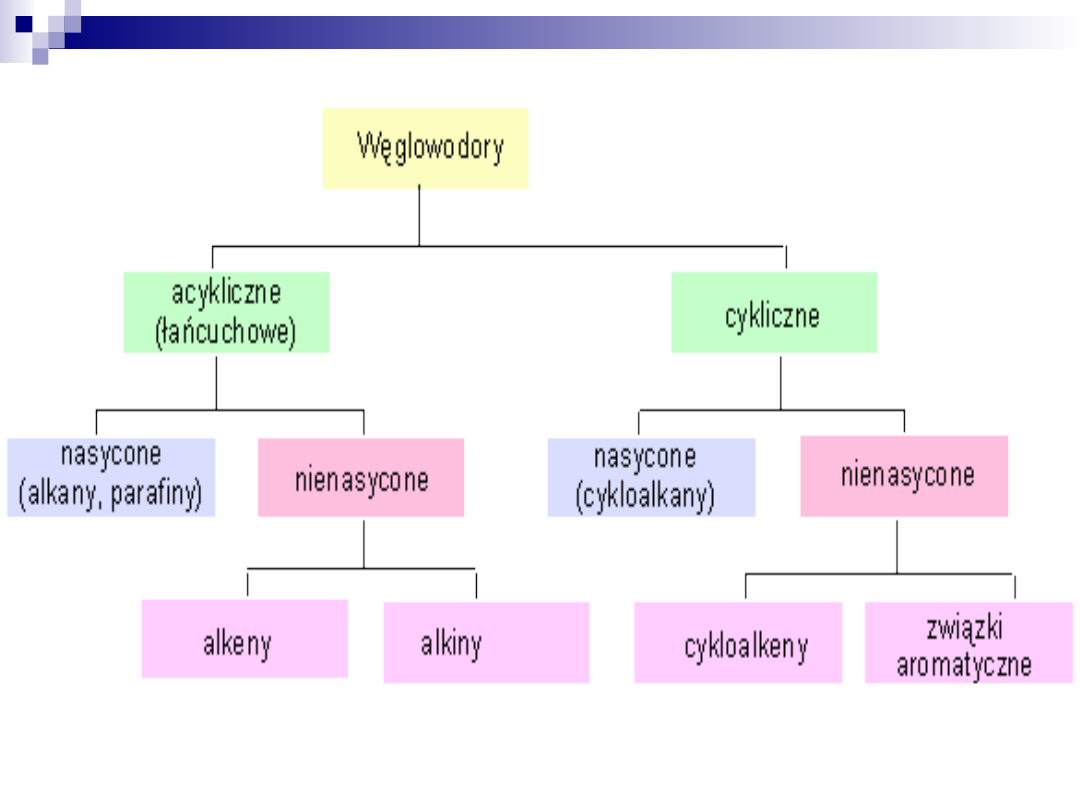
Węglowodory alifatyczne, mogą łączyć
się ze sobą tworząc;
•struktury łańcuchowe
•struktury cykliczne
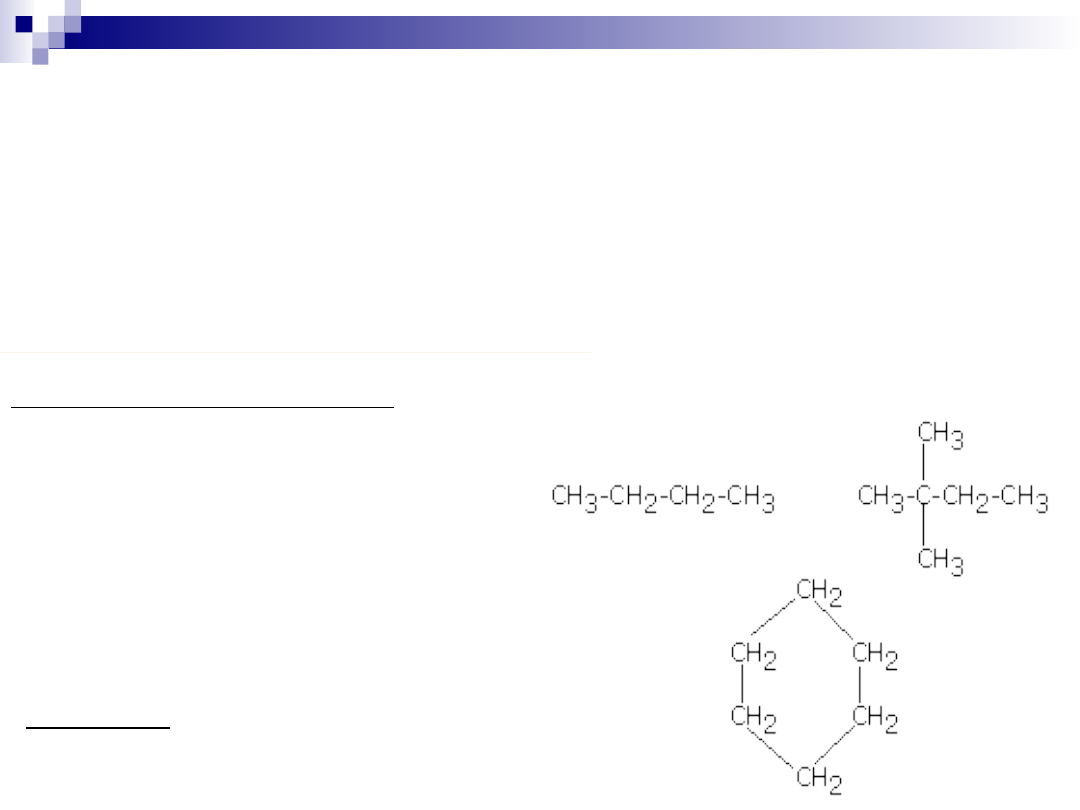
Węglowodory posiadające struktury
łańcuchowe mogą mieć łańcuchy
proste lub rozgałęzione a te z kolei
mogą być:
•nasycone tzn. atomy węgla połączone
są tylko za pomocą wiązań
pojedynczych (-C-C-).
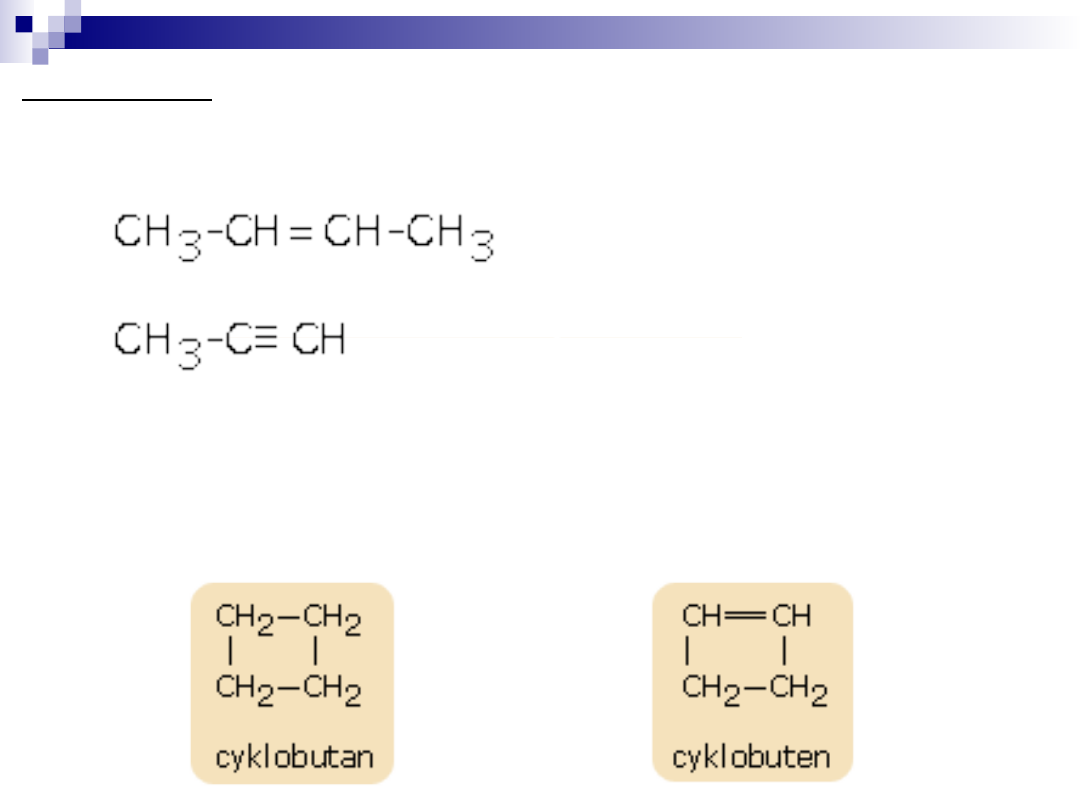
nienasycone tzn. atomy węgla połączone są za pomocą wiązań
podwójnych
(-C=C-) lub potrójnych. Wiązania wielokrotne (podwójne i
potrójne) mogą występować w różnych ilościach.
Przy dwóch wiązaniach podwójnych wyróżnia się układy:
•układ skumulowany C=C=C
•układ sprzężony C=C-C=C
•układ izolowany C=C-C-C-C=C
Połączenia cykliczne mogą być trój-, cztero-, pięcio-, sześcio-, ....
wieloczłonowe, np.:
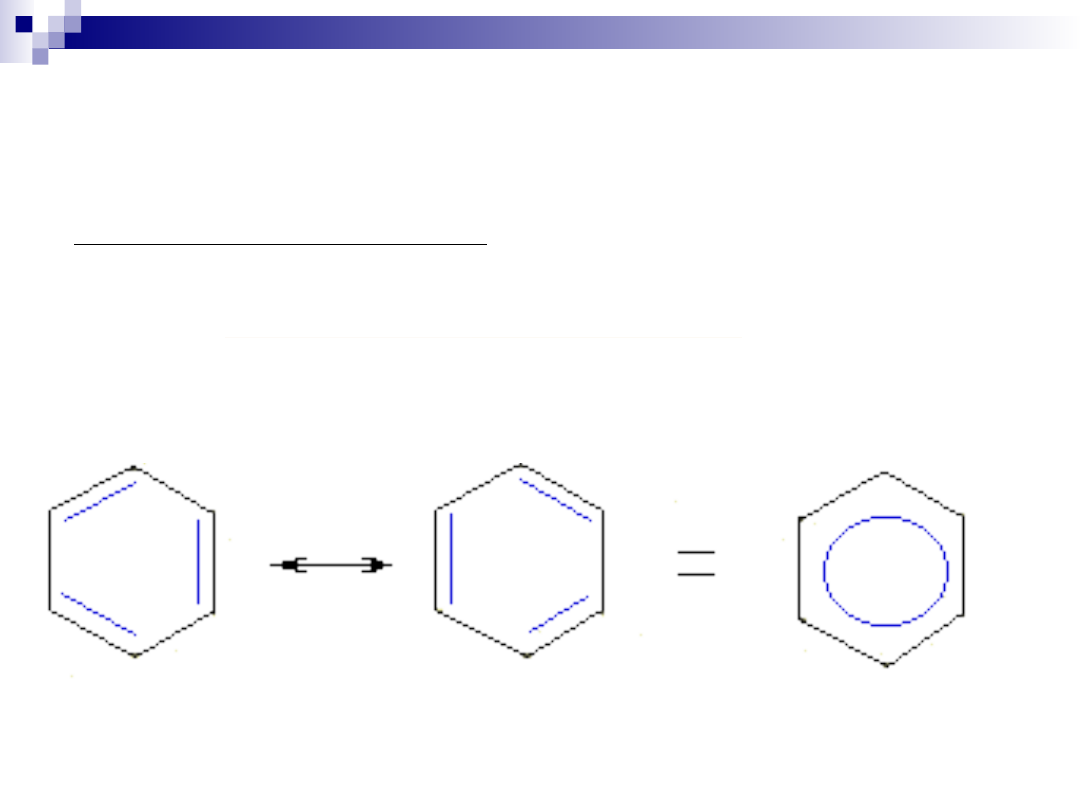
Węglowodory aromatyczne
Wśród połączeń cyklicznych wyróżnia się połączenia
aromatyczne o specyficznym układzie wiązań podwójnych,
sprzężonych.
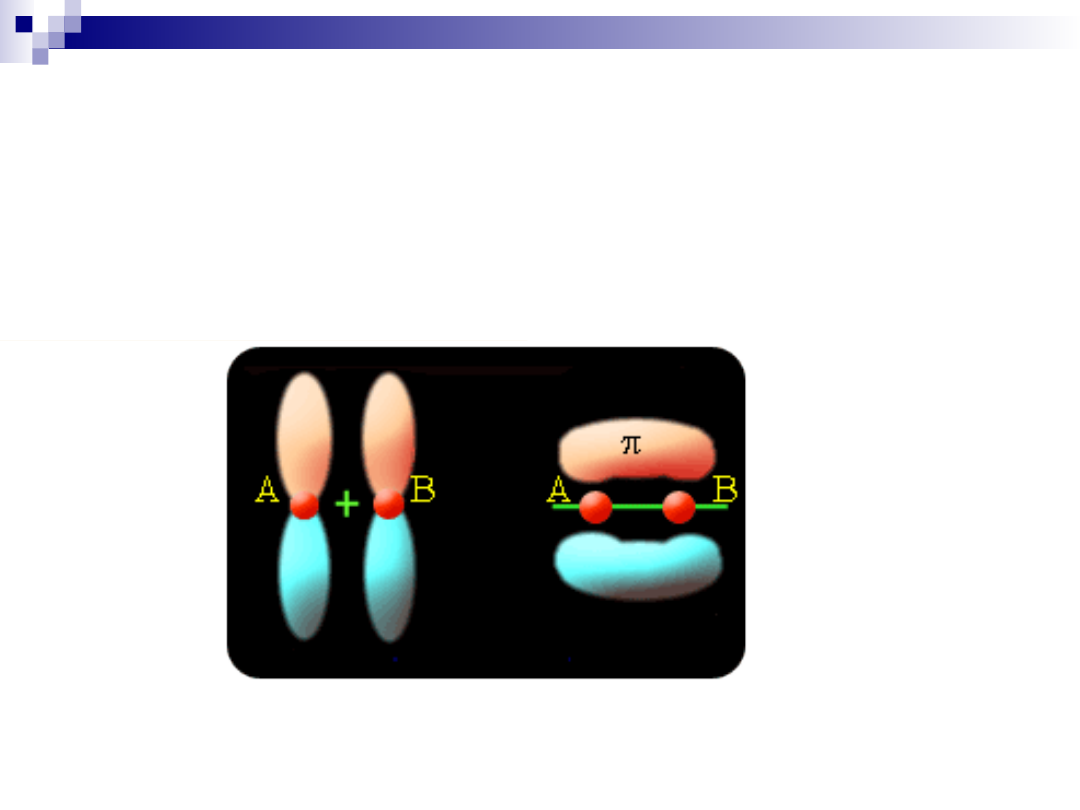
W takim układzie elektrony mogą przesuwać się wzdłuż łańcucha co prowadzi do
wyrównania gęstości elektronowej w całym pierścieniu. Mamy tutaj przypadek delokalizacji
elektronów, który przedstawiany jest za pomocą specjalnego symbolu wiązania (kółko). To
przesuwanie się elektronów wzdłuż pierścienia, zawdzięczamy obecności wiązania π.
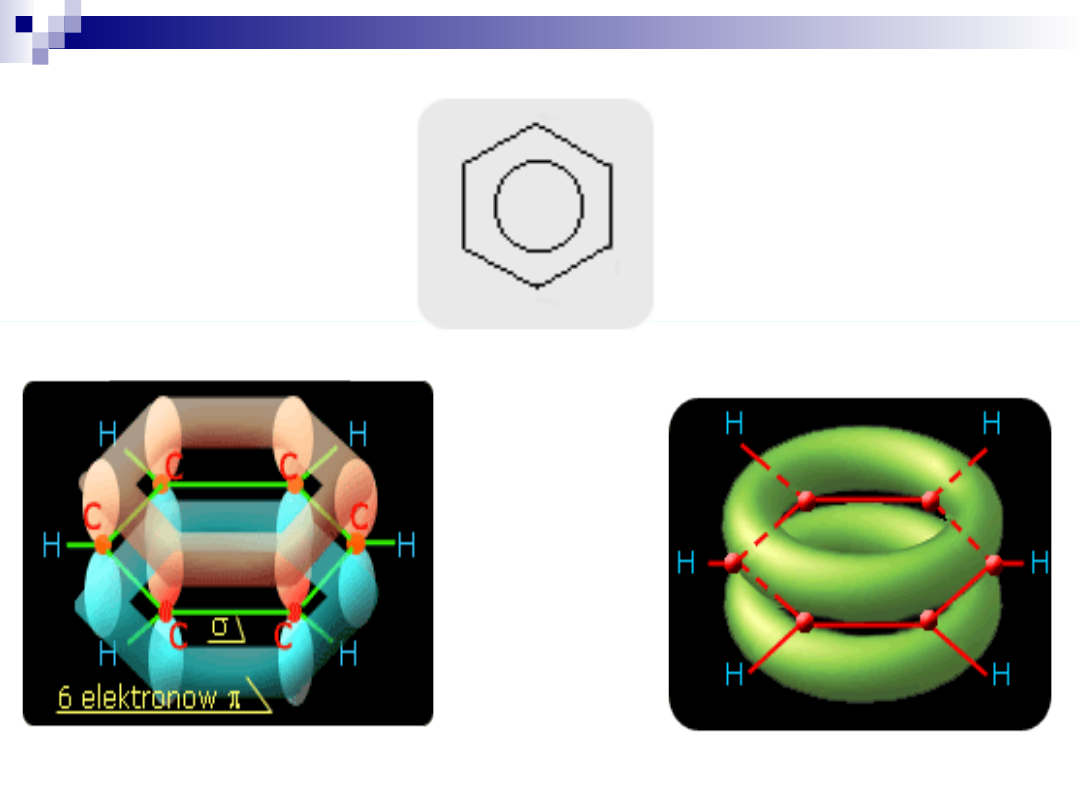
Struktura związków organicznych
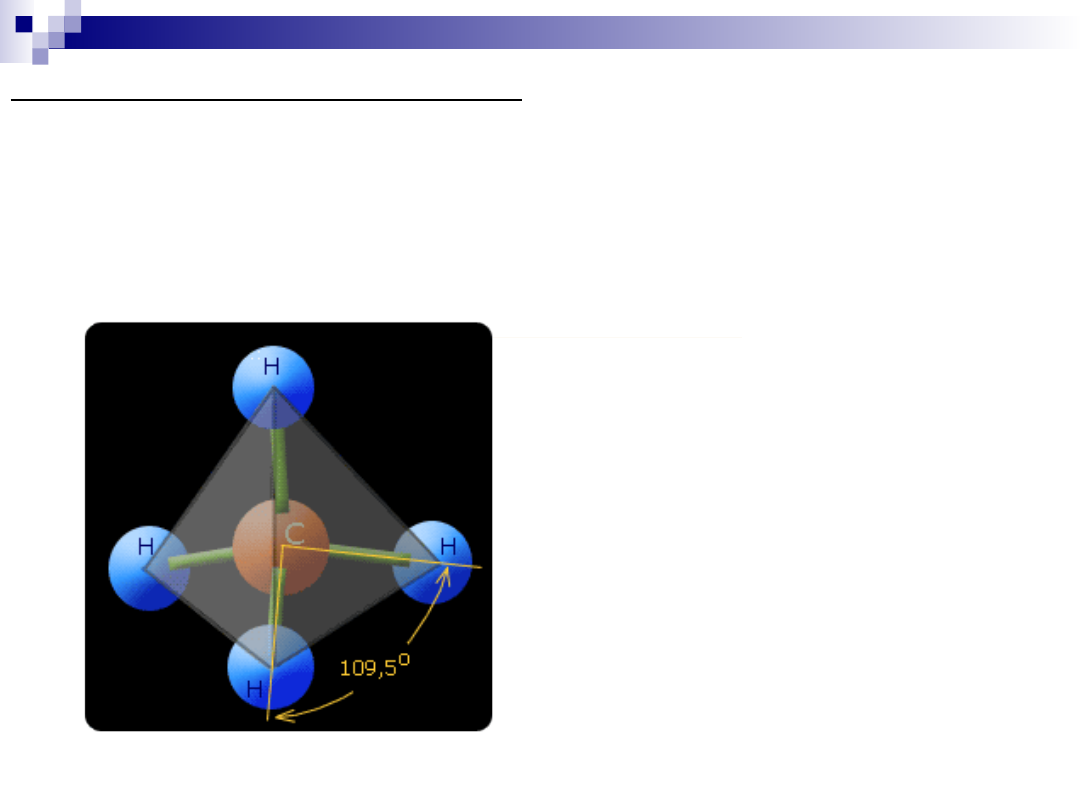
Najprostszym węglowodorem jest metan o wzorze CH
4
o
tetraedrycznej strukturze cząsteczki.
Cząsteczka metanu

Ponieważ atomy węgla i atomy wodoru mają prawie taką samą
elektroujemność, dlatego oprócz wiązania C - H mogą być utworzone
wiązania C - C.
Liczba węglowodorów nie ogranicza się tylko do najprostszego
węglowodoru CH
4
, lecz możliwy jest szereg związków, jak np. C
2
H
6
(etan), C
3
H
8
(propan)…...
każdy człon ma wzór ogólny
C
n
H
2n+2
.
Mówimy wtedy, że węglowodory tworzą szereg homologiczny.
W szeregu homologicznym węglowodory jak ich pochodne, różnią się
o stałą różnicę, zwaną różnicą homologiczną, którą jest
grupa metylenowa -CH
2
-
Przykładem jest szereg homologiczny alkanów, alkenów i alkinów
Wzór
Nazwa
Wzór
Nazwa
Wzór
Nazwa
Wzór
Nazwa
Alkany
Alkany
C
C
n
n
H
H
2n+2
2n+2
Alkile
Alkile
C
C
n
n
H
H
2n+1
2n+1
-Rodnik
Alkeny
Alkeny
C
C
n
n
H
H
2n
2n
Alkiny
Alkiny
C
C
n
n
H
H
2n-2
2n-2
CH
4
Metan
-CH
3
Metyl
C
2
H
6
Etan
-C
2
H
5
Etyl
C
2
H
4
Eten,
etylen
C
2
H
2
Etyn,
acetyle
n
C
3
H
8
Propan
-C
3
H
7
Propyl
C
3
H
6
Propen,
propyle
n
C
3
H
4
Propyn
C
4
H
10
Butan
-C
4
H
9
Butyl
C
4
H
8
Buten
C
4
H
6
Butyn
C
5
H
12
Pentan
-C
5
H
11
Amyl,
Pentyl
C
5
H
10
Penten
C
3
H
4
Pentyn
C
6
H
14
Heksan
-C
6
H
13
Heksyl
C
6
H
12
Heksen
C
6
H
10
Heksyn
C
7
H
16
Heptan
-C
7
H
15
Heptyl
C
7
H
14
Hepten
C
7
H
12
Heptyn
C
8
H
18
Oktan
-C
8
H
17
Oktyl
C
8
H
16
Okten
C
8
H
14
Oktyn
C
9
H
20
Nonan
-C
9
H
19
Nonyl
C
9
H
18
Nonen
C
9
H
16
Nonyn
C
10
H
22
Dekan
-C
10
H
21
Dekyl
C
10
H
20
Deken
C
10
H
18
Dekyn
C
11
H
24
Undeka
n
C
12
H
26
Dodeka
n

Zapamiętać nazwy pierwszych
Zapamiętać nazwy pierwszych
dziesięciu alkanów !!!!!!!
dziesięciu alkanów !!!!!!!
Rodzaje izomerii
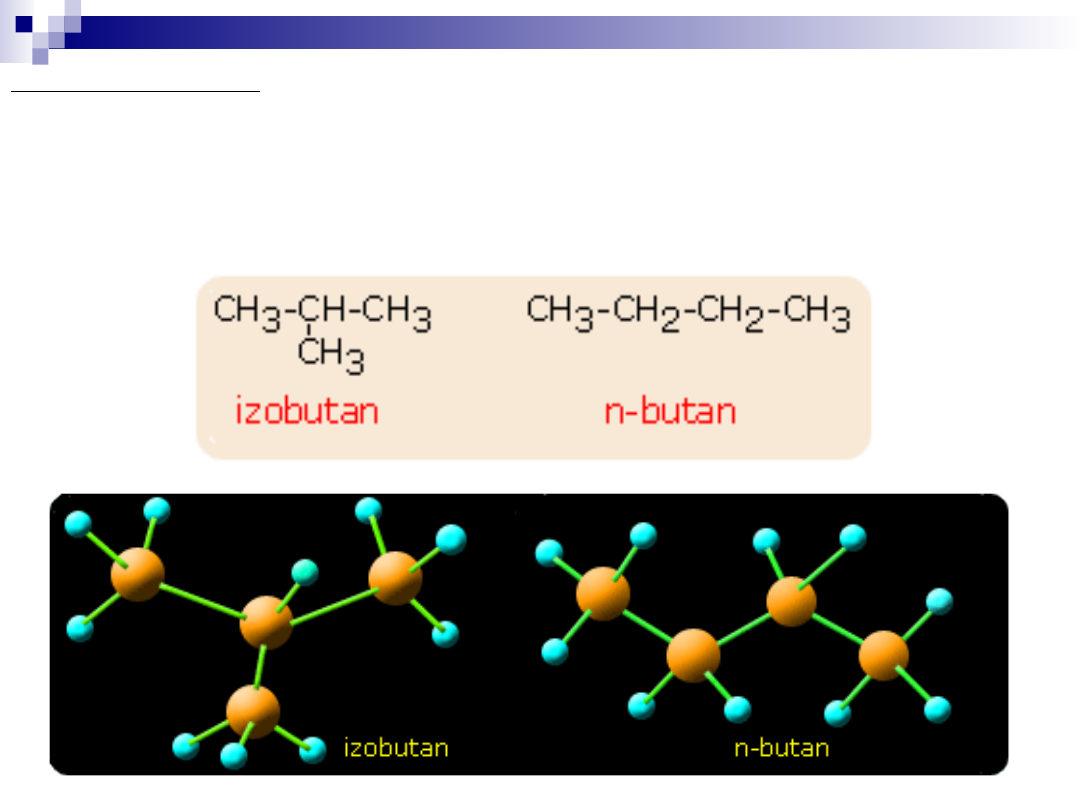
Pierwsze możliwe przestrzenne rozmieszczenie atomów węgla w
cząsteczce występuje gdy cząsteczka zawiera 4 atomy węgla (C
4
H
10
).
W takiej cząsteczce są możliwe dwa sposoby połączenia atomów
węgla w cząsteczce: w postaci łańcucha n-butanu i w postaci
rozgałęzionej, czyli metylopropanu (izobutan).

Na przedstawionym modelu widzimy, że cząsteczki zawierają taką
samą liczbę atomów tego samego pierwiastka, lecz atomy te są
połączone z sobą w inny sposób. Innym przykładem jest związek
chemiczny o wzorze sumarycznym - C
5
H
12
. Związek chemiczny o
takim wzorze może posiadać trzy odmiany strukturalne. Takie
związki różniące się przestrzennym rozmieszczeniem atomów
nazywa się izomerami.
Rodzaje izomerii występujące w związkach organicznych przedstawia
poniższy schemat.

Wyróżnia się izomerię
strukturalną
steroeoizomeria (przestrzenna)
Izomeria strukturalna - polega na występowaniu związków
izomerycznych, w których atomy tych samych pierwiastków są ze
sobą połączone w różnej kolejności
W odniesieniu do węglowodorów i ich pochodnych wyróżniamy:
izomerię łańcuchową, gdzie atomy węgla mogą przyjmować różne
ułożenia w łańcuchu
izomerię położenia, gdzie mamy do czynienia z różnym położeniem
wiązań nienasyconych oraz różnym położeniem podstawników w
cząsteczce
izomerię z różnymi podstawnikami w cząsteczce
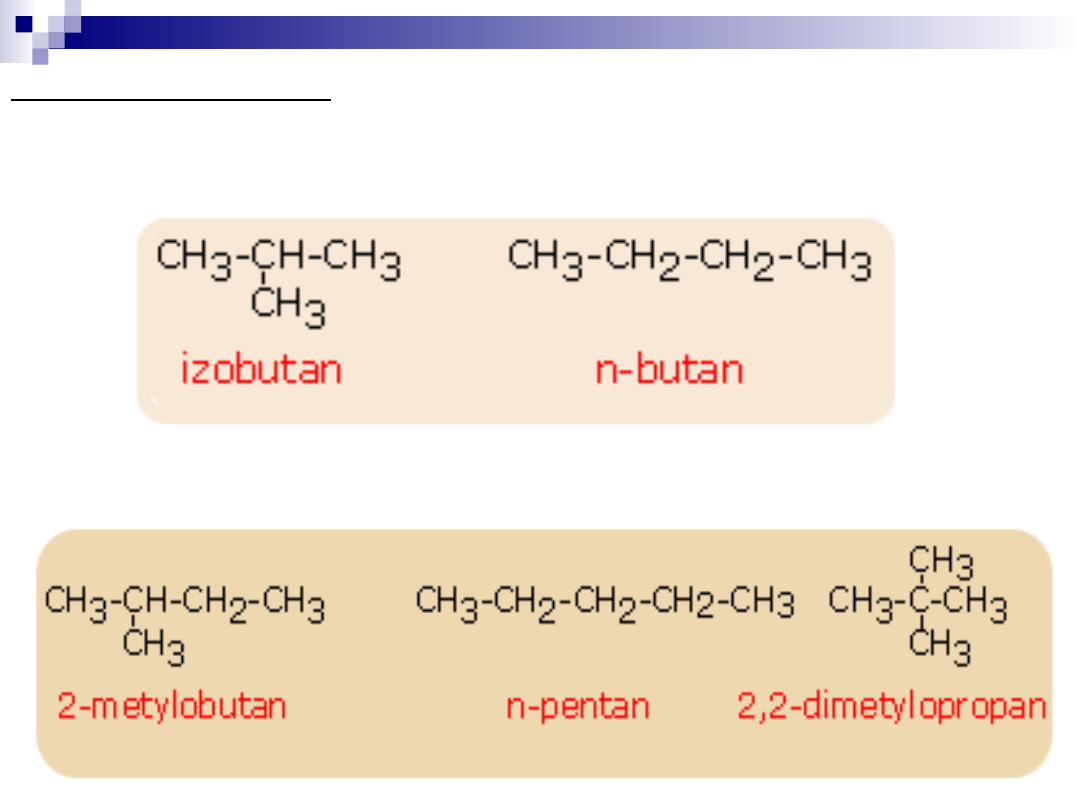
Izomeria łańcuchowa
W cząsteczkach węglowodorów począwszy od butanu atomy węgla
mogą przyjmować różne ułożenia w łąńcuchu
C
4
H
10
Ze wzrostem liczby atomów węgla szybko wzrasta ilość
izomerów. C
5
H
12

Dla cząsteczki posiadającej 10 atomów węgla izomerów jest 75, dla
20 atomów węgla – 36 6319, dla 30 atomów węgla – 411 109
izomerów.
Nazw
a
Wzór
suma-
ryczny
Wzór
półstruktu-
ralny
Ilość
izome
-rów
Nazwa
Wzór
suma-
ryczny
Wzór
półstruktura
lny
Ilość
izome-
rów
Metan
CH
4
CH
4
1
Heksa
n
C
6
H
14
CH
3
(CH
2
)
4
CH
3
5
Etan
C
2
H
6
CH
3
CH
3
1
Hepta
n
C
7
H
16
CH
3
(CH
2
)
5
CH
3
9
Propa
n
C
3
H
8
CH
3
CH
2
CH
3
1
Oktan
C
8
H
18
CH
3
(CH
2
)
6
CH
3
18
Butan
C
4
H
10
CH
3
CH
2
CH
2
CH
3
2
Nonan
C
9
H
20
CH
3
(CH
2
)
7
CH
3
35
Penta
n
C
5
H
12
CH
3
(CH
2
)
3
CH
3
3
Dekan
C
10
H
22
CH
3
(CH
2
)
8
CH
3
75
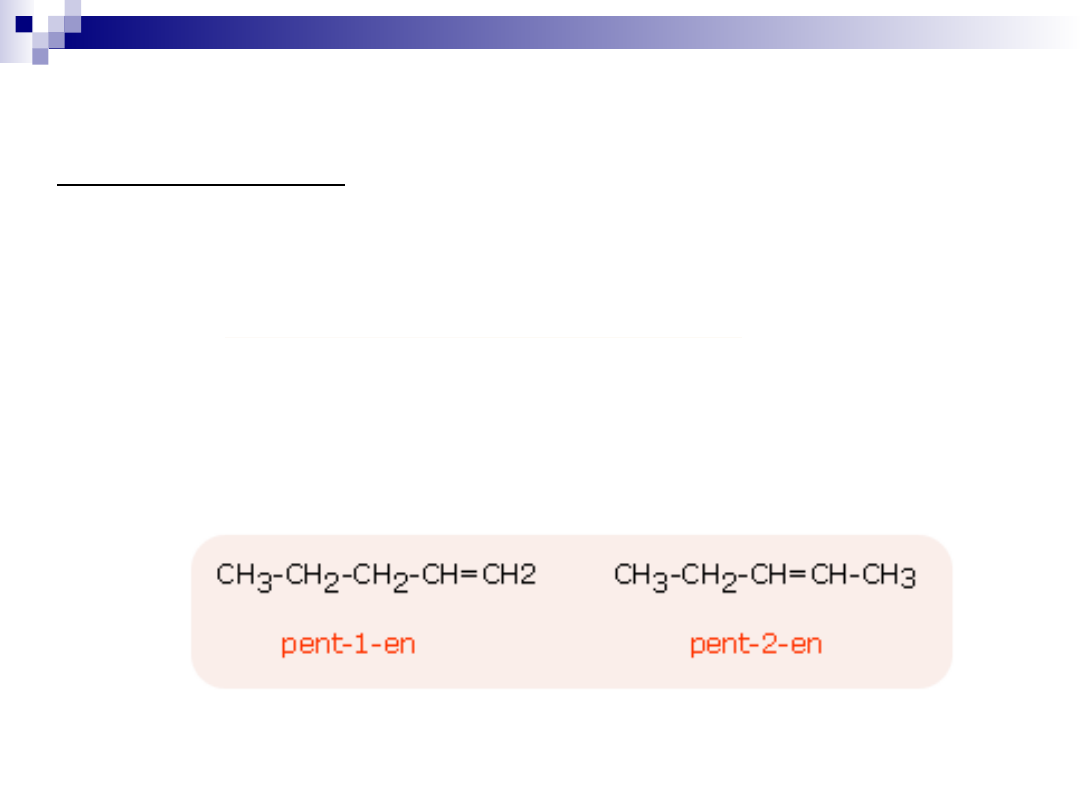
Izomeria położenia
Izomeria położenia dotyczy położenia podstawnika lub
wiązania wielokrotnego w cząsteczce.
Przykłady:
C
3
H
7
-Cl 1-chloropropan CH
3
-CH
2
-CH
2
-Cl
2-chloropropan CH
3
-CHCl-CH
3
C
5
H
10
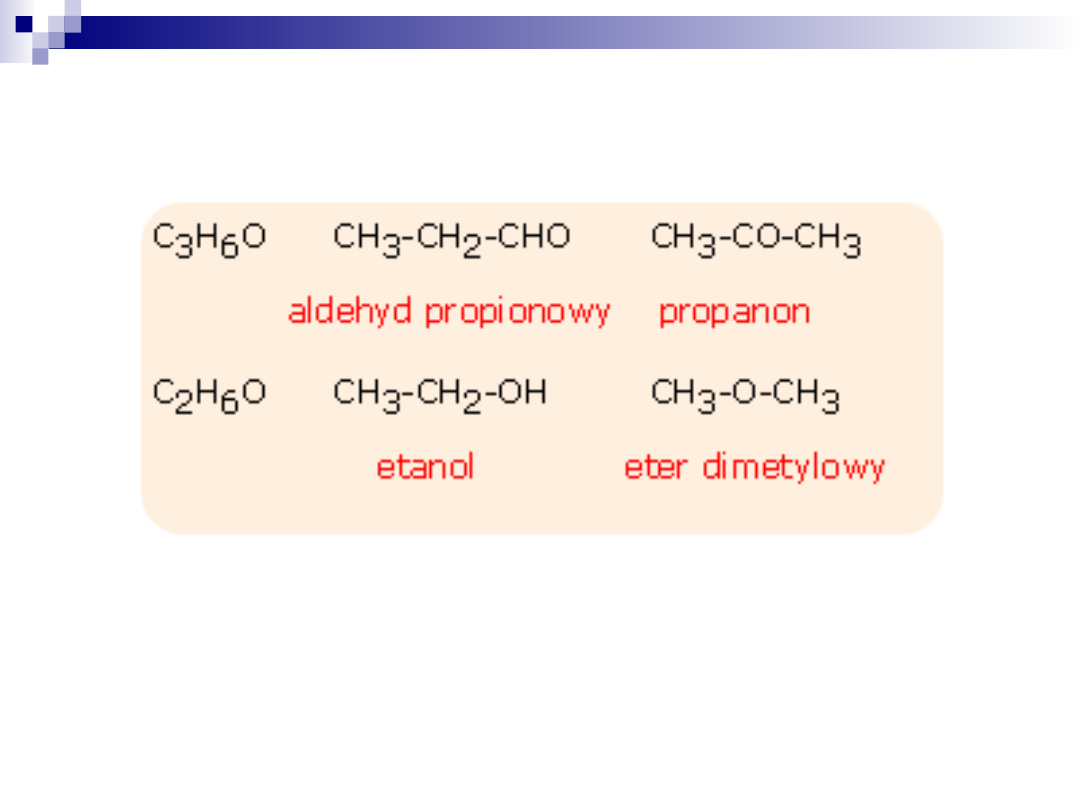
Izomeria z różnymi podstawnikami w cząsteczce
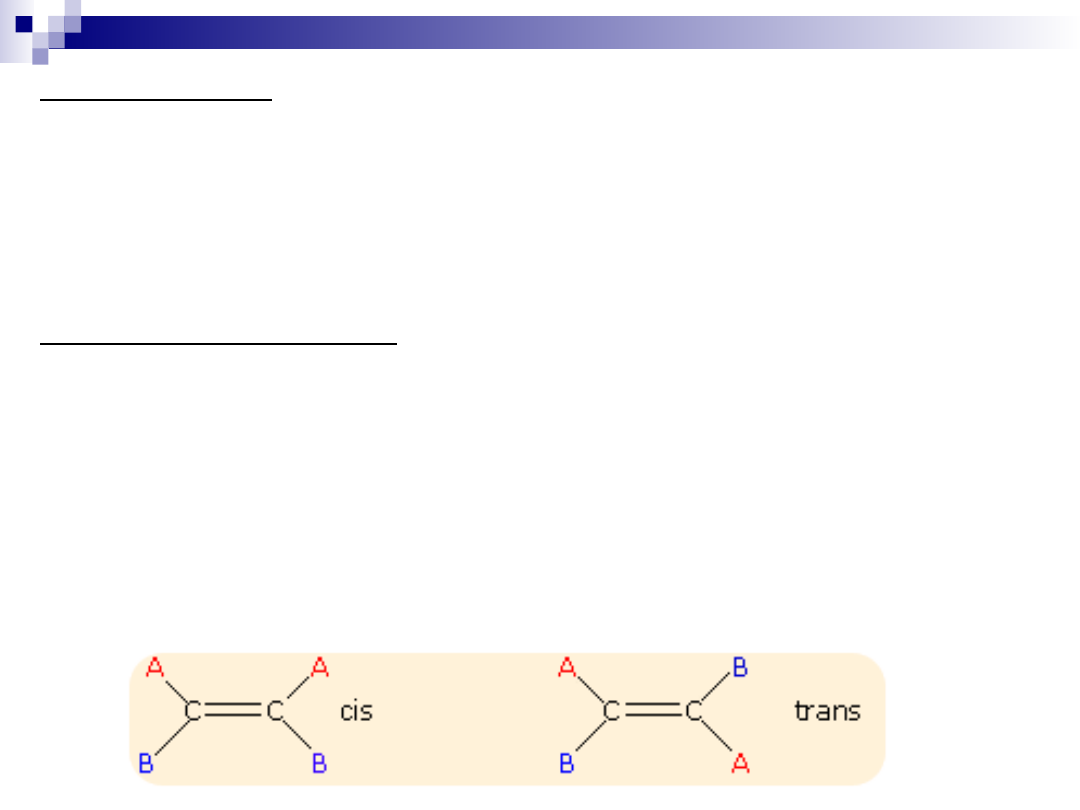
Stereoizomeria
Stereoizomeria - to szczególny rodzaj izomerii, gdzie atomy
połączone są między sobą w identycznej kolejności ale różnią
się sposobem rozmieszczenia atomów w przestrzeni.
Wyróżniamy tutaj następujące rodzaje izomerii;
•izomeria geometryczna
•izomeria optyczna
Izomeria geometryczna
Ten typ izomerii występuje wówczas, gdy w układzie
przestrzennym cząsteczki zaznacza się określona płaszczyzna.
Jeżeli wyróżnione grupy cząsteczki leżą po tej samej stronie
płaszczyzny mamy do czynienia z izomerem
cis
a jeżeli po
przeciwnych stronach z izomerem
trans
.
Konfigurację izomerów geometrycznych rozróżnia się za
pomocą nazw, które zawierają przedrostek
cis-
lub
trans
-, co
wskazuje na usytuowanie grup po tej samej lub po przeciwnej
stronie cząsteczki.
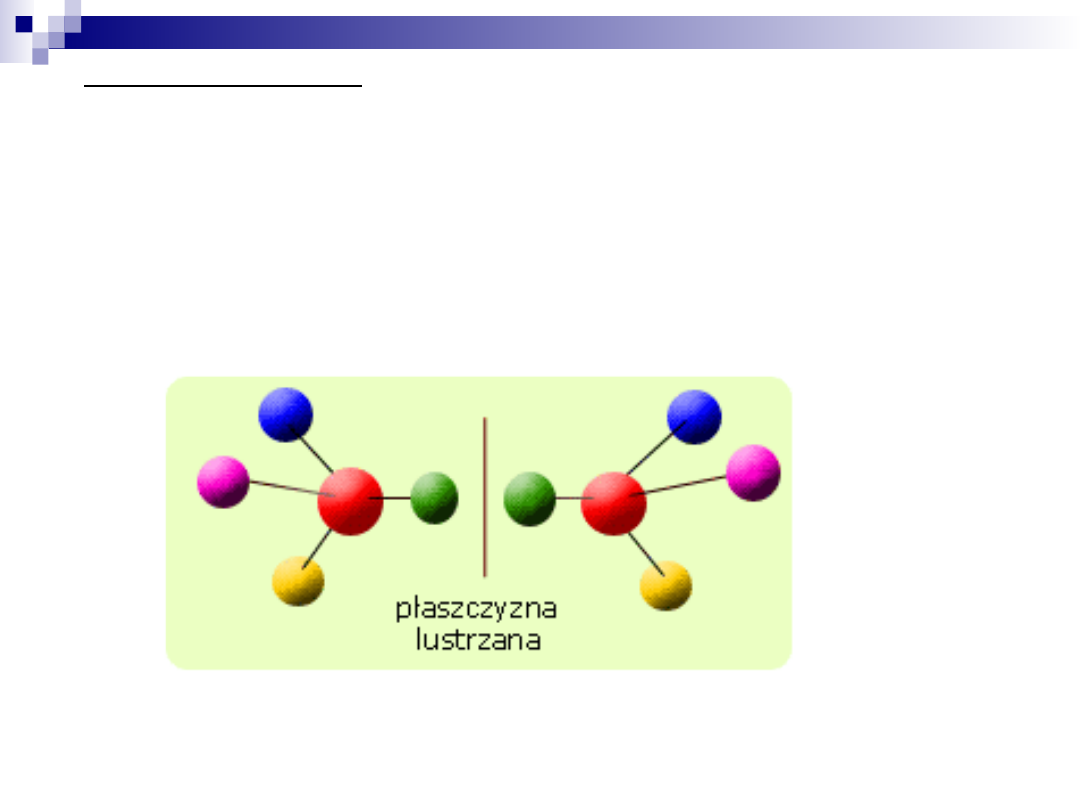
Izomeria optyczna
Jest to rodzaj stereoizomerii występującej w cząsteczkach
chiralnych, które zawierają atom węgla, do którego
przyłączone są cztery różne grupy. Taki atom nosi nazwę
centrum chiralności.
A to oznacza, że dla każdej cząsteczki posiadającej centrum
chiralności możemy znaleźć drugą cząsteczkę będącą jej
lustrzanym odbiciem
Związki skręcające płaszczyznę światła w prawo zaznacza się
za pomocą symbolu (+) przed nazwą związku, skręcające w
lewo symbolem (-).
Na przykład: (+) - glukoza, (-) - fruktoza
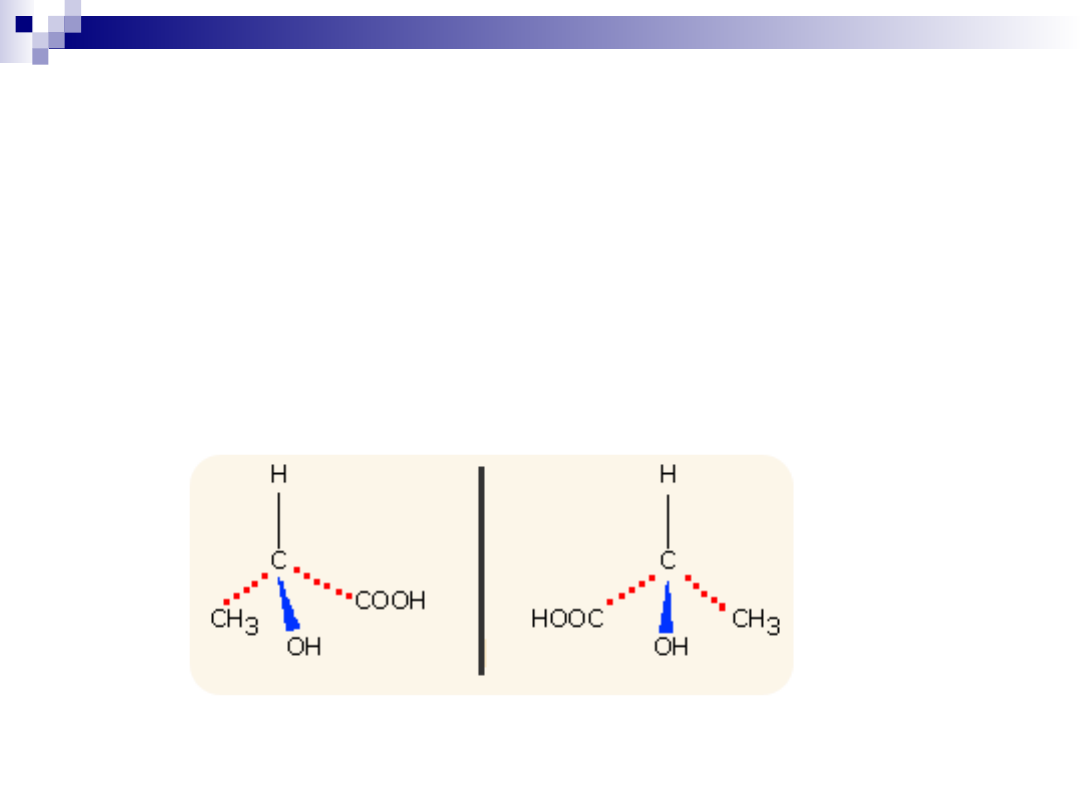
Izomery będące wzajemnymi odbiciami lustrzanymi noszą
nazwę enancjomerów.
Przykład - kwas mlekowy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
2 Ch organiczna podzial reakcje IIid 20221 ppt
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
Ocena reakcji organizmu na wysiłek statyczny ppt
10 Ch organiczna LIPIDYid 10801 ppt
9 Ch organiczna WĘGLOWODANY
02 Pojęcie i podziały prawaid 3482 ppt
Ch organiczna wykład 1d
Ch organiczna wykład 1g
140 Organizacje miedzynarodowe ONZid 15686 ppt
14a socjologia organizacji, psychologia zarządzaniaid 15867 ppt
1 Pojęcie i zasady organizacji finansów w przedsiebiorstwieid 9604 ppt
chemia fizyczna 1-1, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, chem org,
Ch organiczna wykład 1e
Rozpuszczalniki organiczne pochodne chloroorganiczne, etery, ppt
14 Logistyka zaopatrzenia Organizacja procesów magazynowycid 15668 ppt
więcej podobnych podstron