
ALDEHYD
ALDEHYD
Y
Y
I
I
KETONY
KETONY
cz 2
cz 2
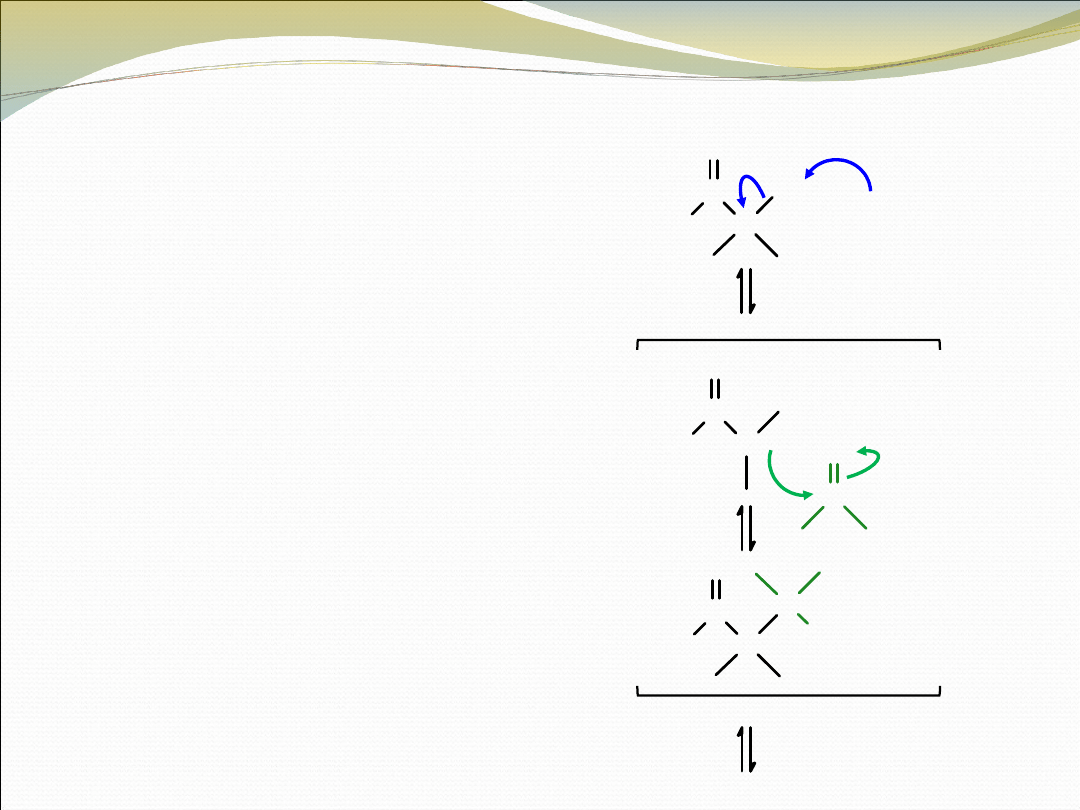
KONDENSACJA ALDOLOWA
Jeden z komponentów karbonylowych
zawierających atom wodoru α pod
działaniem zasady zostaje
przekształcony w jon enolanowy
Jon enolanowy działa jak donor
nukleofilowy i ulega przyłączeniu
do elektrofilowej grupy
karbonylowej komponenta
akceptorowego
C
R
O
C
H
OH
..
..
..–
C
R
O
C
–..
C
O
.. ..
donor
nukleofilowy
akceptor
elektrofilowy
C
R
O
C
C
O
–
..
....
Protonowanie tetraedrycznego
pośredniego jonu alkoksylowego
prowadzi do obojętnego produktu
kondensacji
H
2
O
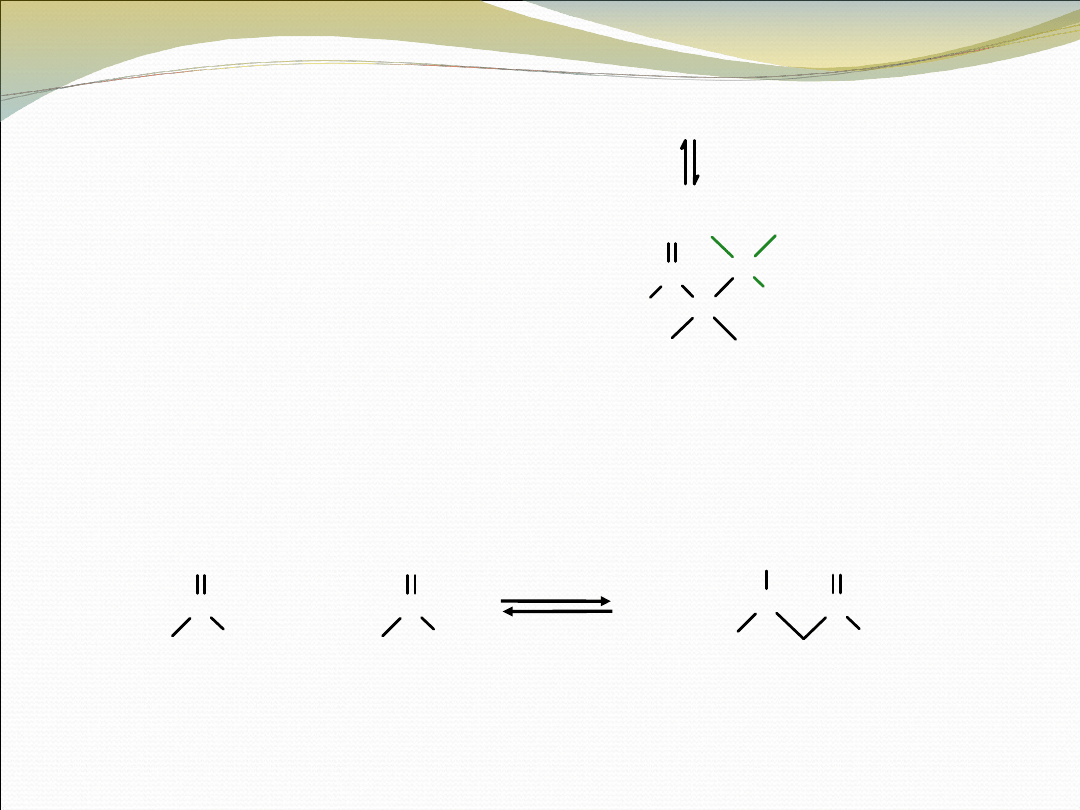
Protonowanie tetraedrycznego
pośredniego jonu alkoksylowego
prowadzi do obojętnego produktu
kondensacji
H
2
O
C
R
O
C
C
O
H
+
-
OH
Ogólny mechanizm reakcji kondensacji karbonylowej. Jeden reagent
(donor) działa jako nukleofil, podczas gdy dugi reagent (akceptor) działa jako
elektrofil
Reakcja aldolowa
C
O
CH
3
H
..
..
C
O
CH
3
H
..
..
+
zasada
3-hydroksybutanal
C
O
H
CH
3
C
H
O
..
.. ..
..
MIESZANA KONDENSACJA
ALDOLOWA
CH
3
CHO
CH
3
CH
2
CHO
zasada
CH
3
CHCH
2
CHO
OH
+
+
CH
3
CH
CHCHO
OH
CH
3
CH
3
CH
2
CHCHCHO
OH
CH
3
+
CH
3
CH
2
CH
CH
2
CHO
OH
+
+
produkty
symetryczne
produkty mieszane
acetaldehy
d
propanal
O
H
3
C
H
H
CH
O
O
H
3
C
+
etanol
Na
+
-
OC
2
H
5
+
H
2
O
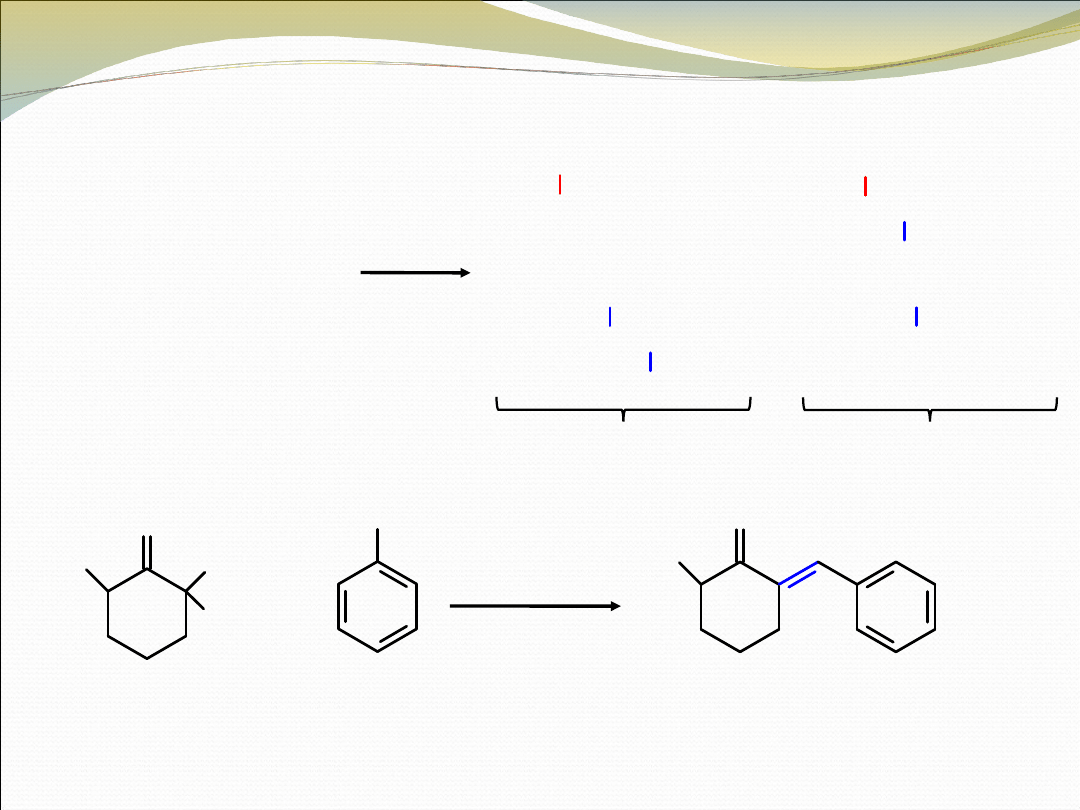
2-metylocykloheksanon
(donor)
benzaldehyd
(akceptor)
78%
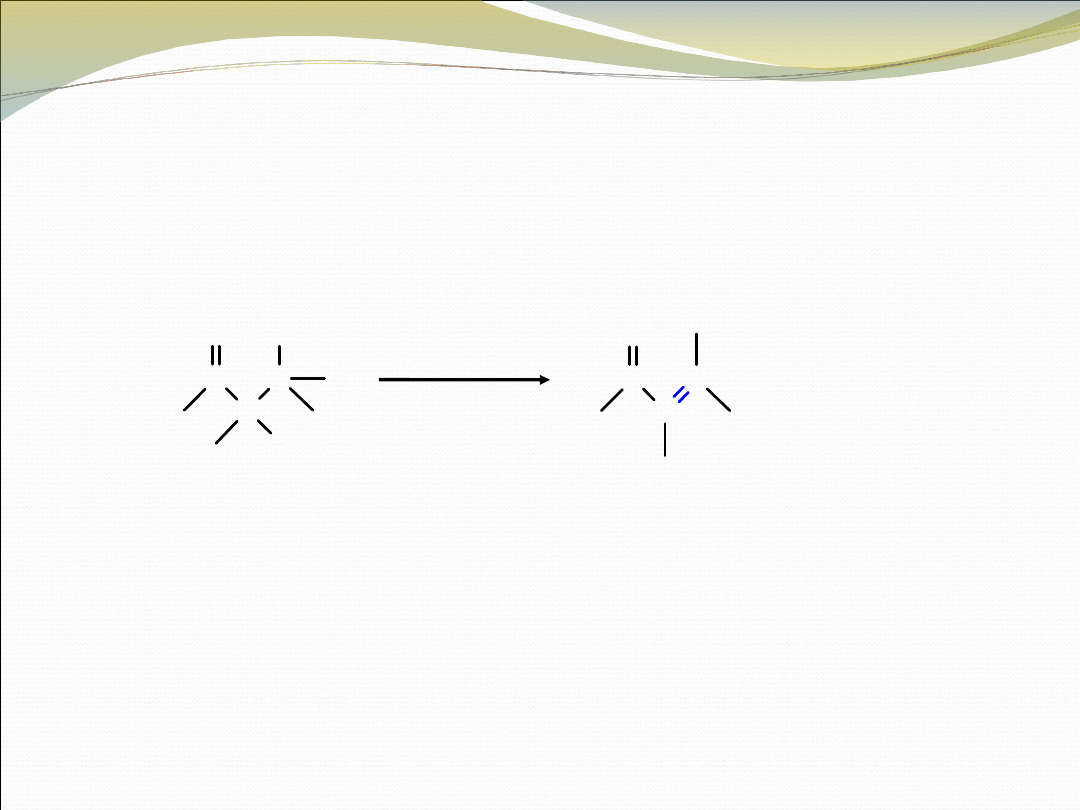
DEHYDRATACJA PRODUKTÓW KONDENSACJI
ALDOLOWEJ
β-hydroksyketon
lub -aldehyd
sprzężony enon
+
H
2
O
C
C
C
O
H
O
H
C
C
C
O
H
+
lub
-
OH
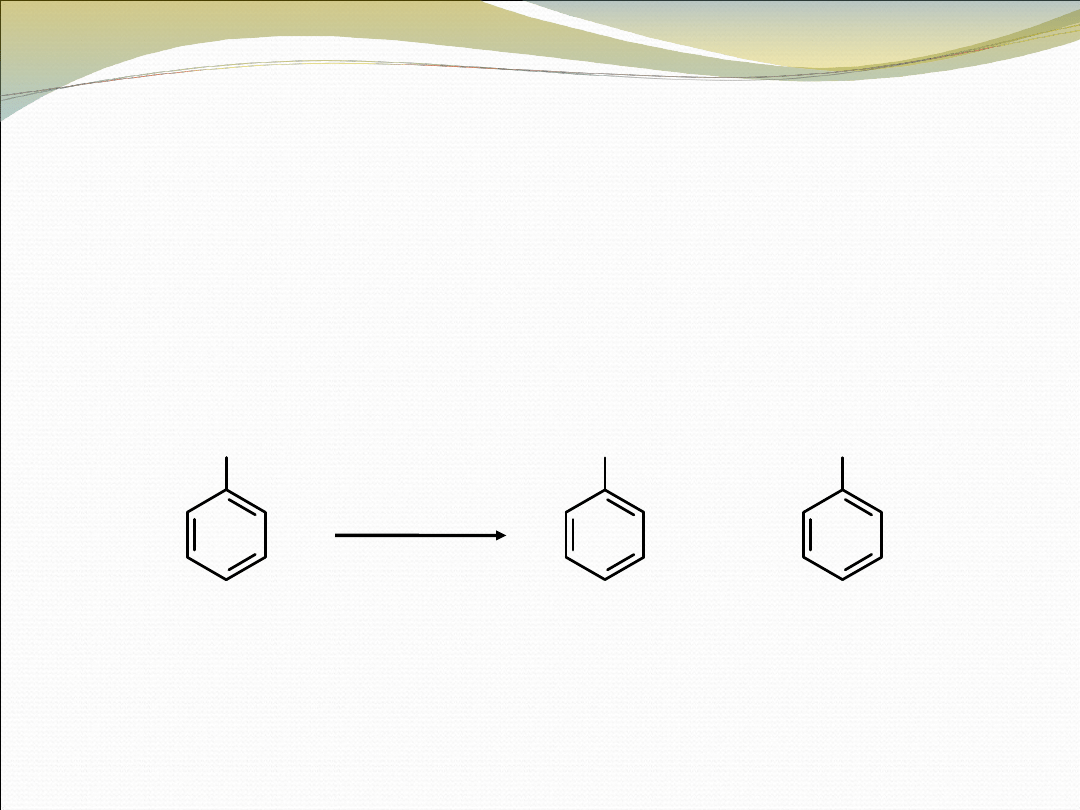
REAKCJA CANNIZZARO
Zachodzi gdy aldehyd, który nie ma wodorów przy atomie węgla
sąsiadującym z grupą –CHO jest podgrzewany z zasadą (OH
–
). W wyniku
reakcji powstają równoważne ilości kwasu karboksylowego i alkoholu
CO
2
H
CH
2
OH
CHO
+
2
1.
–
OH, H
2
O
2.
H
3
O
+
benzaldehyd
kwas benzoesowy
alkohol
benzylowy
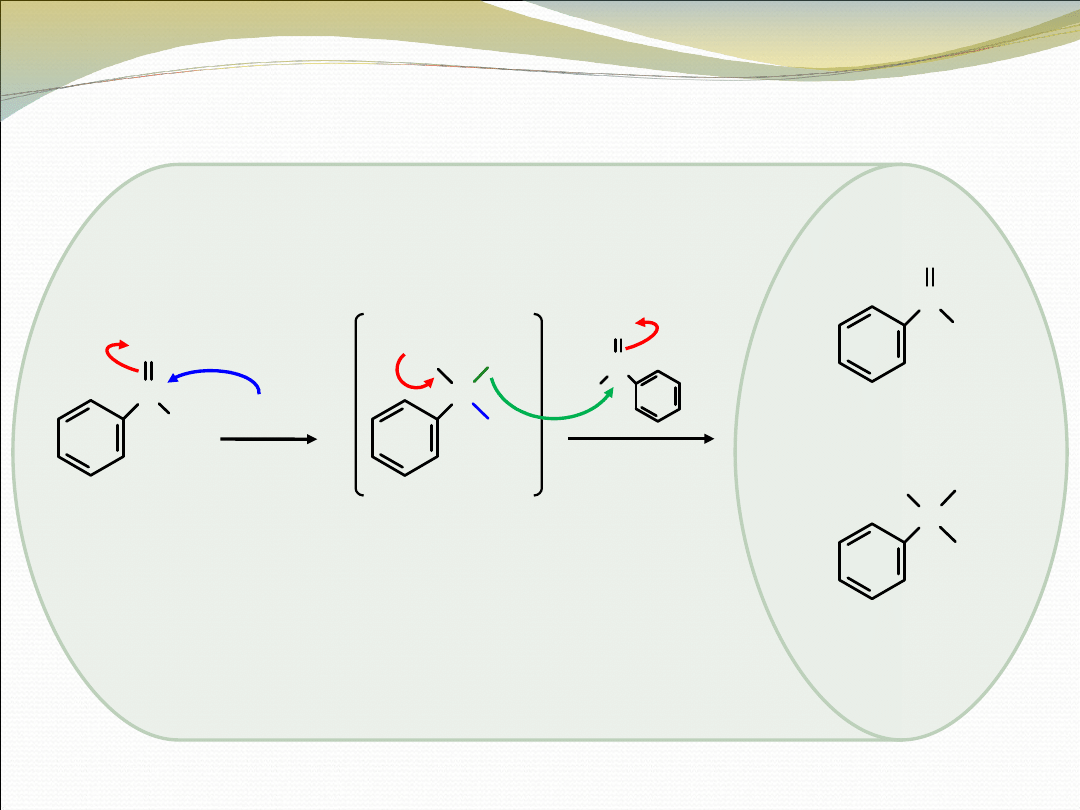
C
O
H
–
OH
..
....
C
OH
H
O
C
O
H
2.
H
3
O
+
1.
.. ..
..
–
C
O
OH
C
O
H
H
H
+
(utleniony)
(zredukowany)
tetraedryczny
produkt pośredni
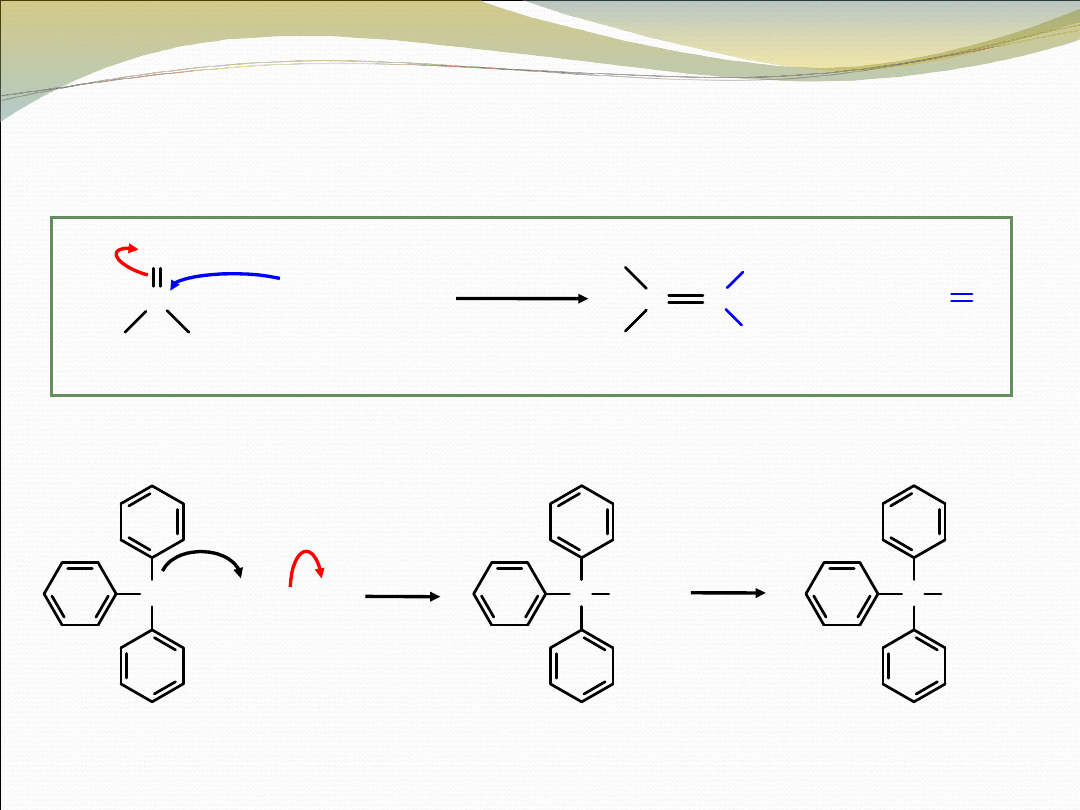
REAKCJA WITTIGA
między ylidem fosforowym i aldehydem lub
ketonem prowadzi do utworzenia się alkenu
C
O
..
..
R
2
C―P(C
6
H
5
)
3
+
–..
+
keton/aldehyd
ylid
THF
C
C
R
R
(C
6
H
5
)
3
P
O
+
alken
tlenek
trifenylofosfin
y
P
..
P
CH
3
+
P
CH
2
+
..–
+
CH
3
―
Br
S
N
2
BuLi
THF
Br –
trifenylofosfina
bromometa
n
bromek
metylotrifenylofosfoniow
y
fosforan
metylenotrifenylowy
(
ylid
)
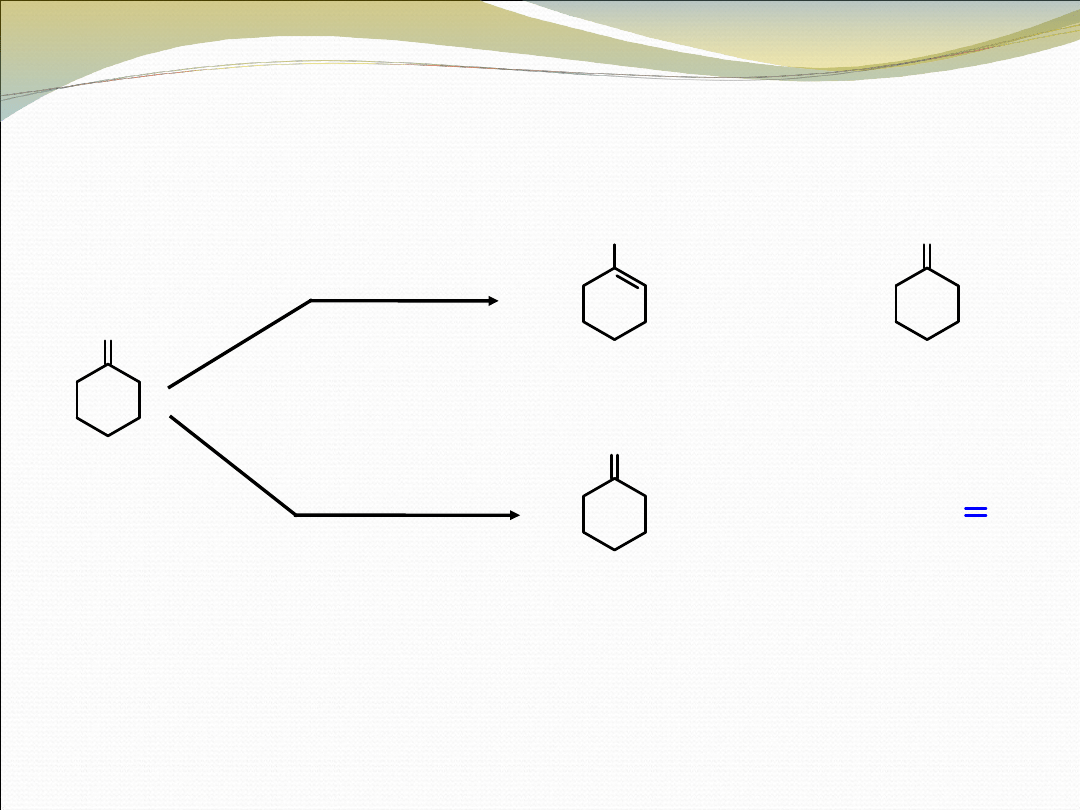
O
CH
3
CH
2
CH
2
(C
6
H
5
)
3
P
O
cykloheksanon
1-
metylocykloheksen
metylenocykloheksa
n
metylenocykloheksa
n(84%)
1.
CH
3
MgBr
2. POCl
3
(C
6
H
5
)
3
P―CH
2
roztwór w THF
+ –
+
+
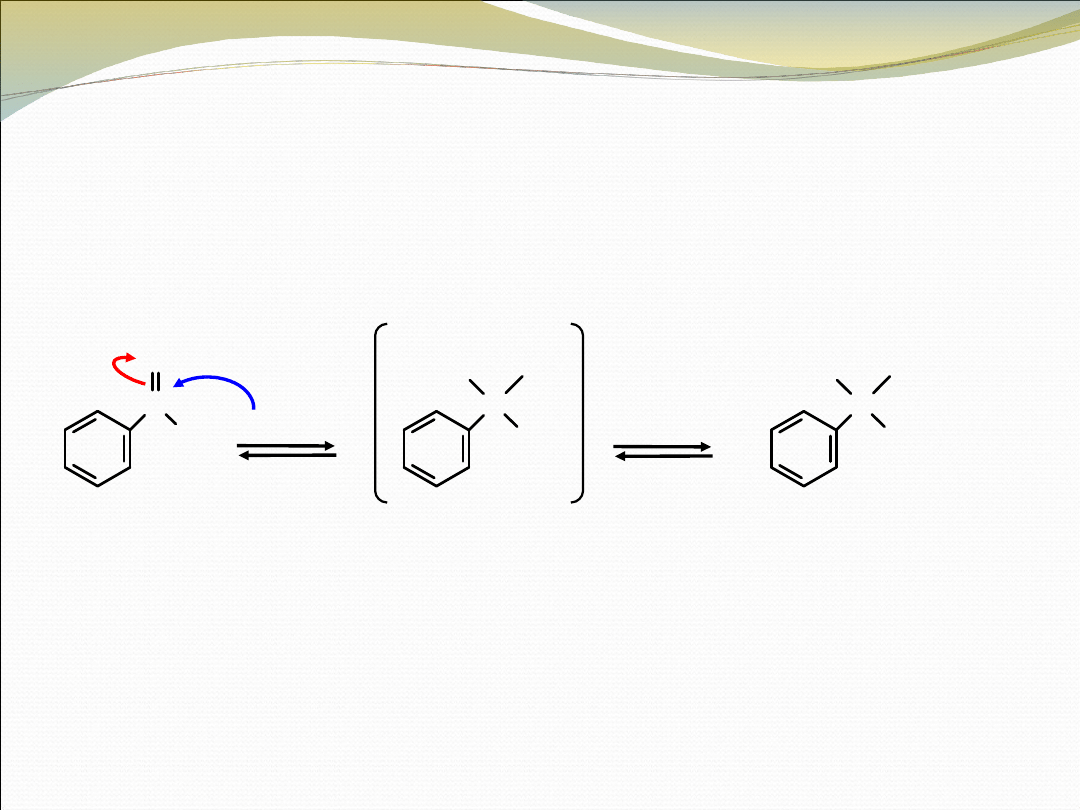
REAKCJA ALDEHYDÓW I KETONÓW Z CN
–
CYJANOHYDRYNA
C
H
CN
HO
benzaldehyd
tetraedryczny
produkt pośredni
nitryl kwasu
migdałowgo
(88%)
C
O
H
....
C
H
CN
O
..
.. ..
–
C≡N
–
..
HCN
+
C≡N
–
..
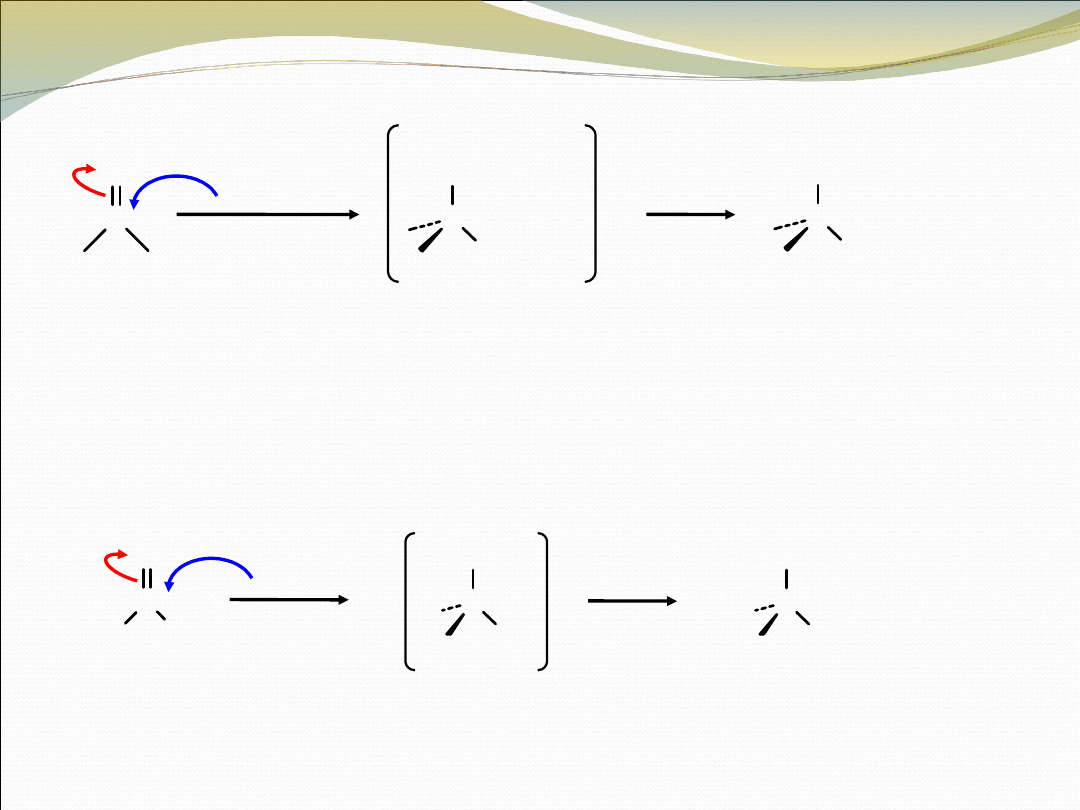
C
O
C
O
H
R
..
..
C
O
R
..
..
.. –
+
MgX
R
–
+
MgX
..
addycja
nukleofilowa
grupa
karbonylowa
tetraedryczny
produkt pośredni
alkohol
H
3
O
+
+
HO
MgX
Mechanizm reakcji Grignarda,
reakcji nukleofilowej
addycji
karboanionu do ketonu lub do aldehydu
Mechanizm redukcji grupy karbonylowej w wyniku reakcji addycji
nukleofilowej „jonu wodorkowego” z NaBH
4
lub z LiAlH
4
C
O
R
R'
....
C
O
H
H
R'
R
z NaBH
4
„:H
–
”
C
O
H
R'
R
..
.... –
H
3
O
+
+
H
2
O
REAKCJA REDUKCJI ALDEHYDÓW I KETONÓW DO
ALKANÓW
REDUKCJA CLEMMENSA
REAKCJA WOLFFA-KIŻNERA
C
CH
2
CH
3
O
C
CH
2
CH
3
H
H
Zn(Hg)
H
3
O
+
propiofenon
propylobenzen (86%)
C
R
R'
H
H
C
O
R
R'
C
R
R'
N
NH
2
H
2
N–NH
2
OH
–
, H
2
O
hydrazon
alkan
INNE REAKCJE ALDEHYDÓW I KETONÓW
• REAKCJA
UTLENIANIA
• CHLOROWCOWANIE ALDEHYDÓW/KETONÓW, GDZIE X = Cl,
Br LUB I
C
O
R
H
C
O
R
OH
odczynnik Jonesa
lub Ag
+
, NH
4
OH
C
O
R
C
H
C
O
R
C
X
+
X
2
+
H
X
CH
3
COOH
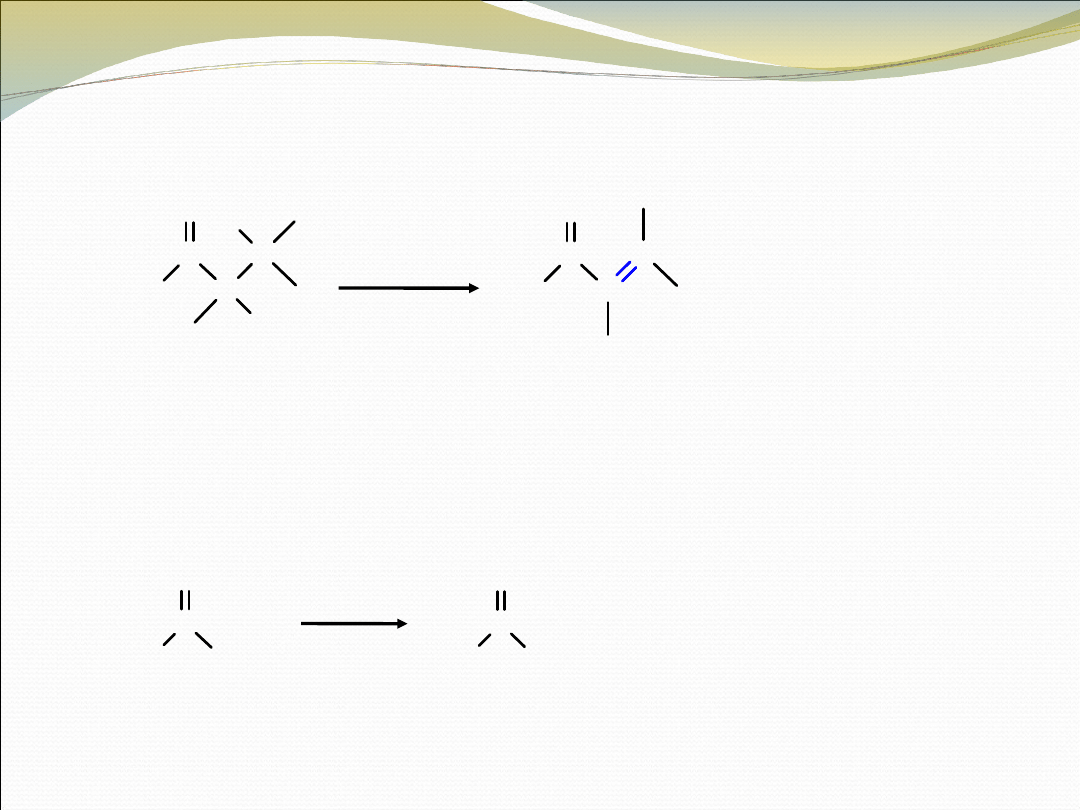
• DEHYDROBROMOWANIE α-BROMOKETONÓW
C
O
R
C
Br
C
H
C
O
R
C
C
pirydyna
Δ
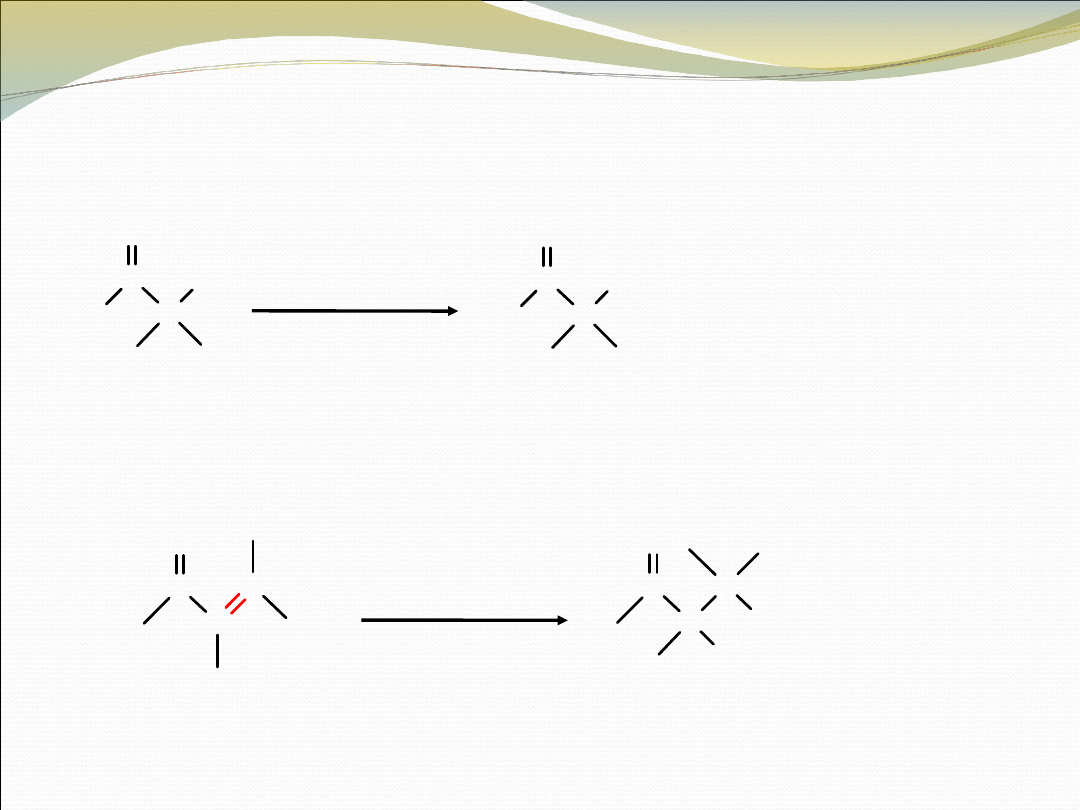
• REAKCJA HALOFORMOWA, GDZIE X = Cl, Br LUB
I
C
O
R
CH
3
C
O
R
O
-
X
2
NaOH
+
CH
X
3
• ALKILOWANIE KETONÓW
• ALKILOWANIE α, β–NIENASYCONYCH ALDEHYDÓW I
KETONÓW
C
O
R
C
H
C
O
R
C
R'
1.
LDA w THF
2.
R’X
LDA = LiN(C
3
H
7
)
2
diizopropyloamidek
litu
C
O
C
C
C
O
C
H
C
R
1.
„:R
–
”
2.
H
3
O
+
α,β-nienasycony
keton/aldehyd
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
aldehydy i ketony addycja nukleofilowa
aldehydy i ketony
Aldehydy i ketony
Aldehydy i ketony
Aldehydy, ketony, kwasy, ALDEHYDY
Aldehydy, ketony i kwasy - test 2, 1p
ISE powtorka z chemii, ISE aldehydy i ketony, P 5
aldehydy i ketony zadania
13 Aldehydy i ketony kondensacja aldolowa
(3wysł) polifenole, aldehydy, ketony,kwasy,mydła 2010 11(1)
Aldehydy i ketony
wyk 8 aldehydy,ketony cd
6 aldehydy,ketony
Aldehydy i ketonywisła
Aldehydy i ketony
więcej podobnych podstron