
RADIOTERAPIA
Monika Szumilas
Natalia Sławska
Dietetyka rok 2 grupa C3
2009/2010

Radioterapia (dawniej Curieterapia) -
metoda leczenia za pomocą promieniowania
jonizującego, którego energia powoduje
powstawanie zmian w strukturze atomu lub
cząsteczki. Stosowana w onkologii do
leczenia choroby nowotworowej oraz
łagodzenia bólu związanego z rozsianym
procesem nowotworowym, np. w przerzutach
nowotworowych do kości.
Radioterapia jest pod specjalnością lekarską w
obrębie onkologii.

PODZIAŁ ZE WZGLĘDU NA
SPOSÓB NAPROMIENIANIA
brachyterapia, BTH: leczenie przy użyciu źródła
promieniowania znajdującego się w
bezpośrednim kontakcie z guzem;
teleradioterapia, RTH: leczenie z
zastosowaniem źródła umieszczonego w
pewnej odległości od tkanek.
chemioterapia: używanie syntetycznych
związków chemicznych
hormonoterapia - metoda leczenia
nowotworów, w których etiologii uczestniczą
czynniki hormonalne
Leczeniem izotopami promieniotwórczymi: (np.
jodem lub strontem radioaktywnym) zajmuje
się medycyna nuklearna.

PODZIAŁ ZE WZGLĘDU NA STAN
PACJENTA
radioterapia radykalna: ma na celu
napromieniowanie guza i/lub jego okolicy w
celu jego zniszczenia;
radioterapia paliatywna: ma na celu
łagodzenie bólu spowodowanego chorobą
nowotworową w przypadku gdy wyleczenie
pacjenta jest już niemożliwe;
radioterapia objawowa: ma na celu
zmniejszenie dolegliwości bólowych
spowodowanych przerzutami.

PODZIAŁ ZE WZGLĘDU NA UŻYTĄ
ENERGIĘ
Radioterapia konwencjonalna (60-400 kV)
Promieniowanie mało przenikliwe, płytkie,
miękkie, graniczne, wyłącznie
promieniowanie X. Do leczenia nowotworów
skóry.
Radioterapia megawoltowa (1,25-25 MeV)
Promieniowanie gamma, generowane przez
kobalt 60 (linie o energii 1,17 i 1,33 MeV).
Promieniowanie X o wysokiej energii generowane
w przyśpieszaczu liniowym. (4-25 MeV)
Elektrony (6-22 MeV)

PODZIAŁ ZE WZGLĘDU NA RODZAJ
PROMIENIOWANIA GENEROWANEGO
W APARATACH
Promieniowanie pośrednio jonizujące,
elektromagnetyczne: X i gamma
Promieniowanie cząstkowe:
bezpośrednio jonizujące: elektron, proton,
cząstka alfa, ciężkie jony (tlenu, węgla);
pośrednio jonizujące: neutron.

BRACHYTERAPIA

BRACHYTERAPIA
(curieterapia) nazywana też terapią
kontaktową jest jedną z technik leczenia w
radioterapii. Metoda ta polega na
bezpośrednim napromienianiu zmian
chorobowych przez umieszczenie źródła
promieniowania w guzie lub jego sąsiedztwie.
Podstawowym zastosowaniem brachyterapii
jest leczenie zmian nowotworowych, ale jest
ona wykorzystywana także w terapii takich
chorób jak toczeń czy keloid.

Główną przewagą brachyterapii nad teleterapią
jest jej precyzja – dzięki umieszczeniu źródła
promieniotwórczego bezpośrednio w okolicy
guza (lub nawet w jego wnętrzu) możliwa jest
tzw. konformalizacja terapii, tzn. zwiększenie
dawki, która trafia w zmianę, przy
jednoczesnym zmniejszeniu narażenia
zdrowych organów na radiację. Ma to
szczególnie wielkie znaczenie przy leczeniu
nowotworów w okolicy takich narządów
wysoce wrażliwych na promieniowanie
jonizujące jak np. płuca.

Do wad brachyterapii zaliczamy
skomplikowany proces planowania leczenia
(wymaga użycia zaawansowanych technik
komputerowych), wysokie dawki
promieniowania (dotyczy gł. metody HDR –
może to być niebezpieczne np. przy
przesunięciu się aplikatora) oraz niemożność
dotarcia aplikatora w niektóre rejony ciała
(np. wewnątrz czaszki).

Źródło promieniotwórcze w brachyterapii jest
najczęściej umieszczane w tzw. aplikatorze,
czyli plastikowej rurce, która wprowadzana
jest w bezpośrednią okolicę guza (może być
ona nawet przebijana na wylot przez ciało,
jak ma to miejsce np. w leczeniu nowotworów
piersi) i wewnątrz której umieszczane jest
źródło promieniotwórcze. Cała procedura
załadunku, w celu zmniejszenia narażenia
personelu na promieniowanie, odbywa się
automatycznie, po opuszczeniu przez
personel tzw. bunkra, czyli pomieszczenia, w
którym odbywa się sesja radioterapii.

Do rzadziej stosowanych metod brachyterapii
zaliczamy umieszczanie w ciele źródeł
stałych, np. kulek lub igieł wykonanych z
radioaktywnego izotopu jodu o krótkim
okresie półtrwania. Źródło takie jest
umieszczane w ciele pacjenta na stałe i
uszkadza komórki nowotworowe, po czym
stopniowo traci na aktywności.

ODMIANY BRACHYTERAPII
brachyterapia wewnątrztkankowa:
umieszczenie źródła promieniowania w guzie,
brachyterapia wewnątrzjamowa: umieszczenie
źródła promieniowania w bezpośrednim
sąsiedztwie guza przy użyciu naturalnych
otworów w ciele (jama ustna, drogi rodne etc.)
brachyterapia powierzchniowa: umieszczenie
źródła promieniotwórczego na skórze w celu
wyleczenia zmian powierzchniowych.
brachyterapia śródnaczyniowa: źródła
promieniotwórcze umieszczane są w
naczyniach krwionośnych aby zapobiec
restenozie.
brachyterapia śródoperacyjna

PODZIAŁ BRACHYTERAPII ZE
WZGLĘDU NA CZAS I INTENSYWNOŚĆ
NAPROMIENIOWYWANIA
HDR (
High Dose Rate – wysoka dawka) – sesja
napromieniowania trwa dość krótko (zazwyczaj kilka minut), lecz
używane jest źródło o bardzo wysokiej aktywności
.
LDR (
Low Dose Rate – niska dawka) – zabieg jest długotrwały
(najczęściej trwa około doby), lecz stosowane są źródła o znacznie
niższej aktywności promieniotwórczej. Metoda ta stosowana jest
głównie w nowotworach układu rozrodczego. Daje doskonałe efekty
terapeutyczne, lecz powoduje znaczny dyskomfort – wymaga od
pacjentki pozostania w niemal całkowitym bezruchu przez wiele
godzin.
PDR (
Pulse Dose Rate – dawka pulsująca) – aplikator jest
umieszczony w ciele pacjenta przez długi czas, lecz źródło
promieniotwórcze jest na zmianę wpuszczane do niego i wyciągane
z powrotem (cała procedura jest z góry programowana przez
człowieka i realizowana przez komputer). Dawka stosowana w PDR
ma wartość pośrednią pomiędzy tą stosowaną w HDR i LDR.
Ultra LDR - nazwa odnosi się do terapii niskoaktywnymi izotopami
umieszczanymi na stałe w ciele pacjenta.

ŹRÓDŁA RADIOAKTYWNE STOSOWANE W
BRACHYTERAPII MUSZĄ SPEŁNIAĆ
NASTĘPUJĄCE WARUNKI:
odpowiednia energia (optymalnie 0,2-0,4
MeV)
odpowiednio długi okres półrozpadu
idealnie bez rozpadu cząsteczkowego
wysoka aktywność właściwa
brak gazowych produktów rozpadu
plastyczność
odporność na uszkodzenia
odpowiednia forma
TELERADIOTERAPIA

TELERADIOTERAPIA
jedna z technik leczenia w radioterapii za pomocą
promieniowania jonizującego, w metodzie tej źródło
promieniowania umieszczone jest w pewnej odległości
od tkanek za pomocą aparatów rentgenowskich lub
urządzeń kobaltowych czy cezowych. Polega na
napromienianiu wiązkami zewnętrznymi określonej
objętości tkanek, obejmującej guz nowotworowy z
adekwatnym marginesem tkanek oraz, w razie
potrzeby, regionalne węzły chłonne. Objętość
napromieniania powinna być określona jak najbardziej
precyzyjnie, tak aby możliwe było podanie
jednorazowej dużej dawki przy maksymalnej ochronie
tkanek prawidłowych, zwłaszcza tzw. narządów
krytycznych. Służy temu proces planowania leczenia
przy użyciu TK lub MRI.

JEDNYM Z RODZAJÓW
TELERADIOTERAPII JEST TERAPIA
HADRONOWA
Wyróżniamy jej rodzaje:
terapię cząstkami naładowanymi
protonami
jonami
ujemnymi mezonami pi
terapię cząstkami neutralnymi (neutronami)
FNT - terapia szybkimi neutronami
BNCT – terapia borowo-neutronowa

TELERADIOTERAPIA JEST SKUTECZNA
JAKO LECZENIE PALIATYWNE U
PACJENTÓW Z MIEJSCOWO
ZAAWANSOWANYM RAKIEM
ŻOŁĄDKA
Grupa badawcza radioterapeutów z Singapuru
opublikowała na łamach International Journal
of Radiation Oncology, Biology, Physics
wyniki retrospektywnej analizy skuteczności
teleradioterapii jako leczenia paliatywnego u
pacjentów z miejscowo zaawansowanym
rakiem żołądka. Analiza wykazała, że ten
sposób postępowania jest skuteczny w
łagodzeniu objawów choroby. Zastosowane
leczenie było dobrze tolerowane.

Do analizy włączono pacjentów z pierwotnie lokalnie
zaawansowanym lub nawrotowym rakiem żołądka,
u których występowały dolegliwości związane z
chorobą. Pacjenci byli leczeni paliatywnie wyłącznie
przy pomocy teleradioterapii (bez chemioterapii).
Przeanalizowano dane dotyczące 33 pacjentów
leczonych w okresie od listopada 1999 r. do grudnia
2004 r. Mediana wieku pacjentów wynosiła 76 lat
(zakres od 38 do 90 lat). 21 osób (64% spośród
biorących udział w badaniu) miało przerzuty odległe
w chwili rozpoczęcia paliatywnej radioterapii.
Najczęściej zgłaszane dolegliwości to: krwawienie
(24 pacjentów), zaparcie (8 pacjentów) oraz ból (8
pacjentów). Schemat zastosowanej radioterapii był
różny u poszczególnych pacjentów (od
8 Gy w jednej frakcji do 40 Gy w 16 frakcjach), przy
czym większość osób (17) otrzymała 30 Gy w 10
frakcjach.

Mediana całkowitego czasu przeżycia wyniosła 145 dni.
8% pacjentów przeżyło 12 miesięcy. Odpowiedź
kliniczną stwierdzono u 54,3% pacjentów z
krwawieniem (13 osób spośród 24), u 25% pacjentów
z zaparciem (2 osoby spośród 8) oraz u 25%
pacjentów
z dolegliwościami bólowymi (2 osoby spośród 8).
Mediana czasu trwania odpowiedzi wynosiła przy
wymienionych wyżej objawach odpowiednio 140, 102
i 105 dni. Nie stwierdzono zależności pomiędzy
jakością odpowiedzi klinicznej i wielkością
zastosowanej dawki promieniowania. Tolerancja
leczenia była dobra – wystąpił tylko 1 przypadek
toksyczności w stopniu 3. (wg CTC).

Autorzy stwierdzają we wnioskach, że
teleradioterapia jest skuteczna jako metoda
leczenia paliatywnego u pacjentów z
miejscowo zaawansowanym rakiem żołądka.
Na uwagę zasługuje fakt, że korzystne efekty
kliniczne utrzymują się przez większość
pozostałego czasu życia pacjentów.
Źródło: Tey J, Back MF, Shakespeare TP, Mukherjee RK, Lu JJ, Lee KM, Wong LC, Leong CN, Zhu
M. The role of palliative radiation therapy in symptomatic locally advanced gastric cancer.
Int J Radiat Oncol Biol Phys 2006.11.20
SYMULATOR - OKREŚLANIE MIEJSC
BĘDĄCYCH NAŚWIETLANYCH
PROMIENIOWANIEM GAMMA

Do leczenia promieniami zewnętrznymi, jako źródło
źródła promieniowania gamma najczęściej
wykorzystuje się aparat kobaltowy (bomba kobaltowa)
wykorzystujący promieniowanie izotopu kobaltu
60
Co o
czasie połowicznego rozpadu 5,26 lat lub bomby
cezowe wykorzystujące izotop
137
Cs o czasie
połowicznego rozpadu 30 lat. Do leczenia
miejscowego niewielkich zmian nowotworowych
położonych w narządach takich jak oskrzela, przełyk,
narząd rodny, mózg używa się również źródła
irydowego, wykorzystującego izotop irydu
192
Ir o
czasie połowicznego rozpadu 73,8 lat. Do wytwarzania
wysokoenergetycznych wiązek elektronów stosuje się
akceleratory liniowe (jest to przyspieszacz czyli
urządzenie przyspieszające naładowane cząstki).
BOMBA
KOBALTOWA

CHEMIOTERAPIA

Chemioterapia nowotworów – metoda systemowego
leczenia nowotworów złośliwych za pomocą leków
cytostatycznych. W leczeniu nowotworów stosuje się
także leki hormonalne, leki celowane molekularnie
(np. erlotynib, imatinib) i przeciwciała monoklonalne.
Cytostatyki zabijają komórki dzielące się, stąd oprócz
komórek nowotworowych zabija również prawidłowe
komórki organizmu.
Leczenie systemowe za pomocą cytostatyków może być
prowadzone jedynie przez lekarzy posiadających
specjalizację z onkologii klinicznej. Leczenie musi
być prowadzone na oddziałach szpitalnych
posiadających pracownie cytostatyków oraz
odpowiednio wykwalifikowany personel.

PODZIAŁ
metoda radykalna - ma na celu całkowitą eliminację komórek
nowotworowych z organizmu, co zagwarantuje skuteczność leczenia;
stosowana głównie w leczeniu nowotworów hematologicznych, a
także guzów litych (rak jądra, ciążowa choroba trofoblastyczna),
metoda uzupełniająca - adiuwantowa - stosowana po radykalnym
zabiegu operacyjnym. Jej celem jest zlikwidowanie pozostałych po
zabiegu w postaci mikroprzerzutów komórek nowotworowych,
metoda wstępna - neoadiuwantowa, indukcyjna - stosowana przed
zabiegiem operacyjnym celem zmniejszenia masy guza i jego
regionalnego zaawansowania, co ma umożliwić przeprowadzenie
radykalnego zabiegu operacyjnego lub zabiegu mniej
okaleczającego, np. kwadrantektomia zamiast mastektomii,
metoda regionalna - stosowana w przypadku niektórych typów
nowotworów - miejscowe podawanie cytostatyków, np. do tętnicy
wątrobowej, do jamy opłucnej, do jamy otrzewnej
metoda paliatywna - stosowana w celu spowolnienia progresji
choroby lub zmniejszenia dolegliwości u chorych, u których
wyleczenie nie jest możliwe.

metoda cytotoksyczna - oddziałująca toksycznie na komórki
nowotworowe.
metoda antyangiogeniczna - oddziałująca toksycznie na sieć
naczyń krwionośnych dostarczających tlen i składniki pokarmowe
do komórek nowotworowych, a odbierających produkty przemiany
materii. Zniszczenie tych naczyń krwionośnych prowadzi do śmierci
komórek nowotworowych w wyniku braku dostawy substancji
odżywczych i tlenu. Stosowane są tu przeciwciała monoklonalne
np. bewacizumab hamujące rozwój nowych naczyń krwionośnych.
metoda metronomiczna - polegająca na podawaniu małych
dawek leków cytostatycznych w krótkich odstępach czasu.
metoda mioablacyjna z autologicznym przeszczepem szpiku
kostnego - polegająca na podaniu dużej dawki leków
cytostatycznych, w wyniku działania której poza komórkami
nowotworowymi giną również krwinki. Przed zabiegiem pobiera się
od pacjenta komórki krwiotwórcze ze szpiku kostnego. Komórki te
następnie podaje się pacjentowi po chemioterapii w celu
odtworzenia zabitych przy okazji leczenia krwinek.

W premedykacji stosowane są leki
przeciwwymiotne: ondansetron,
deksametazon, metoklopramid, tropisetron
pozwalające zmniejszyć nudności i wymioty
towarzyszące chemioterapii. Niektóre
opracowania wskazują na zalety stosowania
zawartych w marihuanie kannabinoli w
łagodzeniu negatywnych skutków takich jak
nudności i wymioty, i umożliwianiu
pacjentowi odżywianie się. Leki te wyszły już
poza fazę badań naukowych, nie są
stosowane w Polsce, mają rejestrację w USA

NOWOTWORY PRZEWODU
POKARMOWEGO
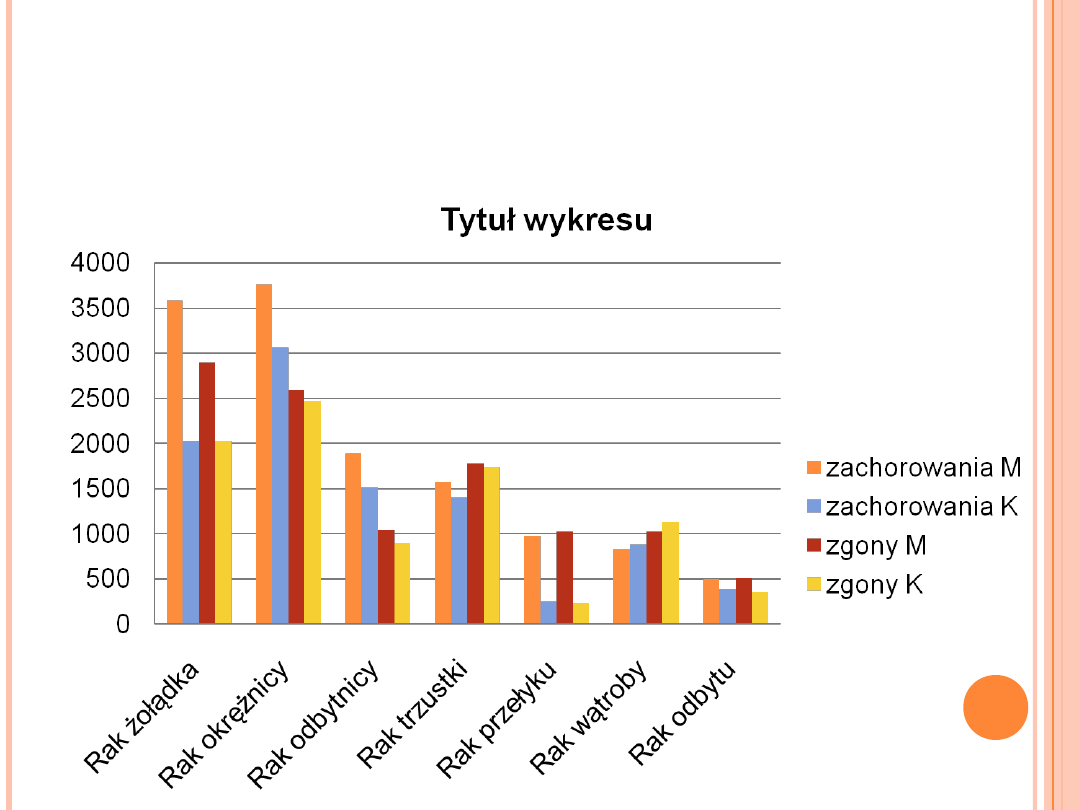
ZAREJESTROWANE ZACHOROWANIA I
ZGONY W POLSCE W 1999 ROKU
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
Leczenie uzupełniające nowotworów narządu rodnego chemioterapia, radioterapia
Radioterapia VI rok (nowa wersja2)
PODSTAWY RADIOTERAPII
Radiotelefon - pytania i odpowiedzi, AM SZCZECIN, GMDSS ( GOC ), wsio
Radioterapia egzamin
Wpływ radioterapii na stan jamy ustnej i gardła
radioteleks materialy pyt kontrolne
77 Nw 10 Radiotelefon przenosny
sciaga na radio, podstawy chemio i radioterapii
Korespondencja radiotelefoniczna - baza pytań UKE, Baza pytań PPL(A), BAZA PYTAŃ EGZAMINACYJNYCH UKE
Radioterapia
Wpływ radioterapii na jamę ustną
62 MT 04 Podzespoly radiotechniczne
ICAO 9432 RADIOTELEPHONY MANUAL
47 radiotelefon 7P6BZPMYDJSNBEK4OT2EWGFHSNU7MXKFXEQKACQ
radioterapia studenci
2 J Jassem NSCLC radioterapia chemioterapia spotkanie ekspid 20392 ppt
cb nowe radiotelefony lafajet
CB radio - jaki wybrać radiotelefon i antenę, CB RADIA
więcej podobnych podstron