
Przewodzenie
Przewodzenie
prądu przez
prądu przez
roztwory
roztwory
elektrolitów
elektrolitów
Konduktometria
Konduktometria

Przewodniki dzielimy na :
•
elektronowe
•
jonowe
W
przewodnikach elektronowych
nośnikiem
prądu są elektrony (czasem też dziury).
Przepływowi
ładunku
elektrycznego
nie
towarzyszy ruch masy, ani żadne reakcje
chemiczne.
Przewodnictwo
ich
maleje
ze
wzrostem temperatury. Należą tu metale i
półprzewodniki.
W
przewodnikach jonowych
nośnikiem prądu są
jony. Przepływowi ładunku towarzyszy ruch masy i
mogą
zachodzić
reakcje
chemiczne.
Przewodnictwo ich rośnie wraz ze wzrostem
temperatury. Należą tu kryształy o budowie
jonowej, stopione sole, zjonizowane gazy i
roztwory elektrolitów
.
e
_
+
K
+
A
-
katoda
anoda
Elektroliza
K
e
K
A
e
A
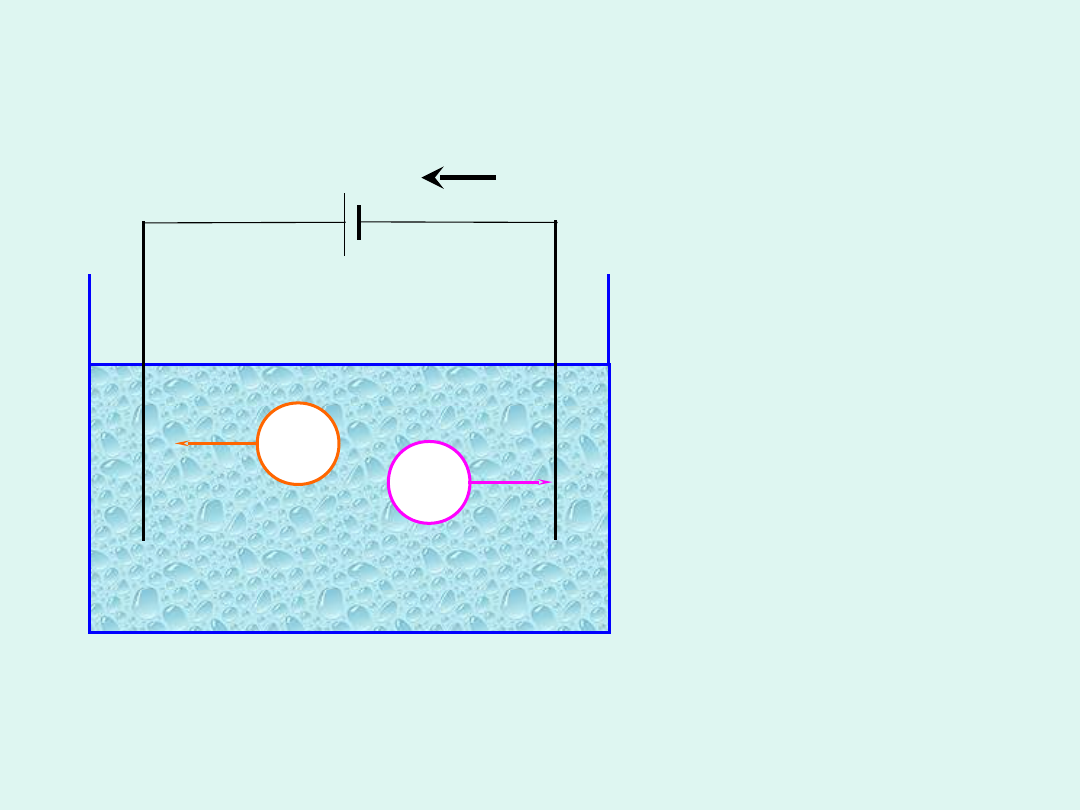
Gdy przez
roztwór
elektrolitu płynie
prąd stały, jony
wędrują do
odpowiednich
elektrod, gdzie
ulegają
rozładowaniu,
wydzielają się
rozmaite
substancje.
Zjawisko to nosi
nazwę
elektrolizy
.

Prawa elektrolizy Faraday’a
I
Masa substancji wydzielonej na
elektrodzie jest wprost proporcjonalna do
ładunku, jaki przepłynął przez roztwór.
dla prądu stałego
II
Jeżeli przez roztwory przepłynął ten
sam ładunek, to masy dwu substancji
wydzielonych na elektrodach mają się do
siebie jak ich współczynniki
elektrochemiczne.
q
k
m
t
I
k
m
const
q
gdy
k
k
m
m
2
1
2
1

Prawa Ohma
I
Natężenie prądu płynącego przez
opornik jest wprost proporcjonalne do
napięcia.
II
Opór opornika jest wprost
proporcjonalny do jego długości, a
odwrotnie proporcjonalny do jego pola
przekroju poprzecznego do kierunku
prądu.
R
I
U
R
U
I
A
l
R
– oporność (dawniej - opór właściwy) ;
l
– długość
przewodnika ;
A
– pole przekroju poprzecznego,
prostopadłego do kierunku przepływu prądu

Przewodnictwo
Oporność
Przewodność (dawniej – przewodnictwo
właściwe)
1
G
R
A
1 A
R
l
G l
1 1 l
l
G
R A
A
jednostka [
-1
= S
]
jednostka [
-1
·m
-1
= S
·m
-1
]
jednostka [
·m
]

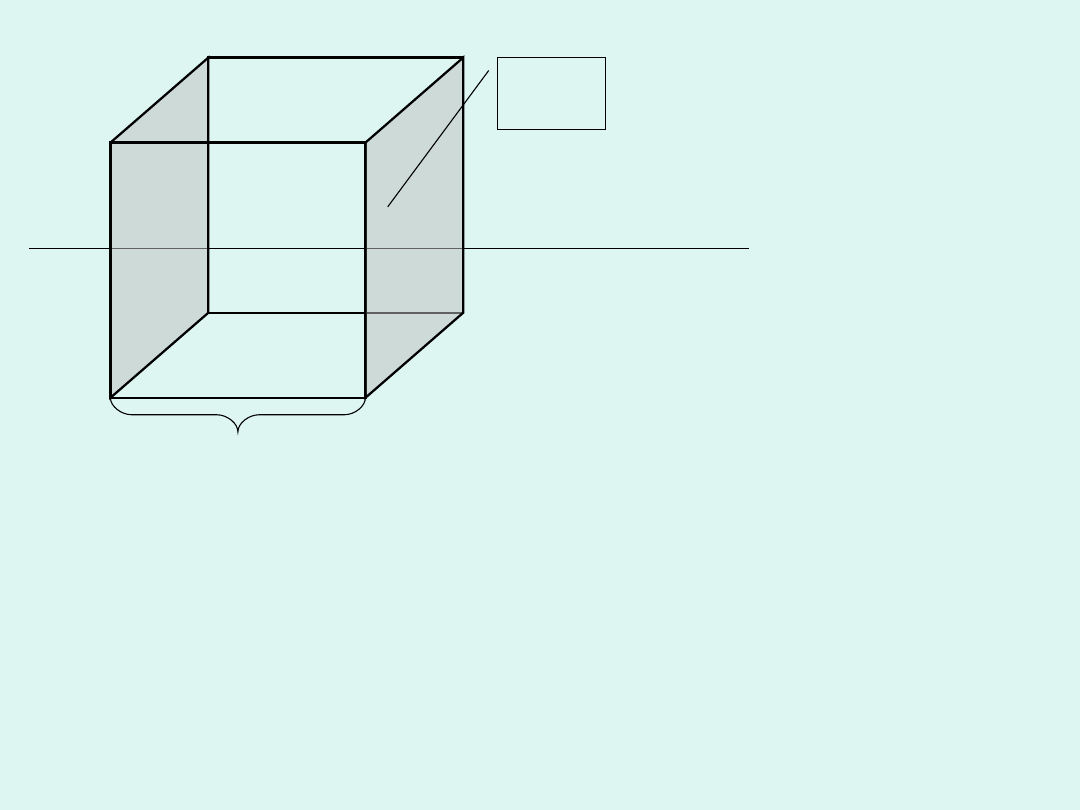
Przewodność
elektrolityczna
(dawniej - przewodnictwo właściwe
elektrolitu) jest to przewodnictwo
roztworu
elektrolitu
zawartego
pomiędzy równoległymi elektrodami
odległymi o jednostkę (1 m) i polu
przekroju poprzecznego słupa cieczy
zawartego między nimi jednostkowym
(1 m
2
), przy czym pole elektryczne
pomiędzy elektrodami jest jednorodne.
1 metr
1 m
2
kierunek
przepływu
prądu
Jako przewodność elektrolityczną rozumiemy
przewodnictwo sześcianu o boku jednostkowym,
zawierającego roztwór elektrolitu, umieszczonego w
jednorodnym polu elektrycznym.

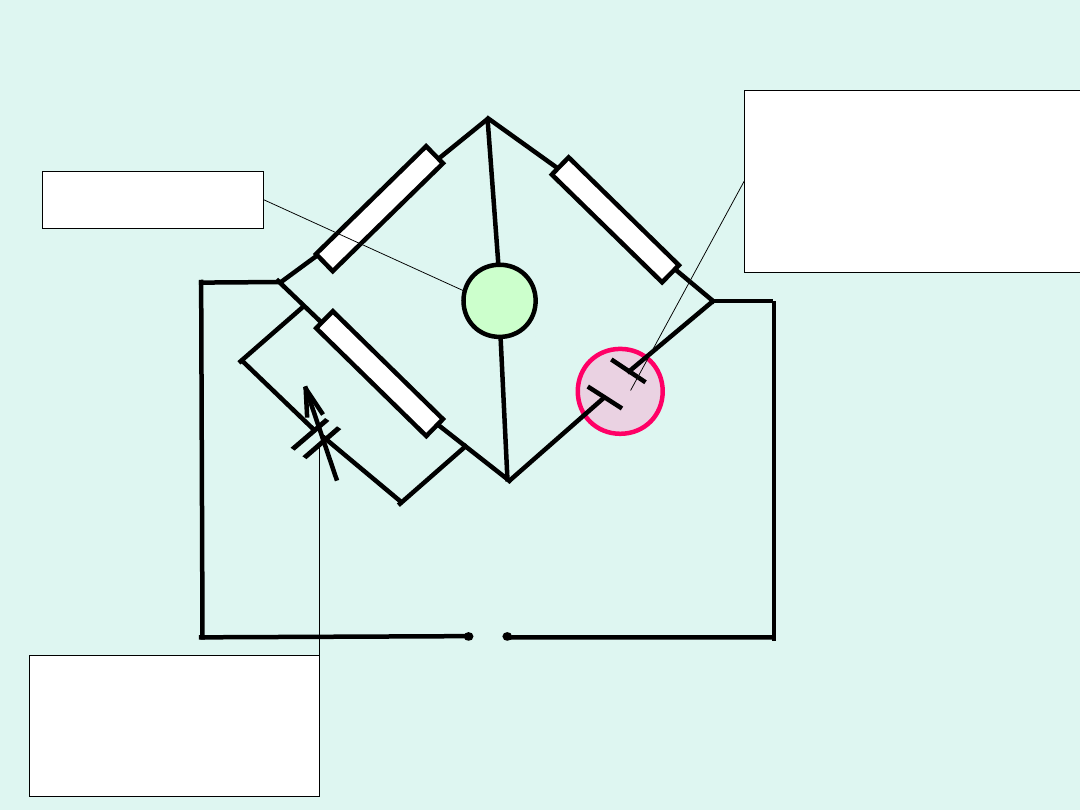
Do pomiaru przewodności elektrolitycznej używany
jest zmodyfikowany
mostek Wheatstone’a
.
Mostek ten jest zasilany prądem zmiennym (zwykle
o częstotliwości 1 kHz, aby :
•
zapobiec polaryzacji elektrod
•
zapobiec elektrolizie roztworu
W trakcie pomiarów naczynko konduktometryczne
musi być termostatowane, ponieważ przewodnictwo
roztworów rośnie silnie wraz ze wzrostem
temperatury.
Ponieważ w zmiennym polu elektrycznym naczynko
konduktometryczne wykazuje pozorny opór
pojemnościowy, to w obwód włączony jest
kondensator o zmiennej pojemności , kompensujący
pojemność elektryczną naczynka.
~
prąd zmienny o
częstotliwości
1000 Hz
naczyńko
konduktometrycz
ne
(koniecznie musi
być
termostatowane)
kondensator o
zmiennej
pojemności
galwanome
tr
A
D
C
B
C
2
R
x
R
3
R
2
R
1
C
x
G
Zmodyfikowany mostek
Wheatstone’a

Aby zmierzyć opór naczynka napełnionego badanym
roztworem elektrolitu, należy tak dobrać opory
R
1
,
R
2
i
R
3
oraz pojemność kondensatora
C
2
, aby
mostek był w równowadze. Wówczas potencjały w
punktach
B
i
A
są jednakowe i nie płynie pomiędzy
nimi
prąd
elektryczny,
co
pokazuje
nam
galwanometr
G
.
x
3
2
1
I
I
i
I
I
B
A
1 1
3 3
2 2
x x
V
V
I R
I R
I R
I R
=
�
=
=
I R
I R
I R
I R
R
R
R
R
R
R
R
R
x x
x
x
1 1
2 2
3 3
1
2
3
3
2
1
Przykładowe sondy konduktometryczne (naczynka
konduktometryczne)
Ponieważ
nie
można
określić
parametrów
geometrycznych elektrod (
l/A
) oraz pole elektryczne w
rzeczywistym naczynku nie jest jednorodne, to pomiar
przewodności elektrolitycznej wykonujemy jako pomiar
porównawczy. Stałą naczyńka ustalamy przez pomiar
oporu naczynka napełnionego wzorcowym roztworem
elektrolitu.
G
k
R
k
G
R
k
G
k
R
k
x
x
x
wz
wz
wz
wz
wz
wz
wz
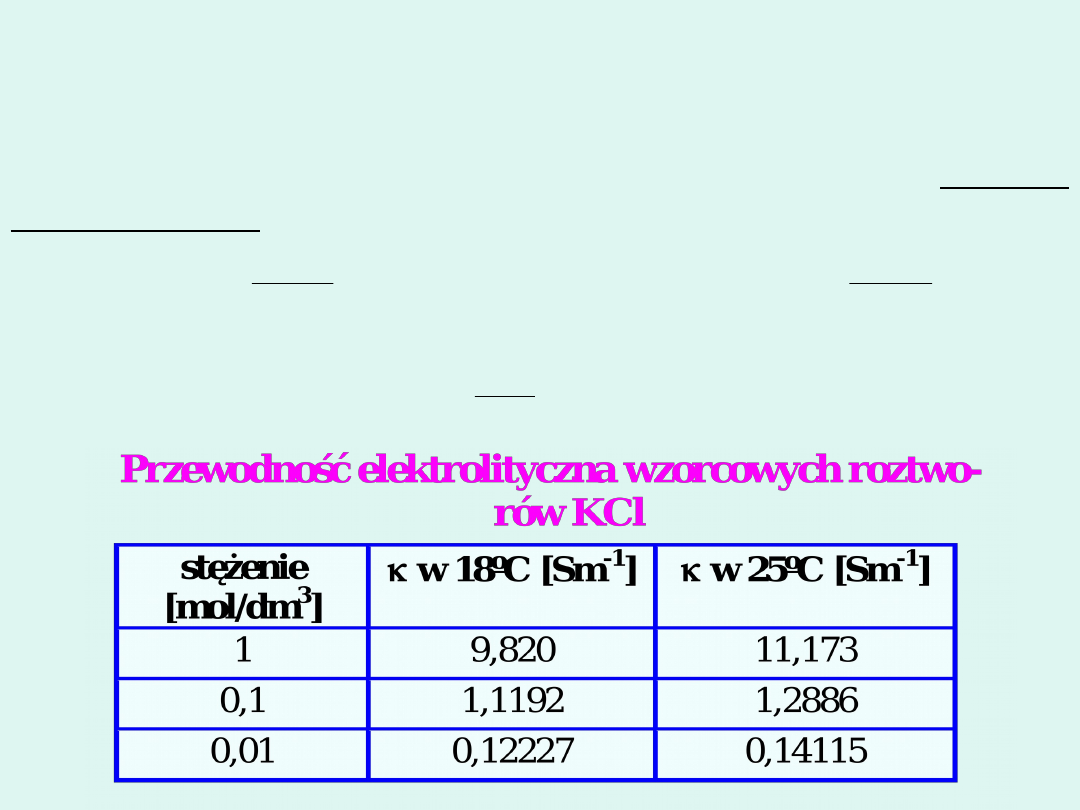
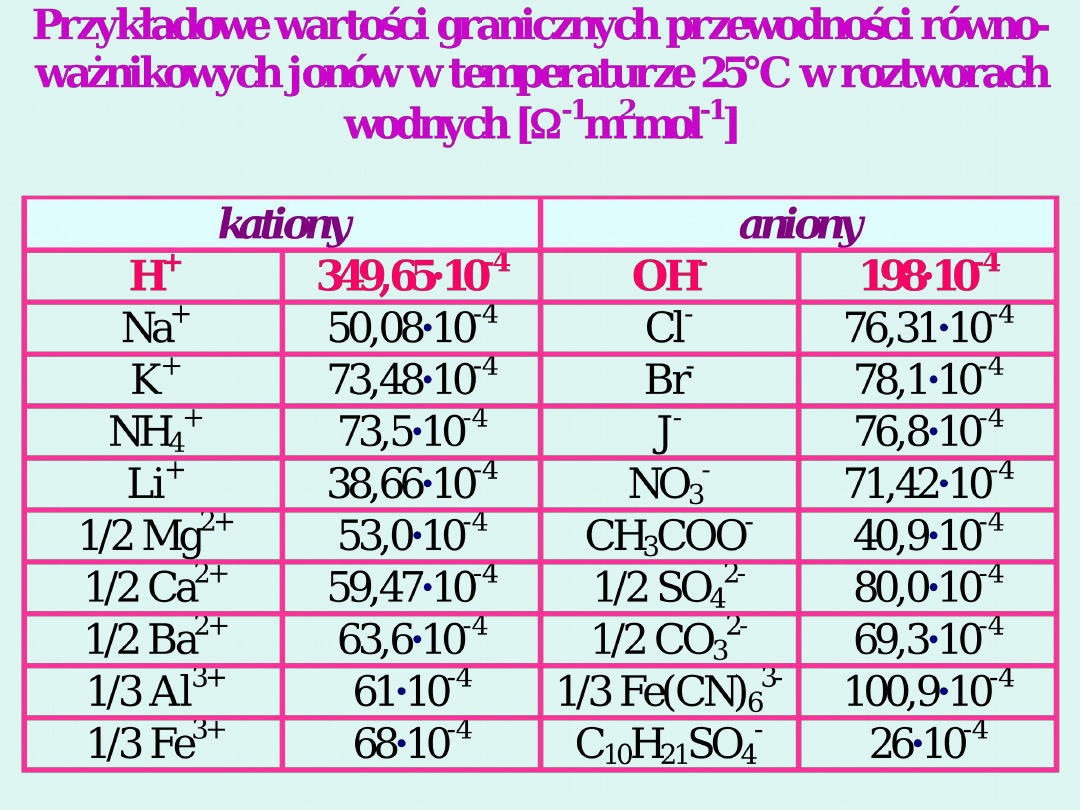
Przykłady zależności przewodności
elektrolitycznej od stężenia
Sm
-1
H
2
SO
4
NaO
H
HJ
CH
3
COOH
x10
0
20
40
60
80
100
120
140
160
0
2
4
6
8
10
12
c [mol/dm
3
]
P
rz
e
w
o
d
n
o
ś
ć
e
le
k
tr
o
li
ty
c
zn
a

Można ją obliczyć z poniższego wzoru, przy czym
stężenie podstawiamy wyrażone w mol/m
3
.
jednostka [
-1
m
2
mol
-1
= S·m
2
mol
-1
]
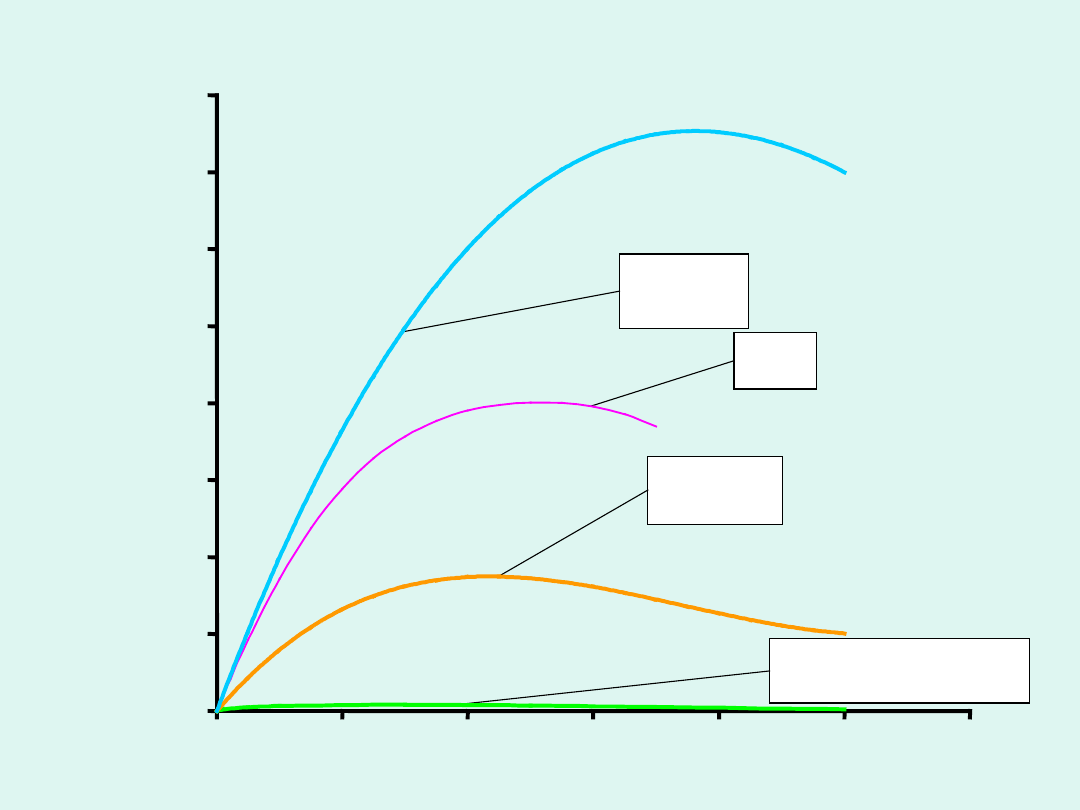
Przewodność molowa
(dawniej –
przewodnictwo
molowe)
jest
to
przewodnictwo
roztworu
elektrolitu
zawartego
pomiędzy
równoległymi
elektrodami odległymi o jednostkę (1 m) i
o takim polu przekroju poprzecznego słupa
cieczy zawartego między nimi, że w tak
utworzonej objętości zawarty jest jeden
mol elektrolitu, przy czym pole elektryczne
pomiędzy elektrodami jest jednorodne.
c
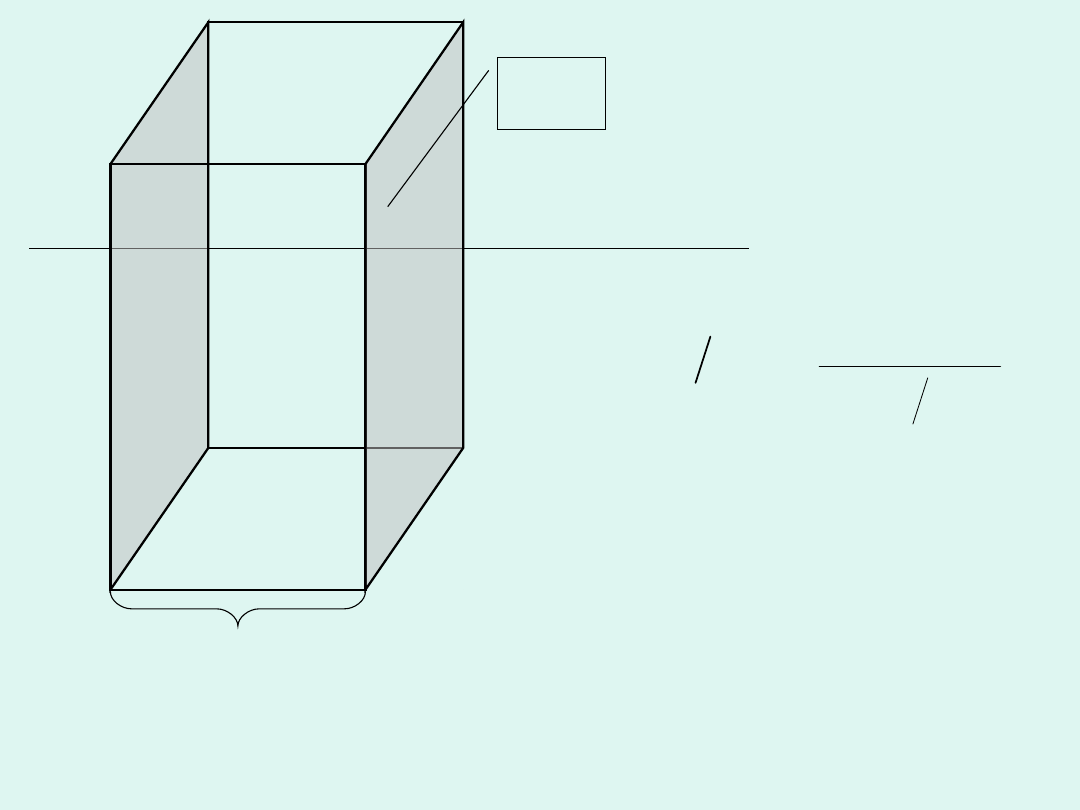
1 metr
A
kierunek
przepływu
prądu
Jako
przewodność
molową
rozumiemy
przewodnictwo
prostopadłościanu
zawierającego
roztwór
elektrolitu,
o
jednostkowej
grubości i takiej objętości, że
znajduje się w niej 1 mol
elektrolitu, umieszczonego w
jednorodnym
polu
elektrycznym.
3
3
1
1 A V m mol
c mol m
�
�
� =
=
�
� �
�
�
�

Przewodność
równoważnikowa
eqv
(dawniej – przewodnictwo równoważnikowe)
jest to przewodnictwo roztworu elektrolitu
zawartego
pomiędzy
równoległymi
elektrodami odległymi o jednostkę (1 m) i o
takim polu przekroju poprzecznego słupa
cieczy zawartego między nimi, że w tak
utworzonej objętości zawarty jest jeden
gramorównoważnik elektrolitu, przy czym pole
elektryczne
pomiędzy
elektrodami
jest
jednorodne.

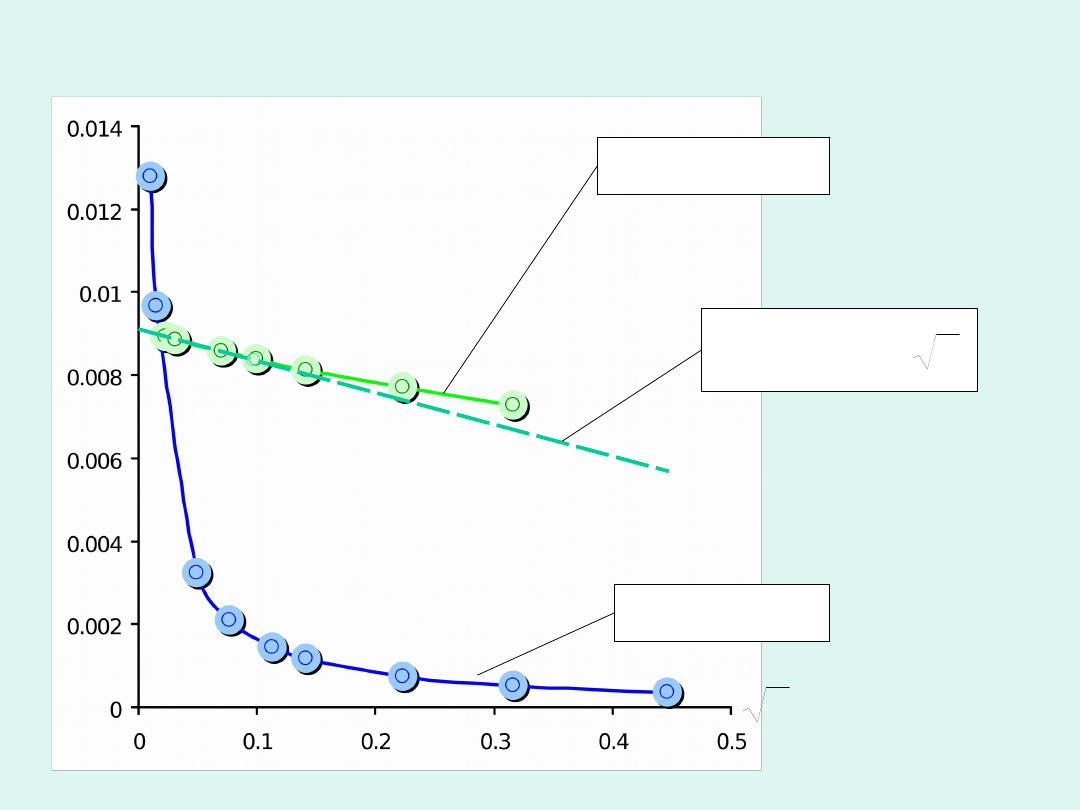
Dla mocnych elektrolitów przewodność
molowa zależy od stężenia w sposób, który
można opisać
wzorem Kohlrascha
.
c
b
o
o
– graniczna przewodność molowa
b
– stała
Powyższy wzór jest słuszny dla roztworów o
stężeniu nie przekraczającym 0,01 mol/dm
3
.

Graniczna
przewodność
molowa
(równoważnikowa)
o
(
eqv,o
) to przewodność
molowa (równoważnikowa) w rozcieńczeniu
nieskończenie wielkim (gdy stężenie dąży do
zera).
Dla mocnych elektrolitów
o
można
wyznaczyć przez ekstrapolację zależności
podanej przez Kohlrauscha do stężenia
zerowego.
[Sm
2
mol
-
1
]
o
CH
3
COO
H
CH
3
COON
a
[(mol/dm
3
)
1/2
]
c
c
b
o
Przykładowe zależności przewodności
molowej od pierwiastka ze stężenia
mocny
elektrolit
słaby elektrolit

Jony w roztworze w polu elektrycznym
wędrują niezależnie od siebie, a
przewodnictwo roztworu elektrolitu
jest sumą przewodnictw pochodzących
od poszczególnych jonów (kationów i
anionów).
Prawo niezależnej wędrówki
jonów Kohlrauscha
F
el
F
Gdy jon porusza się ruchem jednostajnym, to siły
działające na niego się równoważą czyli siła
oporu lepkiego jest równa sile elektrycznej.
E
e
z
F
i
el
i
i
v
r
6
F
i
i
i
i
i
i
el
r
6
e
z
E
v
v
r
6
eE
z
F
F
E
– natężenie pola elektrycznego ;
e
– ładunek
elementarny ;
– lepkość rozpuszczalnika ;
r
i
–
promień jonu ;
v
i
– szybkość poruszania się jonu
Ruchliwość jonu
Ruchliwość jonu
to szybkość poruszania
się jonu w polu elektrycznym o natężeniu
jednostkowym.
E
v
u
i
i
jednostka [
m
2
/V·s
]
Ruchliwość jonu powiązana jest z
przewodnością równoważnikową jonu.
i
i
eqv
u
F
,
Ruchliwość jonu zależy jego ładunku, promienia
hydrodynamicznego czyli razem z jego warstwa
solwatacyjną, lepkości rozpuszczalnika, a pośrednio
od temperatury, gdyż lepkość cieczy maleje wraz ze
wzrostem temperatury.
i
i
i
r
6
e
z
u
W wodzie jony powstałe z jej autodysocjacji (H
+
i OH
-
)
wyróżniają się wysoką ruchliwością, co wskazuje, że
ich mechanizm migracji jest inny niż pozostałych
jonów.
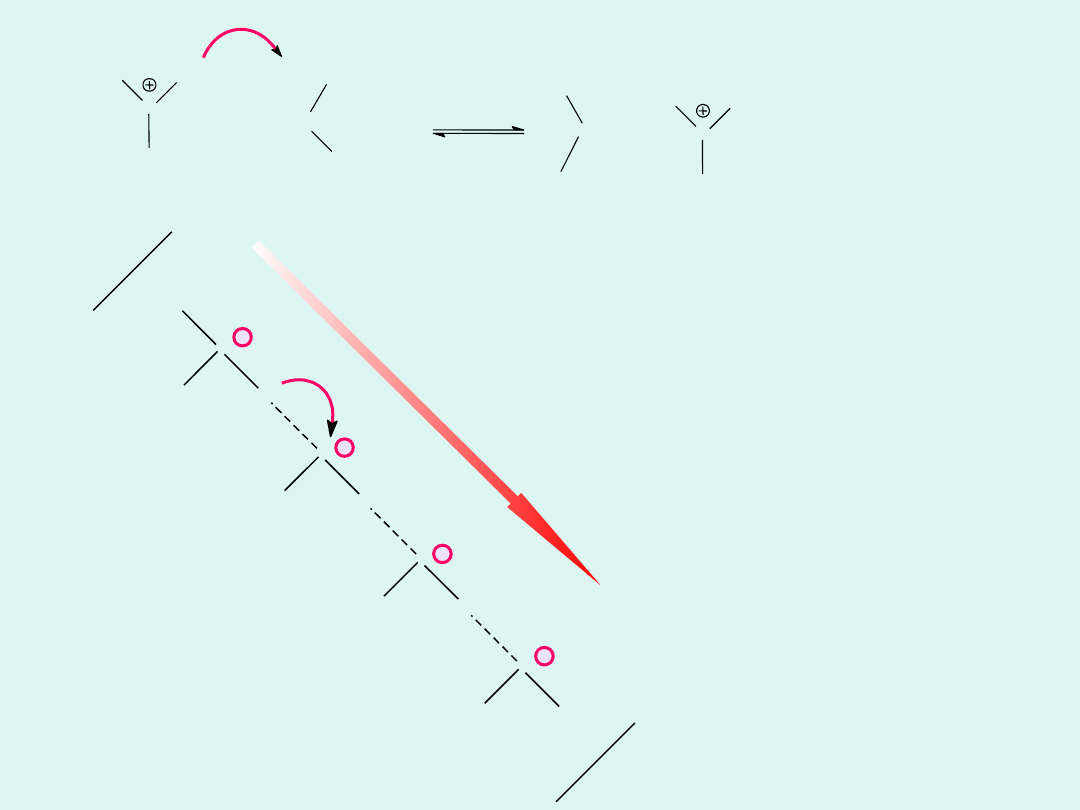
Mechanizm
łańcuchowy
transportu
jonów
wodorowych w
wodzie
O
H
H
O
H
H
O
H
H
O
H
H
H
H
+
_
+
+
+
+
+
+
O
H
H
H
+
O
H
H
H
O
H
H
H
+
O
H
H
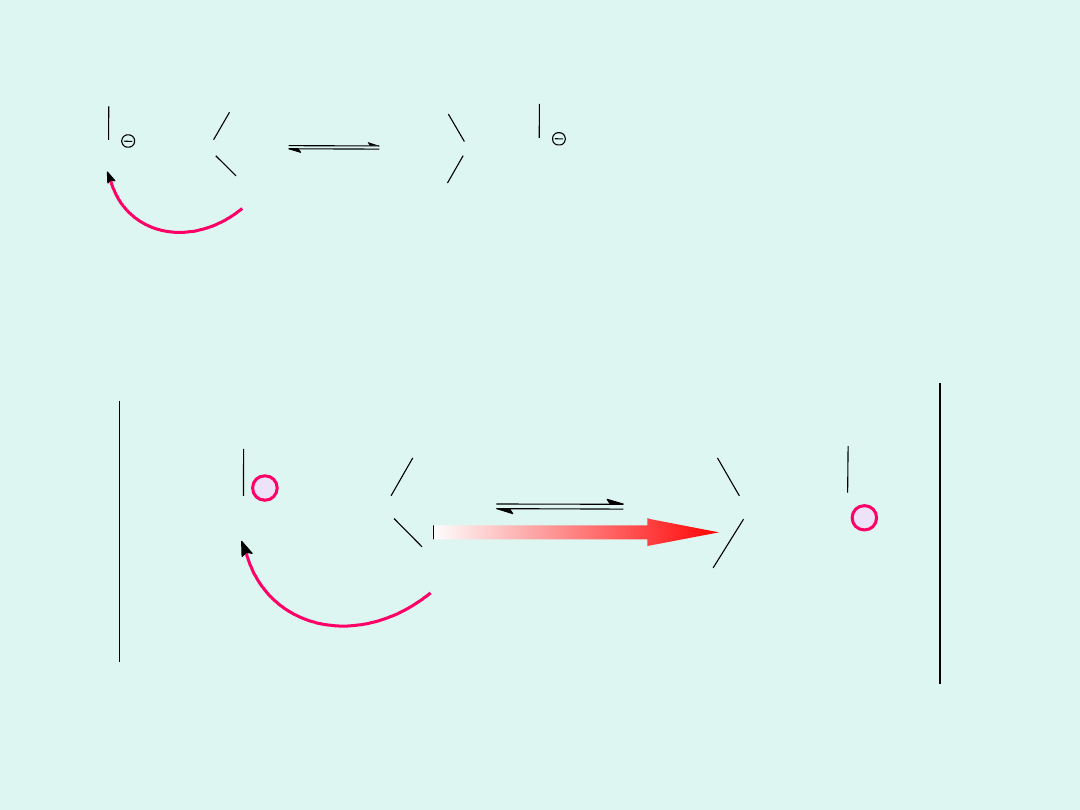
+
O
H
H
H
+
O
H
O
H
+
O
H
H
+
_
+
O
H
H
H
+
O
H
O
H
+
O
H
H
-
-
Mechanizm
transportu
jonów
wodorotlenowyc
h w wodzie

Liczby przenoszenia jonów
Liczby przenoszenia jonu mówią, jaki ułamek
ładunku został przeniesiony przez jony danego
znaku.
Liczba przenoszenia jonu
to stosunek
ładunku przeniesionego przez jony danego znaku
do całkowitego ładunku przeniesionego przez
roztwór.
+
Q
Q
t
t
t
t
1
Q
Q
+
-
+
-
-
=
=
+ =
Znajomość liczb przenoszenia jest niezbędna do
wyznaczenia
przewodności
molowych
(równoważnikowych) jonów.
eqv,
eqv,
eqv
eqv
t
t
t
t
+
-
+
-
+ +
- -
+
-
l
l
=
=
L
L
n l
n l
=
=
L
L
Metody wyznaczania liczb
przenoszenia :
•
Metoda Hittorfa
•
Metoda ruchomej granicy
Żeby wyznaczyć przewodności równoważnikowe
jonów należy wyznaczyć przewodność
równoważnikową elektrolitu i liczby przenoszenia
jonów w nim.
Wykorzystanie pomiarów
konduktometrycznych
•
Wyznaczanie iloczynu
rozpuszczalności soli trudno
rozpuszczalnych
•
Wyznaczanie iloczynu
jonowego wody
•
Wyznaczanie stałych
dysocjacji słabych
elektrolitów
•
Miareczkowanie
konduktometryczne
Omawiane
na
ćwiczeniach
rachunkowy
ch –
obowiązuje
do
egzaminu !

Miareczkowanie konduktometryczne polega na
wyznaczaniu punktu równoważnikowego pośrednio
poprzez pomiar przewodnictwa. W tym celu do
próbki dodajemy porcjami roztwór titranta i po
każdym
dodaniu
mierzymy
przewodnictwo
roztworu.
Podstawą metody jest prawo niezależnej wędrówki
jonów Kohlrauscha.
W czasie miareczkowania, na skutek zachodzącej
reakcji chemicznej zmienia się stężenie i rodzaj
jonów
w
roztworze,
co
powoduje
zmiany
przewodnictwa.
Metodę
miareczkowania
konduktometrycznego
można wykorzystać do miareczkowań kwasowo-
zasadowych,
strąceniowych
i
kompleksometrycznych.
Miareczkowanie
konduktometryczne
i
i
i
c
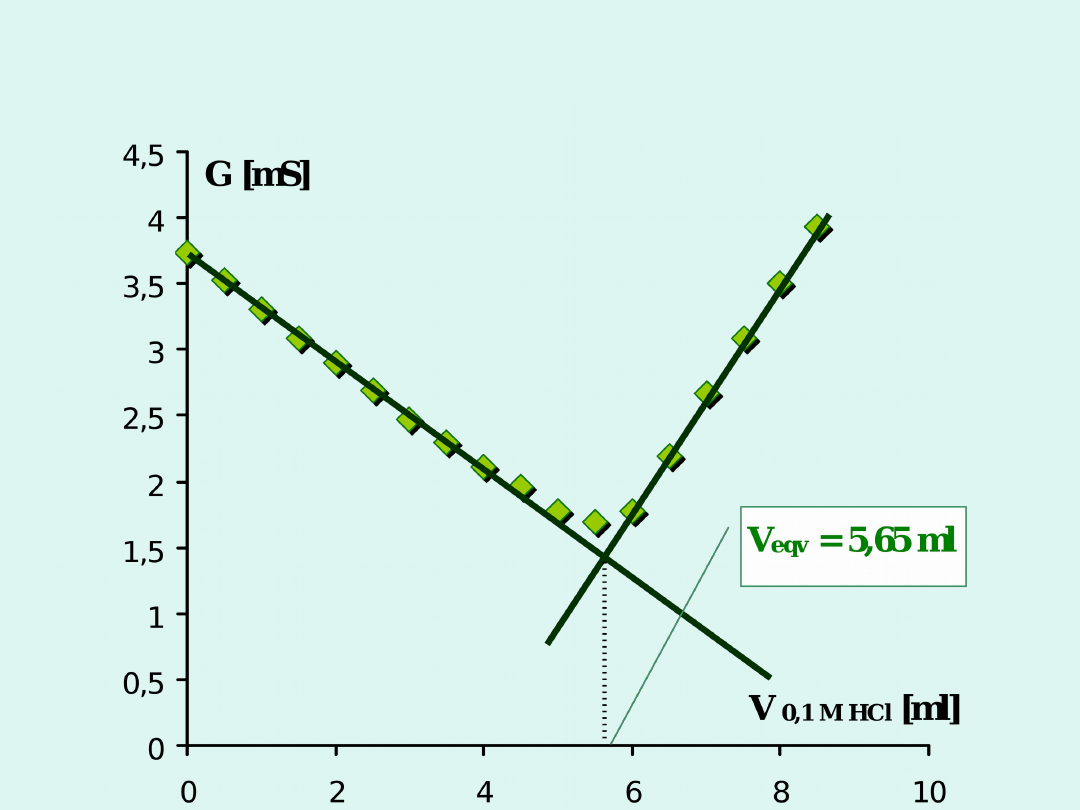
Miareczkowanie mocnej zasady (NaOH) mocnym
kwasem (HCl)
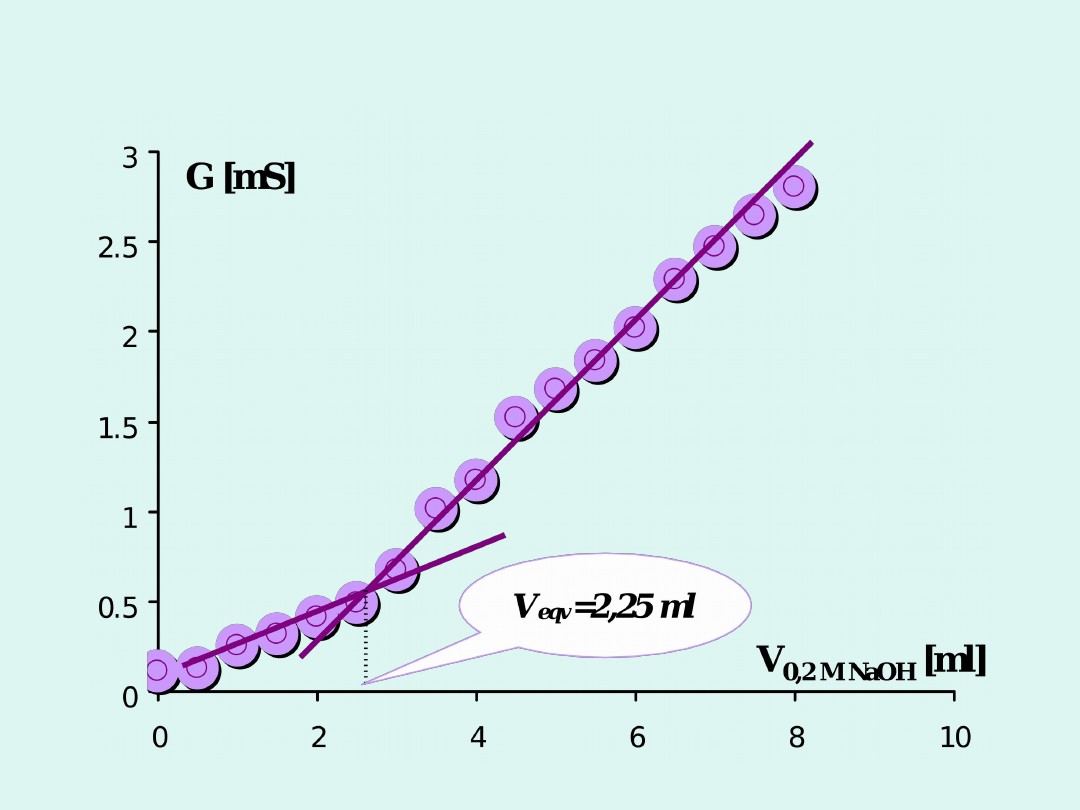
Miareczkowanie słabego kwasu (CH
3
COOH)
mocną zasadą (NaOH)
Zastosowania praktyczne
pomiarów konduktometrycznych
Badanie jakości wody
Przewodność elektrolityczna wody pitnej
zgodnie z prawem nie może przekraczać
2500 S/cm czyli 0,25 S/m w 20ºC.
Badanie jakości mleka (oznaczanie
zawartości tłuszczu, skwaśnienia mleka,
sygnalizacja mastitis – zapalenia wymion)
klasa
czystoś
ci
I
II
III
IV
V
[S/cm]
500
1000 1500 2000 >200
0
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
13 Konduktometria 2id 14683 ppt
13 konwertery 3id 14690 ppt
13 Konduktometriaid 14682 ppt
11 3id 12114 ppt
009 Dystrybucja 3id 2475 ppt
06 podstawy SQL 3id 6524 ppt
02 3id 3357 ppt
13 Konduktometriaid 14681 Nieznany (2)
(2698) makroekonomia cz1 3id 980 ppt
13 Planowanie finansoweid 14736 ppt
13 wykład aminokwasyIIid 14508 ppt
1 3id 8354 ppt
(10) Uczenie się pojęć 3id 789 ppt
03 Komunikacja marketingowa 3id 4172 ppt
więcej podobnych podstron