
Czynniki mutagenne i
teratogenne

CO TO JEST MUTACJA ?
• Zmiana która zaszła w materiale genetycznym.
• Jeśli zmiana ta dotyczy DNA komórki somatycznej,
to jej efektem może być zmiana fenotypu (np. w
efekcie mutacji somatycznej może dojść do
transformacji nowotworowej komórki).
• Jeżeli zmiana dotyczy gamet, to może być ona
przekazywana z pokolenia na pokolenie.
• Innym termin określający mutacje genowe to
„MUTACJE PUNKTOWE”.

PODZIAŁ MUTACJI
• Mutacje punktowe = genowe
–
zmiana / uszkodzenie dotyczy
pojedynczego genu, często w wyniku
zamiany tylko jednej pary zasad.
• Mutacje chromosomowe
– dotyczą
zmiany struktury chromosomów.
• Mutacje genomowe
– dotyczą liczby
zaburzeń chromosomów

• Mutacje spontaniczne
– są wynikiem błędu
w procesie replikacji, są one jednak bardzo
rzadkie (1 na miliard). Dokładność procesu
replikacji jest zawdzięczana zdolności
korektorskiej jednej z podjednostek
polimerazy DNA. Usunięcie tej podjednostki
powoduje 1000 krotne podwyższenie poziomu
mutacji spontanicznych.
• Mutacje indukowane
– są wynikiem działania
związków mutagennych. Mutageny dzielimy
na trzy grupy:
mutageny fizyczne, chemiczne
i biologiczne
.
PODZIAŁ MUTACJI
II

• Mylne wstawienie zasady w czasie procesu
replikacji
– jest to zjawisko które zachodzi
bardzo rzadko, średnio częstość mutacji w
jednym cyklu replikacji w przeliczeniu na
jedną parę nukleotydów wynosi 10
-9
. Jednak
częstość różnych par zasad w tym samym
genie może znacznie się różnić. W genie
mogą występować sekwencje które mutują
znacznie łatwiej od innych.
• Ślizganie się polimerazy
– może mieć
miejsce gdy w DNA występują długie
powtórzenia tych samych par zasad.
• Modyfikacje chemiczne zasad w DNA –
jest to
proces zachodzący samorzutnie i bez udziału
mutagenów.
MOLEKULARNE MECHANIZMY POWSTAWANIA
MUTACJI SPONTANICZNYCH U CZŁOWIEKA

Rodzaje mutacji punktowych:
– Substytucje:
• TRANZYCJE
– zamiana
puryny
na
purynę
lub
pirymidyny
na
pirymidynę
A » G T » C
G » A C » T
• TRANZWERSJE
- zamiana
puryny
na
pirymidynę
lub odwrotnie
A » C or T T » A or G
G » C or T C »A or G

– Mutacje powodujące przesunięcie
RAMKI ODCZYTU
• INSERCJE
– wstawienie (jednej lub kilku par
zasad) do łańcucha DNA.
• DELECJE
–wypadnięcie (jednej lub kilku par
zasad) z łańcucha DNA.

MUTAGENY
MUTAGENY
• Fizyczne
(promieniowanie)
• Chemiczne
(różne związki
chemiczne)
• Biologiczne
(wirusy)

• promieniowanie jonizujące
(X, neutrony,
promieniowanie kosmiczne) jest to
promieniowanie wysokoenergetyczne, które
przenikając przez środowisko powoduje
jonizację napotkanych atomów. Najbardziej
wrażliwe są tkanki o komórkach intensywnie
dzielących się.
Fizyczne
Fizyczne

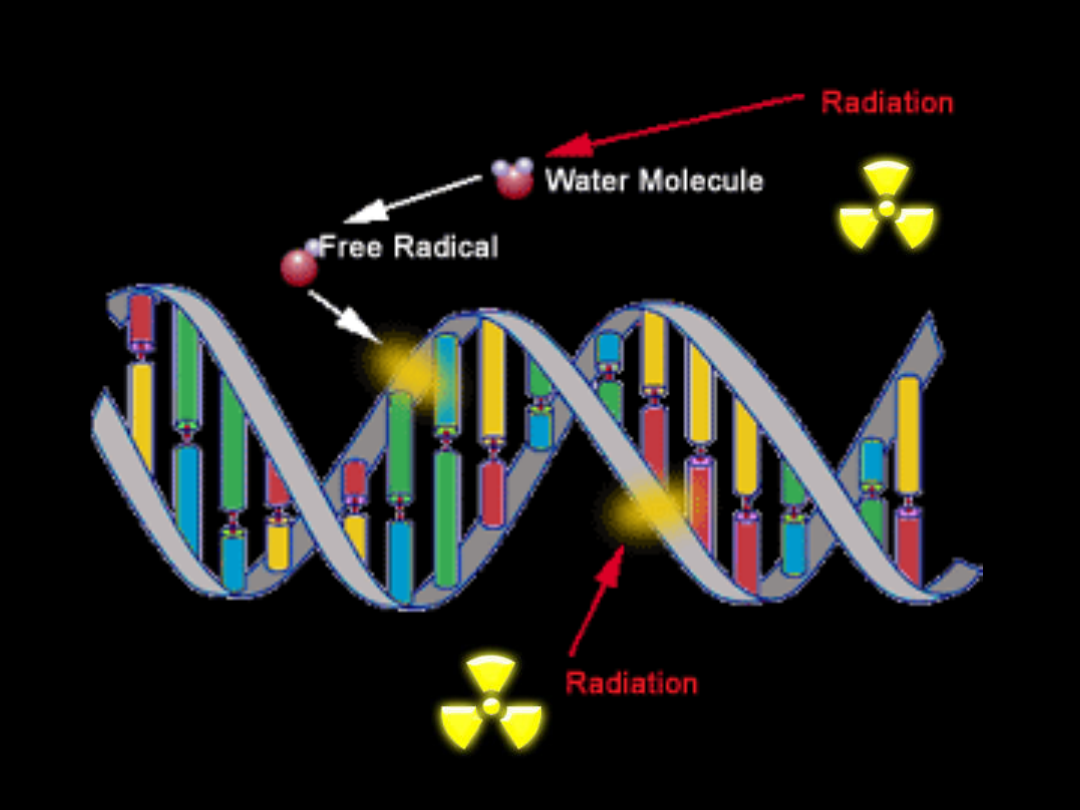
• jeśli wolny rodnik przyłączy się do zasady –
osłabienie wiązania, wypadnięcie nukleotydu
• przyłączenie do grupy fosforanowej – pęka
nić DNA. Jeżeli dzieje się tak po obydwu
stronach, może pęknąć cały chromosom .
Promieniowanie jonizujące
Promieniowanie
jonizujące
powoduje
powstawanie
wolnych
rodników.

promieniowanie UV
emituje fale
pochłaniane przez DNA (~ 260nm), większa
długość fali = mniejsza energia, a tym
samym mniejsza zdolność przenikania przez
tkanki.
Nie powoduje jonizacji ale wzbudza
atomy.
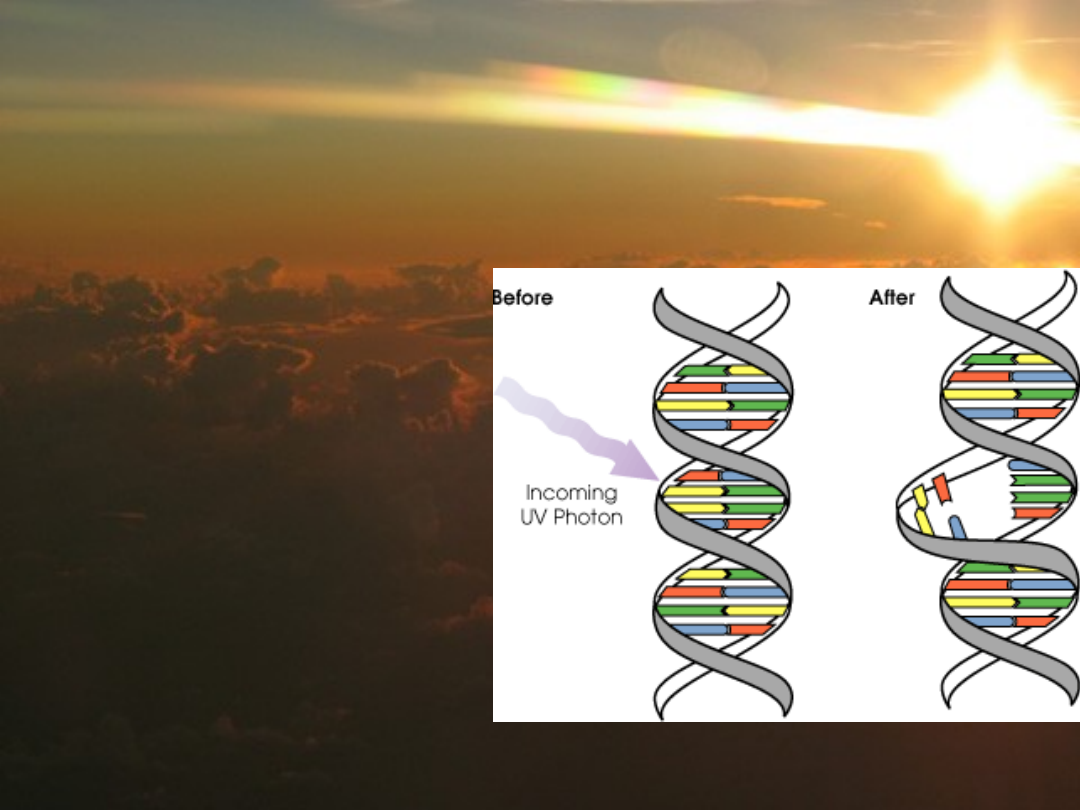
Promieniowanie UV
Promieniowanie UV
• powstają dimery
pirymidynowe
(głównie T-T)
• powstają wiązania
DNA z białkami
• rzadziej: pękanie
pojedynczych nici

• analogi zasad
• związki
alkilujące
• związki
nitrozowe
• barwniki
akrydynowe
• nitropireny
• pestycydy
Chemiczne
Chemiczne
• metale ciężkie
• aromatyczne
węglowodory
wielopierścieniow
e
• leki
przeciwnowotwor
owe
• inne leki
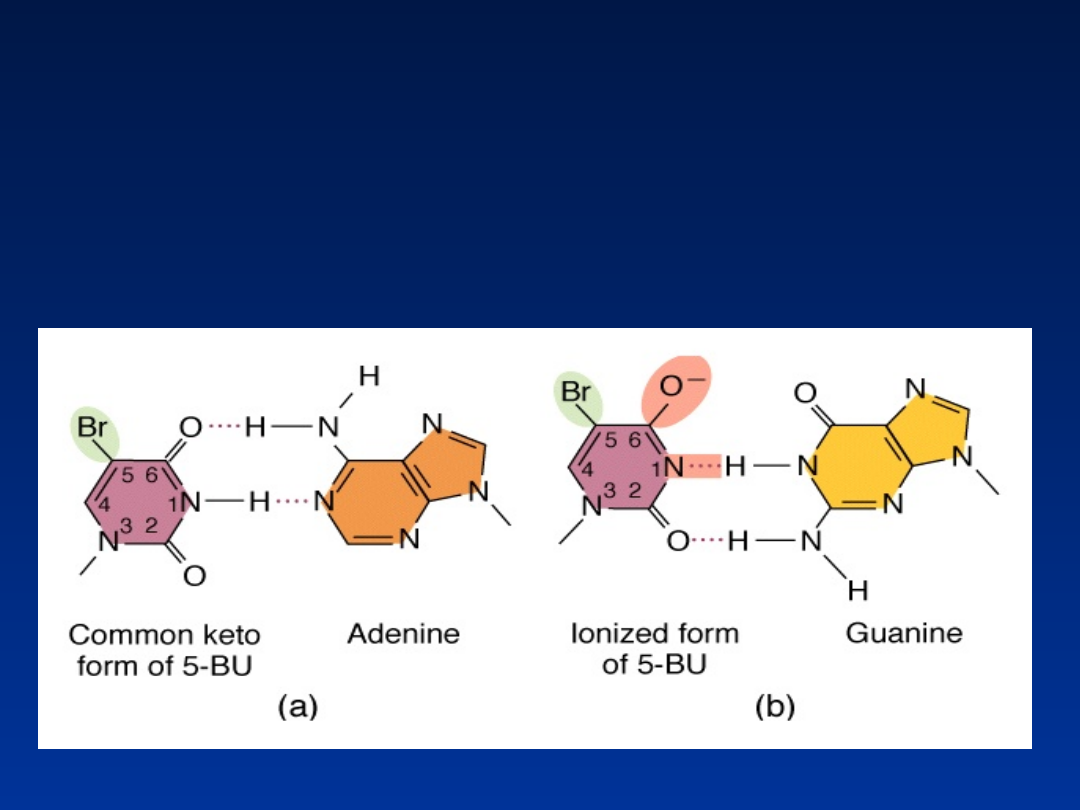
Analogi zasad
Analogi zasad
5-bromouracyl
– analog tyminy, wiąże się z
guaniną zamiast z adeniną
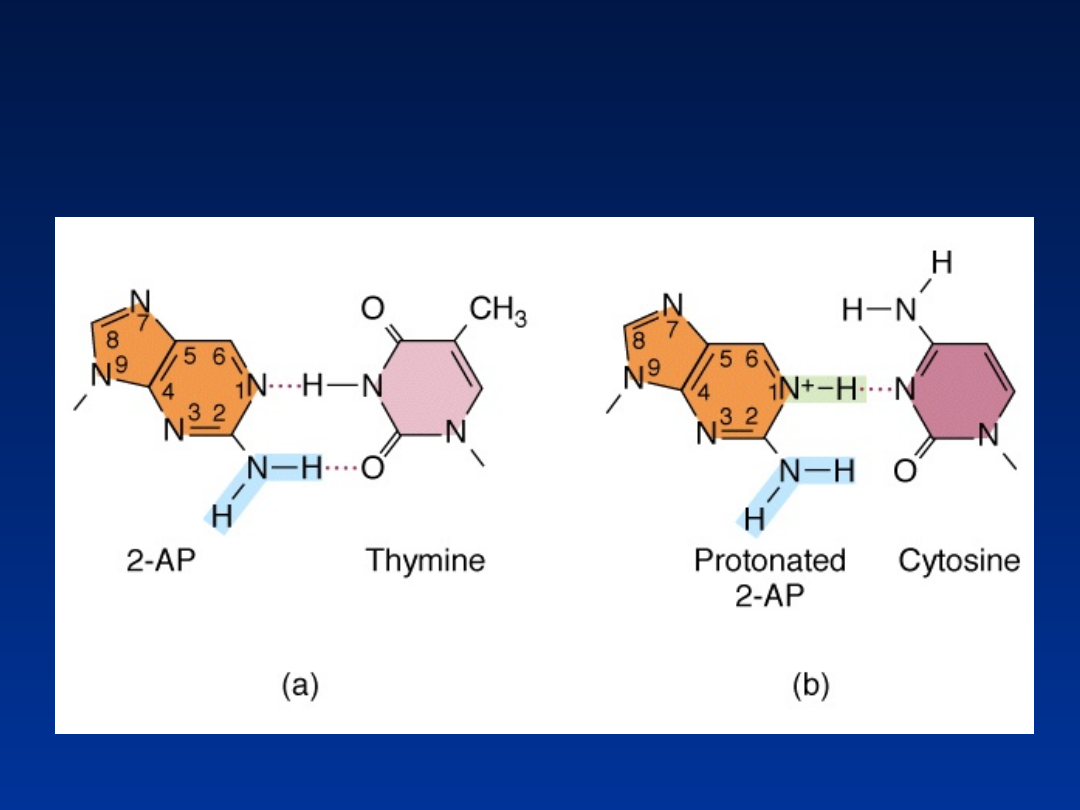
2-aminopuryna
– analog adeniny, wiąże się z
cytozyną zamiast z tyminą

Związki alkilujące
Związki alkilujące
Powodują przyłączanie dodatkowych rodników
alkilowych do DNA. (najczęściej do guaniny –
związki jednofunkcyjne). Następuje wycinanie
zmodyfikowanych zasad przez endonukleazy
lub specyficzne glikozylazy DNA – miejsce
apurynowe, apirymidynowe
lub transwersje (A-
C, C-T, T-G)
• Alkilacja grupy fosforanowej
– pękanie
łańcucha DNA (związki jednofunkcyjne)
• Alkilacja zasad
– wiązanie krzyżowe w obrębie
1 lub dwóch nici (związki dwufunkcyjne)
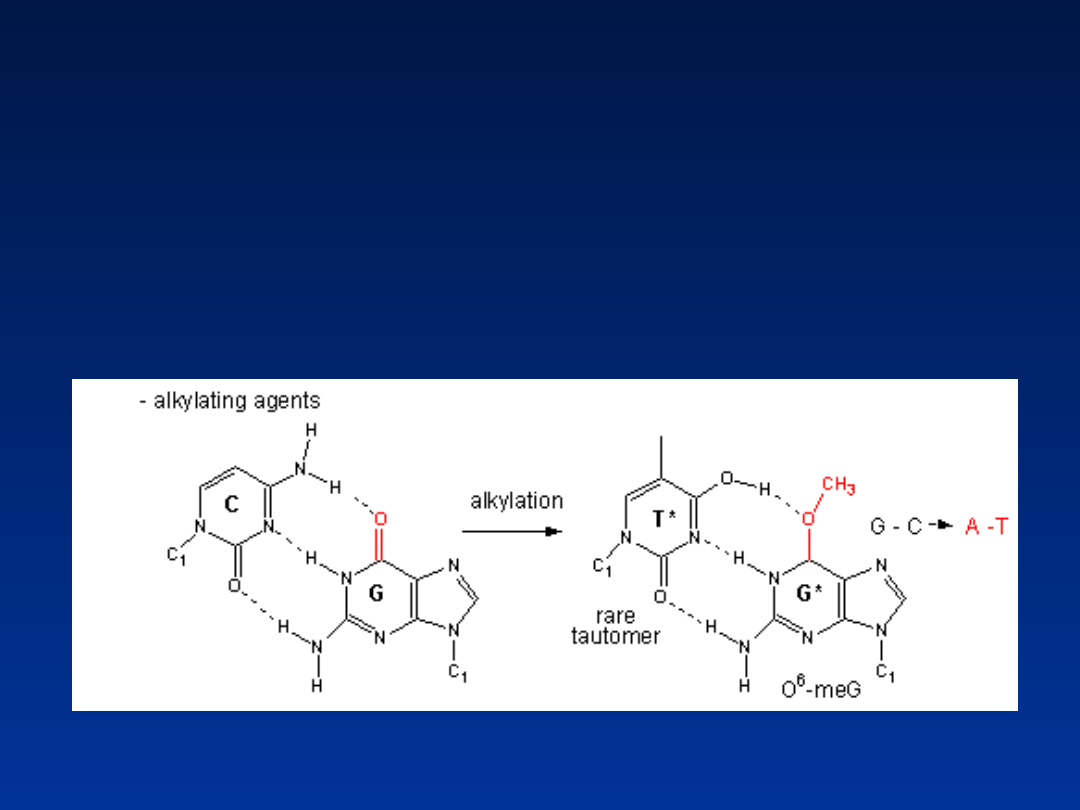
dwufunkcyjne
• iperyt azotowy
• busulfan
• cyklofosfamid
jednofukcyjne:
• sulfonian
dwumetylowy
• sulfonian
etylometylowy
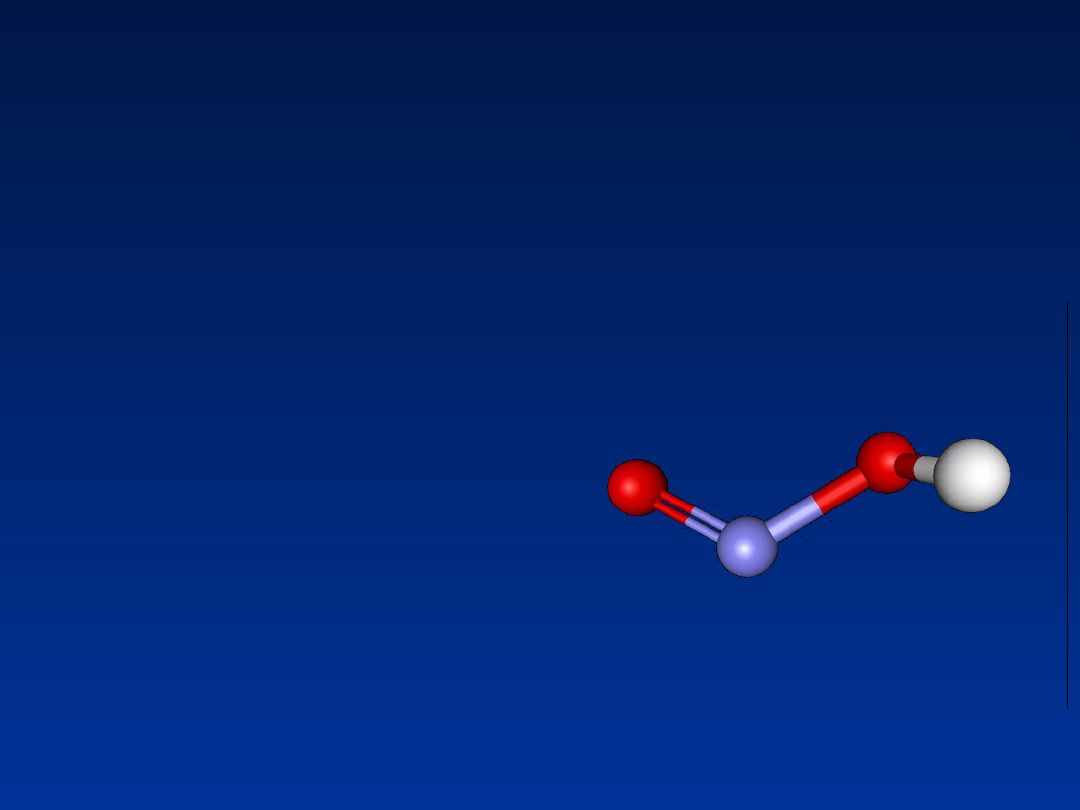
Związki nitrozowe (HNO
Związki nitrozowe (HNO
2
2
)
)
Powodują dezaminację DNA i RNA
zamieniając:
cytozynę w uracyl
guaninę w ksantynę
(para z cytozyną)
adeninę w hipoksantynę
(para z cytozyną)
HNO
2
Barwniki akrydynowe
Barwniki akrydynowe
• bromek etydyny
• oranż
akrydynowy
• proflawina
• akryflawina
• quinakryna
Interkalują w DNA zniekształcając
matrycę – wypadnięcie lub
dostawienie zasady podczas
replikacji.
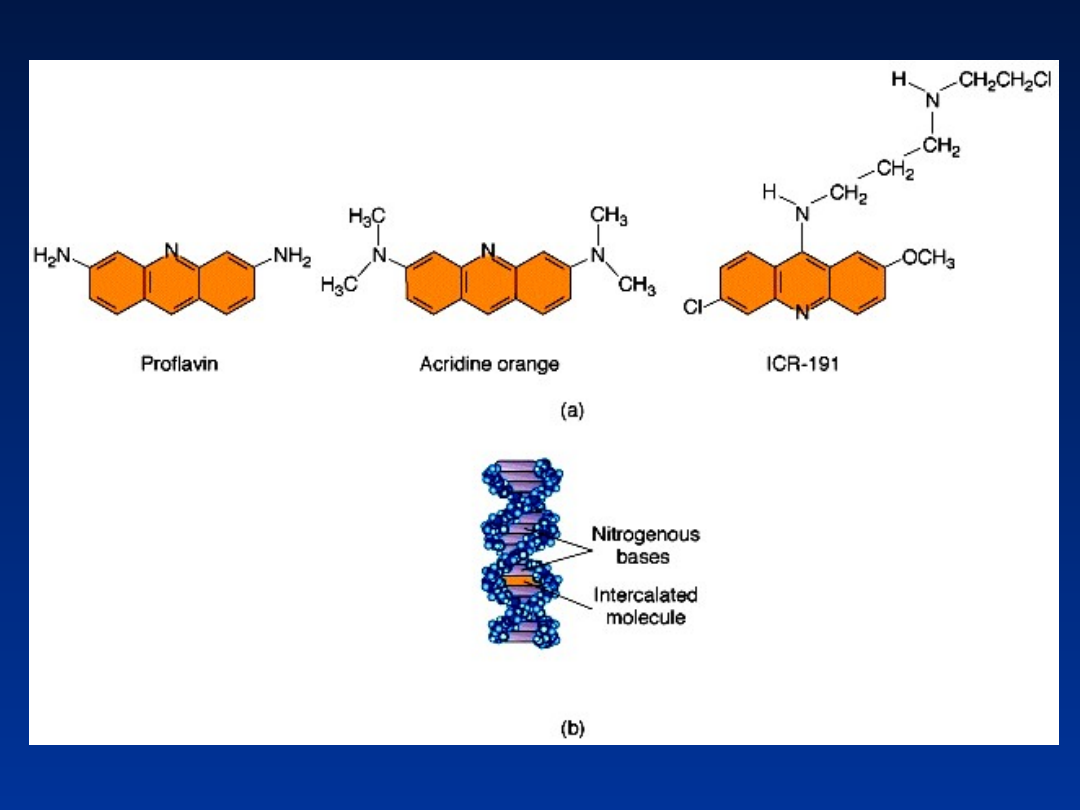

Leki o działaniu
Leki o działaniu
mutagennym -
mutagennym -
leki przeciwnowotworowe
leki przeciwnowotworowe
Mechanizm działania:
- Hamowanie replikacji
- Destrukcja DNA
- Hamowanie syntezy białek
- Niszczenie struktur
komórkowych
• syntezy
dezoksyrybonukleotydó
w – 5-fluorouracyl
• niszczenie wrzeciona
kariokinetycznego
(kolchicyna)
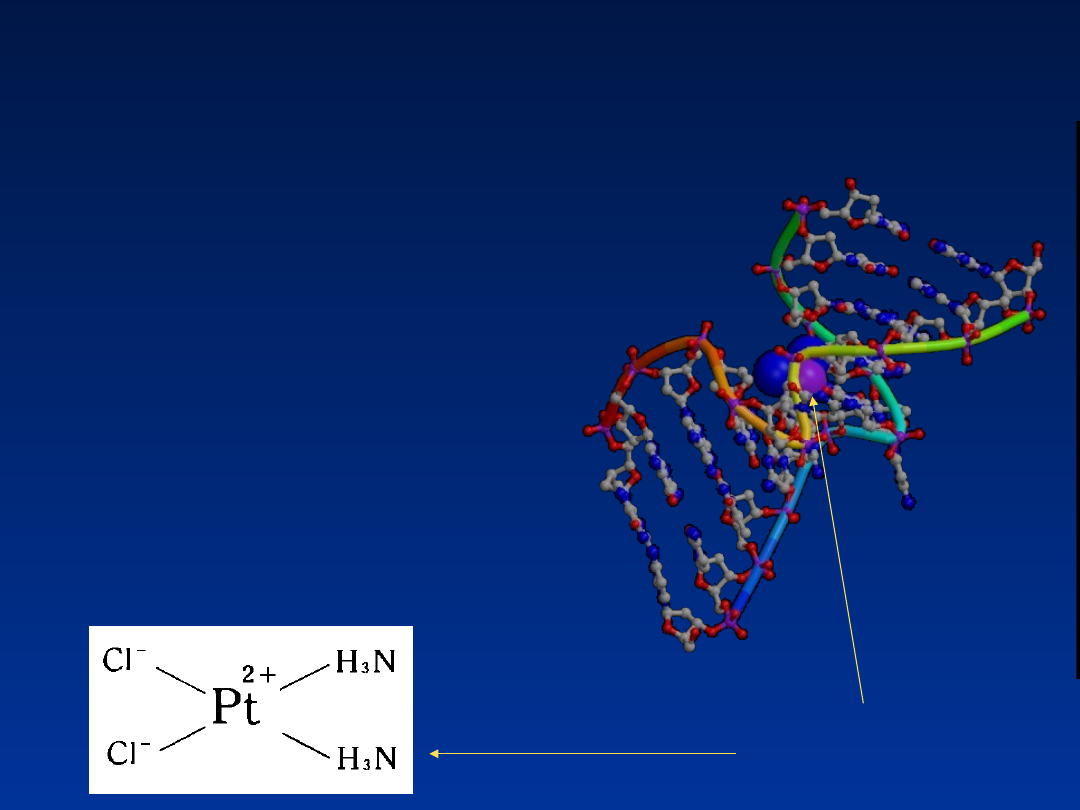
• gotowego DNA –
cisplatyna (wiązanie
krzyżowe)
Leki stosuje się na różnych
etapach:
cisplatyna

Swoiste dla cyklu komórkowego (słabiej
na fazę G
0
)
•
leki alkilujące
(cyklofosfamid,
busulfan)
•
antybiotyki
(adriamycyna,
bleomycyna)
Swoiste dla fazy cyklu komórkowego
•
antymetabolity
(metotreksat –
antagonista kwasu foliowego
odpowiedzialnego za segregację
chromosomów) – faza S
•
alkaloidy
(winkrystyna, winblastyna)
– faza M
•
inhibitory topoizomerazy II
(etopozyd)

Analogi zasad
Analogi zasad
Działanie na zasadzie hamowania
konkurencyjnego
Antagoniści składników kwasów
nukleinowych lub ich syntezy.
-6-merkaptopuryna
(hamuje syntezę
puryn – AML)
-5-fluorouracyl
(rak żołądka, jamy
nosowo – gardłowej, pęcherza
moczowego, jajników)
-ametopteryna (metotreksat –
antagonista kwasu foliowego – leczenie
ALL u dzieci)
-cytarabina (arabinozyd cytozyny,
białaczka limfatyczna)

Związki alkilujące
Związki alkilujące
• bardzo małe dawki powodują wzmożenie
podziałów komórkowych
• hamują wzrost komórek, podziały
• Zaburzają mitozę w komórkach szybko
rosnących (np. cebulki włosów)
• Działanie cytostatyczne głównie tkanki
chłonnej (białaczka przewlekła, ziarnica
złośliwa, szpiczak mnogi)
• Np.
cyklofosfamid
(Endoxan) – pochodna
iperytu azotowego
• Konieczny metabolizm w wątrobie przez
system
oksydaz
• Raki: żołądka, jajnika, prostaty, oskrzeli

Inhibitory topoizomerazy II
Inhibitory topoizomerazy II
Antybiotyki
Antybiotyki
Etopozyd
– hamuje działanie
topoizomerazy, niezbędnej do
poreplikacyjnego rozdziału DNA i
kondensacji chromosomów w mitozie
•
Aktynomycyna
– hamuje
transkrypcję
•
Bleomycyna
– rozcina łańcuchy
DNA
•
Doksorubicyna
– antybiotyki
antracyklinowe – interkalacja

Alkaloidy
Alkaloidy
•
kolchicyna
•
winkrystyna
•
winblastyna
•
adriablastyna
- Stosuje się także
hormony i
hormony i
antyhormony
antyhormony
– jeśli nowotwory są
hormonozależne (nowotwory gonad)
- Promieniowanie jonizujące
- Promieniowanie jonizujące
(191Au,
32P, 131I)

Inne leki
Inne leki
Leki immunosupresyjne (np.
Leki immunosupresyjne (np.
metotreksat)
metotreksat)
Leczenie chorób autoagresji,
zapobieganie odrzutom
przeszczepów, choroba
hemolityczna noworodków
Działanie immunosupresyjne
poprzez wpływ na rozmnażanie i
różnicowanie komórek
immunologicznie kompetentnych

Środki odkażające
Środki odkażające
Etakrydyna
(Rivanol) – związek
interkalujący. Stosuje się 0,1 – 0,5%
roztwór. Nie wolno wlewać
bezpośrednio do rany!
Działa na bakterie, odkażająco na
skórę i błony śluzowe.
Metody badania
Metody badania
mutagenności - Prokaryota
mutagenności - Prokaryota
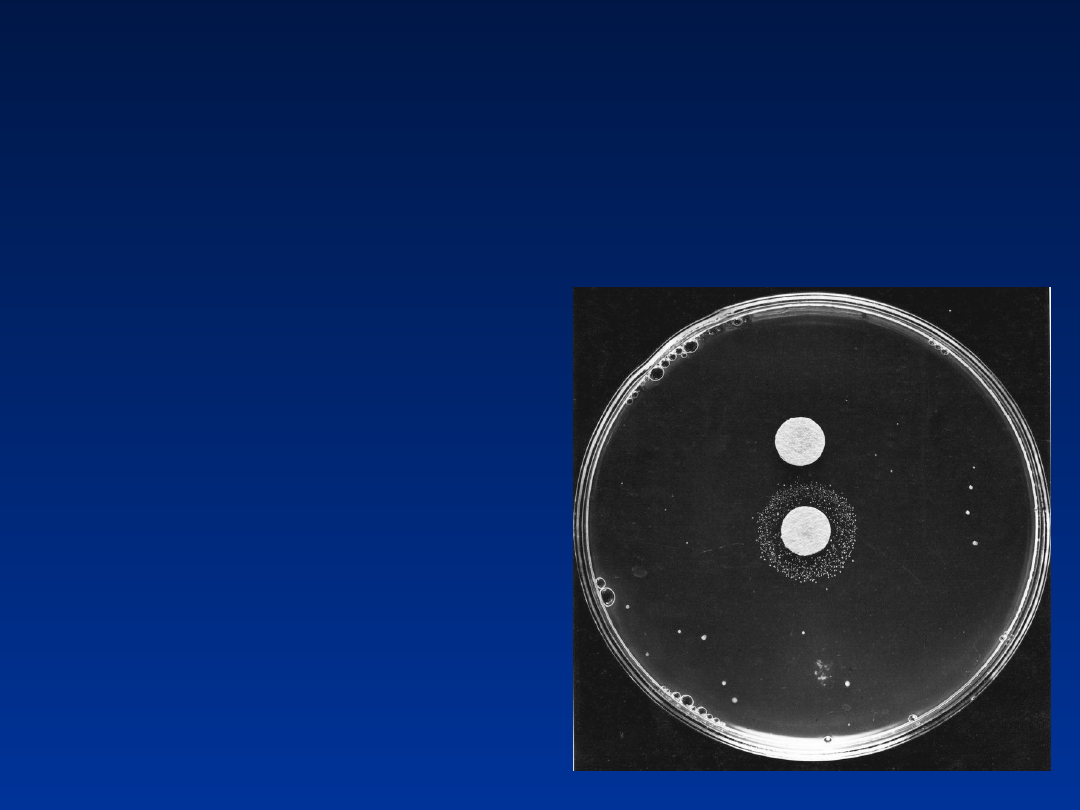
Bakterie his– miesza się z
homogenatem z wątroby
szczura. Wylewa się na
podłoże minimalne (nie
zawierające histydyny).
Przeżyją tylko te, które
„nauczyły się”
syntetyzować histydynę –
his+, czyli rewertanty
(mutacja powrotna)
Test Amesa
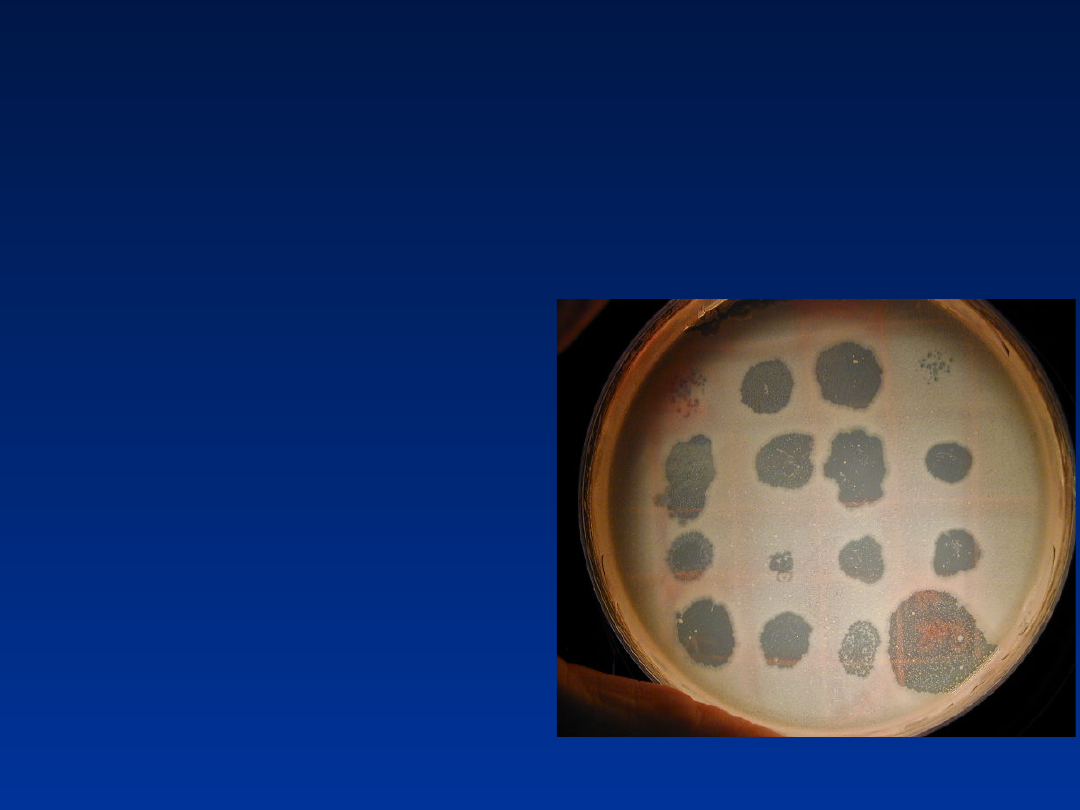
Test indukcji faga
2 szczepy bakteryjne
– jeden z
lizogenicznym
fagiem, drugi
normalny. Hodowla
na stałym podłożu,
dodaje się badanego
związku - indukcja
faga (uszkodzenie
DNA i przestawienie
na cykl lityczny).
Wirusy atakują
zdrowe komórki.
Ilość łysinek
świadczy o stopniu
mutagenności.

Metody badania
Metody badania
mutagenności - Eukaryota
mutagenności - Eukaryota
• test plamkowy
• badanie aberracji chromosomowych in
vitro (CA)
• test wymiany chromatyd siostrzanych
(SCE)
• test in vivo (test mikrojądrowy)
• test kometkowy
• test wykrywania dominujących mutacji
letalnych u ssaków

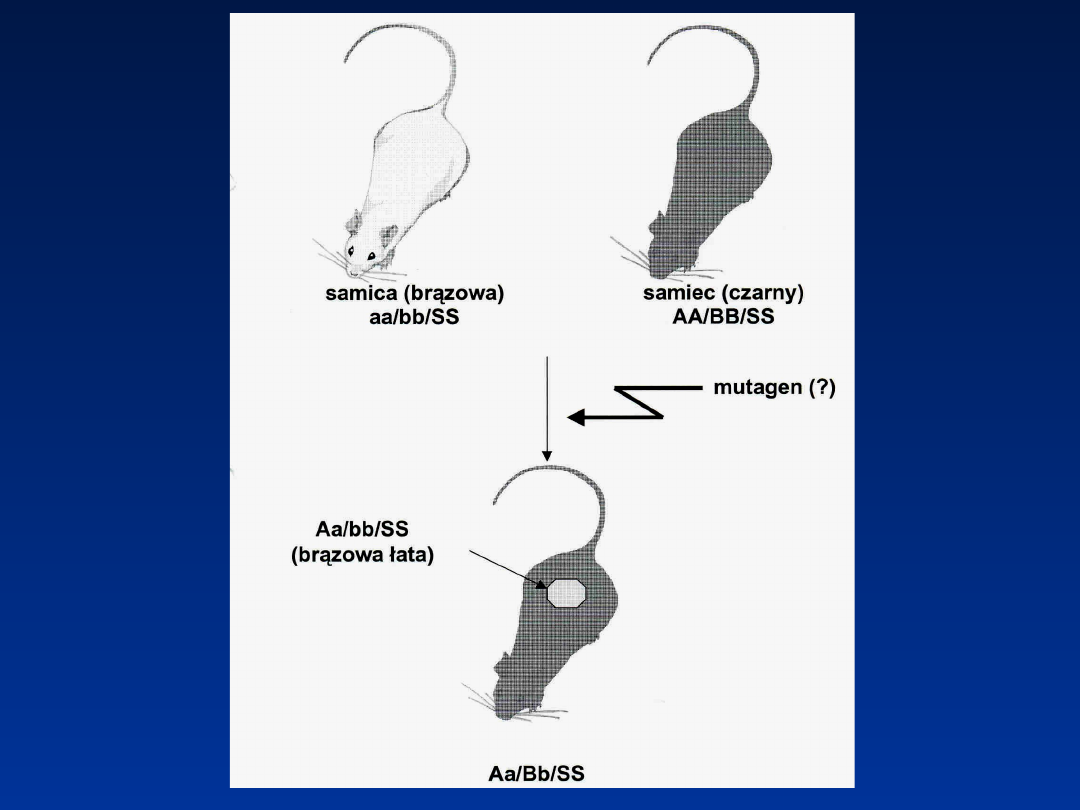
Test plamkowy
Test plamkowy
+
aa/bb/SS AA/BB/SS
(łatka- klon
komórkowy)
Aa/Bb/SS Aa/bb/SS
agouti czarne agouti z
brązową łatą
na
czarnym
tle
A – gen agouti
B – gen czarnej barwy
S – jednolite
wybarwienie
a – jednolite
wybarwienie
b – brązowa barwa
s – łaciatość
Związek jest
mutagenem, jeżeli na
500 myszek urodzą się
4 z brązową łatą

Test kometkowy (test
Test kometkowy (test
degradacji DNA)
degradacji DNA)
•czynnik
mutagenny
•zawieszenie w
kropli agarozy
•szkiełko
•obróbka zaczyna
się w roztworze do
lizy (niszczenie
błon
komórkowych)
•elektroforeza
DNA. wybarwianie
fluorochromem
Etapy elektroforezy testu
kometkowego (DNA
zdegradowane)

Addukty (np. benzopiren)
Addukty (np. benzopiren)
Reagują z cząsteczką DNA, pochodne węglowodorów
aromatycznych. Nie są mutagenne w takiej postaci,
w jakiej je wdychamy, dopiero po szeregu obróbek
metabolicznych. Łączą się z zasadą azotową.
Konsekwencje:
• zahamowanie lub obniżenie szybkości replikacji DNA
• niewłaściwe parowanie zasad podczas replikacji
• generowanie miejsc apurynowych

Efekty mutacji w różnych
komórkach
mutacje komórek rozrodczych – mutacja
we wszystkich komórkach organizmu
mutacje komórek somatycznych –
karcinogeneza – mutacja w komórkach guza
mutacje komórek płodowych –
teratogeneza – organizm mozaikowy

Mechanizmy teratogenezy
zmiana ekspresji genów
zaburzenia apoptozy
zaburzenia migracji i proliferacji
komórek
zaburzenia syntezy i funkcji białek
komórkowych
zaburzenia produkcji energii

Czynniki wpływające na
powstawanie wad
dawka teratogenu
tydzień ciąży
czas trwania ekspozycji
specyficzność działania teratogenu
metabolizm matczyny
transport przez łożysko
metabolizm płodu

Wady wrodzone indukowane
czynnikiem teratogennym
zmiany anatomiczne (deformacje,
malformacje, dysrupcje, dysplazje)
zmiany funkcjonalne (głuchota, ślepota,
niepełnosprawność intelektualna)

Fazospecyficzność działania
teratogennego
skutki klinicznie większości teratogenów zależa od
stadium rozwoju płodu/zarodka
np. wady serca – 20-40 dzień ciąży, wady oczu – 24-40
dzień ciąży
genopatie – przed zapłodnieniem
blastopatie – do 14 dnia po zapłodnieniu
embriopatie – 14-60 dzień po zapłodnieniu
– tworzą się zawiązki narządów
fetopatie – po 60 dniu życia płodowego

Fazospecyficzność działania
teratogennego
• Po 60 dniu życia płodowego (zakończona
organogeneza):
• okres proliferacji i migracji komórek, wzrost
i dojrzewanie narzadów
• zaburzenia funkcjonalne – dysfunkcje OUN,
nowotwory wrodzone

Teratogeny swoiste –
takie, które
prowadzą do określonych zaburzeń

Przykładowe mechanizmy
prowadzące do powstania wad
Talidomid prowadzi m.n. do fokomelii:
• Związek ten lub jego metabolity łączą się z
sekwencjami powtarzalnymi regionów
promotorowych genów IGF-1 i IGF-2
obniżając aktywność transkrypcyjną. Geny
IGF-1 i IGF-2 regulują angiogenezę w
rozwijających się kończynach. Dochodzi
zatem do zahamowania angiogenezy i do
zahamowania rozwoju kończyn.

Przykładowe mechanizmy
prowadzące do powstania wad
Liczba przypadków fokomelii odnotowana w
Niemczech
po roku 1963 nie odnotowano przypadków
fokomelii
Liczba przypadków fokomelii
rok
0 1940-1958
1 1959
30
1960
154
1961

FAS
cechy dysmorfii twarzy
• krótkie szpary powiekowe
• płaska środkowa część twarzy
• wiotka górna warga
• płaska rynienka nosowa

Kwas retinowy
reguluje między innymi
rozwój szkieletu poprzez jądrowe receptory.
Zaburzenia aktywności tych receptorów
prowadzą
do
zaburzeń
różnicowania
chondroblastów, a w konsekwencji do
zaburzeń tworzenia chrząstki,
okres krytyczny – 3-5 tydzień ciąży !
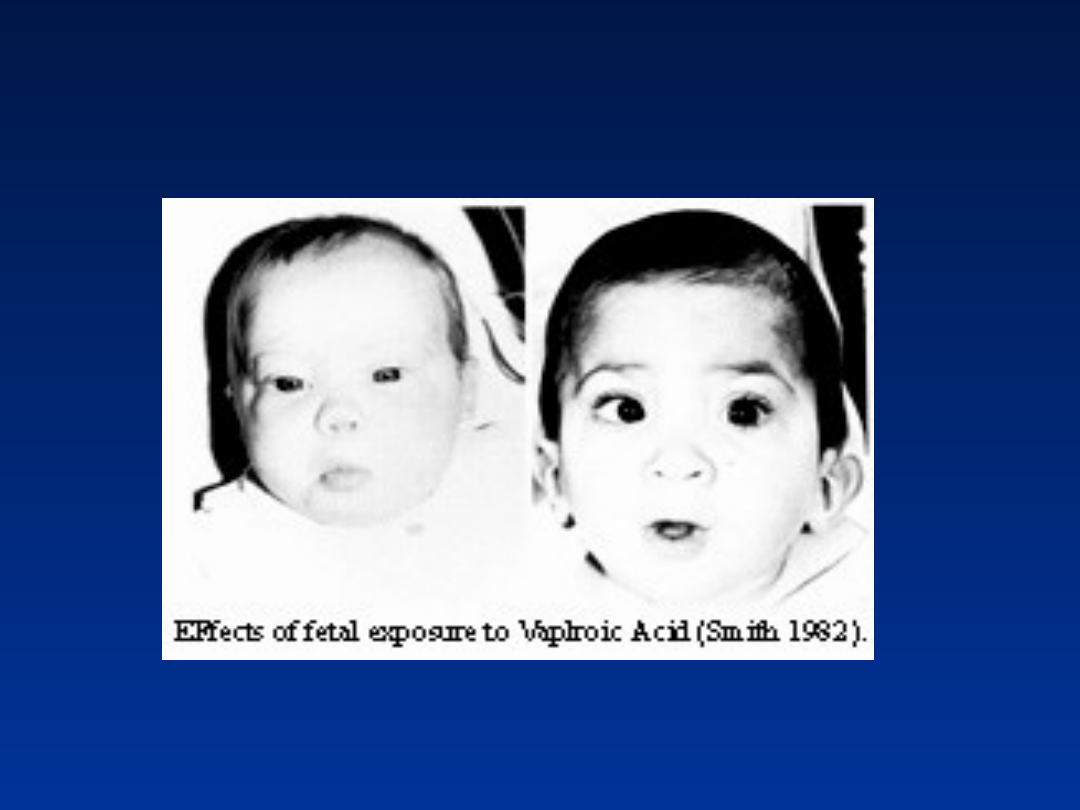
Wysokie czoło, fałdy nakątne, szeroki
grzbiet nosa,
długa rynienka nosowa, małe usta
Dysmorfie twarzy spowodowane
kwasem walproinowym
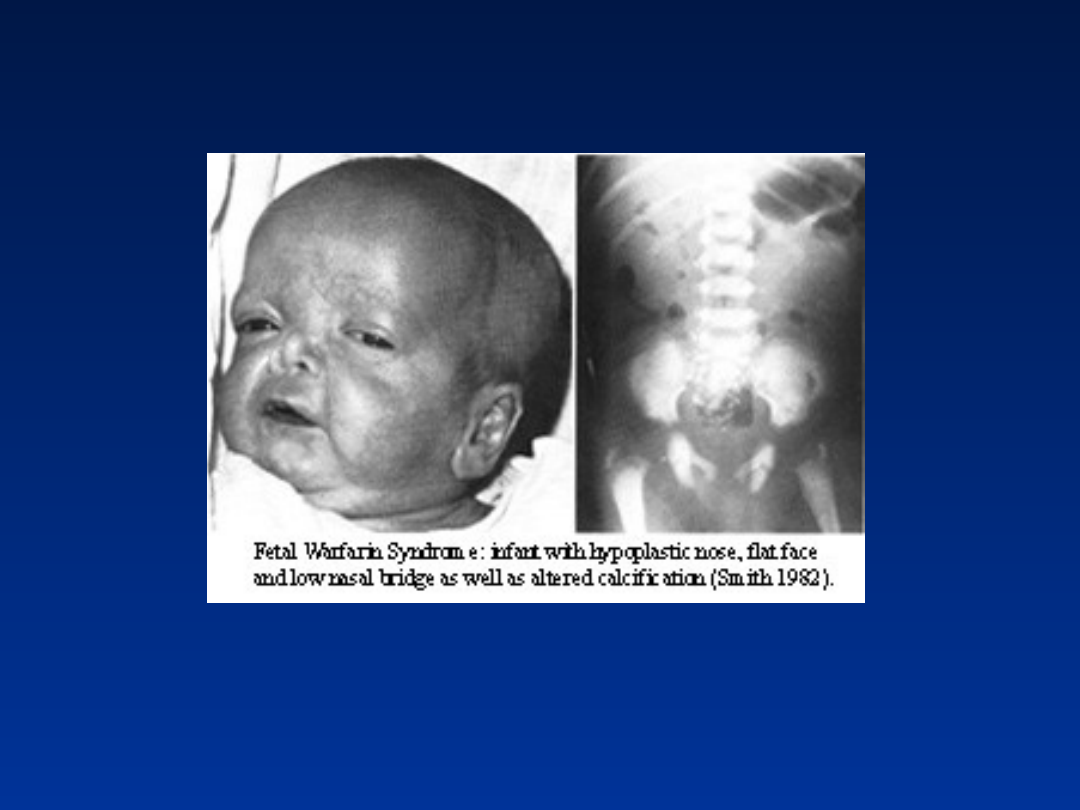
Wady spowodowane warfaryną
niedorozwój nosa zaburzenia kostnienia
nasad
nos siodełkowaty zwłaszcza kręgosłup,
kość udowa
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
Wyszukiwarka
Podobne podstrony:
TERATOGENEZA
Mutageneza wykład 4
informacja o substancjach, preparatach o działaniu rakotwórczym lub mutagennym
Problemy teratogenezy, Genetyka
Mutageneza
Geny homeotyczne. Teratogeneza.
TERATOGEN
TORCHES Czynniki teratogenne dla płodu, mnemotechniki medyczne
Teratogeneza, Problemy teratogenezy w genetyce klinicznej
Czynniki mutagenne
CZYNNIKI MUTAGENNE
mutageny hard ]
4 Mutageneza id 37220 Nieznany (2)
Biomonitoring mutagenności powietrza i wody
prenatalny, teratogeny, FAS
TERATOGENY
więcej podobnych podstron