
Małgorzata Ligęza
ŁAŃCUCHOWA REAKCJA
POLIMERYZACJI- PCR

PCR (Polymerase Chain
Reaction)
• Metoda amplifikacji-powielania
łańcuchów DNA w warunkach
laboratoryjnych, polegająca na
sekwencji wielokrotnego
podgrzewania i oziębiania próbki.
• Technika została wynaleziona w 1983
roku przez Kary'ego Mullisa, za co
otrzymał w roku 1993 Nagrodę
Nobla.

Składniki mieszaniny
reakcyjnej
• matrycowy DNA
• trifosforany deoksyrybonukleozydów
• startery (primery)
krótkie (najczęściej ok. 20 nukleotydów) fragmenty
DNA
komplementarne do fragmentów matrycy, znajdujących
się na obu końcach interesującego nas genu
• Termostabilna polimeraza DNA
polimeraza Taq wyizolowana z bakterii Thermus
aquaticus
polimeraza Pfu z archeowców Pyrococcus furiosis

• Reakcję PCR przeprowadza się w bloku grzejnym,
który jest kontrolowany przez termocykler. Produkt
reakcji ocenia się przez elektroforezę i barwienie
bromkiem etydyny.

3 etapy reakcji PCR:
• Denaturacja dwuniciowego DNA
15-30s, 90-95
○
C
• Przyłączenie starterów
30-60s, 50-60
○
C
• Elongacja
różny czas trwania, 72
○
C
Wymienione etapy tworzą 1 cykl.
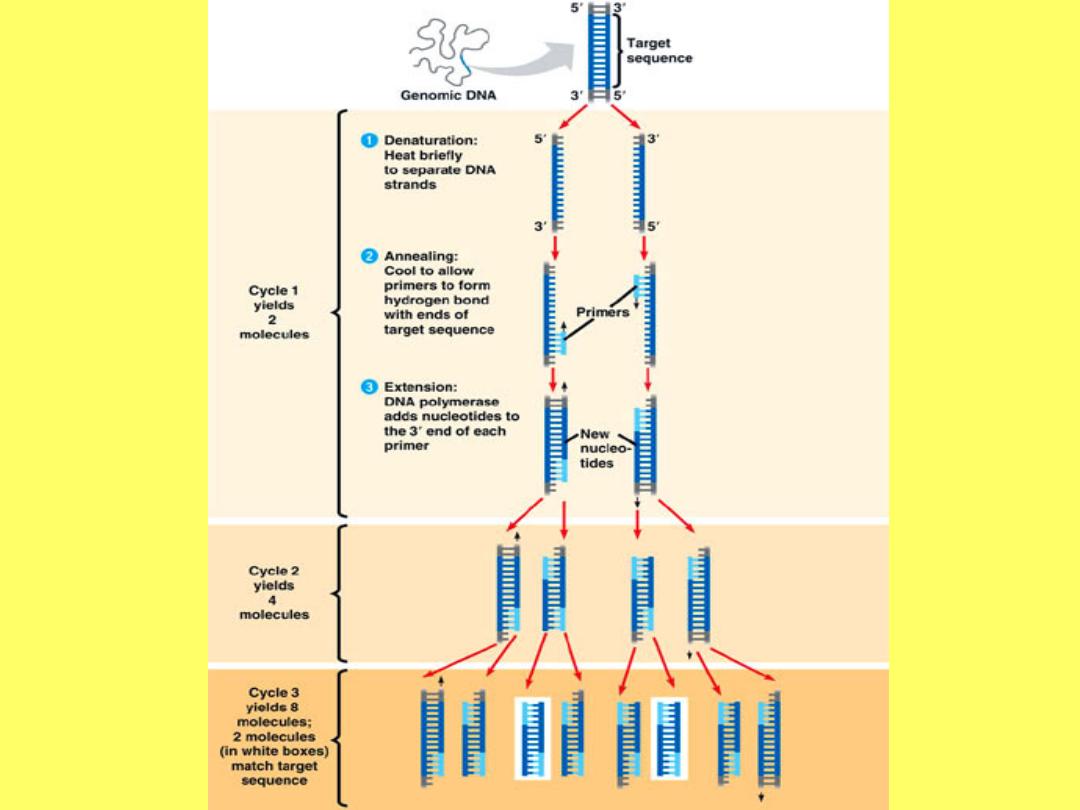

Etap I-
Denaturacja dwuniciowego DNA
• W wysokiej temperaturze pękają
wiązania wodorowe i podwójna
helisa DNA rozdziela się na dwa
pojedyncze łańcuchy.
• W celu uzyskania tego efektu
podnosi się temperaturę mieszaniny
reakcyjnej do wymaganych 95° na 15
sekund.

Etap II-
Przyłaczanie starterów
• Tworzą się odcinki dwuniciowe, składających
się z przygotowanych starterów
(oligonukleotydów hybrydyzujących z końcem
3` każdej nici,komplementarnych do sekwencji
DNA oskrzydlających gen mający ulec
namnożeniu) z matrycową cząsteczką DNA.
• Etap ten zachodzi w temperaturze niższej,
ściśle określonej dla danej pary starterów
(pomiędzy 45-60 °C).

Etap III-
Elongacja
• Właściwa synteza DNA i tym samym
amplifikacja pożądanego genu.
• Podwyższenie temperatury do około 72 °C
powoduje rozpoczęcie się syntezy nici
komplementarnej do matrycy.
• Pod koniec pierwszego cyklu otrzymujemy
dwie kopie DNA zawierające region, który
chcieliśmy zwielokrotnić.

• Proces powtarza się, zwykle
przeprowadza się od 20 do 40 cykli
• Ilość kopii DNA wzrasta wykładniczo
• Wydajność reakcji nie jest 100%-owa
(niespecyficzne produkty)
• Niespecyficzne produkty są związane
z powstawaniem lokalnych struktur
drugorzędowych lub niespecyficznym
łączeniu się starterów z matrycą

Eliminacja niespecyficznych
produktów
• Optymalizacja warunków
• Dodanie DMSO (dimetylosulfotlenek)
lub glicerolu
• Zastosowanie polimerazy TopoTaq
• Zastosowanie polimerazy typu hot
start
Odmiany reakcji PCR-
RT PCR Reverse Transcriptase PCR
• Synteza DNA na
matrycy
dojrzałego mRNA
przy pomocy
odwrotnej
transkryptazy.
• Dzięki temu
kopiowane są
tylko egzony.
Odwrotna transkryptaza – struktura
III-rzędowa
Odmiany reakcji PCR-
Real Time PCR
• Wprowadzenie do
środowiska reakcji
znakowanych
fluorescencyjnie
sond w celu
określenia ilości
matrycy użytej w
reakcji oraz
śledzenia ilości
powstającego
produktu.

Odmiany reakcji PCR-
Multiplex PCR
• Zastosowanie starterów dla różnych
genów lub odmiennych fragmentów
tego samego genu. Pozwala na
jednoczesne wykrywanie DNA kilku
patogenów. Szczególnie przydatny w
genetyce sądowej i kryminalistyce.

Zalety metody PCR
• Sekwencja badanego genu nie musi być
znana – wystarczy znajomość sekwencji
oskrzydlających
• Startery nie muszą być komplementarne do
matrycy w 100%
• Specyficzność – dobór odpowiednich
starterów pozwala na amplifikację
odpowiedniego odcinka
• Czułość – możliwe wykrycie nawet
pojedynczej cząsteczki DNA

Cechy badania:
• Analiza liczby kopii
wirusa/bakterii
• Możliwość śledzenia
postępów leczenia
Co można wykryć:
Wirus opryszczki
Entero- i parvowirusy
Cytomegalia
HIV
Badania PCR w medycynie
Badanie ilościowe Badanie
jakościowe
Cechy badania:
•Identyfikacja materiału
genetycznego wirusa/bakterii
a nie przeciwciał
•Identyfikacja możliwa na
wczesnym etapie zakażenia
Co można wykryć:
Wirus różyczki
Wirus hepatitis B i C
Bakteria Salmonella
Bakteria Ureaplasma

Inne zastosowania PCR
• Ustalanie ojcostwa
• Kryminalistyka
• Ustalanie nosicielstwa zmutowanego
genu
• Antropologia
• Diagnostyka preimplantacyjna

Bibliografia:
• Podstawy genetyki dla studentów i
lekarzy, Gerard Drewa, Tomasz
Ferenc, Elsevier Urban & Partner,
Wrocław 2003, wyd. 2
• PCR wczoraj i dziś, czyli "stara
śpiewka" w nowej aranżacji, Wojciech
Bobela
• Źródła internetowe
Document Outline
- Slide 1
- PCR (Polymerase Chain Reaction)
- Składniki mieszaniny reakcyjnej
- Slide 4
- 3 etapy reakcji PCR:
- Slide 6
- Etap I- Denaturacja dwuniciowego DNA
- Etap II- Przyłaczanie starterów
- Etap III- Elongacja
- Slide 10
- Eliminacja niespecyficznych produktów
- Odmiany reakcji PCR- RT PCR Reverse Transcriptase PCR
- Odmiany reakcji PCR- Real Time PCR
- Odmiany reakcji PCR- Multiplex PCR
- Zalety metody PCR
- Slide 16
- Inne zastosowania PCR
- Bibliografia:
Wyszukiwarka
Podobne podstrony:
bez żywności 16 Wykorzystanie łańcuchowej reakcji polimerazy (PCR) w bezpieczeństwie żywności
Łańcuchowa reakcja polimeryzacji (PCR)
Spr Reakcja łańcuchowa polimerazy (PCR)
Podstawy polimerazowej reakcji łańcuchowej PCR
Reakcja łańcuchowa polimerazy
Podstawy polimerazowej reakcji łańcuchowej PC1
Reakcja lancuchowa, Studia, chemia jądrowa
Reakcja łańcuchowa
Reakcja lancuchowa
199807 reakcja lancuchowa polim
Enzymy restrykcyjne i reakcja łańcuchowa polimerazy(PCR) zastosowanie (2)
Czynności obronne i reakcje stresowe
CZLOWIEK I CHOROBA – PODSTAWOWE REAKCJE NA
Tworzenie Łańcucha Wartości Dodanej
Logistyczny łańcuch dostaw
więcej podobnych podstron