
Zadanie: 1
Sporządzono dwa wodne roztwory soli: siarczanu (VI) sodu i azotanu (III) sodu
Który z wyżej wymienionych roztworów soli nie będzie miał odczynu obojętnego?
Uzasadnij odpowiedź i napisz równanie odpowiedniej reakcji chemicznej w formie jonowej
skr
óconej.
Zadanie: 2
Zbadano odczyn wodnych roztworów następujących soli:
I chlorku baru
II octanu amonu
III siarczku sodu
Wnioski wynikające z obserwacji zebrano w tabeli. Uzupełnij brakujące miejsca (a, b, c)
Informacja do zadania 3 i 4
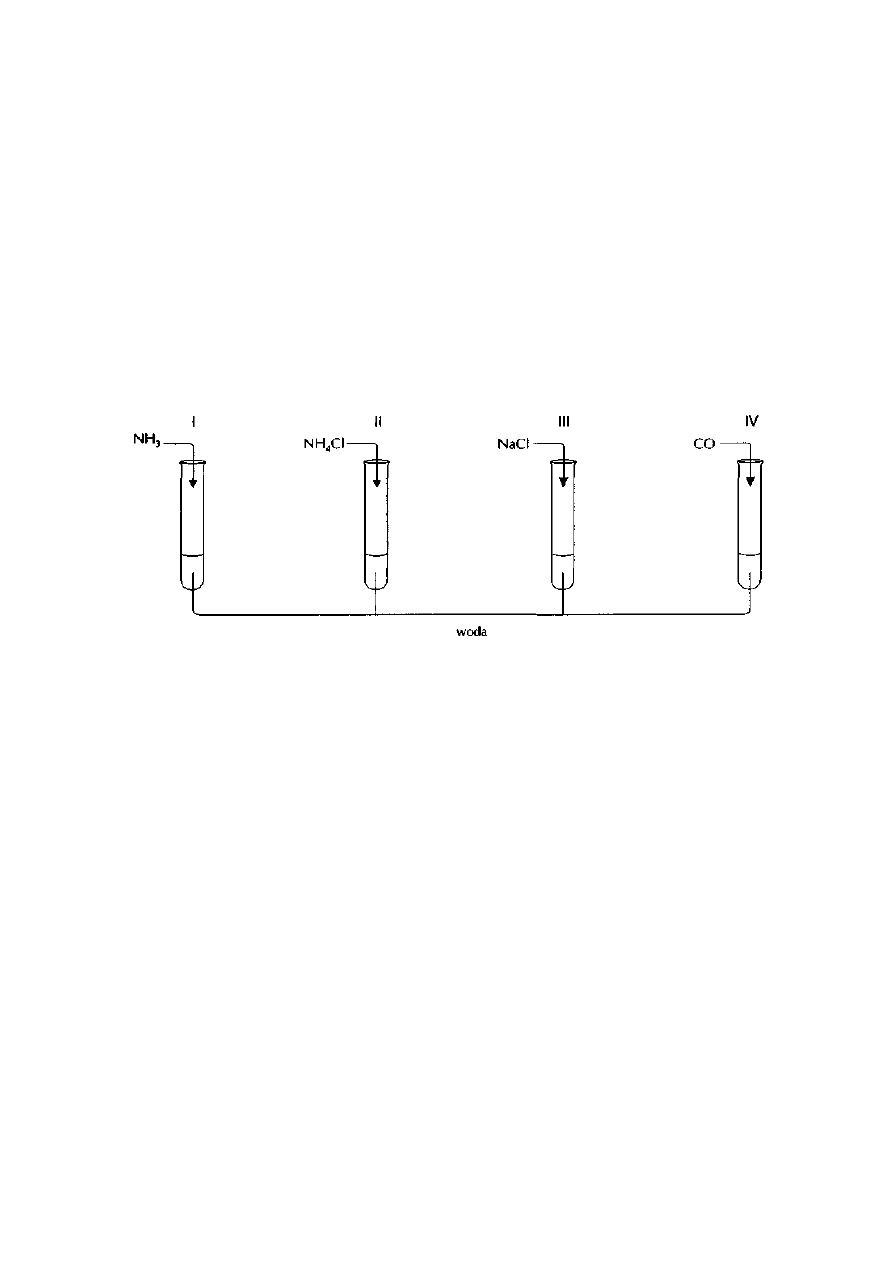
Wykonano doświadczenia pokazane na poniższym rysunku:
U wylotu probówek umieszczono zwilżony wodą destylowaną żółty papierek uniwersalny
Zadanie: 3
Zapisz po dwie obserwacje, jakich dokonano podczas każdego doświadczenia
W opisie uwzględnij między innymi zmianę barwy papierka uniwersalnego
Zadanie: 4
Napisz w formie jonowej skróconej równania reakcji zachodzących w probówkach I i II

Informacja do zadania 5, 6, 7.
Wykonano doświadczenia przedstawione na poniższym rysunku:
Zadanie: 5
Określ, jaki odczyn posiadają roztwory otrzymane w wyniku tych doświadczeń.
Zadanie: 6
Napisz w formie jonowej skróconej równania reakcji zachodzących w probówkach I i III.
Zadanie: 7
Nazwij reakcje chemiczne zachodzące w probówkach I i II.
Informacja do zadań 8 i 9
Stała dysocjacji NaOH jest bardzo duża, zaś stała dysocjacji kwasu azotowego (III) wynosi 2▪10
-4
.
Zadanie: 8
a) Na podstawie powyższych informacji określ odczyn wodnego roztworu NaNO
2
.
b) Zapisz w formie skróconej jonowej równania hydrolizy tej soli
c) Jaką rolę według teorii Bronsteda pełni w tej reakcji woda

Zadanie: 9
Oblicz stopień dysocjacji oraz pH roztworu kwasu azotowego (III) o stężeniu 0,5 mol/dm
3
.
Zadanie: 10
Zadanie: 11

Zadanie 12. (3 pkt)
Podaj odczyn wodnych roztworów następujących soli:
a) Na
2
SO
3
...................
b) Na
2
SO
4
...................
c) NaHCO
3
..................
Zadanie 13. (2 pkt)
Aby przygotować działkę do uprawy pewnego gatunku roślin, ziemię nawożono saletrą
amonową, czyli azotanem (V) amonu. Podaj, jaki będzie wpływ nawożenia saletrą na odczyn tej gleby.
Odpowiedź uzasadnij, podając nazwę zachodzącego procesu chemicznego.
Zadanie 14. (1 pkt)
Zapisz w formie jonowej (zapis skrócony) równanie reakcji, jakiej ulega azotan(V) amonu w
roztworze wodnym.
Zadanie: 15 (4 pkt)
Uzupełnij tabelkę:
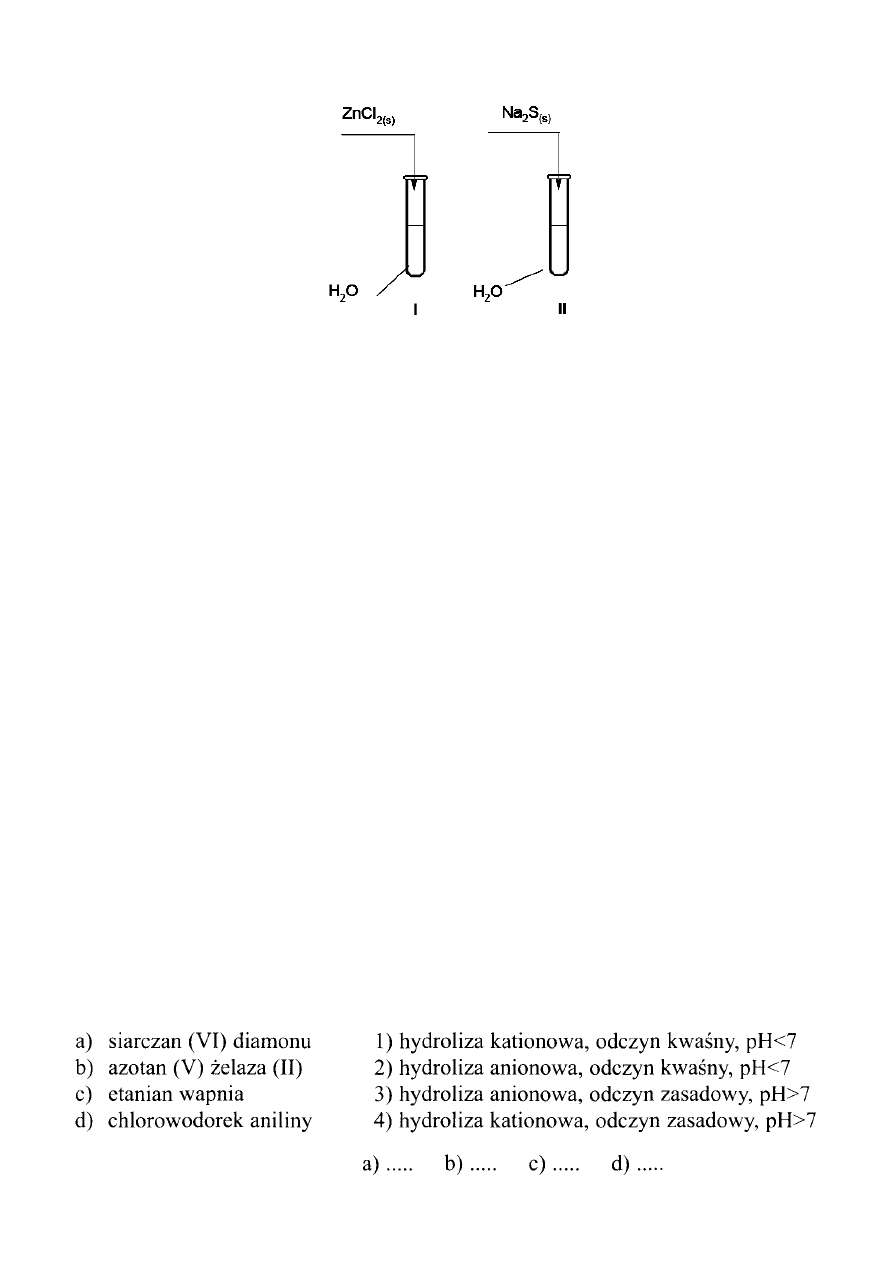
Zadanie 16. (2 pkt)
Przeprowadzono doświadczenia, które ilustruje poniższy rysunek.
Podaj odczyn roztworów otrzymanych w obu probówkach.
Odpowiedź uzasadnij, pisząc w formie jonowej skróconej równania zachodzących reakcji.
Zadanie: 17 (4 pkt.)
Napisz równania reakcji zachowania się anionu wodorowęglanowego w wodzie zgodnie z teorią
Bronsteda:
W tych reakcjach anion pełni rolę: ....................................................................
Zgodnie z tą teorią kwas to: ..............................................................................
Zadanie: 18 (2 pkt.)
Przyporządkuj lewej kolumnie odpowiednie określenia z prawej kolumny:
Zadanie: 19 (1 pkt)
Iglaki lubią kwaśną ziemię. Aby zmienić pH gleby lekko zasadowej użyjesz roztworu soli:
a) chlorku sodu
b) siarczanu(VI) miedzi(II)
c) siarczanu(VI) sodu
d) węglanu sodu
Zadanie 20. (1 pkt)
Do 4 probówek z wodą wprowadzono:
l
— FeCI
3
,
II
— NH
3
,
III
— HBr,
IV
— SiH
4
.
Wskaż, w których probówkach stwierdzono kwasowy odczyn roztworów:
A. l i II,
B. II i III, C. III i IV, D. l i III.
Zadanie 21. (1 pkt)
Określ odczyn roztworów otrzymanych po wprowadzeniu do wody następujących substancji:
l .............................................. II ...............................................
III ............................................. IV ...............................................
Zadanie 22. (3 pkt.)
Ułóż równania świadczące o tym, że według teorii Brónsteda chlorowodór w roztworze wodnym
jest kwasem, natomiast amoniak
— zasadą. A woda — to kwas czy zasada?
Zadanie 23. (1 pkt)
Wyjaśnij, dlaczego roztwór wodny Na
2
S ma odczyn zasadowy.

Zadanie 24. (3 pkt.)
Następujące sole: Na
2
S, NaCI, FeCI
3
, rozpuszczono w wodzie.
Wy
bierz te, które ulegają hydrolizie i ułóż równania odpowiednich reakcji w formie jonowej.
Zadanie 25. (3 pkt)
Napisz, jaki odczyn mają wodne roztwory:
1. metanolanu sodu,
2. fenolanu sodu,
3. octanu sodu.
Zadanie 26. (4 pkt)
Przeprowadzono doświadczenie jak na poniższym schemacie.
Napisz obserwacje, jakich można dokonać na podstawie przeprowadzonego doświadczenia oraz
napisz jonowe równania reakcji, na których oparto eksperyment.

Zadanie 27. (5 pkt)
Określ odczyn wodnych roztworów soli, których nazwy podano poniżej. Spośród tych związków
wybierz te, które ulegają hydrolizie i napisz skrócone jonowe równania reakcji hydrolizy tych soli.
1. Siarczan(VI) sodu.
2. Chlorek żelaza(II).
3. Siarczek baru.
Zadanie 28. (1 pkt)
Określ, jaką rolę pełni woda w reakcji opisanej poniższym równaniem (kwasu czy zasady według
teorii Brónsteda).
Zadanie 29. (3 pkt)
Skóra człowieka ma odczyn lekko kwaśny (pH ~ 5,5).
Jaki odczyn ma powszechnie stosowane mydło, którego głównym składnikiem może być
pal
mitynian potasu. W formie cząsteczkowej i jonowej napisz równania reakcji uzasadniające
odczyn wodnego roztworu mydła (palmitynianu potasu).
Zadanie 30. (1 pkt)
W probówkach znajdują się wodne roztwory związków.
W której z probówek odczyn jest zasadowy?
A. II i III
B. II i IV C. I i IV D. I i III

Zadanie 31. (2 pkt)
Określ odczyn poniższych soli po dodaniu do nich wody.
1) KNO
2
2) ZnCO
3
3) CuSO
4
4) PbSO
3
1)....................................... 2).......................................
3)....................................... 4).......................................
Zadanie 32. (1 pkt)
Przeprowadzono doświadczenie, które ilustrują poniższe rysunki:
W którym z powyższych roztworów fenoloftaleina nie zabarwi się na kolor malinowy?
A. I, III, IV
B. tylko w III C. II, IV, V D. tylko w II
Zadanie 33. (4 pkt)
Uczeń za pomocą uniwersalnego papierka wskaźnikowego zbadał odczyn wodnych roztworów:
kwasu solnego, wodorotlenku sodu, chlorku cynku
i octanu amonu. Uzupełnij tabelę, wpisując barwę
uniwersalnego papierka wskaźnikowego i odczyn roztworu.
Zadanie 34. (1 pkt)
W probówkach znajdują się wodne roztwory soli.
Wskaż, w których probówkach roztwory wykazują pH < 7.
A. I i II
B. I, II i III C. I i III D. III i IV
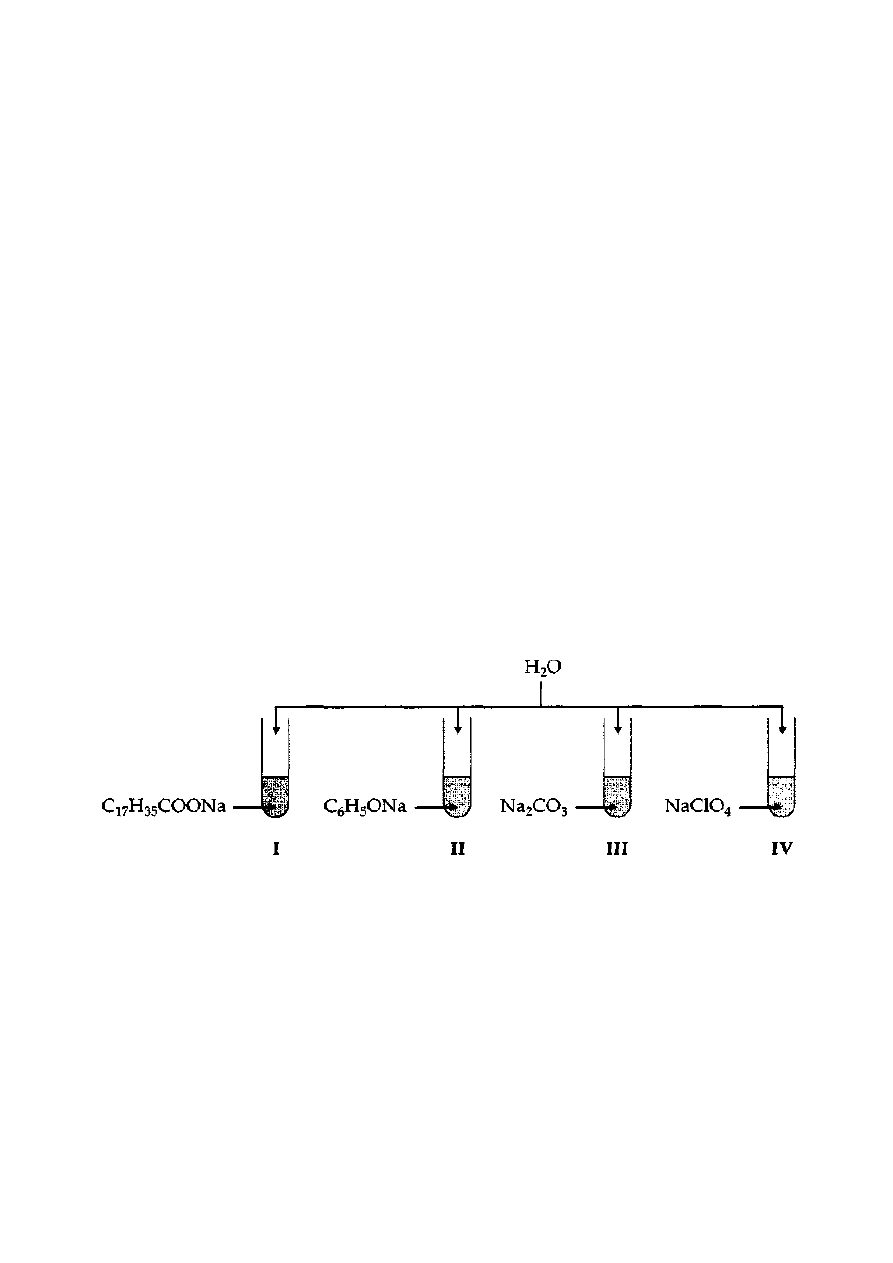
Zadanie 35. (2 pkt)
Dane są następujące sole: ZnCl
2
, NaNO
3
, K
2
S, KCl, (NH
4
)
2
SO
4
, Li
2
SO
3
. Wskaż, które z soli
wymienionych powyżej, po rozpuszczeniu w wodzie nie powodują zmiany stężenia jonów H
+
i OH
.
Wyjaśnij ten fakt.
Zadanie 36. (2 pkt)
Napisz wzory soli z zadania 5., które po rozpuszczeniu w wodzie obniżają pH roztworu. Napisz w
formie jonowej równanie reakcji (dla jednej wybranej soli) uzasadniające obniżenie wartości pH.
Zadanie 37. (1 pkt)
Przygotowano wodne roztwory kilku substancji.
W której z probówek roztwór nie wykazuje odczynu zasadowego?
A. III
B. II
C.IV
D. III
Zadanie 38. (5 pkt)
Poniżej podano cztery pary soli:
A. PbSO
4
i NH
4
Cl B. NH
4
Cl i NaNO
2
C. NaNO
2
i CaCO
3
D. NH
4
Cl i PbSO
4
Wskaż tę parę, która zawiera obie sole ulegające hydrolizie. Napisz równania reakcji hydrolizy
tych soli w formie cząsteczkowej i jonowej.

Zadanie 39. (5 pkt)
Wodne roztwory etanolanu sodu i palmitynianu sodu posiadają taki sam odczyn. Pisząc
odpowiednie równania reakcji w formie cząsteczkowej i jonowej wyjaśnij, jaki odczyn posiadają wodne
roztwory tych substancji.
Zadanie: 40 (1 pkt)
Uczniowie określali pH roztworów następujących substancji: HCl KOH Na
2
SO
4
CuCl
2
K
2
CO
3
. Wynik
i umieścili w tabeli. Który z uczniów poprawnie wykonał zadanie?
Zadanie: 41 (1 pkt)
Do probówek z wodą wprowadzono substancje.
W której poziomej kolumnie w tabeli prawidłowo przedstawiono stężenie jonów ?

Zadanie: 42 (1 pkt)
Do probówek z wodą wprowadzono substancje.
W której poziomej kolumnie w tabeli prawidłowo przedstawiono stężenie jonów ?
Wyszukiwarka
Podobne podstrony:
04 4 Folia Hydroliza soli zadania do lekcji nr 1
04 4 Reakcje utleniania i redukcji zadania do lekcji nr 1
04 4 Reakcje utleniania i redukcji zadania do lekcji nr 2
06 4 Mangan i jego związki zadania do lekcji nr 2
7Izotopy i ich zastosowanie zadania do lekcji nr 1
03 4 Ogniwa galwaniczne zadania do lekcji nr 2
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
02 5 Odczyn roztworów wodnych pH zadania do lekcji nr 2
03 4 Folia Teorie kwasowo zasadowe zadania do lekcji nr 1
05 3 Efekty energetyczne reakcji zadania do lekcji nr 1
07 4 Chrom i jego związki zadania do lekcji nr 2
02 3 Szybkość reakcji chemicznych zadania do lekcji nr 2
10Promieniotwórczość zadania do lekcji nr 2
9Promieniotwórczość zadania do lekcji nr 1
chemiaix pl wp content uploads 2011 05 02 5 Rozpuszczalność zadania do lekcji nr 2
07 5 Prawa elektrolizy zadania do lekcji nr 2
02 5 Rozpuszczalność zadania do lekcji nr 3
05 4 Iloczyn rozpuszczalności zadania do lekcji nr 1
05 4 FOLIA Procesy elektrolizy zadania do lekcji nr 1
więcej podobnych podstron