
SYNTEZA
AMINOKWASÓW
I PEPTYDÓW

METODY LABORATORYJNE
1. Amonoliza α-halogenokwasów
R
OH
O
X
2,
P
4
H
2
O
R
OH
O
X
NH
3
nadmiar
R
OH
O
NH
2
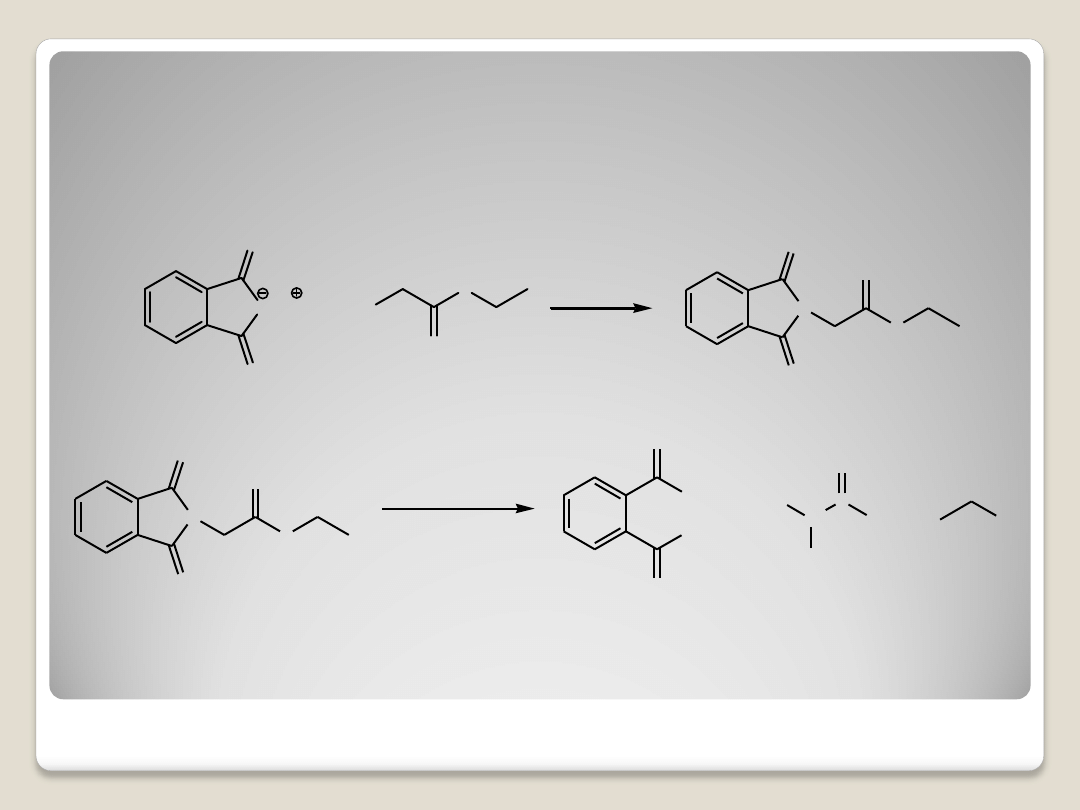
2. Synteza Gabriela z ftalimidku potasu
N
O
O
K
+
Cl
O
O
ftaimidek potasu
chlorooctan etylu
N
O
O
O
O
N
O
O
O
O
1. KOH, H
2
O
2. HCl
O
OH
O
OH
H
2
N
CH
C
H
OH
O
+
kwas ftalowy
glicyna
OH
+

Kolejny wariant tej syntezy to reakcja z α-bromomalonianem dietylu, z utworzeniem estru
imido malonowego
N
O
O
K
Br
O
O
O
O
+
N
O
O
O
O
O
O
ester ftalimidomalonowy
NaOC
2
H
5
ClC
2
H
4
S(CH
3
)
N
O
O
O
O
O
O
CH
2
H
2
C
S
CH
3
NaOH
H
N
CO
2
O
O
O
O
O
CH
2
H
2
C
S
CH
3
HCl
O
OH
O
OH
+
H
2
N
CH
C
H
2
C
OH
O
H
2
C
S
CH
3
+
CO
2
metionina
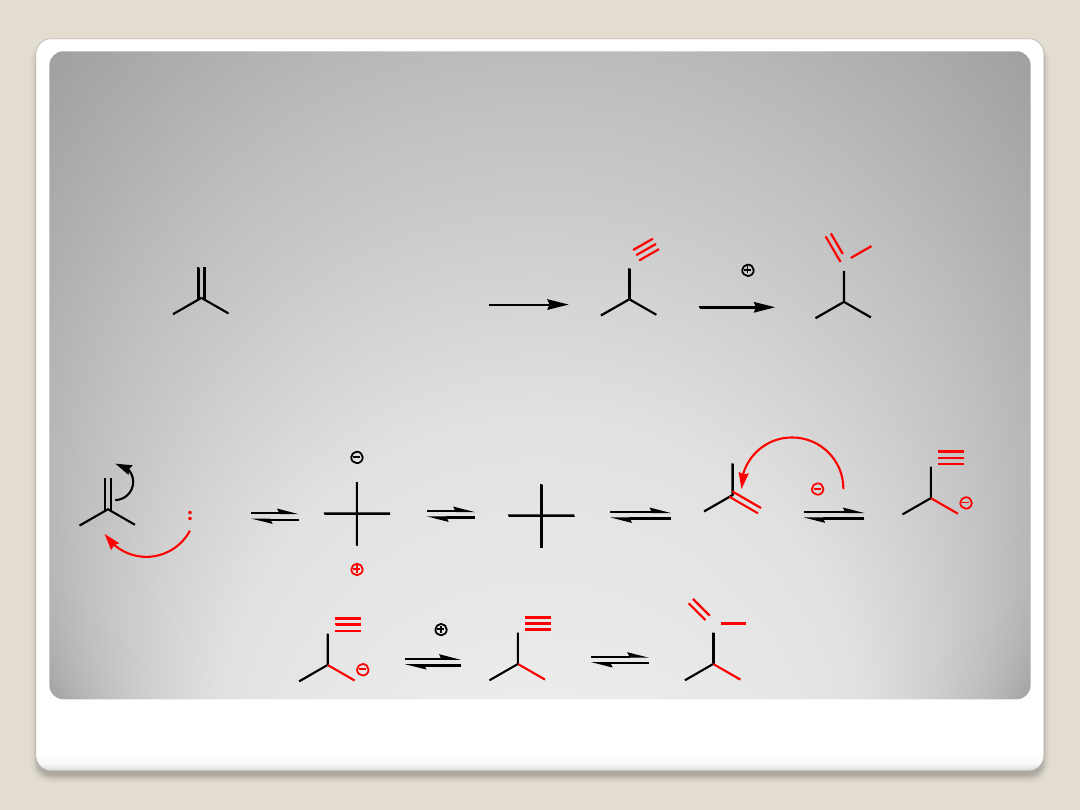
3. Synteza Streckera
Reakcja aldehydu z amoniakiem i cyjanowodorem z utworzeniem α-aminoitrylu. Hydroliza grupy
nitrylowej prowadzi do aminokwasu.
R
H
O
+
NH
3
+
HCN
R
NH
2
C
N
H
3
O
temp.
R
NH
2
C
OH
O
Mechanizm:
R
H
O
NH
3
R
H
O
NH
3
R
H
OH
NH
2
- H
2
O
R
H
NH
CN
R
C
NH
N
R
C
NH
N
H
R
C
NH
2
N
H
2
O
R
C
NH
2
OH
O

H
2
N
CH
C
CH
3
OH
O
SOCl
2
H
2
N
CH
C
H
OH
O
H
2
N
CH
C
CH
3
O
NH
CH
C
H
OH
O
Ala
Gly
Ala
Gly
+
H
2
N
CH
C
CH
3
O
NH
CH
C
CH
3
OH
O
AlaAla
H
2
N
CH
C
CH
3
O
NH
CH
C
CH
3
O
NH
CH
C
CH
3
O
NH
2
AlaAlaAla
+
+
H
2
N
CH
C
CH
3
O
NH
CH
C
CH
3
O
NH
CH
C
H
OH
O
AlaAla
Gly
SYNTEZA PEPTYDÓW
I BIAŁEK
METODY LABORATORYJNE
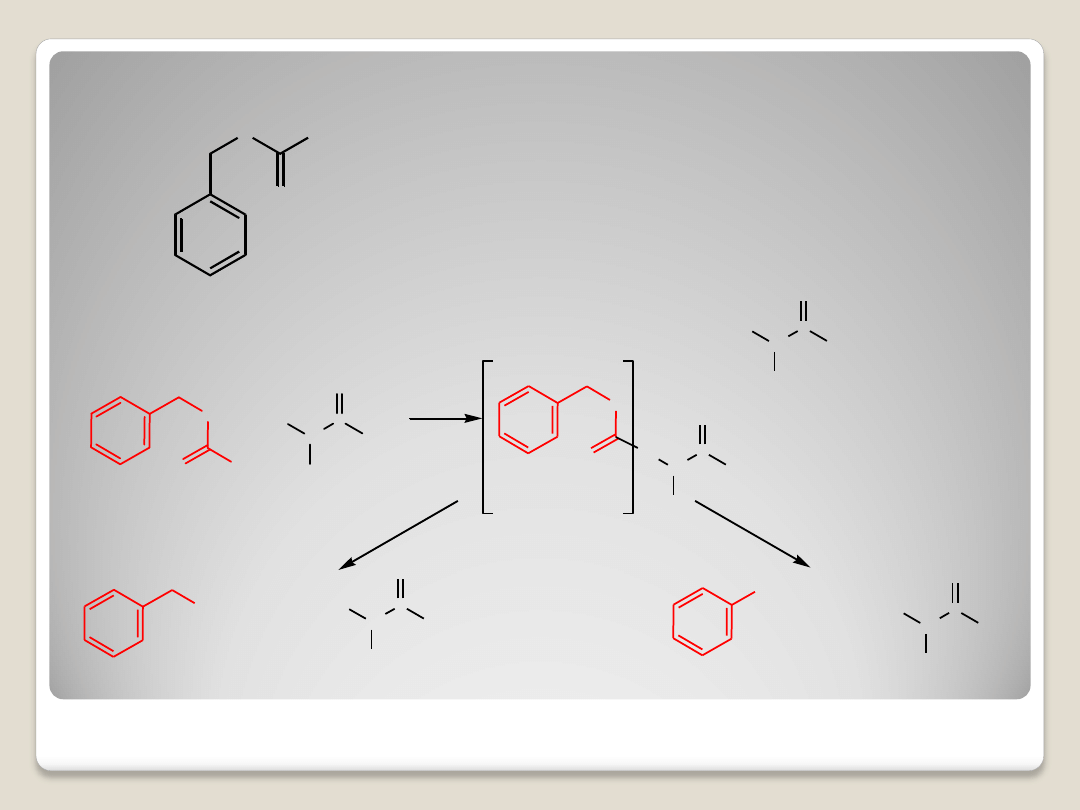
Grupy zabezpieczające
Cl
O
chloromrówczan benzylu
O
Cl
O
O
H
2
N
CH
C
R
OH
O
+
O
O
NH
CH
C
R
OH
O
grupa benzyloksykarbonylowa (Cbz)
Cbz
HN
CH
C
R
OH
O
HBr, kwas octowy
H
2,
Pd/C
Br
+
CO
2
+
H
2
N
CH
C
R
OH
O
CH
3
+
CO
2
+
H
2
N
CH
C
R
OH
O

O
O
O
węglan di-tert-butylu
O
O
O
H
2
N
CH
C
R
OH
O
+
zasada
O
O
H
N
CH
C
R
OH
O
grupa tert-Butoksykarbonylowa (Boc)
Boc
HN
CH
C
R
OH
O
+
CO
2
+
H
2
N
CH
C
R
OH
O
HCl. kwas octowy

Najprostszym sposobem zwiększenia reaktywności grupy karbonylowej jest
przeprowadzenie w chlorek kwasowy. W syntezie peptydów stosujemy jednak
estryfikację z zastosowaniem DCC.
Z
HN
CH
C
R
OH
O
1. (C
2
H
5
)
3
N
2. ClCO
2
C
2
H
5
Z
HN
CH
C
R
O
O
O
O
bezwodnik
Z
HN
CH
C
R
O
O
O
O
+
H
2
N
CH
C
R
OH
O
Z
HN
CH
C
R
O
NH
CH
C
R
OH
O
+
CO
2
+
C
2
H
5
OH
Aktywacja grupy karbonylowej
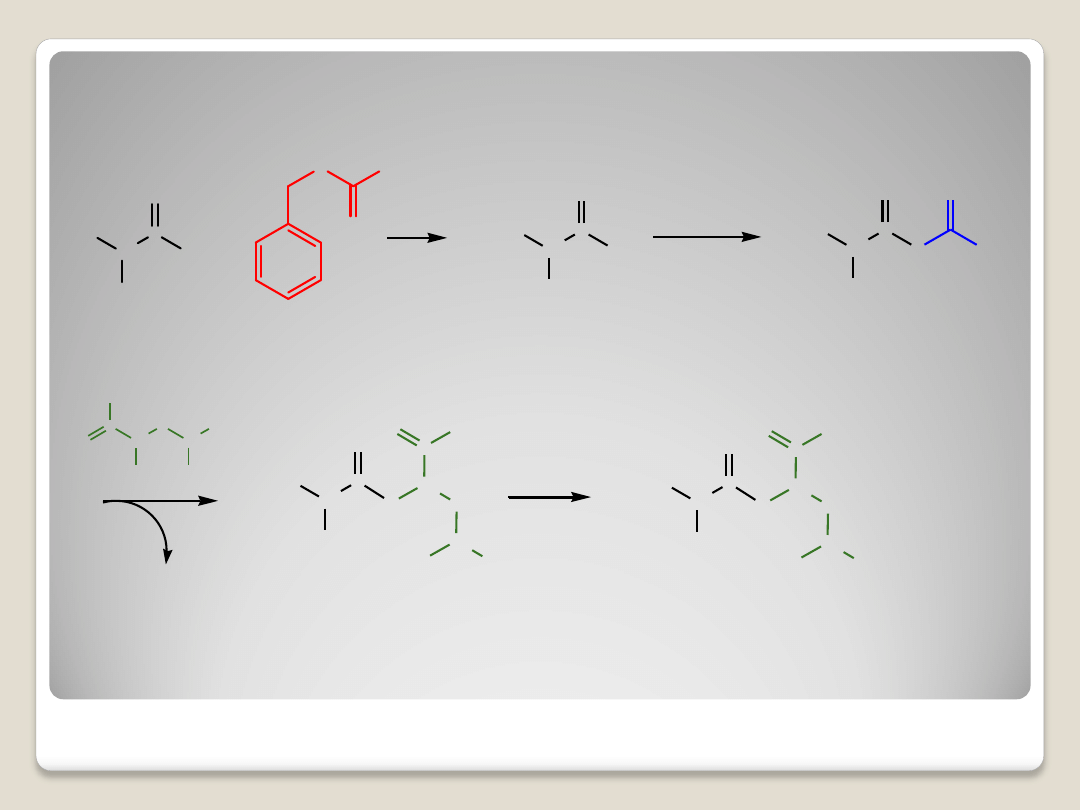
H
2
N
CH
C
CH
3
OH
O
+
O
O
Cl
Cbz
HN
CH
C
CH
3
OH
O
Ala
Cbz-Ala
1. (C
2
H
5
)
3
N
2.
ClCO
2
C
2
H
5
Cbz
HN
CH
C
CH
3
O
O
O
C
2
H
5
NH
2
CH
C
H
2
C
OH
O
CH
CH
3
CH
3
Cbz
HN
CH
C
CH
3
O
N
H
CH
C
CH
2
OH
O
CH
CH
3
H
3
C
CO
2
+ C
2
H
5
CbzAla-Leu
Leu
H
2
/Pd
H
2
N
CH
C
CH
3
O
N
H
CH
C
CH
2
OH
O
CH
CH
3
H
3
C
+ toluen + CO
2
Ala-Leu

Analiza sekwencji
peptydów

1. Metoda Sangera
Metoda bazuje na DNFB (2,4-dinitrofluorobenzenie). Po potraktowaniu peptydu DNFB
zachodzi reakcja S
N
Ar pomiędzy wolną grupą aminową terminalnego aminokwasu. Hydroliza
peptydu daje mieszaninę aminokwasów i terminalny aminokwas związany z DNFB.
O
2
N
F
NO
2
+
H
2
N
CH
C
CH
3
N
H
O
HCO
3
O
2
N
NO
2
H
N
CH
C
CH
3
N
H
O
H
O
2
N
NO
2
H
N
CH
C
CH
3
OH
O
+ mieszanina aminokwasów

2. Degradacja Edmana
Modyfikacja metody Sangera z zastosowaniem izocyjanianu fenylu.
N
C
S
H
2
N
CH
C
CH
3
N
H
O
+
pH~9
N
H
C
S
N
H
CH
C
CH
3
NH
O
H
N
H
C
S
N
CH
C
CH
3
O
H
+ polipeptyd z łańcuchem krótszym
o jeden aminokwas
N
CH
NH
C
S
CH
3
O
H
Polipeptyd jest ponownie zawracany do reakcji. Ostatni aminokwas, C-terminalny jest
identyfikowany enzymatycznie przez karboksypeptydazy.

Oznaczanie sekwencji
Wyznaczenie sumarycznego składu peptydu
2Val, Leu, His, Phe
DNFB + karboksypeptydaza
Wyznaczenie N-terminalnego i C-terminalnego aminokwasu
Val (Val, His, Phe) Leu
Hydroliza częściowa do dipeptydów
Val-His, His-Val, Val-Phe, Phe-Leu
Odczytanie sekwencji
Val-His-Val-Phe-Leu
Wyszukiwarka
Podobne podstrony:
Synteza aminokwasów
druk herb, I II Wstęp regulatory wzrostu inhibitory syntezy aminokwasów druk
8a Syntezy prostych aminokwasów
8a Syntezy prostych aminokwasów
aminokwasy
AMINOKWASY 7
06 Podstawy syntezy polimerówid 6357 ppt
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
Wykład VIII Synteza układów sekwencyjnych
Wykład katabolizm azotu aminokwasów
aminokwasy 1
Metabolizm aminokwasów
Przemiany aminokwasów w biologicznie ważne, wyspecjalizowane produkty
cwiczenie 7 Aminokwasy id 125541
02 Metody syntezy organicznej VI s1id 3675
aminokwasy wersja IV
3 NOWY Aminokwasy II 2012 2013(1)
Ćwiczenia usprawniające analizę i syntezę wzrokową oraz orientację przestrzenną(1), Ćwiczenia uspraw
Zastosowanie enzymow w syntezie- wyniki, PWR, III semestr
więcej podobnych podstron