
Wpływ reaktywnych form tlenu na ośrodkowy układ
nerwowy
The influence of reactive oxygen species on the central
nervous system
Marzena Gutowicz
Katedra i Zakład Biochemii, Warszawski Uniwersytet Medyczny
Streszczenie
Stresoksydacyjnywkomórkachorganizmutoprzewagapotencjałuoksydacyjnegonadstatusem
antyoksydacyjnym.Przyczynąstresuoksydacyjnegosąreaktywneformytlenu(RFT)powstają-
cepodczasniepełnejredukcjicząsteczkitlenuwłańcuchuoddechowymorazwielereakcjibio-
chemicznychzachodzącychwkomórce.SkutkiemdziałaniaRFTsąuszkodzeniabłonkomórko-
wych,zmianystrukturalneifunkcjonalnebiałekenzymatycznychinieenzymatycznych,zaburzenia
wbudowieDNA.Przyczynąstresuoksydacyjnegomożebyćnietylkonadmiernewytwarzanie
wolnychrodników,alerównieżspadekaktywnościenzymówantyoksydacyjnychi/lubobniżenie
poziomuczynnikówredukujących.
Mózgjestnarządemszczególniewrażliwymnadziałaniereaktywnychformtlenuzewzględu
nadużązawartośćnienasyconychkwasówtłuszczowych,intensywnymetabolizmtlenowyisto-
sunkowomałąaktywnośćenzymówantyoksydacyjnych.Licznedanewskazująnaudziałstresu
oksydacyjnegowpatogeneziewieluchoróbneurodegeneracyjnych
Słowa kluczowe:
ośrodkowy układ nerwowy • reaktywne formy tlenu • stres oksydacyjny
Summary
Oxidativestresscanbedefinedasariseofoxidativepotentialordecreaseofantioxidantstatus.
Oxidativestressiscausedbyreactiveoxygenspecies(ROS)whichareproducedbyone-elec-
tronreductionofoxygenintheelectrontransportchain,aswellasmanyotherreactions.Effects
ofROScanresultincellularmembranedamage,structuralandfunctionalchangesinenzymatic
andnon-enzymaticproteins,anddamagetotheDNAstructure.Excessivegenerationoffreera-
dicals,decreaseofenzymaticantioxidantactivity,and/orreducingagentsareconsideredasthe
maincausesofoxidativestress.
Sincethebraincontainsalargeamountofpolyunsaturatedfattyacids,consumesupto20%of
oxygenusedbythewholebody,andshowslowantioxidantactivity,itseemstobeespeciallyvul-
nerabletooxidativestress.
Numerousdatashowthesignificantroleofoxidativestressinpathogenesisofmanyneurodege-
nerativediseases.
Key words:
central nervous system • reactive oxygen species • oxidative stress
Received: 2010.10.20
Accepted: 2011.01.28
Published: 2011.02.19
104
Review
www.
phmd
.pl
® Postepy Hig Med Dosw (online), 2011; 65: 104-113
e-ISSN 1732-2693
® Postepy Hig Med Dosw (online), 2011; 65
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com
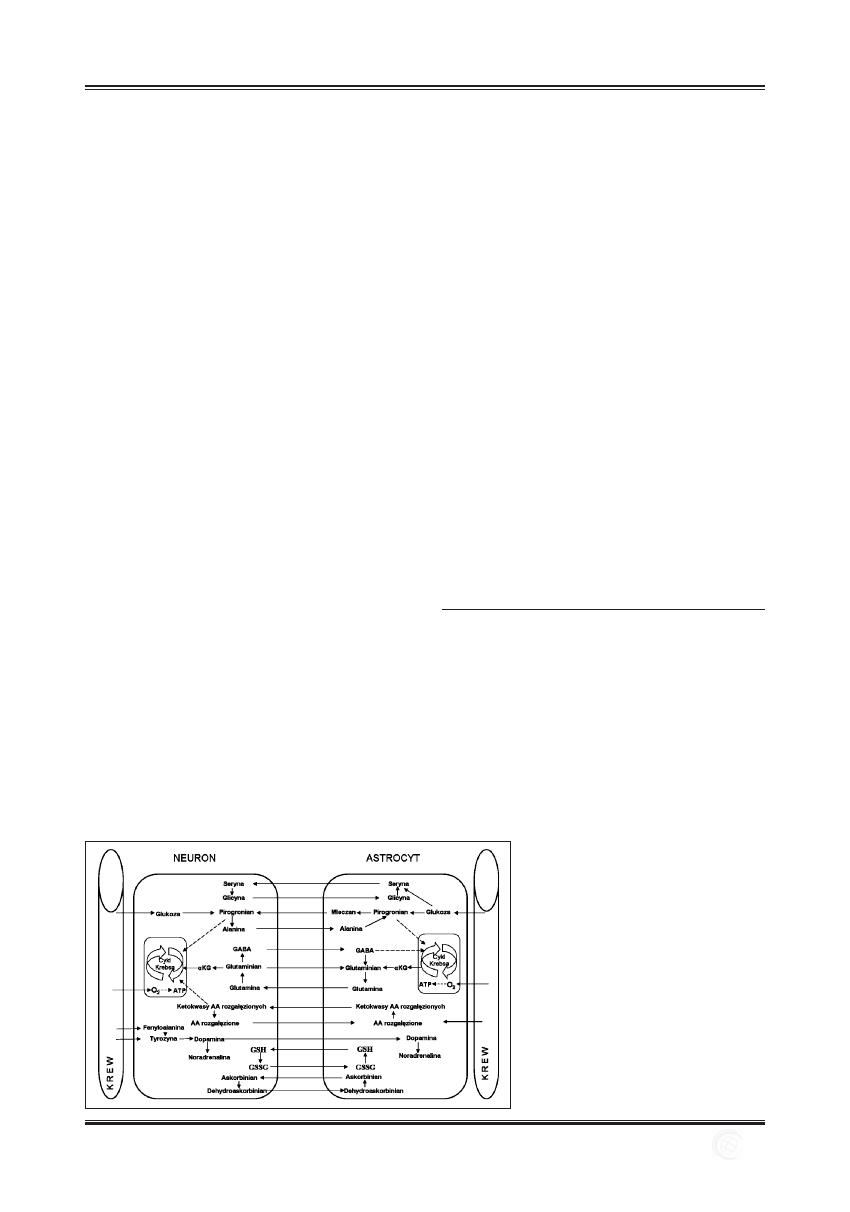
WskładOUNwchodzimózgowieirdzeńkręgowy,zbu-
dowanezkilkutypówkomórek,zktórychnajważniejszy-
misąneuronyiglej.Zadaniemneuronówjestodbieranie,
analizowanie,przetwarzanieiwysyłaniesygnałówdona-
rządówefektorowych.Komunikacjamiędzyneuronalna
odbywasiępoprzezsynapsyzudziałemróżnychneuro-
przekaźników(acetylocholina,noradrenalina,glutaminian,
serotonina,dopamina,GABA,NOiin.).
Komórkiglejumożnapodzielićnamakroglej(astrocyty
ioligodendrocyty)imikroglej.Komórkitenieprzekazu-
jąimpulsównerwowych,alepełniąfunkcjepomocnicze.
Głównymzadaniemoligodendrocytówjesttworzenieosło-
nekmielinowychaksonówiwspółudziałwprocesachme-
tabolicznychneuronów.Komórkimikroglejuuczestniczą
wobronieimmunologicznej,większośćznichtomakrofagi
osiadłeusuwająceześrodowiskaróżnepatogenyiobumarłe
neurony[92,96].Systemantyoksydacyjnyidetoksykacyj-
nyneuronówjestmałowydajny,dlategowiększośćfunkcji
obronnychprzejęłyastrocyty,którekontrolujągospodarkę
energetycznąneuronów,procesyoksydacyjno-antyoksyda-
cyjneorazrównowagęjonową.Magazynująiwydzielają
takieantyoksydantyjakglutationczykwasaskorbinowy,
służązamagazynsubstancjitoksycznychiproduktów
przemianymaterii.Astrocytywychwytujązkrwigluko-
zę,wbudowująjąwglikogenorazprzekształcająwmle-
czanidostarczajągoneuronom,atakżesyntetyzująciała
ketonowenapotrzebyneuronów.Ponadtowydzielajączyn-
nikiwzrostowe,uczestnicząwtworzeniusynapsitrans-
misjisynaptycznej,atakżeregulująneurogenezęwhipo-
kampieistrefiepodkomorowej[47,98].
W
olne
rodniki
tlenoWe
i
ich
pochodne
W
mózgu
człoWieka
Mózgczłowiekatoprawie2%masyciała,azużywa20%
całkowitejilościtlenupobieranegoprzezorganizm.Jak
wiadomotlenjestniezbędnydożycia,gdyżdziękiniemu
możliwejestuzyskanieenergiiwprocesieutleniania,ale
możeteżdziałaćtoksycznie,ponieważwwieluukładach
biologicznychzostajeprzekształconywreaktywneformy
(RFT).Doreaktywnychformtlenunależązarównowol-
nerodnikitlenowe(WRT)jakizwiązki,któremajązdol-
nośćichgenerowania.Prawie90%RFTpowstajewłań-
cuchuoddechowym,aleichźródłemsąrównieżreakcje
katalizowaneprzezoksydazy,cytochromP-450,procesy
hydroksylacjiniektórychksenobiotyków,promieniowanie
Full-text PDF:
http://www.phmd.pl/fulltxt.php?ICID=933486
Word count:
3919
Tables:
—
Figures:
2
References:
111
Adres autorki:
dr n. med. Marzena Gutowicz, Katedra i Zakład Biochemii, Warszawski Uniwersytet Medyczny, ul. S. Banacha 1,
02-097 Warszawa; e-mail: mgutowicz@wum.edu.pl
Wykaz skrótów:
DA – dopamina; DHA – kwas dokozaheksaenowy; DOPA – 3,4-dihydroksyfenyloalanina;
DOPAC – kwas dihydroksyfenylooctowy; GABA – kwas gamma-aminomasłowy; GSH – zredukowany
glutation; HO
2
•
– rodnik wodoronadtlenkowy; L
•
– lipidowy rodnik alkilowy; LOO
•
– lipidowy rodnik
nadtlenkowy; MAO – oksydaza monoaminowa; MDA – dialdehyd malonowy; NF-
kB – jądrowy
czynnik transkrypcyjny
kB (nuclear factor kB); NO – tlenek azotu; NOS – syntaza tlenku azotu;
O
2
–.
– anionorodnik ponadtlenkowy;
•
OH – rodnik hydroksylowy; ONOO
–
– nadtlenoazotyn;
OUN – ośrodkowy układ nerwowy; RFT – reaktywne formy tlenu; SOD – dysmutaza ponadtlenkowa;
WNKT – wielonienasycone kwasy tłuszczowe; WRT – wolne rodniki tlenowe.
Ryc. 1. Wzajemna wymiana składników między
astrocytem i neuronem
Gutowicz M. – Wpływ reaktywnych form tlenu na ośrodkowy układ nerwowy
105
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com
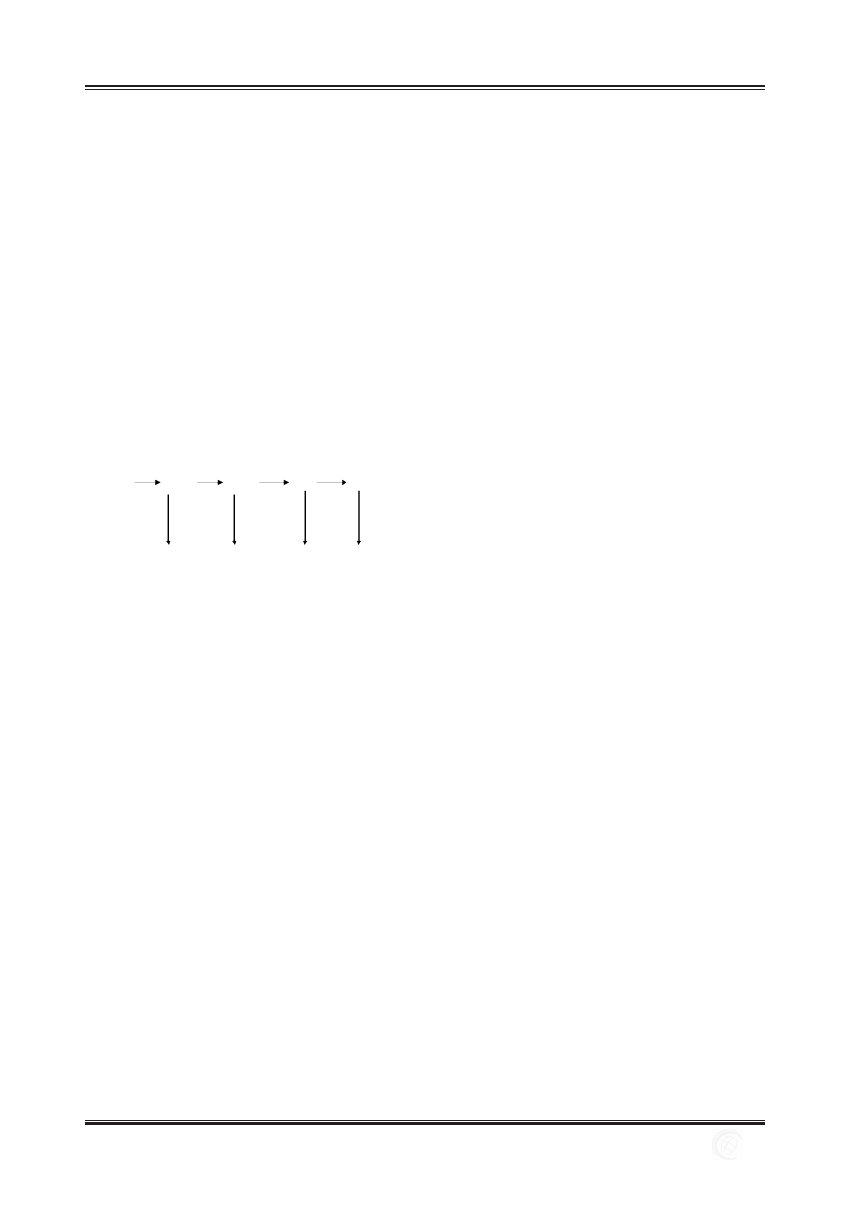
jonizujące,jonymetaliprzejściowych,zanieczyszczenia
środowiskoweiwieleinnychczynników[11,28].Wolne
rodnikisątoatomylubcząsteczkizawierającejedenlub
więcejniesparowanychelektronównaorbitaluwalencyj-
nym.CharakterystycznącechąWRTjestichdużareak-
tywnośćikrótkiokrespółtrwaniawynikającyzdążenia
dosparowaniaelektronówprzezodebranieluboddanie
ichinnymcząsteczkom.Wwynikudziałaniareaktywnych
formtlenudochodzidowielorakichuszkodzeńwewnątrz-
komórkowych,takichjakperoksydacjalipidówbłonko-
mórkowych,inaktywacjaenzymów,uszkodzenieDNA,
zmianystrukturalnewcząsteczkachbiałekiwęglowoda-
nów.Oksydacyjniezmodyfikowanezwiązkiicząstecz-
kizaburzająhomeostazękomóreknerwowych,comoże
prowadzićdoichśmierciwwynikuapoptozylubnekro-
zy[8,100].Licznebadaniawskazują,żereaktywneformy
tlenymogąsięprzyczyniaćdorozwojuwieluchoróbneu-
rodegeneracyjnych.WiększośćRFTpowstajepodczasjed-
no-,dwu-lubtrójelektronowejredukcjicząsteczkitlenu
włańcuchuoddechowym.
Anionorodnik ponadtlenkowy O
2
–
·
Wwynikujednoelektronowejredukcjitlenupowstajeanio-
norodnikponadtlenkowy:
O
2
+e
–
®O
2
–.
Głównym„producentem”O
2
–.
wmózgusąmitochondria
(zwłaszczaIkompleksłańcuchaoddechowegoorazko-
enzymQ
10
).Anionorodnikponadtlenkowypowstajerów-
nieżpodczas„wybuchutlenowego”woligodendrocytach
wwynikudziałaniaoksydazyNAD(P)Horazwinnych
reakcjachoksydoredukcyjnych.BogatymźródłemO
2
–.
są
mikrosomy,gdziedziałałańcuchtransportuelektronów
isystemmonooksygenazzależnychodcytochromuP-450.
WperoksysomachgłównymźródłemO
2
–.
jestoksydaza
ksantynowautleniającahipoksantynęiksantynędokwa-
sumoczowegoorazłańcuchtransportuelektronówzwiąza-
nyzreduktaząNADHicytochromemb5.Autooksydacja
adrenaliny,noradrenalinyizwiązkówtiolowychrównież
prowadzidopowstaniaanionorodnikaponadtlenkowego.
Anionorodnikponadtlenkowynienależydonajbardziejre-
aktywnychWRT,alemazdolnośćutlenianiajonówme-
taliprzejściowych,przezcomożeinaktywowaćenzymy,
którychtemetalesąkofaktorami.Matakżezdolnośćutle-
nianiacysteiny,cozmieniakonformacjębiałekimożepo-
zbawiaćenzymyaktywnościbiologicznej[20,41,48,110].
Znacznie silniejszym utleniaczem jest sprotonowa-
napostaćanionorodnikaponadtlenkowegoczylirodnik
wodoronadtlenkowy(HO
2
•
),któryłatwiejdyfundujeprzez
błonyiszybciejwchodziwreakcjęzezwiązkamioładun-
kuujemnym.Jestontakżegłównyminicjatoremperoksy-
dacjilipidów[94].
Nadtlenek wodoru H
2
O
2
Podczasdwuelektronowejredukcjicząsteczkitlenupo-
wstajenadtlenekwodoru:
O
2
+2e
–
+2H
+
®H
2
O
2
Powstajeonrównieżwwynikudysmutacjidwóchaniono-
rodnikówponadtlenkowych.Procestenmożeprzebiegać
spontanicznie,alewkomórceponad90%tegotypureak-
cjizachodzizudziałemdysmutazyponadtlenkowej(SOD):
O
2
–.
+O
2
–.
+2H
+
®
SOD
H
2
O
2
+O
2
Nadtlenekwodorupowstajetakżewwynikudziałaniaoksy-
dazyD-aminokwasowej,glikolanowej,aldehydowejiwielu
innychoksydoreduktaz,którewspółpracujązFADH
2
jako
koenzymem.Wmózguistotnymi„producentami”H
2
O
2
są
oksydazymonoaminowe(MAO)utleniającedopaminędo
kwasudihydroksyfenylooctowego(DOPAC)orazreakcje
samoutlenianiadopaminydomelanin[50,68]:
DA+O
2
+H
2
O
®
MAO
DOPAC+NH
3
+H
2
O
2
Dużeilościnadtlenkuwodorupowstająwfagocytują-
cychkomórkachmikroglejupodczas„wybuchutlenowe-
go”.ReaktywnośćH
2
O
2
jestnajniższazewszystkichRFT.
Jednakdługiokrespółtrwaniaorazbrakładunkuelektrycz-
negopowoduje,żeH
2
O
2
możeswobodniedyfundowaćprzez
błonykomórkowedziałającdalekoodmiejscapowstania.
BezpośrednionieutleniaonlipidówbłonowychaniDNA,
alemożeutleniaćgrupytiolowe,fenolowe,tioestrowe,czy
indoloweróżnychzwiązków.Wkomórcenadtlenekwodo-
rurozkładanyjestdowodyprzezkatalazęiperoksydazę
glutationową[11,30].
Rodnik hydroksylowy
•
OH
H
2
O
2
wobecnościjonówmetaligrupprzejściowychwy-
twarzarodnikhydroksylowy:
Fe
2+
+H
2
O
2
®Fe
3+
+
•
OH+OH
–
(reakcjaFentona)
Rodnikhydroksylowymożeteżpowstaćwreakcjinadtlen-
kuwodoruzanionorodnikiemponadtlenkowymzudzia-
łemjonówmetali[62]:
O
2
–.
+H
2
O
2
®
Fe
2+
/Cu
1+
•
OH+OH
–
+O
2
(reakcjaHabera-Weissa)
WmózgugłównymźródłemżelazadoreakcjiFentona
iHabera-Weissasąferrytyna,neuromelaninaorazmikro-
glej.Rodnikhydroksylowynależydonajbardziejagresyw-
nychWRT.Możeonbyćdonoremiakceptoremelektronu,
więcmożebyćzarównoreduktoremiutleniaczem.Dzięki
bardzodużejreaktywnościimałejswoistościsubstratowej
•
OHmożeatakowaćwszystkiecząsteczkizjakimizetknie
sięwkomórce.Rodnikhydroksylowyuszkadzabiałka
przezutlenienieresztaminokwasóworazgrupsulfhydry-
lowych.ModyfikujerównieżzasadyazotowewDNA,co
1
O
2
O
2
-
O
2
2-
O
-
O
-2
HO
2
-
H
2
O
2
HO
·
H
2
O
H
+
2H
+
H
+
2H
+
e
e
e
e
Ryc. 2. Wolne rodniki tlenowe
Postepy Hig Med Dosw (online), 2011; tom 65: 104-113
106
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

możepowodowaćpęknięciapodwójnejhelisy.Narażone
najegodziałaniesązwłaszczanienasyconekwasytłusz-
czowe,cojestwyjątkowoniebezpiecznedlatkankimó-
zgowej,któraażw60%zbudowanajestzlipidów.Duże
ilości
•
OHpowstająwfagocytującycholigodendrocytach
wreakcjikatalizowanejprzezmieloperoksydazę[49,15].
Rodnikhydroksylowywmózguhamujeaktywnośćoksy-
dazmonoaminowych(MAO-A,MAO-B),enzymówodpo-
wiedzialnychzakatabolizmtakichneuroprzekaźnikówjak
dopamina,noradrenalinaczyserotonina.Przyczyniasięteż
doutratyneuronówwniedokrwieniumózgu,wchorobach
ParkinsonaiAlzheimera.Wreakcji
•
OHzdopaminąpo-
wstaje6-hydroksydopaminauznawanazagłównyczynnik
odpowiedzialnyzapatogenezęchorobyParkinsona[6,81].
Tlenek azotu NO
Dowolnychrodnikówzaliczamyteżtlenekazotuwytwa-
rzanygłównieprzezsyntazętlenkuazotuzargininyiO
2
.
Wneuronachwystępujeizoenzymkonstytutywnysyntazy
NO(nNOS),natomiastwmakrofagachiglejuindukowany
(iNOS).AktywnośćnNOSzależnajestodjonówwapnia
ikalmoduliny.NOwmózgupełnifunkcjęneuroprzekaź-
nikaineuromodulatora,jednakzewzględunaswójwol-
norodnikowycharaktermożerównieżdziałaćtoksycznie.
Zaobserwowanowzroststężeniatlenkuazotuwmózgu
osóbzestwardnieniemrozsianym[102].
Tlenekazotułatwowchodziwreakcjęzżelazemkomplek-
sówżelazowo-siarkowychihemu,inaktywująctakiebiałka
jakcytochromy,hemoglobinaczykatalaza.Możeteżuwal-
niaćżelazozferrytyny,cojestszczególnieniebezpieczne
wniektórychstrukturachmózgu[63,82].Nadmiernewy-
twarzanieNOmożeprowadzićdodegeneracjineuronów,
ponieważjestoninhibitoremoksydazycytochromowej–
ostatniegoenzymułańcuchaoddechowego.NOiinneWRT
utleniająaktywneresztycysteinywneurograninie–neuro-
nalnejkinaziebiałkowejC,aliczbapowstałychmostków
disiarczkowychzależyodnasileniastresuoksydacyjnego.
WiążącsięzgrupąhemowącyklazyguanylowejNOakty-
wujejąizapomocąpowstałegocGMPwywołujeróżno-
rodneskutkibiologiczne.Łatwowiążesięzglutationem
lubzinnymizwiązkamitiolowymitworząctzw.nitrozo-
tiole,któreodgrywająważnąrolęwtransporcie,magazy-
nowaniuimetabolizmieNO[80,95].Wwynikureakcji
tlenkuazotuzanionorodnikiemponatlenkowympowsta-
jewysokoreaktywnynadtlenoazotyn(ONOO
–
),któryni-
trozylujebiałka,zasadyazotowewDNA,hamujegliko-
lizę(awięcteżsyntezęATP),uszkadzafosfolipidybłon
synaptycznych.ONOO
–
zaburzafosforylacjębiałekijest
aktywatoremkinazytyrozynowejonkogenusrc.obniżateż
stężenieGSHorazhamujeaktywnośćsyntetazyglutami-
nowej.Wneuronachnadtlenoazotynaktywujeapoptozę,
natomiastwastrocytachjąhamuje[36,57,58].
S
treS
okSydacyjny
W
oun
WsprawniefunkcjonującychkomórkachOUNpanujerów-
nowagamiędzypowstawaniemwolnychrodnikówaichusu-
waniemPrzesunięcierównowagiwkierunkutworzeniaRFT
generujestresoksydacyjny.Inaczejmówiąc,stresoksy-
dacyjnyjesttowzrostpotencjałuutleniającegodopozio-
muzagrażającegostabilnościstrukturkomórkowych[89].
Zużywając20%tlenumózgjestszczególnienarażonyna
atakwolnychrodników.Około5%tlenu,któryjestwykorzy-
stywanywłańcuchuoddechowymwmitochondriachoraz
wperoksysomachimikrosomachzamienianejestwjegore-
aktywneformy[48,52].Zewzględunaswójkształt,neuro-
nywykazująbardzoniekorzystnystosunekpowierzchnido
objętości,dlategonajbardziejnarażonenadziałaniewolnych
rodnikówsąbłonykomórkowe,wktórychmożewystąpić
wieleszkodliwychprocesów,takichjak:zmianapłynności
błonspowodowanaperoksydacjąlipidów,modyfikacjaak-
tywnościenzymówbłonowych,utlenianiegruptiolowych
białekbłonowych,rozprzęgnięcietransportubłonowego,
zmianacharakteruantygenowegobłonorazderegulacja
potencjałubłonowego.Przyczynąstresuoksydacyjnego
wmózgumożebyćnadmiernewytwarzaniewolnychrod-
ników,obniżenieaktywnościenzymówantyoksydacyjnych
i/lubobniżeniestężeniaczynnikówredukujących[56,69].
W
płyW
reaktyWnych
form
tlenu
na
Składniki
komórek
oun
Lipidy
Najpowszechniejwystępującymprocesemwolnorodnikowym
wkomórcejestłańcuchowaperoksydacjalipidów,polegająca
nautlenianiuresztwielonienasyconychkwasówtłuszczowych
(WNKT),którewchodząwskładfosfolipidówbłonowych
ilipoprotein.Procestenmożezachodzićnieenzymatycznie
wwynikureakcjiwolnorodnikowych,bądźzudziałemenzy-
mów,takichjakcyklooksygenazyilipooksygenazy.Proces
nieenzymatycznejautooksydacjimożnapodzielićnatrzyeta-
py:inicjację,prolongacjęiterminację.Inicjacjęperoksyda-
cjilipidówmogązapoczątkowaćtakieRFTjak:ozon,NO,
ONOO
–
,rodnikhydroksylowyiwodoronadtlenkowy,atak-
żepośredniojonymetaliprzejściowych[3,37,71].Wwyni-
kuusunięciawodoruzgrupymetylenowejnienasyconego
kwasutłuszczowegoprzezrodniktlenowypowstajerodnik
alkilowyzniesparowanymelektronemprzyatomiewęgla:
LH
®
RFT
L
•
Rodnikalkilowymożereagowaćztlenemipowstajerod-
niknadtlenkowy:
L
•
+O
2
®LOO
•
Wfazieprolongacjirodniknadtlenkowyreagujezinnym
nienasyconymkwasemtłuszczowymgenerującwodoro-
nadtleneklipidowyikolejnyrodnikalkilowy:
LOO
•
+LH
®LOOH+L
•
LOO
•
iL
•
mogąutleniaćkolejnecząsteczkikwasówtłuszczo-
wych,jesttoreakcjałańcuchowa,wwynikuktórejmożedojść
doautooksydacjikilkusetcząsteczekWNKT.Terminacjape-
roksydacjimożezajśćwreakcjidysproporcjonowaniadwóch
rodnikówalkilowychlubnadtlenkowych[77,85]:
L
•
+L
•
®LL
LOO
•
+LOO
•
®LOOL+O
2
lubwreakcjimiędzydwomaróżnymirodnikami:
LOO
•
+L
•
®LOOL
Gutowicz M. – Wpływ reaktywnych form tlenu na ośrodkowy układ nerwowy
107
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

Produktyperoksydacjiulegajądalszymprzemianomdo
fragmentóworóżnejdługości.Najbardziejznanymwy-
znacznikiemautooksydacjilipidówjestdialdehydmalono-
wy(MDA),aleopróczniegopowstajewieleinnychzwiąz-
kówocharakterzealdehydów,ketonów,epoksydówczy
węglowodorównp.wwynikuperoksydacjikwasuarachi-
donowegopowstajeponad60różnychzwiązków.Wtrak-
ciemetabolizmukwasuarachidonowegopowstajerów-
nieżanionorodnikponadtlenkowy(wwynikudziałania
lipooksygenazy)irodnikhydroksylowy(wwynikudzia-
łaniacyklooksygenazy).Końcoweprodukty
b-degradacji
WNKTreagujązinnymilipidami,zgrupamitiolowymi
iaminowymibiałek,zzasadamiazotowymikwasównu-
kleinowychiaminocukramiwywołującróżnorakieskutki,
takiejak:zmianawłaściwościantygenowychbiałek,inak-
tywacjaenzymów,zahamowaniereplikacjiitranskryp-
cji,mutagenezaikancerogeneza[11,109].Najgroźniejszy
zmetabolitów–4-hydroksy-2-nonenalhamujeglikolizę,
syntezębiałekikwasównukleinowych.Upośledzatrans-
portglukozyiglutationu,uszkadzaneuronycholinergicz-
neiprzyspieszaapoptozękomóreknerwowych[18].Mózg
człowiekawponad60%składasięzlipidów,awiększość
znichtofosfolipidybłonowezresztaminienasyconych
kwasówtłuszczowych.Peroksydacjiszczególniełatwo
ulegająkwasarachidonowy(20:4n-6)idokozaheksaeno-
wy(22:6n-3;DHA),którestanowiągłównąpulęWNKT
wmózgu.PodczasperoksydacjiDHApowstajązwiąz-
kizwaneneuroprostanami,gdyżznalezionojegłównie
wneuronach.Pozatymdużestężenieżelazawniektórych
strukturachmózgudodatkowoprzyspieszautlenianieli-
pidów.Aldehydoweproduktyperoksydacjilipidówmogą
kowalencyjniewiązaćsięwreakcjiMichaelazgrupami
tiolowymibiałeklubzglutationem,obniżającichstęże-
niewkomórce.MogąteżtworzyćzasadySchiffazwol-
nymigrupamiaminowymiaminokwasówlubwiązaćsię
zzasadamiazotowymiDNAinicjującprocesymutagene-
zyikancerogenezy.Stężenieproduktówperoksydacjili-
pidówuchorychnaParkinsonajest8-krotniewyższeniż
uosóbzdrowych[5,17,38].
Białka
Dużaaktywnośćmetabolicznaitlenowamózgujestszcze-
gólnieniebezpiecznadlabiałek.Reaktywneformytlenu
uszkadzająstrategiczneaminokwasy,takiejakcysteina,
seryna,tyrozynaczytreoninazmieniającaktywnośćen-
zymówiwłaściwościbiałeknieenzymatycznych[99].Pod
ichwpływemmożedojśćdoutlenieniazarównołańcucha
polipeptydowego,jakiresztaminokwasowych.Możeto
prowadzićdofragmentacjipolipeptydu,tworzeniawiązań
krzyżowych,zmianstrukturyaminokwasów,copowoduje
najczęściejutratębiologicznychfunkcjibiałka,alemoże
teżspełniaćfunkcjeregulatorowe[11,84].
WiększośćWRTmazdolnośćinicjacjioksydacjibiałek,
alenajgroźniejszyjestrodnikhydroksylowy.
•
OHzwykle
odrywaprotonprzywęglu
awytwarzającrodnikalkilowy,
któryreagującztlenemtworzyrodnikalkoksylowy.Oba
terodnikimogąutleniaćkolejneaminokwasy,coprowa-
dzidopęknięćwłańcuchupolipeptydowym.Oderwanie
protonuprzywęglu
gglutaminianulubasparaginianu
możerównieżspowodowaćfragmentacjębiałka[29,99].
NajbardziejwrażliwenadziałanieWRTsąaminokwasy
siarkoweiaromatyczne.Cysteinautleniasiędoróżnych
pochodnych(wzależnościodczynnikautleniającegoido-
stęputlenu)lubdocystyny,ametioninadosulfotlenków.
Tyrozynamożezostaćutlenionado3,4-dihydroksyfeny-
loalaniny(DOPA)lubmożetworzyćwiązaniakrzyżowe
zdrugątyrozyną.Wwynikuutlenieniatryptofanupowstaje
formylokinureinaikinureina,ahistydyny2-oksohistydy-
na.Aminokwasyzwolnągrupąhydroksylową,aminową
lubamidowączęstoutlenianesądopochodnychkarbony-
lowychbędącychgłównymwyznacznikiemoksydacyj-
nychuszkodzeńbiałek.Pochodnetemogąreagowaćzli-
zynątworzącwiązaniakrzyżowe[16,25,60,83].
Równieżtlenekazotumożezmieniaćfunkcjewielubiałek
ienzymów.ReagujączgrupąhemowącytochromuP-450
hamujejegoaktywność.Indukujeteżbiałkop53(supresor
onkogenezy),wywołującapoptozękomóreknerwowych.
NOtworzącnitrozo-żelazowo-siarkowykomplekszako-
nitaząblokujecyklKrebsa,atakżewzależnościodstęże-
nia,możehamowaćposzczególneenzymyłańcuchaodde-
chowegoidehydrogenazępirogronianową.Zahamowanie
aktywnościenzymówzwiązanychzmetabolizmemener-
getycznymjestzabójczedlaneuronów,zewzględunaich
dużezapotrzebowanienaATP[10,32,64].
Wysocereaktywnymczynnikiemutleniającymjestrów-
nieżnadtlenoazotyn,któryopróczzdolnościoksydacyj-
nychwykazujeaktywnośćnitrowania(przyłączanieNO
2
)
initrozowania(przyłączanieNO)resztaminokwasów.
WwynikureakcjiONOO
–
zpierścieniemarylowymty-
rozynypowstaje3-nitrotyrozynalub2,5-dinitrotyrozyna,
copowodujeinaktywacjętakichenzymówjak:SOD-1,
syntetazaglutaminowa,syntazaprostacykliniin.[35,36].
WynikiemdziałaniaRFTjestzmianaaktywnościbiałek
regulatorowych,cojestszczególnieniebezpiecznedlame-
tabolizmukomóreknerwowych.Reaktywneformytlenu
zaburzająfunkcjonowaniekaskadprzekazywaniasygna-
łówwewnątrzkomórkowychorazmodyfikujączynniki
transkrypcyjnegenówodpowiedzinastresoksydacyjny
poprzezzmianęichkonformacjii/lubutlenieniestrate-
gicznychaminokwasów,takichjakcysteina,tyrozyna,czy
seryna.Dobiałekszczególniewrażliwychnaszoktlenowy
należątioredoksyna,transferazaS-glutationowaoraztzw.
kinazystresu–enzymyuaktywnianeprzezbiałkabogate
wcysteinę,którychkonformacjazostałazmienionaprzez
wolnerodniki[2,24].
Oksydacyjnieuszkodzonebiałkazazwyczajtracąaktywność
biologiczną,mająteżtendencjędotworzeniaagregatów,
ponieważprzestająbyćrozpoznawaneprzezproteasomy
oraznieulegająubikwitynacji.Stężeniegrupkarbonylo-
wych–głównegomarkeraoksydacjibiałek–wistocie
czarnejjestdwukrotniewyższeuchorychnaParkinsona
niżuosóbzdrowych[91,69].
Kwasy nukleinowe
DNAzewzględunaswefunkcje,czyliprzechowywanie,
powielanieiprzekazywanieinformacjigenetycznej,jest
bardziejodpornynadziałanieRFTniżinneskładnikiko-
mórki.NajgroźniejszymdlaDNAjestrodnikhydroksylo-
wy,któryuszkadzazarównozasadyazotowe,resztycukro-
we,jakiwiązaniafosfodiestrowe,powodującmodyfikację
nukleotydóworazpęknięcianiciDNA.Najczęstszym
Postepy Hig Med Dosw (online), 2011; tom 65: 104-113
108
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

uszkodzeniomulegająresztytymidynyprowadzącdopo-
wstaniadimeróworazróżnychnadtlenków.Wwynikure-
akcji
•
OHzguaninąpowstaje8-hydroksyguanina,atopro-
wadzidomutacjityputranswersjiG-C
®T-A.Utlenienie
podwójnychwiązańwpierścieniucytozynyprowadzido
powstania5-hydroksycytozyny.Równiegroźnymjak
•
OH
jestnadtlenoazotyn,któryopróczutlenianianukleotydów
mateżzdolnośćichnitrowania.Wreakcjizguaninątwo-
rzy8-nitroguaninę,powodująctranswersjęG-C
®T-A.RFT
zwiększająstężeniejonówwapniawkomórce,coprowa-
dzidoaktywacjikinazbiałkowychzależnychodCa
2+
od-
powiedzialnychzafosforylacjęczynnikówtranskrypcyj-
nych[72,78].
Modyfikacjezasad,delecje,adduktypirymidynowe,wy-
wołaneWRTprowadządozaburzeńwasocjacjiczynni-
kówtranskrypcyjnych,zmianyramkiodczytu,zwiększo-
nejekspresjiprotoonkogenów,pęknięćchromosomów
iwieluinnychanomaliiczęstodlakomórkiletalnych[27].
Mitochondriazewzględunaobecnośćłańcuchaoddechowe-
gogenerująnajwięcejwolnychrodników.Mitochondrialny
materiałgenetycznyjestszczególnienarażonynamutacje
wywołaneRFT,ponieważniejestchronionyprzezbiałka
histonoweibłonęjądrowąorazniemasekwencjiintrono-
wych[12].JakwrażliwyjestDNAmitochondrialnyświad-
czyto,żenawetw„zdrowych”mitochondriachstwierdzo-
noszesnastokrotniewiększestężenie8-hydroksyguaniny
niżwDNAjądrowym[13].Sześćdziesiątdwaprocentmi-
tochondriówznajdujesięwdendrytacha23%wsynap-
sach,czyliwiększośćenergiiwytwarzanejprzezneurony
zużywanajestnaodbióriprzekazywaniesygnałówner-
wowych,dlategotakniebezpiecznedlaukładunerwowego
sąjakiekolwiekmodyfikacjewmitochondrialnymmate-
rialegenetycznym.Wwiększościchoróbneurodegenera-
cyjnychstwierdzonodysfunkcjęmitochondriówspowodo-
wanąstresemoksydacyjnym[9,43].
S
treS
okSydacyjny
a
choroby
neurodegeneracyjne
Przyczynywieluchoróbneurodegeneracyjnychniezostały
dokońcawyjaśnione.Wieleróżnychczynnikówmożemieć
wpływnaetiologiętychschorzeń:czynnikigenetyczne,
toksyny(endogenneiśrodowiskowe),zakażeniabakteryj-
neiwirusowe.PodejrzewasięteżudziałRFTwpatogene-
ziechoróbParkinsona,Alzheimera,wstwardnieniurozsia-
nymczystwardnieniuzanikowymbocznym.Wielebadań
wskazujenawzrostpoziomuRFTwudarachiuszkodze-
niachmózgu,anawetwchorobachpsychicznych[50,44].
Neuronysąszczególniewrażliwenazaburzeniaoksyda-
cyjne,zewzględunanasilonymetabolizmtlenowy,dużą
zawartośćnienasyconychkwasówtłuszczowychorazrela-
tywnieniskipoziomantyoksydantów(zarównoenzyma-
tycznychjakinieenzymatycznych).Nawetkrótkotrwałe
niedotlenieniepowodujewzroststężeniaRFTiuszkodze-
nialipidów,białekiDNA[56,109].
Choroba Alzheimera (AD)–charakterystycznymobja-
wemtejchorobysązłogibeta-amyloiduwprzestrzenimię-
dzykomórkowejorazodkładaniecytoszkieletarnychbiałek
tauwewnątrzneuronów.Pozatymnastępujeutrataneuro-
nówcholinergicznychwprzodomózgowiu,zmianywsy-
napsachkorymózgowejihipokampa[59].
Wmózguosóbzmarłychipłyniemózgowo-rdzeniowym
chorychzaobserwowanopodwyższonestężenie4-hydrok-
synonenaluidialdehydumalonowego–produktówperok-
sydacjilipidów,wzroststężenianeuroprostanów,produk-
tówperoksydacjikwasudekozaheksaenowegoorazgrup
karbonylowych–produktówutlenianiabiałek.Stwierdzono
takżewzroststężenia8-hydroksyguaniny–markeraoksy-
dacyjnychuszkodzeńDNA,przyobniżonejaktywności
transferazyglutationowej,ważnegozmiataczautlenionych
produktówprzemianmetabolicznych[19,65,70].Unosi-
cieligenuApoE-epsilon-4,kodującegoapolipoproteinęE,
stwierdzononasileniestresuoksydacyjnegowhipokam-
pie[87].Zewzględunaobecnośćłańcuchaoddechowego
mitochondriasąnajbardziejnarażonenautlenianieswo-
ichskładników.WmitochondriachpacjentówzADwy-
stępujetrzyrazywięcejuszkodzeńniżuosóbzdrowych,
stwierdzonoteżzmniejszonąaktywnośćoksydazycyto-
chromowejwkorzeczołowejiskroniowej,coprowadzido
akumulacjiproduktówniepełnejredukcjicząsteczkitlenu,
azwłaszczarodnikahydroksylowego[74,101].
Niektórzybadaczesugerująudziałprocesówzapalnych
wpatogeneziechorobyAlzheimera,coprowadzidoakty-
wacjimikroglejuinasileniastresuoksydacyjnegospowo-
dowanegowybuchemtlenowym[22].Dotychczasniema
jednoznacznychopiniiczytopowstającezłogibeta-amylo-
iduaktywująstanzapalnyinadmiernewytwarzanierodni-
ków,czyteżstresoksydacyjnyiczynnikiprozapalnepowo-
dująodkładaniesięzłogówihiperfosforylacjębiałkatau.
Choroba Parkinsona (PD)–poleganapostępującymza-
nikuneuronówdopaminergicznychistotyczarnej.Prowadzi
todoniedoborówdopaminy,coskutkujezaburzeniami
neuromotorycznymi.Jakdotychczasnieustalonojedno-
znacznejprzyczynychorobyParkinsona,wydajesię,że
tychprzyczynmożebyćbardzowieleodgenetycznych
pośrodowiskowe.Spośródwszystkichprzypadków90%
totzw.sporadycznapostaćParkinsona,a10%rodzinna
[107].WkilkurodzinnychpostaciachPDstwierdzonomu-
tacjęwgeniekodującymalfa-synukleinę(PARK1),parki-
nę(PARK2)lubhydrolazęC-końcaubikwitynyUCH-L1
(PARK5).MutacjewgenachPARKpowodująpowstawa-
niebłędniesfałdowanychbiałekorazbiałek,któreniede-
gradująwproteasomachiulegająagregacjiwpostaciciał
Lewy’ego[61,106].
Innateoriazakładadługotrwałąekspozycjęnaniewielkie
dawkiśrodkówtrujących,takichjakpestycydy,ołówczy
konserwanty[53].
Kolejnateoriasugerujedziałanieczynnikainicjującego
zapalenie,możetobyćpatogen,czasoweniedotlenienie
czystresoksydacyjny.Podwpływemczynnikainicjują-
cegoobumieraniewielkaliczbaneuronów,topowoduje
aktywacjęmikroglejuisekrecjęcytokin,którezkoleiak-
tywująwneuronachreceptoryTNF,towłączaszlakapop-
totycznypoprzezaktywacjękaspaz[55,73].
TeoriawolnorodnikowazakładaudziałRFTwpatogene-
ziechorobyParkinsona.Wytwarzaniunadmiernychilości
wolnychrodnikówsprzyjajądużestężeniażelazaidopa-
minywneuronachistotyczarnej.Dopaminajestmetabo-
lizowanaprzezmonooksygenazy,ajednymzproduktów
tejreakcjijestH
2
O
2
,którywreakcjiFentonazudziałem
Gutowicz M. – Wpływ reaktywnych form tlenu na ośrodkowy układ nerwowy
109
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

jonówżelazaprzekształcanyjestwnajbardziejreaktyw-
nyrodnikhydroksylowy.
•
OHreagujeteżzsamądopami-
nąipowstajeneurotoksyczna6-hydroksydopamina,która
uważanajestzajedenzczynnikówwywołującychchoro-
bęParkinsona[21,108].Oudzialestresuoksydacyjnego
wPDświadczywzrostpoziomuproduktówutlenianiabia-
łek,lipidówikwasównukleinowych,orazspadekstęże-
niazredukowanegoglutationuienzymówantyoksydacyj-
nych[15,51].PoziomproduktówutlenianiaDNAwistocie
czarnejchorychnaParkinsonajest16-krotniewyższyniż
uosóbzdrowych[111].
Wwieluprzypadkachzaobserwowanowistocieczarnej
spadekaktywnościkompleksuIłańcuchaoddechowe-
goorazwzrostwytwarzaniaanionorodnikaponadtlenko-
wegoirodnikahydroksylowego,coprowadziłodoutraty
mitochondriówiśmiercineuronów.Potraktowanieszczu-
rówrotenonem–inhibitoremkompleksuIspowodowało
degeneracjęneuronówwsubstancjiczarnejiobjawypo-
dobnedoPD[46,93].
Wlatachosiemdziesiątychub.w.zaobserwowanoobjawy
parkinsonizmuumłodychnarkomanówzażywającychhe-
roinę.Podczasprodukcji„ulicznejheroiny”powstajeme-
tylofenylotetrahydropirydyna(MPTP).Związektenjest
metabolizowanywkomórkachglejuprzezoksydazęmo-
noaminowądobardzotoksycznegoMPP
+
,któryprzenika
doneuronówdopaminergicznychzudziałemtransporte-
rówDAT.MPP
+
pobudzauwalnianiedopaminyzzakoń-
czeńsynaptycznych,uwalniażelazozneuromelaninyna-
silającreakcjęFentonaorazblokujekompleksIłańcucha
oddechowegopowodującśmierćneuronów[54,88].
Stwardnienie zanikowe boczne (ALS).Jesttochoro-
bazwyrodnieniowaukładunerwowegoopostępującym
przebieguinieznanejjakdotądetiologii.Wchorobietej
dochodzidozanikuneuronówmotorycznychprowadzące
doniewydolnościmięśni,paraliżuiśmierci.Prawie10%
przypadkówALStotzw.rodzinnapostać,zczego2–5%
poleganamutacjiwgeniekodującymmiedziowo-cynko-
wądysmutazęponadtlenkową(SOD1).Wielebadańnad
tymtypemALSwskazujenapodwyższonestężenienad-
tlenkuwodoru,rodnikahydroksylowegoorazproduktów
utlenienialipidów,białekiDNA[4,40,90].
WsporadycznejpostaciALS(niezwiązanejzmutacją
wgenieSOD1)równieżzaobserwowanowzroststężenia
grupkarbonylowychinitrotyrozyny,produktówutlenienia
initrowaniabiałekwrdzeniukręgowymipłyniemózgo-
wo-rdzeniowym[31,103].Atakżeznaczącywzrostpozio-
mu4-hydroksynonenalui8-hydroksyguaninyproduktów
utlenianialipidówiDNAwekrwiipłyniemózgowo-
rdzeniowympacjentówzALS[69,97].Wmózgachosób
zmarłychnaALSstwierdzonospadekaktywnościoksyda-
zycytochromowejiperoksydazyglutationowejorazwzrost
stężenianitrotyrozyny[33,79].
Inne choroby OUN
Udużejgrupypacjentówzestwardnieniemrozsianym
(MS)stwierdzonopolimorfizmgenówkodującychtrans-
ferazyglutationowe,zwłaszczazklasmiipi,coprowa-
dzidoobniżeniapotencjałudetoksykacyjnegoiantyok-
sydacyjnego[67].
Natomiastwpłyniemózgowo-rdzeniowympacjentówzMS
zaobserwowanowzroststężeniadialdehydumalonowego
orazspadekaktywnościperoksydazyglutationowej[23].
RównieżupacjentówzchorobąHuntingtonastwierdzo-
nowyższestężenieMDAwekrwi,orazwyższestężenie
8-hydroksyguaninywmózgu[26,42].
UosóbzzespołemDownawystępujenadekspresjadys-
mutazyponadtlenkowej,coskutkujenadmiernymwytwa-
rzaniemH
2
O
2
iwystąpieniemstresuoksydacyjnego[76].
Wsurowicypacjentówzudaremniedokrwiennymstwier-
dzonopodwyższonestężenieMDAorazobniżonąaktyw-
nośćwiększościenzymówantyoksydacyjnych[1].
Równieżwprzypadkubakteryjnegozapaleniaoponmózgo-
wychstwierdzonowpłyniemózgowo-rdzeniowymwzrost
parametrówstresuoksydacyjnegowyrażonegoperoksyda-
cjąlipidów.Nastąpiłteżwzrostaktywnościdysmutazypo-
nadtlenkowejitransferazyglutationowejorazspadekstę-
żeniazredukowanegoglutationu[34].
Niektórzybadaczetwierdzą,żeczęśćprzypadkówcho-
róbpsychicznychmożemiećpodłożewolnorodnikowe.
Uwielupacjentówleczonychzpowoduschizofreniizaob-
serwowanowzrostaktywnościSOD,natomiastupacjen-
tówznieleczonąschizofreniąstwierdzonoobniżonąak-
tywnośćSODorazpodwyższonestężenieMDA[66,104].
Corazwięcejbadańwskazujenapowiązaniestresuoksy-
dacyjnegozchorobamizwiązanymizośrodkowymukła-
demnerwowym,choćniezawszemożnastwierdzićczy
strestenjestprzyczyną,czyskutkiemdanejchoroby.Na
pewnoistniejewieleróżnychprzyczynmogącychspowo-
dowaćlubnasilićdaneschorzenienp.nieodpowiedniadie-
ta,niezdrowytrybżycia,zanieczyszczeniaśrodowiskowe,
czyteżużywki,choćniektórzybadaczetwierdzą,żenie-
któreużywki,takiejakkawa,nikotynaczyalkoholwręcz
obniżająryzykozachorowanianachorobęParkinsona[14].
p
ozytyWne
działanie
rft
W
oun
Reaktywneformytlenuopróczszkodliwegodziałaniapeł-
niąrównieżrolepozytywne:wcześniejwspomniany„wy-
buchtlenowy”chronikomórkinerwoweprzedpatogenami,
WRTbiorąudziałwneuromodulacji,neurotransmisjiire-
gulacjiplastycznościsynaps.Wpływająnaekspresjęge-
nów,podziałiróżnicowaniesiękomórekorazwewnętrz-
nąhomeostazęjonówwapnia[39,105].
Aktywnośćcyklazyguanylowejorazstężeniecykliczne-
goGMPuzależnionejestodzmianstężeniatlenkuazotu,
nadtlenkuwodoruianionorodnikaponadtlenkowego[86].
PodwyższonestężeniaH
2
O
2
inadtlenkówlipidówgene-
rująsyntezęprostaglandyn,leukotrienówimelanin.O
2
–.
jestsubstratemtakichenzymówjakoksydazagalaktozo-
wa,dioksygenazaindofenolowa,dihydroksylazadopami-
nowaiin.,atakżewpływanametabolizmksenobiotyków
iagregacjępłytekkrwi[11,45].
RFTregulująprocesyprzekazywaniasygnałówmiędzy
neuronamiiwichobrębie,regulująfunkcjereceptorówpo-
przezodwracalneutlenianiegruptiolowychbiałek.Małe
Postepy Hig Med Dosw (online), 2011; tom 65: 104-113
110
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

stężeniaH
2
O
2
pobudzajączynnikjądrowyNF-
kB–aktywa-
torekspresjigenówkodującychSOD,tioredoksynę,cytoki-
nyiin.[73].NOuczestniczywkontroliodpowiedziimmu-
nologicznejiregulujenapięcienaczyńkrwionośnych[7].
Zarównonadmiernewytwarzaniewolnychrodników,jak
iichniedobórmożebyćdlaorganizmuszkodliwe,dlate-
gotakważnajestrównowagamiędzymechanizmamipro-
iantyoksydacyjnymi.
p
iśmiennictWo
[1]AdibhatlaR.M.,HatcherJ.F.:LipidoxidationandperoxidationinCNS
healthanddisease:frommolecularmechanismstotherapeuticoppor-
tunities.Antioxid.RedoxSignal.,2010;12:125–169
[2]AdlerV.,YinZ.,TewK.,RonaiZ.:Roleofredoxpotentialandreacti-
veoxygenspeciesinstresssignaling.Oncogene,1999;18:6104–6111
[3]Afanas’evI.B.:Freeradicalmechanismsofagingprocessesunder
physiologicalconditions.Biogerontology,2005;6:283–290
[4]AgarJ.,DurhamH.:Relevanceofoxidativeinjuryinthepathogene-
sisofmotorneurondiseases.Amyotroph.LateralScler.OtherMotor
NeuronDisord.,2003;4:232–242
[5]AlessandriJ.M.,GuesnetP.,VancasselS.,AstorgP.,DenisI.,Langelier
B.,AïdS.,Poumès-BallihautC.,Champeil-PotokarG.,LavialleM.:
Polyunsaturatedfattyacidsinthecentralnervoussystem:evolution
ofconceptsandnutritionalimplicationsthroughoutlife.Reprod.Nutr.
Dev.,2004;44:509–538
[6]AlperG.,GirginF.K.,OzgönülM.,MenteşG.,ErsözB.:MAOinhibitors
andoxidantstressinagingbraintissue.Eur.Neuropsychopharmacol.,
1999;9:247–252
[7]AmitaiY.:Physiologicrolefor„inducible”nitricoxidesynthase:Anew
formofastrocytic-neuronalinterface.Glia,2010;58:1775–1781
[8]AndreoliT.E.:Freeradicalsandoxidativestress.Am.J.Med.,2000;
108:650–651
[9]AttwellD.,IadecolaC.:Theneuralbasisoffunctionalbrainimaging
signals.TrendsNeurosci.,2002;25:621–662
[10]BallS.:Chemiaszarychkomórek.Neurochemiaitoksykologiaośrod-
kowegoukładunerwowego.MedykSp.zo.o.Warszawa2003
[11]Bartosz G.: Druga twarz tlenu. Wolne rodniki w przyrodzie.
WydawnictwoNaukowePWN.Warszawa2006
[12]BealM.F.:Aging,energy,andoxidativestressinneurodegenerative
diseases.Ann.Neurol.,1995;38:357–366
[13]BeckmanK.B.,AmesB.N.:EndogenousoxidativedamageofmtD-
NA.Mutat.Res.,1999;424:51–58
[14]BenedettiM.D.,BowerJ.H.,MaraganoreD.M.,McDonnellS.K.,
PetersonB.J.,AhlskogJ.E.,SchaidD.J.,RoccaW.A.:Smoking,al-
cohol,andcoffeeconsumptionprecedingParkinson’sdisease:aca-
se-controlstudy.Neurology,2000;55:1350–1358
[15]BergD.,YoudimB.H.,RiedererP.:Redoximbalance.CellTissueRes.
2004;318:201–213
[16]BerlettB.S.,StadtmanE.R.:Proteinoxidationinaging,disease,and
oxidativestress.J.Biol.Chem.,1997;272:20313–20316
[17]BrennaJ.T.,DiauG.Y.:Theinfluenceofdietarydocosahexaenoicacid
andarachidonicacidoncentralnervoussystempolyunsaturatedfatty
acidcomposition.ProstaglandinsLeukot.Essent.FattyAcids,2007;
77:247–250
[18]Bruce-KellerA.J.,LiY.J.,LovellM.A.,KraemerP.J.,GaryD.S.,
BrownR.R.,MarkesberyW.R.,MattsonM.P.:4-Hydroxynonenal,
aproductoflipidperoxidation,damagescholinergicneuronsandim-
pairsvisuospatialmemoryinrats.J.Neuropathol.Exp.Neurol.,1998;
57:257–267
[19]ButterfieldD.A.,LauderbackC.M.:Lipidperoxidationandprotein
oxidationinAlzheimer’sdiseasebrain:potentialcausesandconse-
quencesinvolvingamyloidbeta-peptide-associatedfreeradicaloxi-
dativestress.FreeRadic.Biol.Med.,2002;32:1050–1060
[20]CadenasE.:Mitochondrialfreeradicalproductionandcellsignaling.
Mol.AspectsMed.,2004;25:17–26
[21]CadetJ.L.,BrannockC.:Freeradicalsandthepathobiologyofbrain
dopaminesystems.Neurochem.Int.,1998;32:117–131
[22]CagninA.,BrooksD.J.,KennedyA.M.,GunnR.N.,MyersR.,
TurkheimerF.E.,JonesT.,BanatiR.B.:In-vivomeasurementofacti-
vatedmicrogliaindementia.Lancet,2001;358:461–467
[23]CalabreseV.,ScapagniniG.,RavagnaA.,BellaR.,ButterfieldD.A.,
CalvaniM.,PennisiG.,GiuffridaStellaA.M.:Disruptionofthiolho-
meostasisandnitrosativestressinthecerebrospinalfluidofpatients
withactivemultiplesclerosis:evidenceforaprotectiveroleoface-
tylcarnitine.Neurochem.Res.,2003;28:1321–1328
[24]ChakrabortiS.,ChakrabortiT.:Oxidant-mediatedactivationofmito-
gen-activatedproteinkinasesandnucleartranscriptionfactorsinthe
cardiovascularsystem:abriefoverview.CellSignal.,1998;10:675–683
[25]ChavkoM.,AukerC.R.,McCarronR.M.:Relationshipbetweenpro-
teinnitrationandoxidationanddevelopmentofhyperoxicseizures.
NitricOxide,2003;9:18–23
[26]ChenC.M.,WuY.R.,ChengM.L.,LiuJ.L.,LeeY.M.,LeeP.W.,Soong
B.W.,ChiuD.T.:Increasedoxidativedamageandmitochondrialab-
normalitiesintheperipheralbloodofHuntington’sdiseasepatients.
BiochemBiophys.Res.Commun.,2007;359:335–340
[27]Cheng K.C., Cahill D.S., Kasai H., Nishimura S., Loeb L.A.:
8-Hydroxyguanine,anabundantformofoxidativeDNAdamage,
causesG----TandA----Csubstitutions.J.Biol.Chem.,1992;267:
166–172
[28]ChongZ.Z.,LiF.,MaieseK.:Oxidativestressinthebrain:Novelcel-
lulartargetsthatgovernsurvivalduringneurodegenerativedisease.
Prog.Neurobiol.,2005;75:207–246
[29]CiolinoH.P.,LevineR.L.:Modificationofproteinsinendothelial
celldeathduringoxidativestress.FreeRadic.Biol.Med.,1997;22:
1277–1282
[30]ConnerE.M.,GrishamM.B.:Inflammation,freeradicals,andantio-
xidants.Nutrition,1996;12:274–277
[31]CooksonM.R.,ShawP.J.:Oxidativestressandmotorneuronedise-
ase.BrainPathol.,1999;9:165–186
[32]DawsonV.L.,DawsonT.M.:Nitricoxideinneuronaldegeneration.
Proc.Soc.Exp.Biol.Med.,1996;211:33–40
[33]DelantyN.,DichterM.A.:Oxidativeinjuryinthenervoussystem.
ActaNeurol.Scand.,1998;98:145–153
[34]deMenezesC.C.,DornelesA.G.,SperottoR.L.,DuarteM.M.,
SchetingerM.R.,LoroV.L.:Oxidativestressincerebrospinalfluidof
patientswithasepticandbacterialmeningitis.Neurochem.Res.,2009;
34:1255–1260
[35]DenicolaA.,RadiR.:Peroxynitriteanddrug-dependenttoxicity.
Toxicology,2005;208:273–288
[36]DiStasiA.M.,MallozziC.,MacchiaG.,PetrucciT.C.,MinettiM.:
Peroxynitriteinducestryosinenitrationandmodulatestyrosinepho-
sphorylationofsynapticproteins.J.Neurochem.,1999;73:727–735
[37]DixT.A.,AikensJ.:Mechanismsandbiologicalrelevanceoflipidpe-
roxidationinitiation.Chem.Res.Toxicol.,1993;6:2–18
[38]DmitrievL.F.:Theinvolvementoflipidradicalcyclesandtheadenine
nucleotidetranslocatorinneurodegenerativediseases.J.Alzheimers
Dis.,2007;11:183–190
[39]DrögeW.:Freeradicalsinthephysiologicalcontrolofcellfunction.
Physiol.Rev.,2002;82:47–95
[40]ElliottJ.L.:Zincandcopperinthepathogenesisofamyotrophicla-
teralsclerosis.Prog.Neuropsychopharmacol.Biol.Psychiatry,2001;
25:1169–1185
[41]FaraciF.M.:Reactiveoxygenspecies:influenceoncerebralvascular
tone.J.Appl.Physiol.,2006;100:739–743
[42]FiskumG.,MurphyA.N.,BealM.F.:Mitochondriainneurodegenera-
tion:acuteischemiaandchronicneurodegenerativediseases.J.Cereb.
BloodFlowMetab.,1999;19:351–369
[43]GibsonG.E.,RatanR.R.,BealM.F.:Mitochondriaandoxidativestress
inneurodegenerativedisorders.Ann.NYAcad.Sci.,2008;1147:xi–xii
[44]Gilgun-SherkiY.,MelamedE.,OffenD.:Oxidativestressinduced-
neurodegenerativediseases:theneedforantioxidantsthatpenetrate
thebloodbrainbarrier.Neuropharmacology,2001;40:959–975
[45]GondkoR.:Czyprzemianyrodnikówtlenowychworganizmieprze-
biegającyklicznie?PostępyBiochemii,1995;41:243–247
[46]GreenamyreJ.T.,BetarbetR.,ShererT.B.:Therotenonemodel
of Parkinson’s disease: genes, environment and mitochondria.
ParkinsonismRelat.Disord.,2003;9:S59–S64
[47]GuzmánM.,BlázquezC.:Isthereanastrocyte-neuronketonebody
shuttle?TrendsEndocrinol.Metab.,2001;12:169–173
[48]HalliwellB.:Reactiveoxygenspeciesandthecentralnervoussystem.
J.Neurochem.,1992;59:1609–1623
Gutowicz M. – Wpływ reaktywnych form tlenu na ośrodkowy układ nerwowy
111
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

[49]HalliwellB.:Roleoffreeradicalsintheneurodegenerativediseases:
therapeuticimplicationsforantioxidanttreatment.DrugsAging,2001;
18:685–716
[50]HalliwellB.,ClementM.V.,LongL.H.:Hydrogenperoxideinthehu-
manbody.FEBSLett.,2000;486:10–13
[51]HirrlingerJ.,SchulzJ.B.,DringenR.:Effectsofdopamineonthe
glutathionemetabolismofculturedastroglialcells:implicationsfor
Parkinson’sdisease.J.Neurochem.,2002;82:458–467
[52]IschiropoulosH.,BeckmanJ.S.:Oxidativestressandnitrationinneu-
rodegeneration:cause,effect,orassociation?J.Clin.Invest.,2003;
111:163–169
[53]JennerP.:Parkinson’sdisease,pesticidesandmitochondrialdysfunc-
tion.TrendsNeurosci.,2001;24:245–247
[54]JohannessenJ.N.,MarkeyS.P.:Assessmentoftheopiatepropertiesof
twoconstituentsofatoxicillicitdrugmixture.DrugAlcoholDepend.,
1984;13:367–374
[55]KimY.S.,JohT.H.:Microglia,majorplayerinthebraininflamma-
tion:theirrolesinthepathogenesisofParkinson’sdisease.Exp.Mol.
Med.,2006;38:333–347
[56]KopczyńskaE.,TorlińskiL.,ZiółkowskiM.:Wpływuzależnienia
odalkoholunaparametrystresuoksydacyjnego.PostępyHig.Med.
Dośw.,2001;55:95–111
[57]KoppalT.,DrakeJ.,ButterfieldD.A.:In vivomodulationofrodentglu-
tathioneanditsroleinperoxynitrite-inducedneocorticalsynaptoso-
malmembraneproteindamage.Biochim.Biophys.Acta,1999;1453:
407–411
[58]KoppenolW.H.:Thebasicchemistryofnitrogenmonoxideandpero-
xynitrite.FreeRadic.Biol.Med.,1998;25:385–391
[59]LawA.,GauthierS.,QuirionR.:SayNOtoAlzheimer’sdisease:the
putativelinksbetweennitricoxideanddementiaoftheAlzheimer’s
type.BrainRes.BrainRes.Rev.,2001;35:73–96
[60]LevineR.L.,StadtmanE.R.:Oxidativemodificationofproteinsdu-
ringaging.Exp.Gerontol.,2001;36:1495–1502
[61]LiH.,GuoM.:ProteindegradationinParkinsondiseaserevisited:it’s
complex.J.Clin.Invest.,2009;119:442–445
[62]LiczmanskiA.E.:Toksycznośćtlenu.Uszkodzenieżywychkomórek.
PostępyBiochemii,1988;34:273–291
[63]LitvinovD.I.,DubovaiaV.I.,Vasil’evM.G.,LekishviliM.V.,Prasolov
V.S.,TurpaevK.T.:EffectofcatalaseontheexpressionofNO-
dependentgenesinprimarychondrocytes.Mol.Biol.,2003;37:
482–485
[64]LiuP.K.,RobertsonC.S.,ValadkaA.:Theassociationbetweenneu-
ronalnitricoxidesynthaseandneuronalsensitivityinthebrainafter
braininjury.Ann.NYAcad.Sci.,2002;962:226–241
[65]LovellM.A.,XieC.,MarkesberyW.R.:Decreasedglutathionetrans-
feraseactivityinbrainandventricularfluidinAlzheimer’sdisease.
Neurology,1998;51:1562–1566
[66]MahadikS.P.,MukherjeeS.:Freeradicalpathologyandantioxidant
defenseinschizophrenia:areview.Schizophr.Res.,1996;19:1–17
[67]MannC.L.,DaviesM.B.,BoggildM.D.,AllderseaJ.,FryerA.A.,Jones
P.W.,KoKoC.,YoungC.,StrangeR.C.,HawkinsC.P.:Glutathione
S-transferasepolymorphismsinMS:theirrelationshiptodisability.
Neurology,2000;54:552–557
[68]MaragosW.F.,YoungK.L.,AltmanC.S.,PocernichC.B.,DrakeJ.,
ButterfieldD.A.,SeifI.,HolschneiderD.P.,ChenK.,ShihJ.C.:Striatal
damageandoxidativestressinducedbythemitochondrialtoxinmalo-
natearereducedinclorgyline-treatedratsandMAO-Adeficientmice.
Neurochem.Res.,2004;29:741–746
[69]MarianiE.,PolidoriM.C.,CherubiniA.,MecocciP.:Oxidativestress
inbrainaging,neurodegenerativeandvasculardiseases:anoverview.
J.Chromatogr.BAnalyt.Technol.Biomed.LifeSci.,2005;827:65–75
[70]MarkesberyW.R.,CarneyJ.M.:OxidativealterationsinAlzheimer’s
disease.BrainPathol.,1999;9:133–146
[71]MarnettL.J.:Oxyradicals,lipidperoxidationandDNAdamage.
Toxicology,2002;181–182:219–222
[72]MarnettL.J.,RigginsJ.N.,WestJ.D.:Endogenousgenerationofreac-
tiveoxidantsandelectrophilesandtheirreactionswithDNAandpro-
tein.J.Clin.Invest.,2003;111:583–593
[73]McCordJ.M.:Theevolutionoffreeradicalsandoxidativestress.Am.
J.Med.,2000;108:652–659
[74]MecocciP.,MacGarveyU.,KaufmanA.E.,KoontzD.,ShoffnerJ.M.,
WallaceD.C.,BealM.F.:OxidativedamagetomitochondrialDNA
showsmarkedage-dependentincreasesinhumanbrain.Ann.Neurol.,
1993;34:609–616
[75]MogiM.,TogariA.,KondoT.,MizunoY.,KomureO.,KunoS.,
IchinoseH.,NagatsuT.:Caspaseactivitiesandtumornecrosisfactor
receptorR1(p55)levelareelevatedinthesubstantianigrafrompar-
kinsonianbrain.J.Neural.Transm.,2000;107:335–341
[76]MuchováJ.,SustrováM.,GaraiováI.,LiptákováA.,BlazícekP.,
KvasnickaP.,PueschelS.,DurackováZ.:Influenceofageonactivi-
tiesofantioxidantenzymesandlipidperoxidationproductsineryth-
rocytesandneutrophilsofDownsyndromepatients.FreeRadic.Biol.
Med.,2001;31:499–508
[77]NikiE.,YoshidaY.,SaitoY.,NoguchiN.:Lipidperoxidation:me-
chanisms,inhibition,andbiologicaleffects.Biochem.Biophys.Res.
Commun.,2005;338:668–676
[78]OhshimaH.:Geneticandepigeneticdamageinducedbyreactiveni-
trogenspecies:implicationsincarcinogenesis.Toxicol.Lett.,2003;
140-141:99–104
[79]Okado-MatsumotoA.,FridovichI.:Amyotrophiclateralsclerosis:apro-
posedmechanism.Proc.Natl.Acad.Sci.USA,2002;99:9010–9014
[80]OszajcaK.,SzemrajJ.,BartkowiakJ.:Udziałtlenkuazotuwregula-
cjiekspresjigenów.PostępyBiochemii,2007;53:254–262
[81]PalumboA.,NapolitanoA.,BaroneP.,d’IschiaM.:Nitrite-andpe-
roxide-dependentoxidationpathwaysofdopamine:6-nitrodopamine
and6-hydroxydopamineformationaspotentialcontributorymechani-
smsofoxidativestress-andnitricoxide-inducedneurotoxicityinneu-
ronaldegeneration.Chem.Res.Toxicol.,1999;12:1213–1222
[82]PeuchenS.,BolañosJ.P.,HealesS.J.,AlmeidaA.,DuchenM.R.,Clark
J.B.:Interrelationshipsbetweenastrocytefunction,oxidativestressand
antioxidantstatuswithinthecentralnervoussystem.Prog.Neurobiol.,
1997;52:261–281
[83]PfeifferS.,SchmidtK.,MayerB.:Dityrosineformationoutcompetes
tyrosinenitrationatlowsteady-stateconcentrationsofperoxynitrite.
Implicationsfortyrosinemodificationbynitricoxide/superoxidein
vivo.J.Biol.Chem.,2000;275:6346–6352
[84]PonczekM.B.,WachowiczB.:Oddziaływaniereaktywnychformtle-
nuiazotuzbiałkami.PostępyBiochemii,2005;51:40–45
[85]PorterN.A.,CaldwellS.E.,MillsK.A.:Mechanismsoffreeradical
oxidationofunsaturatedlipids.Lipids,1995;30:277–290
[86]ProvostC.,ChoufaniF.,AvedanianL.,BkailyG.,GobeilF.,Jacques
D.:Nitricoxideandreactiveoxygenspeciesinthenucleusrevisited.
Can.J.Physiol.Pharmacol.,2010;88:296–304
[87]RamassamyC.,AverillD.,BeffertU.,BastianettoS.,TherouxL.,
Lussier-CacanS.,CohnJ.S.,ChristenY.,DavignonJ.,QuirionR.,
PoirierJ.:Oxidativedamageandprotectionbyantioxidantsinthe
frontalcortexofAlzheimer’sdiseaseisrelatedtotheapolipoprotein
Egenotype.FreeRadic.Biol.Med.,1999;27:544–553
[88]RavindranathV.:Metabolismofxenobioticsinthecentralnervous
system:implicationsandchallenges.Biochem.Pharmacol.,1998;56:
547–551
[89]RoedigerB.,ArmatiP.J.:Oxidativestressinducesaxonalbeadingin
culturedhumanbraintissue.Neurobiol.Dis.,2003;13:222–229
[90]RotilioG.,AquilanoK.,CirioloM.R.:InterplayofCu,Znsuperoxide
dismutaseandnitricoxidesynthaseinneurodegenerativeprocesses.
IUBMBLife,2003;55:629–634
[91]SaitohM.,NishitohH.,FujiiM.,TakedaK.,TobiumeK.,SawadaY.,
KawabataM.,MiyazonoK.,IchijoH.:Mammalianthioredoxinisadi-
rectinhibitorofapoptosissignal-regulatingkinase(ASK)1.EMBO
J.,1998;17:2596–2606
[92]SawickiW.T.:Histologia.WydawnictwolekarskiePZWL,2008
[93]SayreL.M.,PerryG.,SmithM.A.:Oxidativestressandneurotoxici-
ty.Chem.Res.Toxicol.,2008;21:172–188
[94]ScandaliosJ.G.:Oxidativestress:molecularperceptionandtransduc-
tionofsignalstriggeringantioxidantgenedefenses.Braz.J.Med.Biol.
Res.,2005;38:995–1014
[95]ShelineY.I.:Hippocampalatrophyinmajordepression:aresultofde-
pression-inducedneurotoxicity?Mol.Psychiatry,1996;1:298–299
[96]SiegalG.L.,AlbertsR.W.,BradyS.T.,PriceD.L.:Neurocellularana-
tomy.BasicNeurochemistry.Molecular,cellularandmedicalaspects.
ElsevierAcademicPress,2006
[97]SimpsonE.P.,HenryY.K.,HenkelJ.S.,SmithR.G.,AppelS.H.:
IncreasedlipidperoxidationinseraofALSpatients:apotentialbio-
markerofdiseaseburden.Neurology,2004;62:1758–1765
[98]SongH.,StevensC.F.,GageF.H.:Astrogliainduceneurogenesisfrom
adultneuralstemcells.Nature,2002;417:39–44
[99]StadtmanE.R.,LevineR.L.:Proteinoxidation.Ann.NYAcad.Sci.,
2000;899:191–208
Postepy Hig Med Dosw (online), 2011; tom 65: 104-113
112
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

[100]StoianI.,OrosA.,MoldoveanuE.:Apoptosisandfreeradicals.
Biochem.Mol.Med.,1996;59:93–97
[101]SullivanP.G.,BrownM.R.:Mitochondrialaginganddysfunctionin
Alzheimer’sdisease.Prog.Neuropsychopharmacol.Biol.Psychiatry,
2005;29:407–410
[102]SvenningssonA.,PeterssonA.S.,AndersenO.,HanssonG.K.:Nitric
oxidemetabolitesinCSFofpatientswithMSarerelatedtoclinical
diseasecourse.Neurology,1999;53:1880–1882
[103]TohgiH.,AbeT.,YamazakiK.,MurataT.,IshizakiE.,IsobeC.:
Remarkableincreaseincerebrospinalfluid3-nitrotyrosineinpatients
withsporadicamyotrophiclateralsclerosis.Ann.Neurol.,1999;46:
129–131
[104]TylecA.,JarząbA.,Stryjecka-ZimmerM.,WójcickaA.:Stresoksy-
dacyjnywschizofrenii.Pol.Merk.Lek.,2007;23(133):74–77
[105]ValkoM.,LeibfritzD.,MoncolJ.,CroninM.T.,MazurM.,TelserJ.:
Freeradicalsandantioxidantsinnormalphysiologicalfunctionsand
humandisease.Int.J.Biochem.CellBiol.,2007;39:44–84
[106]Vila M., Przedborski S.: Genetic clues to the pathogenesis of
Parkinson’sdisease.Nat.Med.,2004;10:S58–S62
[107]WeintraubD.,ComellaC.L.,HornS.:Parkinson’sdisease–Part1:
Pathophysiology,symptoms,burden,diagnosis,andassessment.Am.
J.Manag.Care,2008;14:S40–S48
[108]YoudimM.B.,BakhleY.S.:Monoamineoxidase:isoformsandinhi-
bitorsinParkinson’sdiseaseanddepressiveillness.Br.J.Pharmacol.,
2006;147:S287–S296
[109]ZajdelA.,WilczokA.,SlowinskiJ.,OrchelJ.,MazurekU.:Aldehydic
lipidperoxidationproductsinhumanbrainastrocytomas.J.Neurooncol.,
2007;84:167–173
[110]ZasadowskiA.,WysockiA.D.,BarskiD.,SpodniewskaA.:Some
aspectsofreactiveoxygenspecies(ROS)andantioxidativesystem
agent’saction.Shortreview.ActaToxicol.,2004;12:5–19
[111]ZhangJ.,PerryG.,SmithM.A.,RobertsonD.,OlsonS.J.,Graham
D.G.,MontineT.J.:Parkinson’sdiseaseisassociatedwithoxidative
damagetocytoplasmicDNAandRNAinsubstantianigraneurons.
Am.J.Pathol.,1999;154:1423–1429
Autorkadeklarujebrakpotencjalnychkonfliktówinteresów.
Gutowicz M. – Wpływ reaktywnych form tlenu na ośrodkowy układ nerwowy
113
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com
Wyszukiwarka
Podobne podstrony:
STEFANquot JEDEN Z WYKLETYCHquot artykul dr Tomasza Labuszewskiego
Artykuł, dr A Zając
Czytajcie artykuły dr Jerzego Jaśkowskiego
6 artyku kierunki rozwoju robót przygotowawczych dr enie wyrobisk górniczych
Artykuły, 7. CELE WYCHOWANIA MŁODZIEŻY W NAUCZANIU PRYMASA TYSIĄCLECIA. ANALIZA PEDAGOGICZNA W ŚWIET
Artykuł dodatkowy dr Jadwigi Jastrząb
dr Klóska artykuł
7 zapalenie wewnetrznych narzadow plciowych dr pawlaczyk
higiena dla studentów 2011 dr I Kosinska
Krwawienie dr
zdarzenia masowe, Dr I Baumberg 1 1
przykładowa prezentacja przygotowana na zajęcia z dr inż R Siwiło oceniona
wykład dr szaroty pojęcia
Panic dr Runge (1)
dr M Latos Miłkowska Upadłość i likwidacja pracodawcy
więcej podobnych podstron