
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Joanna Dorota Górzyńska
Badanie właściwości surowców szklarskich i szkła
813[02].Z2.01
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr Elżbieta Pietrasz
mgr inż. Krzysztof Kubit
Opracowanie redakcyjne:
mgr inż. Joanna Górzyńska
Konsultacja:
mgr inż. Czesław Nowak
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 813[02].Z2.01
„Badanie właściwości surowców szklarskich i szkła”, zawartego w modułowym programie
nauczania dla zawodu Operator urządzeń przemysłu szklarskiego.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Materiał nauczania
7
4.1.
Budowa szkła
7
4.1.1.
Materiał nauczania
7
4.1.2.
Pytania sprawdzające
15
4.1.3.
Ć
wiczenia
16
4.1.4.
Sprawdzian postępów
19
4.2.
Surowce szklarskie
20
4.2.1.
Materiał nauczania
20
4.2.2.
Pytania sprawdzające
36
4.2.3.
Ć
wiczenia
36
4.2.4.
Sprawdzian postępów
39
4.3.
Badania właściwości szkła
40
4.3.1.
Materiał nauczania
40
4.3.2.
Pytania sprawdzające
47
4.3.3.
Ć
wiczenia
48
4.3.4.
Sprawdzian postępów
49
4.4.
Pomiar wielkości niezbędnych do topienia masy szklanej
50
4.4.1.
Materiał nauczania
50
4.4.2.
Pytania sprawdzające
62
4.4.3.
Ć
wiczenia
63
4.4.4.
Sprawdzian postępów
64
5.
Sprawdzian osiągnięć
65
6.
Literatura
70

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu wiedzy o podstawowych surowcach
szklarskich, ich właściwościach oraz o podstawowych właściwościach płynnej masy szklanej,
szkła i metodach badań właściwości szkła.
W poradniku zamieszczono:
−
wymagania wstępne – wykaz umiejętności, jakie powinieneś mieć już ukształtowane,
abyś bez problemu mógł korzystać z poradnika,
−
cele kształcenia – wykaz umiejętności, jaki ukształtujesz podczas pracy z poradnikiem,
−
materiał nauczania – wiadomości teoretyczne niezbędne do opanowania treści jednostki
modułowej,
−
zestaw pytań, abyś mógł sprawdzić, czy już opanowałeś określone treści,
−
ć
wiczenia, które pomogą Ci zweryfikować wiadomości teoretyczne oraz ukształtować
umiejętności praktyczne,
−
sprawdzian postępów,
−
sprawdzian osiągnięć, przykładowy zestaw zadań. Zaliczenie testu potwierdzi
opanowanie materiału całej jednostki modułowej,
−
literaturę obowiązującą.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
813[02].Z2
Technologia
wytwarzania szkła
813[02].Z2.02
Sporządzanie zestawów
szklarskich
813[02].Z2.03
Topienie szkła
813[02].Z2.06
Zdobienie wyrobów
szklarskich
813[02].Z2.07
Przetwarzanie szkła
813[02].Z2.04
Formowanie wyrobów
szklarskich
813[02].Z2.05
Wykonywanie obróbki
wyrobów szklarskich
813[02].Z2.01
Badanie właściwości
surowców szklarskich
i szkła

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
charakteryzować budowę atomu,
−
określać liczbę atomową i masową,
−
posługiwać się układem okresowym pierwiastków,
−
zapisać proste reakcje chemiczne,
−
określać sposoby otrzymywania związków nieorganicznych,
−
charakteryzować tlenki, wodorotlenki, kwasy, sole,
−
korzystać z różnych źródeł informacji,
−
posługiwać się pojęciami technologii szkła,
−
dobierać odpowiednią dokumentację techniczną,
−
obsługiwać komputer,
−
współpracować w grupie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
-
scharakteryzować układ okresowy pierwiastków,
-
scharakteryzować nieorganiczne i organiczne związki chemiczne stosowane w przemyśle
szklarskim,
-
rozróżnić typy reakcji chemicznych,
-
wykonać obliczenia masowe i energetyczne reakcji chemicznych,
-
sporządzić roztwór o określonym stężeniu procentowym,
-
sporządzić mieszaninę o określonym składzie,
-
wykonać pomiar temperatury gazów i cieczy,
-
wykonać pomiar ciśnienia gazów i cieczy manometrem,
-
wykonać pomiar przepływu gazów i cieczy za pomocą kryz i zwężek,
-
wyjaśnić zasady pomiaru wysokości lustra szkła za pomocą poziomomierzy,
-
zinterpretować i opracować wyniki pomiarów,
-
sklasyfikować surowce ze względu na skład chemiczny,
-
określić właściwości i przeznaczenie surowców szklarskich,
-
scharakteryzować właściwości płynnej masy szklanej,
-
określić wpływ właściwości szkła na wytwarzanie, obróbkę i zdobienie wyrobów,
-
określić czynniki mające wpływ na zmianę właściwości szkła,
-
scharakteryzować składniki barwiące szkło,
-
sklasyfikować metody badania właściwości szkła,
-
dobrać sprzęt i urządzenia do badania właściwości szkła,
-
pobrać próbki surowców i szkła do badań laboratoryjnych zgodnie z instrukcją,
-
posłużyć się instrukcją lub normą podczas wykonywania badań i pomiarów,
-
wykonać podstawowe badania właściwości szkła,
-
sklasyfikować rodzaje szkła ze względu na skład chemiczny,
-
zastosować przepisy bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej, oraz
ochrony środowiska podczas wykonywania badań właściwości szkła.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1.
Budowa szkła
4.1.1. Materiał nauczania
Układ okresowy pierwiastków
Pierwiastek chemiczny jest to substancja prosta, składająca się z atomów jednego
rodzaju, tzn. atomów o tej samej liczbie kolejnej – atomowej.
Pojecie pierwiastka jako podstawowego składnika materii wprowadził Boyle (czytaj Bojl)
w końcu XVII w. Takie substancje, jak żelazo, miedź, siarka, srebro itp. są pierwiastkami,
ponieważ składają się wyłącznie z atomów jednego rodzaju.
Przez atom rozumie się najmniejszą część pierwiastka zachowującą jeszcze jego
właściwości. Każdy pierwiastek ma określony symbol.
Obecnie stosowaną symbolikę pierwiastków wprowadził w XIX w. Berzelius (czytaj
Bercelius). Symbol pierwiastka, w zależności od potrzeb, może mieć różne znaczenie, np. K
oznacza:
a)
substancję potas,
b)
jeden atom potasu,
c)
jeden mol atomów potasu (6,02 · 10
23
atomów),
d)
masę molową (39,1 g).
Analogicznie odczytuje się inne symbole.
Pierwsze próby klasyfikacji pierwiastków podjął Döbereiner (czytaj Dejberajner)
i Newlands (czytaj Njulends). Zauważyli oni, że po „ułożeniu” pierwiastków według
wzrastających mas atomowych następuje okresowe powtarzanie się pierwiastków
o podobnych właściwościach chemicznych.
Pod koniec IX w. Mendelejew, ułożył znane wówczas pierwiastki w tabelę
z wyodrębnieniem okresów i grup. W ten sposób powstał układ okresowy pierwiastków.
Mendelejew wykazał zależność właściwości fizycznych i chemicznych pierwiastków od ich
ułożenia w układzie okresowym, a także przewidział istnienie wielu nie znanych wówczas
pierwiastków.
Właściwości pierwiastków zmieniają się stopniowo, w zależności od ich miejsca
w układzie okresowym. Jest to prawo okresowości. Właściwości pierwiastków zależą przede
wszystkim od liczby atomowej, liczby powłok elektronowych oraz liczby elektronów
walencyjnych w atomach. Układ okresowy, w którym można wyróżnić pierwiastki
poszczególnych grup, okresów i bloków, można przedstawić następująco:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Rys. 1. Układ okresowy pierwiastków [9]
Obecnie używany układ okresowy pierwiastków uzupełniono o grupę gazów szlachetnych
oraz zawiera nowo odkryte i sztucznie wytworzone pierwiastki. Układ ten składa się z 18 grup
i 7 okresów. Pionowe kolumny układu okresowego (grupy) zawierają pierwiastki, których
atomy mają podobne właściwości chemiczne. Poziome szeregi układu okresowego (okresy)
zawierają pierwiastki, których właściwości zmieniają się stopniowo. Każdy okres zaczyna się
bardzo aktywnym metalem, wraz ze wzrostem grupy w okresie aktywność pierwiastków
maleje aż dochodzimy do zupełnie nieaktywnego gazu szlachetnego. Osobno w dwu
dodatkowych okresach umieszczone są lantanowce i aktynowce.
Podstawę współczesnego układu okresowego pierwiastków stanowi ich konfiguracja
elektronowa czyli rozmieszczenie elektronów na powłokach elektronowych, wyznaczająca
podział na bloki: s, p d, f.
–
Blok s obejmuje pierwiastki 1 i 2 grupy
–
Blok p obejmuje pierwiastki grup od 13 do 18
–
Blok d obejmuje pierwiastki grup od 3 do 12
–
Blok f tworzą lantanowce i aktynowce.
Innym podziałem pierwiastków w układzie okresowym jest ich podział ze względu na
właściwości grup głównych, do których zaliczamy:
I – Litowce,
II – Berylowce,
III – Borowce,
IV – Węglowce,
V – Azotowce,
VI – Tlenowce,
VII – Fluorowce,
oraz grup pobocznych, wśród których występują:
IB – Miedziowce, Związki kompleksowe,
IIB – Cynkowce,
VIB – Chromowce,
VIIB – Manganowce,
VIIIB – śelazowce.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Właściwości związków nieorganicznych
Związek chemiczny jest przykładem substancji złożonej, powstającej w wyniku
połączenia kilku pierwiastków. Skład związku chemicznego określa jest wzór chemiczny.
Najczęściej substancje nieorganiczne dzieli się na nastepujace grupy: pierwiastki, tlenki,
wodorki, wodorotlenki, kwasy, sole.
A. Tlenki – są to związki pierwiastków (metali i niemetali) z tlenem, w których tlen
występuje na – II stopniu utlenienia.
Wzór ogólny tlenków
E
x
O
II
Gdzie:
E – symbol pierwiastka
x – wartościowość pierwiastka
Ze względu na charakter chemiczny tlenki tworzą następujące grupy:
–
Tlenki zasadowe – tlenki metali, które reagują z kwasami dając sole
(MgO, CaO, BaO, Na
2
O, K
2
O)
MgO + 2 HCl → MgCl
2
+ H
2
O
–
Tlenki kwasowe – tlenki niemetali, które reagują z zasadami dając sole (SO
3
, P
4
O
10
,
SiO
2
)
SO
3
+ 2 NaOH → Na
2
SO
4
+ H
2
O
–
Tlenki amfoteryczne – tlenki metali, które reagują z kwasami i z zasadami dając sole
(Al(OH)
3
, Zn(OH)
2
)
Al
2
O
3
+ 6 HCl → 2 AlCl
3
+ 3 H
2
O
Al
2
O
3
+ 2 NaOH + 3 H
2
O → 2 Na[Al(OH)
4
]
–
Tlenki obojętne – tlenki niemetali które nie reagują ani z kwasami ani z zasadami,
np. CO i NO.
W układzie okresowym właściwości tlenków zmieniają się następująco:
–
w okresie – od typowo zasadowych w grupie 1 i 2, poprzez amfoteryczne w grupie 13, aż
po typowo kwasowe w grupie 17.
–
w grupie – ze wzrostem okresu w grupie rośnie charakter zasadowy ich tlenków.
B. Wodorotlenki – są to związki chemiczne zbudowane z metalu i jednej lub kilku grup
wodorotlenowych – OH.
Wzór ogólny wodorotlenku
M
n
(OH)
n
Gdzie:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
M – kation metalu
n – wartościowość metalu
Ze względu na charakter chemiczny wodorotlenki dzielą się na:
–
wodorotlenki zasadowe – reagujące z kwasami i niereagujące z zasadami
NaOH + HCl → NaCl + H
2
O
–
wodorotlenki amfoteryczne – reagujące zarówno z kwasami, jak i zasadami
Zn(OH)
2
+ 2 HCl → ZnCl
2
+ 2 H
2
O
Zn(OH)
2
+ 2 NaOH → Na
2
ZnO
2
+ 2 H
2
O
C. Kwasy – są to związki chemiczne zbudowane z wodoru i reszty kwasowej.
Wzór ogólny kwasu
H
m
R
m
R – reszta kwasowa
m – wartościowość reszty kwasowej
Kwasy reagują z:
–
wodorotlenkami – reakcje zobojętnienia
HNO
3
+ KOH → KNO
3
+ H
2
O
–
tlenkami zasadowymi
2 HBr + CaO → CaBr
2
+ H
2
O
–
metalami aktywnymi (aktywniejsze od wodoru)
2 H
3
PO
4
+ 3 Mg → Mg
3
(PO
4
)
2
+ 3 H
2
D. Sole – są związkami chemicznymi zbudowanymi z metalu i reszty kwasowej.
Wzór ogólny soli
M
m
n
R
n
m
Gdzie:
M – kation metalu
R – reszta kwasowa
m – wartościowość reszty kwasowej
n – wartościowość metalu
Rodzaje soli:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
a)
sole obojętne
–
sole proste – zawierające jeden rodzaj kationów i jeden rodzaj anionów, np.
Na
2
SO
4
zawierające Na
+
i SO
4
2
–
sole podwójne – zawierające dwa rodzaje kationów i jeden rodzaj anionu
np. MgAl
2
(SO
4
)
4
–
hydraty – sole uwodnione, zawierające wbudowane w sieć krystaliczną cząsteczki
wody, np. CuSO
4
· 5 H
2
O
b)
wodorosole – zawierające aniony powstające podczas stopniowej dysocjacji kwasów
np. anion wodorowęglanowy HCO
3
-
c) hydroksosole – zawierające aniony OH
-
, aniony reszt kwasowych i kationy metalu.
Właściwości związków orgnicznych
Chemia organiczna jest chemią związków węgla. Prawie wszystkie związki pochodzące
od organizmów żywych odznaczają się tym, że ich cząsteczki zawierają atomy węgla. Atomy
węgla mogą łączyć się ze sobą tworząc struktury:
–
liniowe,
–
rozgałęzione,
–
cykliczne.
Do atomów węgla tworzących te łańcuchy i pierścienie mogą przyłączać się inne atomy,
głównie: wodoru, tlenu, azotu, siarki, fosforu, fluoru, chloru, bromu, jodu, i wiele innych
pierwiastków.
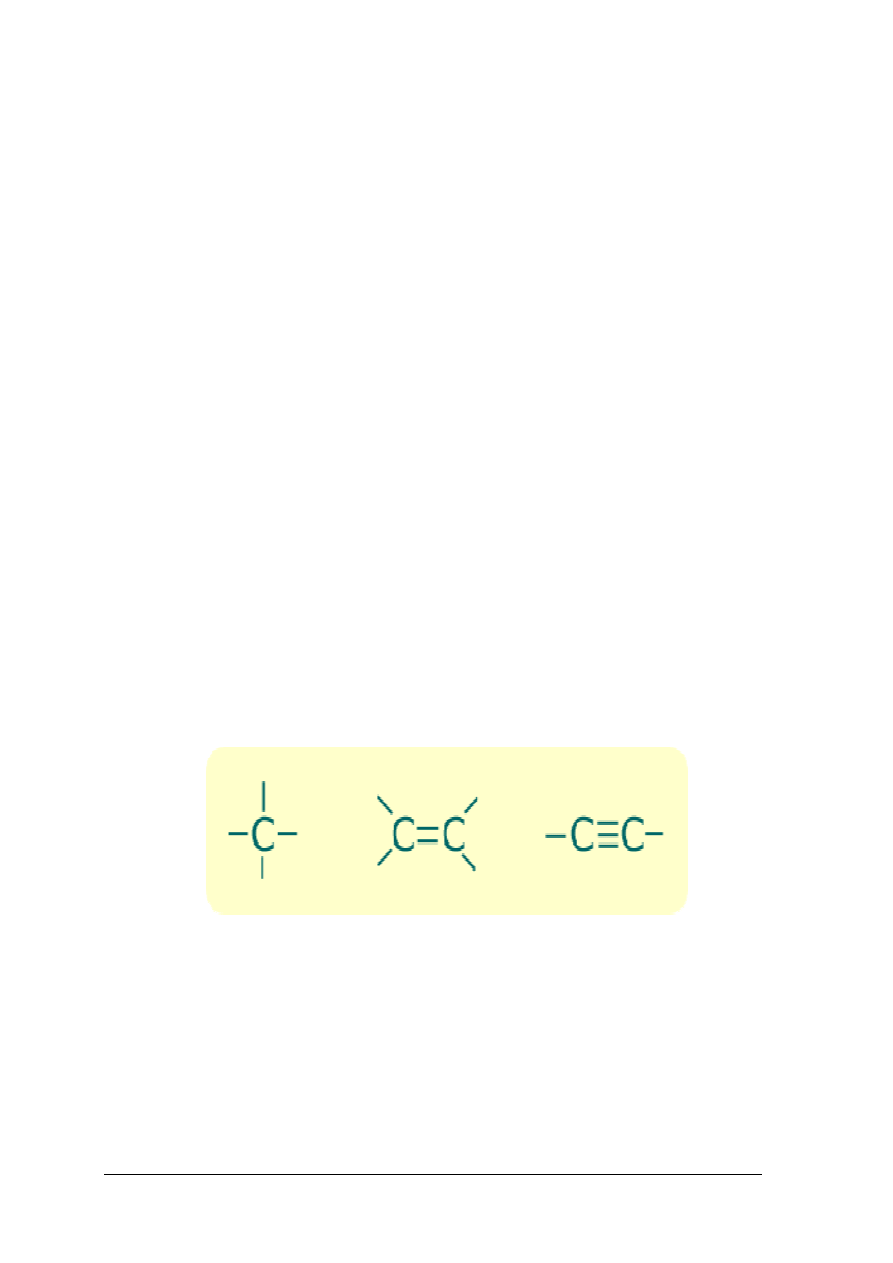
Węgiel jest pierwiastkiem o dużej aktywności chemicznej i zdolnością do łączenia się
między sobą. Ponadto sąsiadujące atomy węgla mogą łączyć się ze sobą za pomocą wiązań:
–
pojedynczych,
–
podwójnych,
–
potrójnych.
O tych właściwościach węgla decyduje jego budowa elektronowa. Atom węgla ma cztery
elektrony walencyjne, które może wykorzystać do utworzenia czterech wiązań
kowalencyjnych z innymi atomami węgla, wodorem i innymi pierwiastkami.
Rys. 2. Wiązania kowalencyjne atomu węgla. [9]
Typy reakcji chemicznych
Przemiany chemiczne (reakcje chemiczne) przebiegające z udziałem związków
chemicznych, nieorganicznych można najogólniej podzielić na następujące grupy:
a)
reakcje syntezy (łączenia),
b)
reakcje analizy (rozkładu),
c)
reakcje wymiany.
Przemiana chemiczna zachodzi wówczas, gdy z jednej lub kilku substancji powstają
nowe substancję o zupełnie odmiennych właściwościach fizycznych i chemicznych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Reakcje te mogą być egzotermiczne lub endotermiczne, czyli mogą przebiegać
z wydzielaniem lub pobieraniem energii. Mogą przebiegać bez zmiany stopnia utlenienia
pierwiastków lub ze zmianą.
Reakcje przebiegające z udziałem związków organicznych są bardziej skomplikowane
i nie zawsze można je zaliczyć do wymienionych grup.
A. Reakcja syntezy – przebiega wówczas, gdy z dwu lub więcej substancji prostych powstaje
jedna substancja złożona o odmiennych właściwościach fizycznych i chemicznych:
A + B → AB
Przykładami reakcji syntezy są:
S + O
2
→
SO
2
2Mg + O
2
→
2MgO
CaO + H
2
O → Ca (OH)
2
B. Reakcja analizy – przebiega wówczas, gdy z jednej substancji złożonej powstają dwie
substancje proste (lub więcej) różniące się od substratu właściwościami fizycznymi
i chemicznymi:
AB → A + B
Przykładami reakcji analizy są:
2 HgO → 2HG + O
2
CaCO
3
→
Ca + CO
2
H
2
CO
3
→
H
2
O + CO
2
Wiele reakcji analizy, w zależności od warunków, może przebiegać w kierunku
odwrotnym i wtedy zachodzi proces syntezy. Szczególnym przypadkiem takich reakcji są:
O
3
↔
O + O
2
(tlen atomowy + tlen cząsteczkowy)
C. Reakcja wymiany – przebiega wówczas, gdy składniki substancji reagują z sobą
zamieniając się miejscami, według schematu:
AB + C → AC + B
AB + CD → AD + BC
Przykładem reakcji wymiany, w czasie której z jednego związku chemicznego i jednego
pierwiastka powstaje inny związek chemiczny i inny mniej aktywny pierwiastek. Taką reakcję
nazywamy reakcją wymiany pojedynczej lub reakcją wypierania:
Hg (NO
3
)
2
+ Zn → Zn(NO
3
)
2
+ Hg
Obliczenia masowe i energetyczne wynikające z reakcji chemicznych
Najczęściej podczas reakcji chemicznych zmiany energii występują w postaci ciepła bądź
oddawanego do otoczenia i wtedy mamy do czynienia z przemianą chemiczną egzotermiczną,
bądź pochłanianego z otoczenia, i mamy wtedy do czynienia z przemianą chemiczną
endotermiczną.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Rys. 3. Reakcje chemiczne zmiany energii.
[9]
Jaka jest różnica między tymi obiema przemianami?
W przypadku przemiany egzotermicznej mieszanina reagująca na ogół ogrzewa się,
w przypadku zaś przemiany endotermicznej – staje się zimniejsza. Ciepło wydzielane lub
pobrane, w odniesieniu do określonych ilości (moli) substancji nazywa się ciepłem reakcji.
Wartość ciepła reakcji oznacza się różnymi znakami, w zależności od tego, czy energia jest
przekazywana do otoczenia, czy do układu;
–
znakiem minus (-) oznacza się efekt cieplny, podczas którego układ przekazuje do
otoczenia energię na sposób ciepła,
–
znakiem plus (+) oznacza się efekt cieplny, podczas którego otoczenie przekazuje do
układu energię na sposób ciepła.
Dla interpretacji wyników dogodne jest wprowadzenie tzw. funkcji termodynamicznej –
entalpii (oznaczamy ja literą H), będącej funkcją stanu (zmiana ∆H zależy tylko od stanu
początkowego i końcowego).
Przykład:
reakcja egzotermiczna
C + O
2
→ CO
2
+ 394 kJ Q
p
= 394 kJ/mol ∆H = -394 kJ/mol
reakcja endotermiczna
N
2
+ O
2
→ 2 NO – 180,8 kJ Q
p
= -180 kJ/mol ∆H = 180,8 kJ/mol
Zmiana entalpii ∆H ma znak odwrotny. Dla reakcji egzotermicznych ujemny,
a endotermicznych dodatni.
Użytecznym pojęciem jest standardowa entalpia tworzenia, którą definiuje się jako
entalpię towarzyszącą syntezie 1 mola związku chemicznego w warunkach standardowych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Tabela 1. Molowe entalpie standardowe tworzenia niektórych związków chemicznych. [4,s.75]
Zwi
ą
zek
∆
H
o
298
kJ/mol
Zwi
ą
zek
∆
H
o
298
kJ/mol
H
2
O
(c)
H
2
O
(g)
HCl
(g)
HNO
3(c)
H
2
SO
4(c)
CO
(g)
CO
2(g)
NH
3(g)
NO
(g)
NO
2(g)
-285,85
-241,79
-92,30
-173,22
-811,32
-110,54
-393,42
-46,19
+90,37
+33,85
SO
2(g)
SO
3(g)
NaCl
(s)
KCL
(s)
NaOH
(s)
CH
4(g)
CH
3
OH
(c)
C
2
H
5
OH
(c)
CH
3
COOH
(c)
C
6
H
6(c)
-296,86
-385,18
-410,99
-435,90
-426,77
-74,85
-238,57
-277,65
-487,01
-49,03
Przykład:
Wypisz entalpie standardowe reagentów w poniższej reakcji:
CH
4(g)
+ 2 O
2(g)
= CO
2(g)
+ 2 H
2
O
(c)
Odczytujemy entalpie tworzenia następujących substancji z tablic:
∆
H (CO
2
) = -393,1 kJ/mol
∆
H (H
2
O) = -285,9 kJ/mol
∆
H (CH
4
) = -74,8 kJ/mol
∆
H (O
2
) = 0 kJ/mol (entalpia tworzenia każdej substancji pierwiastkowej jest równa zero).
Prawo Hessa oraz prawo Laplace'a umożliwiają obliczanie efektów cieplnych różnego
rodzaju procesów. Ilustracją tego prawa niech będzie przykład, w którym wychodząc
z gazowego HCl, gazowego NH
3
oraz wody, otrzymamy dwiema różnymi drogami roztwór
wodny chlorku amonowego.
Budowa chemiczna szkła
Materiały, z których po stopieniu można otrzymać szkło – to materiały szkłotwórcze.
Należą do nich: SiO
2
, B
2
O
3,
P
2
O
5
, TiO
2
.
Rozróżniamy więc szkła: krzemianowe, boranowe, fosforanowe lub mieszane
boranowo-krzemianowe.
Dodawanie do materiałów szkłotwórczych innych materiałów – tlenków, nie tworzących
szkła, ma na celu ułatwienie topienia mieszaniny albo zmianę właściwości; lub możliwość
przechłodzenia stopu bez krystalizacji. Tego rodzaju tlenki nazywamy modyfikatorami. Są to
przeważnie tlenki metali jednowartościowych R
2
O (topniki alkaliczne), najczęściej: Na
2
O,
K
2
O, Li
2
O lub tlenki metali dwuwartościowych RO, najczęściej: CaO, MgO, ZnO, BaO, PbO
(stabilizujące).
Dodawane są też takie tlenki, jak: Al
2
O
3
, ZrO
2
, BeO, TiO
2
– odgrywające rolę pośrednią,
częściowo szkłotwórczą, częściowo modyfikującą.
Szkło można otrzymać z samej krzemionki, wystarczy stopić je w temperaturze 1730
o
C
i stop odpowiednio przechłodzić, aby otrzymać szkło – szkło krzemionkowe- kwarcowe.
Krzemionka z dodatkiem jednego a tlenków metali jednowartościowych (sód, potas, lit)
nazywanych zasadowymi - alkalicznymi, np. z Na
2
O topi się w temperaturze o wiele niż
krzemionka bez domieszek. Krzemionka reaguje z Na
2
O tworząc krzemiany sodowe. Roztwór
– stopiona masa – jest bardzo płynna (ma małą lepkość). Roztwór wodny krzemianu
sodowego lub potasowego nazywamy szkłem wodnym.
Dodanie do krzemionki jednego z tlenków metali dwuwartościowych np. CaO, powoduje
obniżenie temperatury topienia – tworzą się krzemiany wapniowe, topiące się łatwo
i rozpuszczające nadmiar krzemionki. Masa taka nie daje się normalnie przechłodzić
ponieważ łatwo krystalizuje.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
Dopiero łączne zestawienie tlenków: sodowego, wapniowego w odpowiednich ilościach
jako dodatku do krzemionki ułatwia otrzymanie szkła trójskładnikowego – szkło zwykłe.
Szkło jest roztworem krzemianów – sodowego i wapniowego oraz wolnej krzemionki
pozostałej w nadmiarze, dla której do reakcji nie wystarczyło Na
2
O i CaO:
Na
2
SiO
3
·
CaSiO
3
·
SiO
2
.
Mieszaniny i roztwory
Mieszanina od związku chemicznego różni się tym, że można ją rozdzielić na składniki
prostsze za pomocą metod fizycznych. Przykładami mieszanin mogą być: sól + piasek, mąka
+ cukier, saletra potasowa + kreda+ skaleń.
W praktyce spotykamy dwa rodzaje mieszanin:
a) niejednorodne, np. piasku i cukru, wody i tłuszczu. Składniki tych mieszanin można
rozdzielić w sposób mechaniczny.
b) jednorodne, w których nie można odróżnić części składowych, np. mieszanina wody
i alkoholu, cukru i wody.
Mieszaninę jednorodną, składającą się z dwu lub większej liczby składników bez
względu na stan skupienia nazywa się roztworem. Roztwory mogą być gazowe, ciekłe lub
stałe.
Jednym ze składników roztworu jest rozpuszczalnik, w którym rozpuszczają się dowolne
substancje.
Rozpuszczalnik wraz z substancją rozpuszczoną stanowi roztwór. Przez stężenie
roztworu rozumiemy wielkość określającą zawartość składnika w roztworze, wyrażoną
stosunkiem ilości składnika do ilości roztworu lub do ilości rozpuszczalnika.
Istnieje wiele sposobów wyrażania stężeń:
a) stężenie procentowe masowe, określa liczbę gramów zawartą w 100 gramach roztworu
c % = m
s
/m
r
·
100%
m
s
– masa substancji, m
r
– masa roztworu.
b) stężenie procentowe masowo-objętościowe, określa liczbę gramów substancji
rozpuszczonej w 100 cm
3
roztworu (stosunek masy do objętości).
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jak zdefiniujesz pojęcie pierwiastka chemicznego?
2.
Jak określisz znaczenie różnych pierwiastków?
3.
Jak scharakteryzujesz prawo okresowości pierwiastków?
4.
Jakie wyróżnisz bloki w układzie okresowym pierwiastków?
5.
Jakie związki zaliczysz do określonej grupy głównej układu okresowego?
6.
Jakie związki zaliczysz do określonej grupy pobocznej układu okresowego?
7.
Jak zdefiniujesz pojęcie tlenków amfoterycznych?
8.
Jakie tlenki nazywane są obojętnymi?
9.
Jak przedstawisz wzór ogólny kwasu?
10.
Jakie są reakcje chemiczne związków nieorganicznych?
11.
Jak zapiszesz reakcje chemicznej wymiany?
12.
Jakie grupy tworzą tlenki pod względem charakteru chemicznego?
13.
Jakie grupy tworzą wodorotlenki pod względem charakteru chemicznego?
14.
Co to są sole w ujęciu chemicznym związków nieorganicznych?
15.
Jaką reakcję nazywamy egzotermiczną?
16.
Jaką reakcję nazywamy endotermiczną?
17.
W jaki sposób obliczamy stężenie procentowe roztworu?
18.
Jak wyjaśnisz pojęcie mieszaniny jednorodnej?
19.
Jak wyjaśnisz pojęcie roztworu?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
4.1.3. Ćwiczenia
Ćwiczenie 1
Określ oznaczenia pierwiastków układu okresowego: żelaza, siarki, krzemu, glinu, złota.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odszukać w materiałach dydaktycznych przykład oznaczenia pierwiastka,
2)
dokonać analizy układu okresowego pierwiastków,
3)
wypisać oznaczenia poszczególnych pierwiastków.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
układ okresowy pierwiastków,
−
poradnik dla ucznia
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Scharakteryzuj grupy główne układu okresowego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odszukać w materiałach dydaktycznych treści dotyczące układu okresowego
pierwiastków,
2)
odszukać dostępne źródła informacji, literaturę,
3) zapisać grupy główne układu okresowego.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
dostępne źródła informacji,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Ćwiczenie 3
W tabeli wypisz pięć związków chemicznych określonych grup układu okresowego
pierwiastków.
Tabela do ćwiczenia 3.
GRUPA
PRZYKŁADOWE ZWIĄZKI CHEMICZNE
V
VI
VIB
VIIIB
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych nazwy grup układu okresowego,
2) wypisać przykładowe związki chemiczne określonej grupy.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
tabela,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 4
Napisz reakcje syntezy pięciu dowolnych kwasów.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące reakcji syntezy,
2) wybrać pięć znanych kwasów,
3) napisać ich postać chemiczną,
4) utworzyć reakcje syntezy,
5) dobrać współczynniki reakcji chemicznych.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Ćwiczenie 5
Sporządź mieszaninę roztworu o następującym składzie: 100 g cukru, 300 g wody.
Oblicz, jakie jest stężenie procentowe cukru w roztworze.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
zapoznać się z instrukcją do wykonania ćwiczenia,
2)
przygotować stanowisko pracy,
3)
wykonać ćwiczenie,
4)
obliczyć stężenie procentowe cukru w roztworze.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
instrukcja do wykonania ćwiczenia,
−
woda, cukier,
−
zlewki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 6
Sporządź mieszaninę 20-procentowego roztworu z wodorotlenku sodu i wody, aby
otrzymać 1,1 kg tego roztworu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
zapoznać się z instrukcją do wykonania ćwiczenia,
2)
obliczyć zawartość związków w mieszaninie,
3)
przygotować stanowisko pracy,
4)
wykonać ćwiczenie.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
instrukcja do wykonania ćwiczenia,
−
instrukcja bhp,
−
woda, wodorotlenek sodu,
−
zlewki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
zdefiniować pojęcie pierwiastka chemicznego?
2)
określić znaczenie pierwiastków?
3)
scharakteryzować prawo okresowości pierwiastków?
4)
rozróżniać bloki układu okresowego?
5)
określić związki zaliczane do grup głównych układu okresowego?
6)
określić związki zaliczane do grup pobocznych układu okresowego?
7)
zdefiniować pojęcie tlenków amfoterycznych?
8)
określić tlenki obojetne?
9)
przedstawić wzór ogólny kwasu?
10)
określić reakcje chemiczne związków nieorganicznych?
11)
zapisać reakcje chemicznej wymiany?
12)
określić grupy tlenków pod względem chemicznym?
13)
określić grupy tworzenia wodorotlenków?
14)
określać sole w ujęciu chemicznym?
15)
zdefiniować reakcje egzotermiczne?
16)
zdefiniować reakcje endotermiczne?
17)
określić zasady obliczania stężeń procentowych roztworu?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
4.2. Surowce szklarskie
4.2.1. Materiał nauczania
Surowce szklarskie
Podział surowców szklarskich jest dokonywany z różnych punktów widzenia. Przed 50
laty dzielono surowce szklarskie na pospolite i rzadkie. Do pospolitych zaliczano: piasek,
sodę, potaż, wapień, sulfat i minię. Pozostałe surowce zaliczano do rzadkich. Podział ten jest
obecnie nieuzasadniony, gdyż wiele surowców rzadkich stało się pospolitymi.
Według funkcji pełnionych w szkle, surowce szklarskie dzielą się na:
1. Surowce podstawowe.
a) Surowce wprowadzające tlenki szkłotwórcze. Surowce tej grupy zawierają tlenki,
które tworzą zasadniczą więźbę szkła lub do niej mogą wstąpić. Do tlenków
o charakterze wybitnie szkłotwórczym należą: SiO
2
, B
2
O
3
i P
2
O
5
. Do tlenków
o charakterze amfoterycznym, które mogą tworzyć więźbę, zaliczamy: AL
2
O
3
, TiO
2
i ZrO
2
.
b) Surowce wprowadzające tlenki modyfikujące. Tlenki o własnościach zasadowych
tworzą grupę modyfikatorów więźby szkła. Modyfikatory rozrywają lub rozluźniają
sieć przestrzenną szkła. Modyfikatorami najsilniej zrywającymi sieć są jony
alkaliów. Jony metali dwuwartościowych nie zrywają sieci, lecz zmniejszają ilość
tlenków szkłotwórczych powodując rozluźnienie sieci przestrzennej szkła. Surowce
należące do tej grupy wprowadzają do szkła następujące tlenki: Na
2
O, K
2
O, Li
2
O,
CaO, MgO, BaO, BeO, PbO i ZnO.
2. Surowce pomocnicze. Surowce klarujące i przyspieszające topienie szkła. Surowce
stosowane do klarowania i przyśpieszania topienia szkła biorą udział w procesach
technologicznych o specjalnym charakterze, z których każdy wymaga określonych
surowców. Wiele z tych surowców ma charakter więcej niż jednofunkcyjny.
3.
Surowce dodatkowe.
a) Surowce do barwienia szkła.
b) Surowce do zamącania szkła.
c) Surowce do odbarwiania masy szklanej.
4. Surowce wtórne.
Ze względu na pochodzenie, wyróżnić można dwie grupy surowców:
−
mineralne – naturalne, występujące w przyrodzie,
−
sztuczne – syntetyczne, produkowane przez przemysł chemiczny celowo lub powstające
jako produkt odpadowy.
Surowce podstawowe, do zestawu szklarskiego, dobiera się tak, aby wprowadziły w skład
szkła określone tlenki. W tabeli 2 przedstawiono surowce podstawowe, w których wprowadza
się do masy szklanej 12 tlenków najczęściej spotykanych w szkłach przemysłowych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
Tabela 2. Wykaz tlenków wchodzących najczęściej w skład szkieł przemysłowych oraz surowców
podstawowych stosowanych dla wprowadzenia tych tlenków w skład szkła. [6,s.50].
Surowce
Tlenki
Mineralne (naturalne)
Sztuczne
I. Szkłotwórcze
Kwaśne
SiO
2
B
2
O
3
P
2
O
5
Amfoteryczne
Al
2
O
3
ZrO
2
TiO
2
II. Modyfikujące
Grupa R
2
O
Na
2
O
K
2
O
Li
2
O
Grupa R
2
O
CaO
MgO
ZnO
BaO
PbO
Piasek kwarcowy (szklarski)
-
-
skalenie,
kaolin,
skały
magmowe
cyrkon (krzemian cyrkonowy)
rutyl (dwutlenek tytanu)
-
-
-
wapienie: kalcyt, marmur,
kamień wapienny, kreda
dolomit
-
-
-
-
boraks, kwas borowy
kwas ortofosforowy, fosforany
wodorotlenek glinowy, tlenek
glinowy, glinian sodowy
dwutlenek cyrkonu
biel tytanowa (dwutlenek tytanu)
soda, sulfat
potaż, kwaśny węglan potasowy
techniczny
-
magnezyt
biel cynkowa, tlenek cynkowy
techniczny
węglan barowy techniczny
minia, glejta
Właściwości i znaczenie surowców szklarskich
1. Surowce szkłotwórcze.
Związki krzemionkowe
Dwutlenek krzemu należy uważać za podstawowy składnik szkła. Szkła przemysłowe
zawierają najczęściej 55–80% SiO
2
. Wraz ze wzrostem zawartości SiO
2
w szkłach:
−
zwiększa się temperatura mięknięcia szkła,
−
rośnie jego lepkość,
−
maleje długość technologiczna.
SiO
2
poprawia szereg właściwości technicznych szkieł:
−
maleje współczynnik rozszerzalności liniowej szkła,
−
wzrasta jego twardość i uzyskuje lepsze właściwości mechaniczne,
−
zmniejsza się gęstość i współczynnik załamania światła,
−
rośnie odporność chemiczna zwłaszcza na działanie wody i kwasów,
−
poprawiają się właściwości dielektryczne.
Szkła ze wzrastającą zawartością krzemionki topią się trudniej i mają większą skłonność
do krystalizacji.
Do zestawów szklarskich SiO
2
wprowadza się głównie w postaci kwarcu za pomocą
piasków kwarcowych. Jest on głównym surowcem szklarskim, dlatego jego chemiczny skład
ma zasadniczy wpływ na jakość szkła.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Piasek szklarski(kwarcowy) wydobyty wprost ze złoża przeważnie nie nadaje się do
topienia szkła. Piaski surowe zawierają liczne zanieczyszczenia i domieszki, dla których
oddzielenia stosuje się różne metody uszlachetniające, np. płukanie piasku. Metody te muszą
zapewnić nie tylko równomierne uziarnienie, ale także minimalną zawartość szkodliwych
domieszek, zwłaszcza związków żelaza.
O przydatności piasku do zestawu szklarskiego decydują następujące cechy:
a) niską zawartość części ilastych,
b) odpowiednie uziarnienie,
c) niską zawartość mechanicznych zanieczyszczeń organicznych,
d) niską zawartość związków żelaza,
e) niską zawartość innych tlenków barwiących lub wpływających na skład masy szklanej.
Tabela 3. Klasyfikacja piasków szklarskich wg BN-80/6811-01
Charakterystyka fizyko – chemiczna piasku kwarcowego:
−
główny składnik SiO
2
, zawartość 99,0% – 99,7%,
−
postać: ziarnista,
−
kolor: biały do szarego, w zależności od zawartości zanieczyszczeń,
−
bez zapachu,
−
nierozpuszczalny w wodzie.
Związki boru
Tlenek borowy B
2
O
3
wprowadza się do szkła w postaci czystych produktów sztucznych:
boraksu lub kwasu borowego.
Kwas borowy otrzymuje się z minerałów zawierających bor. Boraks krystaliczny
sztuczny jest produktem bardzo czystym. Otrzymywanym z minerałów borowych najczęściej
z tynkalu. Boraks krystaliczny tworzy drobne, bezbarwne kryształy z wyglądu przypomina
miałką sól kuchenną. Rozpuszcza się łatwo w wodzie, ogrzany do temperatury 75
o
C

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
pęcznieje i kipi następnie topi się na przeźroczystą bezbarwną masę nazywaną szkliwem
boraksowym (perła boraksowa).
Trójtlenek boru:
–
wykazuje silne właściwości szkłotwórcze i łatwo tworzy szkła z wieloma tlenkami;
–
wprowadza się go do szkieł i szkliw krzemianowych dla obniżenia temperatury topnienia
oraz polepszenia ich właściwości;
–
obniża silnie lepkość szkieł krzemianowych w wysokiej temperaturze, zwiększa
natomiast lepkość w niskiej temperaturze w pobliżu temperatury transformacji;
–
ułatwia rozpuszczanie tlenków barwiących, stąd chętnie dodaje się go w niewielkich
ilościach do szkieł barwnych, zwłaszcza w miejsce alkaliów;
–
wraz z tlenkami pierwiastków lekkich (Li
2
O, BeO, MgO, Al
2
O
3
) daje szkła
przepuszczalne dla promieniowania rentgenowskiego;
–
bor polepsza właściwości mechaniczne szkieł, wpływając silnie na wartość modułu
sprężystości szkieł;
–
zwiększa znacznie ich twardość;
–
szkła zawierające bor są odporniejsze na działanie kwasów;
–
bor działając jako topnik pozwala zmniejszyć zawartość alkaliów w szkle, dzięki temu
poprawiają się właściwości elektroizolacyjne szkieł (duża odporność, małe straty
dielektryczne);
–
w szkłach technicznych bor pozwala zmniejszyć zawartość alkaliów, nadając im wraz
z glinem, odporność chemiczną, niski współczynnik rozszerzalności termicznej
i związaną z tym odporność na wstrząsy cieplne;
–
wadą jest lotność boru.
Związki glinu
Surowce glinowe wprowadzają do szkła tlenek glinu Al
2
O
3.
Można je podzielić następująco:
1. Naturalne związki glinu – glinokrzemiany:
−
skaleń,
−
kaolin,
−
skały magmowe.
2. Syntetyczne (sztuczne związki) glinu:
−
techniczny tlenek glinu,
−
wodorotlenek glinu,
−
glinian sodowy.
Naturalne surowce glinowe są częściej stosowane w odróżnieniu do surowców
sztucznych z uwagi na:
−
niską temperaturę topienia (łatwiej topliwe),
−
są tańsze i łatwiej dostępne,
−
oprócz tlenku glinu i ewentualnie innych tlenków zawierają krzemionkę zwykle
w dużych ilościach.
Wadą stosowania surowców naturalnych jest:
−
niestałość składu chemicznego,
−
znaczne zanieczyszczenie związkami barwiącymi, głównie związkami żelaza.
W przemyśle szklarskim najczęściej stosowanym naturalnym surowcem glinowym jest
skaleń.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Do najbardziej znanych skaleni należą: skaleń potasowy, sodowy, wapniowy. Dla
przemysłu szklarskiego ma znaczenie skaleń potasowy i sodowy. Przygotowuje się je
w postaci mączki, posiadający barwę kremową lub lekko różową.
Surowce glinowe sztuczne są znacznie czyściejsze, mają stały skład chemiczny, lecz są
droższe, a także trudno topliwe i trudno rozpuszczalne w masie szklanej. Do nich należą:
Techniczny wodorotlenek glinu Al(OH)
3
,
−
produkowany jest w cementowni jako produkt uboczny cementu szybkowiążącego,
−
jest to biały drobny proszek,
−
stosowany do topienia szkieł o dużej bezbarwności (szkła optyczne) oraz do szkieł
technicznych o dużej zawartości tlenku glinowego i niskiej zawartości alkaliów.
Techniczny tlenek glinu Al
2
O
3
−
jest to biały proszek o wysokiej temperaturze topienia,
−
nie rozpuszcza się w wodzie ani w kwasach wyjątek stanowi kwas fluorowodorowy,
−
posiada dużą stałość składu chemicznego,
−
najlepszy do topienia jest tlenek glinu drobnoziarnisty ponieważ grube ziarna są
przyczyną powstawania kamieni i smug.
Glinian sodowy Al
2
O
3
⋅
3 Na
2
O
−
zawiera 35,40% Al2O3 i 64,60 % Na2O,
−
jest proszkiem szrobiałym,
−
jest higroskopijny.
Glin nadaje szkłom szereg korzystnych właściwości:
−
zwiększa wytrzymałość mechaniczną szkła oraz jego twardość;
−
poprawia wyraźnie odporność na działanie wody;
−
zwiększa silnie napięcie powierzchniowe;
−
wpływa na zmianę krzywej lepkości, znacznie zwiększa lepkość w pobliżu temperatury
wyrobowej;
−
zwiększa się długość technologiczna szkła i nadaje się ono do formowania maszynowego;
−
Al2O3 zmniejsza podatność szkieł sodowo-wapniowych na krystalizację i ułatwia ich
topnienie.
2. Surowce modyfikujące.
Soda
Jako surowców wprowadzających tlenek sodowy używa się prawie wyłącznie sody
i sulfatu. Tlenek sodowy może być wprowadzony do szkła także z innymi surowcami, jak np.
skały magmowe, środki zmętniające (fluorokrzemian sodowy, kriolit), środki klarujące
(saletra sodowa, chlorek sodu), a także boraks.
Soda jest produktem sztucznym otrzymywanym fabrycznie metodą Solvaja, nazywaną
kalcynowaną lub amoniakalną. W handlu znajduje się dwa rodzaje sody: soda kalcynowana
lekka lub ciężka
Przez zastosowanie sody ciężkiej osiąga się następujące korzyści:
1)
równe wagowo ilości sody ciężkiej wymagają o wiele mniejszej przestrzeni
magazynowania aniżeli soda lekka,
2)
soda ciężka jest mniej higroskopijna i zachowuje większą stałość składu,
3)
soda ciężka powoduje mniejszy rozkurz, zmniejsza zmiany zestawu i korozję materiałów
ogniotrwałych, poprawia warunki higieny pracy w hutach szkła,
4)
soda ciężka z powodu lepszej przewodności cieplnej przyśpiesza topienie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Soda:
−
dobrze rozpuszcza się w wodzie,
−
jest bardzo higroskopijna, w czasie przyłączania wody wydziela się ciepło, zbrylenia
twardniejące z upływem czasu,
−
roztarta w palcach powoduje wrażenie śliskości wskutek zmydlenia naskórka,
−
charakteryzuje się durzą stałością składu chemicznego.
Związki sodu wprowadzamy do szkieł, aby uzyskać korzystne właściwości:
−
obniżyć ich temperaturę topnienia;
−
obniżyć ich temperaturę mięknięcia i lepkości;
−
zwiększyć długość technologiczną szkła;
Wady stosowania sody:
−
zmniejsza się twardość i obniża wytrzymałość mechaniczna szkła;
−
obniża się odporność chemiczna i może dochodzić do tworzenia się na powierzchni szkła
wykwitów pod wpływem wilgoci;
−
pogarszają się właściwości szkła jako dielektryka.
Związki potasu
Tlenek potasowy K
2
O ma w szkle własności podobne do tlenku sodowego. Tlenek
potasowy w szkłach:
−
poprawia właściwości optyczne, nadaje ładny połysk,
−
zwiększa lepkość co powoduje trudniejsze klarowanie,
−
wykazuje pozytywne zachowanie wobec tlenków barwiących, mają one bardziej
selektywną absorpcję widma i dają pełniejsze oraz bardziej czyste odcienie,
−
zwiększa współczynnik rozszerzalności cieplnej w mniejszym stopniu od tlenku
sodowego,
−
przy uderzeniu wydają czysty dźwięk, są szlachetniejsze,
−
mają większą odporność na działanie wody.
Tlenek potasowy jest stosowany do wyrobu szkła kryształowego, optycznego, barwnego,
aparaturowego, gospodarczego i niektórych szkieł technicznych. Jako surowiec podstawowy
stosuje się węglan potasowy, a do klarowania szkła saletrę potasową.
Inną odmianą wprowadzającą tlenek potasowy do szkieł jest potaż, to techniczny węglan
potasowy K
2
CO
3
.
Potaż pochodzenia mineralnego, to:
−
biały proszek,
−
bez zapachu,
−
topi się w temperaturze 890ºC,
−
jest łatwo rozpuszczalny w wodzie,
−
roztarty w wilgotnych palcach powoduje wrażenie śliskości,
−
jest silnie higroskopijny z tego powodu należy go przechowywać w szczelnie zakrytych
zasobnikach lub w suchych i ciepłych składach.
Związki litu
Lit jest pierwiastkiem bardzo rozpowszechnionym w przyrodzie, lecz rzadko występuje
w większych ilościach. Surowcem wprowadzającym tlenek litowy do szkła jest techniczny
węglan litowy Li
2
CO
3
. Charakterystyka Li
2
CO
3
:
−
jest białym krystalicznym proszkiem topiącym się w temp. 618°C,
−
wodzie jest mało rozpuszczalny,
−
nie jest higroskopijny,
−
czysty
węglan litowy zawiera 40,6% Li
2
O i 59,4°/o CO
2
.
Li
2
O znajduje zastosowanie do produkcji szkieł kineskopowych i pyroceramu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
Tlenek litowy:
−
powoduje łatwą topliwość szkieł, co umożliwia wprowadzenie mniejszych ilości tlenków
alkalicznych,
−
obniża punkt mięknienia szkła,
−
wykazuje niski współczynnik rozszerzalności cieplnej i dlatego szkła mają większą
odporność na szybkie zmiany temperatury,
−
zmniejsza współczynnik załamania światła,
−
dodawany jest do
trudno topliwych szkieł.
Związki wapnia
Do wprowadzenia w skład szkła tlenku wapniowego CaO włącza się do zestawu tanie
i rozpowszechnione surowce mineralne – wapienie.
Tlenek wapniowy:
−
nadaje szkłu wiele cennych własności,
−
wpływa korzystnie na niektóre własności mechaniczne szkieł, np. zwiększa najbardziej ze
wszystkich tlenków wytrzymałość na rozerwanie i współczynnik sprężystości,
−
większe jednak ilości CaO zwiększają kruchość szkła i obniżają wytrzymałość na
ś
ciskanie,
−
wzrost tlenku wapniowego w szkle kosztem SiO2 podnosi odporność szkła na działanie
wody,
−
zmniejsza lepkość szkła w wysokich temperaturach, a zwiększa w zakresie temperatur
odprężania,
−
skłonność do krystalizacji ogranicza ilość tlenku wapniowego w szkle,
Zwykłe szkła sodowo-wapniowe powinny zawierać co najmniej 6% CaO, przeciętna
zawartość wynosi 7-10% CaO.
Tlenek wapniowy wprowadza się do szkła głównie w postaci wapienia i kredy.
Wapienie stosowane w przemyśle szklarskim dzielimy według struktury na:
1) kalcyty – wapienie czyste gruboziarniste,
2) marmury – wapienie drobnokrystaliczne,
3) wapienie – kamień wapienny o bardzo drobnych ziarnach,
4) kreda – wapień o strukturze ziemistej.
Związki magnezu
Tlenek magnezowy:
−
nadaje szkłu bardzo dobre własności i jest powszechnie stosowany dla częściowej
zamiany tlenku wapniowego,
−
znaczniejsze
obniżenie
lepkości
następuje
w
temperaturach
niskich
i wskutek tego szkła magnezowo-wapniowe są dłuższe od szkieł wapniowych oraz
łatwiej się odprężają,
−
obniżania zdolności do krystalizacji umożliwia pracę maszynom formującym w niższych
temperaturach,
−
ma pewne znaczenie także przy ręcznej produkcji wyrobów cienkościennych, przez
zastąpienie tlenku wapniowego tlenkiem magnezowym w szkłach sodowo- wapniowych
systematycznie obniża się górna temperatura krystalizacji,
−
posiada w szkle najniższy ze wszystkich tlenków ziem alkalicznych współczynnik
rozszerzalności cieplnej, szkła zawierające MgO wykazują większą odporność termiczną,
−
przy zawartości 3–4% MgO zmniejsza się także szybkość krystalizacji.
Tlenek magnezowy jest wprowadzany do szkła przeważnie w postaci dolomitu, a do
szkieł o niskiej zawartości tlenku wapniowego – w postaci magnezytu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Dolomit
Głównym składnikiem dolomitu jest podwójny węglan wapniowo magnezowy
MgCa(CO
3
)
2
.
Mączka dolomitowa – jest to biały, szorstki proszek nierozpuszczalny w wodzie. Mączkę
dolomitową należy przechowywać w suchym i ciepłych składach lub zasobnikach.
Ze względu na bardzo zmienny skład chemiczny, dolomit można wprowadzać do zestawu
po oznaczeniu zawartości MgO i CaO.
Związki baru
Tlenek barowy BaO wprowadza się do topienia szkieł: laboratoryjnych, optycznych,
wysokogatunkowych szkieł gospodarczych oraz do szkieł formowanych metodą wytłaczania.
Wprowadzony do szkieł tlenek barowy:
−
korzystnie wpływa na proces topienia masy szklanej,
−
małe ilości BaO przyśpieszają topienie,
−
wykazują dużą skłonność do krystalizacji, jednak mniejszą niż szkła wapniowe,
−
powoduje wydłużenie szkła i obniża lepkość, szczególnie w niższych temperaturach, co
także upodobnia szkła barowe do ołowiowych,
−
nadaje szkłu własności pośrednie między własnościami tlenku wapniowego i tlenku
ołowiawego. Dotyczy to przede wszystkim takich własności, jak: połysk, współczynnik
załamania światła, układ lepkości, odporność chemiczna, własności mechaniczne
i przewodność elektryczna. Z tych własności szczególnie często wykorzystuje się
własności optyczne, gdyż prowadzi to do zaoszczędzenia PbO.
Najważniejszym surowcem szklarskim wprowadzającym BaO jest węglan barowy.
Siarczan barowy stosuje się jako surowiec przyśpieszający topienie.
Węglan barowy
Jest surowcem dostatecznie czystym, zawiera nieduże ilości zanieczyszczeń nie
szkodliwych dla szkła,
−
jest drobnym bardzo białym proszkiem,
−
nierozpuszczalny w wodzie,
−
jest higroskopijny, pod wpływem wilgoci zbija się w grudki,
−
dostarczany jest w szczelnych pojemnikach, przechowywany w suchych i ciepłych
składach,
−
rozkłada się w temp. 1350°C.
Węglan barowy jest silną trucizną, gdyż w organizmie rozkłada się na trujące
nierozpuszczalne sole barowe i dlatego przy jego stosowaniu należy bezwzględnie
przestrzegać przepisów bhp.
Związki ołowiu
Tlenek ołowiu PbO jest zaliczany do grupy szkłotwórczych. Ilość PbO w szkłach może
dochodzić nawet do 80%.
Szkła ołowiowe:
−
o zmniejszonej ilości alkaliów wykazują wiele korzystnych własności, jak większą
odporność hydrolityczną i niższą przewodność elektryczną, dlatego tlenek ołowiawy jest
wprowadzany do różnych szkieł elektrotechnicznych,
−
powoduje najwyższy ze wszystkich tlenków wzrost współczynnika załamania światła
i dlatego wchodzi w skład szkieł optycznych i kryształowych,
−
zmniejsza twardość szkła i odporność na działanie kwasów, dzięki czemu szkła
kryształowe można łatwo rzeźbić i polerować kwasami,
−
nadają szkłom mocny dźwięk z powodu niskiego współczynnika sprężystości,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
−
łatwo się w szkle redukuje, co stanowi pewną trudność przy topieniu i obróbce na
palnikach szkieł ołowiowych,
−
zmniejsza lepkość w całym zakresie temperatur, dlatego szkła ołowiowe topią się
i formują łatwo.
Minia ołowiowa
Minia ołowiowa jest podstawowym surowcem służącym do wprowadzania tlenku
ołowiawego do szkła. Minię otrzymuje się przez utlenienie czystego metalicznego ołowiu.
Minia ołowiowa:
−
to proszek barwy od pomarańczowej do mocno czerwonej, barwa uzależniona jest od
gatunku,
−
ogrzewana staje się czarna, lecz po ostygnięciu przybiera barwę poprzednią,
−
nie rozpuszcza
się w wodzie,
Jest higroskopijna, dostarczana jest w szczelnych pojemnikach. Jest produktem
szkodliwym dla zdrowia. Wchłanianie minii ołowiowej powoduje ciężkie chroniczne zatrucie
organizmu, nazywane ołowicą. Z tego względu podczas pracy z minią obowiązuje
bezwzględne przestrzeganie przepisów bhp.
Glejta
Tlenek ołowiawy PbO nazywany glejtą jest żółtym ciężkim proszkiem. Zdarza się, że
szkło z dodatkiem ołowiu nie może być topione w atmosferze utleniającej. Z powodu
niewielkiej zawartości ołowiu przetopiony tlenek ołowiawy, czyli glejta, znajduje
zastosowanie jako czynnik redukujący przy wytapianiu rubinu miedziowego.
Związki cynku
Tlenek cynkowy ZnO wprowadza się do szkieł najczęściej dla podwyższenia własności
termicznych i chemicznych, mniej mechanicznych.
Oprócz tego tlenek cynkowy w ilości 5 ÷ 8% w szkle jest wraz z siarczkiem kadmowym
niezbędnym środkiem do produkcji rubinów selenowych oraz do produkcji szkieł zamąconych
(dla wzmocnienia działania fluorowych środków mącących).
Tlenek cynkowy ZnO:
−
jest niezwykle trudno topliwy,
−
w połączeniu z krzemionką tworzy dość łatwo topliwe krzemiany,
−
zwiększa przewodność cieplną, dlatego szkła cynkowe mają dobrą wytrzymałość
termiczną,
−
polepsza odporność chemiczną,
−
nie ma dużego wpływu na własności mechaniczne szkła, jedynie zwiększa twardość
szkła,
−
w wyższych temperaturach znacznie zmniejsza lepkość szkła.
Przez wprowadzenie tlenku cynkowego do szkła zamiast alkaliów i krzemionki można
otrzymać szkła o takiej samej lepkości i topliwości, lecz o zwiększonej odporności termicznej
i chemicznej. Czyste szkła cynkowe mają skłonność do krystalizacji, natomiast szkła
mieszane, np. glinowo-cynkowe – nie wykazują jej. W szkłach bezołowiowych wprowadzenie
do 8% ZnO nie powoduje krystalizacji. W szkłach ołowiowych 9% ZnO zamącą szkło.
Jako surowca szklarskiego używa bieli cynkowej. Otrzymywana jest z rud cynkowych.
Biel cynkowa jest czystym tlenkiem cynkowym:
−
jest drobnym białym proszkiem,
−
roztarta w palcach nie jest śliska lecz maże się,
−
nie rozpuszcza się w wodzie,
−
ogrzana przybiera zabarwienie żółte, które znika po ostygnięciu próbki,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
−
jest nieco higroskopijna, powinna być przechowywana w zakrytych zasobnikach,
pojemnikach,
−
jest stosowana do topienia szkieł termometrycznych oraz do szkieł barwnych w celu
utrwalenia barwy.
3. Surowce wtórne.
W przemyśle szklarskim do wykorzystania nadają się głównie: granulowane żużle
wielkopiecowe oraz stłuczka szklana.
Przykładem
surowca
szklarskiego
będącego
odpowiednio
uzdatnionym
ż
użlem
wielkopiecowym jest Calumite.
Calumite jest najtańszym surowcem glinowym dla szkła okiennego, wprowadzając
prawie cały glin i magnez, równocześnie zmniejszając zużycie mączki wapiennej. Przyspiesza
on proces topienia, ułatwia klarowanie a także daje oszczędność paliw. śużle hutnicze
zawierają siarkę w formie siarczków, które mogą barwić szkło. Aby temu zapobiec należy
stworzyć odpowiednio utleniające warunki topienia masy szklanej.
Bardzo cennym surowcem do topienia szkła i produkcji wszelkiego rodzaju wyrobów
szklanych jest stłuczka szklana. Zastosowanie jej pozwala na:
−
oszczędność składników surowcowych,
−
zmniejszenia w sposób znaczny zużycia energii na topienie masy szklanej,
−
zmniejszenie emisji CO2 do atmosfery,
−
przyspieszenie procesu wytopu oraz przedłużenie żywotności agregatów topliwych, czyli
zmniejszenie
zużycia materiałów ogniotrwałych, donic i basenu wanny.
Główne jej znaczenie polega na tym, że nie posiadająca jako odpad wartości użytkowej
może być użyta zamiast pełnowartościowych surowców.
Stosuje się stłuczkę własną i obcą pochodzącą. Stłuczka szklana własna ma taki sam lub
zbliżony skład chemiczny, jaki posiada gotowy produkt, czyli otrzyma w piecu szklarskim
masa szklana.
Stłuczka własna pozostająca w hucie szkła z odpadów produkcyjnych (np. obrzeży taśmy
szkła wytarzanej metodą ciągnienia pionowego), braków odrzuconych przy sortowaniu,
powinna być starannie zbierana i przechowywana tak, aby można było wykorzystać bez
zanieczyszczeń w procesie wytwarzania szkła. Przy prawidłowej gospodarce stłuczka
znajduje się w ciągłym obiegu.
Stłuczka szklana obca pochodząca ze skupu, głównie od odbiorców opakowań szklanych
oraz ze zbiornic odpadów, aby mogła być użyta musi spełniać wymagania obowiązujących
norm.
4. Surowce pomocnicze i dodatkowe.
Surowce pomocnicze dodawane są do zestawu w niewielkiej ilości w celu:
−
ułatwienia i przyspieszenia procesów topienia masy szklanej, wytworzenia w czasie
topienia szkła produktów gazowych ułatwiających wydzielanie się pęcherzy,
−
wytworzenia szczególnych warunków topienia, np. wytworzenia odpowiedniej atmosfery
utleniającej bądź redukującej.
Jako surowce pomocnicze stosowane są:
a)
azotany, czyli saletry-sodową NaNO
3
,
−
potasową KNO
3
,
−
barową Ba(N0
3
)
2
,
b)
siarczany-sodowy (sulfat) Na
2
SO
4
,
−
amonowy (NH4)2SO4,
−
barowy (baryt) Ba SO4,
c)
chlorki-amonowy (salmiak) NH
4
Cl,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
−
sodowy (halit) NaCl,
−
potasowy (sylwin) KCl
d)
arszenik As
2
O
3
i związki fluoru.
Saletry. Są surowcami produkowanymi sztucznie w zakładach przemysłu azotowego. Dla
przemysłu szklarskiego używa się azotanów o technicznym stopniu czystości.
Saletra sodowa (azotan sodowy) NaNO
3
, tworzy bezbarwne kryształy dobrze
rozpuszczalne w wodzie. Jest bardzo higroskopijna, wchłaniając przez dłuższy czas wilgoć
z powietrza ulega całkowitemu rozpuszczeniu.
Saletra potasowa (azotan potasowy) KNO
3
otrzymywana jest z saletry sodowej
i chlorku potasowego w wyniku reakcji wymiany. Jest substancją krystaliczną, bezbarwną,
dobrze rozpuszcza się w wodzie.. Jest mało higroskopijna.
Saletra barowa (azotan barowy) Ba(NO
3
)
2
otrzymywana przez działanie kwasu
azotowego na węglanbarowy, tworzy bezbarwne kryształy słabiej rozpuszczalne w wodzie.
Jest mało higroskopijna.
Siarczany. Siarczan sodowy (sulfat) Na
2
SO
4
– jako surowca używa się technicznego
bezwodnego siarczanu wytwarzanego przez przemysł chemiczny z soli kamiennej. Jest
drobno krystalicznym proszkiem, łatwo rozpuszczalnym w wodzie. Jest higroskopijny i łatwo
ulega zbryleniu.
Siarczan amonowy (NH
4
)
2
SO
4
jest surowcem otrzymywanym sztucznie. Jest to biały
drobno krystaliczny proszek łatwo rozpuszczalny w wodzie.
Siarczan barowy (baryt) BaSO
4
jest substancją krystaliczną, zmielony (mączka barytowa),
jest szarym lub brunatnym proszkiem, nierozpuszczalnym w wodzie. Jest minerałem
zawierającym głównie siarczan barowy BaSO
4
.
Stosuje się go w celu przyspieszenia topienia i klarowania masy szklanej, ponieważ
zmniejsza jej lepkość a także wprowadza do masy BaO, korzystnie wpływający na proces
topienia. Wadą surowca jest duże zanieczyszczenie, zwłaszcza związkami żelaza.
Chlorki. Chlorek amonowy (salmiak) NH
4
Cl, otrzymywany jest syntetycznie (produkt
uboczny przy wytwarzaniu sody) jest to substancja krystaliczna w postaci białego proszku,
dobrze rozpuszczalna w wodzie. W czasie ogrzewania łatwo sublimuje, zestalone
w powietrzu pary tworzą białe dymy.
Chlorek sodowy – NaCl występuje w przyrodzie jako minerał halit znany powszechnie
pod nazwą soli kamiennej. Sól kamienna jest skałą osadową występującą w skupieniach
zbitych a niekiedy w postaci dużych kryształów (układ regularny). Chlorek sodowy dobrze
rozpuszcza się w wodzie. W stanie czystym nie jest higroskopijny. Topi się w temperaturze
800°C, a przy ogrzaniu do temperatury 1413°C całkowicie ulatnia się.
Chlorek potasowy – KCl jest rozpowszechniony jako minerał sylwin. Jego właściwości są
podobne do chlorku sodowego.
Arszenik. Jest technicznym tlenkiem arsenawym As
2
O
3
i zwany również trójtlenkiem arsenu.
Arszenik jest białym proszkiem trudno rozpuszczalnym w wodzie. Arszenik jest bardzo silną
trucizną, dawka śmiertelna wynosi ok. 0,1 g i dlatego wszystkie czynności z arszenikiem
należy wykonywać bardzo ostrożnie, bezwzględnie przestrzegając przepisów bhp.
5. Surowce szklarskie dodatkowe
Surowce dodatkowe wprowadza się do zestawu w niedużych ilościach, głównie w celu
nadania szkłom szczególnych właściwości. Przykładem surowców dodatkowych są substancje
barwiące szkło.
Barwniki szkła dzielimy na:
1) barwniki jonowe,
2) barwniki koloidalne.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
Barwniki jonowe rozpuszczają się w szkle, nadając szkłu zabarwienie o intensywności
proporcjonalnej do stężenia barwnika w szkle.
Do barwników jonowych należą tlenki: Fe, Mn, Co, Ni, Cu i ziem rzadkich. Barwniki
jonowe dzielimy z kolei na dwie grupy:
a) tlenki metali o jednym stopniu utlenienia, np. tlenki Co, Ni, Nd i in.
b) tlenki metali o dwóch lub więcej stopniach utlenienia, np. tlenki Mn, Cr, Ce i in.
Barwa szkła zależy od: rodzaju barwnika, jego ilości, rodzaju barwionego szkła
i warunków topienia.
W przypadku barwników jonowych barwa szkieł zależy od: rodzaju jonu, stopnia
utlenienia, liczby koordynacji.
Surowce do barwienia szkła można podzielić również z punktu widzenia barwy, jaką
nadają szkłu:
związki manganu
1) barwa fioletowa
związki niklu
związki neodymu
związki kobaltu
2) barwa niebieska
związki miedzi
związki żelaza
3) barwa zielona
związki chromu
związki siarki
związki żelaza
4) barwa żółta
związki kadmu
związki srebra
związki ceru
związki selenu
5) barwią czerwono
związki miedzi
związki złota
Związki żelaza – często występują w surowcach jako zanieczyszczenie. Ich obecność
powoduje barwienie szkła zależnie od stopnia utleniania żelaza na niebiesko, gdy żelazo
występuje jako Fe
2+
lub na żółto w przypadku występowania żelaza Fe
3+
.W szkle występują
najczęściej oba tlenki, tj. FeO i Fe
2
O
3
.
Związki chromu – stosowane są do barwienia szkła na zielono, a w odpowiednich
warunkach uzyskać można barwę żółtą lub pomarańczową. Jako surowce barwiące stosuje się
najczęściej sztucznie otrzymane związki jak tlenek chromowy Cr
2
O
3
oraz chromiany
i dwuchromiany potasu i sodu.
Tlenek chromowy Cr
2
O
3
jest ciemnozielonym proszkiem nierozpuszczalnym
w wodzie, kwasach i alkaliach. Stapiany z substancjami utleniającymi np. azotanami
przechodzi w chromiany.
Dwuchromian potasowy K
2
Cr
2
O
7
barwy pomarańczowej i chromian potasowy K
2
CrO
4
barwy żółtej są substancjami łatwo rozpuszczalnymi w wodzie.
Chromian i dwuchromian sodowy mają podobne właściwości jak sole potasowe lecz jako
higroskopijne i tworzące hydraty o zmiennej zawartości wody rzadko są stosowane.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Związki manganu – wprowadzane są do zestawu w celu zabarwienia szkła na fioletowo, jak
też dla usunięcia zabarwienia spowodowanego obecnością żelaza, przez wytworzenie barwy
dopełniającej. Najczęściej stosowany jest w tym celu dwutlenek manganu MnO
2
zwany
braunsztynem. Jako ruda występuje również manganit Mn
2
O
3
· H
2
O. Sztucznie braunsztyn
otrzymywany jest przez prażenie azotanu manganawego, powinien zawierać nie mniej niż
90% MnO
2
.
Rzadziej stosowany jest nadmanganian potasowy KMnO
4
, substancja tworząca kryształy
barwy szarofioletowej. Nadmanganian potasowy rozpuszcza się w wodzie z zabarwieniem
fioletowym.
Związki niklu – wprowadzają do szkła jon niklawy Ni
2+
powodujący zabarwienie fioletowe,
choć można uzyskać również inne barwy. Stosowane są w tym celu najczęściej otrzymywane
chemicznie z rud niklowych tlenek niklawy – NiO i tlenek niklowy – Ni
2
O
3
. Mogą być
również używane wodorotlenek niklawy – Ni(OH)
2
i węglan niklawy – NiCO
3
.
Tlenek
niklawy
NiO
jest
proszkiem
barwy
szarozielonej
nierozpuszczalnym
w wodzie, trudno topliwym. Rozpuszcza się w kwasach z wytworzeniem odpowiednich soli
niklawych mających w roztworze barwę zieloną.
Tlenek niklowy – Ni
2
O
3
barwy szaroczarnej, ogrzany do temperatury powyżej 600°C rozkłada
się z wydzieleniem tlenu.
Związki kobaltu – powodują zabarwienie szkła na ciemnoniebiesko. Stosowane są również
do odbarwiania szkła poprzez wygaszanie barwy żółtej pochodzącej od jonów Fe
3+
.
Najczęściej stosowany jest tlenek kobaltawy CoO. Tlenek kobaltawy jest proszkiem barwy
szarozielonej, trudno topliwym, nierozpuszczalnym w wodzie. Reaguje z kwasami tworząc
odpowiednie sole. Stosowane są również tlenek kobaltowy Co
2
O
3
, brunatnoczarny. Rzadziej
stosowane są: węglan, fosforan i arsenian kobaltawy.
Związki miedzi – barwią szkło na niebiesko lub czerwono (rubin miedziowy). Jako surowiec
do barwienia masy szklanej stosowany jest. najczęściej tlenek miedziowy CuO
i znacznie rzadziej siarczan miedziowy CuSO
4
·5H
2
O. Oba związki otrzymuje się
w wyniku przeróbki chemicznej rud miedzi.
Selen i jego związki – selen oraz seleniny np. selenin sodowy Na
2
SeO
3
, cynkowy ZnSeO
3
,
barowy BaSeO
3
wywołują czerwone zabarwienie szkła. Stosowane są również do odbarwiania
szkła (najczęściej w zestawie z kobaltem). Jako surowca szklarskiego używa się selenu
szarego, zwanego metalicznym. Jest to szary proszek o temperaturze topnienia 220° C, wrze
w temperaturze 688°C a po zestaleniu pary tworzy czerwoną odmianę. Selen spala się
w powietrzu z niebieskim płomieniem tworząc dwutlenek selenu SeO
2
, który rozpuszcza się
w wodzie dając słaby kwas selenawy H
2
SeO
3
. Po rozcieńczeniu wodą powstaje koloidalny
selen czerwony.
Związki antymonu – używa się je do barwienia szkła na czerwono. Jako surowiec stosowany
jest przeważnie trójtlenek antymonu Sb
2
O
3
(stosowany razem z siarką), rzadziej inne związki
np. siarczki. Trójtlenek antymonu (tlenek antymonawy) otrzymywany jest chemicznie
z przeróbki występującego w przyrodzie antymonitu Sb
2
S
3
, ciemnego łatwo topliwego
minerału. Tlenek Sb
2
S
3
jest białym proszkiem, źle rozpuszczalnym w wodzie.
Związki kadmu – stosowany najczęściej bywa siarczek kadmowy CdS barwiący szkło na
kolor żółty. Jest to żółty proszek otrzymywany chemicznie z metalicznego kadmu
uzyskiwanego jako produkt uboczny przy przeróbce rud cynkowych.
Związki tytanu – używane w zestawieniu z innymi tlenkami np. cerowym CeO
2
dwutlenek
tytanu TiO
2
wywołuje w szkle barwę żółtą. Dwutlenek tytanu (tlenek tytanowy) zwany
niekiedy bielą tytanową uzyskiwany jest w wyniku przeróbki chemicznej minerałów głównie
ilmenitu FeO·TiO
2
oraz rutylu TiO
2
. Dwutlenek tytanu jest białym proszkiem
nierozpuszczalnym w wodzie, w kwasach oraz w zasadach.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
Związki srebra – stosowane bywają najczęściej azotan srebrowy AgN0
3
wywołujący,
w wyniku tworzenia w szkle zawiesiny metalicznego srebra, barwę żółtą. Rzadziej używany
jest chlorek srebrowy AgCl. Azotan srebrowy jest substancją w postaci bezbarwnych
kryształów ciemniejących przy dłuższym naświetlaniu w wyniku rozkładu i wydzielania
metalicznego srebra. Jest dobrze rozpuszczalny w wodzie.
Związki siarki – siarki elementarnej nie stosuje się do produkcji szkieł użytkowych.
Znaczenie ma siarka występująca w postaci siarczków. W praktyce przy współdziałaniu ze
związkami żelaza nadaje ona szkłu barwę od żółtej do brunatnej. Dla wyraźnego zabarwienia
szkła wystarczą te ilości siarki i żelaza, które jako zanieczyszczenia występują w surowcach
szklarskich. Topienie szkła musi odbywać się w warunkach redukcyjnych. Rolę środka
redukującego spełniają substancje zawierające węgiel.
FeS powoduje powstawanie brudnych odcieni szkła. Jego działanie zwiększa się przy
większej zawartości żelaza w szkle lub w szkłach niskoalkalicznych. Przy produkcji
brązowych szkieł barwionych siarką stosuje się zwiększoną ilość alkaliów. Część Na
2
O
wprowadzana jest do zestawu w postaci siarczanu. Równocześnie stosowany jest dodatek
węgla lub grafitu.
Jako surowiec wprowadzający siarkę stosuje się sulfat. Jako środki redukujące – koks lub
grafit. Używa się także innych substancji organicznych, np. trocin lub mąki. Mają one różny
skutek barwienia, co wynika raczej z różnic w równomiernym ich rozdziale
w zestawie.
Związki złota – służą do wytwarzania szkieł o barwie czerwonopurpurowej. Jest to tzw. złoty
rubin. Zabarwienie szkła polega na koloidalnym rozproszeniu złota metalicznego w szkle.
Złoto rozpuszcza się w szkle w małych ilościach.
Ziemie rzadkie
Ziemie rzadkie stosuje się w produkcji szkła dla osiągnięcia następujących celów:
1) charakterystycznego zabarwienia szkła,
2) odbarwiania wysokojakościowych szkieł,
3) produkcji szkieł o specjalnych własnościach fizycznych i optycznych.
Największe znaczenie mają związki ceru i neodymu.
Związki ceru – stosuje się te związki nie tylko do barwienia szkła, ale i do odbarwiania. Cer
barwi szkło żółto i brązowo w zależności od stężenia tlenku cerowego CeO
2
.
W szkle nie zawierającym ołowiu 3,5% CeO
2
powoduje powstanie żółtego zabarwienia
z odcieniem czerwonym. Tlenek cerowy ma znaczenie dla wytwarzania szkieł o specjalnych
własnościach fizycznych i optycznych. Bezbarwne szkła zawierające 2 ÷ 4% tlenku cerawego
Ce
2
O
3
selektywnie pochłaniają promienie nadfioletowe. Służy również do wytwarzania szkieł
okularowych, chroniących wzrok przed promieniami nadfioletowymi.
Tlenek cerowy Ce0
2
, tworzy w stanie czystym biały proszek.. Techniczny tlenek cerowy
zawiera do 99,5% CeO
2
. Często bywa zanieczyszczony innymi ziemiami rzadkimi i ma barwę
od żółtej do brunatnej.
Związki neodymu – stosuje się je przede wszystkim do wytwarzania szkieł
o bardzo pięknych efektach barwnych. Szkła barwione neodymem wykazują oryginalną
przepuszczalność promieni świetlnych. Mają one barwę fioletową, ale złożoną z promieni
fioletowych, niebieskich, czerwonych, a ponadto przepuszczają wąskie pasmo promieni
ż
ółtozielonych, dla których barwa fioletowa jest dopełniającą.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
Metody pobierania próbek surowców szklarskich do badań laboratoryjnych
Surowce z zakładów produkcyjnych (hut) w postaci próbek do badania pobiera się
z silosów z danym surowcem, bezpośrednio po jego przyjęciu przez hutę lub w miarę
pojawiania się w procesie produkcyjnym wad wyrobów szklanych.
Pobieranie próbek rozpoczyna się z chwilą wylosowania opakowania z którego
pobierzemy próbkę. Trzeba je oczyścić, aby podczas ich otwierania i pobierania próbek nie
nastąpiło zanieczyszczenie produktu. Pobieranie powinno odbywać się możliwie szybko
i w
warunkach, które nie wpływają na właściwości badanego produktu. Nie należy pobierać
próbek, na przykład, w czasie deszczu, silnego wiatru, mrozu itp. Do pobierania należy
stosować odpowiednie przyrządy umożliwiające pobieranie próbki.
Zarówno przyrząd do pobierania próbek jak i naczyń do których próbki są pobierane,
muszą być odporne na działanie chemiczne.
Objętość próbki pierwotnej produktu ciekłego, półciekłego lub mazistego powinna
wynosić co najmniej 100 ml. Liczba próbek pierwotnych, które należy uzyskać z danej partii
produktu, wynika z podzielenia wielkości próbki ogólnej: masę próbki pierwotnej.
Z pobranych próbek pierwotnych sporządza się próbkę ogólną. W tym celu produkty ciekłe,
półciekłe lub maziste umieszcza się odpowiednio w dużym naczyniu i starannie miesza.
Kawałki większe od 25mm rozdrobnić i starannie wymieszać. Masa próbki ogólnej zależy od
wielkości partii produktu.
Otrzymana próbka ogólna musi być poddana homogenizacji i zmniejszeniu ilości próbki
laboratoryjnej. Jeśli chodzi o materiały stałe sypkie, to najstarszą techniką zmniejszania masy
próbki jest techniką ćwiartkowania. Operacja ćwiarkowania prowadzi do zmniejszenia masy
próbki o połowę. Zazwyczaj wybór ćwiartek pobieranych do dalszych operacji pozostawia się
pracownikowi wykonującemu ćwiartkowanie. Choć jeśli przez A, B, C, D oznaczy się
poszczególne ćwiartki wyboru pary ćwiartek dokonać można przez losowanie.
1)
2)
3)
Rys. 4. Schemat operacji ćwiartkowania: 1) usypanie stożka, 2) przekształcenie stożka
w placek i jego podział na cztery części, 3) Pobranie dwóch ćwiartek do dalszych
operacji [5, s. 69]
Operacje ćwiartkowania są bardzo pracochłonne i stąd coraz więcej uwagi poświęca się
innemu sposobowi zmniejszania masy próbki, a mianowicie przemiennemu sypaniu dwóch
stożków.
Rys. 5.
Schemat operacji przemiennego usypywania dwóch stożków [5, s. 69]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Jest to najprostsza technika ręcznego zmniejszania masy próbki. Za pomocą łopaty
(o wielkości dostosowanej zarówno do największych kawałków materiału, jak do całkowitej
ilości materiału) szufluje się ten materiał przemiennie na dwa możliwie identyczne stosy.
Wybór jednego z dwóch usypanych stożków do dalszej operacji musi być oczywiście
absolutnie przypadkowa. Ta technika zmniejszania masy próbki jest mniej pracochłonna.
Jeśli zachodzi konieczność większego zmniejszenia masy próbki, możliwe jest
zastosowanie modyfikacji techniki przemiennego sypania dwóch stożków.
Głównymi czynnikami determinującymi wybór sprzętu do pobierania próbek towarów
stałych są: granulacja, ilość towaru oraz czy jest on w spoczynku, czy też w ruchu. Jak przy
wszystkich innych towarach próbniki muszą być wykonane z materiału nie oddziałującego
w jakikolwiek sposób z towarem.
Najprostszym urządzeniem do pobierania próbek są:
–
łopatki lub łopaty, w zależności od ilości pobrania składnika, do pobierania próbek
sypkich,
–
zagłębniki (sztachery), do pobierania próbek towarów drobnoziarnistych (do 20 mm),
granulowanych oraz sproszkowanych,
–
próbniki otwarte lub zamykane, do pobrania próbek sypkich,
–
pipety, biurety, do pobierania próbek roztworów,
–
kolby miarowe, cylindry, do pobierania próbek roztworów.
Rys. 6. Naczynia miarowe najczęściej stosowane w analizie objętościowej: a) kolba, b ) cylinder, c)
biureta [4, s. 61]
Próbnik jest skonstruowany jest z rury metalowej ściętej pod kątem 45° na jednym końcu,
z lekko zaokrąglonymi krawędziami, na drugim końcu znajduje się rękojeść z odpornego
materiału zamykająca rurę. Długość próbnika powinna być taka, aby umożliwiła pobranie
próbki z całego przekroju (długości) pojemnika po jego przekątnej, a średnica wewnętrzna
przynajmniej 2,5-krotnie większa od maksymalnej średnicy ziarna, jednakże nie mniejsza niż
20 mm. Po napełnieniu próbnik wyciąga się, a zawartość przesypuje do uprzednio
przygotowanego naczynia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
Rys. 7.
Próbnik do pobierania próbek sypkich [5, s. 84]
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jak dzielą się surowce szklarskie według funkcji pełnionej w szkle?
2.
Jak dzielą się surowce szklarskie według pochodzenia?
3.
Jakie tlenki zaliczamy do modyfikujących?
4.
Jakie cechy piasku szklarskiego decydują o jego przydatności do zestawu szklarskiego?
5.
Jakie tlenki wprowadza do masy szklanej dolomit?
6.
Jakie znasz surowce glinowe sztuczne?
7.
W postaci, jakich surowców wprowadza się do szkła tlenek ołowiu?
8.
Jakie surowce wtórne znajdują zastosowanie w przemyśle szklarskim?
9.
Jakie zalety posiada stłuczka szklana własna?
10.
Jaki znasz grupy barwników szklarskich?
11.
Od czego uzależniona jest barwa szkieł?
12.
Jakich związków barwiących szkło należy użyć, aby zabarwić szkło na kolor czerwony?
13.
Jaki związek barwiący masę szklaną zastosujesz, aby uzyskać złoty rubin?
14.
W jaki sposób pobieramy próbki surowców szklarskich?
15.
Jakiego sprzętu używamy do pobierania próbek piasku?
4.2.3. Ćwiczenia
Ćwiczenie 1
Do podstawowych surowców szklarskich dopisz tlenki wprowadzane do zestawu
szklarskiego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
Tabela do ćwiczenia 1
Surowiec
Wprowadzane tlenku
Dolomit
Kreda
Boraks
Potaż
Minia ołowiowa
Soda
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące opisy surowców szklarskich,
2) dobrać tlenki do określonych surowców szklarskich,
3) uzupełnić tabelę.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
tabela,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Do określonych rodzajów szkła dopisz odpowiednią do produkcji klasę piasków
szklarskich oraz wpisz zawartości tlenków żelaza w określonych klasach piasków.
Tabela do ćwiczenia 2
Rodzaj szkła
Klasa
piasku
szklarskiego
Zawartość tlenków żelaza, w % masowych
Opakowania
szklane
barwne
Szkło
optyczne
Szkło
krzemionkowe
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych tabele z klasyfikacją piasków szklarskich,
2) dobrać klasę pisaku do rodzaju szkła,
3) zapoznać się z normę branżową dla piasku,
4) uzupełnić tabelę.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
−
tabela,
−
norma branżowa dla piasku,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 3
Porównaj właściowści dwóch związków chemicznych – sody i dolomitu – stosowanych
w przemyśle szklarskim.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych opisy surowców szklarskich,
2) dobrać informacje do określonych surowców szklarskich,
3) porównać surowice szklarskie.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 4
Określ wpływ następujących tlenków na właściwości szkła: MgO, CaO, SiO
2
, Al
2
O
3
.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych opis surowców szklarskich wprowadzające
podane tlenki,
2) zapisać wpływ tlenków na właściwości szkła.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
dokonać podział surowców szklarskich?
2)
określić tlenki modyfikujące?
3)
określić przydatność pisaków szklarskich?
4)
określić tlenki wprowadzane za pomocą dolomitu?
5)
wymienić surowce glinowe sztuczne?
6)
dobierać surowiec wprowadzający do szkieł tlenek ołowiu?
7)
sklasyfikować surowce wtórne przemysłu szklarskiego?
8)
ocenić zalety stłuczki szklanej własnej?
9)
określić grupy barwników szklarskich?
10)
określić barwniki cząsteczkowe?
11)
określić czynniki wpływające na barwę szkła?
12)
określić związki barwiące na kolor żółty?
13)
określić związki barwiące na kolor zielony?
14)
określić zasady pobierania próbek surowców szklarskich?
15)
określić sprzęt używany do pobierania próbek sypkich?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
4.3. Badania właściwości szkła
4.3.1.
Materiał nauczania
Klasyfikacja rodzajów szkła
Usystematyzowanie szkła w podział wymaga olbrzymiego materiału doświadczeń
i obserwacji nagromadzonych w technologii szkła. Najbardziej powszechnym podziałem
materiału technologii szkła jest podział według przeznaczenia wyrobów szklarskich, a więc
podział według gałęzi produkcji.
TECHNOLOGIA SZKŁA
GAŁĘZIE TECHNOLOGII
SZKŁA OPAKOWANIA SZKŁA SZKŁA
BUDOWLANE SZKLANE GOSPODARCZE TECHNICZNE
– szkła płaskie
– opakowania do
– szkła stołowe i
– szkła elektro-
ciągnione,
produktów
galanteria,
próżniowe,
–
szkła płaskie
spożywczych,
– szkła kryształowe,
– szkła optyczne,
walcowane,
- opakowania do
– szkła oświetleniowe.
– włókna szklane,
– kształtki
kosmetyków,
– rurki i pręty
budowlane,
- opakowania do
szklane,
– szkła piankowe.
artykułów i
– szkła
odczynników chemicznych.
laboratoryjne.
Właściwości płynnej masy szklanej i szkła
Lepkość stanowi jedną z cech hydrodynamicznych cieczy. Masa szklana w stanie stopionym
jest cieczą, a najważniejszą jej technologiczną właściwością jest lepkość.
Jeżeli w dwóch stykających się warstwach cieczy prędkość jednej warstwy jest różna od
drugiej, to obserwujemy stan przejściowy, podczas którego zachodzą procesy dążące do
wyrównania prędkości w obu warstwach. Procesy te noszą nazwę tarcia wewnętrznego lub
lepkości..
Z praktycznego punktu widzenia znajomość lepkości konieczna jest dla prawidłowego
prowadzenia procesów topienia, klarowania, formowania i obróbki szkła, gdyż te stadia jego
wytwarzania uwarunkowane są procesami płynięcia.
Nadzwyczaj ważną, z technologicznego punktu widzenia, jest zależność lepkości szkła od
temperatury. Podczas wytwarzania np. zwykłych krzemianowych szkieł sodowo-wapniowych
lepkość masy szklanej od temperatury topienia (około 1500 °C) do temperatury odprężania
wyrobów (około 500 °C) zmienia się w przybliżeniu 10
13
razy. Ogólnie przyjmuje się, że
lepkość szkła w temperaturze topienia i klarowania wynosi 10
2
dPas, a w temperaturze
pokojowej około l0
20
dPas.
Na rysunku przedstawiono wykres zależności lepkości szkła od temperatury. Na krzywej
można wyróżnić szereg charaktycznych punktów ważnych zarówno dla teorii, jak i dla
praktyki technologicznej.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
Rys. 8.
Zależność lepkości szkła od temperatury. [1,s.89]
Tabela 4. Charakterystyczne punkty na krzywej lepkości. [1,s. 90]
Oznaczenie
Lepkość,
dPas
Opis
Temperatura osiadania
10
4
Temperatura, w której pręt 80Pt+20Rh
(o średnicy 0,5 mm, wysokości 241 mm)
zanurza się w szkło z prędkością 2 cm/min.
Temperatura
mięknięcia
wg
Littletona
10
7,65
Temperatura, w której nić szklana o średnicy
0,55-0,77 mm i długości 235 mm, ogrzewana
z szybkością 5-10°C/min wydłuża się pod
własnym ciężarem (w górnych 100 mm nici)
z prędkością 1 mm/min.
Temperatura
mięknięcia
dylatometrycznego
10
11,3
Temperatura, w której występuje maksimum na
krzywej dylatometrycznej. Czas relaksacji
naprężeń wynosi 15 sekund.
Ś
rednia
temperatura
deformacji
10
13,3
Temperatura, w której następuje przejście szkła
ze stanu ciekłego w stan stały. Zgodnie
z normami francuskimi ten punkt leży przy
pierwszej anomalii krzywej rozszerzalności
odprężonego szkła; określa się z krzywej
rozszerzalności.
Górna
temperatura
odprężania
10
13
Temperatura, w której czas relaksacji naprężeń
wynosi 15 minut.
Dolna
temperatura
odprężania
10
14,5
Temperatura, w której czas relaksacji naprężeń
wynosi 4 godziny.
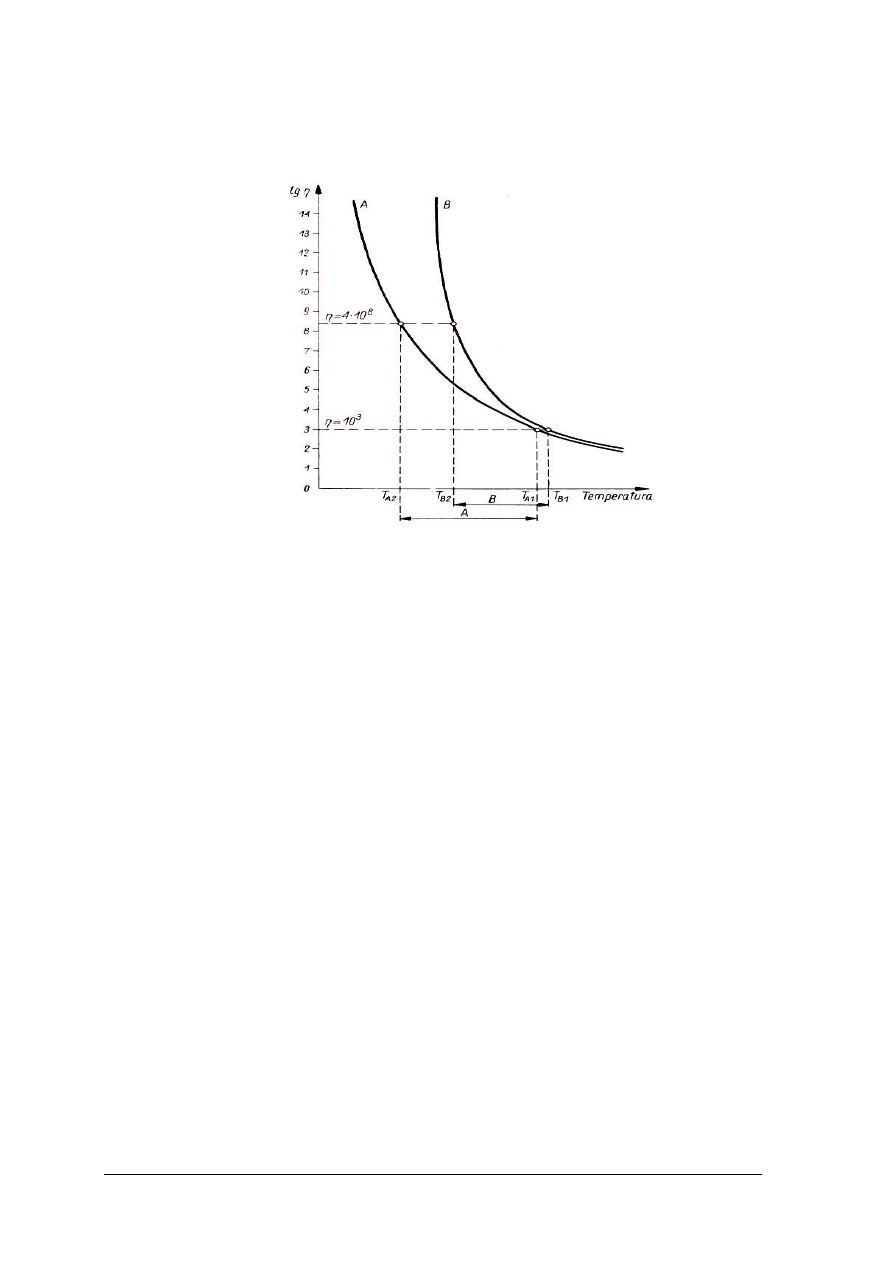
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
Przyjęto umownie, że przeciętny zakres lepkości, odpowiedni do formowania wyrobów
szklanych wynosi 10
3
–10
8
dPas. Nazywa się go zakresem lepkości kształtowania masy
szklanej lub zakresem lepkości wywarzania wyrobów.
Rys. 9.
Wykres zmian lepkości dwóch różnych szkieł różnej długości
technologicznej, zależnie od zmian temperatury. [1,s.93]
Zakres temperatury kształtowania zmienia się w zależności od rodzaju szkła, ściślej –
w zależności od składu chemicznego szkła. Na rysunku 3 przedstawiono wykres lepkości
w funkcji temperatury dla dwóch szkieł o różnym składzie chemicznym. Porównując ich
zakresy temperatury wytwarzania wyrobów, wyznaczone zakresem lepkości 10
3
–10
8
dPas,
stwierdzamy, że szkło A ma większy zakres temperatury kształtowania masy.
Ponieważ zakłada się, że w jednakowych warunkach stygnięcie bezbarwnych szkieł
przezroczystych odbywa się z jednakową w przybliżeniu szybkością, wnioskujemy iż szkło
A, mające większy zakres temperatury kształtowania, będzie stygło dłużej. Mówi się więc, że
szkło A jest dłuższe technologicznie, zaś szkło B – krótsze. Stąd pojęcie długości
technologicznej szkła.
Jasne jest, że szkła dłuższe mogą być kształtowane dłużej, a więc dokładniej, lub
wymyślniej, ale odbije się to na wydajności produkcji. Szkła krótsze mogą być produkowane
szybciej, nie należy jednak żądać, aby były kształtowane wymyślnie, co wymaga przecież
czasu dłuższego. Stąd wniosek, że długość technologiczna szkła musi być dobrana bardzo
wnikliwie do rodzaju wyrobów i do sposobów ich wytwarzania. Dostosowanie odpowiedniej
długości szkła jest szczególnie ważne przy wytwarzaniu wyrobów za pomocą automatów,
mających określony czas wytwarzania wyrobów. Technolog musi przeto umieć dostosować
długość szkła do warunków pracy wiedząc, iż długość technologiczna szkła zależy od jego
składu chemicznego.
Najczęściej stosowane tlenki można ułożyć w szereg, w którym na początku (od lewej
strony) znajdują się tlenki najbardziej zmniejszające (skracające) długość szkła, a na końcu
(po prawej stronie) tlenki najbardziej wydłużające szkło:
ZnO – MgO – CaO – Al
2
O
3
– SiO
2
– B
2
O
3
– Na
2
O – K
2
O – PbO

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
Wprawdzie takie uszeregowanie porównawcze tlenków pod względem ich wpływu na
długość szkła może mieć tylko znaczenie orientacyjne, jednak na tej podstawie można ocenić
w przybliżeniu i porównać długość różnych szkieł.
Krystalizacja – szkło w zwykłych warunkach jest nietrwałe, tj. znajduje się w stanie
metastabilnym i zawsze istnieje w nim tendencja przejścia w trwalszy stan krystaliczny.
Tendencję tę określa się jako podatność szkła na krystalizację. Zatem wszystkie szkła będą
krystalizować, jeżeli stworzy się im odpowiednie warunki.
W procesie krystalizacji szkło-ciało bezpostaciowe poprzez uporządkowanie struktury
przechodzi w ciało krystaliczne o uporządkowanej budowie wewnętrznej.
Proces krystalizacji uzależniony jest od wielu czynników: składu chemicznego,
temperatury, a także lepkości, stopienia nie jednorodności masy szklanej, obecności ciał
obcych, kontaktu z materiałami ogniotrwałymi, obecność gazów w masie szklanej zarówno
w pęcherzykach, jak i rozpuszczonych. W zależności od tego, który czynnik przeważa,
rozróżnia się następujące rodzaje (typy) krystalizacji: homogeniczną i heterogeniczną,
spontaniczną (samorzutną) i regulowaną. Proces krystalizacji ma bardzo duże znaczenie dla
wad masy szklanej w postaci oszkleń.
Napięcie powierzchniowe, czyli energia odniesiona do powierzchni jednostkowej materiału,
ukazująca się gdy cząsteczki znajdujące się na powierzchni są mocniej przyciągane ze strony
warstw wewnętrznych cieczy niż ze strony cząsteczek ośrodka otaczającego powierzchnię
masy szklanej.
Napięcie powierzchniowe masy szklanej odgrywa bardzo dużą rolę w technologii szkła,
gdyż wpływa w sposób zasadniczy nie tylko na przebieg produkcji, ale i na jakość wyrobów.
Przy wytapianiu szkła napięcie powierzchniowe wpływa na usuwanie pęcherzyków gazowych
z masy szklanej oraz na jej homogenizację. Od wielkości napięcia powierzchniowego zależy
szybkość wzrostu pęcherzy gazowych i szybkość ulatniania się ich z masy szklanej. Szybkość
mieszania i znikania nici (niejednorodności) w masie szklanej zależy od stosunku napięcia
powierzchniowego szkła podstawowego i szkła nici. Jeżeli napięcie powierzchniowe szkła
nici jest większe od napięcia powierzchniowego szkła podstawowego, to nić dąży do przyjęcia
formy kulistej, a co za tym idzie, będzie trudno rozpuszczać się. Przy stosunku odwrotnym
tych napięć nić będzie dążyć do rozciągnięcia się w błonkę, a więc będzie łatwiej rozpuszczać
się.
Przy wytwarzaniu wyrobów szklanych napięcie powierzchniowe wpływa na to, że:
1) powierzchnie wyrobów dmuchanych lub odlewanych stają się gładkie,
2) przy formowaniu wyrobów metodą wytłaczania masa szklana o dużym napięciu
powierzchniowym źle wypełnia wklęsłości formy i nie daje ostrych krawędzi wzoru,
3) przy wyciąganiu szkła płaskiego sposobem zmechanizowanym napięcie powierzchniowe
powoduje zwężanie się taśmy,
4) przy wytwarzaniu szkła płaskiego metodą float napięcie powierzchniowe warunkuje
uzyskanie jego wysokiej jakości powierzchni (polerowanie ogniowe).
Oprócz składu chemicznego i temperatury duży wpływ na napięcie powierzchniowe
wykazują inne czynniki, np. otaczająca atmosfera. Napięcie powierzchniowe szkła topionego
w atmosferze silnie redukującej może być większe nawet o 22% od napięcia takiego samego
szkła, lecz topionego w środowisku utleniającym.
Odporność termiczna szkła to zdolność szkła do wytrzymywania nagłych zmian temperatury
bez zniszczenia. Określa się ją przez pomiar największej różnicy temperatury, jaką mogą
wytrzymać — nie pękając — próbki szkła. W odróżnieniu od innych właściwości cieplnych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
odporność termiczna szkła jest charakterystyką szkła zależną od intensywności przekazywania
ciepła na powierzchni szkła, jakości tej powierzchni oraz od wymiarów geometrycznych.
Dlatego też rozróżnia się odporność termiczną szkła jako tworzywa określaną na
znormalizowanych próbkach oraz odporność termiczną wyrobu szklanego określaną na
gotowych wyrobach.
Chemiczną odpornością nazywa się zdolność do przeciwstawienia się szkła niszczącemu
działaniu środków chemicznych. Szkło, w porównaniu z innymi materiałami, odznacza się
dużą odpornością na wpływy atmosferyczne i na działanie substancji chemicznych. Ze
względów praktycznych odporność na działanie wody ma największe znaczenie.
Należy rozróżniać dwa sposoby oddziaływania wody na szkło: w postaci wilgotnej atmosfery
i ciekłej wody. Mechanizm niszczenia szkła przez wilgotną atmosferę zaczyna się od
zaadsorbowania na powierzchni szkła cząsteczek wody. Zaadsorbowana woda wiąże się
strukturalnie ze szkłem i w postaci grup OH pokrywa jego powierzchnię. Te grupy powodują
dalszą sorpcję (wchłanianie) wody i powstanie warstewki wody.
Proces wchłaniania wody przez szkło jest zależy od składu chemicznego danego szkła,
procesów obróbki cieplnej, sposobu formowania, wpływu środków przyspieszających lub
obniżających topienie.
Niszczenie szkła roztworami kwasów następuje na zasadzie wypierania kwasu krzemowego
z krzemianów kwasami silniejszymi. Powstający kwas krzemowy szybko polimeryzuje
i koaguluje do postaci żelu, przedostając się do roztworu tylko w małych ilościach. Metale
natomiast prawie całkowicie przechodzą do roztworu i w ten sposób szkło pokrywa się
warstewką krzemionki.
Na odporność chemiczną na działanie kwasów wpływają te same czynniki i w takim
samym kierunku jak w przypadku higroskopijności szkła. Zwiększenie stężenia kwasów do
wartości pH = 1,5 powoduje intensyfikację niszczenia szkła. Dalszy wzrost stężenia kwasu
powoduje zahamowanie reakcji, a według niektórych danych w bardzo stężonych kwasach
ustaje całkowicie ich działanie niszczące.
Odporność na działanie zasad
Ługi działają na szkła przemysłowe na ogół około 100 razy silniej niż kwasy, gdyż
powodują przejście żelu krzemionkowego z powierzchni szkła do roztworu koloidalnego.
Silniejszy niż w przypadku działania kwasów rozkład szkła tłumaczy się tym, że na szkle nie
mogą wytworzyć warstewki ochronne.
Zniszczenie struktury szkła (wiązań Si-O-Si) gra decydującą rolę przy działaniu
roztworów alkalicznych (zasadowych) na zwykłe szkła przemysłowe. Charakterystyczną
cechą oddziaływania zasad na szkło, podobnie jak kwasu fluorowodorowego i fosforowego,
jest rozpuszczanie warstw powierzchniowych całkowicie, przy czym prędkość rozpuszczania
jest stała, a grubość strawianej warstwy jest proporcjonalna do czasu oddziaływania roztworu.
Odporność na wietrzenie
Wietrzenie jest to proces chemicznych zmian na szkle spowodowany działaniem wody
lub pary wodnej oraz gazów zawartych w atmosferze, głównie CO
2
i SO
2
. W przypadku szkła
skutki wietrzenia występują początkowo w postaci cienkiej, iryzującej (powodującej tęczowe
odblaski) warstewki, później – opalescencji, białego nalotu, galaretowatego osadu na
powierzchni, a na koniec – łusek. Początkowe stadia wietrzenia można obserwować na
starych oszkleniach, a stadia końcowe – na szkłach starożytnych, w muzeach.
Występowanie galaretowatego osadu lub łusek świadczy o tym, iż proces korozji posunął
się już daleko w głąb szkła.
Znaczenie przemysłowe odporności szkła na wietrzenie jest oczywiście bardzo duże dla
właściwego transportu, przechowywania i użytkowania
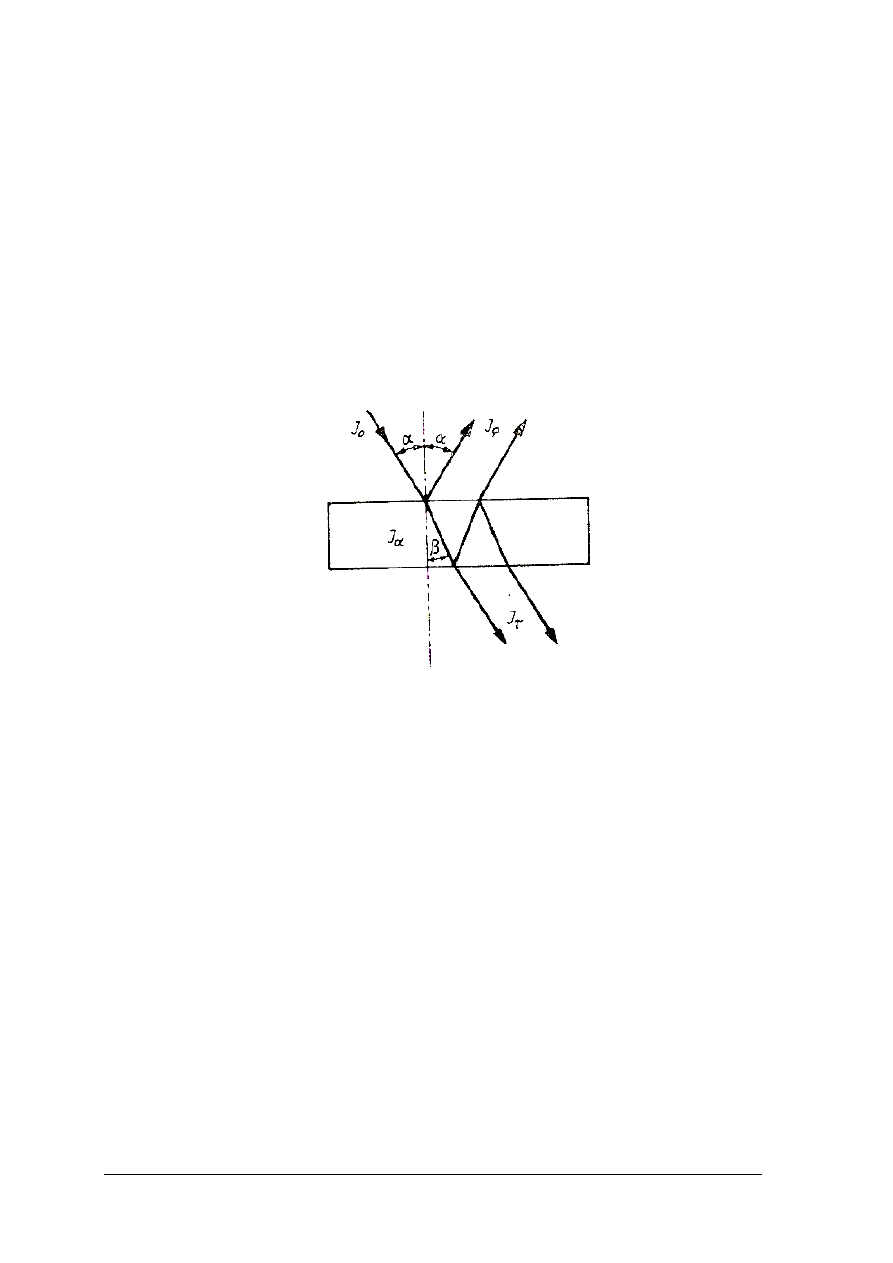
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
szkła. Na przykład wytworzony wilgotny osad może stać się spoiwem między płytami szkła,
co powoduje zlepianie się płyt szkła przechowywanego: 1) w wilgoci, 2) w temperaturze
niższej od temperatury napływającego z zewnątrz powietrza (wykraplanie się wilgoci),
3) w nieodpowiednim (higroskopijnym lub alkalicznym) papierze.
Właściwości optyczne
Przy oddziaływaniu promieniowania elektromagnetycznego (świetlnego) na szkło
zachodzą zjawiska, które ujawniają pewne cechy szkła określane jako właściwości optyczne.
Jeżeli strumień promieniowania monochromatycznego o określonym natężeniu światła,
pada na wypolerowaną płytkę szklaną, to ulega następującym zmianom:
–
część strumienia odbije się, (Iρ)
–
część zostanie pochłonięta, (Iά)
–
część przejdzie przez szkło (Iτ).
A zatem Io = Iρ + Iά + Iτ
Rys. 10. Przepuszczalność, załamanie i odbicie światła na powierzchni granicznej szkło-powietrze. [8,s.112]
Każdy z tych współczynników zależy od długości fali. Współczynnik odbicia zależy od
kata padania wiązki świtała. Im większy jest kąt padania, tym większy jest współczynnik
odbicia.
Przepuszczalność i absorpcja (pochłanianie) promieniowania, a więc i gęstość optyczna
zależą od długości fali promieniowania. Dlatego rozróżnia się wartości tych współczynników
podawane dla danej długości fali (wartości widmowe) i wartości sumaryczne obejmujące cały
zakres promieniowania np. części widzialnej.
W przypadku gdy powierzchnia szkła nie jest gładka lub szkło jest optycznie
niejednorodne, następuje rozproszone (dyfuzyjne) odbicie lub przepuszczenie światła. Z tymi
zjawiskami związane są pojęcia matowości i blasku szkła (z rozproszonym odbiciem) oraz
zamącenia szkła (z dyfuzyjnym przepuszczaniem światła).
Wpływ składu chemicznego szkła na odbicie, pochłanianie i przepuszczanie światła jest
zróżnicowany. Odbicie światła zależy przede wszystkim od współczynnika załamania światła,
a zatem te pierwiastki, które podwyższają współczynnik załamania, zwiększają także
współczynnik odbicia.
Przepuszczalność i pochłanianie światła w mniejszym stopniu zależą od składu
podstawowego szkła. Duży wpływ na te wielkości mają pierwiastki barwiące, których
niewielka zawartość w istotny sposób wpływa na wartość współczynnika pochłaniania,
przepuszczalności i gęstości optycznej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
Właściwości mechaniczne
Wytrzymałością
mechaniczną
szkła
nazywa
się przeciwstawianie się szkła
mechanicznemu zniszczeniu. W zależności od rodzaju niszczących sił rozróżnia się
wytrzymałość szkła na rozrywanie, ściskanie, zginanie i uderzenie.
Wytrzymałość szkła zależy od stanu jego powierzchni, składu chemicznego, stopnia
odprężenia, jednorodności, wymiaru badanych próbek, środowiska i temperatury.
W procesie produkcyjnym pogorszenie jednorodności bardzo obniża wytrzymałość szkła.
W obszarze szkła zawierającym nici i inne wtrącenia powstają dodatkowe naprężenia, które
stają się ogniskiem zniszczenia materiału. Szczególnie niekorzystne są nici znajdujące się
w stanie rozciągania i rozmieszczone przy powierzchni wyrobu lub w jej pobliżu. Podobne
oddziaływanie wykazują także inne wady szkła i wady powierzchni. Spękania wewnętrzne,
zarodki krystaliczne, obce ciała („kamienie"), pęcherze i pęcherzyki, niejednorodność
chemiczna i termiczna szkła powodują zakłócenia w wytrzymałości wyrobu.
Działanie na powierzchnię szkła czynników atmosferycznych powoduje zmniejszenie
wytrzymałości ok. 20% w porównaniu z wytrzymałością szkła w powietrzu suchym.
Na wytrzymałość wpływa nie tylko intensywność, ale i czas działania czynników
zewnętrznych na powierzchnię szkła, dlatego wytrzymałość szkła przechowywanego
w normalnych warunkach atmosferycznych maleje z upływem czasu.
Metody badania właściwości szkła
Badanie którejkolwiek z właściwości szkła jest czynnością wymagającą dużej precyzji od
pracownika, a czasami nawet wielokrotnego powtarzania metod badań.
Do pomiaru właściwości szkła służą odpowiednie urządzenia, po wstępnym
i odpowiednim przygotowaniu próbek do określonych badań.
W przypadku badania próbek szkła określonego rodzaju szkła wykrajamy odpowiedniej
wielkości, masy i kształtu skrawek lub w zależności od metody badania – odpowiednio
skrawek rozdrabniamy na granulat, nadając mu odpowiednie uziarnienie. Jeśli do urządzenia
pomiarowego ma być przygotowany odpowiedni kawałek szkła, myjemy go i usuwamy
z niego wszelkie zanieczyszczenia. Czynnością dodatkową może być polerowanie kawałka
szkła przed badaniem lub przetrzymanie go w odpowiedniej mieszaninie roztworowej, celem
uzyskania pożądanych cech szkła. Tak przygotowane szkło poddajemy badaniu
w laboratorium.
Na ogół opisy czynności przygotowawczych i określonych badań są zawarte
w dokumentacji technicznej, zwanej normą branżową lub polską normą z odpowiednim
oznaczeniem cyfrowym.
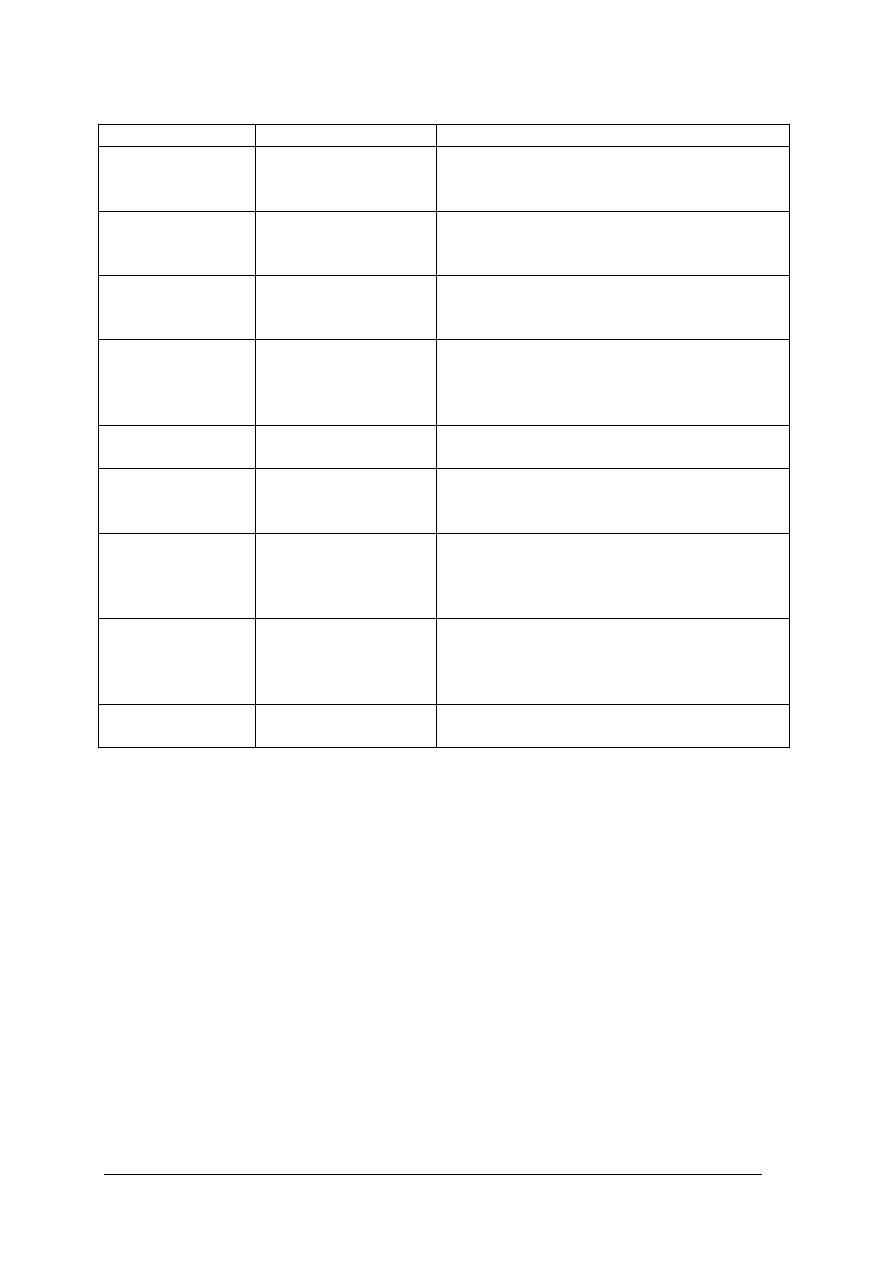
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
47
Tabela 5. Metody badania właściwości szkła, urządzenia oraz sprzęt potrzebny do przeprowadzenia badań
Rodzaj badania
Sprzęt, urządzenia
Opis
Badanie lepkości
Mikroskop
wysokotemperaturowy
Określanie temperatur na podstawie zdjęć
fotograficznych
wykonanych
podczas
ogrzewania próbki szkła
Pomiar
małych
lepkości (10
2
–10
5
dPas)
Wiskozymetr
rotacyjny
Pomiary oporu, jaki stawia masa szklana
podczas mieszania
Pomiar
dużych
lepkości (10
7
–10
17
dPas)
Wiskozymetr
Pomiar
prędkości
deformacji
próbek
o określonych wymiarach Przy działaniu siły
rozciągającej, ściskającej, skręcającej
Pomiar
tempetarury
mięknięcia
szkła
wg Littletona
Piec nagrzewający
Wyznaczenie temperatury mięknięcia szkła
Badanie zdolności
do krystalizacji
Piec gradientowy
Wyznaczanie temperatury krystalizacji szkła,
określenie zdolności szkła do krystalizacji
Badanie
właściwości
optycznych
Polaryskopy
Pomiar różnicy dróg optycznych w szkle
Odporność
chemiczna
Np.
suszarka,
wytrząsarka
Oznaczenia związków, np. odporność na
działanie kwasów, zasad, następuje zgodnie z
odpowiednimi
metodami
opisanymi
w normach
Odporność
mechaniczna
Np. nacisk na szkło
lub uderzenia młotem
Wyznaczanie odporności mechanicznej szkła,
np. badanie na ściskanie, zginanie, rozciąganie
–
następuje
zgodnie
z
odpowiednimi
metodami opisanymi w normach
Odporność
termiczna
Piec
Badanie odporności szkła na nagłe zmiany
temperatury
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jak zdefiniujesz lepkość szkła?
2.
Jak scharakteryzujesz średnią temperaturę deformacji na krzywej lepkości?
3.
Jak zdefiniujesz pojęcie krystalizacji?
4.
Jak zdefiniujesz napięcie powierzchniowe szkieł?
5.
Na jakie cechy szkła wpływ ma napięcie powierzchniowe?
6.
Jak zdefiniujesz pojecie odporności termicznej szkła?
10. Jakie czynniki mają wpływ na właściwości płynnej masy szklanej?
11. Jakie czynniki mają wpływ na zmianę właściwości szkła?
12. Jak zdefiniujesz proces wietrzenia szkieł?
13. Jak są sposoby pobierania próbek szkła do badań laboratoryjnych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
48
4.3.3. Ćwiczenia
Ćwiczenie 1
Przygotuj próbkę szkła do badania odporności hydrolitycznej szkła.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odebrać od nauczyciela materiał szkła do pobrania próbki, potrzebny sprzęt oraz inne
materiały do wykonania ćwiczenia, instrukcję poboru próbki, instrukcję stanowiskową
bhp,
2) zapoznać się z instrukcją do wykonania ćwiczenia,
3) założyć środki ochrony osobistej,
4) wykonać ćwiczenie.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
ś
rodki ochrony osobistej – instrukcja do wykonania ćwiczenia,
−
norma branżowa,
−
sprzęt, materiały,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Wykonaj badanie wytrzymałości szkła na ściskanie zgodnie z normą PN-66/S-13062.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odebrać od nauczyciela materiał – szkło, instrukcję ćwiczeniową, instrukcję sprzętu,
instrukcję stanowiskową bhp, normę,
2) zapoznać się z instrukcją do wykonania ćwiczenia,
3) założyć środki ochrony osobistej,
4) wykonać ćwiczenie,
5) dokonać obliczeń.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
ś
rodki ochrony osobistej
−
norma branżowa,
−
sprzęt, materiały,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
49
Ćwiczenie 3
Z pośród przygotowanych przez nauczyciela przyrządów i aparatury do oznaczania
odporności ziaren szkła na działanie wody zgodnie z polską normą PN-83/B-13162 dobierz
według punktu 2.2 tejże normy trzy przyrządy potrzebne do wykonania oznaczenia. Wybór
swój uzasadnij zgodnie z punktem normy.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) zapoznać się z polską normą,
2) przeczytać pkt według którego należy wykonać zadanie,
3) sporządzić wypis aparatury i przyrządów potrzebnych do wykonania oznaczenia,
4) wybrać dostępną aparaturę,
5) uzasadnić wybór aparatury.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
norma branżowa,
−
aparatura i przyrządy,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
zdefiniować pojęcie lepkości szkła?
2)
scharakteryzować średnią temperaturę deformacji na krzywej
lepkości?
3)
zdefiniować pojęcie krystalizacji?
4)
zdefiniować pojęcie napięcia powierzchniowego szkła?
5)
wymienić czynniki mające wpływ na właściwości płynnej masy
szklanej?
6)
zdefiniować odporność termiczną szkieł?
7)
określić czynniki mające wpływ na właściwości płynnej masy
szklanej?
8)
wymienić czynniki wpływające na zmianę właściwości szkieł?
9)
określić sposoby pobierania próbek szkła do badań?
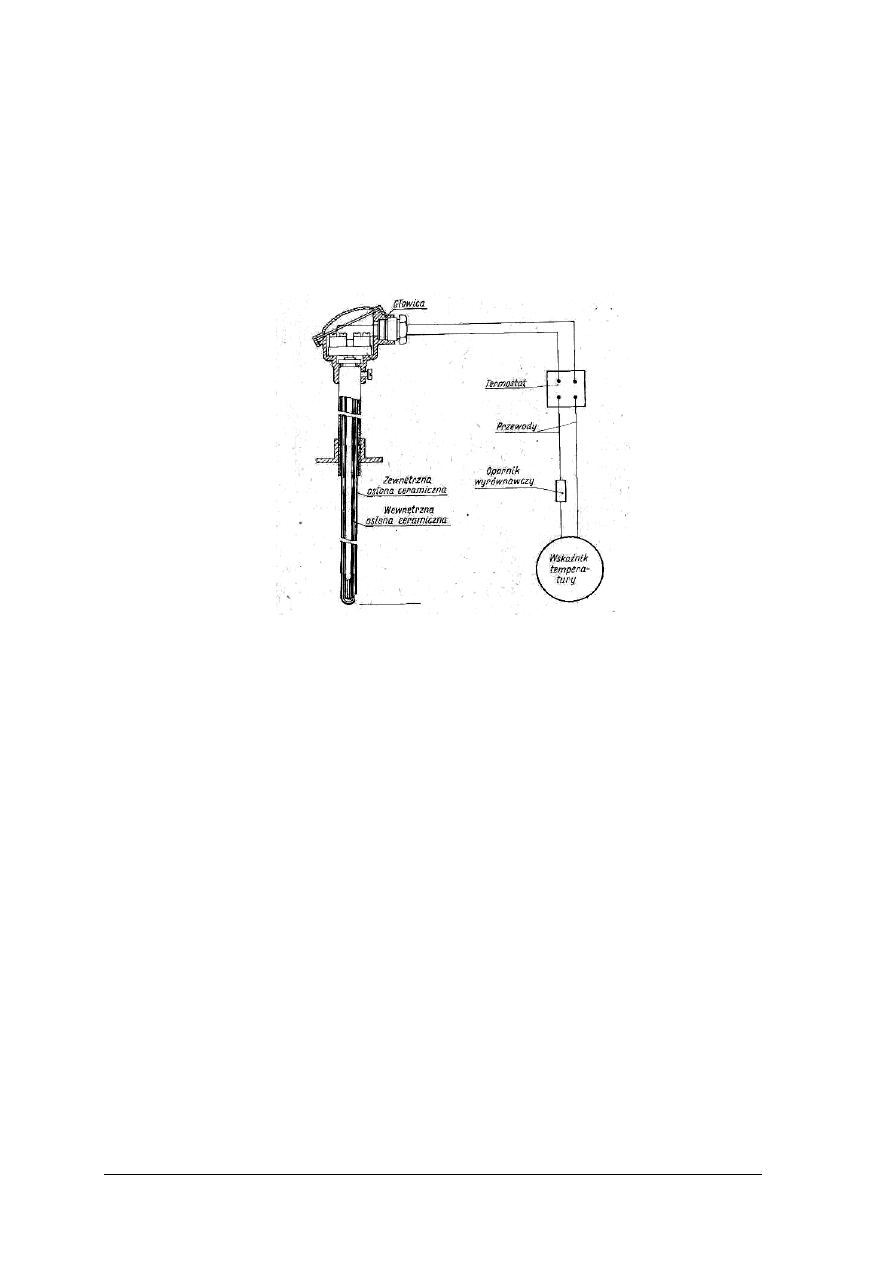
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
50
4.4.
Pomiar wielkości niezbędnych do topienia masy
4.4.1. Materiał nauczania
Pomiary temperatury
W przemyśle szklarskim używa się do pomiaru temperatury przeważnie termometrów
termoelektrycznych, pirometrów monochromatycznych lub promieniowania całkowitego oraz
termometrów oporowych.
Rys. 11. Schemat termometru termoelektrycznego [3, s. 220]
Termometr termoelektryczny składa się z:
−
termoelementu (termopary) złożonego z dwóch drutów, różnych metali dobranych
odpowiednio, których końce z jednej strony są spojone,
−
osłony chroniącej termoelement przed zbyt szybkim zniszczeniem,
−
przewodów łączących termoelement z miliwoltomierzem,
−
miliwoltomierza.
Działanie tego urządzenia jest następujące: jeżeli miejsce spojenia drutów ogrzejemy do
jakiej koi wiek temperatury T
1;
zaś końce niespojone i izolowane wzajemnie (końce zimne)
będą pozostawać w temperaturze T
2
(w pracach laboratoryjnych w termosie z lodem,
w warunkach zaś przemysłowych w temperaturze otoczenia), to na końcach obu drutów
niespojonych powstanie pewne napięcie elektryczne, którego wartość zależy od różnicy
wartości temperatury T
1
– T
2
. Wartość tego napięcia jest różna dla różnych rodzajów drutów.
Mierzy się ją właśnie za pomocą przyrządu pomiarowego, zwanego miliwoltomierzem,
wyskalowanego bezpośrednio w stopniach temperatury (°C lub K).
W przemyśle szklarskim stosuje się przeważnie następujące rodzaje termoelementów:
−
platynarod (PtRh) i platyna (Pt) – oznaczenie PtRh-Pt,
−
nikielchrom (NiCr) i nikiel (Ni) – oznaczenie NiCr-Ni,
−
ż
elazo (Fe) i konstantan (Konst.) – oznaczenie Fe-Konst.
Do izolacji poszczególnych drutów w wymienionych termoelementach używa się rurek
porcelanowych, szamotowych lub sznurka azbestowego, którym okręca się ściśle druty, zwój
koło zwoju. Termoelementy umieszcza się w rurach osłonowych z mas ogniotrwałych lub
stalowych, które osłaniają druty przed działaniem utleniającym płomienia w piecu

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
51
i zwiększają trwałość termoelementu, ale równocześnie zwiększają jego bezwładność cieplną
powodującą, że termoelement reaguje na zmiany temperatury z pewnym opóźnieniem, na co
należy zwrócić uwagę w czasie dokonywania pomiarów.
Termoelementy przeznaczone do pomiaru temperatury masy szklanej mają osłonę
zewnętrzną z platyny. Rurka osłonowa zakończona jest głowicą termoelementu; jest to
metalowe pudełko z krążkiem izolacyjnym i dwoma zaciskami, do którego z jednej strony
dołączone są druty termopary, a z drugiej – przewody prowadzące do miliwoltomierza.
Nawet drobne zmiany charakterystyki termoelementu są powodem poważnych błędów
w pomiarach. Dlatego konieczne jest okresowe sprawdzanie prawidłowości działania
termoelementu. Przyczyną zmian charakterystyk termoelmentow jest starzenie się materiału
oraz szkodliwe działanie ośrodka, w którym wykonuje się pomiary.
Ponieważ podstawowym elementem pomiarowym jest spojenie drutów, termoelement
powinien być montowany w ten sposób w piecu, aby spojenie mogło osiągnąć temperaturę
mierzonego ośrodka. Do pomiaru temperatury masy szklanej najlepiej jest stosować
zanurzenie końca termopary na głębokość 50 mm, a do pomiarów w przewodach gazowych
należy stosować zasadę przeciwkierunku, czyli termopara powinna być umieszczona pod
kątem w kierunku przepływu lub wprost w przeciwnym kierunku przepływu gazu.
Zaletami termoelementów są:
−
szeroki zakres stosowania,
−
możliwość uzyskania dużej dokładności,
−
możliwość pomiarów punktowych i pomiarów zdalnych,
−
możliwość rejestracji,
−
zastosowanie do układów regulacji,
−
trwałość i łatwość odtwarzania charakterystyk.
Do wad należą:
−
bezwładność cieplna przy stosowaniu osłon,
−
wrażliwość mierników na wstrząsy mechaniczne i działanie pola magnetycznego.
Termoelementy dzięki swoim zaletom znalazły bardzo szerokie zastosowanie
w przemyśle do pomiaru temperatury. Jednak w temperaturach niskich są one mało czułe.
Pirometry optyczne (termometry promieniowe) można podzielić na dwie zasadnicze
grupy:
−
pirometry wybiorczego promieniowania (monochromatyczne),
−
pirometry całkowitego promieniowania (ardometry).
Pirometr monochromatyczny – zasada jego działania opiera się na zjawisku
promieniowania przez ciała rozgrzane do wysokiej temperatury. Natężenie promieniowania
monochromatycznego ciała doskonale czarnego zależy od jego temperatury (prawo Plancka).
Pomiaru natężenia promieniowania ciała dokonuje się przez porównanie jasności tego ciała
z jasnością rozżarzonego włókna wolframowego żarówki w zakresie długości fal 0,65
mikrometra (barwa czerwona).
Rys. 12. Schemat pirometru optycznego monochromatycznego: 1) okular, 2) obiektyw,
3) żarówka, 4) opornik, 5) układ optyczny, 6) filtr czerwony [3, s. 224]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
52
Pirometr ten składa się z lunety, w której osadzone są okular 1 i obiektyw 2. Do lunety
wmontowana jest żarówka 3 połączona z baterią przez opornik 4, którym reguluje się
natężenie prądu doprowadzanego o żarówki, a więc i jej stopień żarzenia (jasność włókna).
W obwód żarówki wmontowany jest amperomierz wyskalowany w °C lub K. Układ optyczny
5 służy do regulowania ostrości obrazu przedmiotu mierzonego i włókna żarówki. Pomiędzy
okiem obserwatora a żarówką umieszczony jest filtr czerwony 6.
Dokonanie pomiaru temperatury w piecu polega na nastawieniu lunety na wnętrze pieca
przez otwór pomiarowy umieszczony zwykle w ścianie bocznej pieca. Najpierw należy za
pomocą okulara nastawić ostrość rozżarzonego włókna żarówki. Następnie porównuje się
jasność rozżarzonej nitki żarówki z jasnością promieniowania wnętrza pieca przez zmianę
oporu w oporniku. Po zrównaniu jasności pola z jasnością włókna odczytuje się na
amperomierzu wynik pomiaru. Lunetę należy kierować albo na ścianę przeciwną pieca, albo
na lustro masy szklanej.
Najlepiej jest wykonywać dwa pomiary, jeden zaczynając od temperatury wyższej niż
mierzona, drugi natomiast od temperatury niższej niż mierzona i następnie porównać oba
wyniki.
Do zalet pirometrów monochromatycznych należą:
−
duża dokładność pomiaru,
−
duży zakres pomiaru temperatury obejmujący 1000–2300 K.
Do wad zalicza się:
−
niemożliwość wykonywania pomiarów ciągłych, a więc stosowania rejestracji wyników,
−
subiektywne ocenianie temperatury,
−
konieczność stosowania źródła prądu stałego (baterii).
Najczęściej są one używane dla sprawdzania wyników, oznaczonych za pomocą termopar
lub innych przyrządów. Należy jednak wspomnieć o pirometrach fotoelektrycznych, mających
zalety pirometrów monochromatycznych, lecz nie mających ich wad. Są to jednak przyrządy
bardzo drogie i dlatego rzadko stosowane.
Pirometry całkowitego promieniowania – ardometry
Są to przyrządy działające na zasadzie pomiaru energii całkowitej, wysyłanej przez
rozżarzone ciało.
Rys. 13. Schemat areometru 1) soczewka, 2) termopara [3, s. 227]
Promieniowanie z pieca kierowane jest przez soczewkę z fluorytu 1 na umieszczoną
w próżni bardzo czułą termoparę 2, której gorące końce są umieszczone w ognisku soczewki.
Gorące końce (spojenie) powleka się warstwą sadzy. Termopara jest połączona
z galwanometrem-miliwoltomierzem, który pozwala na odczytywanie mierzonej temperatury.
Przy stosowaniu ardometrów ważne jest takie ustawienie przyrządu, aby gorące końce
termopary znajdowały się w środku obrazu badanego ciała. Stosunek powierzchni ciała
badanego do odległości pirometru od tego ciała określony jest dla każdego typu ardometru
i wynosi przeważnie 1:20 i 1:25. Ponieważ odległość ardometru od ciała badanego wynosi
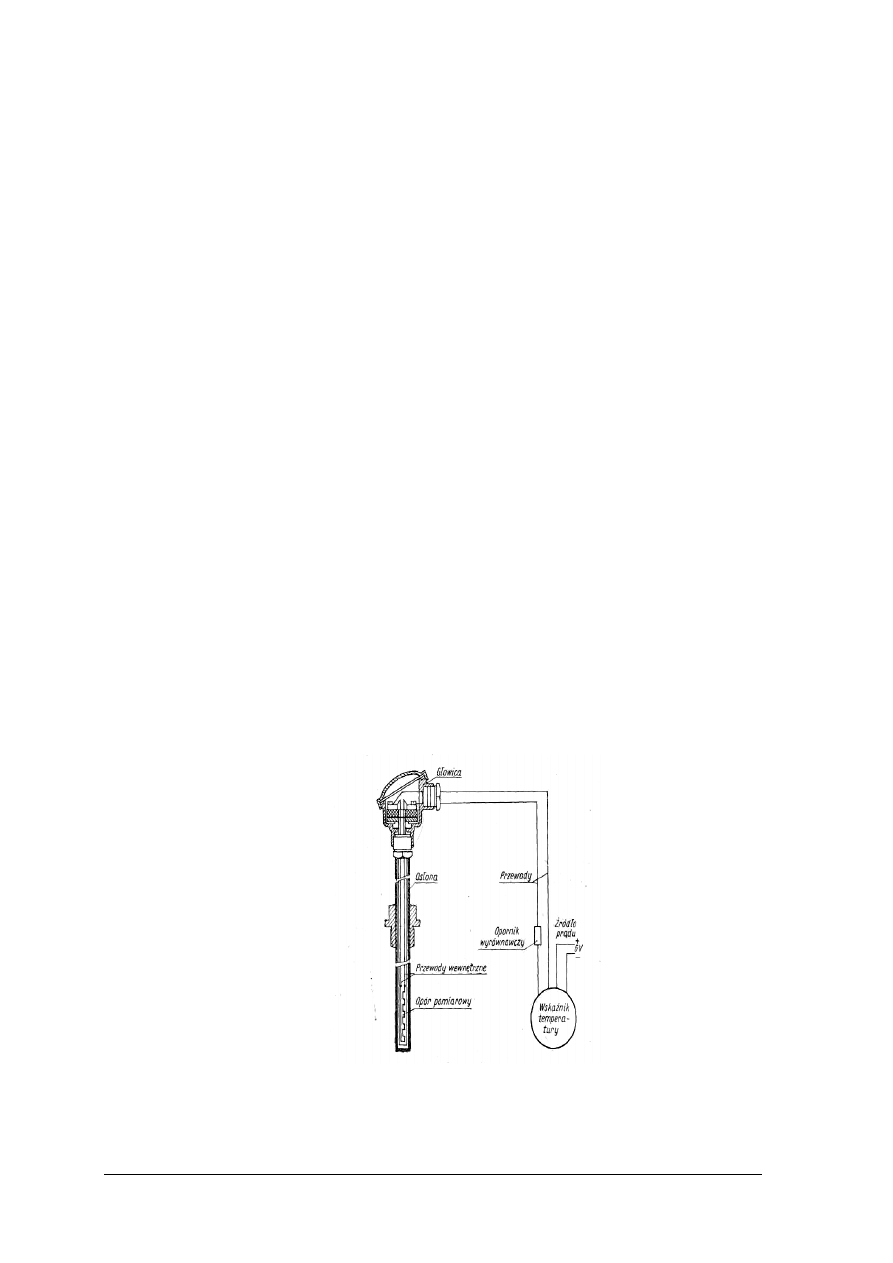
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
53
przeważnie powyżej 1 m i ardometr mocno się nagrzewa, w ardometr wmontowany jest opór
kompensujący temperaturę przyrządu. Przy ciągłym pomiarze temperatury w piecu ardometr
silnie nagrzewa się, jego temperatura może wynosić powyżej 325 K i dlatego powinien on być
chłodzony wodą lub powietrzem.
Ardometry wykazują zalety wynikające z zastosowania termoelementu, lecz nie mają tej
dokładności co termoelementy. Wady ardometrów są następujące:
−
niemożliwość pomiaru temperatury małych ciał,
−
zależność wskazań od zanieczyszczenia powietrza,
−
niemożliwość pomiaru temperatury gazów,
−
mała dokładność wynikająca z niemożliwości stosowania poprawki na stopień czarności
ciała badanego.
Ardometry stosowane są wtedy, gdy wysoka temperatura lub korodujące działanie
ośrodka uniemożliwiają zastosowanie termoelementu, a pomiar ciągły jest konieczny
i wówczas,
gdy
wymagana
dokładność
nie
zmusza
do
stosowania
pirometru
monochromatycznego. Ardometry często stosuje się do pomiaru temperatury w części
topienia pieca wannowego ze względu na przepalanie się termoelementów w tej części pieca,
a zapis ciągły jest tutaj pożądany. Wskazania ardometrów kontroluje się przez okresowe
wykonywanie
pomiarów
sprawdzających
za
pomocą
przenośnego
pirometru
monochromatycznego.
Termometry oporowe
Działanie termometrów oporowych polega na zjawisku zmiany oporności elektrycznej
przewodnika metalowego w zależności od temperatury. Charaktery styczne dane dotyczące
zależności oporności od temperatury dla wielu metali są znane z dużą dokładnością, a więc
z przyrostu oporności danego odcinka przewodu można określić, jaki jest przyrost jego
temperatury, jeżeli oporność przewodnika zmienia się liniowo wraz ze zmianą temperatury.
W przemyśle stosuje się do pomiaru temperatury termometry oporowe wykonane z drutu
platynowego i niklowego.
Termometr platynowy służy do pomiaru temperatury w zakresie od 75 do 825 K, a niklowy
w zakresie od 225 do 425 K.
Rys. 14. Schemat termometru oporowego [3, s. 228]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
54
Zalety termometrów oporowych:
−
duża dokładność pomiarów,
−
możliwość ciągłego prowadzenia pomiarów,
−
możliwość pomiarów zdalnych i zastosowania rejestratorów,
−
możliwość zastosowania jednego miernika do kilku przyrządów.
Wady termometrów oporowych:
−
konieczność zastosowania źródła prądu,
−
wrażliwość miernika na wstrząsy i drgania.
Pomiary ciśnienia gazów w piecu
W praktyce przemysłowej mierzy się ciśnienie względne, czyli nadwyżkę ciśnienia
w stosunku do ciśnienia atmosferycznego. Przyrządy służące do pomiaru ciśnienia można
podzielić na dwie zasadnicze grupy:
Cieczowe – hydrostatyczne, w których miarą ciśnienia jest przemieszczenie względem
układu cieczy manometrycznej;
Sprężynowe – mechaniczne, w których miarą ciśnienia jest odkształcenie sprężyste
elementu wykonanego z metalu lub z innego materiału sprężystego.
Są jeszcze inne przyrządy, jak tłokowe, elektryczne i złożone, lecz mają one mniejsze
zastosowanie.
Ze względu na rodzaj ciśnienia mówi się o manometrach do pomiaru ciśnień wyższych
od atmosferycznego oraz o wakuometrach, inaczej zwanych ciągomierzami do pomiaru
ciśnień niższych niż atmosferyczne.
Niektóre manometry mają swoje specjalne nazwy, jak barometr, mikromanometr i inne,
zależnie od przeznaczenia.
Manometry cieczowe – hydrostatyczne
Działanie tych manometrów oparte jest na pomiarze przemieszczania się poziomów
cieczy w naczyniach połączonych. Przemieszczenia te zachodzą samoczynnie wskutek
procesu ustalania się równowagi hydrostatycznej pomiędzy mierzonym ciśnieniem,
a przeciwważnym ciśnieniem słupa cieczy manometrycznej.
U-rurka
Manometr ten składa się z dwóch pionowych naczyń w kształcie rurek jednakowej
ś
rednicy wewnętrznej, połączonych u dołu i napełnionych do połowy cieczą manometryczną.
Jeżeli nie chodzi o dużą dokładność, może to być zwykła rurka szklana wygięta w kształcie
litery U.
Rys. 15. Schemat manometru w postaci U-rurki [3, s. 231]
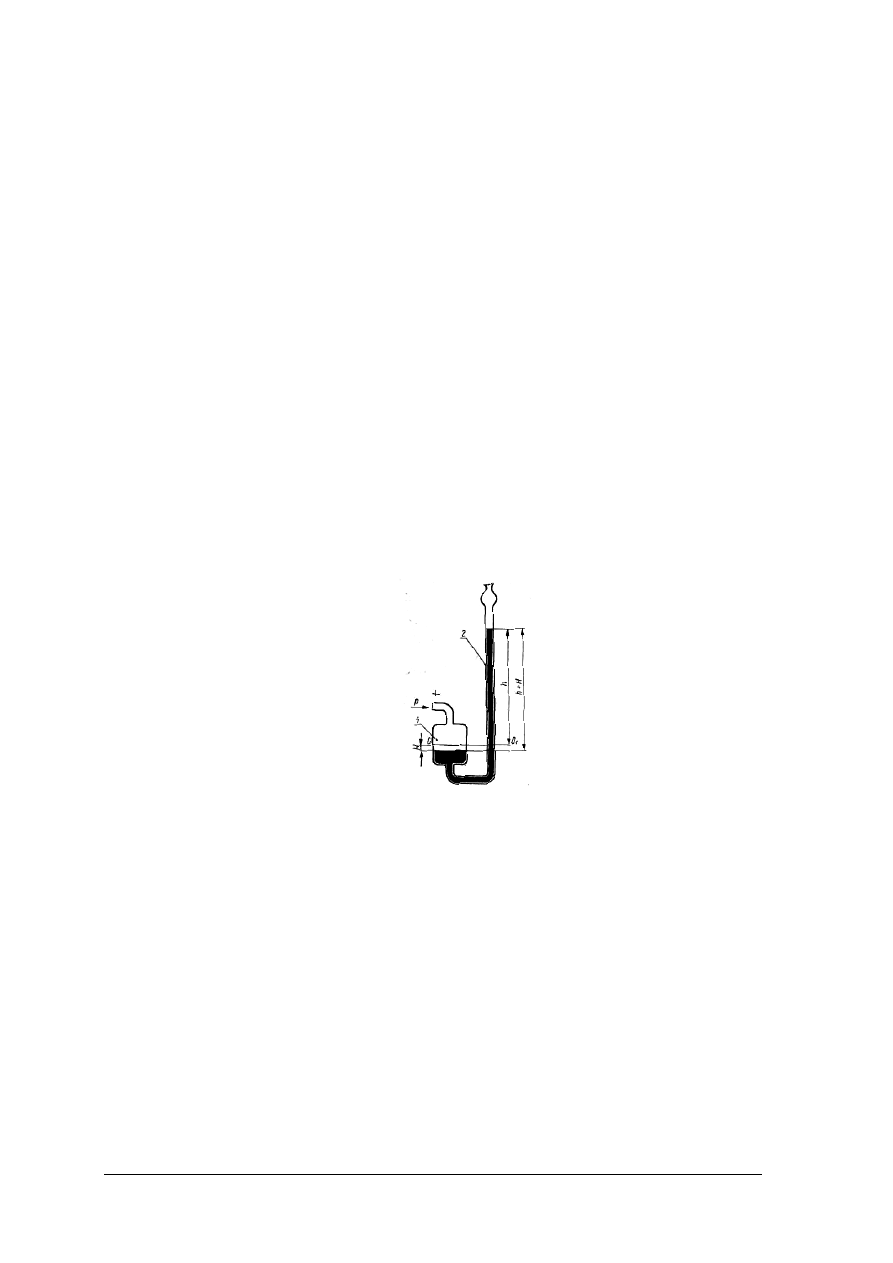
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
55
Można też dwie rurki szklane połączyć u dołu wężem gumowym lub przewodem
metalowym.
Podziałka zerowa U-rurki zwykle jest umieszczona na połowie wysokości rurek. Dopóki
ciśnienie nad cieczą manometryczną w obu naczyniach jest równe, meniski (poziomy cieczy)
znajdują się na poziomie tej kresy. Jeżeli połączymy górną część jednej z rurek z przestrzenią,
w której panuje inne ciśnienie niż atmosferyczne (górna część drugiej rurki jest połączona
z atmosferą), poziom cieczy w naczyniach zmieni się. Poziom w rurce połączonej z wyższym
ciśnieniem niż atmosferyczne opadnie, w rurce zaś połączonej z atmosferą poziom cieczy
podniesie się. Powstanie różnica poziomów cieczy w rurkach, która zrównoważy różnicę
ciśnienia mierzonego i atmosferycznego. Jeżeli przekroje obu rurek są równe, przyrost lub
ubytek wysokości (h) w pierwszej i drugiej rurce są równe. W U-rurce należy odczytywać
poziom cieczy w obu rurkach – w prawej i w lewej – przemieszczenia bowiem ich menisków
od położenia zerowego różnią się, a to wskutek wahań w przekroju rurki.
Wygodniejszy w użyciu jest manometr jednokierunkowy lub naczyniowy, ponieważ
poziom cieczy odczytuje się tylko w jednym węższym naczyniu – rurce szklanej 2. Drugie
naczynie 1, kilkadziesiąt razy szersze, może być metalowe. Szersze naczynie łączy się górą
z większym ciśnieniem, węższe z mniejszym. Wskutek tego część cieczy z szerszego
naczynia przeleje się do naczynia węższego i poziom cieczy w węższym naczyniu podniesie
się. Obniżenia się cieczy w naczyniu szerszym zazwyczaj nie widzimy i mierzyć nie musimy,
toteż w podziałkę zaopatruje się tylko węższe naczynie. Manometr ten wymaga jednak
okresowego sprawdzania położenia zerowego, gdyż ubytek cieczy manometrycznej wskutek
parowania powoduje błędy pomiarowe.
Rys. 16.
Schemat manometru naczyniowego [3, s. 232]
Manometry hydrostatyczne mogą być stosowane w dwojakim charakterze:
−
jako manometry do mierzenia nadciśnienia,
−
jako wakuometry do mierzenia podciśnienia.
Obszar mierniczy manometrów hydrostatycznych, stosowanych bezpośrednio w ruchu,
zazwyczaj nie przekracza 3000 Pa, gdyż długi manometr jest niewygodny w obsłudze,
a ponadto utrzymanie stałej temperatury na całej długości słupa cieczy nie jest łatwe.
Manometry cieczowe z podziałką wykonaną na pasku metalu lub na desce drewnianej
dają dokładność odczytów od 0,5 do 1 mm. Większą dokładność dają podziałki lustrzane.
Błąd odczytania wynosi 1 mm, co można tolerować, gdy ciśnienia mierzone nie są małe.
W czasie pomiarów ciśnień małych, na przykład 100 Pa (ok. 10 mm H
2
O), błąd odczytania 1
mm stanowiłby już pokaźny-procent. Staramy się wtedy zwiększyć dokładność przez
stosowanie manometrów z rurką pochyłą.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
56
Rys. 17. Manometr Krella z rurką pochyłą [3, s. 233]
Manometr ten jest jednokierunkowy; drugie naczynie (zwykle połączone) ma większy
przekrój, aby zapewnić cieczy w wąskiej rurce pochyłej większe przemieszczenie.
Wadą tych przyrządów jest konieczność okresowego uzupełniania cieczy, uwzględniania
dla dokładnych pomiarów zmian ciężaru właściwego cieczy w zależności od temperatury
niemożliwości rejestracji wskazań. Jednak ze względu na prostotę budowy, dosyć dużą
dokładność oraz możliwość stosowania do pomiarów nad- i podciśnienia lub różnicy ciśnień,
manometry te są szeroko stosowane.
Manometr dzwonowy
Jest wyposażony w lekki dzwon zanurzony w zbiorniku z cieczą manometryczną.
Rys. 18. Manometr dzwonowy [3, s. 234]
Dzwon w odróżnieniu jest otwarty u dołu i ma zanurzenie zmienne. Przestrzeń pod
dzwonem jest połączona z przestrzenią, w której mierzy się ciśnienie. Jeżeli ciśnienie to
wzrasta, dzwon wynurza się tak długo aż osiągnięty zostanie stan równowagi pomiędzy
zmniejszonym wyporem dzwonu a ciśnieniem działającym na wewnętrzną powierzchnię
przekroju dzwonu. Obecnie budowane manometry dzwonowe są zaopatrzone w odpowiednie
przeciwciężary uchylne w celu zmniejszenia wymiarów przyrządu. Ruchy dzwonu mogą być
przenoszone na układ wskazujący lub rejestrujący. Należy jednak pamiętać, że w manometrze
dzwonowym decydujący wpływ na dokładność wskazań ma ciężar właściwy cieczy
manometrycznej. Dokładność wskazań manometrów dzwonowych wynosi około 2%.
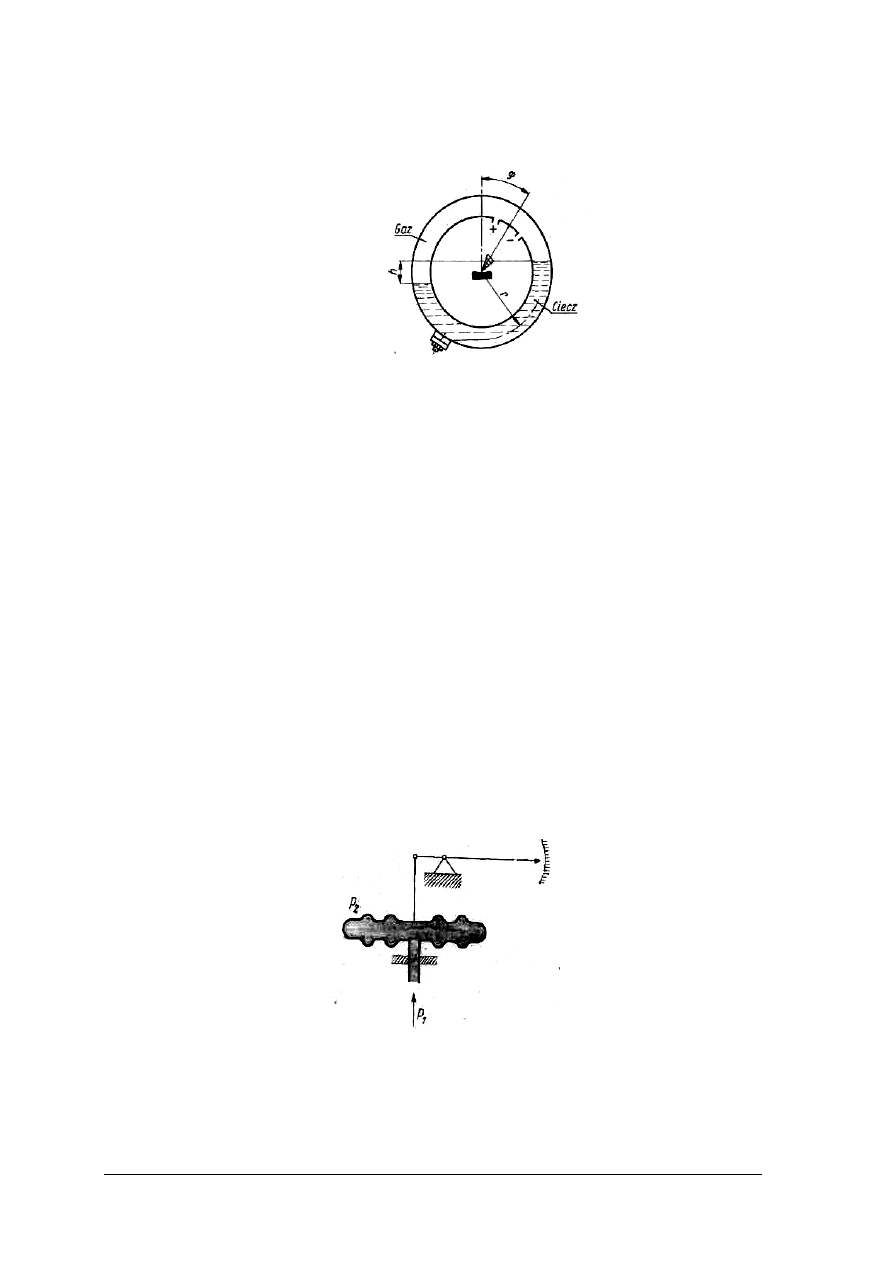
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
57
Waga pierścieniowa
Manometrem cieczowym, w którym ilość i ciężar właściwy cieczy nie mają wpływu na
dokładność wskazań, jest waga pierścieniowa.
Rys. 19. Waga pierścieniowa [3, s. 235]
Metalowa rurka w kształcie pierścienia umocowana jest w sposób umożliwiający obrót
jej dokoła środka geometrycznego. Wnętrze rurki jest rozdzielone ścianką. Przez napełnienie
rurki cieczą do połowy wysokości powstają dwie przestrzenie wolne, z których każda jest
ograniczona ścianką działową i cieczą. W wypadku połączenia jednej przestrzeni z atmosferą,
a drugiej z przewodem, w którym mierzymy ciśnienie, pierścień w czasie różnych ciśnień
obraca się o kąt
φ, będący miarą wartości nadciśnienia lub podciśnienia. Obrót spowodowany
jest parciem na ścianę działową; przeciwciężar umieszczony na obwodzie wagi stwarza
w czasie obrotu moment obrotowy, działający w kierunku przeciwnym. W położeniu
równowagi obu momentów pierścień zatrzymuje się. Strzałka umieszczona nad skalą
wskazuje mierzone ciśnienie. Można tu zastosować rejestrację pomiarów. Stosując obracający
się razem z pierścieniem wagi opornik ślizgowy lub rtęciowy, można wagę pierścieniową
włączyć do układu automatycznej regulacji.
Manometry sprężynowe-mechaniczne
Podstawowym elementem manometrów sprężynowych, których sprężyste odkształcenie
jest miarą badanego ciśnienia, może być zakrzywiona sprężysta rurka metalowa lub przepona
(membrana) albo puszka membranowa. We wszystkich tych elementach zmiany odkształcenia
przenoszone są mechanicznie za pośrednictwem układu dźwigniowego na wskazówkę lub
element rejestrujący. W przeponie, zwłaszcza płaskiej, następuje dosyć małe odkształcenie
sprężyste. Toteż manometry te muszą być zaopatrzone w większe przekładnie.
Rys. 20. Manometr przeponowy [3, s. 236]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
58
Obszar mierniczy manometrów przeponowych jest nieduży, gdyż musi być ograniczony
zakresem odkształceń proporcjonalnych do ciśnienia.
W manometrach rurkowych elementem sprężynującym jest metalowa rurka spłaszczona
i zgięta w kształcie niepełnej obręczy zamocowanej jednym końcem.
Drugi koniec może swobodnie przemieszczać się, gdy rurka pod działaniem ciśnienia
doprowadzonego do jej wnętrza odkształca się sprężyście – rozprostowuje się. Istotne
znaczenie w odkształceniu rurki ma jej spłaszczenie. Im bardziej spłaszczona jest rurka, tym
czulszy jest manometr. Rurki do pomiaru małych ciśnień muszą być bardziej spłaszczone.
Zastosowanie tego typu manometrów nie nastręcza poważniejszych trudności po włączeniu do
układu regulacji. Wadą ich jest dosyć mała dokładność (2,5
–1,5%) oraz trudności stosowania
do pomiaru bardzo małych ciśnień. Manometry te wykazują różną dokładność w różnych
punktach obszaru mierniczego. Dlatego określony jest obszar roboczy przyrządu, który
wynosi: dla płynnie zmieniającego się ciśnienia 1/3
–2/3, natomiast dla ciśnienia pulsującego
1/3–1/2 nominalnego obszaru mierniczego przyrządu. Ponadto występuje w tych przyrządach
zjawisko histerezy i zmęczenia sprężystego, co powoduje błędy pomiarowe. Krótkotrwałe
nawet przeciążenie powoduje trwałe odkształcenie elementu sprężystego i zmianę jego
charakterystyki.
Manometry sprężynowe wymagają, częstszej kontroli niż manometry cieczowe, gdyż
wadliwość ich pracy jest trudniejsza do zauważenia.
Do pomiaru ciśnień małych, wyrażonych w Pa, dawniej w mm sł. H
2
O, stosuje się
manometry z puszką membranową lub przeponą z cienkiej gumy i skóry, bardzo silnie
naciągniętą. Do pomiaru jeszcze mniejszych ciśnień stosuje ssie nieraz baterie puszek
membranowych zwiększające sumaryczne odkształcenie.
Przyrządy do pomiaru prędkości przepływu gazów
Przemysłowe pomiary prędkości przepływu gazów sprowadzają się do określenia
natężenia przepływu. Według podstawowego prawa przepływu można twierdzić, że energia
całkowita (ciśnienie całkowite) płynącego ośrodka jest wielkością stałą. Mówimy, że zachodzi
przemiana potencjalnej energii ciśnienia lub potencjalnej energii grawitacyjnej w energię
jawnego ruchu materii. Energia ta jest sumą energii potencjalnej (ciśnienia statycznego)
i energii ruchu jawnego (ciśnienia dynamicznego). Ciśnienie dynamiczne charakteryzuje ruch
ośrodka i jest ono proporcjonalne do kwadratu prędkości gazu.
Z powyższego prawa wynikają dwie podstawowe metody pomiaru przepływu: metoda
spiętrzenia i metoda dławienia.
Metoda spiętrzenia polega na punktowym pomiarze ciśnienia dynamicznego za pomocą
rurki spiętrzającej. Przykładem takiej rurki jest rurka spiętrzająca Prandtla. Otwór do odbioru
ciśnienia całkowitego znajduje się na głowicy O. Boczne szczeliny S do odbioru ciśnienia
statycznego znajdują się w miejscu najmniejszego zakłócenia.
Rys. 21. Rurka spiętrzająca Prandtla [3, s. 238]
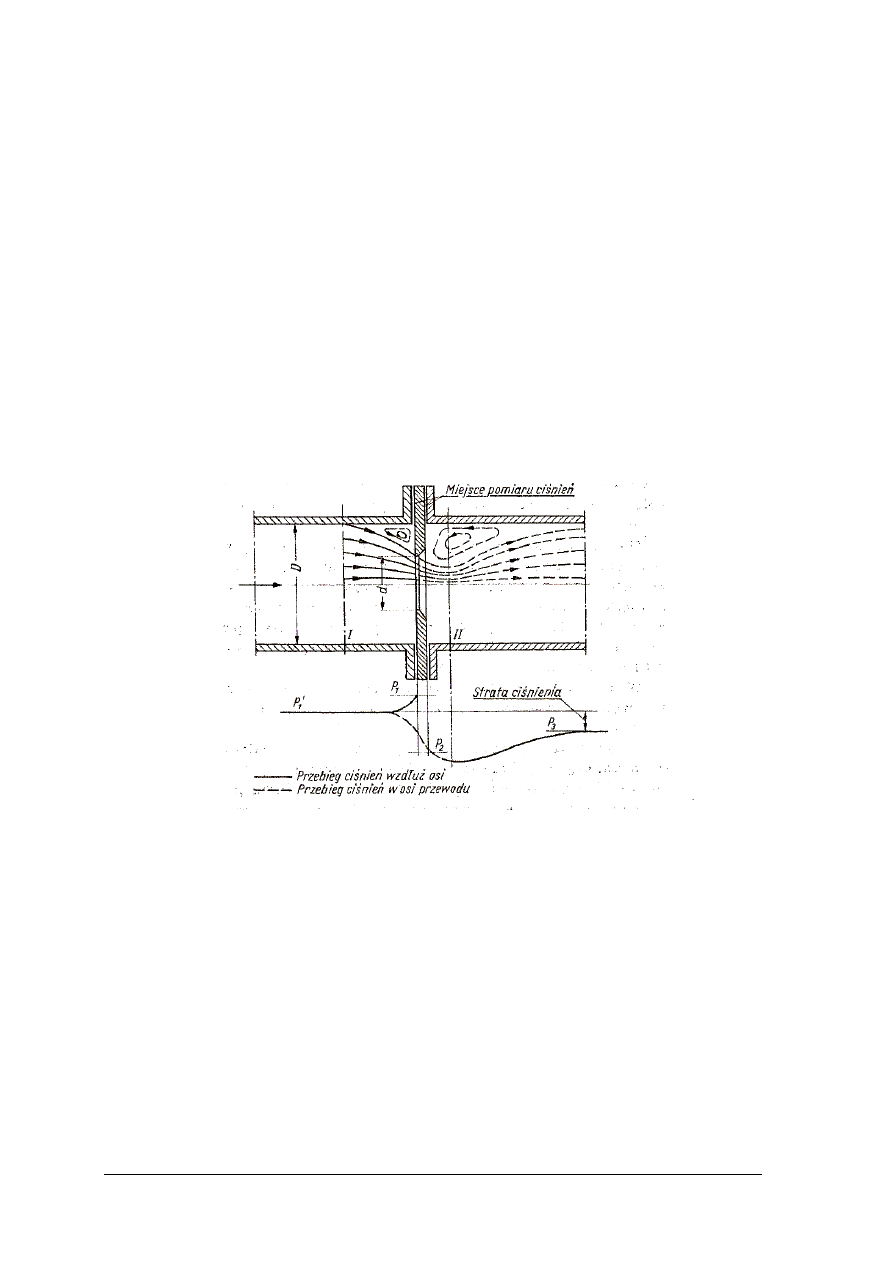
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
59
Jeżeli rurkę tę wprowadzi się do przewodu, w którym zachodzi przepływ i ustawi zagięty
koniec wzdłuż prądu, otworem ku prądowi, to rurka odbierze ciśnienie całkowite, największe
w danym miejscu. Końce rurki łączone z przyrządem pomiarowym oznaczono m. W razie
niedokładnego ustawienia rurki Prandtla, czyli odchylenia jej osi od kierunku strugi, wartości
odbieranych ciśnień całkowitego i statycznego maleją jednakowo, przy czym ich różnica
(ciśnienie kinetyczne) pozostaje bez zmiany. Odebrane tą rurką ciśnienie kinetyczne przy
odchyleniu 5
–15° można uważać za praktycznie bezbłędne.
Metodę spiętrzania stosuje się do kontroli innych przyrządów oraz do dorywczych
pomiarów natężenia przepływu w przewodach, które nie są kołowymi.
Metoda dławienia polega na pomiarze spadku ciśnienia statycznego w elemencie
dławiącym. Jest nim wstawka (zwężka) zmniejszająca pole przekroju przewodu. Zwężki służą
do wywołania spadku ciśnienia. Przystosowane do pomiaru natężenia przepływu nazywają się
zwężkami pomiarowymi lub w skrócie wprost zwężkami. Zwężka jest nadajnikiem ciśnienia
mierniczego i dopiero z manometrem różnicowym i rurą wlotową tworzy kompletny zespół
mierniczy do pomiaru chwilowego przepływu. Zmiana przekroju powoduje zmianę prędkości
gazu w miejscu wmontowania elementu, a co za tym idzie podwyższenie ciśnienia
statycznego przed, a obniżenie za elementem dławiącym.
Rys. 22. Przebieg strumienia gazu i rozkład ciśnienia w zwężce pomiarowej [3, s. 239]
Rysunek przedstawia przebieg strumienia gazu i rozkład ciśnienia w zwężce pomiarowej.
Różnica tych ciśnień, zwana ciśnieniem czynnym, jest proporcjonalna do natężenia
przepływu.
W zwężkach jak i w każdej zwężonej części przewodu, przez który płynie gaz, muszą
zachodzić zjawiska zwiększenia prędkości i zmniejszenia ciśnienia. Jeżeli gaz płynie zwartą
masą (strugą ciągłą) przez wszystkie przekroje przewodu, nie gromadząc się i nie wyciekając
nigdzie na zewnątrz, czyli jeżeli przez wszystkie przekroje przewodu przepływa ta sama ilość
gazu, to w zwężonych przekrojach gaz musi mieć większą prędkość liniową.
Drugim istotnym zjawiskiem zachodzącym w czasie przepływu przez zwężone części
przewodu jest spadek ciśnienia. Jeżeli bowiem w i zwężce zachodzi przyrost prędkości
liniowej, musi też temu towarzyszyć spadek jakiejś innej energii. Jeżeli znikąd nie ma
dopływu energii, przyrost energii ruchu jawnego odbywa się kosztem energii ciśnienia
samego gazu. Spadek ciśnienia mierzy się różnicą dwóch ciśnień statycznych – przed i za
zwężką i nazywa się go ciśnieniem mierniczym. Jeżeli nie ma wymiany energii z otoczeniem,
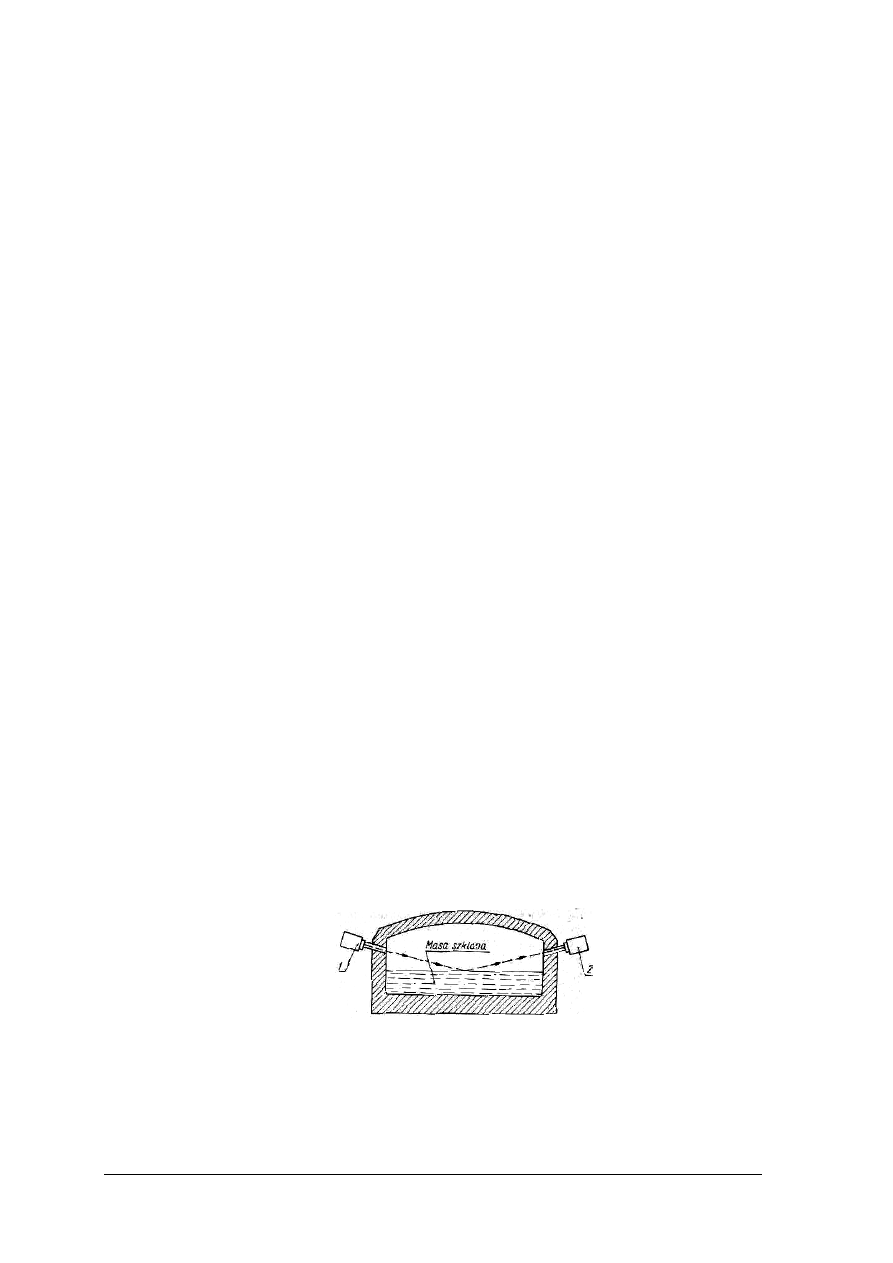
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
60
przemiana ciśnienia w energię ruchu jawnego zachodzi ilościowo, czyli ubytek ciśnienia
statycznego jest równy przyrostowi ciśnienia kinetycznego. Stosunek pola najwęższego
przekroju otworu zwężki do pola przekroju przed zwężką nazywa się rozwarciem zwężki.
Nie zawsze jednak najmniejszy przekrój zwężki jest najwęższym przekrojem strugi gazu
przepływającego przez zwężkę. Struga nieraz ulega dalszemu zwężeniu już po wylocie ze
zwężki. Zjawisko to spowodowane bezwładnością gazu nazywa się kontrakcją. Stosunek
najmniejszego pola przekroju strugi do najmniejszego pola otworu zwężki nazywa się
współczynnikiem kontrakcji.
W zależności od tego czy zachodzi zjawisko kontrakcji w zwężkach dzielimy je na dwie
zasadnicze grupy:
a) kryzy – to zwężki, w których struga gazu odrywa się od niezaokrąglonej krawędzi
wlotowej i następnie po wylocie ze zwężki zwęża się samoczynnie. Kryza jest to płaska
przegroda z umieszczonym w środku otworem. Powszechnie stosowana jest kryza
normalna, jako najtańsza i najłatwiejsza w wykonaniu, zajmująca mało miejsca,
a jednocześnie dająca dostatecznie dokładny pomiar,
b) dysze – to zwężki zaopatrzone u wlotu w odcinek cylindryczny, zapobiegający zjawisku
bezwładności dalszego zwężania. Aby ten kształtujący odcinek był wypełniony strugą,
wlot do dyszy powinien mieć kształt lejkowaty. W dyszach kontrakcja nie zachodzi,
najwyższy przekrój dyszy jest jednocześnie najwęższym przekrojem strugi.
Przyrządy do pomiaru wysokości poziomu masy szklanej w basenie wanny-
poziomomierze
Czerpanie masy szklanej z wanny zmianowej za pomocą urządzeń mechanicznych
wymaga utrzymywania przez cały czas pracy stałej wysokości poziomu masy w wannie lub –
stałego lustra masy.
Jest wiele metod i sposobów pomiaru wysokości lustra masy w wannie, a więc jest wiele
urządzeń służących do pomiaru, zwanych ogólnie poziomomierzami. Spośród nich należy
wymienić następujące poziomomierze: optyczne, pływakowe, elektryczne, pneumatyczne
i absorpcyjne (z zastosowaniem izotopów), laserowe.
Poziomomierze optyczne działają na zasadzie odbicia promieniowania od lustra masy
szklanej. Pomiar polega na obserwacji przez lunetę z podziałką wzajemnego położenia obrazu
kształtki ceramicznej, umieszczonej w ścianie basenu wanny po przeciwnej stronie lunety i jej
lustrzanego odbicia od powierzchni masy. Pomiar jest prosty. Pozwala on na uzyskanie
dokładności pomiaru ± 0,1–0,01 mm.
Wiązka równoległych promieni wysyłana przez źródło promieniowania 1 odbija się od
lustra szkła i dochodzi do układu pomiarowego 2, zawierającego elementy światłoczułe.
W zależności od poziomu masy szklanej zmienia się ilość promieni dochodzących do układu
fotoczułego.
Rys. 23. Poziomomierz optyczny 1) źródło promieniowania, 2) układ pomiarowy [3, s. 244]
W celu wyeliminowania wpływu świecenia pieca stosuje się źródło promieni takiej
długości fali, która nie jest emitowana przez piec lub źródło o promieniach wysyłanych
impulsów.
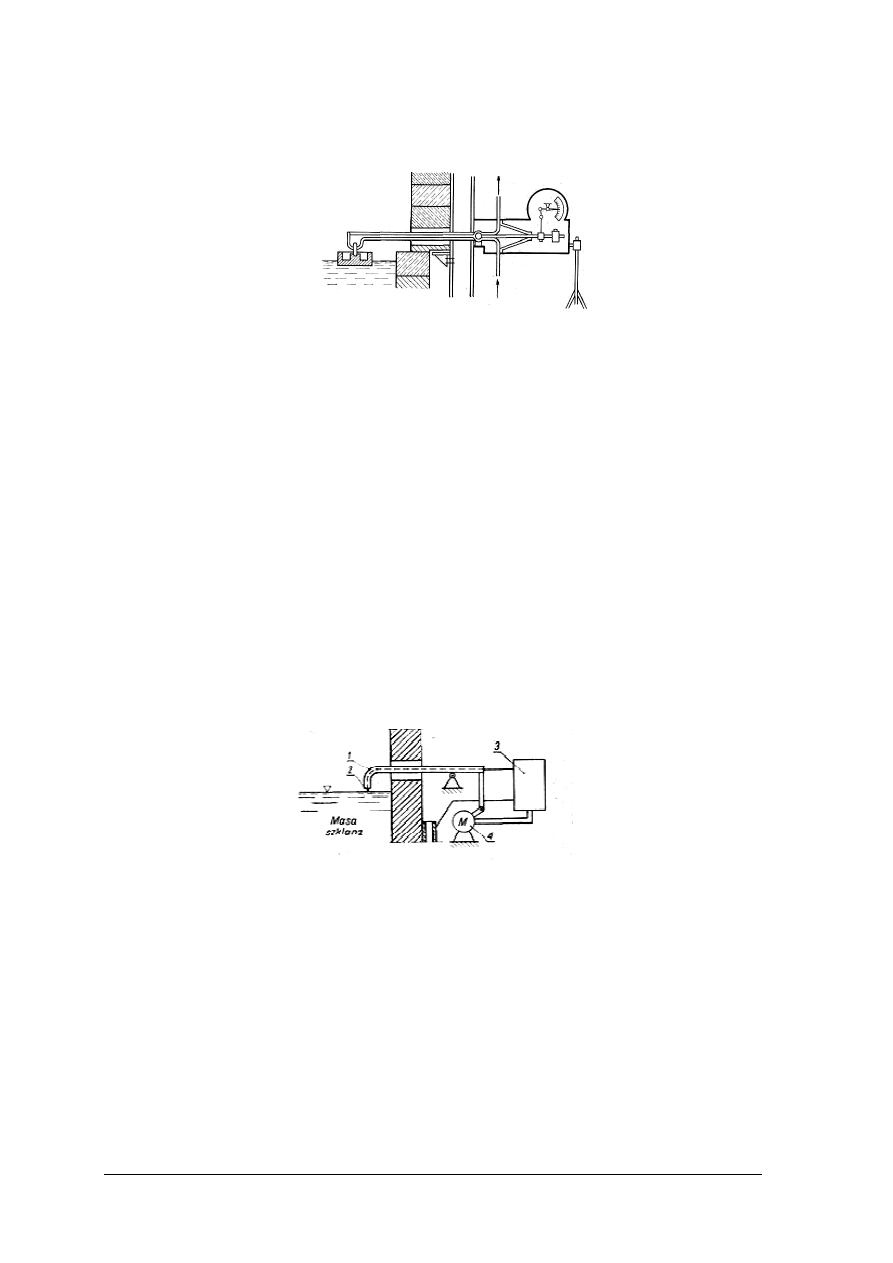
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
61
Poziomomierze pływakowe wyposażone są w pływaki umieszczone na powierzchni masy
szklanej w wannie i podnoszące się lufo opuszczające w miarę wahań wysokości lustra masy.
Rys. 24.
Poziomomierz pływakowy [3, s. 245]
Pływak jest połączony aa pośrednictwem układu dźwigni z urządzeniem rejestrującym
lub sygnalizującym. Pionowe ruchy pływaka są rejestrowane lub sygnalizowane dźwiękowo
albo za pomocą sygnału świetlnego. Zastosowanie dodatkowego układu indukcyjnego
pozwala na uzyskanie dość dużej dokładności około 0,2 mm, na zdalną rejestrację oraz
sterowanie i zasypnika mechanicznego w zależności od wskazań urządzenia pomiarowego.
Wadą tego sposobu jest korozja pływaka przez stopioną masę szklaną, wskutek czego wartość
zerowa na skali urządzenia ulega ciągłej zmianie. Jest kilka różnych konstrukcji
poziomomierzy, w których stosowany jest sposób pływakowy. Poziomomierze te można
stosować w piecach wannowych wszelkiego rodzaju.
Poziomomierze elektryczne działają na zasadzie wykorzystania dobrej przewodności
elektrycznej masy szklanej w wysokiej temperaturze. W równych odstępach czasu elektroda
platynowa, poruszana silnikiem elektrycznym, opuszcza się z góry na dół aż do momentu
zetknięcia się z powierzchnią masy. W momencie tym obwód elektryczny zostaje zamknięty
przez masę szklaną. Położenie elektrody wskazuje wysokość lustra masy w wannie. Następnie
podnosi się ją do góry tak długo aż ciągnąca się nić szklana ulegnie zerwaniu, wówczas cykl
pomiaru powtarza się. Uzyskiwana dokładność pomiaru wynosi ±0,1 mm. Wadą tej metody
jest oblepianie elektrody masą szklaną.
Rys. 25. Poziomomierz elektryczny stykowy: 1) rurka ceramiczna z elektrodą, 2) elektroda,
3) układ przekaźnikowy, 4) serwomotor M [3, s. 245]
Poziomomierze pneumatyczne działają na zasadzie dławienia wypływu powietrza z rurki
ceramicznej, umieszczonej nad lustrem szkła, przez zmieniającą się wysokość poziomu masy.
Zmiany ciśnienia powietrza wypływającego z rurki ceramicznej są miarą zmian poziomu
masy. Dokładność pomiaru wynosi ± 0,05 mm. Wadą urządzenia jest bardzo wąski zakres
pomiaru (0,6-M mm) spowodowany możliwością zatkania masą
szklaną wylotu rurki przez zbyt wysoki poziom masy lub – przerwę w zjawisku dławienia
wypływu w wyniku jej zbyt niskiego poziomu
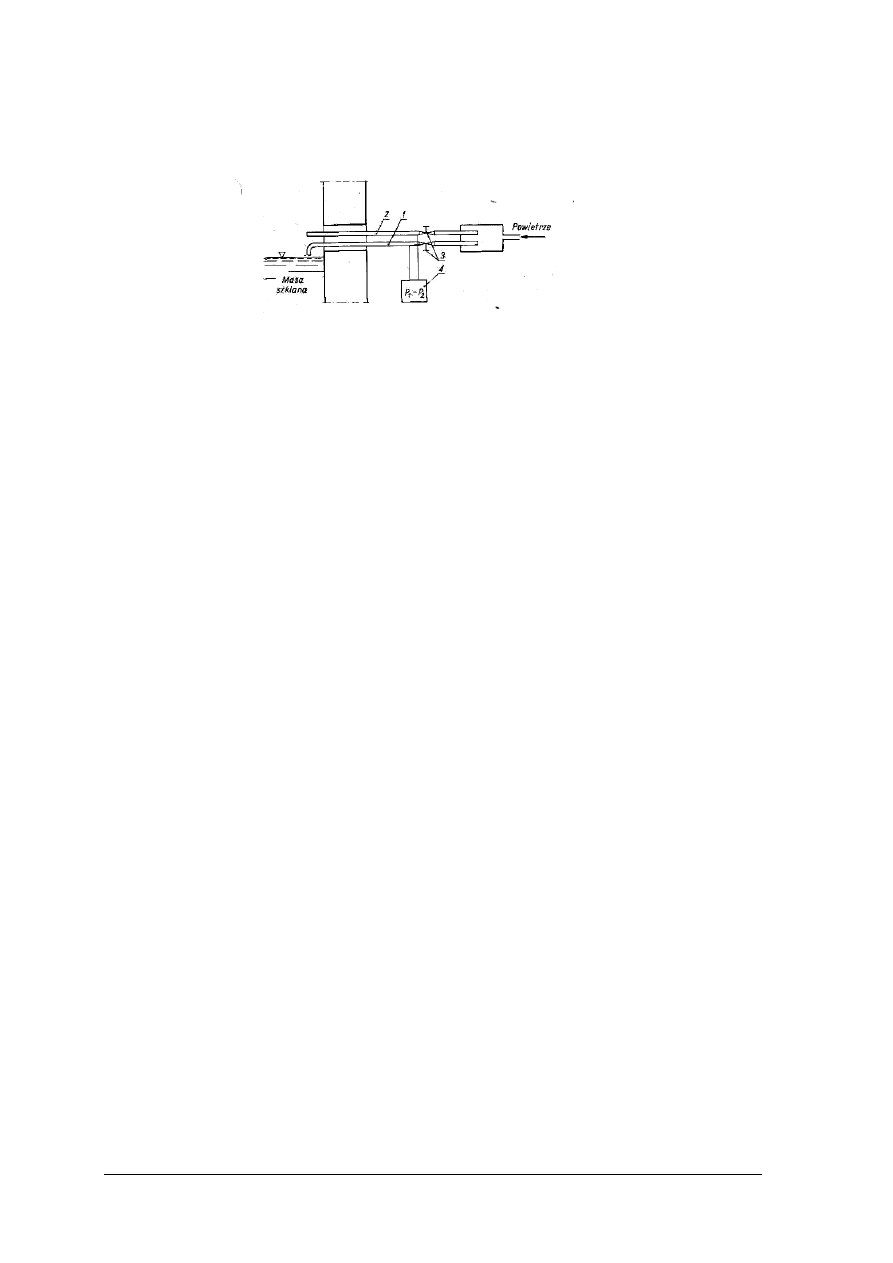
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
62
Rys. 26. Poziomomierz pneumatyczny: 1, 2) dysze powietrzne, 3) zawory, 4) manometr
różnicowy [3, s. 245].
Dlatego metoda ta może być stosowana tylko ze sprzężeniem urządzenia pomiarowego
z automatycznym zasypnikiem, natomiast nie może – przy zasypie ręcznym.
Poziomomierze izotopowe działają na zasadzie znacznego pochłaniania przez szkło
promieni gamma, wysyłanych przez substancje radioaktywne. Zmieniający się poziom masy
szklanej zasłania drogę wiązce promieni wysyłanych przez ciało radioaktywne, a tym samym
zmienia natężenie promieniowania dochodzące do licznika umieszczonego naprzeciw ciała
radioaktywnego po drugiej stronie, część promieniowania jest absorbowana przez szkło.
Dokładność pomiaru wynosi ± 0,25 mm. Wadą tego urządzenia jest możliwość stosowania go
tylko w wąskich kanałach (na przykład w zasilaczach), natomiast w szerokich wannach
wymaga wybudowania przy basenie wąskiej kieszeni, w której masa szklana jest zawsze
mniej ruchliwa niż w basenie wanny. Stosowanie tego rodzaju urządzenia wymaga dużej
ostrożności ze względu na szkodliwość promieni gamma dla zdrowia obsługi.
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie parametry podlegają pomiarom w piecach szklarskich?
2.
Jakie przyrządy stosuje się do pomiaru temperatury w piecach szklarskich?
3.
Jaka jest zasada działania termometru termoelektrycznego?
4.
Jakie rodzaje termoelementów stosuje się do pomiaru temperatury?
5.
Jakie są wady i zalety termoelementów do pomiaru temperatury?
6.
Jaki jest podział pirometrów do pomiaru temperatury?
7.
W jaki sposób działa pirometr monochromatyczny?
8.
W jaki sposób działa pirometr całkowitego promieniowania?
9.
Jakie są wady i zalety pirometrów optycznych?
10.
W jaki sposób działa termometr oporowy?
11.
Jakie są wady i zalety termometrów oporowych?
12.
Jak można sklasyfikować przyrządy do pomiaru ciśnienia gazów w piecu?
13.
W jaki sposób działają manometry cieczowe?
14.
W jaki sposób działają manometry dzwonowe?
15.
Jakie są wady i zalety manometrów cieczowych?
16.
W jaki sposób działają manometry sprężynowe?
17.
Jakie są wady i zalety manometrów sprężynowych?
18.
Jakie przyrządy stosuje się do pomiarów prędkości przepływu gazów?
19.
Jakie metody wykorzystywane są do pomiaru prędkości przepływu gazów?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
63
20.
W jaki sposób działa rurka spiętrzająca do pomiaru wielkości przepływu gazów?
21.
W jaki sposób działa kryza pomiarowa do pomiaru wielkości przepływu gazów?
22.
Wyjaśnić zasadę działania dyszy pomiarowej do pomiaru wielkości przepływu gazów?
23.
Jak można sklasyfikować przyrządy do pomiaru wysokości poziomu masy szklanej?
24.
W jaki sposób działa poziomomierz optyczny do pomiaru wysokości poziomu masy
szklanej?
25.
W jaki sposób działa poziomomierz pływakowy do pomiaru wysokości poziomu masy
szklanej?
26.
W jaki sposób działa poziomomierz pneumatyczny do pomiaru wysokości poziomu masy
szklanej?
27.
W jaki sposób działa poziomomierz izotopowy do pomiaru wysokości poziomu masy
szklanej?
4.4.3. Ćwiczenia
Ćwiczenie 1
Wykonaj pomiar ciśnienia powietrza za pomocą manometru cieczowego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych przyrządy do pomiaru ciśnienia,
2) dokonać analizy budowy manometru cieczowego,
3) zapoznać się z instrukcją do wykonania ćwiczenia,
4) wykonać pomiar ciśnienia za pomocą manometru naczyniowego.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
instrukcja do wykonania pomiaru manometrem cieczowym,
−
manometr cieczowy,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Zapisz, zasadę działania poziomomierza elektrycznego oraz optycznego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych treści dotyczące pomiaru wysokości lustra, szkła
w basenie wanny szklanej,
2) dokonać analizy treści,
3) zapisać zasadę działania poziomomierza optycznego i elektrycznego.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
64
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 3
Wykonaj pomiar temperatury obmierza rozgrzanego pieca laboratoryjnego.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w materiałach dydaktycznych przyrządy do pomiaru temperatury,
2) dokonać analizy budowy pirometru optycznego,
3) zapoznać się z instrukcją do wykonania pomiaru temperatury pirometrem optycznym,
4) wykonać pomiar temperatury.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
instrukcja do wykonywania pomiaru pirometrem optycznym,
−
pirometr optyczny,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
określić, które parametry podlegają pomiarom w piecach szklarskich?
2)
określić przyrządy, które stosuje się do pomiaru temperatury
w piecach szklarskich?
3)
wyjaśnić zasadę zasada działania termometru termoelektrycznego?
4)
określić wady i zalety termoelementów do pomiaru temperatury?
5)
wyjaśnić zasadę działania pirometru monochromatycznego?
6)
wyjaśnić zasadę działania pirometru całkowitego promieniowania?
7)
określić wady i zalety pirometrów optycznych?
8)
sklasyfikować przyrządy do pomiaru ciśnienia gazów w piecu?
9)
wyjaśnić zasadę działania manometrów cieczowych?
10)
wyjaśnić zasadę działania manometrów dzwonowych?
11)
wyjaśnić zasadę działania manometrów sprężynowych?
12)
wskazać przyrządy do pomiarów wielkości przepływu gazów?
13)
określić metody wykorzystywane do pomiaru prędkości przepływu
gazów?
14)
wyjaśnić zasadę działania rurki spiętrzającej do pomiaru wielkości
przepływu gazów?
15)
wyjaśnić zasadę działania kryzy do pomiaru wielkości przepływu
gazów?
16)
wyjaśnić zasadę działania dyszy do pomiaru wielkości przepływu
gazów?
17)
sklasyfikować przyrządy do pomiaru wysokości poziomu masy
szklanej?
18)
wyjaśnić zasadę działania poziomomierza optycznego do pomiaru
wysokości poziomu masy szklanej?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
65
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Test zawiera 20 zadań. Do każdego zadania dołączone są 4 możliwości odpowiedzi.
Tylko jedna jest prawidłowa.
5.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi, stawiając w odpowiedniej rubryce
znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem, a następnie
ponownie zakreślić odpowiedź prawidłową.
6.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7.
Jeśli udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
8.
Na rozwiązanie testu masz 40 minut.
Powodzenia!

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
66
ZESTAW ZADAŃ TESTOWYCH
1. Substancja prosta składająca się z atomów jednego rodzaju, to
a)
pierwiastek.
b)
granulat.
c)
związek.
d)
produkt.
2.
Główną III grupę układu okresowego pierwiastków, tworzą
a) berylowce.
b) borowce.
c) tlenowce.
d) żelazowce.
3.
Poboczną VIIIB grupę układu okresowego pierwiastków, tworzą
a) berylowce.
b) borowce.
c) tlenowce.
d) żelazowce.
4.
Tlenki metali, które reagują z kwasami dając sole, to tlenki
a) zasadowe.
b) kwasowe.
c) amfoteryczne.
d) obojętne.
5.
Schemat AB – A + B przedstawia reakcję
a) syntezy.
b) analizy.
c) redukcji.
d) wymiany.
6.
Do pomiaru ciśnienia gazów i cieczy służą
a) manometry.
b) rotametry.
c) poziomomierze.
d) zwężki.
7.
Poziomomierze działające na zasadzie odbicia promieniowania od lustra masy szklanej,
to
a) poziomomierze pneumatyczne.
b) poziomomierze elektryczne.
c) poziomomierze pływakowe.
d) poziomomierze optyczne.
8.
Tlenki, wprowadzane do masy szklanej przez dolomit, to
a) Na
2
O i Li
2
O.
b) MgO i CaO.
c) PbO i Pb
3
O
4
.
d) ZnO i BaO.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
67
9. Tlenek glinu do zestawu szklarskiego wprowadza
a) dolomit.
b) skaleń.
c) potaż.
d) baryt.
10. Tlenek wapnia do zestawu szklarskiego wprowadza
a) glejta.
b) saletra.
c) kreda.
d) sulfat.
11. Tlenki metali, które reagują z kwasami i z zasadami dając sole, to tlenki
a) zasadowe.
b) amfoteryczne.
c) kwasowe.
d) obojętne.
12. Spośród poniższych, surowiec naturalny, to
a) biel cynkowa.
b) soda.
c) minia ołowiowa.
d) baryt.
13. Do barwników metalicznych zaliczamy
a) P.
b) Co.
c) Si.
d) K.
14. Nazwa chemiczna sulfatu to
a) siarczan sodowy.
b) chlorek amonowy.
c) siarczan potasowy.
d) saletra potasowa.
15. Barwę zieloną szkła można otrzymać dodając do zestawu szklanego zwiąki
a) ceru.
b) niklu.
c) złota.
d) żelaza.
16. Tarcie wewnętrzne to inaczej
a) lepkość.
b) napięcie powierzchniowe.
c) sprężystość.
d) krystalizacja.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
68
17. Przyrządem do pomiaru temperatury, w którym wykorzystywane jest zjawisko
powstawiania napięcia w miejscu połączenia drutów jest
a) ardometr.
b) termopara.
c) termometr oporowy.
d) pirometr monochromatyczny.
18. Na rysunku obok przedstawiono
a) wagę pierścieniową.
b) manometr Krella.
c) rurkę Prandtla.
d) U-rurkę.
19. Na rysunku obok przedstawiono przyrząd do pomiaru
a)
ciśnienia.
b)
temperatury.
c)
wielkości przepływu.
d)
poziomu masy szklanej.
20. Na rysunku obok przedstawiono schemat działania poziomomierza
a) optycznego.
b) elektrycznego.
c) mechanicznego.
d) pneumatycznego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
69
KARTA ODPOWIEDZI
Imię i nazwisko.............................................................................................................................
Badanie właściwości surowców szklarskich i szkła
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
70
6.
LITERATURA
1.
Cienińska M., Dorosz D., Greiner-Wrona E., Gruszka B., Kucharski J., Lisiecki M.,
Łączka M., Procyk B., Siwulski S., Środa M., Wacławska I., Wasylak J.: Technologia
szkła – właściwości fizykochemiczne, cz.1, Kraków 2002
2.
Chabowski L., Nowotny W., Piece szklarskie, Warszawa 1966
3.
Hilgertner A., Nowotny W.: Piece szklarskie. WSiP, Warszawa 1975
4.
Kaczyński F., Podstawy chemii ogólnej i organicznej, Olsztyn 1997
5.
Namieśnik J,, Łukasiuk J., Jamrógiewicz Z.: Pobieranie próbek środowiskowych do
analizy. Wydawnictwo Naukowe PWN, Warszawa 1995
6. Nowotny W.: Technologia szkła cz.2.WSiP, Warszawa 1974
7. Nowotny W.: Technologia szkła cz.1.WSiP, Warszawa 1975
8. Technologia szkła I (praca zbiorowa). Arkady, Warszawa 1987
9. www.dami.pl
Wyszukiwarka
Podobne podstrony:
operator urzadzen przemyslu szklarskiego 813[02] z2 01 n
operator urzadzen przemyslu szklarskiego 813[02] z2 03 u
operator urzadzen przemyslu szklarskiego 813[02] z2 05 n
operator urzadzen przemyslu szklarskiego 813[02] z2 05 u
operator urzadzen przemyslu szklarskiego 813[02] z2 07 u
operator urzadzen przemyslu szklarskiego 813[02] z2 02 n
operator urzadzen przemyslu szklarskiego 813[02] z2 02 u
operator urzadzen przemyslu szklarskiego 813[02] z2 04 n
operator urzadzen przemyslu szklarskiego 813[02] z2 04 u
operator urzadzen przemyslu szklarskiego 813[02] o1 01 u
operator urzadzen przemyslu szklarskiego 813[02] z2 06 u
operator urzadzen przemyslu szklarskiego 813[02] o1 01 n
operator urzadzen przemyslu szklarskiego 813[02] z2 06 n
operator urzadzen przemyslu szklarskiego 813[02] z2 03 n
operator urzadzen przemyslu szklarskiego 813[02] z2 07 n
operator urzadzen przemyslu szklarskiego 813[02] z2 03 u
więcej podobnych podstron