
Zalecenia dotycz
ące planowania diet wegańskich u niemowląt
Dr Ann Reed Mangels, dyplomowana dietetyczka, członkini Amerykańskiego Towarzystwa
Dietetycznego
Virginia Messina, magister zdrowia publicznego, dyplomowana dietetyczka
ABSTRAKT
Odpowiednio zaplanowane diety wegańskie mogą zaspokajać zapotrzebowanie niemowląt na
składniki odżywcze. Amerykańskie Stowarzyszenie Dietetyczne oraz Amerykańska Akademia
Pediatrii uznają, że diety wegańskie mogą sprzyjać normalnemu rozwojowi niemowląt. Rodzice
powinni zapewniać wegańskim niemowlętom odpowiednie produkty żywnościowe używając
wytycznych zgodnych z zaleceniami zawartymi w niniejszym artykule. Kluczowe zagadnienia, które
pojawiają się w pracy z wegańskimi rodzinami dotyczą składu mleka weganek, odpowiednich
substytutów mleka matki, suplementów, rodzaju i ilości tłuszczu w diecie oraz wprowadzania stałych
pokarmów. Rozwój wegańskich niemowląt wydaje się zgodny z oczekiwanym rozwojem niemowląt
odstawionych od piersi i prawidłowo żywionych. Skład mleka weganek jest podobny do składu mleka
niewegetariańskich matek, z wyjątkiem składu tłuszczów. Przez pierwsze 4-6 miesięcy życia
niemowlęcia, mleko matki powinno być jego jedynym pokarmem. Alternatywą może być mleko
sojowe modyfikowane dla niemowląt. Komercyjnie produkowane mleko sojowe nie powinno być
podstawowym napojem przed ukończeniem pierwszego roku życia. Wegańskie niemowlęta karmione
piersią mogą potrzebować suplementacji witaminy B12, jeśli dieta matki jest nieodpowiednia. Starsze
niemowlęta mogą potrzebować suplementów cynku i sprawdzonych źródeł żelaza oraz witamin D i
B12. Czas wprowadzenia pokarmów stałych jest podobny do tego zalecanego w przypadku dzieci
niewegetariańskich. Tofu, suszone warzywa strączkowe i odpowiedniki mięsa są wprowadzane jako
ź
ródła białka około 7-8 miesiąca życia. Diety wegańskie mogą być zaplanowane tak, aby zawierać
odpowiednie składniki odżywcze i wspierać rozwój niemowląt.
J Am Diet Assoc. 2001;101:670-677
Czas od narodzin do 1 roku życia jest okresem, kiedy składniki odżywcze odgrywają
kluczową rolę, a przywiązywanie wagi do właściwego odżywiania jest decydujące dla wspierania
niezwykle szybkiego wzrostu, w tym rozwoju mózgu, obserwowanego w tym okresie. W tym czasie
mleko matki lub mleko modyfikowane dla niemowląt dostarcza dużej części energii i białek
potrzebnych zarówno wegańskim, jak i niewegańskim niemowlętom. Pierwsze pokarmy stałe
podawane w większości przypadków to płatki dla niemowląt, owoce i warzywa. Mięso jest
wprowadzane dopiero później. Zarówno Amerykańskie Stowarzyszenie Dietetyczne jak i
Amerykańska Akademia Pediatrii zapewniają, że dobrze zaplanowane diety wegańskie mogą
zaspokoić potrzeby odżywcze niemowląt i wspierać normalny rozwój (1,2). Rodzice powinni znać
właściwe produkty i zapewniać je wegańskim niemowlętom, stosując się do wskazówek omówionych
w tym artykule. lub do podobnych wskazań.
Celem niniejszej pracy jest określenie ważnych kwestii związanych z żywieniem wegańskich
niemowląt i przedstawienie zaleceń, które pomogą zawodowym dietetykom współpracować z
rodzinami takich dzieci w planowaniu diety zaspokajającej zapotrzebowanie związane ze wzrostem i
rozwojem, dostosowanej do wieku, praktycznej i zgodnej z przekonaniami danej rodziny.

ROZWÓJ WEGA
ŃSKICH NIEMOWLĄT
Ograniczona liczba badań dotyczyła wagi urodzeniowej dzieci wegańskich matek. Badanie
niemal 400 niemowląt i dzieci, których 75% matek stosowało dietę wegańską podczas całej ciąży
pokazało, ze waga urodzeniowa i przypadki niskiej wagi urodzeniowej są podobne do tych
notowanych wśród dzieci dobrze wykształconych białych Amerykanek (3). Odnotowana waga
urodzeniowa 19 niemowląt urodzonych w terminie przez wegańskie matki była nieznacznie niższa niż
waga dzieci urodzonych niewegetariańskim matkom (4). Niższa waga urodzeniowa dzieci
holenderskich matek na diecie makrobiotycznej, która wyklucza większość produktów odzwierzęcych
jak i pewną ilość innych produktów została przypisana małemu przyrostowi wagi matek (5,6). Przy
właściwym przybieraniu na wadze matek i odpowiednim wyborze produktów spożywczych w czasie
ciąży, waga urodzeniowa wegańskich niemowląt powinna zawierać się w przedziale właściwym dla
niemowląt urodzonych przez zdrowe kobiety niewegetariańske.
Przez pierwsze 6 miesięcy życia, większość niemowląt, wegańskich jak i niewegańskich,
dostaje przede wszystkim mleko matki lub mleko modyfikowane. Zdrowe niemowlęta, które
otrzymują odpowiednie ilości mleka matki odżywiającej się prawidłową dietą wegańską, lub
sojowego mleka modyfikowanego dla niemowląt, dobrze się rozwijają w czasie wczesnego
niemowlęctwa (7,8). Istnieją dowody słabego wzrostu we wczesnym okresie życia niemowląt kobiet
na diecie makrobiotycznej, co wydaje się być związane z niewystarczającą ilością mleka matki (6).
Posiadamy bardzo ograniczone informacje dotyczące rozwoju starszych wegańskich niemowląt.
Jedno z badań przeprowadzono na grupie 31 dzieci do 2 roku życia; 73% z nich było na diecie
wegańskiej od urodzenia (3). Waga badanych dzieci w stosunku do ich wieku była podobna do
wartości referencyjnych podawanych przez Krajowe Centrum Statystyki Zdrowotnej
1
. Badane dzieci
były zazwyczaj nieco niższe niż średnia populacji porównawczej (-0,24 cm dla dzieci poniżej 1 roku
ż
ycia) (3). Bez wątpienia potrzebne są dodatkowe badania w tym zakresie, w szczególności w
związku z dużą dostępnością odpowiednich produktów żywnościowych wspierających rozwój dzieci
wegańskich.
MLEKO WEGA
ŃSKICH MATEK
Najbardziej zależnymi od diety matki składnikami jej mleka są: większość witamin z grupy
B, witamina A, C i D (9). Zawartość minerałów, tłuszczu całkowitego i cholesterolu nie jest znacząco
uzależniona od diety matki. Mimo że całkowita zawartość tłuszczu w mleku weganek jest podobna do
mleka kobiet wszystkożernych, skład tłuszczu może się różnić w zależności od jego spożycia przez
matkę. Sanders (10) stwierdził, że mleko wegańskich Brytyjek zawierało mniej nasyconego tłuszczu i
kwasu eikozapentaenowego, a więcej kwasów linolenowego i linolowego. Inne badania wykazały
wyższą zawartość kwasów linolenowego i linolowego w mleku kobiet na diecie makrobiotycznej (11,
12).
Chociaż zawartość minerałów w mleku matki w zależności od jej diety różni się nieznacznie,
Dagnelie i współpracownicy (12) odkryli nieco niższą zawartość magnezu i wapnia w mleku kobiet
na diecie makrobiotycznej. Jednakże Specker (13) stwierdził, że niskie spożycie wapnia przez kobiety
na diecie makrobiotycznej nie skutkowało obniżeniem zawartości wapnia w ich mleku.
1
Centrum obejmuje swoimi badaniami USA – przyp. tłum.
Zawartość witaminy D w mleku matki jest różna w zależności od diety i ekspozycji na
ś
wiatło słoneczne (14, 15), mimo że stężenie aktywnej witaminy D jest zazwyczaj niskie w mleku
kobiet. Poziom witaminy B12 także zależy od diety matki. Niektóre badania sugerują, że witamina
B12 ze źródeł spożywanych przez matkę nie jest dostępna dla niemowlęcia karmionego piersią (16),
jednak nie wszystkie badania wspierają tę tezę (17).
Hughs i Sanders (18) odkryli niższą zawartość ryboflawiny w mleku brytyjskich weganek w
porównaniu z kobietami wszystkożernymi, jednakże była ona zbliżona do wartości z próbek mleka
zebranych w całej Wielkiej Brytanii.
Odkryto, że mleko weganek zawiera mniej tauryny, niż mleko kobiet wszystkożernych (19),
ale jej poziom był porównywalny do średniej w populacji USA (20).
Dorośli weganie spożywają bardzo małe ilości karnityny, jednak stężenie karnityny w osoczu
jest u nich takie same lub nieznacznie niższe niż u osób wszystkożernych (21). Zawartość karnityny w
mleku matek niewegetarianek jest zróżnicowana (22) i wydaje się być niezależna od diety matki (23).
Ponieważ zapasy matki wydają się dodatnio wpływać na zawartość karnityny w mleku, a weganie
najwyraźniej syntetyzują wystarczającą ilość karnityny, można zatem się spodziewać, że zawartość
karnityny w mleku weganek będzie wystarczająca, mimo że brak jest doniesień na temat badań
poziomu tego składnika w pokarmie kobiet na takiej diecie.
Pomimo że zawartość izoflawonów w mleku może wzrosnąć nawet 10-krotnie, kiedy dieta
matki zawiera produkty sojowe (24), dzienne spożycie izoflawonów przez niemowlęta karmione
piersią pozostaje na nieznaczącym poziomie (25).
Wydaje się, że w mleku wegetarianek i kobiet wszystkożernych występują różnice w stężeniu
zanieczyszczeń ze środowiska, przy czym poziom szkodliwych substancji środowiskowych jest
związany z częstotliwością spożycia mięsa, ryb i produktów mlecznych (12). Według badań, mleko
weganek zawiera mniej szkodliwych substancji takich jak DDT, chlordan i polichlorowane bifenyle.
W większości przypadków zawartość tych szkodliwych substancji wynosiła zaledwie 1-2% wartości
notowanych w ogólnej populacji (26).
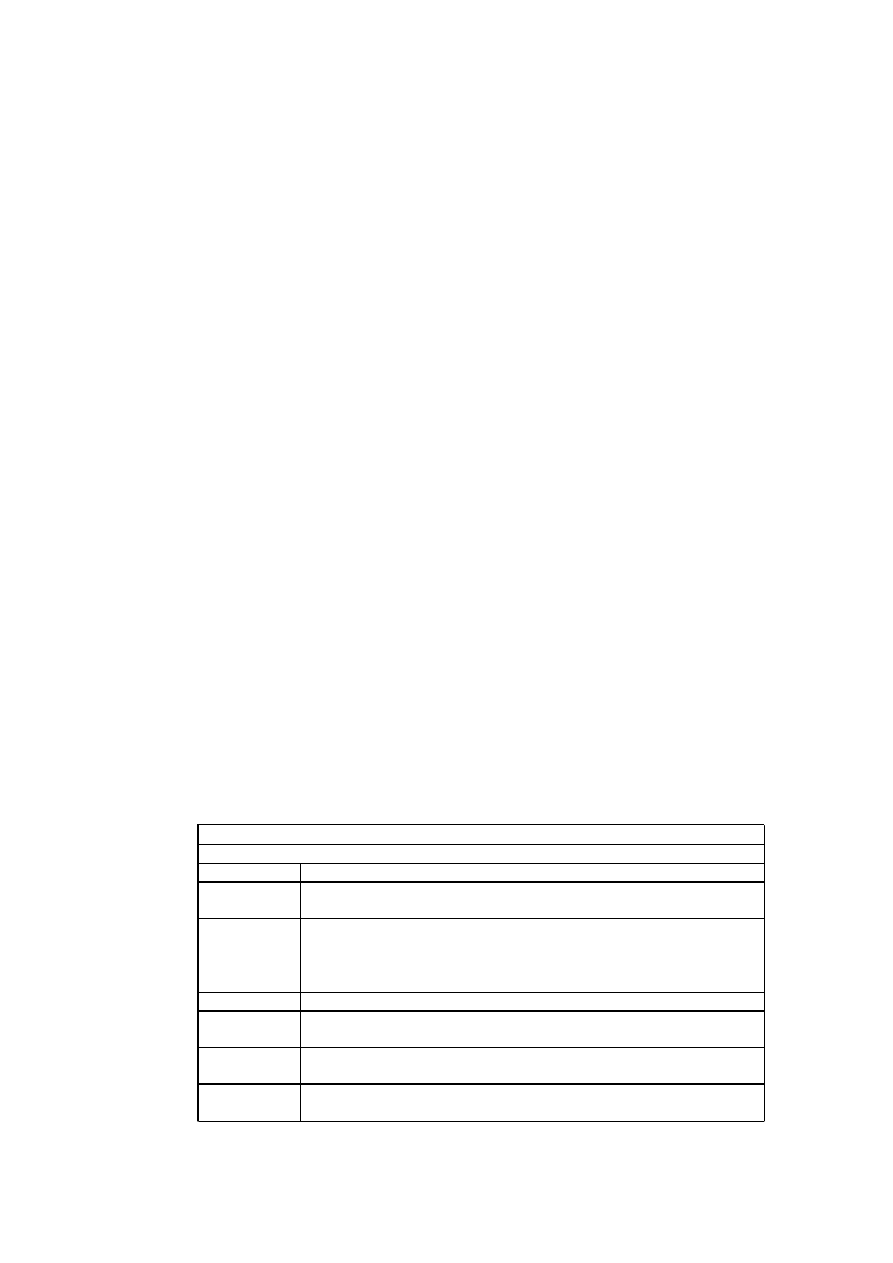
Rekom endowane suplementy dla wega
ń
skich niemowl
ą
t karmionych piersi
ą
Składnik
Ż
elazo
Cynk
Tabela 1
Rekomendowana dawka
Pojedyncza dawka po urodzeniu: 0,5-1,0 mg domi
ęś
niowo lub 1,0-2,0
mg doustnie
200 IU (5 µg) zaczynaj
ą
c od 3 m
ż
. dla niemowl
ą
t zagro
ż
onych
niedoborem (bez wystarczaj
ą
cej ekspozycji na sło
ń
ce, lub
mieszkaj
ą
cych w północnym klimacie, cz te
ż
posiadaj
ą
cych ciemn
ą
skór
ę
)
W itamina K
W itamina D
0,4 µg/dzie
ń
od urodzenia; 0,5 µg/dzie
ń
zaczynaj
ą
c od 6 m
ż
., chyba,
ż
e dieta matki jest odpowiednia
1 mg/kg/dzie
ń
zaczynaj
ą
c od 4 do 6 m
ż
.
W itamina B12
0,25 mg/dzie
ń
zaczynaj
ą
c od 6 m
ż
., je
ś
li woda zawiera mniej ni
ż
0,3
ppm fluoru
Fluor
Powinno si
ę
rozwa
ż
a
ć
w przypadku starszych dzieci; wi
ę
cej
informacji w tek
ś
cie
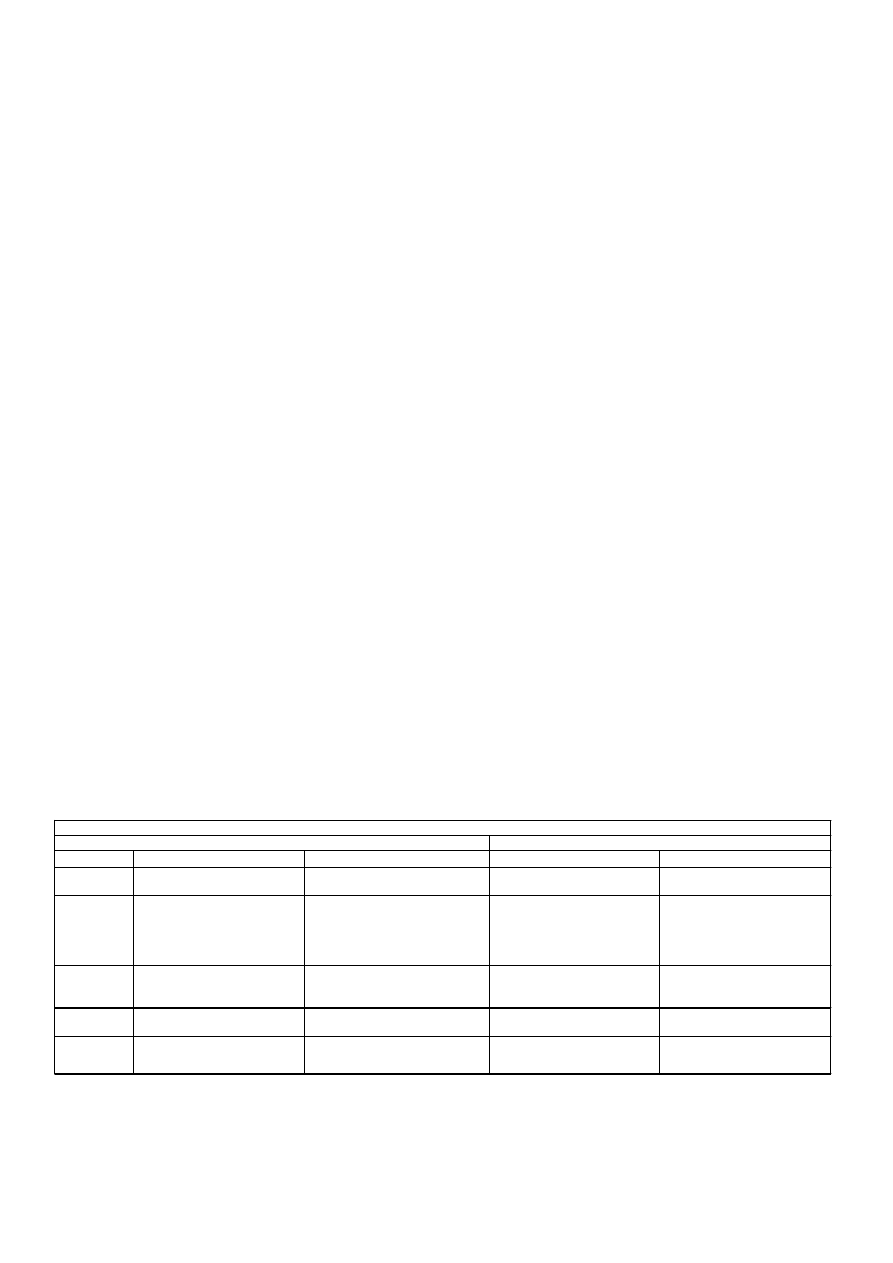
KWAS
DOKOZAHEKSAENOWY
W
DIECIE
WEGA
ŃSKICH
NIEMOWL
ĄT
KARMIONYCH PIERSI
Ą
Kwas dokozaheksaenowy (DHA) jest wielonienasyconym kwasem tłuszczowym n-3
obecnym we wszystkich komórkach ciała, a występującym w szczególnie wysokim stężeniu w mózgu
i siatkówce. Ponieważ DHA występuje głównie w rybach i jajkach, weganie nie spożywają go, ale
zależą od endogennej syntezy z kwasu linolenowego n-3. Niska proporcja kwasu linolowego do
kwasu linolenowego w diecie maksymalizuje konwersję (27, 28). Niektóre badania wykazały
obniżone poziomy DHA w osoczu wegan w porównaniu do osób wszystkożernych (10, 29).
Niemowlęta, które spożywają gotowe DHA, bądź z mleka matki lub mleka modyfikowanego
wzbogaconego w DHA, mają wyższe poziomy DHA we krwi (30), mózgu i siatkówce (31).
Wykazano, że wczesna podaż DHA w diecie łączy się z lepszymi wynikami w testach
psychomotorycznych w wieku 4 miesięcy (32), ale nie w wieku 24 miesięcy (33), wyższymi
wynikami w skali rozwoju umysłowego w wieku 18 miesięcy (34), lepszą ostrością widzenia (35, 36)
i innymi korzyściami.
Poziom DHA w mleku weganek wydaje się być niższy niż u laktoowowegetarianek i kobiet
wszystkożernych (4), ale wyższy niż w komercyjnym mleku modyfikowanym (które w USA nie
zawiera DHA) (37). Karmione piersią wegańskie niemowlęta mają niższy poziom DHA w
erytrocytach niż karmione piersią niemowlęta matek wszystkożernych (4).
Zarówno urodzone w terminie jak i przedwcześnie urodzone niemowlęta potrafią
syntetyzować DHA z kwasu linolenowego (38-40). Jednym ze sposobów wspierania syntezy DHA u
karmionych piersią wegańskich niemowląt jest zwiększenie zawartości kwasu linolenowego w mleku.
Karmiące piersią weganki powinny włączyć pokarmy bogate w kwas linolenowy do swojej diety
(mielone nasiona lnu, olej lniany, olej rzepakowy, olej sojowy) i ograniczyć spożycie kwasu
linolowego, aby zwiększyć syntezą DHA. Suplementowanie DHA u kobiet karmiących piersią za
pomocą trójglicerydu DHA produkowanego przez algi będące jego bogatym źródłem jest obecnie
przedmiotem badań (41, 42).
Tabela 2
Sugerowany plan karmienia wega
ń
skich niemowl
ą
t, 4 do 12 miesi
ą
ca
ż
ycia
Pokarm
11-12 m
ż
.
a
Nało
ż
enie si
ę
rozw a
ż
anych przedziałów w iekowych wynika z ró
ż
nego tempa rozwoju dzieci
Mleko
Płatki i
pieczywo
mleko matki lub sojowe mleko dla
niemowl
ą
t
Wzbogacone w
ż
elazo płatki
ś
niadaniowe dla niemowl
ą
t
(wprowadzenie ich m o
ż
na opó
ź
ni
ć
do 6 m
ż
.)
Nie
Owoce
9-10 m
ż
.
4-6 m
ż
.
mleko matki lub sojowe mleko dla
niemowl
ą
t
Płatki
ś
niadaniowe dla niemowl
ą
t,
krakersy, tosty, niesłodzone suche
płatki
ś
niadaniowe
papka owocowa, soki owocowe
6-8 m
ż
.
a
Nie
mleko matki lub sojowe mleko dla
niemowl
ą
t
Płatki
ś
niadaniowe dla niemowl
ą
t,
krakersy, tosty, niesłodzone suche
płatki
ś
niadaniowe, mi
ę
kkie
pieczywo, ry
ż
, makaron
Owoce mi
ę
kkie, gotowane lub z
puszki; owoce obrane surowe, sok
owocowy
mleko matki lub sojowe mleko dla
niemowl
ą
t
Płatki
ś
niadaniowe dla niemowl
ą
t,
krakersy, tosty, niesłodzone suche
płatki
ś
niadaniowe, mi
ę
kkie
pieczywo
Owoce mi
ę
kkie lub gotowane, sok
owocowy
Mi
ę
kkie, gotowane kawałki warzyw,
sok warzywny
Tofu, puree z ro
ś
lin str
ą
czkowych,
ser sojowy, jogurt sojowy, małe
kawałki kotletów sojowych, tempeh
Warzywa
Ro
ś
liny
str
ą
czkowe
Tofu, puree z ro
ś
lin str
ą
czkowych,
ser sojowy, jogurt sojowy
Mi
ę
kkie, gotowane rozgniecione
warzywa, sok warzywny
papka warzywna, sok warzywny
Tofu, puree z ro
ś
lin str
ą
czkowych,
jogurt sojowy (7-8 m
ż
.)
Nie

MLEKO DLA WEGA
ŃSKICH NIEMOWLĄT
Mleko matki jest optymalnym pokarmem dla wszystkich niemowląt. Istnieje wiele korzyści z
karmienia piersią (43). Amerykańska Akademia Pediatrii zaleca ludzkie mleko jako jedyne źródło
składników odżywczych przez pierwsze 6 miesięcy życia dla noworodków urodzonych w terminie
(44). Akademia rekomenduje również, żeby utrzymywać karmienie piersią co najmniej przez
pierwszych 12 miesięcy, uzupełniając je odpowiednimi dodatkowymi pokarmami (44). Wiele
weganek decyduje się karmić piersią jeszcze dłużej (45) i powinno to być wspierane.
Komercyjne mleka modyfikowane dla niemowląt są zalecane w przypadku braku karmienia
piersią lub odstawienia od piersi przed ukończeniem 1 rż. Standardowe mleka modyfikowane są
oparte na modyfikowanym mleku krowim i nie są odpowiednie dla wegańskich niemowląt. Sojowe
mleka modyfikowane zawierają izolat białka sojowego wzbogaconego metioniną. Niemowlęta
karmione wyłącznie opartym na soi mlekiem modyfikowanym rosną i rozwijają się normalnie (8, 46).
Mimo że niektóre marki zawierają witaminę D i, rzadziej, tłuszcze pochodzące ze źródeł
odzwierzęcych, modyfikowane mleka sojowe są jedyną opcją dla wegańskich niemowląt
niekarmionych piersią (8). Nie ma żadnych komercyjnych mlek modyfikowanych niezawierających
produktów odzwierzęcych dla wegańskich niemowląt, które nie tolerują soi. Podobnie, wszystkie
komercyjne produkty dla wcześniaków zawierają produkty odzwierzęce.
Wyrażano pewne obawy związane z użyciem sojowego mleka modyfikowanego w wieku
niemowlęcym (47, 48) ze względu na wysoką zawartość izoflawonów (25). Poziomy izoflawonów z
soi w osoczu niemowląt karmionych modyfikowanym mlekiem sojowym są znacząco wyższe niż u
niemowląt karmionych modyfikowanym mlekiem krowim lub mlekiem matki (25). Fitoestrogeny z
klasy izoflawonów takie jak genisteina, daidzeina i ich glikozydy, które znajdują się w produktach
zwierających białko sojowe są kojarzone z szeregiem działań hormonalnych i niehormonalnych (49).
Skutki wczesnej ekspozycji na izoflawony z soi są przedmiotem badań (50). Sojowe mleka
modyfikowane są używane od ponad 30 lat (49), a produkty sojowe są regularnie podawane
niemowlętom w krajach azjatyckich (51) bez żadnych widocznych negatywnych skutków, chociaż
długoterminowe efekty nie były badane. Wstępne dane sugerują brak działania hormonalnego (52)
czy zmiany w funkcjonowaniu systemu immunologicznego (53). Setchel (49) sugeruje, że ekspozycja
na sojowe mleka modyfikowane w niemowlęctwie może de facto być korzystna w zakresie ochrony
przed hormonozależnymi chorobami w późniejszym życiu.
Okazjonalne doniesienia o problemach żywieniowych u wegańskich lub wegetariańskich
niemowląt są często związane ze stosowaniem domowej roboty mlek w pierwszym roku życia (54-
58). Produkty takie jak komercyjne lub domowe mleko sojowe, ryżowe, z orzechów lub nasion;
niezawierająca nabiału śmietanka, owsianka na wodzie czy papki z owoców lub warzyw nie powinny
być używane jako zastępniki mleka matki lub komercyjnego mleka modyfikowanego dla niemowląt
poniżej pierwszego roku życia. Te pokarmy nie zawierają właściwej proporcji makroskładników, ani
wystarczających ilości wielu witamin i minerałów.
Pełne mleko krowie nie powinno być wprowadzane do diety niewegańskich niemowląt przed
ukończeniem pierwszego roku życia ze względu na niską zawartość i małą biodostępność żelaza i
nieodpowiednio wysoką zawartość białek, sodu, potasu i chloru w mleku krowim (59). Mleko krowie
zawiera także ograniczone ilości niezbędnych kwasów tłuszczowych, witaminy E i cynku (59).
Komercyjne mleko sojowe nie powinno być wprowadzane do diety niemowląt przed
ukończeniem pierwszego roku życia z podobnych względów. O ile mleko sojowe zawiera więcej
ż
elaza niż mleko krowie i podobną ilość cynku, dostępność biologiczna żelaza i cynku z produktów
sojowych wydaje się być relatywnie niska (60, 61). W wieku ok. roku pokarmy takie jak suszona
fasola, pełne ziarna i warzywa mogą podnieść poziom żelaza i cynku w diecie niemowląt i wraz z
komercyjnym mlekiem sojowym (i ewentualną suplementacją żelaza i cynku) powinny prowadzić do
odpowiedniej podaży tych składników odżywczych.
Zwykłe pełnotłuste mleko sojowe dostarcza białko i sód na poziomie podobnym do mleka
krowiego. Zawartość potasu jest nieco wyższa w mleku sojowym niż krowim. Mleko sojowe jest
także źródłem zarówno kwasu linolowego jak i alfa-linolenowego.
Jesteśmy przekonane, że komercyjne, wzbogacone, pełnotłuste mleko sojowe może być
wprowadzane do diety wegańskich niemowląt po ukończeniu 1 rż., jeśli dziecko rośnie normalnie, ma
odpowiednią wagę i wzrost dla swojego wieku, spożywa różnorodne pokarmy, w tym produkty
sojowe, fasole, zboża, owoce i warzywa. Po wprowadzeniu wzbogaconego mleka sojowego, rodzice
powinni nadal podawać mleko matki lub komercyjne sojowe mleko modyfikowane dla niemowląt
jako napój uzupełniający dopóki dziecko nie skończy co najmniej 2 rż. lub jest w stanie regularnie pić
ok. 710 ml mleka sojowego dziennie. Wybieranie bezsmakowego mleka sojowego zamiast mlek
smakowych takich jak waniliowe, czekoladowe, czy karobowe może pomóc uniknąć wykształcenia
się u małego dziecka preferencji do bardzo słodkich napojów. Całkowita zawartość tłuszczu w
pełnotłustym mleku sojowym jest zbliżona do jego zawartości w 2% mleku krowim. Stąd też inne
pokarmy zawierające tłuszcz powinny być wprowadzone do diety wegańskich niemowląt tak, aby
tłuszcz pochodzący z pokarmu nie został zbytnio ograniczony (62).
Niskotłuszczowe lub beztłuszczowe mleko sojowe nie powinno być używane przez pierwsze
2 lata życia ze względu na ich niższą gęstość kaloryczną, podobnie jak niskotłuszczowe i
beztłuszczowe mleko krowie nie powinny być podawane w tej grupie wiekowej (2). Mleko ryżowe
nie jest rekomendowane jako podstawowy napój dla wegańskich niemowląt i małych dzieci ze
względu na jego niską gęstość kaloryczną i niską zawartość białka.
Tabela 3
Przek
ą
ska 1
Przek
ą
ska 2
Mleko matki (180 ml)
a
Pełnoziarnisty chleb (1/4 kromki)
Mleko matki (180 ml)
Obiad
W zbogacone w
ż
elazo płatki
ś
niadaniowe dla niemowl
ą
t (1/4
szklanki) z zarodkami pszenicy (2
ły
ż
eczki)
Ś
niadanie
Rozgniecione tofu (30 g)
Brokuły, gotowane na parze i
posiekane (1 ły
ż
ka)
Banan, rozgnieciony (2 ły
ż
ki)
Przykładowy jadłospis, szacunkowa analiza składników od
ż
ywczych i porównanie do zalecanej dziennej
dawki (RDA) dla 9-miesi
ę
cznego wega
ń
skiego niem owl
ę
cia
Kolacja
Wzbogacone w
ż
elazo płatki
ś
niadaniowe dla niemowl
ą
t (1/4
szklanki) z zarodkami pszenicy (2
ły
ż
eczki)
Czerwona fasola, rozgnieciona (2
ły
ż
ki)
Kabaczek, rozgnieciony (1 ły
ż
ka)
Mus jabłkowy (1 ły
ż
ka)
Mleko matki (180 ml)
Sok jabłkowy wzbogacony o wit. C i
wap
ń
(120 ml),
Pełnoziarniste pieczywo pszenne
(1/4 kromki)
Mleko matki (180 ml)
Krakers grahamowy (1)

Przybli
ż
ona analiza od
ż
ywcza w porównaniu do zalecanej dziennej dawki (RDA)
Składnik
W arto
ść
%RDA
b
867
96
19
136
9
118
54
38
39
643
238
14,0
127
415
4,1
137
549
110
76
152
1,0
333
0,7
175
10,6
265
127
159
0,5
167
0,3
d
60
5,0
Energia (kcal)
c
Białko (g)
(% kcal)
W
ę
glowodany (g)
(% kcal)
Tłuszcz całkowity (g)
(% kcal)
W ap
ń
(mg)
Ż
elazo (mg)
Sód (mg)
Cynk (mg)
W itamina A (µ g)
W itamina B12 (µg)
Błonnik pokarmowy (g)
W itamina C (mg)
Tiamina (mg)
Ryboflawina (mg)
Niacyna (mg)
Kw as foliowy (µ g)
W itamina B6 (mg)
a - Zast
ę
pnikiem mleka matki mo
ż
e by
ć
sojowe mleko modyfikowane. Niektóre niemowl
ę
ta nie b
ę
d
ą
piły mleka przy posiłkach, lecz do przek
ą
sek.
b - Na podstawie (63, 70, 78-80)
c - Dla niemowl
ę
cia o masie ciała 9kg
d - Poziom witaminy B12 waha si
ę
w zale
ż
no
ś
ci od diety matki. Przyj
ę
to zało
ż
enie,
ż
e dieta matki zawiera odpow iedni
ą
ilo
ść
witaminy B12.
SUPLEMENTY DLA WEGA
ŃSKICH NIEMOWLĄT
Za wyjątkiem wit. B12 i, być może, cynku, wytyczne, co do suplementacji u wegańskich
niemowląt są takie same jak w przypadku niemowląt wszystkożernych. Ponieważ zapasy wit. B12
matki mogą nie być dostępne dla niemowlęcia i ze względu na to, że niemowlęta potrzebują ciągłej
podaży wit. B12, aby zapewnić szybki wzrost, ważne jest, aby wszystkie wegańskie niemowlęta
karmione piersią otrzymywały regularnie suplement wit. B12 (0.4 µg dziennie przez pierwsze 6
miesięcy, 0,5 µg dziennie począwszy od 6 mż.), chyba że matka regularnie przyjmuje suplementy lub
pokarmy wzbogacone wit. B12 (63).
Zawartość cynku w ludzkim mleku spada wraz z trwaniem laktacji (64, 65). W miarę jak
spada ilość cynku w mleku matki, do diety dziecka wprowadzane są zazwyczaj pokarmy zawierające
ten składnik. Źródła cynku odpowiednie dla niemowląt to wzbogacone o cynk płatki śniadaniowe,
rośliny strączkowe, pełne ziarna, zarodki pszenne i tofu. O ile pokarmy te dostarczają cynku, jego
biodostępność jest ograniczona kwasem fitowym występującym w pełnych ziarnach i roślinach
strączkowych. Stosowanie pełnoziarnistego pieczywa na zakwasie drożdżowym i fermentowanych
produktów sojowych poprawia biodostępność cynku (66, 67), tak więc spożycie cynku przez
wegańskie niemowlęta może, choć nie musi, być wystarczające w zależności od wybieranych
pokarmów.
Amerykańska Akademia Pediatrii nie rekomenduje suplementów cynku dla wegańskich
niemowląt, gdyż kliniczne objawy niedoboru cynku są rzadkie wśród wegetarian (2). Inni, jednakże,
zalecają suplementowanie cynku u karmionych piersią niemowląt w czasie wprowadzania pokarmów
uzupełniających, jeśli dieta niemowlęcia jest uboga w cynk lub zawiera głównie cynk w postaci słabo
dostępnej biologicznie (68, 69). Potrzeba jest więcej informacji na temat odpowiednich Ilości

suplementów cynku dla wegańskich niemowląt. Wytyczne Instytutu Medycyny proponują 5mg na
dobę jako górną granicę spożycia cynku dla dzieci w wieku pół roku do roku, a dla 1-3latków – 7 mg
na dobę (70). Specjaliści ds. żywienia powinni zwracać szczególną uwagę na cynk podczas oceniania
diet starszych wegańskich niemowląt.
Mimo, że zawartość wit. D w mleku matki waha się w zależności od jej diety i ekspozycji na
ś
wiatło słoneczne, poziom aktywnej wit. D w mleku kobiet jest ogólnie niski. Dlatego też zaleca się,
aby dzieci karmione piersią, które nie spędzają wystarczająco dużo czasu na słońcu otrzymywały
200IU dziennie zaczynając od 3 miesiąca życia. Wydaje się, że 30 minut tygodniowo ekspozycji na
ś
wiatło słoneczne w samej pieluszce lub 2 godziny tygodniowo w ubranku, ale bez nakrycia głowy,
pozwala na utrzymanie odpowiedniego poziomu wit. D u jasnoskórych niemowląt w klimacie
umiarkowanym (71). Ciemnoskóre niemowlęta oraz te mieszkające w klimacie północnym mogą być
narażone na niedobór wit. D i w tych przypadkach suplementacja tej witaminy jest zalecana.
Stężenie żelaza w ludzkim mleku zmniejsza się wraz z upływem czasu i suplementy lub
wzbogacone pokarmy powinny zostać wprowadzone do diety wszystkich niemowląt karmionych
piersią ok. 4-6 miesiąca. W zależności od fluoryzacji wody w kranie, suplementowanie fluoru może
być zalecane po 6 mż.
Sojowe mleka modyfikowane dla niemowląt są wzbogacane w witaminy i minerały, w tym
wit. D, wit. B12 i minerały śladowe. Karmione nimi dzieci mogą potrzebować suplementów fluoru po
6 mż., jeśli woda w kranie nie jest fluorowana. Wreszcie, wszystkie niemowlęta otrzymują
pojedynczą dawkę wit. K zaraz po urodzeniu. Tabela 1 zawiera podsumowanie zalecanych
suplementów dla wegańskich niemowląt karmionych piersią.
POKARMY STAŁE DLA WEGA
ŃSKICH NIEMOWLĄT
Wytyczne dotyczące wprowadzania stałych pokarmów do diety wegańskich niemowląt są
takie same jak dla niemowląt niewegetariańskich (1). Zarówno mleko matki jak i komercyjne mleko
modyfikowane zapewniają wystarczające odżywienie dla dzieci do ok. 6 mż. Indywidualny wzrost i
rozwój dziecka są dużo lepszą wskazówką, kiedy wprowadzać stałe pokarmy, niż wiek niemowlęcia
(2). Jednakże pokarmy stałe powinny być wprowadzane nie później niż w 6 mż. (2). Tabela 2 zawiera
sugerowany harmonogram wprowadzania stałych pokarmów (72).
Wzbogacone w żelazo płatki śniadaniowe są rozsądnym pierwszym stałym pokarmem dla
wegańskich niemowląt, gdyż zapewniają źródło energii i żelaza w łatwo trawionej formie. Najczęściej
stosuje się płatki ryżowe, ponieważ są hipoalergiczne. Karmienie mlekiem matki lub modyfikowanym
powinno być kontynuowane jak do tej pory. Jeśli płatki wzbogacane w żelazo nie są stosowane, dzieci
karmione piersią powinny nadal otrzymywać suplement żelaza. Kiedy płatki są dobrze przyjmowane,
można wprowadzić owoce, soki owocowo-warzywne i warzywa. Kolejność wprowadzania tych
pokarmów nie jest istotna (2). Owoce i warzywa powinny być dobrze rozgniecione albo zmiksowane.
Soki należy wprowadzać dopiero wtedy, gdy dziecko potrafi pić z kubka. Spożycie soków powinno
być ograniczone, gdyż ich nadmierna ilość (więcej niż 235-295 ml dziennie w przypadku dzieci)
może prowadzić do rozwolnienia i zaburzenia wagi i wzrostu (2,73).
W wieku 7-8 miesięcy można już wprowadzać inne dobre źródła białka poza mlekiem matki
lub modyfikowanym. Zalicza się do nich dobrze rozgniecione lub zmiksowane gotowane fasole czy
tofu, oraz jogurt sojowy. Dzieci powinny przechodzić od rozgniecionego czy miksowanego pokarmu

do kawałków miękkiego jedzenia. Inne produkty zbożowe takie jak miękki, gotowany makaron lub
ryż, miękkie pieczywo, suche płatki i krakersy mogą być wprowadzane, kiedy wegańskie niemowlęta
nauczyły się już sprawnie żuć. Stopniowe wprowadzanie różnorodnych pokarmów promuje
prawidłowe nawyki żywieniowe (2).
W miarę jak pokarmy stałe są coraz większą częścią diety i w coraz większym stopniu
zastępują mleko matki lub mleko modyfikowane, należy pamiętać, aby wybierać produkty o wysokiej
gęstości odżywczej. Do produktów, które są skoncentrowanym źródłem kalorii i składników
odżywczych należą rozgniecione tofu, pasty z fasoli, rozgniecione awokado, gotowane suszone
owoce. Regularne posiłki i przekąski pomagają w zapewnieniu spożycia odpowiedniej ilości energii.
Aktualne zalecenia mówią o nieograniczaniu tłuszczy w diecie dzieci do lat 2, mimo że
niektóre badania sugerują, że zmniejszona podaż tłuszczu po 6 mż. nie wpływa negatywnie na rozwój
czy podaż składników odżywczych (74-76), a diety z niższą zawartością tłuszczu rzeczywiście
poprawiają profil lipidowy dzieci (74). Ponieważ tłuszcz jest skondensowanym źródłem kalorii,
włączenie miękkich margaryn lub oleju roślinnego do diety starszych niemowląt może być korzystne.
Tabela 3 zawiera przykładowy jadłospis dla wegańskiego niemowlęcia (77).
PRZYGOTOWYWANIE POSIŁKÓW DLA NIEMOWL
ĄT W DOMU
Wielu wegańskich rodziców decyduje się używać dostępne w sprzedaży, gotowe dania dla
niemowląt. Jednakże, dla nieco starszych niemowląt, dostępna jest tylko ograniczona oferta, więc
rodzice mogą chcieć sami przygotowywać jedzenie dla swojego dziecka. Powinno się do tego
zachęcać, gdyż pokarmy, które są ważne w diecie wegańskich dzieci jak rośliny strączkowe, tofu,
zielone warzywa liściaste rzadko występują w daniach gotowych, a powinny być wprowadzane
wcześnie, aby zwiększyć późniejszą akceptację dla takich produktów (81). Poniższa tabelka zawiera
wytyczne dotyczące domowego przygotowywania jedzenia dla wegańskich niemowląt.
Pokarm dla niemowl
ą
t powinien by
ć
przygotowywany bez dodatku soli, cukru i przypraw.
Produkty spo
ż
ywcze powinny by
ć
dobrze umyte, dokładnie ugotowane i zmiksowane lub rozgniecione do
wła
ś
ciwej konsystencji.
Włókna, skórki i nasiona z warzyw i owoców powinny by
ć
usuni
ę
te.
Gotowane ro
ś
liny str
ą
czkowe nale
ż
y przeci
ś
n
ąć
przez sitko w celu usuni
ę
cia skórek.
Pokarmy przygotowane w domu mog
ę
by
ć
trzymane w lodówce do 2 dni lub mro
ż
one w małych ilo
ś
ciach
do pó
ź
niejszego wykorzystania.
Miód i syrop kukurydziany nie powinny by
ć
podawane dzieciom przed uko
ń
czeniem 1 r
ż
., poniewa
ż
zawieraj
ą
zarodniki laseczki jadu kiełbasianego, które mog
ą
spowodowa
ć
botulizm niemowl
ą
t (2, 82).
(Miód jest przewa
ż
nie wykluczony z diety wega
ń
skiej).
Szpinak, buraczki, rzodkiew, marchewki i odmiany kapusty warzywnej tzw. collard greens przygotowane
w domu b
ą
d
ź
z puszki nie powinny by
ć
podawane niemowl
ę
tom przed 4 m
ż
., gdy
ż
poziom azotanów w
tych warzywach mo
ż
e spowodowa
ć
methemoglobinemi
ę
(2).
Masła orzechowe i z innych nasion nie powinny by
ć
podawana na chlebie czy krakersach przez
uko
ń
czeniem 1 r
ż
. ze wzgl
ę
du na ryzyko zadławienia; w rodzinach z siln
ą
skłonno
ś
ci
ą
do alergii nie
powinno si
ę
podawa
ć
dzieciom orzechów przez uko
ń
czeniem 3 r
ż
. (2)
Tab. Wytyczne dotycz
ą
ce przygotowywania w domu jedzenia dla wega
ń
skich niemowl
ą
t.

ALERGIE
Chociaż wiele pokarmów może powodować reakcje alergiczne u niemowląt, dzieci
wegańskie znajdują się prawdopodobnie w grupie obniżonego ryzyka, gdyż nie spożywają mleka
krowiego, które jest głównym powodem alergii u małych dzieci. Produkty, które mogą najłatwiej
wywołać alergię u wegańskich niemowląt to masła orzechowe, groszek zielony, owoce cytrusowe,
produkty z kukurydzy i soi (także sojowe mleko modyfikowane) i pszenica. Tak jak u każdego
dziecka, stałe pokarmy powinny być wprowadzane w postaci jednoskładnikowych posiłków,
pojedynczo, w tygodniowych odstępach, co pozwala na zidentyfikowanie alergii pokarmowych (2).
U zdrowych niemowląt, sojowe mleko modyfikowane może rzadziej prowokować reakcje
alergiczne niż modyfikowane mleko krowie (83). Jednakże, wśród dzieci w grupie wysokiego ryzyka,
sojowe mleko modyfikowane zdaje się nie mieć żadnej przewagi nad modyfikowanym mlekiem
krowim w profilaktyce i zapobieganiu objawom alergicznym (84).
Według wytycznych Amerykańskiej Akademii Pediatrii (2) odpowiednie kroki, które należy
podjąć w celu zmniejszenia ryzyka alergii u wegańskich niemowląt z grupy podwyższonego ryzyka,
obejmują: 1) karmienie wyłącznie piersią przez pierwsze 4 do 6 miesięcy; 2) wyeliminowanie
wszystkich orzechów z diety matki; 3) niewprowadzanie orzechów do diety dziecka przed
ukończeniem 3 roku życia.
Wczesne wprowadzenie do diety mleka krowiego, czy to naturalnego, czy w postaci mleka
modyfikowanego dla niemowląt, wiąże się nie tylko z podwyższeniem ryzyka wystąpienia alergii, ale
także z podwyższonym ryzykiem wystąpienia insulinozależnej cukrzycy u genetycznie
predysponowanych dzieci (85, 86), choć nie wszystkie badania to potwierdzają (87). Nie jest jasne
czy powyższe odkrycia wskazują na ochronny wpływ karmienia piersią, czy potencjalne ryzyko
związane z karmieniem dzieci mlekiem krowim. Niektóre wyniki badań wpływu śruty sojowej na
rozwój cukrzycy u gryzoni sugerują, że także soja może wpływać na zwiększenie ryzyka wystąpienia
cukrzycy (88-90). To sugerowałoby, że efekt ochronny ma raczej karmienie piersią, niż unikanie
pewnych białek. Jednakże, obecnie nie istnieją żadne dane epidemiologiczne wskazujące na związek
między soją a ryzykiem cukrzycy. Badania na zwierzętach sugerują, że między izolatem białek
sojowych, głównym składnikiem sojowego mleka modyfikowanego dla niemowląt, a ryzykiem
wystąpienia cukrzycy nie istnieje żaden związek (89, 91).
DIETY MAKROBIOTYCZNE DLA NIEMOWL
ĄT
Diety makrobiotyczne często znacząco różnią się od typowych diet wegańskich, a ponieważ
główną zasadą makrobiotyki jest jedzenie w zgodzie z lokalnym środowiskiem, ten sposób
odżywiania jest bardzo zróżnicowany w zależności od regionu. Diety te zazwyczaj nie zawierają
mięsa (chociaż często zawierają owoce morza) ani nabiału oraz ograniczają spożycie owoców i
pewnych warzyw. Jeśli dieta makrobiotyczna zostanie uważnie zaplanowana może być odpowiednia
dla niemowląt. Jednakże, szereg badań wykazało poważne niedobory składników odżywczych,
zwłaszcza wit. B-12, wapnia i wit. D u karmionych piersią i już odstawionych od piersi niemowląt
ż
ywionych wg diety makrobiotycznej. W niektórych makrobiotycznych rodzinach częstą praktyką po
odstawieniu od piersi jest wprowadzanie pokarmu opartego na zbożach, pozbawionego wit. B-12 i
ubogiego w wapń. Ponieważ makrobiotycy często nie spożywają produktów przetworzonych, w tym
wielu dostępnych na rynku wegańskich produktów fortyfikowanych, dieta ta może być znacząco
bardziej restrykcyjna niż typowa dieta wegańska i istnieje większe prawdopodobieństwo, że

doprowadzi do niedoborów składników odżywczych. Dlatego też jest niezbędne, aby dietetycy
zapoznali się z zasadami diety makrobiotycznej, zidentyfikowali potencjalne problemy, i opracowali
akceptowalne strategie planowania jadłospisu, które pozwolą dostarczyć odpowiednią ilość substancji
odżywczych. Ostatnio, liderzy makrobiotycznej społeczności zgodzili się zalecać rodzinom
wprowadzenie mleka krowiego do diety dzieci, aby zapewnić im odpowiednią ilość wapnia i wit. D
(92). Łatwiejszą do zaakceptowania alternatywą dla większości rodzin makrobiotycznych byłoby
używanie wzbogaconego mleka sojowego, gdyż produkty sojowe (miso i tofu) są w diecie
makrobiotycznej bardzo popularne.
WNIOSKI
Odpowiednio zaplanowane diety wegańskie mogą zaspokajać zapotrzebowanie na składniki
odżywcze niemowląt i dzieci i zapewniać im normalny rozwój. Wegańskie niemowlęta poniżej 1 rż.,
podczas każdego karmienia mlekiem, powinny zasadniczo otrzymywać mleko matki. Inną opcją jest
sojowe mleko modyfikowane dla niemowląt. Dodatkowe pokarmy nie powinny być wprowadzane
przed 4-6 mż. Niemowlęta powinny otrzymywać suplementy przepisane przez lekarza. W przypadku
wegańskich niemowląt karmionych piersią będą wśród nich żelazo, wit. D, B12 i cynk. Dietetycy
mogą odgrywać kluczową rolę pomagając rodzicom w zapewnieniu niemowlętom zróżnicowanej
diety wegańskiej, zawierającej odpowiednią ilość składników odżywczych i kalorii.
Tłumaczenie: Sandra Wierzbicka
Korekta: Katarzyna Biernacka
Bibliografia
1. The American Dietetic Association. Position on of The American Dietetic Association: Vegetarian
diets. J Am Diet Assoc. 1997; 97:1317-1321.
2. Committee on Nutrition, American Academy of Pediatrics. Pediatric Nutrition Handbook. 4th ed.
Elk Grove Village, IL: AAP; 1998.
3. O’Connell JM, Dibley MJ, Sierra J, Wallace B, Marks JS, Yip R. Growth of vegetarian children:
The Farm study. Pediatrics. 1989;84:475-481.
4. Sanders TAB, Reddy S. The influence of a vegetarian diet on the fatty acid composition of human
milk and the essential fatty acid status of the infant. J Pediatr. 1992; 120(suppl): S71-S77.
5. Dagnelie PC, van Staveren WA, van Klaveren JD, Burema J. Do children on macrobiotic diets
show catch-up growth? Eur J Clin Nutr.1988; 42: 1007-1016.
6. Dagnelie PC, van Staveren WA, Vergote FJVRA, Burema J, van’t Hof MA, van Klaveren JD,
Hautvast JGAJ. Nutritional status of infants aged 4 to 18 months on macrobiotic diets and matched
omnivorous control infants: a population-based mixed-longitudinal study. II. Growth and
psychomotor development. Eur J Clin Nutr. 1989; 43: 325-338.
7. Jacobs C, Dwyer JT. Vegetarian children: appropriate and inappropriate diets. Am J Clin
Nutr.1988; 48(suppl): 811-818.
8. American Academy of Pediatrics, Committee on Nutrition. Soy proteinbased formulas:
recommendations for use in infant feeding. Pediatrics. 1998; 101: 148-153.
9. Lonnerdal B. Effects of maternal dietary intake on human milk composition. J Nutr. 1986; 116:
499-513.
10. Sanders TAB, Ellis FR, Dickerson JWT. Studies of vegans: The fatty acid composition of plasma
choline phosphoglycerides erythrocytes, adipose tissue, and breast milk, and some indicators of

susceptibility to ischemic heart disease in vegans and omnivore controls. Am J Clin Nutr.
1978;31:805-813.
11. Specker BL, Wey HE, Miller D. Differences in fatty acid composition of human milk in
vegetarian and nonvegetarian women: Long term effect of diet. J Pediatr Gastroenterol Nutr.
1987;6:764-768
12. Dagnelie PC, van Staveren WA, Roos AH, Tuinstra LGM, Burema J. Nutrients and contaminants
in human milk from mothers on macrobiotic and omnivorous diets. Eur J Clin Nutr. 1992; 46: 355-
366.
13. Specker BL. Nutritional concerns of lactating women consuming vegetarian diets. Am J Clin
Nutr. 1994; 59(suppl): 1182S-1186S.
14. Specker BL, Tsang RC. Effect of race and diet on human-milk vitamin D and 25 hydroxyvitamin
D. Am J Dis Child. 1985;139:1134-1137.
15. Specker BL, Tsang RC. Cyclical serum 25 hydroxyvitamin D concentrations paralleling sunshine
exposure in exclusively breast-fed infants. J Pediatr. 1987;110:744-747.
16. Specker BL, Miller D, Norman EJ, Greene H, Hayes KC. Increased urinary methylmalonic acid
excretion in breast-fed infants of vegetarian mothers and identification of an acceptable dietary source
of vitamin B12. Am J Clin Nutr. 1988;47:89-92
17. Specker BL, Black A, Allen L, Morrow F. Vitamin B12: Low milk concentrations are related to
low serum concentrations in vegetarian women and to methylmalonic aciduria in their infants. Am J
Clin Nutr. 1990;52:1073-1076.
18. Hughs J and Sanders TAB. Riboflavin levels in the diet and breast milk of vegans and omnivores.
Proc Nutr Soc. 1979;38:95A.
19. Rana SK, Sanders, TAB. Taurine concentrations in the diet, plasma, and urine and breast milk of
vegans compared with omnivores. Br J Nutr. 1986;56:17-27.
20. Rassin DK, Sturman JA, Gaull GE. Taurine and other free amino acids in milk of man and other
mammals. Early Hum Dev. 1978; 2: 1-13.
21. Lombard KA, Olson AL, Nelson SE, Rebouche CJ. Carnitine status of lactoovovegetarians and
strict vegetarian adults and children. Am J Clin Nutr. 1989; 50: 301-306.
22. Rebouche CJ. Carnitine. In: Shils ME, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in
Health and Disease. 9th ed. Baltimore, MD: Williams & Wilkins; 1999: 505-512.
23. Mitchell ME, Snyder EA. Dietary carnitine effects on carnitine concentrations in urine and milk in
lactating women. Am J Clin Nutr. 1991; 54:814-20.
24. Franke AA, Custer LJ. Daidzein and genistein concentrations in human milk after soy
consumption. Clin Chem. 1996;42:955-964.
25. Setchell KDR, Zimmer-Nechemias L, Cai J, Heubi J. Exposure of infants to phytoestrogens from
soy infant formulas. Lancet. 1997; 350: 23-27.
26. Hergenrather J, Hlady G, Wallace B, Savage E. Pollutants in breast milk of vegetarians [letter]. N
Engl J Med. 1981; 304: 792.
27. Brenner RR, Peluffo RO. Regulation of unsaturated fatty acid biosynthesis. Biochim Biophys
Acta 1969; 176: 471-479.
28. Emken EA, Adlof RO, Gulley RM. Dietary linoleic acid influences desaturation and acylation of
deuterium-labeled linoleic and ALAs in young adult males. Biochem Biophys Acta. 1994; 1213:277-
288.
29. Melchart HU, Limsathayourat N, Mihajlovic H, Eichberg J, Thefeld W, Rottka H. Fatty acid
patterns in triglycerides, diglycerides, free fatty acids, cholesteryl esters, and phosphatidylcholine in
serum from vegetarians and nonvegetarians. Atherosclerosis. 1987;65:159-166.
30. Baur LA, O’Connor J, Pan DA, Wu BJ, O’Connor MJ, Storlien LH. Relationships between the
fatty acid composition of muscle and erythrocyte membrance phospholipid in young children and the
effect of type of infant feeding. Lipids 2000; 35:77-82.
31. Uauy R, Peirano P, Hoffman D, Mena P, Birch D, Birch E. Role of essential fatty acids in the
function of the developing nervous system. Lipids. 1996;3:S167-S176.
32. Agostoni C, Trojan S, Bellu R, Riva E, Giovannini M. Neurodevelopmental quotient of healthy
term infants and feeding practice: The role of long-chain polyunsaturated fatty acids. Pediatr Res.
1995;38:262-266.

33. Agostoni C, Trojan S, Bellu R, Riva E, Bruzzese MG, Giovannini M. Developmental quotient at
24 months and fatty acid composition of diet in early infancy: a follow up study. Arch Dis Child.
1997;76:421-424.
34. Birch EE, Garfield S, Hoffman DR, Uauy R, Birch DG. A randomized controlled trial of early
dietary supply of long-chain polyunsaturated fatty acids and mental development in term infants. Dev
Med Child Neurol. 2000; 42:174-181.
35. SanGiovanni JP, Berkey CS, Dwyer JT, Colditz GA. Dietary essential fatty acids, long-chain
polyunsaturated fatty acids, and visual resolution acuity in healthy fullterm infants: a systematic
review. Early Hum Dev. 2000; 57:165- 188.
36. Birch EE, Hoffman DR, Uauy R, Birch DG, Prestidge C. Visual acuity and the essentiality of
docosahexaenoic acid and arachidonic acid in the diet of term infants. Pediatr Res. 1998; 44:201-209.
37. Cunnane SC, Francescutti V, Brenna JT, Crawford MA. Breast-fed infants achieve a higher rate of
brain and whole body docosahexaenoate accumulation than formula-fed infants not consuming dietary
docosahexaenoate. Lipids. 2000; 35:105-111.
38. Jensen CL, Prager TC, Fraley JK, Chen H, Anderson RE, Heird WC. Effect of dietary
linoleic/alpha-linolenic acid ratio on growth and visual function of term infants. J Pediatr.
1997;131:200-209.
39. Salem N, Jr., Wegher B, Mena P, Uauy R. Arachidonic and docosahexaenoic acids are
biosynthesized from their 18 carbon precursors in human infants. Proc Natl Acad Sci USA. 1996;
93:49-54.
40. Carnielli VP, Wattimean DJL, Luijendijk IHT, Boerlaget A, Degenhart HJ, Sauer PJ. The very
low birthweight premature infant is capable of synthesizing arachidonic and 22:6(n-3) from linoleic
and linolenic acids. Pediatr Res 1996;40:169-174.
41. Jensen CL, Maude M, Anderson RE, Heird WC. Effect of docosahexaenoic acid supplementation
of lactating women on the fatty acid compostion of breast milk lipids and maternal and infant plasma
phospholipids. Am J Clin Nutr 2000;71(suppl):292S-299S.
42. Makrides M, Neumann MA, Gibson RA. Effect of maternal docosahexaenoic acid (DHA)
supplementation on breast milk composition. Eur J Clin Nutr. 1996; 50:352-357.
43. The American Dietetic Association. Position on Promotion of breastfeeding. J Am Diet Assoc.
1997; 97: 662-666.
44. American Academy of Pediatrics, Work Group on Breastfeeding. Breastfeeding and the use of
human milk. Pediatrics. 1997; 100: 1035-1039.
45. Sanders TAB. Growth and development of British vegan children. Am J Clin Nutr. 1988; 48:822-
825.
46. Lasekan JB, Ostrom KM, Jacobs JR, Blatter MM, Ndife LI, Gooch WM, Cho S. Growth of
newborn, term infants fed soy formulas for 1 year. Clin Pediatr. 1999; 38:563-571.
47. Irvine C, Fitzpatrick M, Robertson I, Woodhams D. The potential adverse effects of soybean
phytoestrogens in infant feeding. N Z Med J. 1995; 108:208-209.
48. Robertson IGC. Phytoestrogens: toxicity and regulatory recommendations. Proc Nutr Soc N Z.
1995; 20: 35-42.
49. Setchell KDR. Phytoestrogens: the biochemistry, physiology, and implications for human health
of soy isoflavones. Am J Clin Nutr. 1998; 68(suppl): 1333S-1346S.
50. Badger TM, Hakkak R, Shelnutt SR, Ronis MJJ, Rowlands JC. Long-term use of dietary soy
protein isolates: Lack of apparent toxic effects? [abstr] J Nutr. 2000;130(suppl):678S-679S.
51. Quak SH, Tan SP. Use of soy-protein formulas and soyfood for feeding infants and children in
Asia. Am J Clin Nutr. 1998; 69(suppl):1444S-1446S.
52. Businco L, Bruno G, Giampietro PG, Furcolo G, Lucaroni F. No estrogenic hormonal effects in
children fed soy formula long term [abstr]. J Nutr 2000; 130:710S-711S.
53. Ostrom KM, Lasekan JB. Normal growth and immune function of newborn term infants fed soy
formulas for one full year [abstr]. J Nutr. 2000; 130:709S.
54. Zmora E, Gorodischer R, Bar-Ziv J. Multiple nutritional deficiencies in infants from a strict
vegetarian community. Am J Dis Child. 1979; 133: 141- 144.
55. Shinwell ED, Gorodischer R. Totally vegetarian diets and infant nutrition. Pediatrics. 1982; 70:
582-586.
56. Roussow JE. Kwashiorkor in North America. Am J Clin Nutr. 1989; 49: 588-592.

57. Dagnelie PC, van Staveren WA, Verschuren SAJM, Hautvast JGAJ. Nutritional status of infants
aged 4 to 18 months on macrobiotic diets and matched omnivorous control infants: a population-
based mixed-longitudinal study. !. Weaning pattern, energy and nutrient intake. Eur J Clin Nutr. 1989;
43: 311-323.
58. Shohat M, Levy I, Levy Y, Nitzan M. Nutritional complication in an infant fed exclusively on
homemade sesame seed emulsion. J Am Coll Nutr. 1989; 8: 167-169.
59. American Academy of Pediatrics, Committee on Nutrition. The use of whole cow’s milk in
infancy. Pediatrics. 1992; 89: 1105-1109.
60. Macfarlane BJ, van der Riet WB, Bothwell TH, Bynes RD, Siegenberg D. Effect of traditional
oriental soy products on iron absorption. Am J Clin Nutr. 1990; 51: 873-880.
61. Sandstrom B, Kivisto B, Cederblad A. Absorption of zinc from soy protein meals in humans. J
Nutr. 1987; 117: 321-327.
62. American Academy of Pediatrics, Committee on Nutrition. Cholesterol in childhood. Pediatrics.
1998; 101: 141-147.
63. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Thiamin,
Riboflavin, Niacin, Vitamin B-6, Folate, Vitamin B-12, Pantothenic Acid, Biotin, and Choline.
Washington, DC: National Academy Press, 1998.
64. Moser PB, Reynolds RD. Dietary zinc intake and zinc concentrations of plasma, erythrocytes, and
breast milk in antepartum and postpartum lactating and nonlactating women: a longitudinal study. Am
J Clin Nutr 1983; 38:101-108.
65. Casey CE, Neville MC, Hambidge KM. Studies in human lactation: secretion of zinc, copper, and
manganese in human milk. Am J Clin Nutr 1989; 49:773-785.
66. Sandstrom B, Arvidsson B, Cederblad A, Bjorn-Rasmussen E. Zinc absorption from composite
meals I. The significance of wheat extraction rate, zinc, calcium, and protein content in meals based
on bread. Am J Clin Nutr 1980;33:739-745.
67. Gibson RS, Yeudall F, Drost N, Mtitimuni B, Cullinan T. Dietary interventions to prevent zinc
deficiency. Am J Clin Nutr 1998;68(suppl):484S-487S.
68. Allen LH. Zinc and micronutrient supplements for children. Am J Clin Nutr 1998;
68(suppl):495S-498S.
69. Krebs NF. Zinc supplementation during lactation. Am J Clin Nutr 1998; 68(suppl):509S-512S.
70. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Vitamin A,
Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel,
Silicon, Vanadium, and Zinc. Washington, DC: National Academy Press, 2001.
71. Specker BL, Valanis B, Hertzberg V, Edwards N, Tsang RC. Sunshine exposure and serum-25-
hydroxyvitamin D concentrations in exclusively breast-fed infants. J Pediatr. 1985; 107: 372-376.
72. Smaha MB. Nutrition management of the full-term infant. In: Williams CP, ed. Pediatric Manual
of Clinical Dietetics. Chicago, IL: American Dietetic Association; 1998: 49-66.
73. Smith MM, Lifshitz F. Excess fruit juice consumption as a contributing factor in nonorganic
failure to thrive. Pediatrics. 1994; 93: 438-443.
74. Fuchs GJ, Farris RP, DeWier M, Hutchinson S, Strada R, Suskind RM. Effect of dietary fat on
cardiovascular risk factors in infancy. Pediatrics. 1994;93:756-763.
75. Lagstrom H, Jokinen E, Seppanen R, Ronnemaa T, Viikari J, Valimaki I, Venetoklis J,
Myyrinmaa A, Niinikoski H, Lapinleimu H, Simell O. Nutrient intakes by young children in a
prospective randomized trial of a low-saturated fat, low-cholesterol diet: The STRIP Baby Project.
Arch Pediatr Adolesc Med. 1997;151:181-188.
76. Lagstrom H, Seppanen R, Jokinen E, Niinikoski H, Ronnemaa T, Viikari J, Simell O. Influence of
dietary fat on the nutrient intake and growth of children from 1 to 5 y of age: the Special Turku
Coronary Risk Factor Intervention Project. Am J Clin Nutr. 1999; 69: 516-523.
77. Mangels AR. Nutrition management of the vegetarian child. In: Williams CP, ed. Pediatric
Manual of Clinical Dietetics. Chicago, IL: American Dietetic Association; 1998: 115-132.
78. Food and Nutrition Board. Recommended Dietary Allowances. 10th ed. Washington, DC:
National Academy Press;1989.
79. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Calcium,
Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington, DC: National Academy Press, 1997.

80. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Vitamin C,
Vitamin E, Selenium, and Carotenoids. Washington, DC: National Academy Press, 2000.
81. Messina M, Messina V. The Dietitian’s Guide to Vegetarian Diets. Issues and Applications.
Gaithersburg, MD: Aspen Publishers, Inc., 1996.
82. Kautter DA, Lilly T, Jr., Solomon HM, Lynt RK. Clostridium botulinum spores in infant foods: A
survey. J Food Protection. 1982; 45: 1028.
83. Halpern SR, Sellars WA, Johnson RB, Anderson RB, Saperstein S, Reisch JS. Development of
childhood allergy in infants fed breast, soy, or cow milk. Allergy Clin Immunol. 1973;51:139-151.
84. Kjellman NI, Johansson SG. Soy versus cow’s milk in infants with biparental history of atopic
disease: development of atopic disease and immunoglobulins from birth to 4 years of age. Clin
Allergy. 1979;9:347-358.
85. Dahl-Jorgensen K, Honer G, Hanssen KF. Relationship between cow’s milk consumption and
incidence of IDDM in childhood. Diabetes Care. 1991;14:1081-1083.
86. Gerstein HC. Cow’s milk exposure and type 1 diabetes mellitus. Diabetes Care. 1993;17:13-19.
87. Norris JM, Scott FW. Meta analysis of infant diet and insulin dependent diabetes mellitus: Do
biases play a role? Epidemiology 1996;7:87-92.
88. Hoorfar J, Scott FW, Cloutier HL. Dietary plant materials and development of diabetes in the BB
rat. J Nutr 1991;121:908-16.
89. Elliot RB, Biddy N, Reddy S. Casein peptide precipitates diabetes in the non-obese diabetic
mouse and possibly in humans. In: Laron Z, Karp M eds. Genetic and Environmental Risk Factors for
Type 1 Diabetes (IDDM) Including a Discussion on the Autoimmnue Basis. London: Freund
Publishing House Ltd; 1992:57-62.
90. Scott FW. Food, diabetes, and immunology. In: Forse RA, Bell SJ, Blackburn GL, Kabbash LG,
eds. Diet, Nutrition, and Immunity. Boca Raton,FL: CRC Press; 1994: 71-92.
91. Coleman DL, Kuzava JE, Leiter EH. Effect of diet on incidence of diabetes in non-obese diabetic
mice. Diabetes. 1990;39:432-436.
92. Dagnelie PC, van Staveren WA. Macrobiotic nutrition and child health: Results of a population-
based, mixed-longitudinal cohort study in the Netherlands. Am J Clin Nutr. 1994; 59(suppl): 1187S-
1196S.
Wyszukiwarka
Podobne podstrony:
FAKTY I MITY NA TEMAT KARMIENIA NATURALNEGO, Dzieci, Niemowle
KONSPEKT DO NAUCZANIA NA TEMAT DIETY LEKKO STRAWNEJ BOGATOBIAŁKOWEJ, Konspekty, Dieta lekko strawna
KONSPEKT DO INDYWIDUALNEGO NAUCZANIA NA TEMAT DIETY UBOGOENERGETYCZNEJ W MIAŻDŻYCY I NADCIŚNIENIU TĘ
Vol 14 Podst wiedza na temat przeg okr 1
6 ODCHUDZANIE A NASZ ORGANIZM, Mity i fakty na temat odchudzania
Imelda Chłodna Kilka uwag na temat roli retoryki w kształceniu humanistycznym
informacja na temat kontroli finansowej i audytu wewnętrznego
fakty na temat jakania
Podstawowe informacje na temat zasad przylaczenia farm wiatrowych
Nibymagia, Tolkien, Inne teksty na temat twórczości, Felietony
Litania Loretańska w quenya, Tolkien, Inne teksty na temat twórczości, Nieposegregowane materiały o
Twoja miłość nad górami, POWOŁANIE, WIERSZE NA TEMAT POWOŁANIA
Adresy stron www na temat zastosowania komputera w terapii pedagogicznej, edukacja, WODN, komputer w
Tradycja Kościoła na temat jedności i nierozerwalności małżeństwa - doktryna i praktyka, Sem 1, TMR3
Kilka refleksji na temat budowania systemu motywowania uczniów do nauki
materiały do pracy na temat stresu
Wskazówki ogólne na temat techniki pisania
Ogólne informacje na temat systemu tachografów cyfrowych
więcej podobnych podstron