Spektroskopia Fluorescencyjna
Definicja: promienisty powrót cząsteczki z elektronowo
wzbudzonego stanu do stanu podstawowego
S
0
+ h
ν
S
1
S
1
S
0
+ h
ν
’
Cząsteczka w stanie wzbudzonym staje się innym indywiduum
chemicznym
Procesy rozpraszania
energii wzbudzenia
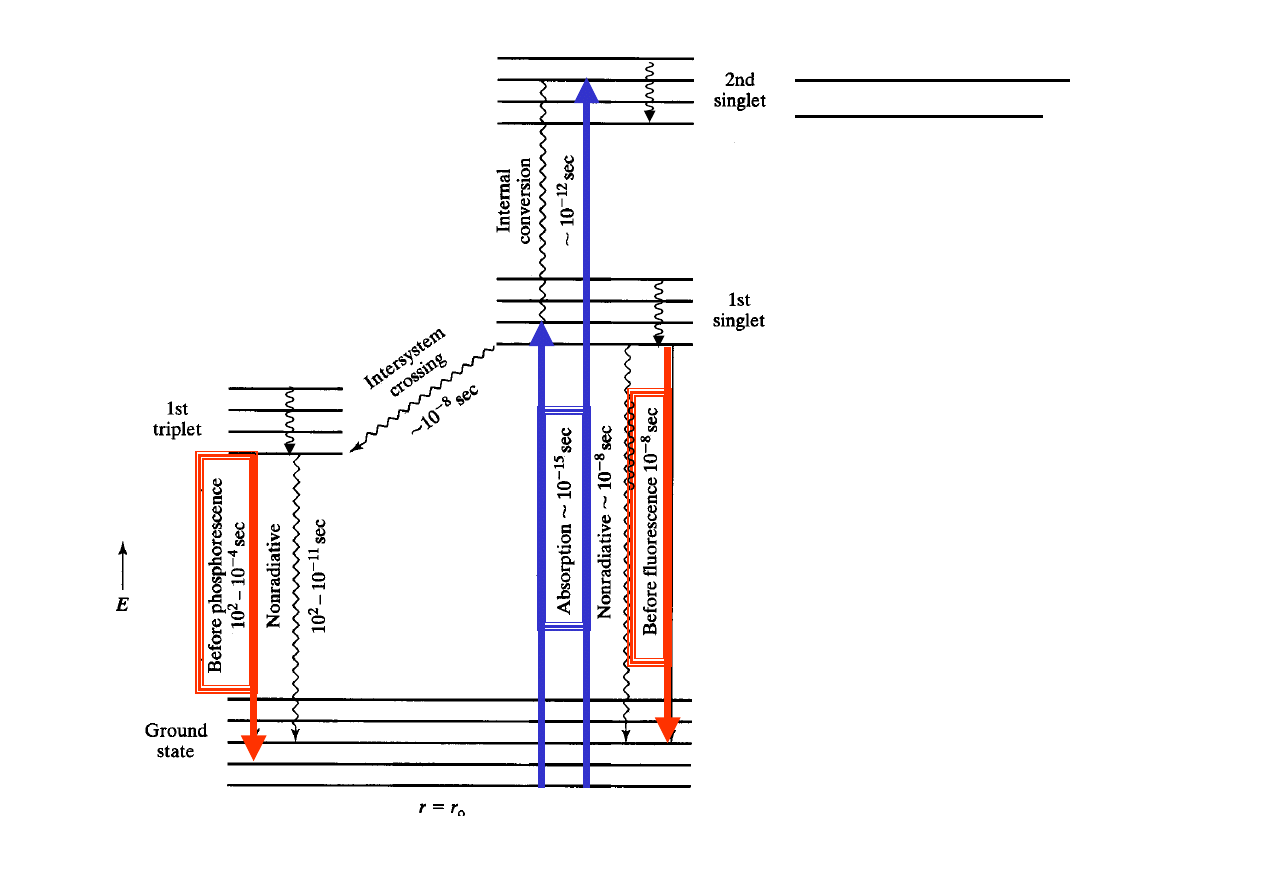
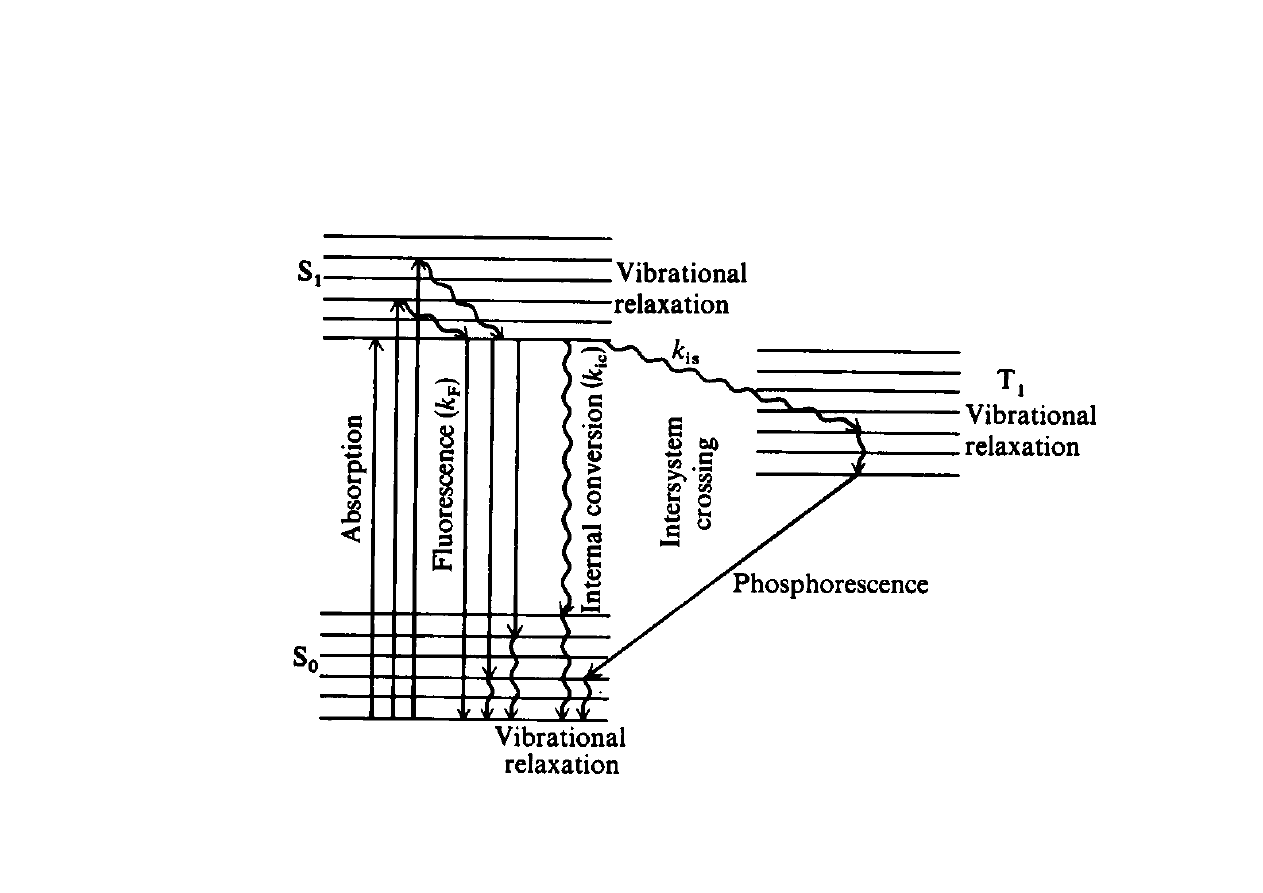
1. Promieniste
•
Fluorescencja - emisja ze
wzbudzonego stanu singletowego
S
1
S
0
(czas życia rzędu kilku
ns)
•
Fosforescencja - emisja z
trypletowego stanu wzbudzonego
poprzedzona
przejściem
ISC
(czas życia 10
-4
10
2
s)
2. Bezpromieniste
•
Relaksacja oscylacyjna
•
Konwersja wewnętrzna
(IC-
internal conversion) - przejścia
między wyższymi stanami o tej
samej multipletowości
•
Przejścia interkombinacyjne
(ISC – InterSystem Crossing) –
przejście między stanami o
różnej multipletowości, S
1
T
1
•
Przenoszenie energii
•
Wygaszanie
Diagram
Jabłońskiego
OR
OR
OR

1)
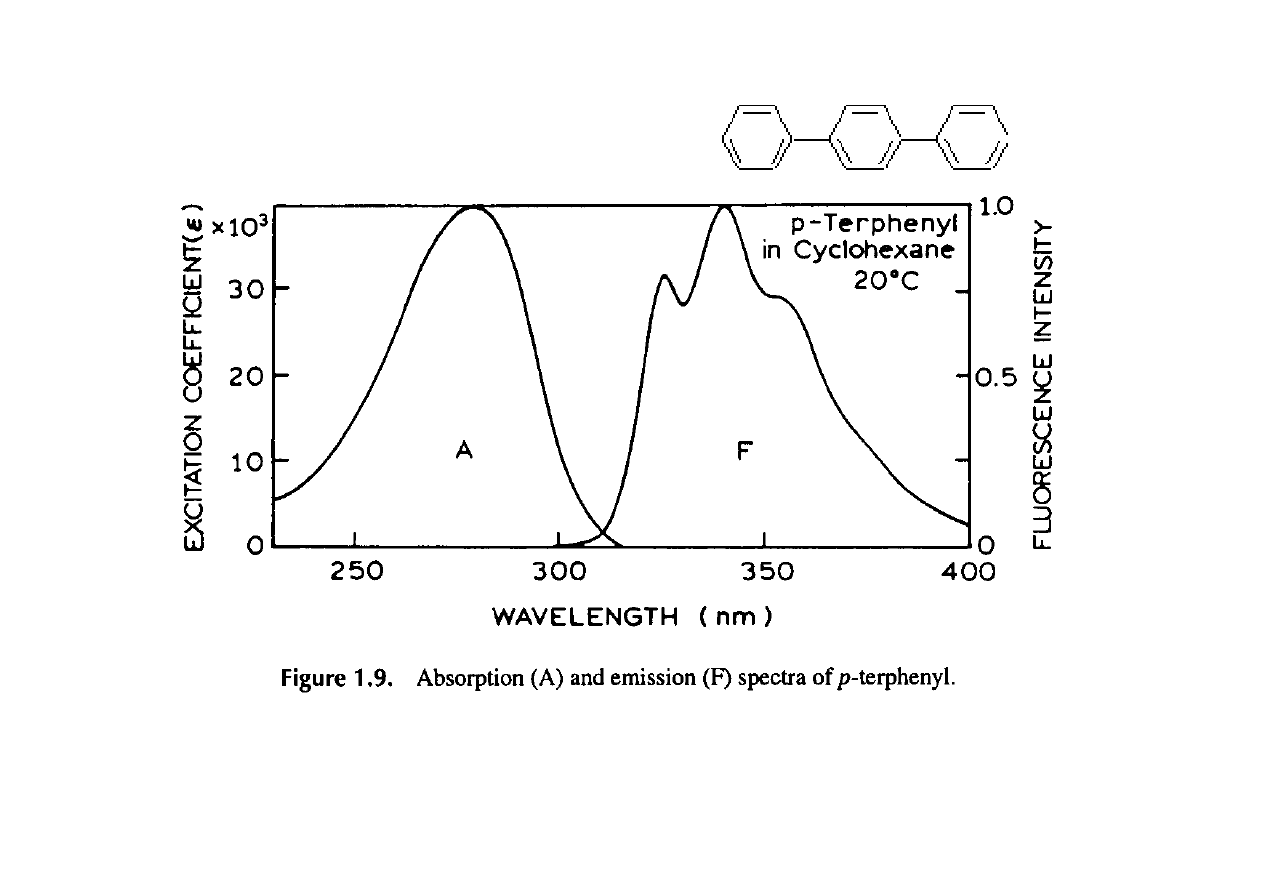
Różnica energii pasm wibracyjnych w widmie emisji
odpowiada rozkładowi poziomów oscylacyjnych w stanie
podstawowym
2)
Widmo absorpcji i widmo fluorescencji są położone
symetrycznie względem nakładających się na siebie pasm 0
0 (w
roztworach występuje rozsunięcie)
3)
Przesunięcie Stokesa – widmo emisyjne jest przesunięte
względem widma absorpcji w stronę fal dłuższych. Przesunięcie
wzrasta gdy geometria stanu wzbudzonego i stanu podstawowego
znacznie się różnią.
Reguła symetrii zwierciadlanej
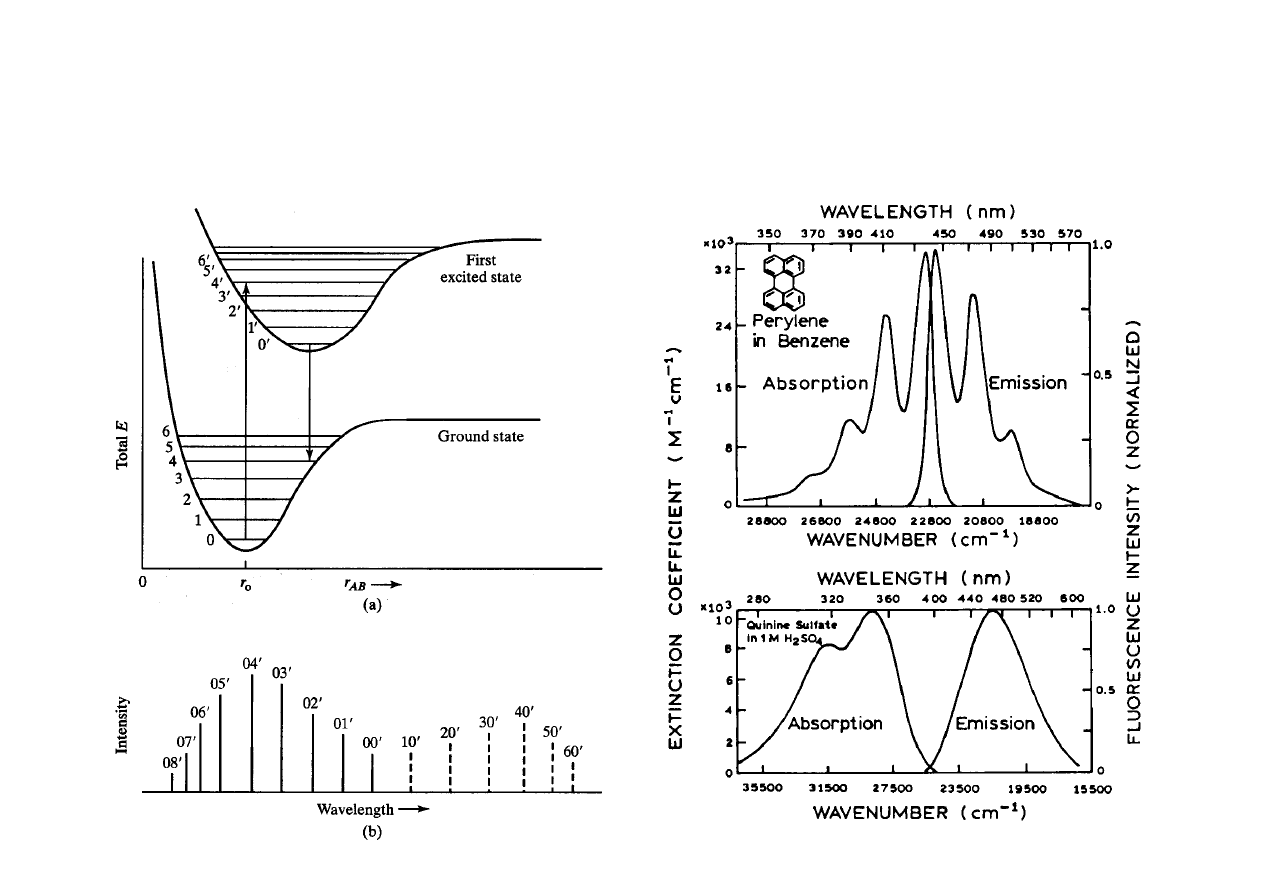
Widmo absorpcji i widmo emisji
Przejścia oscylacyjne –symetria zwierciadlana

Reguła Wawiłowa
Wydajność kwantowa fluorescencji (
φ
) nie zależy od długości fali światła
wzbudzającego
Zależy od względnej szybkości (czasów życia) wszystkich procesów
dezaktywacyjnych
(k = 1/
τ
)
Metoda pomiaru wydajności kwantowej fluorescencji
Względna – porównanie ze standardem (np siarczan chininy)
Wydajność kwantowa fluorescencji
F
Q
τ
τ
ϕ
=
+
+
+
=
]
[
k
k
k
k
k
Q
ISC
n
F
F
anych
zaabsorbow
fotonow
liczba
h
emitowanyc
fotonow
liczba
=
ϕ
A
Awz
wz
d
d
−
−
∞
∞
−
−
×
=
∫
∫
10
1
10
1
~
)
~
(
I
~
)
~
I(
0
wz
0
ν
ν
ν
ν
ϕ
ϕ
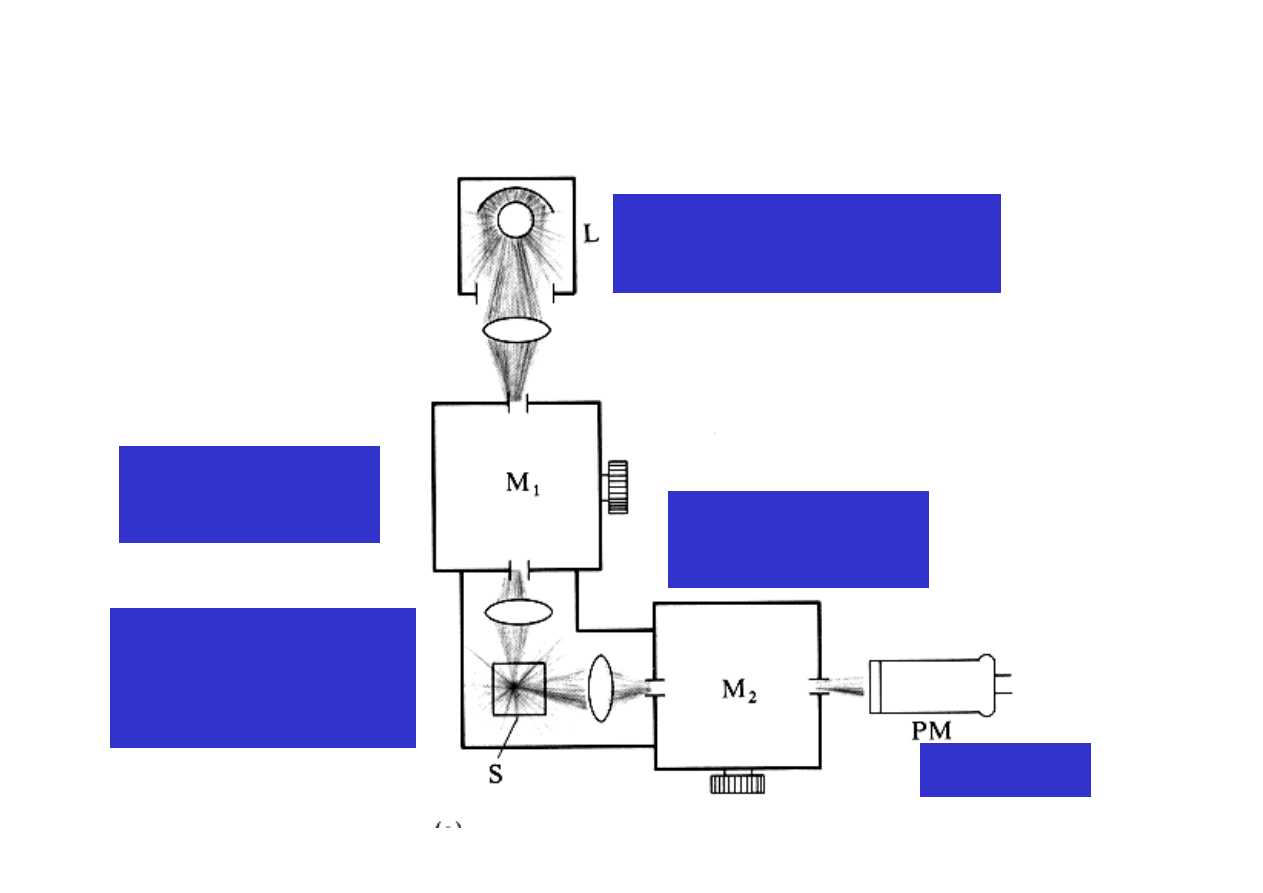
Aparatura – fluorymetr i spektrofluorymetr
Ź
ródło promieniowania
wzbudzającego
Monochromator
wzbudzający
Próbka w komorze
pomiarowej
(geometria 90
o
)
Monochromator
emisyjny
Detektor
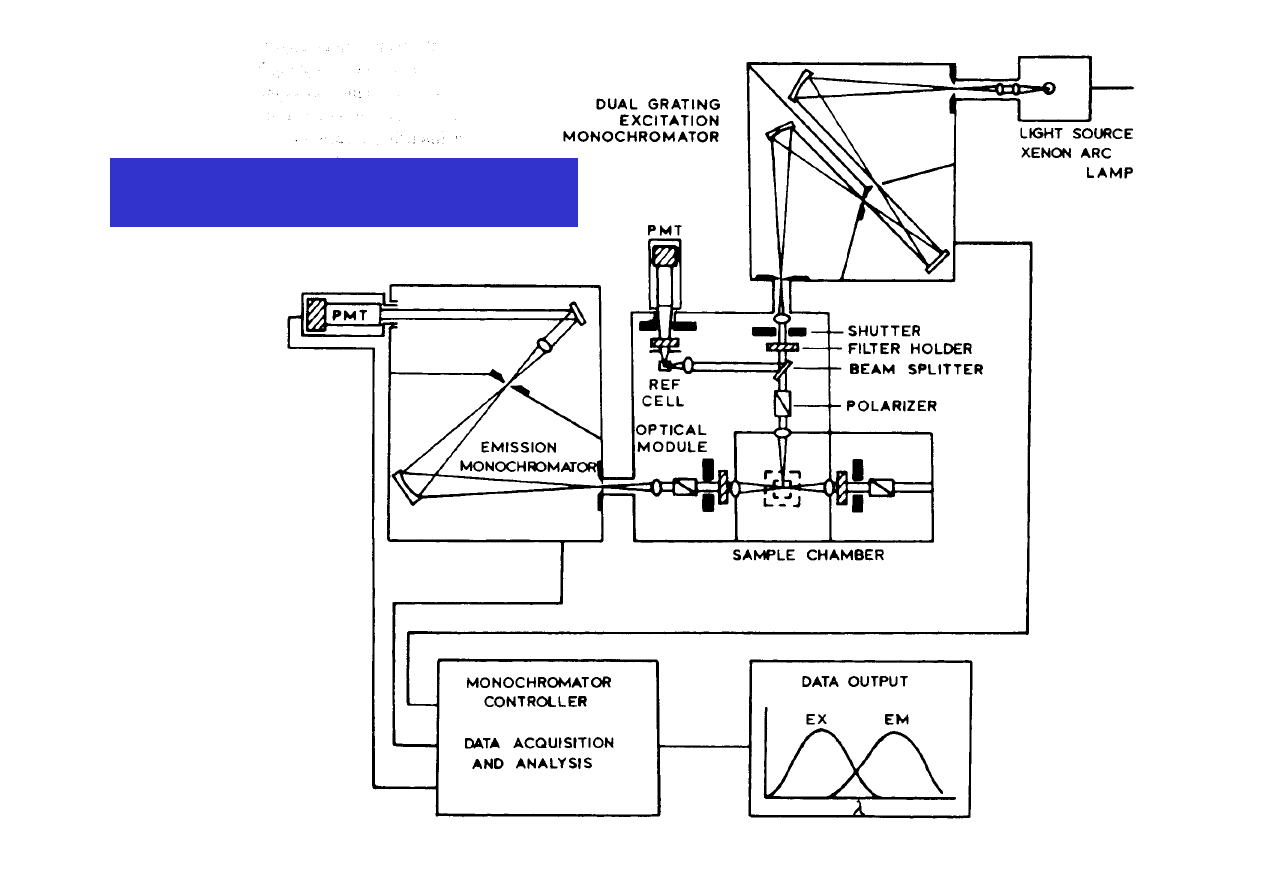
Spektrofluorymetr
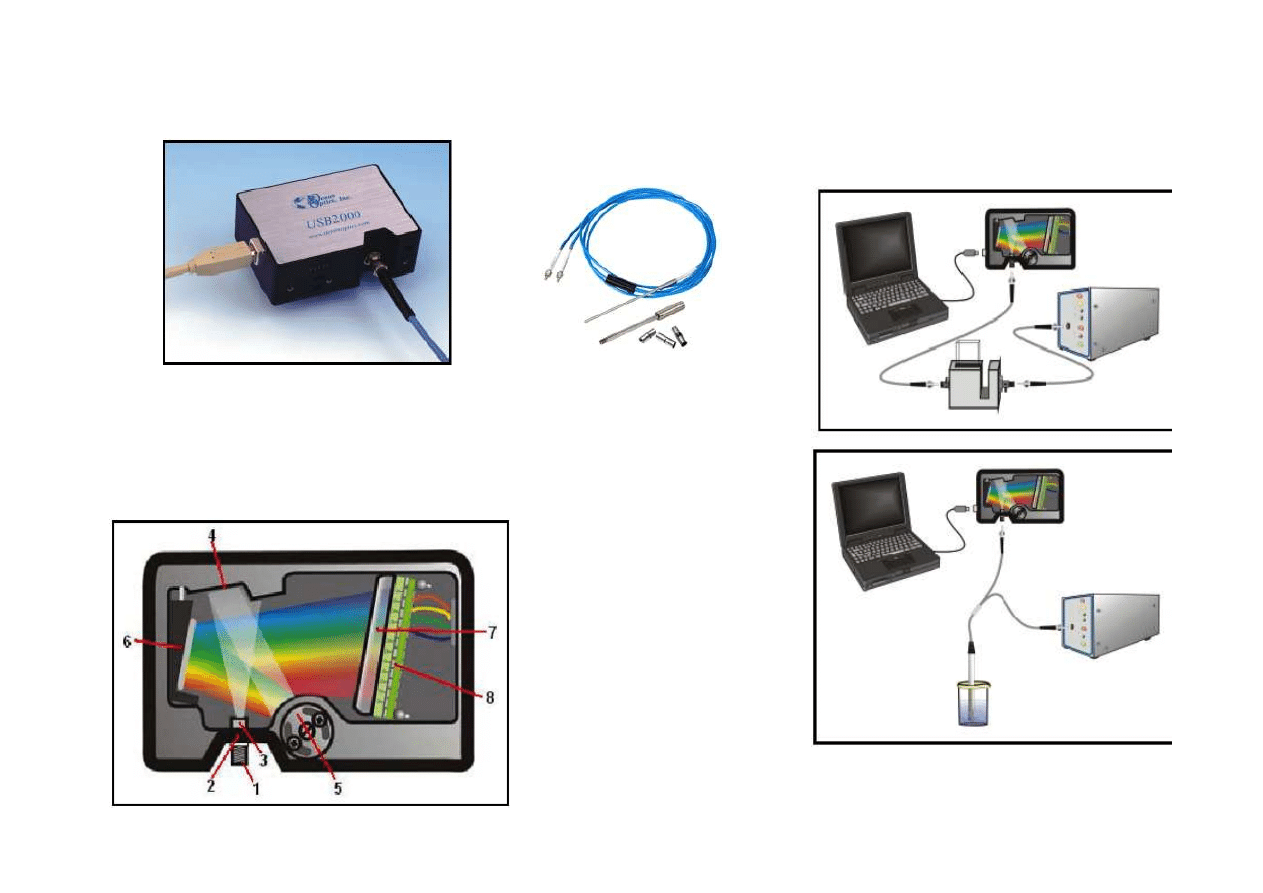
1.
Włókno optyczne
2.
Szczelina wejściowa
3.
Filtr
4.
Kolimator
5.
Siatka dyfrakcyjna
6.
Zwierciadło
7.
Płytka optyczna
8.
Detektor CCD
Miniaturowe spektrofotometry i spektrofluorymetry
Wymiary: 89 x 63 x 34.4 mm
Masa: 190 g (bez kabla)
Włókno optyczne
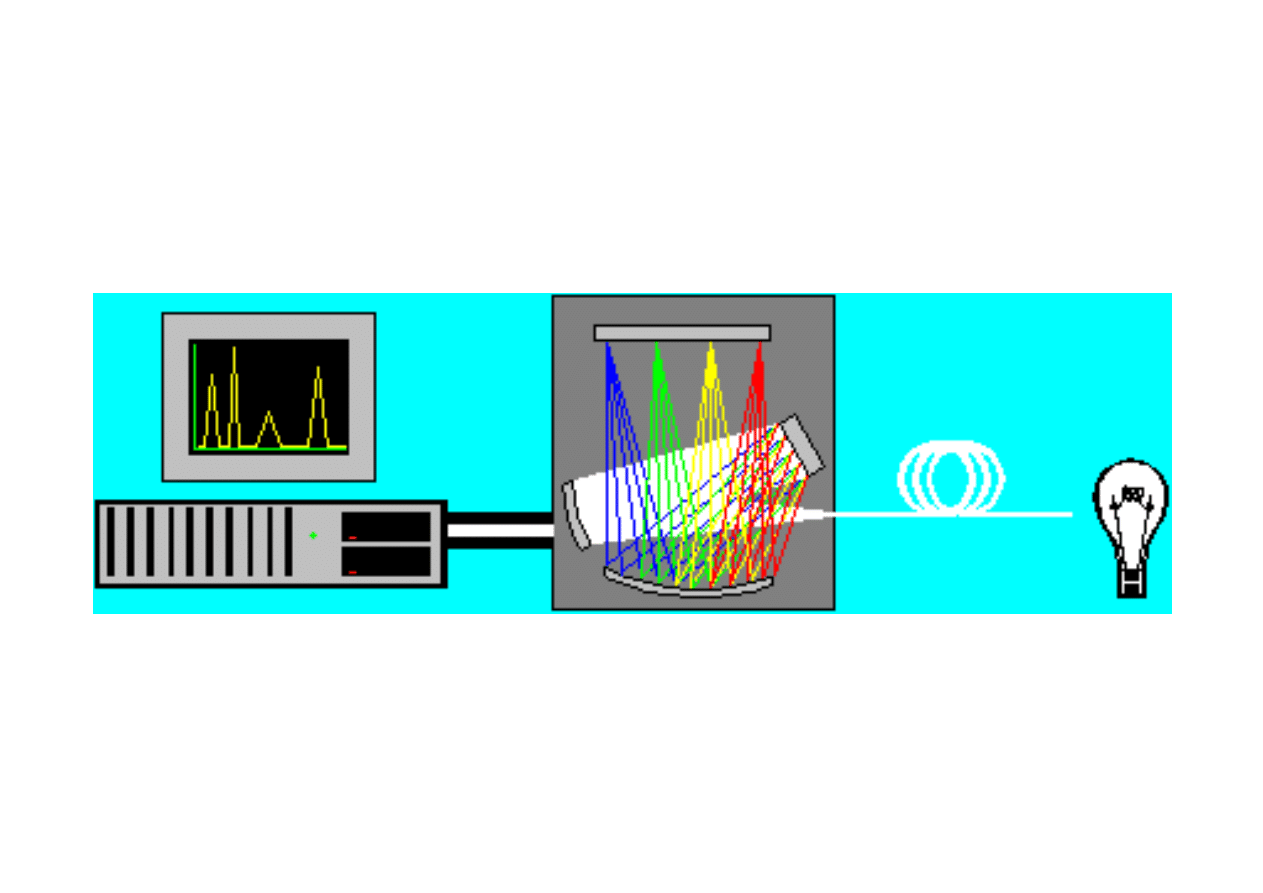
Zasada działania polichromatora w
miniaturowym spektrofluorymetrze
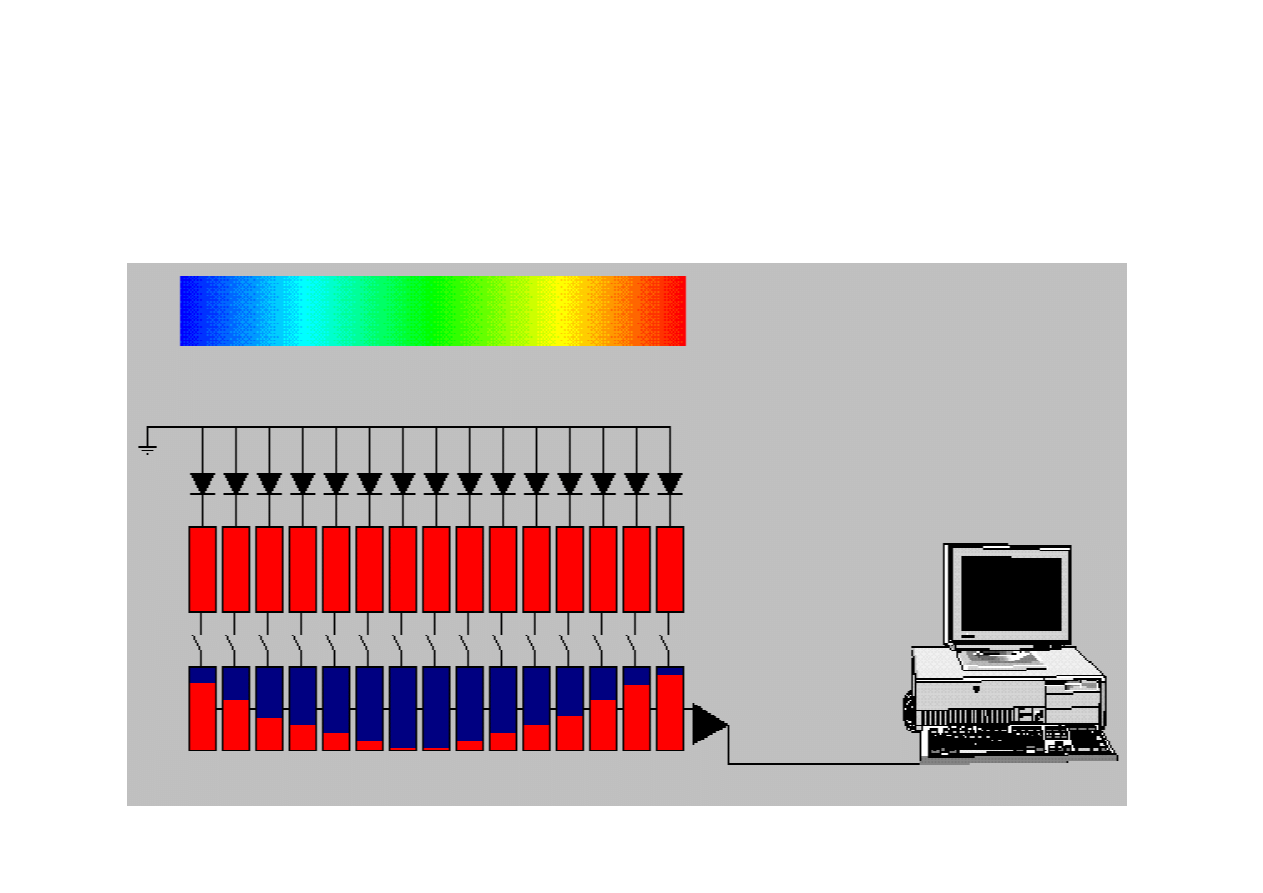
Zasada działania detektora diodowego CCD
w miniaturowym spektrofluorymetrze
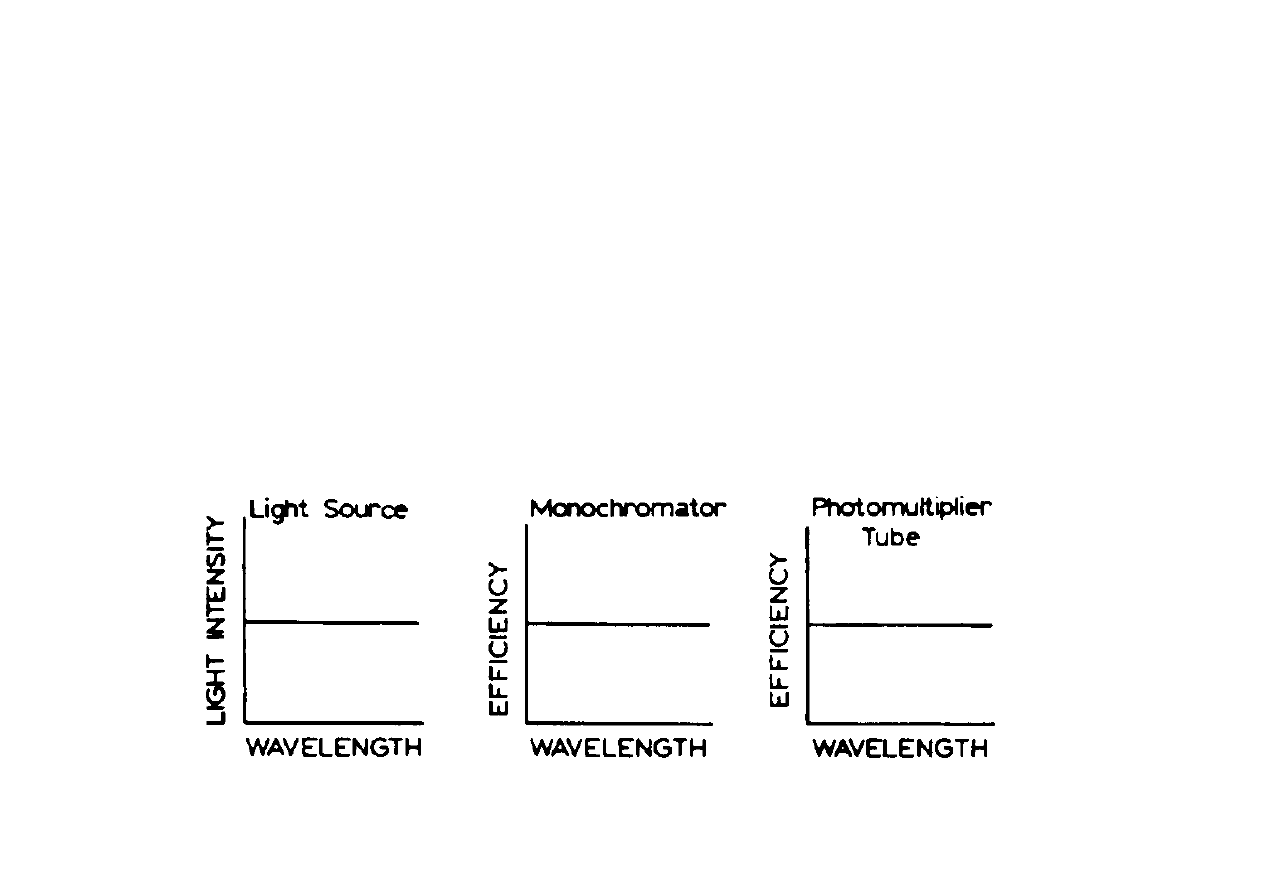
Idealny spektrofluorymetr powinien powinien posiadać
komponenty o następujących cechach:
Intensywność źródła niezależna od dł. fali
Wydajność monochromatora niezależna od
λ
Stała czułość detektoera w całym zakresie UV Vis.
Rzeczywistość jest daleka od ideału!!!
Chatrakterystyka spektrofluorymetru
Light Source
Intensywność lampy
zależy od długości
fali promieniowania
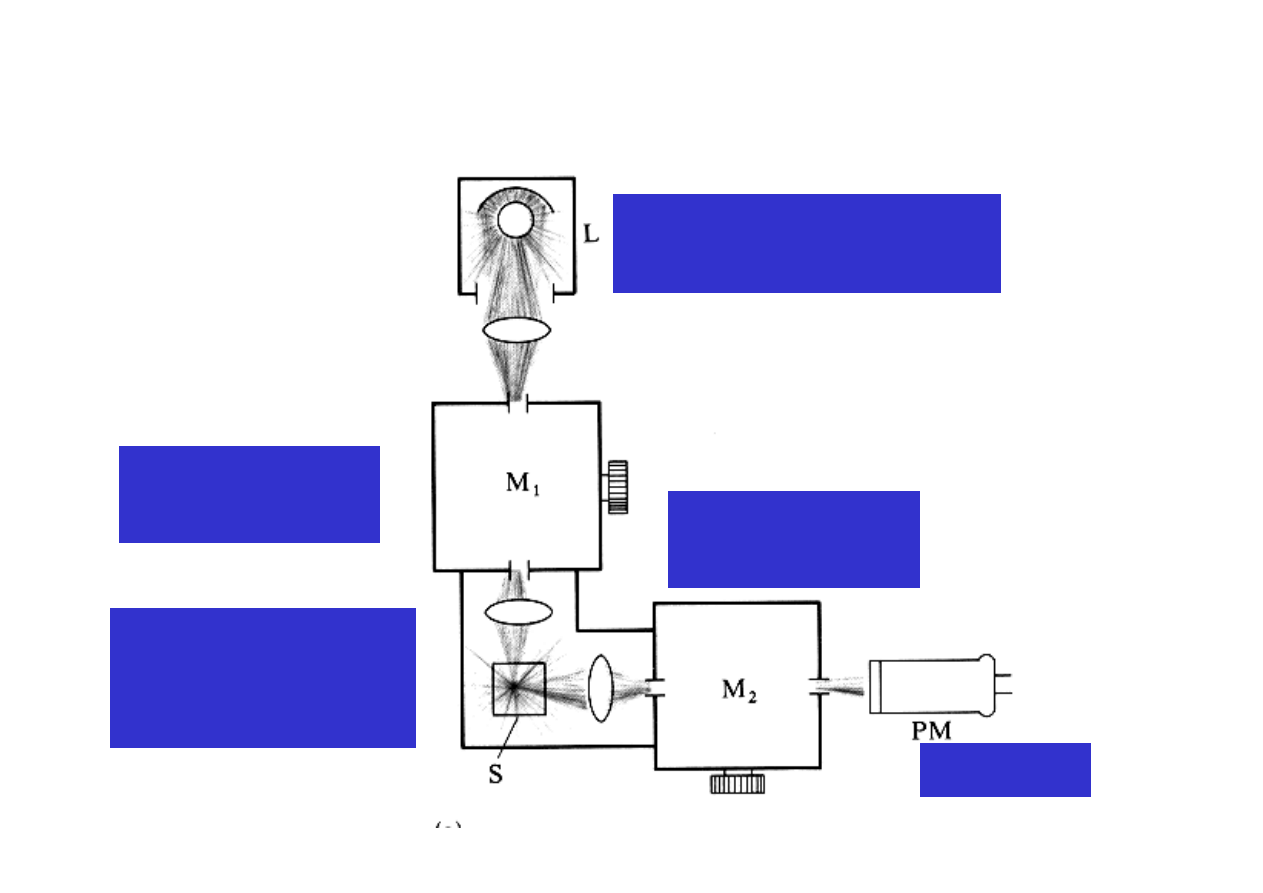
Aparatura – fluorymetr i spektrofluorymetr
Ź
ródło promieniowania
wzbudzającego
Monochromator
wzbudzający
Próbka w komorze
pomiarowej
(geometria 90
o
)
Monochromato
r emisyjny
Detektor

¨
Widmo wzbudzenia – monochromator emisyjny
ustawiony jest na określoną długość fali w zakresie
fluorescencji,
natomiast
monochromator
wzbudzający
przemiata długość fali promieniowania wzbudzającego
(l (
λ
em
= constant,
λ
wzb
zmienia się)
¨
Widmo emisji – monochromator wzbudzający
ustawiony na określoną długość fali absorbowaną przez
próbkę, natomiast monochromator emisyjny przemiata i
analizuje emitowane światło
(
λ
wzb
= constant,
λ
em
zmienia się)
Rodzaje widm fluorescencji
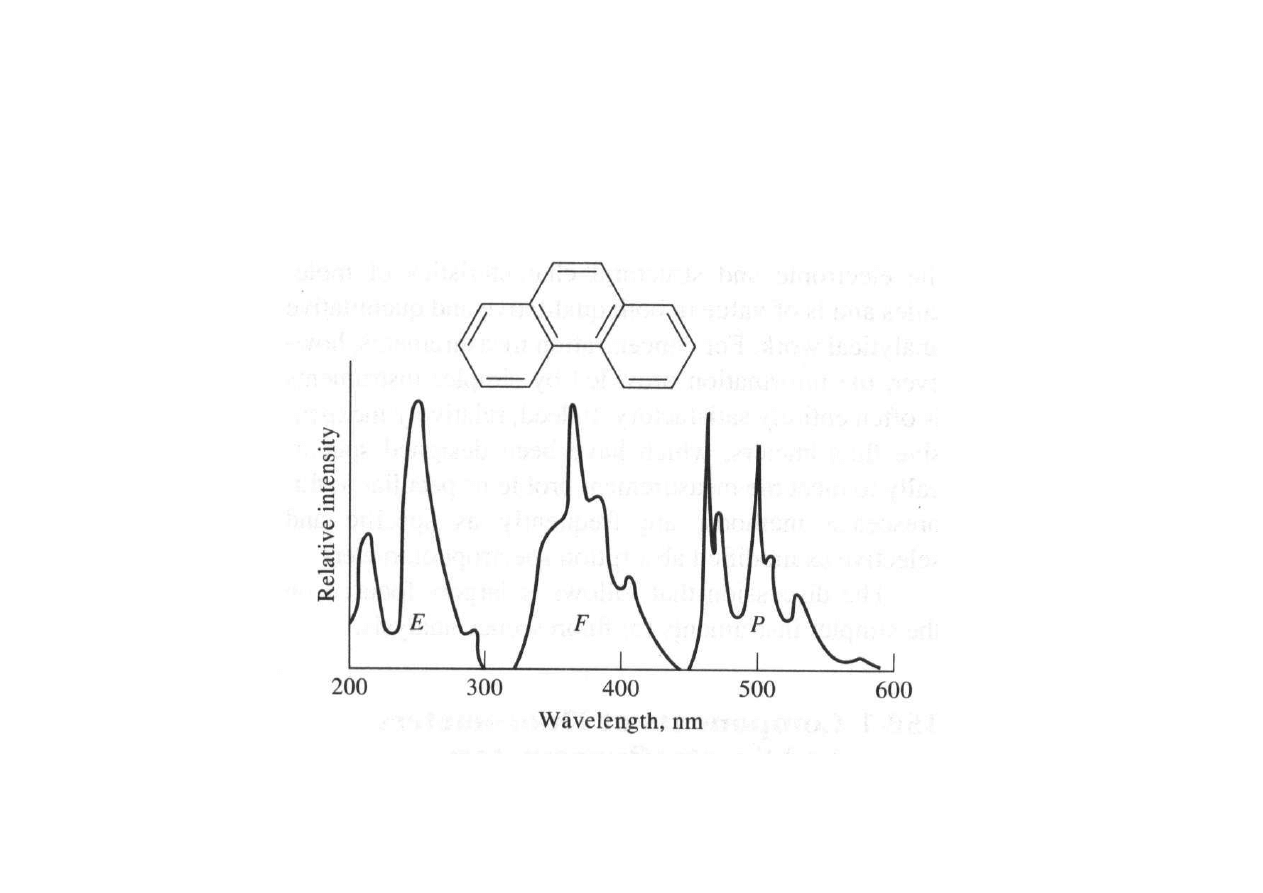
Widma wzbudzenia (E), fluorescencji (F) i
fosforescencji (P)
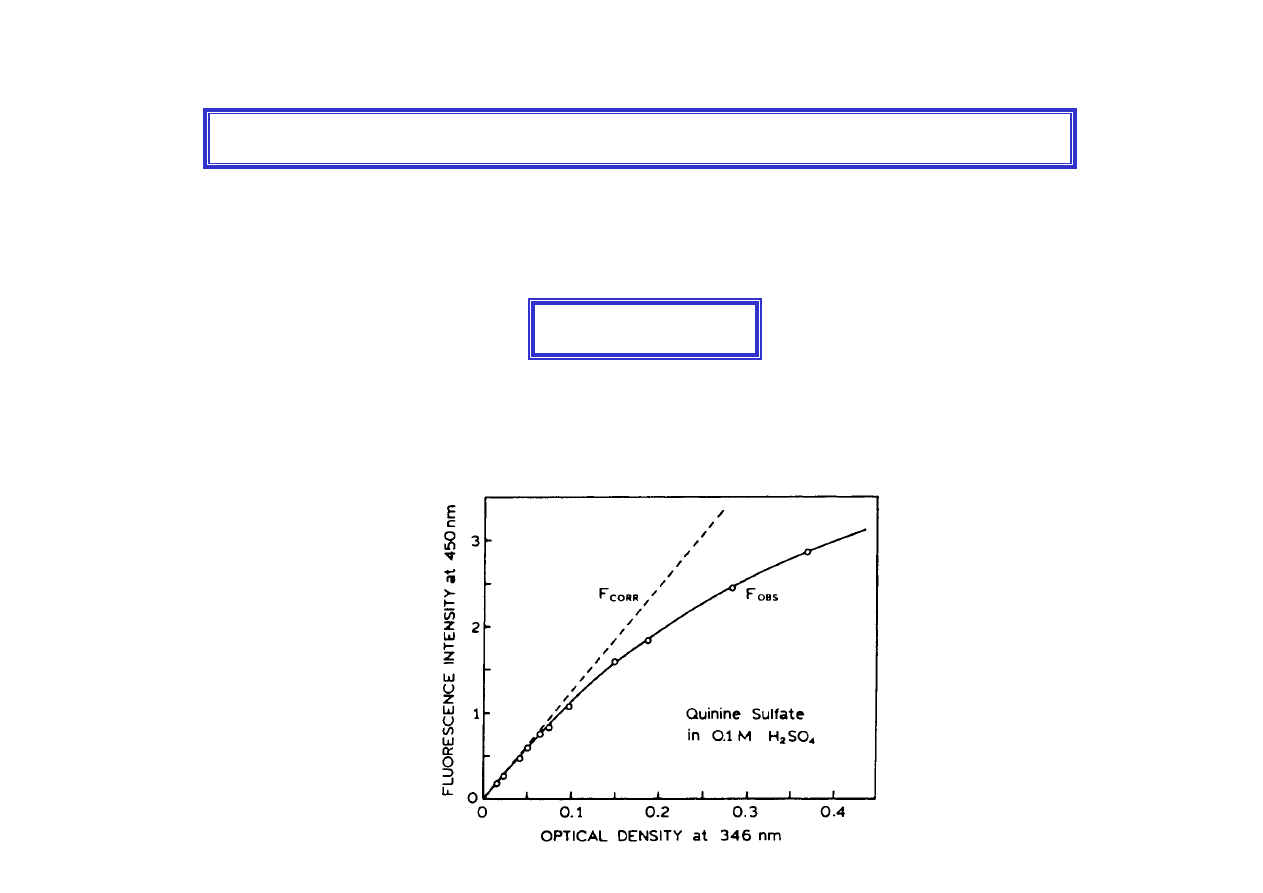
gdzie k stała charakterystyczna dla danej substancji i warunków pomiarowych.
Ponieważ
ε
cl w pomiarach fluorescencyjnych jest <0.1, pomija się dalsze wyrazy
w szeregu wykładniczym i
Zależność ta jest podstawą pomiarów ilościowych i jest spełniana w
ograniczonym zakresie stężeń (roztwory bardzo rozcieńczone
)
Natężenie promieniowania fluorescencyjnego
...)
38
.
0
15
.
1
30
.
2
(
)
10
1
(
3
3
3
2
2
2
0
0
−
−
−
=
−
=
−
b
c
b
c
cb
kI
kI
F
cb
ε
ε
ε
ε
cb
kI
F
ε
0
30
.
2
=
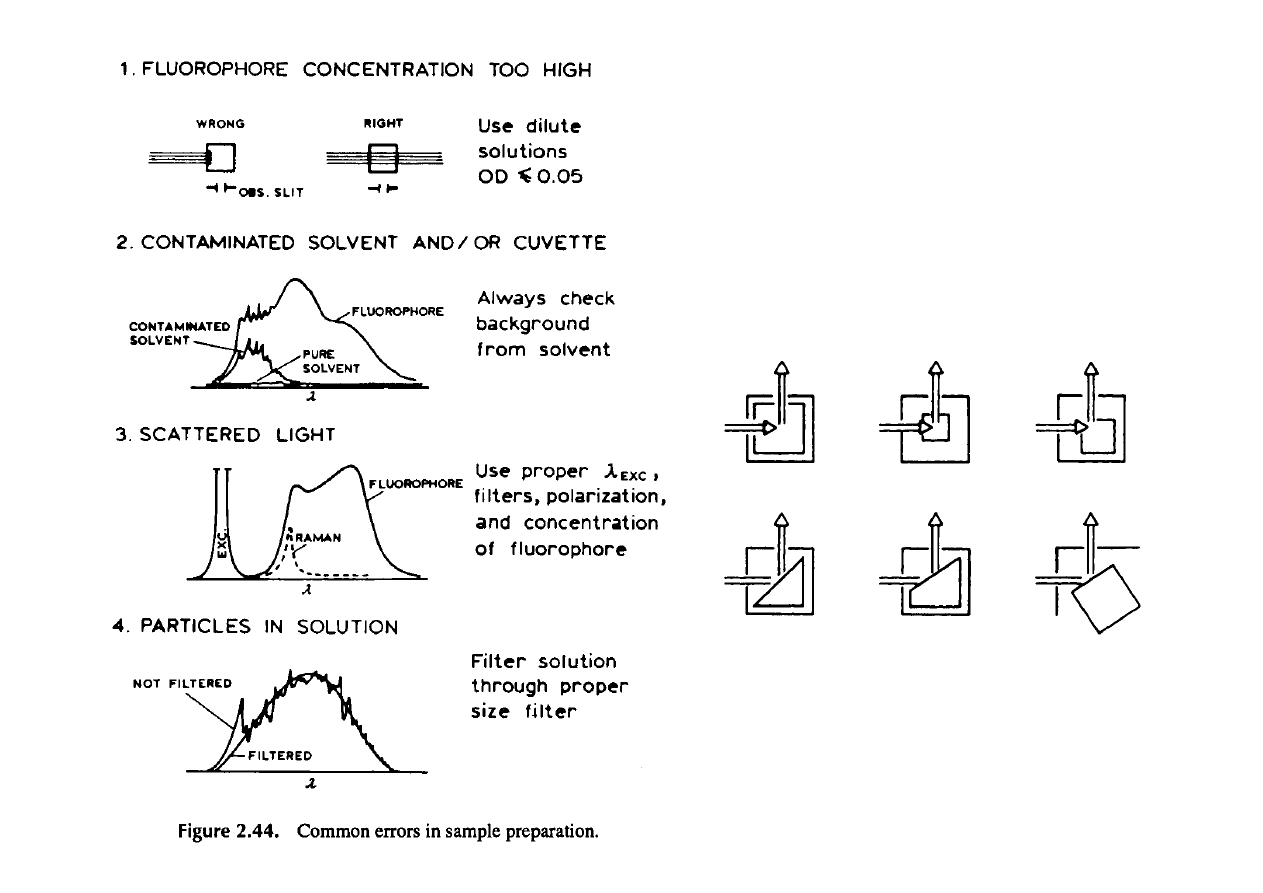
Błędy w pomiarach
fluorescencji

Fluorescencyjny czas życia
(τ
F
) – pomiar
Bardzo krótki impuls światła (<10
-9
sec z lasera pulsowego)
wzbudza cząsteczki do stanu S
n
Po błysku następuje pomiar natężenia fluorescencji w funkcji
czasu
Mierzony zanik fluorescencji jest procesem pierwszego rzędu
(zależy tylko od stężenia wzbudzonym czasteczek i stałej
zaniku, k = 1 /
τ
F
.
Wyrażony za pomocą mierzonej intensywności (F):
F = exp (t
/
τ
F
) i
k = 1/
τ
F
Wieloparametrowość Fluorescencji
Fluorescencyjny czas życia stanu wzbudzonego
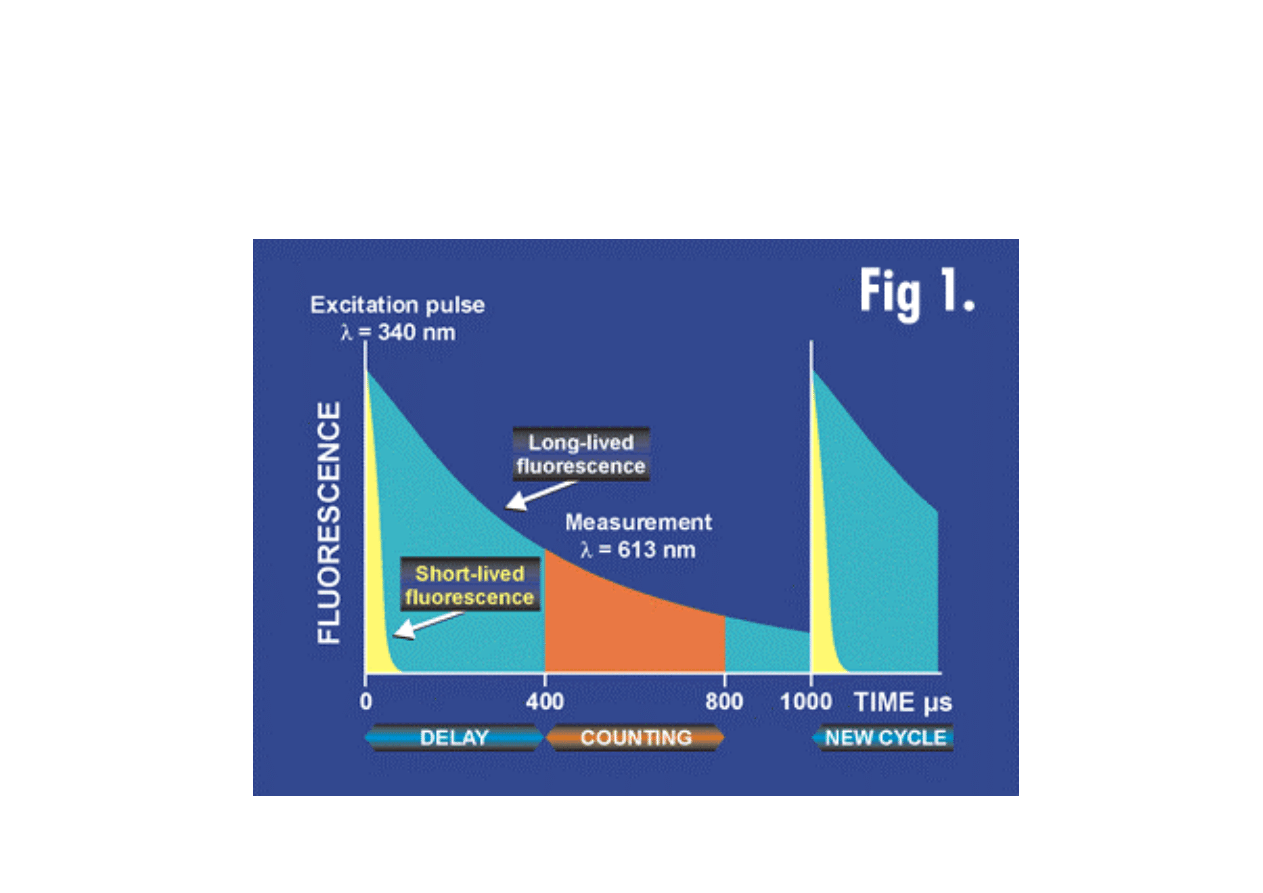
Fluorescencja czasowo rozdzielcza
Time Resolved Fluorescence (TRF)

Zastosowanie spektroskopii fluorescencyjnej
Bardzo wysoka czułość; niskie granice oznaczalności (do 10
-10
M)
1)
Medycyna i analiza kliniczna –ozn. witamin, enzymów, hormonów, środków
dopingujących.
2) Farmacja –badania metabolizmu (barbiturany, amfetamina, LSD)
3)
Biochemia – detekcja i oznaczanie śladów enzymów, koenzymów, lipidów, kwasów
nukleinowych, protein, chlorofilu
4)
ś
ywność – detekcja śladowych komponentów w produktach spożywczych
(aminokwasy, witaminy, proteiny, toksyny)
5)
Ś
rodowisko –powietrze, woda i gleby (policykliczne węglowodory aromatyczne PAH,
aflatoksyny, PCB, fenole, pestycydy)
6) Analiza organiczna i nieorganiczna – oznaczanie wszelkich substancji fluoryzujących
Inne – detekcja w HPLC, sensory fluorescencyjne, badania fotochemiczne i fotofizyczne
stanów wzbudzonych, spektroskopia czasów życia - techniki impulsowe ,
mikroskopia

Wizualizacja obiektów biologicznych z
wykorzystaniem fluorescencji
Mikroskopia Fluorescencyjna
–Bazuje na detekcji cząsteczek fluoryzujących,
które barwią obiekt
–Absorbują światło o danej dł. Fali i emitują światło
o innej
λ
•Obiekt oglądany przez filtr, który przepuszcza tylko
emitowane światło
–Tło jest czarne
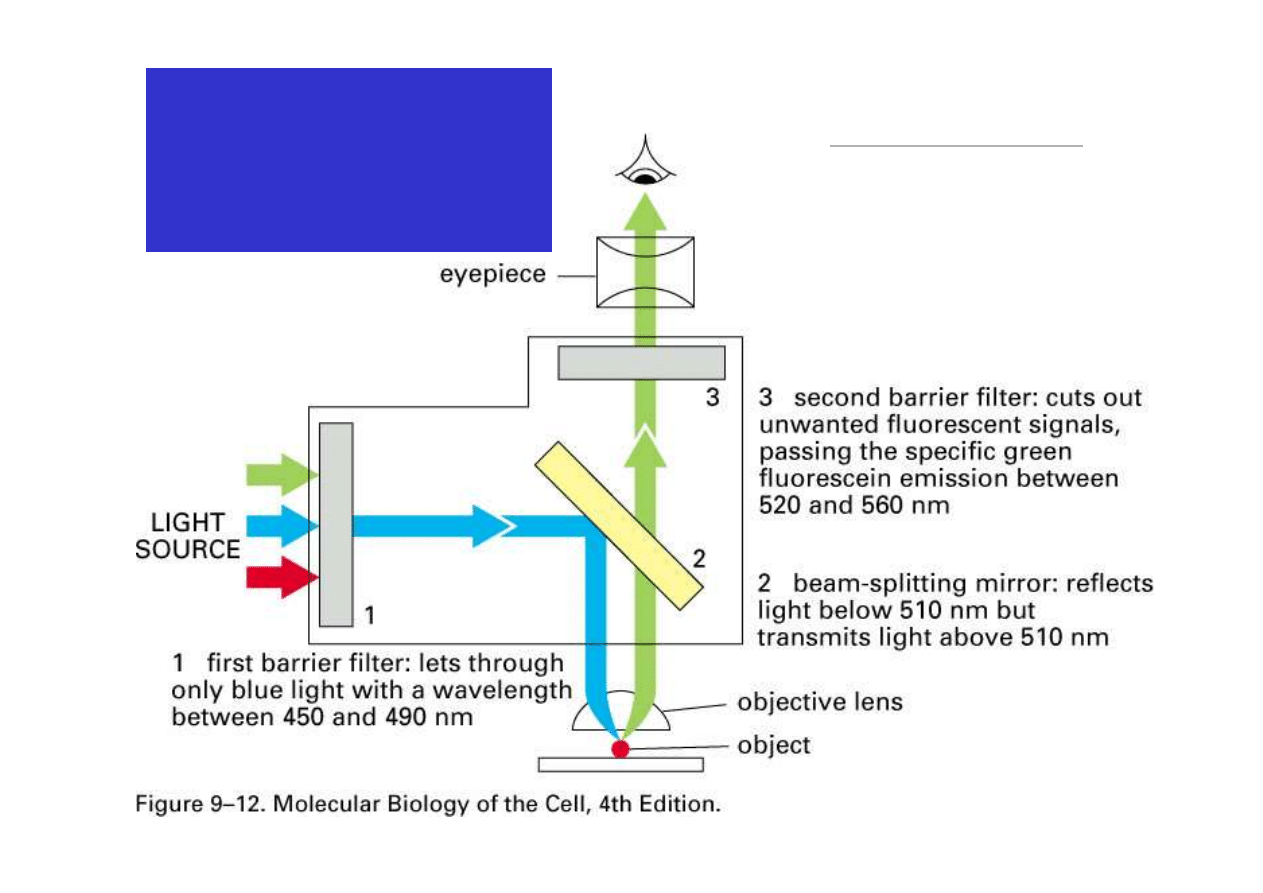
Układ optyczny
Mikroskopu
Fluorescencyjnego
Fluoresceina
-wzbudzona
blue
light
(450-490)
-emituje
green
light
(520-560)
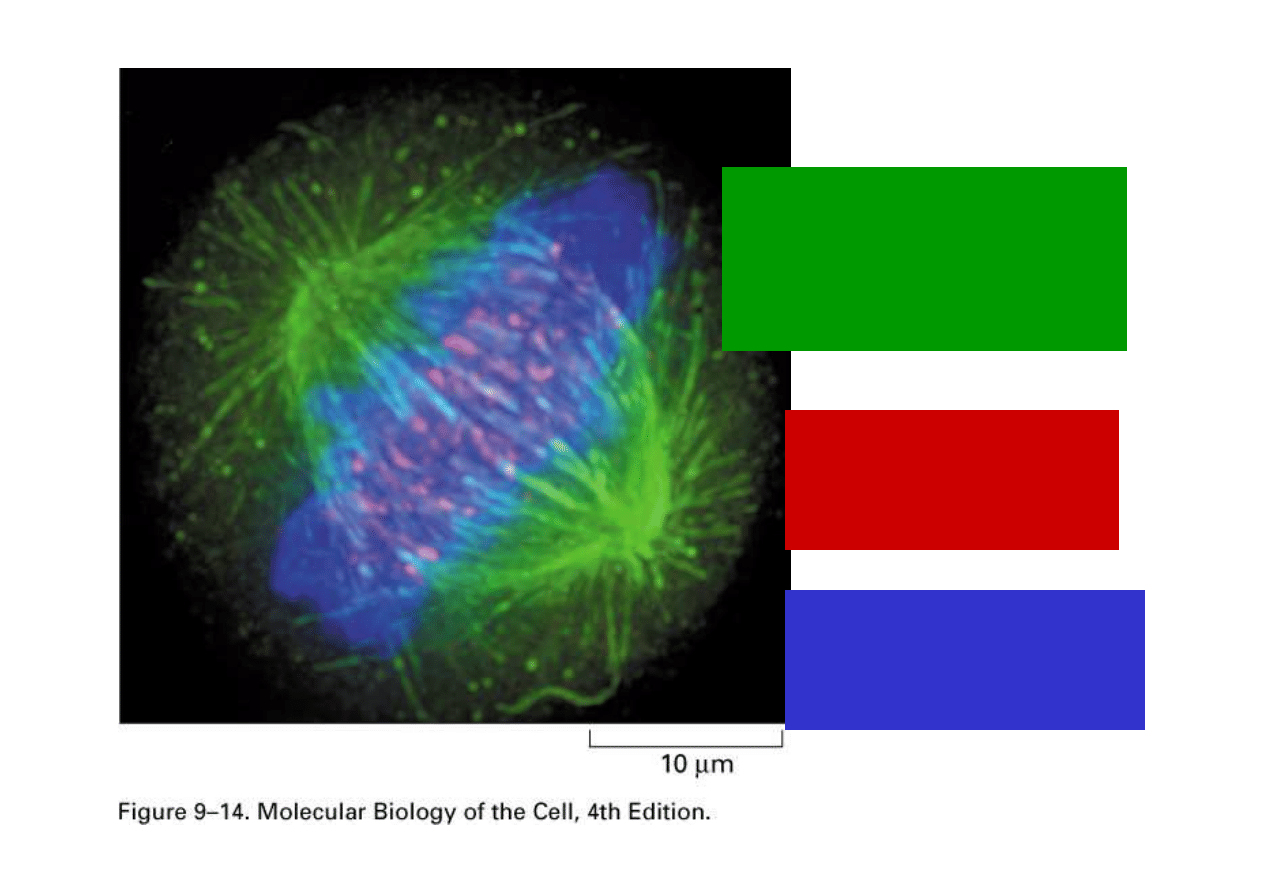
Białka szkieletowe
widoczne jako
zielona
fluorescencja
Centromery –
czerwona
fluorescencja
DNA – niebieski
barwnik
fluorescencyjny
Fluorescencyjny obraz
komórki w mitozie
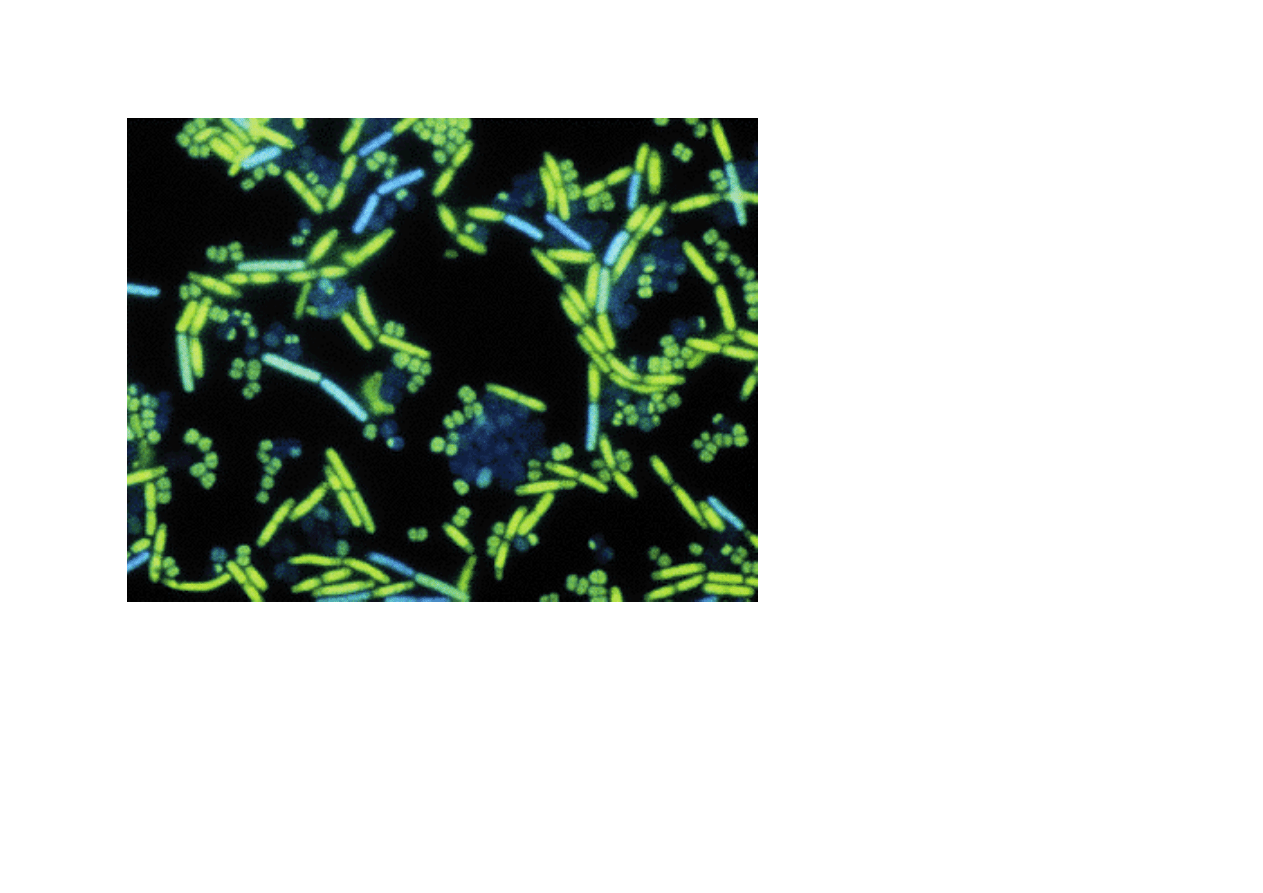
Mieszanina żywych i martwych chromosomów (zabitych
izopropanolem) bakterii Micrococcus luteus.
Barwione dwoma barwnikami DNA: DAPI i SYTOX Green.
ś
ywe i martwe
Chromosomy
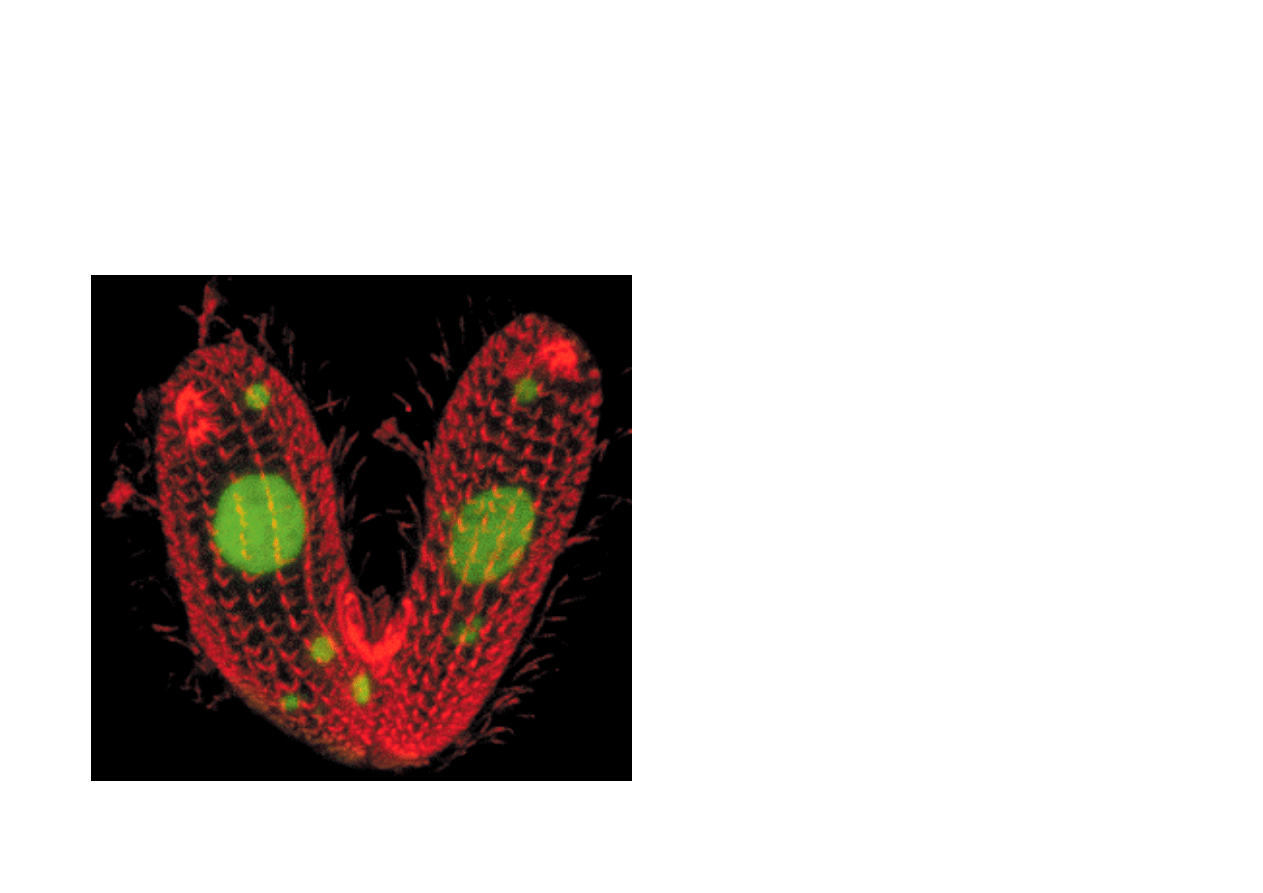
Obraz fluorescencyjny dwóch
pantofelków Tetrahymena
thermophila, sześć godzin po
połączeniu. Jądra i jąderka są
barwione barwnikiem DNA,
SYTOX Green.
Reprodukcja pantofelka
Wyszukiwarka
Podobne podstrony:
05a Spektrochemia , Fluorescenc Nieznany (2)
05a Spektrochemia , Fluorescenc Nieznany
Spektrometr fluorescencji atomowej
Spektroskopia fluorescencyjna Ula Radziwanowska
Spektroskopia NMR
SPEKTROSKOPIA ROTACYJNA
Fluorescencja chlorofilu
Spektrometria mas NMAZ
instr 2011 pdf, Roztw Spektrofoto
analityka podstawy spektroskopii 2012 2013
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
spektro6, Technologia chemiczna pw, 2rok, spektra
Spektrometr-76, Studia, Fizyka, Sprawozdania, 76a
Analiza spektralna widm (2), Matematyka - Fizyka, Pracownia fizyczna, Analiza spektralna widm
SPEKTROFOTOMETRYCZNE OZNACZENIE ŻELAZA W POSTACI TIOCYJANIANU ŻELAZA, NAUKA, WIEDZA
Spektroskopia Jądrowego Rezonansu Magnetycznego
pwsz ioś kalisz Ćw 4 Spektrofotometria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, ana
Analiza Instrumentalna Miareczkowanie spektrofotometryczne Sprawozdanie 3 x
więcej podobnych podstron