
1.
Oblicz wartość stałej równowagi reakcji: 2HI
H
2
+ I
2
w temperaturze 600K, jeśli wiesz, że stężenia
reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm
3
; [H
2
]=0,02 mol/dm
3
; [I
2
]=0,024 mol/dm
3
.
2.
Pięciochlorek fosforu dysocjuje zgodnie z równaniem: PCl
5
PCl
3
+ Cl
2
. W pewnej temperaturze z 2 moli PCl
5
znajdujących się w zamkniętym naczyniu o objętości 100dm
3
uległo rozkładowi 1,5 mola. Oblicz wartość stałej
równowagi tej reakcji.
3.
Mieszaninę 15 moli CO
2
i 12 moli H
2
ogrzano w zamkniętym naczyniu o objętości 600 dm
3
do temperatury
800K. Po ustaleniu się równowagi stwierdzono, że w naczyniu znajduje się 4,4 mola CO. Oblicz wartość stałej
równowagi tej reakcji
4.
W pewnej temperaturze stała równowagi reakcji C
(S)
+ O
2
CO
2
wynosi 0,5. Jeśli do reakcji użyto 2 mole
węgla i 3 mole tlenu, to w stanie równowagi ilość CO
2
wynosi:
a) 1 mol
b) 0,5 mola
c) 1,7 mola
d) potr
zebna jest znajomość objętości zbiornika, aby można było przeprowadzić obliczenia

5.
W temperaturze 1000 K (Kelwinów) stała równowagi (K) reakcji
CO
(g)
+ H
2
O
(g)
CO
2 (g)
+ H
2 (g)
Wynosi 1.
W 1 dm
3
mieszaniny wyjściowej znajdowały się 2 mole CO i 3 mole H
2
O.
Oblicz stężenia równowagowe wszystkich reagentów reakcji.
6.
W pewnych warunkach równowaga reakcji
ustaliła się przy następujących stężeniach:
Oblicz stałą równowagi dla podanej w informacji reakcji chemicznej
7.
Podczas syntezy amoniaku w T=670 K równowaga reakcji:
ustaliła się przy stężeniach: [N
2
] = 4 mol·dm
-3
, [H
2
] = 0,2 mol·dm
-3
, [NH
3
] = 0,08 mol·dm
-3
.
Zapisz wyrażenie na stałą równowagi tej reakcji,
oblicz stałą równowagi oraz stężenie początkowe azotu.

8.
W temperaturze 1900 K w stanie równowagi reakcji:
wyznaczono
następujące stężenia reagentów:
Oblicz:
a) stałą równowagi reakcji syntezy tlenku azotu (II) w temperaturze 1900 K
b) początkowe stężenie azotu przy założeniu, że początkowa mieszanina nie zawierała NO.
9.
Określ jak wzrost temperatury wpływa na:
a) równowagę reakcji
b) wartość stałej równowagi reakcji
10.
Podczas syntezy amoniaku stan równowagi został osiągnięty kiedy stężenia wynosiły:
[N
2
]
– 1,5 mol/dm
3
, [H
2
]
– 4 mol/dm
3
, [NH
3
]
– 6 mol/dm
3
.
Zapisz wyrażenie na stężeniową stałą równowagi tej reakcji i oblicz jej wartość.
11.
Dane jest równanie reakcji:
Podaj wyrażenie na stężeniową stałą równowagi dla tego procesu.
12.
Dla reakcji przebiegającej zgodnie z równaniem A
2(g)
+ B
2(g)
2AB
(g)
oblicz stężenia równowagowe [A
2
] i [B
2
]
oraz wart
ość stężeniowej stałej równowagi, jeśli stężenia początkowe wynosiły: C
A2
= 1 mol/dm
3
i C
B2
= 0,5
mol/dm
3
, a po ustaleniu stanu równowagi stężenie równowagowe [AB] = 0,8 mol/dm
3
.

13.
W roztworze jodu w jodku potasu ustalają się zgodnie z równaniami reakcji odpowiednie stany równowagi
chemicznej:
REAKCJE:
STAŁE RÓWNOWAGI K:
a) I
2(S)
I
2(r)
.
........................................
b) I
2(S)
+ I
(r)
I
3
(r)
........................................
c) I
2(r)
+I
(r)
I
3
(r)
........................................
wzór stałej K
c
trzeciej reakcji może być wyrażony przez stałe reakcji a i b wzorem:
a) K
a
K
b
.
b) K
b
/ K
a
.
c) K
a
/ K
b
.
14.
Reakcja przebiega zgodnie z równaniem: 2A + B
C + D a stała równowagi jest równa 5 • 10
4
.
Oblicz stężenie równowagowe A, jeżeli stężenia w stanie równowagi pozostałych reagentów wynoszą:
[B] = 1 mol/dm
3
[C] = 0,005 mol/dm
3
[D] = 0,001 mol/dm
3
.
15.
W temperaturze 1100 K w zbiorniku o pojemności 1 dm
3
umieszczono 2 mole CO i 3 mole H
2
O w postaci pary.
Ustaliła się równowaga:
CO
(g)
+ H
2
O
(g)
CO
2(g)
+ H
2(g)
W tych warunkach stała równowagi K = 1. Oblicz równowagowe stężenia reagentów.
16.
W pewnych warunkach ciśnienia i temperatury równowaga reakcji
2N
2(g)
+ O
2(g)
2N
2
O
(g)
ustaliła się przy następujących stężeniach reagentów:
C
N
2
= 0,72 mol/dm
3
, c
02
=1,12 mol/dm
3
,
c
N2O
= O,84 mol/dm
3
. Oblicz
stałą równowagi tej reakcji oraz stężenia początkowe substratów.

17.
Stała równowagi reakcji odwracalnej H
2
+ CI
2
2HCI jest równa 8. W stanie równowagi stężenie wodoru
wynosi 2 mol/dm
3
, a stężenie chlorowodoru
4 mol/dm
3
. Oblicz
równowagowe i początkowe stężenie chloru.
18.
W stanie równowagi reakcji N
2(g
, + 3H
2(g)
2NH
3(g)
w określonej temperaturze stężenia reagentów wynoszą:
C
H2
= 2 mol/dm
3
,
C
N2
= 1 mol/dm
3
,
C
NH3
= 4 mol/dm
3
.
Oblicz
stałą równowagi reakcji oraz początkowe stężenia substratów tej reakcji.
• Informacja do zadań 23 i 24
Stała równowagi reakcji kwasu 4-fenylobutanowego z etanolem w pewnej temperaturze wynosi K = 0,67.
19.
Do reakcji estryfikacji użyto 1 mol cząsteczek kwasu 4-fenylobutanowego i nadmiaru etanolu. Oblicz liczbę
moli cząsteczek etanolu, jakiej należy użyć, aby reakcja zaszła z 85-procentową wydajnością.
20.
Wyjaśnij, jaki czynnik może zmienić wartość stałej szybkości podanej reakcji estryfikacji.
21.
Zmieszano 3 mole cząsteczek octanu etylu z 5 molami cząsteczek wody i 1 molem cząsteczek kwasu
octowego. Oblicz,
ile moli cząsteczek alkoholu powstało w stanie równowagi, jeżeli stała równowagi K = 1.
22.
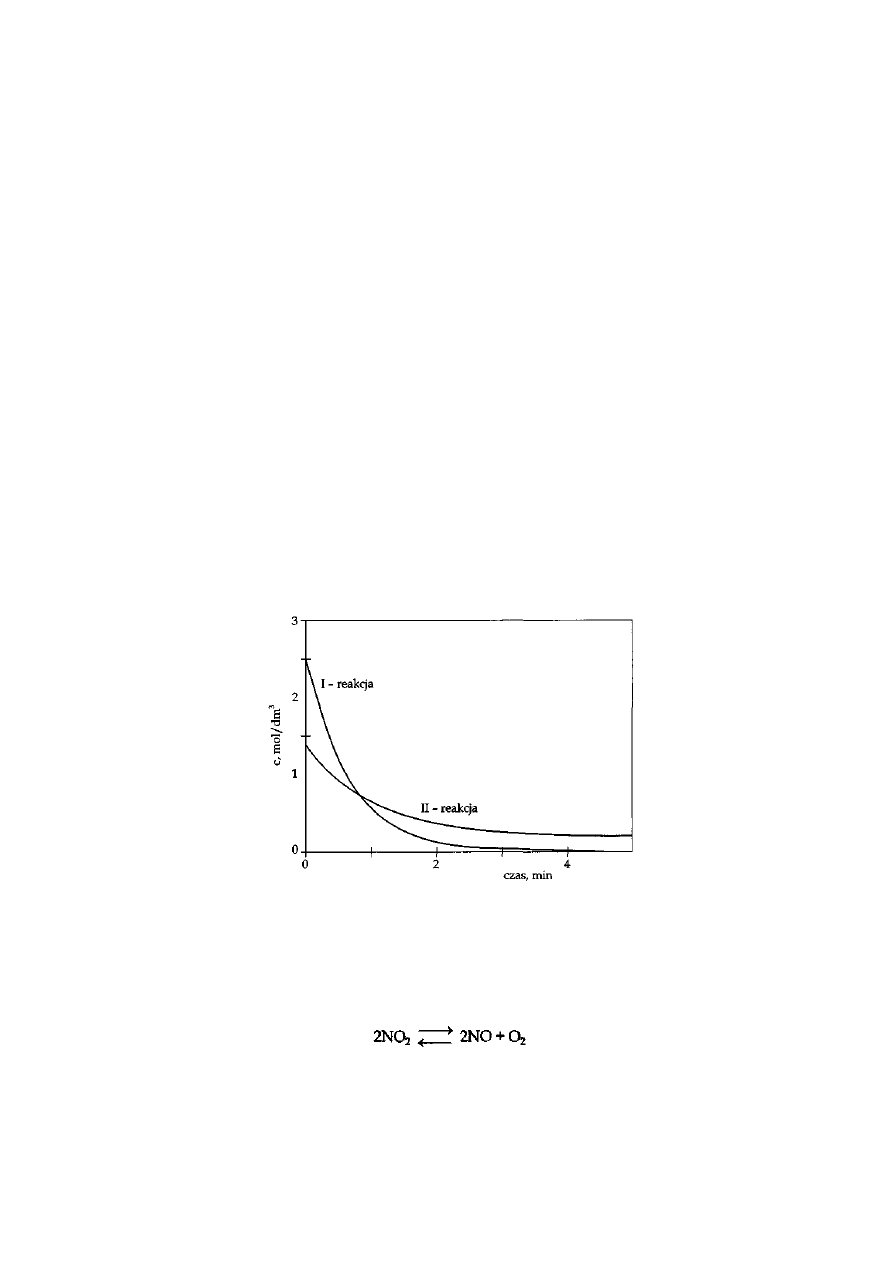
W czasie przebiegu dwóch reakcji chemicznych (I i II) dokonano pomiarów stężenia substratu.
Wyniki przedstawiono na poniższym wykresie.
Na p
odstawie wykresu napisz, która przemiana I czy II jest reakcją, w której ustala się stan równowagi.
Uzasadnij swoją odpowiedź.
23.
W zamkniętym naczyniu, w określonej temperaturze T, równowaga reakcji:
ustaliła się z chwilą osiągnięcia następujących stężeń: [NO
2
] = 0,12 mol/dm
3
[NO] = 0,48 mol/dm
3
[O
2
] = 0,24 mol/dm
3
1. Oblicz stalą równowagi chemicznej w temperaturze T.
2. Oblicz, jakie było wyjściowe stężenie NO
2
.
24.
Zakładając, że reakcja przedstawiona równaniem:
jest egzoenergetyczna, oraz że przebiega jednoetapowo, określ:
Uzasadnij swoją odpowiedź.
1)
jaki wpływ na położenie stanu równowagi będzie miał katalizator,
2)
jaki wpływ na położenie stanu równowagi ma ogrzewanie całego układu.
25.
W temperaturze 1000 K stała równowagi reakcji:
wynosi 1.
W 1 dm
3
mieszaniny wyjściowej znajdowały się 2 mole tlenku węgla(II) i 3 mole wody.
Oblicz stężenia równowagowe wszystkich reagentów reakcji.
26.
W danej temperaturze T stalą równowagi odwracalnej reakcji przebiegającej wg równania:
wynosi 1. Stężenie równowagowe tlenku węgla(IV) i wodoru wynoszą 0,04 mola/dm
3
, a wody 0,03
mola/dm
3
. Oblicz wyjściowe stężenia substratów.
27.
Po ustaleniu się równowagi w reakcji odwracalnej 2A + B
C + D stężenia równowagowe wynosiły:
[A] = 2 mol/dm
3
, [B] = 4 mol/dm
3
, [C] = [D] = 3 mol/dm
3
. Zapisz wyrażenie na stałą równowagi. Oblicz stałą
równowagi K oraz stężenia początkowe reagentów.
Wyszukiwarka
Podobne podstrony:
05 4 FOLIA Procesy elektrolizy zadania do lekcji nr 1
05 5 Procesy elektrolizy zadania do lekcji nr 2
06 4 Mangan i jego związki zadania do lekcji nr 2
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
02 5 Odczyn roztworów wodnych pH zadania do lekcji nr 2
04 4 Folia Hydroliza soli zadania do lekcji nr 1
03 4 Folia Teorie kwasowo zasadowe zadania do lekcji nr 1
05 3 Efekty energetyczne reakcji zadania do lekcji nr 1
07 4 Chrom i jego związki zadania do lekcji nr 2
02 3 Szybkość reakcji chemicznych zadania do lekcji nr 2
10Promieniotwórczość zadania do lekcji nr 2
9Promieniotwórczość zadania do lekcji nr 1
chemiaix pl wp content uploads 2011 05 02 5 Rozpuszczalność zadania do lekcji nr 2
07 5 Prawa elektrolizy zadania do lekcji nr 2
02 5 Rozpuszczalność zadania do lekcji nr 3
05 4 Iloczyn rozpuszczalności zadania do lekcji nr 1
02 4 Folia Odczyn roztworów wodnych pH zadania do lekcji nr 1
więcej podobnych podstron