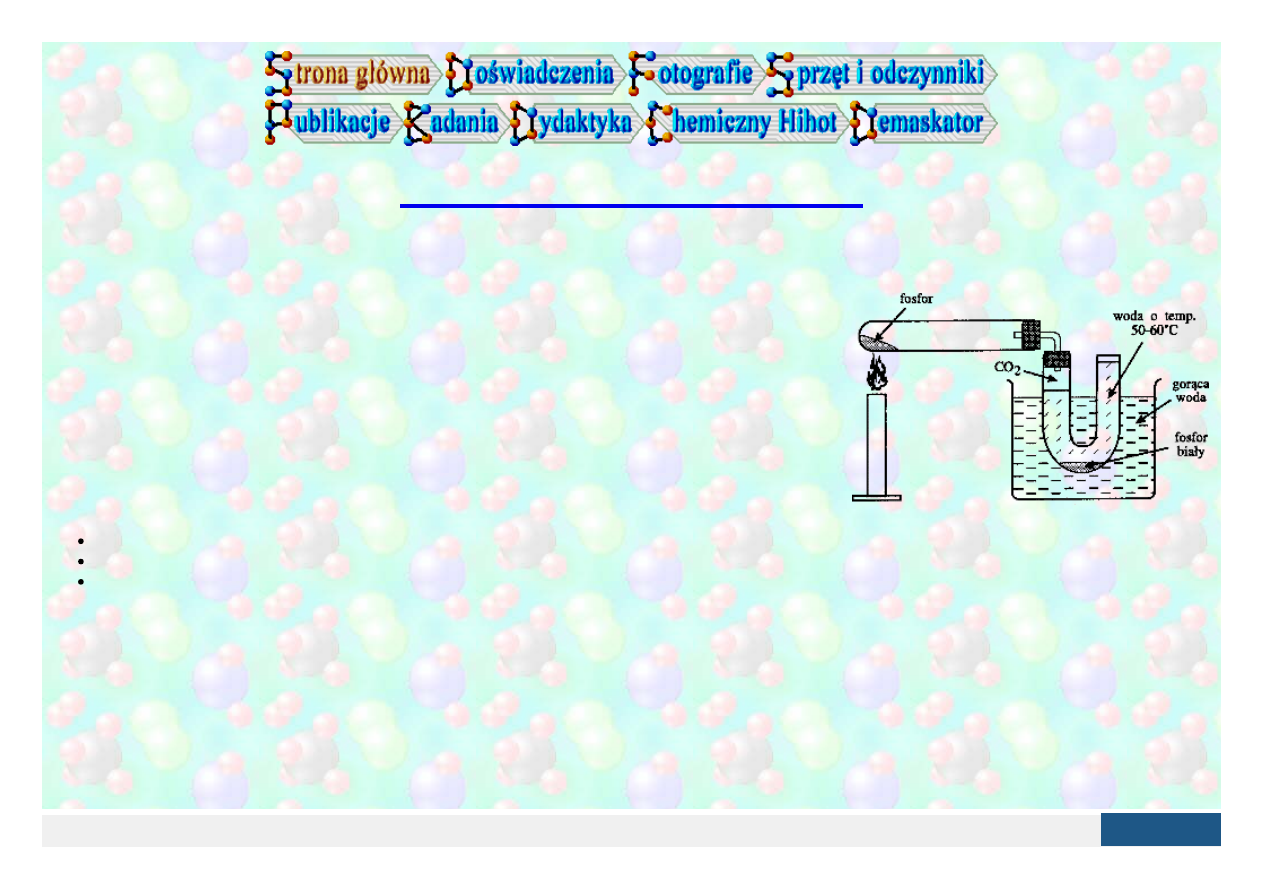
Rys.
1.
Jeden z zaproponowanych w literaturze
sposobów otrzymywania fosforu białego
Bezpieczna przemiana alotropowa fosforu czerwonego w fosfor biały
Temat artykułu ze względu na otrzymywaną niebezpieczną substancję może wzbudzić nieco wątpliwości.
Jednak w książce pt. "Doświadczenia chemiczne dla szkól średnich" (Z. Matysikowa, R. Piosik, Z. Warnke,
Wydawnictwa Szkolne i Pedagogiczne, Warszawa 1984) został zaproponowany zestaw (rys.1) do
otrzymywania fosforu białego, w którym fosfor czerwony, ogrzewany w próbówce, po przejściu w fosfor
gazowy ulega kondensacji w U-rurce wypełnionej wodą i przechodzi w fosfor biały. W wymienionej książce
nie ma przy otrzymywaniu fosforu białego żadnych wskazówek dotyczących obchodzenia się z nim.
Widocznie autorzy tej książki zakładali, że trafi ona tylko do rąk znających się na rzeczy nauczycieli, a
przecież jest ona ogólnodostępna również dla początkujących zapalonych chemików, którzy mogą
wykonywać opisane tam doświadczenia, nie zdając sobie sprawy z istniejącego zagrożenia (!). W tej sytuacji
wydrukowanie w "KCh" artykułu zawierającego wszelkie konieczne wskazówki BHP wydaje się
nieodzowne. Opisany zestaw posiada ponadto kilka wad, gdyż biały fosfor może:
po pierwsze - kondensować już w górnej zimnej części probówki, a nie w U-rurce;
po drugie - zatykać wąską szklaną rurkę stanowiącą połączenie probówki z U-rurka
po trzecie - reagować ze składnikami materiału, z którego wykonane są niektóre korki zamykające probówkę i U-rurkę.
Z łatwością możemy tych problemów uniknąć, stosując zamiast powyższego zestawu retortę ze szkła żaroodpornego. Odkrywca fosforu, Brandt, otrzymał go
(co prawda z innych składników) właśnie w retorcie.
Co to jest retorta? było to podstawowe naczynie reakcyjne alchemików charakteryzujące się długą, zakrzywioną szyjką i dzielnie niegdyś zastępujące
obecnie stosowane kolby (rys. 2.). Po dzień dzisiejszy jednak retorta stanowi symbol chemii. No właśnie, po retorcie został już tylko symbol...
A może moje dane o dostępności retort nie są dość dokładne? Wobec tego ogłaszam akcję: "Poszukiwanie zaginionej retorty". Jeśli ktokolwiek z
czytelników wie, gdzie można nabyć retorty szklane o niewielkich pojemnościach, proszę o powiadomienie na łamach "KCh" szerszego grona
zainteresowanych
Zastosowanie retorty ma najczęściej sens, gdy nie dysponujemy naczyniami na połączenia szlifowe, a chcemy otrzymywać fosfor biały lub wytwarzać
substancje niszczące gumę, na przykład: brom, chlor, kwas azotowy.

O ile obecnie retort w sprzedaży nie widać, to kilka lat temu można było, np. w sklepach Składnicy Harcerskiej nabyć zestaw "Młody Chemik", w skład
którego miedzy innymi wchodziła retorta wykonana ze szkła żaroodpornego "Pyrex". Na pewno znajduje się on w wielu szkolnych i domowych
laboratoriach. Nadszedł wiec czas najwyższy, aby nie używaną do tej pory retortę wreszcie wykorzystać.
Uwaga! Zanim przystąpimy do doświadczenia, musimy uświadomić sobie, z jak niebezpieczną substancją będziemy mieli do czynienia i - mając
to stale na uwadze - wyprzedzać myślowo każdą wykonywaną czynność, rozważając rożne możliwości jej przebiegu i wynikające stąd skutki.
Dzięki temu unikniemy nieszczęśliwego wypadku, a w razie jego powstania nie ulegniemy panice.
Fosfor biały jest substancją niezwykle toksyczną i łatwopalną. Już 0,1 g tego pierwiastka może stać się dawką śmiertelną dla dorosłego człowieka.
Temperatura samozapłonu zaś wynosi 44
o
C. Co gorsza, w stanie dużego rozdrobnienia lub przy szybkim przepływie powietrza nad powierzchnia fosforu
białego, temperatura samozapłonu może być niższa od temperatury pokojowej!
Zanim wiec przystąpimy do pracy z fosforem białym, musimy pamiętać że:
zawsze używamy gumowych rękawic, fartucha i okularów ochronnych,
wszystkie niżej przedstawione doświadczenia przeprowadzamy pod sprawnym wyciągiem, w którym nie znajdują się żadne łatwopalne substancje,
na wypadek pożaru przygotowujemy gaśnicę (najlepiej śniegową) i koc azbestowy,
miejsca oparzone białym fosforem przemywamy 5% roztworem siarczanu miedzi(II) CuSO
4
lub wprost tym roztworem gasimy palący się na
skórze fosfor,
naczyń, w których znajdował się fosfor biały lub jego roztwór, nie należy wyrzucać do pojemnika na śmieci, jak radzą autorzy niektórych książek,
gdyż stanowi to zagrożenie pożarowe.
Resztki fosforu białego pozostawione w naczyniach możemy usunąć prażąc je lekko w płomieniu palnika (pod wyciągiem) i doprowadzając do ich
wnętrza dużą ilość powietrza. Po ostygnięciu, na wszelki wypadek zalewamy je jeszcze na kilka godzin roztworem siarczanu miedzi(II). Brak brązowych
plam na ściankach wewnętrznych naczynia świadczy o nieobecności białego fosforu. Może jedynie powstać (proszę się zastanowić: dlaczego) nieco
niebieskiego osadu Cu
3
(PO
4
)
2
*3H
2
O, czyli jakbyśmy powiedzieli dawniej trójwodnego ortofosforanu miedziowego, a obecnie bis[fosforanu(V)]
trimiedzi(II) - woda(1/3) lub 3-hydratu bis(ortofosforanu)trimiedzi(II). (Och, ta nowa nomenklatura!? - patrz "Nomenklatura związków nieorganicznych",
Wyd. PAN, Zakład Narodowy im. Ossolińskich, Wrocław 1988).
I jeszcze jedna mała dygresja co do roztworu CuSO
4
. Jego "zbawcze" działanie polega na zachodzeniu reakcji
P
4
+10CuSO
4
+16H
2
O -> 10Cu+4H
3
PO
4
+10H
2
SO
4
Jednak po jego zastosowaniu należy jeszcze zobojętnić powstające kwasy i poparzone miejsca przemyć 1% roztworem wodorowęglanu sodu NaHCO
3
(popularna soda oczyszczona) lub nałożyć papkę z tlenku magnezu MgO.
Poza tym na skórze pozostaną nieestetyczne brunatne plamy od rozpuszczonych cząstek metalicznej miedzi. Można próbować je usunąć mieszaniną octu
i wody utlenionej; najlepiej jednak poczekać, aż zejdą wraz z naskórkiem. Pomimo tych przykrych efektów ubocznych w razie wypadku należy bez
wahania stosować przygotowany przed rozpoczęciem doświadczenia roztwór CuSO
4
Nareszcie przebrnęliśmy przez przepisy BHP i możemy przystąpić do doświadczenia, przygotowując się oczywiście wcześniej według wyżej podanych
wskazówek.
Sprzęt i odczynniki
Rys.
2.
Zestaw do przemiany fosforu
czerwonego w biały
fosfor czerwony
5% roztwór siarczanu miedzi(II) CuSO
4
*5H
2
O
dwusiarczek węgla CS
2
węglan wapnia CaCO
3
kwas solny HCl
retorta o pojemności nie większej niż 100 cm
3
(ograniczamy tym samym ilość fosforu czerwonego wziętego do doświadczenia; nigdy nie należy jej
zwiększać)
wanienka hydrauliczna lub duży krystalizator
parowniczka
statyw z lampą
palnik
bibuła filtracyjna
Ustawiamy zestaw według rys. 2. Wsypujemy do retorty fosfor czerwony, uważając aby nie zanieczyścić
wewnętrznych ścianek szyjki retorty (np. przez lejek z długą i szeroką nóżką, o ile retorta nie posiada
górnego tubusa do wsypywania substancji) oraz aby fosfor nie zajmował więcej niż 1/3 pojemności retorty.
Następnie wypełniamy retortę dwutleniem węgla (uzyskanym na przykład w reakcji węglanu wapnia i
kwasu solnego) i zamykamy korkiem. Umieszczamy retortę w statywie, nachylając jej szyjkę tak, aby
znalazła się w wypełnionym gorącą wodą krystalizatorze, na dnie którego znajduje się mała parowniczka.
Teraz możemy już wyjąc korek; co prawda dwutlenek węgla rozpuszcza się nieco w wodzie, ale - ponieważ
jest ona gorąca, a rozpuszczalność gazów w cieczach maleje ze wzrostem temperatury - nie ma obaw aby
woda została wessana do wnętrza retorty.
Na szyjce retorty możemy jeszcze umieścić zwiniętą w spiralę rurkę z dobrze przewodzącego ciepło metalu,
przez którą będzie przepływała woda w celu chłodzenia. Zamiast rurki możemy owinąć cześć szyjki mokrą
watą. Nie jest to jednak niezbędne, najczęściej wystarczy chłodzenie powietrzem.
Rozpoczynamy ogrzewanie retorty pilnując, aby powstawanie gazowego fosforu nie było zbyt intensywne.
Pary fosforu ulegną skropleniu w zimnej części szyjki retorty, po czym krople ciekłego fosforu spłyną w dół, kąpiąc pod wodą do podstawionej
parowniczki (fosfor ma większą gęstość od wody). Gdyby fosfor zaczynał zestalać się już w szyjce retorty, należy przerwać jej chłodzenie.
Jak możemy zauważyć, powstający fosfor biały na skutek obecności niewielkiej ilości fosforu czerwonego nie jest wcale biały, lecz żółty.
Efektownym zjawiskiem towarzyszącym otrzymywaniu fosforu białego tą metodą będą wydostające się czasami na powierzchnię wody pęcherzyki gazu
zawierającego miedzy innymi fosfor gazowy. Gdy tylko zetkną się z powietrzem, fosfor ulegnie gwałtownemu zapaleniu, czemu będzie towarzyszył efekt
dźwiękowy w postaci cichego trzasku.
Zanim cały fosfor ulegnie przemianie (w retorcie pozostanie tylko trochę towarzyszących mu zanieczyszczeń) woda w krystalizatorze będzie już
prawdopodobnie zimna. Często jednak ciekły fosfor ulega przechłodzeniu i krzepnie niemal natychmiast w całej objętości dopiero pod wpływem
lekkiego dotknięcia jego powierzchni bagietką.

Otrzymywanie białego fosforu jest już właściwie zakończone, wiele jednak jest jeszcze przed nami. Co zrobić z retortą, zawierającą resztki fosforu?
Zakładam, że nie chcemy się jej pozbyć.
Jeżeli jeszcze gorącą wyjmiemy z krystalizatora, wówczas ciekły fosfor osadzony na ściankach retorty w zetknięciu z powietrzem ulegnie natychmiast
samo zapaleniu, a to nie byłoby zbyt bezpieczne. Jeżeli zaś pozostawimy ją w spokoju do ostygnięcia, wówczas gaz w retorcie będzie zmniejszał swoją
objętość i ciśnienie atmosferyczne wepchnie wodę do środka retorty, powodując - jeśli jest jeszcze rozgrzana - jej pęknięcie.
Aby uniknąć tych przykrych zjawisk proponuję coś w rodzaju wypośrodkowania dwóch wymienionych metod. Czekamy, aż zimna woda wejdzie do
około 3/4 długości szyjki retorty i dopiero wtedy podnosimy retortę pozwalając wypłynąć znajdującej się w szyjce wodzie. Oczywiście wodę w retorcie
natychmiast zastąpi powietrze, ale oziębiony w szyjce (czyli tam, gdzie jest go teraz najwięcej) fosfor nie jest już taki groźny. Burzliwa reakcja będzie
zachodziła tylko z gazowym fosforem, pozostałym w niechłodzonym wnętrzu retorty.
Jeżeli teraz zaciemnimy pomieszczenie, w którym znajduje się retorta, zauważymy charakterystyczną dla utleniającego się białego fosforu poświatę. Gdy
retorta już zupełnie ostygnie, wlewamy do niej 2-3 cm
3
dwusiarczanu węgla CS
2
(Uwaga! Substancja silnie toksyczna i łatwopalna). Następnie
zamykamy wylot retorty i wstrząsamy nią aż do rozpuszczenia się pozostałości białego fosforu.
Możemy teraz w sposób bezpieczny sprawdzić niezwykłą łatwopalność fosforu. Nanosimy na fragment bibuły do filtrowania, umieszczone w
parowniczce na siatce azbestowej, kilka kropel tak otrzymanego roztworu. Gdy tylko rozpuszczalnik odparuje, drobne cząstki fosforu osadzone na bibule
mają w sumie bardzo dużą powierzchnię, na którą oddziaływuje tlen z powietrza. Ilość powstałego z takiego utleniania ciepła jest wystarczająca do
samozapłonu fosforu białego.
Jeśli nasz roztwór fosforu w dwusiarczku węgla był bardzo rozcieńczony, może się również zdarzyć, iż pomimo samo zapalenia się fosforu płomień ma
zbyt niską temperaturę, aby spowodować zapalenie bibuły, która ulega co najwyżej lekkiemu zwęgleniu.
No tak, ciekawe doświadczenia już wykonane, a otrzymany fosfor dalej pozostaje w parowniczce. Nie możemy go przecież tam zostawić. Nie wyjmując
parowniczki z fosforem z wody, staramy się go od niej oddzielić przez podważanie szklaną łopatką, a jeśli to nie pomoże - stalowym nożem.
Utrzymując fosfor bez przerwy pod zimną wodą, możemy pokroić go na mniejsze kawałki, a następnie przenieść do szczelnie zamykanego szklanego
słoika, wypełnionego wodą, który podpisujemy i odstawiamy na półkę, pamiętając o okresowej kontroli i uzupełnianiu - w razie potrzeby - wody.
Do doświadczenia samo zapalenia na bibule filtracyjnej będziemy w przyszłości pobierać fragment białego fosforu wielkości ziarnka pszenicy i
rozpuszczać w 2 cm
3
CS
2
.
Doświadczenie pozwalające na otrzymywanie fosforu białego w retorcie jest raczej przeznaczone dla ambitniejszych nauczycieli, pragnących
zademonstrować powyższą metodę na kółku chemicznym, a przy okazji uzyskać trochę, akurat brakującego w pracowni białego fosforu.
Jeśli nie jesteśmy w stanie spełnić któregoś z punktów PHP, najlepiej wykonać próbowkową - uproszczoną wersję przemiany fosforu czerwonego w biały.
Dotyczy to szczególnie właścicieli "domowych laboratoriów", nie mogących np. ze względu na zlikwidowanie kola chemicznego wykonać przemiany w
retorcie w szkole.
Czytelników, których zainteresował temat fosforu, odsyłam do artykułu "Alotropia fosforu", zamieszczonego w nr 5/91 KCh. Na zakończenie życzę
wszystkim udanej przemiany (nie tylko fizykochemicznej) i oby nigdy nie powstała sytuacja zmuszająca nas do zastosowania roztworu CuSO
4
Andrzej Kasperowicz - (KCh 2/93)
Przemiana alotropowa - wersja uproszczona
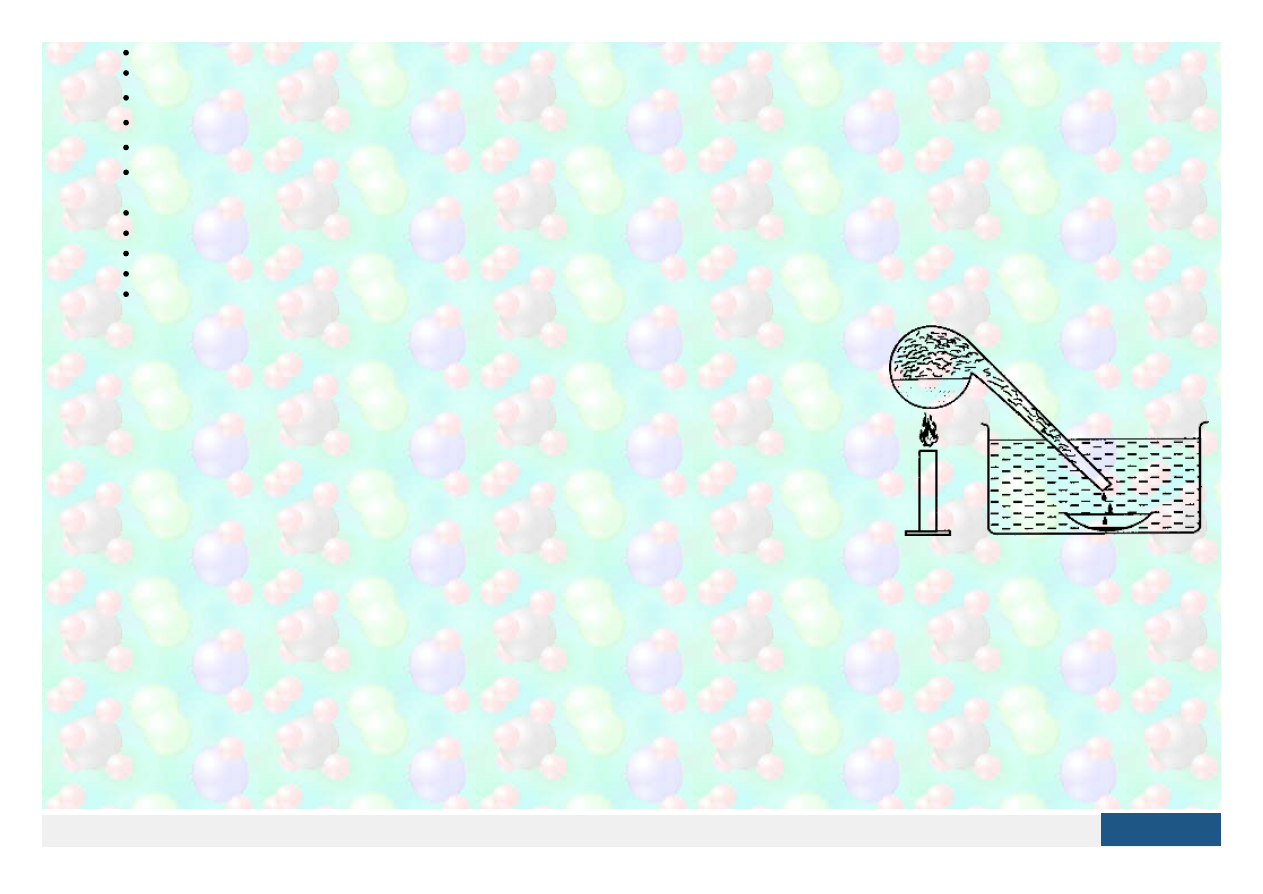
Umieszczamy w probówce odrobinę (tj. wielkości główki od szpilki, nie więcej) fosforu czerwonego lub zdrapaną z pudełka od zapałek brunatną masę do
pocierania (zawiera fosfor czerwony). Zatykamy probówkę zwitkiem waty szklanej i rozpoczynamy powolne ogrzewanie w ciemnościach i pod
wyciągiem lub na świeżym powietrzu. Podczas ogrzewania możemy zaobserwować świecenie fosforu w probówce. Przerywamy ogrzewanie usuwając
palnik spod probówki, po czym za pomocą pesety lub szczypiec do tygli wyciągamy watę szklaną, na której również możemy zauważyć świecenie
fosforu.
(KCh 2/93)
Wyszukiwarka
Podobne podstrony:
przemiany fosforu, Ochrona Środowiska, Biochemia Gleby
Bułyczow Kirył Czerwony jeleń, biały jeleń
FOSFOR CZERWONY, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
Fosfor czerwony
Patomechanizmy zaburzeń gospodarki wapniowo fosforanowej; osteoporoza
Fosfor 2
Oddychanie komorkowe i fosforylacja oksydacyjna
Hydrazyna siarczany fosforany
strącanie fosforu
kwas fosforowy
GOSPODARKA WAPNIOWO FOSFORANOWA (2)
12 Biochemia fosforylacja oksydacyjna nowa
Choroby przytarczyc i zaburzenia gospodarki wapniowo fosforanowej
Transport elektronów i fosforylacja oksydacyjna, biochemia
8 fosforany
bufor fosforanowy G
ćw 7 usuwanie fosforu ze ścieków
więcej podobnych podstron