WĘGLOWCE
Węglowiec |
6C |
14Si |
32Ge |
50Sn |
82Pb |
Konfiguracja elektronów |
[He] 2s22p2 |
[Ne] 3s23p2 |
[Ar] 4s24p2 |
[Kr] 5s25p2 |
[Xe] 6s26p2 |
E.I. [kJ·mol-1] |
1086,1 |
786,3 |
761,2 |
708,4 |
715,4 |
Promień kowal. [pm] |
77,21 |
117,6 |
122,3 |
140,5 |
146 |
Temp. topn. [oC] |
41001 |
1420 |
945 |
232 |
327 |
Rozpowszech. litos. [%] |
0,08 |
27,7 |
7.10-4 |
4.10-2 |
2.10-4 |
Elekroujemność (Pauling) |
2,5 |
1,8 |
1,8 |
1,8 |
1,9 |
1) Dla diamentu
Główne stopnie utlenienia tych pierwiastków -4, +2 i +4.
WĘGIEL
diament d = 3,51 g.cm-3. Twardość (Mohs) 10, znakomite przewodnictwo cieplne. Odmiana w normalnych warunkach metatrwała. Kongo, Syberia, RPA, Brazylia.
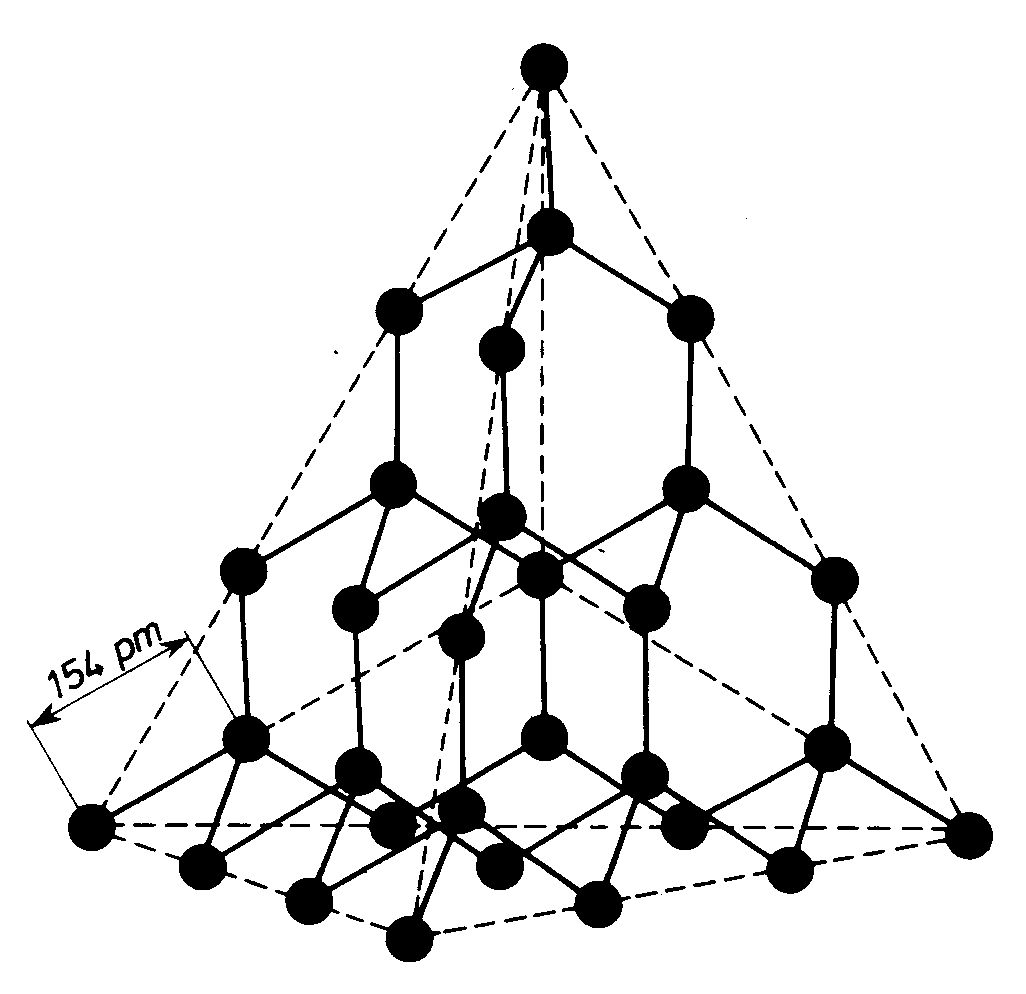
Wiązania w sieci diamentu są
wiązaniami kowalencyjnymi.
Kąty 109o28', zatem hybrydyza-
cja sp3. Długość wiązania C—C
wynosi 154 pm, co odpowiada
długości wiązania C-C w etanie.
Jest to odmiana chemicznie mało
reaktywna. Ogrzewany bez dos-
grafit tępu powietrza daje grafit.
Grafit: Madagaskar, Sri-Lanka, Korea, Norwegia, Syberia.
Gęstość 2,1-2,3 g.cm-3.
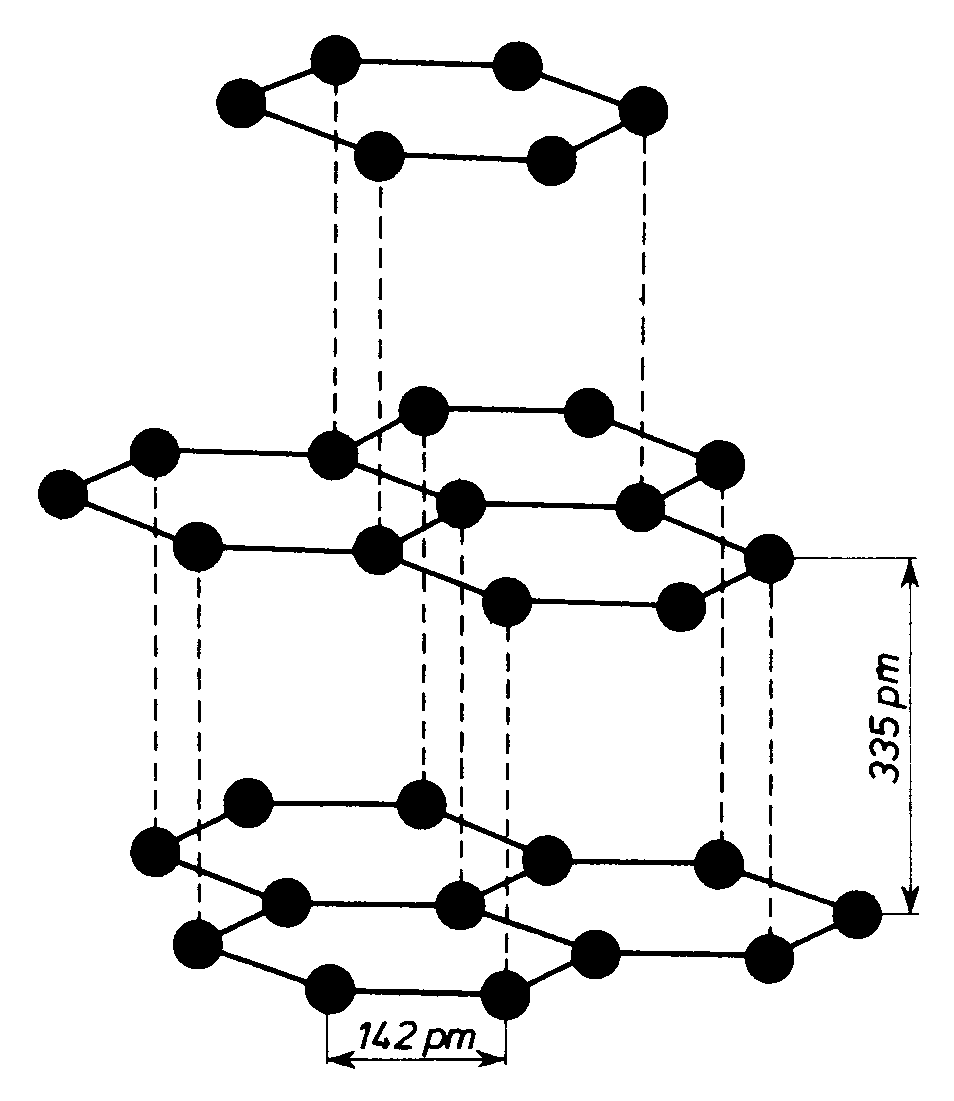
Czarnoszara, miękka odmiana, w
dotyku tłusta. Dobrze przewodzi
prąd elektryczny i ciepło. Budowa
warstwowa. Długość wiązania
C-C wynosi 142 pm, co odpowia-
da długości C-C w benzenie. W
poszczególnych warstwach prze-
wodnictwo jest dobre. Między po-
szczególnymi warstwami działają
słabe siły międzycząsteczkowe. Warstwy są łatwe do usunięcia, lub przesunięcia względem siebie.
Dość mało reaktywny chemicznie, spala się od temp. = 1000 oC.
Grafit: wyrób elektrod, tygli, ołówków, smarów, jako moderator w reaktorach atomowych.
0.0001 GPa to jest dopiero 1000 hPa czyli cisnienie atmosferyczne.
Węgiel bezpostaciowy: Sadza - niecałkowite spalanie gazu ziemnego, jest
to zgrafityzowany, rozdrobniony węgiel, produkcja w olbrzymiej skali.
Węgiel kostny - ogrzewanie kości, krwi itp.
Węgiel drzewny - sucha destylacja drewna. Węgiel aktywny - drzewny, olbrzymie rozwinięcie powierzchni, 300 - 2000 m2.g-1. Pył drzewny mieszany jest z substancjami nieorganicznymi jak wodorotlenki, węglany, siarczany, chlorki berylowców, ZnCl2 i ogrzewany do 500 - 900 oC. Zastosowanie, katalizator (COCl2, SO2Cl2), maski gazowe, oczyszczanie.
Węgiel energetyczny (kopalny) - skomplikowane, wielkocząsteczkowe polimery organiczne.
Do 92 % węgla - antracyt
Do 85 % węgla - węgiel kamienny
Do 70 % węgla - węgiel brunatny
Do 50 % węgla - torf
Węgiel kopalny (niektóre odmiany) ogrzewany do wysokich temperatur daje koks, używany w procesach metalurgicznych.
Ropa naftowa - mieszanina związków organicznych, zasadniczo węglowodory.
Łupki bitumiczne - paliwa o dużej zawartości substancji mineralnych.
Asfalt naturalny, wielkocząsteczkowe węglowodory, często zmieszane z substancjami mineralnymi.
Wosk ziemny (ozokeryt) kopalny minerał, w przybliżeniu CnH2n.
Gaz ziemny - mieszanina węglowodorów gazowych, przede wszystkim metan, zawiera często H2S oraz niekiedy He.
Minerały węglanowe:
CaCO3, kalcyt, kreda, marmur, wapień, aragonit
Kamieniołomy marmuru w Carrarze
CaCO3.MgCO3 - dolomit
MgCO3 - magnezyt,
FeCO3 - syderyt
Węgiel - zawartość w atmosferze CO2 niewielka (0,035 %) lecz bardzo ważna (efekt cieplarniany).
Związki węgla:
katenacja, tworzenie łańcuchów -E—E—E-.....-E-
Energia pojedynczego wiązania C-C 356 kJ.mol-1, C-O 336 kJ.mol-1
Energia pojedynczego wiązania Si—Si 226 kJ.mol-1, Si-O 368 kJ.mol-1
Węglowodory. Tylko po jednym przykładzie z grupy.
Metan CH4. Gaz błotny, gaz ziemny. Bez zapachu. Palny. Tworzy z powietrzem mieszaniny wybuchowe. Lampa Davy'ego (siatka).
W laboratorium: Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3COOK + KOH → K2CO3 + CH4
Jest też produktem suchej destylacji drewna.
Produkty:
20-30% gaz, przede wszystkim CH4, nieco CO i inne.
~ 40% produkty wodniste, m.i. CH3OH, CH3COCH3 i CH3COOH.
4-10% produkty smoliste (z drzew iglastych terpentyna).
20-30% węgiel drzewny.
Etylen (eten), C2H4, bezbarwny gaz, o słodkawym zapachu. Otrzymywany przez dehydratację (odwodnienie) alkoholu etylowego nad Al2O3 (600oC)
C2H5OH → C2H4 + H2O;
także przez odwodnienie C2H5OH kwasem siarkowym (stężonym).
Bardziej reaktywny od CH4. Podaj wzór Lewisa dla etylenu. Jaki jest kształt cząsteczki etylenu.
Odbarwia wodę bromową.
Uzupełnij równania reakcji C2H4 + Br2 →
Redukuje KMnO4. Uzupełnij równania reakcji
C2H4 + KMnO4 + H2SO4 → CO2 + .....+ ......+
Acetylen (etyn), C2H2, bezbarwny gaz, termodynamicznie nietrwały.
2C + H2 → C2H2 łuk elektryczny, ΔHo = 226 kJ.mol-1
CaO + 3C → CaC2 + CO piec elektryczny
CaC2 + 2H2O → Ca(OH)2 + C2H2
Jest reaktywnym gazem. Podaj wzór Lewisa i kształt cząsteczki acetylenu.
Odbarwia wodę bromową
Uzupełnij równania reakcji C2H2 + Br2 →
Redukuje (odbarwia) KMnO4 w środowisku kwaśnym
C2H2 + MnO4- + H3O+ → CO2 + .....+ ......+ itd
Zadanie domowe
C2H2 + MnO4- + OH- → CO32- + .....+ ......+ itd
C2H2 + KMnO4 → K2CO3 + .....+ ......+ itd trudne zadanie
Węgliki:
Jonowe:
1. acetylenki: karbid CaC2 i podobne (Na2C2, K2C2, Al2C6 i inne), substancja jonowa, jony Ca2+ i C22-. Podaj metodą MO konfigurację elektronową jonu acetylenkowego C22-. Oblicz rząd wiązania C—C w tym jonie.
2. metanki: Al4C3, jony Al3+ i C4-. Także Be2C. Reakcja z wodą daje metan. Zapisz tę reakcję w formie jonowej.
3. allilki: Mg2C3 i Li4C3. Jony Mg2+ i C34- . Podaj wzór Lewisa dla jonu C34-. Jaki jest kształt tego jonu.
Li4C3 + 4H2O → 4LiOH + C3H4
Kowalencyjne:
np. SiC (karborund), zbudowany podobnie do diamentu, bardzo twardy. B13C2 - tak twardy jak diament.
Metaliczne (międzywęzłowe): Bardzo wysoko topliwe twarde stopy.
Węgiel trafia w oktaedryczne luki w sieci regularnej albo heksagonalnej metali. Atomy metali powinny mieć promień ponad 130 pm.
Jeżeli wszystkie luki są wypełnione to niezależnie od metalu wzór
jest MC (TiC, WC).
Jeżeli połowa tych luk jest wypełniona to M2C (W2C, V2C).
Jeżeli metale mają mniejszy promień, to ich sieć krystaliczna zniekształca się przy tworzeniu węglików Są mniej odporne chemicznie. Przykładem jest cementyt Fe3C.
Tlenek węgla (II), tlenek węgla. Bezbarwny, bez zapachu, silnie trujący, palny gaz. Bardzo krótkie wiązanie C-O (106 pm). Gaz fizjologiczny.
Odpowiada to strukturze Lewisa -:C O:+ ligand
HCOOH → H2O + CO
Wykrywanie:
PdCl2 + CO + H2O → Pd + CO2 + 2HCl
Otrzymywanie C + O2 → CO2
C + CO2 2CO Gaz generatorowy.
Gaz wodny, rozpalenie warstwy węgla (1250 oC) i puszczenie pary wodnej.
C + H2O CO + H2 ΔHo = + 172 kJ
CO można dalej przerabiać na CO2 i H2 (gaz konwertorowy).
CO + H2O CO2 + H2 Ni 700-830 ºC
Z metanu: CH4 + H2O CO + 3H2 1100 -1300 ºC
Właściwości redukujące, szczególnie w wyższych temperaturach. Podaj reakcję spalania CO, podaj reakcję redukcji z jego pomocą tlenku miedzi (I) oraz tlenku żelaza (III).
Reaguje w obecności węgla aktywnego: CO + Cl2 → COCl2
Z parami siarki CO + S → COS
Karbonylki Ni + 4CO → Ni(CO)4 łatwo lotna ciecz.
Zastosowania tlenku węgla (II) - olbrzymie.
CO + 2H2 CH3OH ZnO-Cr2O3 albo ZnO-Cr2O3-CuO
inne alkohole i glikole można otrzymać tą metodą.
Fischer-Tropsch: nCO + (2n + 1)H2 → CnH2n + 2 + nH2O
Kwas mrówkowy: słaby kwas, K = 2.10-4, nieco mocniejszy od octowego.
Sole synteza: CO + KOH → HCOOK (mrówczan sodu)
AgNO3 + HCOOK → KNO3 + HCOOAg (biały osad)
2HCOOAg → 2Ag + CO2 + HCOOH (ogrzewanie)
Wyraźne właściwości redukujące.
2KMnO4 + 5HCOOH +3H2SO4 → 2MnSO4 + 5CO2 + K2SO4 + 8H2O
Uzupełnij reakcję K2Cr2O7 + H2SO4 +HCOOH → związki Cr(III)
Kwas szczawiowy: kwas średniej mocy, w pierwszym stopniu dysocjacji
Wzory rezonansowe jonu szczawianowego
Wykazuje właściwości redukujące.
MnO4 - + H2C2O4 + ......= Mn2+ + ..... + .......
Podaj podobną reakcję z K2Cr2O7
Strącanie soli wapnia.
Tlenek węgla (IV), ditlenek węgla. Bezbarwny, duszący gaz, o lekko kwaskowym smaku i zapachu. Kształt cząsteczki jest liniowy.
Odpowiada to strukturze Lewisa O C O
Otrzymywanie, produkcja przemysłowa:
C(s) + O2(g) → CO2(g) ΔHo = -393 kJ.mol-1.
CaCO3(s) → CO2(g) + CaO(s) ΔHo = + 178,8 kJ
Także z procesów fermentacyjnych odzyskuje się CO2.
CO2 pochłania się w roztworze Na2CO3
Na2CO3 + CO2 + H2O 2NaHCO3 (ogrzewanie odwraca proces)
lub w roztworze etanoloaminy
25-65 o C
HOCH2CH2NH2 + CO2 + H2O (HOCH2CH2NH3)HCO3
100-150 o C
W laboratorium CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
Gaz o gęstości większej od powietrza. Obliczcie ile razy gęstość CO2 jest
większa od gęstości powietrza. Przyjąć średnią masę molową powietrza = 29.
Jest gazem niepalnym i nie podtrzymującym (w normalnym rozumieniu tego słowa) palenia. Świece, benzyna gasną w atmosferze CO2. W małych stężeniach nie jest toksyczny, w dużych jest toksyczny.
Spalanie jakichkolwiek substancji zawierającej węgiel daje CO2. Także węglowodanów np. C6H12O6 w organizmie człowieka. Człowiek wydycha dziennie 350 dm3 CO2. Gazy „wydechowe” człowieka około 5 % CO2.
Wykrywanie CO2. CO2(g) + Ca(OH)2(aq) → H2O(l) + CaCO3(s)
Znika zabarwienie fenoloftaleiny i strąca się biały osad.
Podaj reakcję spalania glukozy w organizmie.
Silne reduktory np. Mg redukują CO2 CO2 + 2Mg → 2MgO + C
Podobnie: CaCO3 + 2Mg → CaO + 2MgO + C
Stosowany jako medium chłodzące, jako wypełniacz gaśnic śniegowych w aerozolach jako środek napędowy. Do napojów chłodzących. Jako środek ekstrakcyjny w wielu procesach technologicznych (w postaci cieczy). W butlach jest w postaci ciekłej. W postaci stałej „suchy lód”.
Istotna ilość jest zużywana do produkcji mocznika.
CO2 + 2NH3 OC(NH2)ONH4 OC(NH2)2 + H2O
CO2 miernie rozpuszcza się we wodzie. 0,9 dm3/dm3 H2O w 20 oC.
Roztwór jest małej mocy kwasem. Większość CO2 jest w postaci uwodnionych cząsteczek CO2(aq) a nie H2CO3.
Zatem dysocjację pierwszego stopnia należy raczej przedstawić:
K<1,6.10-3
CO2.H2O H2CO3 H3O+ + HCO3- KH2CO3 = 4,5.10-7
HCO3- H3O+ + CO32- KHCO3- = 4,8.10-11
Licząc tylko H2CO3 a nie sumę CO2.H2O + H2CO3 otrzymujemy KH2CO3 = 1,3.10-4.
W warunkach bezwodnych można otrzymać kwas węglowy jako stałą substancję w reakcji (bezwodny eter, suchy HCl, okres półtrwania H2CO3 w temp. 300 K wynosi 180000 lat):
NaHCO3 + HCl = H2CO3 + NaCl
Wodorowęglany - jon HCO3-, wszystkie sole oprócz litowców dobrze rozpuszczalne we wodzie Podaj wzór chemiczny wodorowęglanu baru.
Węglany - jon CO32-, wszystkie sole oprócz litowców nierozpuszczalne we wodzie Podaj wzór chemiczny węglanu miedzi(I).Podaj kształt jonu CO32-, jaki jest kąt O—C—O w tym jonie. Podaj wszystkie wzory rezonansowe jonu CO32- oraz jonu HCO3 -.
2NaOH + CO2 → Na2CO3 + H2O (fenoloftaleina różowa)
Na2CO3 + H2O + CO2 → 2NaHCO3 (barwa fenoloftaleiny znika)
2NaHCO3 → Na2CO3 + H2O + CO2 (fenoloftaleina różowa)
Nieco podobnie reaguje Ca(OH)2, tylko wytrąca się CaCO3
Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l)
CaCO3(s) + H2O(l) + CO2(g) Ca(HCO3)2(aq) rozpuszczanie wapienia
CO32- + CO2 + H2O → 2HCO3- tworzenie jaskiń wapiennych
Pochodne kwasu węglowego. .
kwas kwas kwas mocznik fosgen
węglowy nadwęglowy karbaminowy
Dwusiarczek węgla: jasnożółta ciecz (tw = 46 oC), bardzo łatwo zapalna, silnie toksyczna. Nie miesza się z wodą. Dobrze rozpuszcza I2, P4, S8.
Synteza: C + ¼ S8 → CS2 (1000 oC)
CH4 + ½ S8 → CS2 + 2H2S
Jest to związek reaktywny chemicznie. Spala się do SO2 lub S i CO2 zależnie od ilości tlenu.
Dwucyjan (CN)2; pseudohalogen, halogenoid. Bezbarwny , trujący gaz.
Podobieństwo do Cl2: AgCl, AgCN - białe nierozpusz. w HNO3 sole.
Chlorocyjan Cl—CN, chlorek jodu Cl—I
2NaOH + Cl2 → NaCl + NaOCl + H2O
2NaOH + (CN)2 → NaCN + NaOCN + H2O
Reakcje powstawania: Hg(CN)2 → Hg + (CN)2↑ (+ paracyjan CnNn)
żółty biały
2CuSO4 + 4KCN → 2K2SO4 + 2Cu(CN)2↓ → 2CuCN ↓ + (CN)2↑
CuCN + 3KCN → K3[Cu(CN)4] na jakie jony dysocjuje ten związek?
2CuSO4 + 4KI → 2K2SO4 + 2CuI2 ↓ → 2CuI ↓ + I2
Spala się bardzo gorącym płomieniem (4800 oC)
Cyjanowodór HCN; kwas pruski, t.w. = 25,6 oC, stała dielektryczna ε = 107. Miesza się z wodą. Bardzo silna trucizna. Jest związkiem termodynamicznie nietrwałym. Może polimeryzować prawie wybuchowo. W
roztworach wodnych słaby kwas. KCN - roztwór wodny silnie alkaliczny.
KCN + H2O KOH + HCN zapisz reakcję jonowo.
Produkcja cyjanowodoru w przemyśle:
b) proces Degussa CH4 + NH3 → HCN + 3 H2
(katalizator Pt/Rh albo Pt/Ir, 1200-1300 oC)
W laboratorium: KCN + H2SO4 → HCN + KHSO4
Zastosowanie HCN, przede wszystkim przemysł tworzyw sztucznych.
Cyjanki: jonowe, jon CN-. Rozpuszczalne we wodzie litowców i berylowców. Rozpuszczalny także słabo zdysocjowany Hg(CN)2.
Jon CN- znakomity ligand, izoelektronowy z CO
Tworzy trwałe kompleksy z większością metali przejściowych (bloku d).
FeSO4 + 2KCN → K2SO4 + Fe(CN)2 (brunatny osad)
Fe(CN)2 + 4KCN → K4[Fe(CN)6]
FeCl3 + 3KCN + 3H2O → 3KCl + Fe(OH)3 + 3HCN zapiszcie reakcje
Fe(OH)3 + 6KCN → 3KOH + K3[Fe(CN)6] w formie jonowej
Podaj reakcje jonów Zn2+, Cd2+, Cu2+, Ni2+ oraz Co3+ z nadmiarem KCN.
AgI nie roztwarza się w NH3(aq), ale znakomicie w KCN
AgI(s) + 2KCN(aq) → K[Ag(CN)2](aq) + KI(aq) - zapisz jonowo
Cyjanki są reduktorami. Reagują z tlenem (powoli) do izocyjanianów
2KCN + O2 → 2KNCO anion OCN- izoelektronowy z CO2.
KCN + PbO → KNCO + Pb KNCO + Ag+ → AgNCO ↓ + K+
Pochodzi od beztlenowego kwasu izocyjanowego H-N=C=O.
Z siarką do rodanków: KCN + 1/8 S8 → KSCN
(NH4)2S2 + KCN → (NH4)2S + KSCN
Zakwaszamy HCl i wykrywamy jon SCN-.
Fe3+ + 3SCN- → Fe(SCN)3 Fe(SCN)3 + 3SCN- → [Fe(SCN)6]3-
Pochodzi od kwasu izotiocyjanowego H-N=C=S.
Produkcja przemysłowa NaCN:
Na(l) + NH3(g) → NaNH2(s) + ½H2(g) amidek sodu.
2NaNH2 + C → Na2CN2 + 2H2 cyjanamidek sodu.
Podaj wzór Lewisa tego związku i opisz kształt anionu.
Na2CN2 + C → 2NaCN
Zastosowanie NaCN bardzo duże. Ekstrakcja złota i srebra z urobku skalnego. Galwanotechnika.
4 Au + 8 NaCN + 2H2O + O2 → 4Na[Au(CN)2] + 4NaOH
Zapisz w formie jonowej reakcję ekstrakcji srebra metalicznego Ag z rud za pomocą NaCN. Podaj utleniacz i reduktor.
Halogenowe pochodne węgla:
CF4 - gaz, bardzo odporny chemicznie.
CCl4 - mało reaktywna ciecz, nie reaguje w normalnych warunkach z kwasami ani z zasadami. Nie ulega reakcji hydrolizy.
CS2 + 3Cl2 → CCl4 + S2Cl2
CCl2F2 - freon, technika chłodnicza (ograniczenia stosowania).
C2F4 - tetrafluoroetylen , monomer do produkcji teflonu.
KRZEM
Nietoksyczny pierwiastek, bardzo czysty krzem stosuje się jako półprzewodnik. Bardzo duże zastosowanie ma również wiele związków krzemu.
Występuje w postaci krzemianów, glinokrzemianów i jako ditlenek krzemu SiO2.
SiO2 + 2Mg → 2MgO + Si ΔHo = - 369 kJ.mol-1
Dla potrzeb elektroniki bardzo czysty krzem wytwarza się przez pirolizę SiHCl3.
Stop żelaza z krzemem, żelazokrzem - hutnictwo.
Krzemki: Z metalami daje krzemki. 2Mg + Si → Mg2Si
Krzemki reagują z wodą dając krzemowodory (silany).
Mg2Si + 4H2O → Mg(OH)2 + SiH4
SiCl4 + LiAlH4 → LiCl + AlCl3 + SiH4
Krzem z kwasami nie reaguje. Z zasadami wydziela wodór.
Si + 4NaOH → Na4SiO4 + 2H2
Koloidalna krzemionka SiO2, bardzo rozwinięta powierzchnia.
Stopiony i szybko oziębiony SiO2 - szkło kwarcowe.
Polimery krzemoorganiczne:
Monomery:
metylotrichlorosilan dimetylodichlorosilan trimetylochlorosilan
Tworzywa silikonowe: temperatura pracy od - 100 oC do + 300 oC.
Podstawowa reakcja - kondensacja monomerów.
Oleje 62% produkcji polimerów siloksanowych
Inna metoda produkcji olejów silikonowych.
Elastomery (kauczuki silikonowe, 25 %) - wulkanizacja np. rodnikowa. Mogą być inne rodzaje wulkanizacji
Żywice silikonowe: dodaje się w trakcie kondensacji pewne ilości metylotrichlorosilanu, co daje punkty sieciowania.
Związki halogenowe krzemu.
SiF4. Si + 2F2 → SiF4
Trawienie szkła, próba zajączkowa.
4HF + SiO2 SiF4 + 2H2O 2HF(aq) + SiF4(g) → H2SiF6(aq)
Sumarycznie: 6HF + SiO2 → H2SiF6 + 2H2O
Także krzemiany ulegają reakcji z HF.
Podaj reakcję CaSiO3 z HF.
SiCl4.
Otrzymuje się go w bezpośredniej syntezie. Si + 2Cl2 → SiCl4
Ciecz, gwałtownie hydrolizująca (zupełnie inaczej niż CCl4)
SiCl4 + 2H2O → 4HCl + SiO2 ↓
Związki tlenowe krzemu.
Tlenek krzemu (II) trwały tylko w 1500 - 1600K.
SiO2 + Si 2SiO.
Tlenek krzemu (IV), dwutlenek krzemu. Zupełnie inny niż gazowy CO2. Krystaliczne ciało stałe. Polimer o wiązaniach kowalencyjnych. Zawsze atom krzemu otoczony jest przez 4 atomy tlenu.
Minerały: kwarc górski, ametyst (fioletowy), opal (bezpostaciowy), ziemia okrzemkowa. Występuje w różnych odmianach niskociśnieniowych, kwarc, trydymit i krystobalit.
Kryształy α kwarcu wykazują enancjomorfizm. Jest to zdolność do występowania w dwóch odmianach skręcających płaszczyzny polaryzacji światła w przeciwnym kierunku.
SiO2 ulega działaniu alkaliów:
stapianie SiO2 + 2NaOH → Na2SiO3 + H2O
w roztworze SiO2 + 4NaOH → Na4SiO4 + 2H2O
Także Na2CO3 stapianie SiO2 + Na2CO3 → Na2SiO3 + CO2
Na2SiO3 może istnieć w postaci stopu. W roztworze wodnym jon SiO32- nie
istnieje (wiązanie Si=O bardzo reaktywne, reakcja z wodą). Roztwór wodny krzemianów sodu nazywamy szkłem wodnym.
Reakcje szkła wodnego z uwodnionym zielonym NiCl2.6H2O, białym CaCl2.6H2O i
z różowym CoCl2.6H2O dają osady Ni2SiO4 (zielony), Ca2SiO4(bezb) i Co2SiO4
(niebieski) o półprzepuszczalnych ściankach.
Kwasy krzemowe. SiO2 jest bezwodnikiem kwasu krzemowego.
Hydroliza krzemianów: Na4SiO4 + H2O Na3HSiO4 + NaOH
SiO44- + H2O → HSiO43- + OH-
Dodanie kwasu do krzemianów: Na4SiO4 + 4HCl → H4SiO4 + 4NaCl
Dodanie soli amonowych do krzemianów:
Na4SiO4 + 4NH4Cl → H4SiO4 + 4NaCl + 4NH3
Kwas ortokrzemowy kondensuje i daje kwasy polikrzemowe. Kwasy jedno i dwukrzemowy są rozpuszczalne we wodzie.
Dalsza kondensacja wytwarza dłuższe struktury, a także struktury rozgałęzione.
Powstają roztwory koloidalne i dalej
galaretowate żele. Wysuszony żel kwa-
sów polikrzemowych daje silikażel o
bardzo rozwiniętej powierzchni.
Szkło: szkła są ciałami izotropowymi. Ciało izotropowe - właściwości nie zależą od kierunku pomiaru. Ciało anizotropowe, właściwości zależą od kierunku pomiaru.
Odczyn szkła - alkaliczny. Rozpuszczalność we wodzie jest niewielka.
Nie topi się ostro, mięknie w pewnym zakresie temperatur.
Szkła krzemianowe jak i szkło kwarcowe składa składają się z tetraedrów SiO4 połączonych ze sobą. Jeżeli połączenie jest uporządkowane to mamy stan krystaliczny, jeżeli nieuporządkowane to stan szklisty. Odszklenie - krystalizacja szkła.
Szkło okienne produkuje się przez stapianie piasku z CaCO3 i Na2CO3 w temp. około 1500 oC.
Lepsze szkło laboratoryjne - często dodaje się Na2B4O7.10H2O (boraks) oraz K2CO3.
Szkło laboratoryjne typu „Pyrex” ma dużą zawartość B2O3 i Al2O3.
Szkło kryształowe zawiera PbO.
Barwienie szkła: tlenki kobaltu - fioletowo niebieskie.
Cr2O3 - zielone, Au - rubinowe, Ag - żółte.
Szkło kwarcowe, stopiony i szybko oziębiony SiO2. Bardzo mały współczynnik rozszerzalności cieplnej, rozgrzane nie pęka przy szybkim oziębianiu. Normalne szkło (nawet Pyrex) pęka.
GERMAN
Nietoksyczny pierwiastek, w stanie czystym półprzewodniki oraz optyka do podczerwieni. German wydobywa się zasadniczo z popiołów węglowych lub z pyłów powstających przy obróbce rud cynku.
Ge - sieć przestrzenna typu diamentu, półprzewodnik, oczyszczany metodą topienia strefowego. Jego przewodnictwo wzrasta z temperaturą.
Na powietrzu po ogrzaniu utlenia się do GeO2. Ge + O2 → GeO2
Podobnie kwasy utleniające utleniają go do GeO2.
Uzupełnij: Ge + HNO3 →
GeO2 ma właściwości zdecydowanie kwaśne. Rozpuszcza się dość słabo we wodzie nadając jej odczyn kwaśny.
GeO2 + 2H2O → H4GeO4
Dobrze rozpuszcza się w zasadach dając ortogermaniany.
GeO2 + 4NaOH → Na4GeO4 + 2H2O
GeO2 + 4HCl GeCl4 + 2H2O Stężony HCl
Halogenowe pochodne germanu (IV).
GeF4 - gaz. 3GeF4 + 2H2O → 2H2[GeF6] + GeO2
2KF + GeF4 → K2[GeF6]
GeCl4 - ciecz. GeCl4 + 2KCl → K2[GeCl6]
GeH4 - gaz, związek endotermiczny, ΔHo = 90,9 kJ.mol-1.
CYNA
Kasyteryt SnO2. Otrzymywanie - redukcja węglem kasyterytu.
Łatwo topliwy (232 oC) biały metal (cyna biała-odmiana β). W 13,2 oC przechodzi w odmianę α o strukturze diamentu (cyna szara).
Używana jako stopy do lutowania, jako brązy (stopy z Cu Zn i P), także inne stopy. SnCl4 - kwas Lewisa używany jako katalizator w reakcjach Friedel- Krafts.
Duża ilość organicznych związków cyny jest używana w przemyśle.
C4H9 Cl R R
C4H9—Sn—C4H9 H3C—Sn—CH3 R—Sn—O—Sn—R
C4H9 Cl R R
Cyna jest pierwiastkiem w małych stężeniach niezbędnym dla ludzi. W większych stężeniach związki cyny działają słabo toksycznie.
Przy silnym ogrzaniu utlenia się do SnO2.
Sn2+(aq) + 2e = Sn(s) Eo = -0,137 V.
Zatem roztwarza się w kwasach nieutleniających.
Sn(s) + 2HCl(aq)→ SnCl2(aq) + H2(g)
Zn2+(aq) + 2e = Zn(s) Eo = -0,763 V.
Cynk jest silniejszym reduktorem niż cyna.
Zatem cynk redukuje związki Sn(II).
SnCl2 + Zn ZnCl2 + Sn (jeż cynowy).
Roztwarza się także w gorących zasadach.
Sn + 4H2O + 2NaOH → Na2[Sn(OH)6] + 2H2
Cynowodór: Mało trwały związek.
SnCl4 + LiAlH4 → SnH4 + LiCl + AlCl3
.
Związki cyny (II):
SnCl2 ciało stałe. Można bezwodny otrzymać przez reakcję ogrzanej cyny z gazowym HCl. Z roztworu wodnego krystalizuje dihydrat SnCl2.2H2O. Przy rozcieńczaniu hydrolizuje i wydziela się sól zasadowa Sn(OH)Cl. Napisz reakcję hydrolizy SnCl2.
Wzór Lewisa cząsteczki SnCl2.
Czy to jest kwas, czy
zasada Lewisa, czy też jedno i drugie.
Wzór Lewisa stałego (SnCl2)n , podobny do (GeF2)n.
Polimer ten rozpuszcza się w rozpuszczalnikach donorach pary elektronowej, np. THF, Py, woda. Reaguje także z donorem pary elektronowej jakim jest jon Cl-.
(SnCl2)n + nHCl → n H[SnCl3] podaj kształt anionu.
przy dużym stężeniu HCl powstaje H2[SnCl4] podaj kształt anionu.
SnCl2 + 2NaOH → Sn(OH)2 + 2NaCl biały, amfoteryczny
Sn(OH)2 + NaOH → Na[Sn(OH)3]
Sn(OH)2 + 2NaOH → Na2[Sn(OH)4]
Sn(OH)2 + 2HCl → SnCl2 + 2 H2O
Sole Sn(II) mają charakter redukujący.
SnCl2 + 2HgCl2 → SnCl4 + Hg2Cl2
SnCl2 + Hg2Cl2 → SnCl4 + 2Hg
SnCl2 + 2HCl + ½ O2 → SnCl4 + H2O
Podaj reakcję SnCl2 z H3AsO4 w środowisku kwasu solnego. Podaj reakcję SnCl2 z FeCl3.
Nie udowodniono istnienia jonów typu [Sn(H2O)n]2+. W roztworach SnCl2 są kationy pochodzące od polimerycznych powiązanych przez mostki tlenowe indywiduów.
SnS - brunatny osad, rozpuszczalny w (NH4)2S2. Podaj reakcję. Podaj reakcję otrzymywania SnS. Powstaje on także w bezpośredniej syntezie.
Związki cyny (IV) - najbardziej trwały stopień utlenienia.
SnF4 - ciało stałe o polimerycznej strukturze.
SnCl4 - bezbarwna, dymiąca na powietrzu ciecz. Łatwo hydrolizuje. SnCl4 + 2H2O → SnO2 + 4HCl
Roztwór wodny SnCl4 to koloid uwodnionego SnO2.
Jest silnym kwasem Lewisa. SnCl4 + 2 HCl → H2[SnCl6]
SnO2 - biały, mało reaktywny chemicznie proszek.
3Sn + 4HNO3 → 3SnO2 + 4NO + 2H2O
Sn + H2SO4(stęż.) → .......................... Podaj reakcję.
SnCl4 + 4NaOH → 4NaCl + Sn(OH)4 → SnO2.nH2O
Świeżo strącony SnO2 rozpuszcza się w HCl (stężonym) oraz w NaOH.
SnO2 + 2H2O + 2NaOH → Na2[Sn(OH)6]
SnO2 + 6HCl → H2[SnCl6] + 2H2O
Starzenie się osadu polega na coraz dalszej kondensacji fragmentów
„Stary” SnO2 stapiamy z NaOH SnO2 + 2NaOH → Na2SnO3 + H2O
Na2SnO3 + 3H2O → Na2[Sn(OH)6]
SnS2 - żółty osad rozpuszczalny w KOH, (NH4)2S2 i (NH4)2S.
SnS2 + (NH4)2S2 → (NH4)2SnS3 + S Podaj reakcje z KOH i (NH4)2S
OŁÓW
204 - naturalny, natomiast 206, 207 i 208 z rozpadów promieniotwórczych innych pierwiastków. Ołów z różnych rud ma różną masę atomową.
Dość rozpowszechniony pierwiastek. PbS - galena, PbSO4 - anglezyt i ceruzyt - PbCO3. Ze względu na inne metale ważne są jeszcze minerały PbCrO4 - krokoid, PbMoO4 - wulfenit, PbWO4 - sztolcyt i wanadynit 3Pb3(VO4)2.PbCl2. Najważniejszy minerał galena.
Produkcja: PbS + 1½O2 → PbO + SO2
PbO + CO → Pb + CO2
PbS + 2O2 → PbSO4
PbSO4 + SiO2 → PbSiO3 + SO2 + ½O2
PbSiO3 + CaO + CO → Pb + CaSiO3 + CO2
Prawie cała produkcja akumulatory i stopy i amunicja. Minia Pb3O4 jako pigment używana w farbach antykorozyjnych. Także PbCrO4 i Ca2PbO4 - pigmenty do farb. Pb(OH)2.2PbCO3 - biel ołowiana, jeden z najlepszych pigmentów. Używany także do emaliowania oraz do produkcji szkła kryształowego. Dawniej Pb(C2H5)4 jako dodatek do benzyny.
Powoduje istotne uszkodzenia w wątrobie, mózgu, układzie nerwowym. Małe dawki powodują anemię, duże uszkadzają szybko centralny układ nerwowy. Toksyczność jest średnia, ale kumuluje się i jest prawie wszędzie obecny.
Niebieskawo-biały (świeży przekrój), miękki metal. Na powietrzu szary,
pokryty cienką warstwą zasadowego węglanu. W stanie stopionym reaguje z tlenem powietrza tworząc PbO. Nie udowodniono istnienia jonów typu [Pb(H2O)n]2+. Dobrze rozpuszcza się w kwasach utleniających
Pb + HNO3 → NO + ....................
Pb + H2SO4 → Pb(HSO4)2 + ....................
Pb2+(aq) + 2e = Pb(s) Eo = -0,126V.
Jednak praktycznie nie rozpuszcza się w kwasach nieutleniających, gdyż tworzą się osady chroniące metal przed dalszą reakcją.
Zn2+(aq) + 2e = Zn(s) Eo = -0,762V.
Cynk zatem wypiera ołów z jego soli.
Pb(CH3COO)2 + Zn → Zn(CH3COO)2 + Pb (maczuga Saturna)
Tlenek PbO PbCO3 → CO2 + PbO (czerwony
żółty)
PbO jest amfoteryczny. Podaj jego reakcje z KOH i CH3COOH.
Pb(OH)2 + 2HNO3 → Pb(NO3)2 + 2H2O
Pb(OH)2 + NaOH → Na [Pb(OH)3] lub Na2[Pb(OH)4]
PbSO4 słabo rozpuszczalny we wodzie, dobrze rozpuszczalny w silnych kwasach :
2PbSO4(s) + 2HNO3(aq) → Pb(HSO4)2(aq) + Pb(NO3)2(aq)
PbSO4(s) + H2SO4(aq) → Pb(HSO4)2(aq)
Reakcje strąceniowe:
PbCl2 (biały), PbI2 (żółty), PbCrO4 (żółty), PbF2 (biały) i PbS (czarny).
Związki ołowiu (IV). Stosunkowo mało trwałe.
PbCl4 → PbCl2 + Cl2 Nietrwała żółta ciecz, łatwo hydrolizuje.
PbCl4 + 2H2O PbO2 + 4HCl
Jest kwasem Lewisa PbCl4 + 2KCl → K2[PbCl6] trwałe związki
PbO2 - otrzymywanie i właściwości.
Technicznie, utlenianie anodowe soli Pb(II), czarnobrunatny proszek.
Pb2+(aq) + 2H2O → PbO2(s) + 4H+(aq) + 2e
Silne utleniacze w środowisku alkalicznym
Pb(OH)2 + NaClO → PbO2 + NaCl + H2O
Pb(OH)2 + Cl2 + 2NaOH → PbO2 + 2NaCl + 2H2O
Właściwości raczej kwasowe.
PbO2 + 2KOH + 2H2O → K2[Pb(OH)6] silne utleniacze
Ze stężonym HCl (ogrzewanie) wydziela Cl2, ze stężonym H2SO4 wydziela tlen (ogrzewanie). PbO2 + H2SO4 → PbSO4 + H2O + ½O2
PbO2 silne właściwości utleniające w środowisku kwaśnym.
2Mn2+ + 5PbO2 + 4H3O+ → 2MnO4- + 5Pb2+ + 6H2O
Zapisz reakcję w formie cząsteczkowej.
Minia - Pb3O4 (2PbO.PbO2) pigment, działanie antykorozyjne.
Ogrzewanie glejty w strumieniu powietrza: 3PbO + ½O2 → Pb3O4
Akumulator ołowiowy.
Rysunek przedstawia jedną komorę akumulatora, składającą się z
dwóch elektrod ołowianych zanurzonych w 20 - 30 % H2SO4.
W akumulatorze katoda jest biegunem dodatnim a anoda ujemnym.
a. stan naładowany: katoda (+) - PbO2, anoda (-) - gąbczasty ołów
katoda: PbO2(s) + H2SO4(aq) + 2H+(aq) + 2e PbSO4(s) + 2H2O
(rozładowanie) E0 = 1.685 V
anoda: Pb(s) + SO42-(aq) PbSO4(aq) + 2e E0 = 0.356 V

Podczas ładowania
podłącza się źródło
- + prądu i reakcje za-
chodzą odwrotnie.
k
a a rozładowanie
n t
o o
d d ładowanie
a a
Przegląd grupy. Skokowa zmiana z drugiego do wyższych okresów.
W trzecim i wyższych okresach brak jest tendencji do tworzenia wiązań podwójnych (p-p)π, a pojawia się tendencja do tworzenia wiązań (p-d)π. Ze wzrostem liczby atomowej maleje tendencja do tworzenia łańcuchów. Ze wzrostem liczby atomowej wzrasta tendencja do rozszerzenia oktetu. Dla węgla brak takiej tendencji. Ze wzrostem liczby atomowej maleje trwałość wiązania E-H i coraz silniej zaznaczane są cechy metaliczne. Ze wzrostem liczby atomowej maleje trwałość +IV stopnia utlenienia, a zwiększa się trwałość +II stopnia utlenienia.
EFEKT BIERNEJ PARY ELEKTRONOWEJ. Dla bloku p !!!
Jest to tendencja do tworzenia kationów o ładunku o 2 niższym niż wynika to z numeru grupy. Dotyczy to także stopni utlenienia. W wyższych okresach elektrony s powłoki walencyjnej mają niską energię gdyż są słabo ekranowane od jądra i często nie biorą udziału w tworzeniu jonów, czy też wiązań chemicznych.
32
Wyszukiwarka
Podobne podstrony:
16-WIELOPIERŚCIENIOWE WĘGLOWODORY AROMATYCZNE, kolo1
Sld 16 Predykcja
Ubytki,niepr,poch poł(16 01 2008)
9 Ch organiczna WĘGLOWODANY
16 Metody fotodetekcji Detektory światła systematyka
wyklad badania mediow 15 i 16
RM 16
W08 Patofizjologia zaburzeń gospodarki węglowodanowej
16 Ogolne zasady leczenia ostrych zatrucid 16903 ppt
Węglowodory analityka
WĘGLOWODANY 3
Wykład 16 1
(16)NASDAQid 865 ppt
16 2id 16615 ppt
więcej podobnych podstron