5. A L K E N Y
A. Kołodziejczyk 2010. 02
5.1 Występowanie
Węglowodory o wzorze sumarycznym CnH2n mogą być alkenami, jeżeli zawierają jedno podwójne wiązanie C=C lub cykloalkanami. Alkeny zaliczane są do węglowodorów nienasyconych, zaś cykloalkany do nasyconych. Węglowodory cykliczne też mogą być nienasycone, jeżeli zawierają wiązania wielokrotne; te z jednym wiązaniem podwójnym mają wzór sumaryczny CnH2n-2. Znane są również węglowodory i inne związki, w których jest więcej niż jedno podwójne wiązanie C=C; noszą one nazwę polienów. Alkeny i polieny występują często w naturze. Eten - CH2=CH2 jest hormonem roślinnym przyspieszającym dojrzewanie owoców. Znane barwniki roślinne, np. grupa karotenów, a pośród nich, np. czerwonobrązowy -karoten występujący w marchwi czy czerwony likopen nadający barwę pomidorom. Karoteny są prowitaminami witaminy A, a likopen ma silne działanie przeciwnowotworowe. Terpeny (np. mircen, limonen, pineny) jako oligomery izoprenu też należą do nienasyconych związków, zaś kauczuk stanowiący typowy przykład naturalnego polienu jest również polimerem izoprenu. Dawniej alkeny nazywano również olefinami; nazwa ta nadal jest używana w przemyśle.
Rys.5.1. Przykłady naturalnych alkenów i polienów
W ropie naftowej alkeny i polieny występują w małych ilościach. Dużo ich znajduje się w produktach przeróbki ropy naftowej, pochodzących szczególnie z procesów wysokotemperaturowych. Wiele z nich wytwarzana jest specjalnie w reakcjach krakingu i reformingu.
5.2 Stopień nienasycenia
Cząsteczka dowolnego alkanu zawiera dwa atomy wodoru więcej niż cząsteczka alkenu o tej samej liczbie atomów węgla, co obrazują odpowiednie wzory sumaryczne: CnH2n+2 w porównaniu do CnH2n. Podobnie w cząsteczkach węglowodorów łańcuchowych znajdują się 2 atomy wodoru więcej, niż w odpowiadającym im analogach pierścieniowych.
Warto porównać wzory cząsteczek dowolnego węglowodoru o wzorze sumarycznym C6H14, czyli heksanu, zarówno normalnego, jak i rozgałęzionego z węglowodorami o wzorze sumarycznym C6H12.
Do tego zbioru mogą dojść jeszcze izomery węglowodorów rozgałęzionych i cyklicznych o mniejszych pierścieniach
Zadanie: narysuj wzory tych izomerów
Poprzez wprowadzenie do cząsteczki alkenu dwóch atomów wodoru (wysycenia) otrzymujemy odpowiedni alkan i z tego powodu węglowodory (związki organiczne) zawierające wiązania wielokrotne (podwójne lub potrójne) nazywają się węglowodorami nienasyconymi (związkami nienasyconymi). Różnią się one od związków nasyconych stopniem nienasycenia, czyli liczbą cząsteczek wodoru - H2, potrzebnych do przeprowadzenia związku nienasyconego w nasycony. Podobna sytuacja występuje w związkach cyklicznych, dlatego każde podwójne wiązanie i każdy pierścień jest równoważny jednemu stopniowi nienasycenia - przyłączenie cząsteczki H2 wysyca podwójne wiązanie lub rozrywa pierścień i prowadzi do nasyconego związku łańcuchowego. Heksan jest węglowodorem nasyconym, natomiast hekseny, a także cykloheksan czy metylocyklopentan należą (tylko formalnie) do węglowodorów nienasyconych o stopniu nienasycenia równym 1, z kolei izopren (2-metylobuta-1,3-dien), cyklobuten, bicyklo[3.2.0]heptan i 4-metylopent-2-yn są związkami o stopniu nienasycenia 2, zaś stopień nienasycenia benzenu (cykloheksa-1,3,5-trienu) wynosi 4.
Stopień nienasycenia oblicza się przez podzielenie przez 2 liczbę atomów wodoru potrzebnych do wysycenia danego węglowodoru (związku), np. ze wzoru sumarycznego benzenu - C6H6 - wynika, że do jego całkowitego wysycenia potrzeba 8 atomów wodoru, (formalne porównanie do składu heksanu - C6H14), czyli stopień nienasycenia benzenu jest równy 4 (8:2).
Zadanie: oblicz stopień nienasycenia -karotenu i likopenu.
5.3 Nomenklatura
Najpopularniejsze alkeny posiadają nazwy zwyczajowe, które można uznać za nazwy półsystematyczne, ponieważ wywodzą się od nazw alkanów i są powszechnie stosowane, np. etylen (CH2=CH2), propylen (CH3CH=CH2), butylen, izobutylen. Do typowych nazw zwyczajowych należą nazwy dawno poznanych alkenów, np. izopren, mircen czy pinen. Nazwy alkenów wg zasad IUPAC tworzy się zamieniając końcówkę „an” alkanu o takiej samie liczbie atomów węgla na końcówkę „en”. W ten sposób otrzymujemy nazwy kolejnych homologów alkenów: eten, propen, buten, itd. Wymienione powyżej najpopularniejsze nazwy zwyczajowe, jako od dawna zakorzenione, są akceptowane przez UIPAC.
Atomy węgla w cząsteczce numeruje się w ten sposób, żeby podwójnemu wiązaniu przypisać lokant o najniższej wartości; lokant podwójnego wiązania oznacza nr atomu węgla, przy którym zaczyna się podwójne wiązanie (niższy numer atomów węgla tworzących wiązanie C=C).
Dla węglowodorów zawierających 2 lub więcej podwójnych wiązań zamiast końcówki „en” wprowadza się odpowiednio końcówkę „a-dien” (dla dwóch C=C), „a-trien”, itd., przy czym lokanty wskazujące miejsce podwójnych wiązań w łańcuchu umieszcza się pomiędzy literą „a” i resztą tej końcówki:
5.3.1 Zasada najniższego zestawu lokantów
Atomy węgla w łańcuchu numeruje się w ten sposób, żeby uzyskać najniższy zestaw lokantów, tzn. taki, żeby wartości kolejnych lokantów w wzrastającym szeregu były możliwie najniższe, np. zestaw lokantów 2,3,6,8, jest niższy niż 3,4,6,8 lub 2,4,5,7.
W węglowodorach rozgałęzionych jako główny przyjmuje się najdłuższy łańcuch węglowy zawierający podwójne wiązanie.
Ta sama zasada (najniższego zestawu lokantów) obowiązuje w nazewnictwie węglowodorach pierścieniowych.
nie
3-etylocykloheksen 3,5-dimetylocykloheksen 2,7-dimetylocyklohepta-1,3-dien
Reszta -CH2- nazywana jest metylenem, =CH2 - metylidenem, CH2=CH- - winylen, a CH2=CH−CH2- - allilem.
Zadanie: przypisz poszczególnym atomom C właściwe lokanty.
5.3.2 Izomeria cis/trans
Izomeria cis/trans (Z/E), zwana również izomerią geometryczną, związana jest z zahamowaniem obrotu wokół podwójnego wiązania C=C. W alkenach, podobnie jak w związkach cyklicznych jest możliwość występowania izomerii cis/trans. W izomerze cis podstawniki starsze usytuowane są po tej samej płaszczyźnie podwójnego wiązania, a w izomerze trans - po jego przeciwnych stronach.
Starszeństwo podstawników wyznacza się na takich samych zasadach, jak przy ustalaniu starszeństwa przy określeniu konfiguracji absolutnej.
Symbole Z i E pochodzą od pierwszych liter niemieckich słów zusammen (razem po tej samej stronie, czyli cis) i entgegen (po przeciwnej stronie, czyli trans).
Cykloalkeny o niedużych rozmiarach pierścienia (do 8 atomów C) występują zawsze jako izomery cis, natomiast te o większych pierścieniach mogą zawierać wiązania C=C zarówno cis, jak i trans.
W nazwie małych cykloalkenów opuszczamy przedrostek cis, ponieważ tylko takie izomery mogą istnieć, dla większych pierścieni nazwa cykloalkenu powinna poprzedzana przedrostkiem określającym dany stereoizomer.
Zadanie: wytłumacz dlaczego cykloalkeny o niedużych pierścieniach występują wyłącznie jako izomery cis.
5.4 Właściwości fizyczne, fizykochemiczne i fizjologiczne alkenów
5.4.1 Temperatura wrzenia i topnienia
Niższe alkeny podobnie jak alkany o zbliżonej masie cząsteczkowej są gazami, wyższe są cieczami, a te o wysokiej masie cząsteczkowej nie topnieją w temperaturze pokojowej. Wartości temperatur wrzenia i topnienia monoenów i alkanów są zbliżone.
Porównanie wartości tw. i tt. alkenów i alkanów o tej samej liczbie atomów C i izomerów alkenów Tabela 5.1
tw.oC tt.oC tw.oC tt.oC
etan -89 -183 eten -104 -165
propan -42 -188 propen -48 -185
butan -0,5 -138 but-1-en -6,5 <-190
(E)-but-2-en 1 -106
(Z)-but-2-en 3,7 -139
Różnice we właściwościach pomiędzy izomerami butenu są wyraźnie.
-Karoten jest ciałem krystalicznym o tt. 183oC.
5.4.2 Rozpuszczalność
Alkeny, podobnie jak alkany, są hydrofobowe, nierozpuszczalne w wodzie, dobrze rozpuszczają się w niepolarnych rozpuszczalnikach organicznych.
5.4.3 Palność
Są łatwopalne. Lotne alkeny tworzą mieszanki wybuchowe z powietrzem.
5.4.4 Zapach
Zapach alkenów jest znacznie bardziej intensywny niż alkanów, ostry, raczej nieprzyjemny.
Eten ma działanie narkotyczne, odurzające.
5.5 Elektronowa struktura wiązania C=C
Wiązanie podwójne C=C powstaje w wyniku nałożenia się orbitali atomów węgla, których elektrony walencyjne uległy hybrydyzacji sp2, co oznacza, że hybrydyzacji uległ elektron s i dwa elektrony p.
Rys.5.2. Hybrydyzacja sp2 atomu C
Leżące na jednej płaszczyźnie osie trzech orbitali sp2 przecinają się pod kątem 120o, a prostopadle do tej płaszczyzny znajduje się orbital 2pz obsadzony przez 1 elektron.
Atom węgla, zhybrydyzowany w sposób sp2 może z drugim takim samym atomem utworzyć wiązanie podwójne C=C. Składa się ono z wiązania σ powstałego w wyniku osiowego nałożenia się 2 orbitali sp2 i wiązania w wyniku nałożenia się 2 orbitali p, których wzajemnie równoległe osie są prostopadle do płaszczyzny tworzonej przez osie orbitali sp2.
Rys. 5.3. Wiązanie podwójne C=C składa się z wiązania σ i wiązania
Wiązanie powstaje w wyniku nałożenia się dwóch orbitali p, które są osiowo równoległe do siebie. Tylko w tym układzie jest możliwe utworzenie takiego wiązania. Obrót atomów C wokół wiązania σ jest swobodny, w przypadku C=C wymaga dostarczenia dużej energii, potrzebnej do zerwania wiązania . Brak swobodnego obrotu wokół wiązania podwójnego C=C jest przyczyną występowania izomerii cis/trans.
Energia wiązania podwójnego C=C wynosi 611 kJ/mol (146 kcal/mol) z czego 347 kJ/mol (83 kcal/mol) przypada na wiązanie σ, a 264 kJ/mol (63 kcal/mol) na wiązanie . Z porównania tych wartości wynika, że wiązanie jest znacznie bardziej reaktywne od wiązania σ, tak więc reakcje z udziałem wiązania są charakterystyczne dla alkenów.
Cząsteczka etenu różni się od cząsteczki etanu parametrami, tzn. długością wiązań i wartością kątów.
5.6 Otrzymywanie alkenów
5.6.1 Piroliza ropopochodnych
Głównym źródłem alkenów są procesy petrochemiczne wykorzystujące surowce ropopochodne. W wysokiej temperaturze długie łańcuchy węglowodorowe pękają tworząc mniejsze fragmenty, pośród których znajdują się alkeny. Tego typu reakcje nazywają się krakingiem. (ang. crack - pękać). W temperaturze 800-900oC wiązania C-C pękają 8-9 razy szybciej niż C-H. Piroliza czyli rozkład węglowodorów wyłącznie pod wpływem wysokiej temperatury nazywa się krakingiem termicznym. Są jeszcze innego rodzaju krakingi, np. katalityczny (z użyciem katalizatorów) czy hydrokraking, w obecności katalizatorów i wodoru. Podczas hydrokrakingu nie otrzymuje się alkenów, ponieważ w trakcie procesu ulegają one uwodornieniu.
W uproszczeniu reakcje krakingu można zapisać jako rozkład długiego łańcuchu alkanu na dwa: jeden alkanu i drugi alkenu.
Jest to bardzo skomplikowana reakcja, ponieważ jej pierwotne produkty ulegają dalszym przemianom i powstaje złożona mieszanina, zawierająca zwykle 10-20% metanu (wagowo), alkany i alkeny gazowe, ciekłe oraz stałe, a także koks (węgiel pierwiastkowy). Podczas każdej niekatalitycznej pirolizy węglowodorów powstaje mieszanina alkenów, ale proces można tak prowadzić, żeby wybrany z nich, np. eten, propen, buteny, butadien czy izopren stanowił główny produkt.
Pośród wszystkich produktów chemicznego przemysłu organicznego eten jest wytwarzany na największą skalę - około osiemdziesięciu mln ton rocznie. Kraking, którego celem jest produkcja etenu pozwala ten surowiec otrzymywać z wysoką wydajnością - zawartość etenu w produktach gazowych przekraczała 30%.
5.6.2 Laboratoryjna synteza alkenów
Alkeny otrzymuje się z innych związków organicznych w reakcjach eliminacji małych cząstek, np. halogenowodorów, wody, amoniaku czy wodoru.
5.7 Właściwości chemiczne alkenów
Charakterystyczną reakcją alkenów jest addycja - reakcja przyłączenia atomów lub grup atomów do podwójnego wiązania. Najczęściej spotykanym typem reakcji addycji jest addycja elektrofilowa; biegnie ona mechanizmem jonowym. Addycję elektrofilową zapoczątkowuje atak elektrofilu na wiązanie , w wyniku czego wytwarza się nowe wiązanie pomiędzy atomem węgla i elektrofilem (kosztem wiązania ), a powstały w ten sposób karbokation po przyłączeniu nukleofila zostaje przekształcony w związek nasycony.
Znane są też reakcje addycji biegnące mechanizmem rodnikowym, do których należą reakcje uwodornienia katalitycznego lub przyłączenia bromowodoru w obecności światła, rodników albo pod wpływem podwyższonej temperatury. Zwykle reakcje addycji elektrofilowej biegną bez katalizatorów, natomiast reakcje addycji rodnikowej muszą być wspomagane za pomocą katalizatorów lub w inny sposób (światłem, termicznie czy substancjami generującymi rodniki).
Do podwójnego wiązania przyłączyć się mogą reagenty symetryczne, np. wodór (H2) czy halogeny (X2) lub niesymetryczne, np. halogenowodory (HX), woda, tiole (RSH) i inne reagenty.
Addycja reagentów symetrycznych Addycja reagentów niesymetrycznych
5.7.1 Uwodornienie
Uwodornienie alkenów polega na przyłączeniu cząsteczki wodoru do podwójnego wiązania. Jest reakcją egzotermiczną, ponieważ tworzące się dwa nowe wiązania C−H typu σ są mocniejsze od rozrywanych wiązań H−H (σ) i C−C typu . Ilość wydzielonego ciepła (wartość bezwzględna H) w wyniku uwodornienia 1 mola alkenu nazywa się ciepłem uwodornienia alkenu (ciepłem hydrogenacji). Średnia wartość ciepła uwodornienia jednego mola C=C wynosi 126 kJ/mol (30 kcal/mol).
Rola katalizatora w reakcjach uwodornienia
Alkeny nie reagują z wodorem po zmieszaniu, nawet w wysokiej temperaturze. Do addycji H2 do C=C (uwodornienia) dochodzi w obecności katalizatora. Katalizator obniżając energię aktywacji reakcji zwiększa jej szybkość, ponieważ zwiększa populację cząsteczek substratu zdolnych do pokonania bariery energetycznej, jaką jest energia aktywacji.
Rys. 5.4. Zmiany energii potencjalnej cząsteczki podczas reakcji uwodornienia alkenu bez katalizatora i z katalizatorem
W cząsteczkach zaadsorbowanych na powierzchni katalizatora dochodzi do rozluźnienia wiązań σ w H−H i w C=C, dzięki czemu ich rozerwanie i utworzenie nowych wiązań C−H staje się łatwiejsze.
Rys. 5.5 Zasada działania katalizatora w reakcji uwodornienia alkenów; addycja wodoru następuje w sposób syn
O addycji wodoru w sposób syn świadczy produkt deuterowania cykloheksanu - tworzy się wyłącznie cis-1,2-dideterocykloheksan.
5.7.2 Ciepło uwodornienia alkenów
Molowe ciepło uwodornienia alkenów Tabela 5. 2
Alken |
Wzór |
Ciepło uwodornienia [kJ/mol (kcal/mol)] |
eten |
CH2=CH2 |
137 (32,8) |
propen |
CH3CH=CH2 |
126 (30,1) |
but-1-en |
CH3CH2CH=CH2 |
127 (30,3) |
pent-1-en |
CH3CH2CH2CH=CH2 |
126 (30,1) |
heks-1-en |
CH3CH2CH2CH2CH=CH2 |
127 (30,1) |
3-metylobut-1-en |
CH3CH(CH3)CH=CH2 |
127 (30,3) |
3,3-dimetylobut-1-en |
(CH3)3CCH=CH2 |
127 (30,3) |
4,4-dimetylopent-1-en |
(CH3)3CCH2CH=CH2 |
124 (29,5) |
cis-but-2-en |
|
119,7 (28,6) |
trans-but-2-en |
|
115,5 (27,6) |
2-metylopropen |
|
119 (28) |
cis-pent-2-en |
|
120 (28,6) |
trans-pent-2-en |
|
116 (27,6) |
2-metylo-but-2-en |
|
113 (26,9) |
2,3-dimetylobut-2-en |
|
111 (26,6) |
5.7.3 Ciepło uwodornienia alkenów, a ich trwałość
Ilość ciepła wydzielanego podczas uwodornienia jest zależna od trwałości reagującego związku; im bardziej trwały, tym mniej wydzieli się energii cieplnej podczas przejścia od substratu do produktu.
Z dwóch izomerów but-2-enu (trans- i cis-) w wyniku uwodornienia powstaje ten sam produkt - n-butan i zostaje zużyta taka sama ilość wodoru/mol substratu. W reakcji uwodornienia cis-but-2-enu wydziela się 119,7 kJ/mol (28,6 kcal/mol), a trans-but-2-enu 115,5 kJ/mol (27,6 kcal/mol), co oznacza, że izomer trans jest trwalszy od cis o 4,2 kJ/mol.
Podczas uwodornienia cis-pent-2-enu wydziela się 119,7 kJ/mol (28,6 kcal/mol), a uwodornienie jego izomeru trans daje 115,5 kJ/mol (27,6 kcal/mol). Różnica, która świadczy o większej trwałości izomeru trans wynosi podobnie jak w przypadku butenów 4,2 kJ/mol (1kcal/mol).
Rys. 5.6 Zależność wielkości ciepła uwodornienie od trwałości substratu
Istnieje aż 6 izomerów konstytucyjnych pentenów; znacznie więcej niż butenów (2). Na podstawie porównania wartości ich ciepła uwodornienia można ocenić różnicę energii potencjalnej, a tym samym oszacować wpływ konstytucji cząsteczki na jej trwałość. Położenie podwójnego wiązania w łańcuchu i liczba podstawników alkilowych wokół C=C decyduje o trwałości, a także reaktywności alkenu.
Z porównania wartości ciepła uwodornienia izomerów wynika, że im więcej grup alkilowych wokół C=C, tym trwalszy izomer. Biorąc pod uwagę to spostrzeżenie można ułożyć szereg trwałości alkenów.
Szereg trwałości alkenów:
R2C=CR2 >R2C=CHR >R2C=CH2 >RCH=CHR >RCH=CH2 >CH2=CH2
Trwałość produktów ma wpływ na kierunek takich reakcji, jak dehydrogenacja, dehalogenacja czy dehydratacja. Ten wpływ objawia się tym, że podczas eliminacji cząsteczki H2, HCl, Cl2 lub HOH, z kilku możliwych powstaje alken trwalszy, z przewagą tym większą im bardziej jest trwały.
5.7.4 Trwałość cykloalkenów
Cykloalkeny zawierające 5 lub więcej atomów węgla w pierścieniu wykazują podobną trwałość jak alkeny alifatyczne. Natomiast wiązanie podwójne w cyklobutanie i cyklopropanie dodatkowo zwiększa napięcie, ponieważ zmniejszenie kąta pomiędzy wiązaniami ze 120o (dla atomów węgla o hybrydyzacji sp2 tworzących wiązanie C=C) do 90o lub 60o odpowiednio jak jest w cyklobutanie i cyklopropanie wymaga znacznie większej energii niż zmiana kąta z wartości 109,5o, charakterystycznej dla hybrydyzacji sp3.
Cyklopropen jest trwały jedynie w niskiej temperaturze, natomiast znany jest naturalny, stosunkowo trwały związek zawierający ugrupowanie cyklopropenowe - kwas sterkulinowy, składnik oleju otrzymywanego z nasion tropikalnego drzewa - Sterculia foelida.
Izomery trans cykloalkenów, podobnie jak cykloalkanów są trwałe jedynie pośród większych pierścieni, zawierających 10 lub więcej atomów w pierścieniu, ponieważ dla małych pierścieni utworzenie układu trans jest geometrycznie trudne.
5.8 Addycja elektrofilowa
W trakcie reakcji addycji do podwójnego wiązania C=C dochodzi do rozerwanie wiązania pomiędzy atomami C=C i rozerwania wiązania σ w cząsteczce, która zostaje przyłączona, np. XY, a w ich miejsce powstają dwa nowe wiązania σ CX oraz CY.
Rys. 5.7 Etapy addycji elektrofilowej
Reakcja addycji elektrofilowej do wiązania podwójnego C=C zaczyna się od ataku elektrofila X+ i utworzenie z elektronami nowego wiązania σ - C-X. Wiązanie C=C jest miejscem o wysokiej gęstości elektronowej, wobec czego wykazuje powinowactwo do czynników elektrofilowych - „lubiących elektrony”. Należą do nich czynniki wykazujące deficyt elektronowy, np. kwasy Lewisa: H+, BF3, lun kationy Hg+2, Br+ i inne. W drugim etapie reakcji do atomu węgla z deficytem elektronów C+, zwanym karbokationem przyłącza się nukleofil Y-, przy czym powstaje drugie wiązanie σ - C-Y.
Reakcja addycji zaczynająca się od ataku elektrofila nazywana jest addycją elektrofilową, pomimo tego, że również nukleofil ulega przyłączeniu, ale dopiero w drugim etapie reakcji. Alken wraz z elektrofilem tworzy karbokation, który stabilizuje się przez dokooptowanie nukleofila, np. anionu.
Przykład: addycja chlorowodoru do etenu
5.8.1 Orientacji w reakcjach addycji elektrofilowej
Zwykle w produktach reakcjach addycji cząsteczki XY do alkenu przeważa jeden z możliwych izomerów.
5.8.2 Reguła Markownikowa
Włodzimierz Markownikow, na podstawie obserwacji zaproponował w 1869 r. regułę przewidywania konstytucji produktów reakcji addycji elektrofilowej w następującym brzmieniu: w reakcji addycji jonowej H-X do podwójnego wiązania C=C atom wodoru przyłącza się do tego atomu węgla, przy którym znajduje się więcej atomów wodoru (mniej podstawników alkilowych), zaś X do drugiego podwójnie związanego atomu C.
Włodzimierz Markownikow (1837-1904), prof. w Kazaniu, Odessie i w Moskwie, doktorat u Butlerowa
Uzasadnienie reguły Markownikowa
W I etapie reakcji addycji następuje przyłączenie H+ do C=C i powstaje najbardziej trwały karbokation, czyli karbokation najbardziej rozgałęziony.
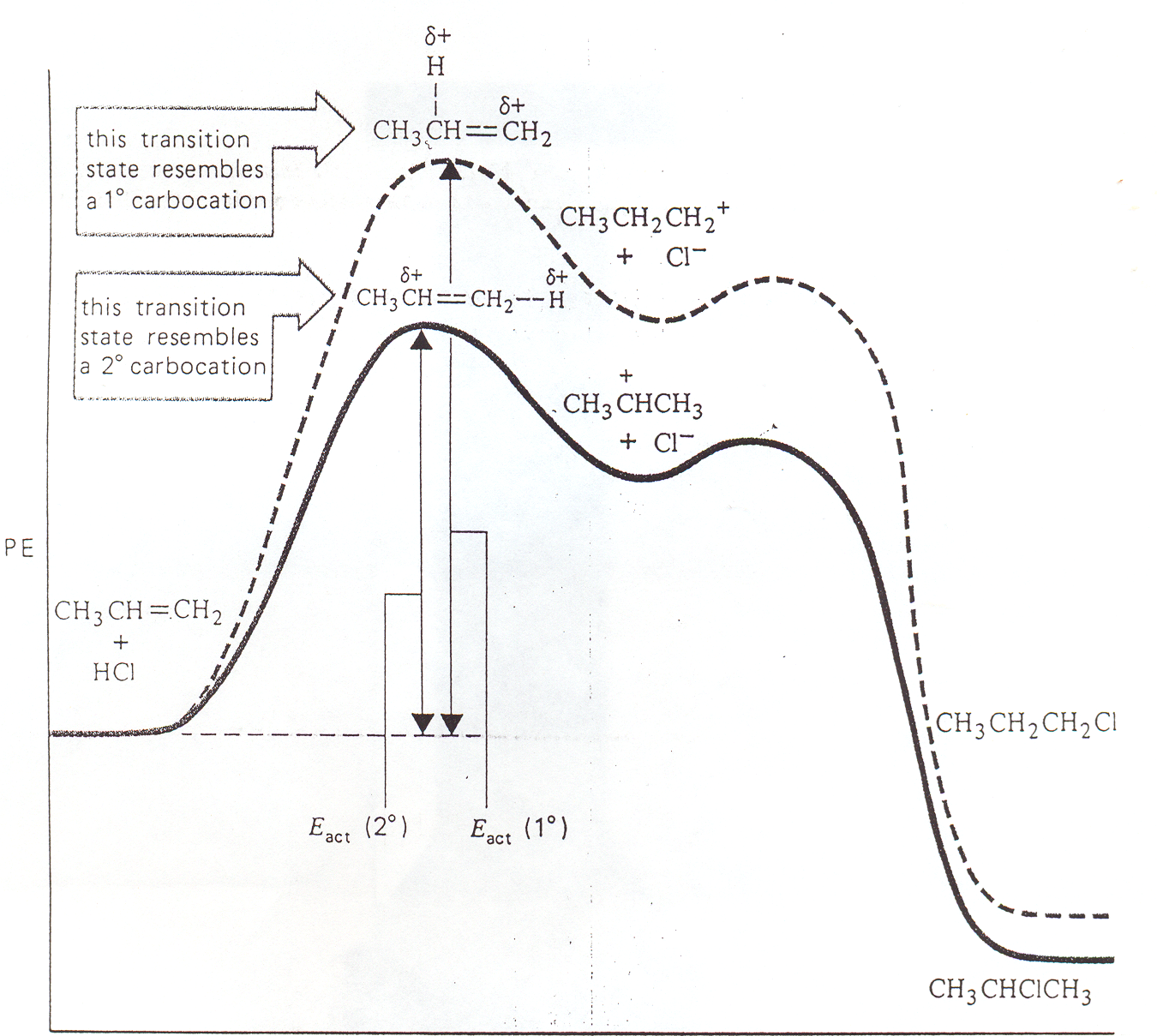
Rys. 5.8. Wykres zmian energii potencjalnej w reakcji addycji HCl do propenu. Niższa wartość energii aktywacji Eact(2o) niż Eact(1o) sprzyja powstawaniu takiego produktu przejściowy, z którego tworzy się związek zgodnie z regułą Markownikowa (chlor przyłącza się do wyżej rzędowego atomu węgla - 2o)
Przegrupowania obserwowane w trakcie niektórych reakcji addycji elektrofilowej potwierdzają z jonowy mechanizm tych reakcji.
Po przyłączeniu się protonu do 3-metylobut-1-enu tworzy się 2o karbokation, który ma możliwość przegrupowania się do bardziej stabilnego karbokationu 3o. W drugim etapie reakcji jon Cl- reaguje zarówno z 2o, jak i 3o karbokationem i w rezultacie powstają dwa produkty.
Migracji może ulec nie tylko jon wodorkowy H- jak w powyższym przykładzie, ale nawet cała grupa metylowa.
3-chloro-2,2-dimetylobutan 2-chloro-2,3-dimetylobutan
5.8.3 Addycja niezgodna z regułą Markownikowa
Reguła Markownikowa nie zawsze przewiduje właściwy produkt. Odnosi się ona tylko do reakcji biegnących mechanizmem jonowym. Przyłączenie bromowodoru (ale nie HCl ani HI) do propenu w obecności rodników lub/i w podwyższonej temperaturze prowadzi do 1-bromopropanu, podczas gdy w wodzie HBr przyłącza się zgodnie z regułą Markownikowa.
Przyczyna tej różnicy tkwi w rodzaju elektrofilu biorącym udział w obu reakcjach. W wodzie reakcja biegnie mechanizmem jonowym i proton jest tym reagentem (elektrofilem), który rozpoczyna addycję tworząc najbardziej trwały karbokation. W obecności nadtlenków lub w podwyższonej temperaturze z bromowodoru powstaje rodnik bromkowy (Br.) i to on staje się elektrofilem, który rozpoczyna reakcję, przyłączając się do alkenu w ten sposób, że powstaje najtrwalszy karborodnik. Rodnik bromkowy jest elektrofilem, ponieważ posiada deficyt elektronów.
Szereg trwałości rodników: H3C. < RH2C. < R2HC. < R3C.
Bromowodór przyłącza się do alkenów niezgodnie z regułą Markownikowa wówczas, kiedy reakcja biegnie mechanizmem rodnikowym.
Przykład
Inicjator rodnikowy R. w reakcji z tetrabromkiem węgla generuje rodnik .CBr3, który jako elektrofil przyłącza się do alkenu w taki sposób, że powstaje najtrwalszy rodnik, a dalej reakcja biegnie już łańcuchowo.
5.8.4 Ćwiczenia
nadtlenki nadtlenki
(CH3)2C=CH2 + CH3CH2SH __→ ? CH3CH2CH2CH=CH2 + HCCl3 __→ ?
nadtlenki
CH3CH2C(CH3)=CH2 + CCl4 __→ ?
nadtlenki nadtlenki
n CH2=CH2 ___→ ? n CH2=CHCl ___→ ?
5.8.5. Addycja fluorowców
Chlor, brom lub jod ulegają łatwo addycji do podwójnego wiązania C=C dając vicinalne dihalogenoalkany.
Reakcja addycji bromu do C=C jest prostym testem na obecność nienasyconych wiązań w badanym związku organicznym. Znikanie brunatnego koloru podczas dodawania bromu do związku organicznego wskazuje na obecność w nim podwójnych wiązań. Nie jest to jednak test selektywny, ponieważ niektóre inne grupy funkcyjne równie szybko reagują z bromem.
Liczba jodowa stosowana do określania udziału nienasyconych kwasów tłuszczowych w danym tłuszczu jest miarą stopnia nienasyconości tłuszczu - wyrażana jest w procentach masy przyłączonego jodu do masy próbki tłuszczu.
Stereochenia addycji halogenów do C=C
Teoretycznie, przyłączenie cząsteczki halogenu, np. bromu do podwójnego wiązania C=C może nastąpić w dwojaki sposób: oba atomy bromu zostaną przyłączone z tej samej strony wiązania podwójnego lub po stronach przeciwnych.
W reakcji z niesymetrycznymi alkenami, w zależności od sposobu addycji Br2 mogą powstać różne produkty, np. w reakcji bromu z trans-1-fenylopropenem można spodziewać się dwóch produktów erytro - (RR) i (SS) lub treo - (SR) i (RS).
Biorąc pod uwagę fakt, że przyłączenie z jednej strony wiązania C=C może nastąpić równocześnie od dołu lub od góry w stosunku do płaszczyzny cząsteczki, a z dwóch stron od góry przy jednym atomie C i dołu przy drugim lub odwrotnie, to produktami takiej reakcji jest mieszanina stereoizomerów, w pierwszym przypadku (RR) i (SS) - erytro oraz w drugim przypadku (SR) i (RS) - treo.
Jak jest w rzeczywistości? Odpowiedź na to pytanie daje eksperyment: powstaje produkt erytro, a poznanie mechanizmu addycji bromu do C=C wyjaśniło przyczynę tego zjawiska.
Mechanizm addycji halogenów do podwójnego wiązania
Cząsteczka halogenu w pobliżu podwójnego wiązania pod wpływem elektronów ulega polaryzacji, a następnie jonizacji.
Kation bromkowy Br+ przyłącza się do jednego z atomów sp2 tworząc karbokation, do którego z kolei przyłącza się anion bromkowy.
Atak anionu bromkowego następuje z przeciwnej strony do obecnego już w cząsteczce atomu bromu. Jest to dobrze widoczne w reakcjach bromowania węglowodorów cyklicznych.
Dokładne studia wykazały, że addycja dodatniego jonu bromkowego Br+ do C=C prowadzi do przejściowego, trójczłonowego, cyklicznego jonu bromoniowego, zwanego nieklasycznym jonem bromoniowym, a w drugim etapie, po ataku jonu bromkowego Br- tworzą się dwa wiązania C-Br po przeciwnych stronach.
Tego typu mechanizm addycji halogenów do podwójnego wiązania wyjaśnia dlaczego w reakcji halogenów z cykloalkenami powstają izomery trans.
W 1994 r. G. Olah otrzymał nagrodę Nobla za syntezę i udowodnienie budowy trwałych, cyklicznych kationów bromoniowych.
George Andrew Olah (ur. 1927 na Węgrzech), doktorat w 1949 r. w Budapeszcie, prof. w Univ. Nord Caroline, USA.
Jonowy mechanizm addycji do C=C widoczny jest w reakcji alkenów z chlorkiem jodu ICl. Chlorek jodu jest spolaryzowany, dlatego jego addycja do podwójnego wiązania zachodzi szybko. Pierwszy przyłącza się jod, jako elektrofil. Przyłączenia jodu jest regiospecyficzne - powstaje najtrwalszy karbokation.
Taki mechanizm addycji elektrofilowej, tzn. tworzenie się przejściowo kationu bromoniowego - jest przyczyną powstawania różnych stereoizomerów w reakcji przyłączenia cząsteczki halogenu (bromu lub chloru) do trans- lub cis-alkenów.
W wyniku przyłączenia bromu do trans-alkenu powstaje racemat (R,S) i (S,R), ↑
zaś produktem przyłączenia do izomeru cis-alkenu jest racemat (R,R) i (S,S) ↓
W reakcji addycji halogenu do cykloalkenów powstaje mieszanina racemicznych trans-dihalogenocykloalkanów.
Przyczyna tworzenia się izomeru trans w trakcie bromowania cykloalkenów leży w tym, że płaski, nieklasyczny jon bromoniowy może być atakowany przez anion bromkowy z jednej lub drugiej strony płaszczyzny pierścienia.
5.8.6 Addycja wody - hydratacja
Alkeny, w odwracalnej reakcji przyłączają cząsteczkę wody tworząc alkohole. Addycja ta jest katalizowana silnymi kwasami (np. rozcieńczonym kwasem siarkowym) lub kwaśnymi katalizatorami stałymi - zeolitami. Produkt powstaje zgonie z regułą Markownikowa.
Addycja wody do podwójnego wiązania C=C nie zawsze biegnie z dobrą wydajnością, ponieważ konkurencję stanowi katalizowana kwasami polimeryzacja, zaś wysoka hydrofobowość wyższych alkenów zmniejsza ich rozpuszczalność w wodzie, a tym samym redukuje szybkość reakcji.
Mechanizm reakcji jest podobny do addycji halogenowodorów. W pierwszym etapie następuje protonowanie podwójnego wiązania, w taki sposób, żeby powstał najtrwalszy karbokation, a następnie dochodzi do przyłączenia cząsteczki wody i odszczepienie protonu z atomu tlenu.
Zadanie: na przykładzie propenu zaproponuj mechanizm addycji cząsteczki wody do podwójnego wiązania C=C.
5.8.7 Reakcje hydroborowania
Diboran (dawniej zwany borowodorem) - B2H6 - przyłącza się do podwójnego wiązania tworząc addukty zwane alkiloboranami. Jest to ważna reakcja, ponieważ poprzez przekształcenie alkiloboranów można do cząsteczek organicznych wprowadzać różne grupy funkcyjne. Dla uproszczenia cząsteczka diboranu będzie zapisywana w postaci monomeru, zwanego boranem - BH3.
W ten sposób kolejno wszystkie trzy atomy wodoru boranu mogą zostać podstawione resztami organicznymi, w rezultacie w reakcji etenu z boranem powstaje trietyloboran:
H2C=CH2 + BH3 _→ B(CH2CH3)3 trietyloboran
Diboran jest toksycznym, łatwopalnym i wybuchowym gazem. Komercyjnie dostępny jest w postaci roztworu w tetrahydrofuranie: BH3.THF.
Reakcja alkenów z boranem biegnie poprzez kompleks i stan przejściowy etapami, aż do wyczerpania atomów wodoru przy atomie boru. Cząsteczka boranu, jako odczynnik elektrofilowy (deficyt elektronów na atomie boru - tylko 6 elektronów wokół niego) przyłącza się do podwójnego wiązania w ten sposób, że tworzy z nim kompleks (kompleks ), który przekształca się w stan przejściowy z częściowym ładunkiem dodatnim na bardziej stabilnym wyżej rzędowym atomie węgla, dlatego przyłączenie boranu zwykle zachodzi niezgodnie z regułą Markownikowa.
Reakcje trialkiloboranów
Z alkenów poprzez trialkiloborany można otrzymywać alkohole. Reakcja polega na usunięciu atomu boru poprzez utlenianie alkiloboranów nadtlenkiem wodoru w środowisku alkalicznym.
Mechanizm reakcji
Kwaśna hydroliza alkiloboranów prowadzi do alkanów. Jest to alternatywny sposób redukcji alkenów do alkanów.
Addycja boranu do 3-metylocykloheksenu nie zawsze jest regiospecyficzna, ponieważ oprócz większego powinowactwa do niżej rzędowego atomu węgla, atom boru równocześnie preferuje mniej zatłoczoną pozycję. W reakcji boranu z 3-metylocykloheksenen otrzymuje się produkty przyłączenia w pozycji 2 i 3 w stosunku 1:1. Bardziej rozbudowane borany zwiększają wydajność produktu addycji w mniej zatłoczonym miejscu.
Addycja rozbudowanego boranu cyklicznego - 9BBN - 9-borobicyklo[3.3.1]nonanu zachodzi bardziej stereoselektywnie. 9BBN otrzymuje się w reakcji cyklookta-1,5-dienu z BH3.
Borany przyłączają się selektywnie w przypadku natrafienia w sąsiedztwie C=C na zawadę przestrzenną, np. w postaci grupy metylowej.
Alkohol, otrzymany w tej reakcji jest izomerem produktu powstającego w wyniku uwodnienia 1-metylocyklopentenu w środowisku kwaśnym czy też w reakcji jego oksyrtęciowania.
5.8.8 Otrzymywanie halohydryn - addycja halogenów do alkenów w wodnym środowisku
Produkt addycji kationu bromkowego do alkenu - kation bromoniowy - tworzy w wodnym środowisku halohydryny (vic-halogenohydroksyalkany). Cząsteczki wody reagują z kationem bromoniowym jako odczynniki nukleofilowe, podobnie jak towarzyszące reakcji aniony bromkowe (halogenkowe). Zwykle jednak stężenie wody wielokrotnie przekracza stężenie jonów halogenkowych, wobec czego halohydryny powstają jako produkt główny.
Zdarza się jednak, że celowo do środowiska reakcji dodaje się silnego odczynnika nukleofilowego, który nawet przy mniejszym stężeniu niż woda tworzy z jonem halogeniowym główny produkt.
Warto zwrócić uwagę na regiospecyficzność reakcji - anion przyłącza się do atomu węgla o wyższej rzędowości; obowiązuje ten sam mechanizm, który determinuje regułę Markownikowa.
Zadanie: jaki produkt powstanie w reakcji propenu z wodą chlorową?; uzasadnij swój wybór.
Alkeny nie rozpuszczają się w wodzie, dlatego reakcje z nimi należy prowadzić z dodatkiem organicznych rozpuszczalników polarnych w celu zwiększenia rozpuszczalności substratów hydrofobowych w wodzie. Do takich rozpuszczalników należą etanol, acetonitryl, DMF lub DMSO.
Zamiast bromu można stosować N-bromoimid kwasu bursztynowego (tzw. bromosukcynoimid; NBS), który rozkładając się w środowisku reakcji uwalnia stopniowo brom.
5.8.9 Oksyrtęciowanie
Oksyrtęciowanie jest obok addycji HOH do alkenów w środowisku kwaśnym, ich uwodnienienia katalitycznego czy hydroborowania, alternatywnym sposobem otrzymywania alkoholi z alkenów. Addycja wody do podwójnego wiązania C=C wobec katalizatorów heterogenicznych biegnie w wysokiej temperaturze (>250oC), natomiast octan rtęci ulega przyłączeniu do alkenów w temperaturze pokojowej, a produkt reakcji redukować się do alkoholu, najłatwiej za pomocą tetrahydroboranu sodu.
Mechanizm reakcji
Mechanizm oksyrtęciowania jest zbliżony do mechanizmu reakcji tworzenia halohydryn, a przyłączenie grupy hydroksylowej następuje zwykle zgodnie z regułą Markownikowa. W trakcie oksyrtęciowania nie dochodzi do reakcji przegrupowania, wobec czego można oczekiwać jednorodnego produktu z dużą wydajnością. Oksyrtęciowanie jest dogodną laboratoryjną metodą przekształcania alkenów w alkohole, ma jednak wadę - musi być prowadzona z zachowaniem środków ostrożności, z uwagi na silnie toksyczne właściwości związków rtęcioorganicznych.
Zadanie: jaki będzie produkt hydratacji 3,3-dimetylobut-1-enu w środowisku kwaśnym?
Reakcja oksyrtęciowania w obecności alkoholu, np. jako rozpuszczalnika prowadzi do utworzenia eteru. Alkohol w tym wypadku pełni rolę nukleofila, który przyłącza się do dodatnio naładowanego atomu węgla powstałego karbokationu.
5.8.10 Halogenowanie w pozycji allilowej
W reakcji propenu w chlorem w podwyższonej temperaturze lub przy niskim stężeniu chloru zamiast addycji następuje podstawienie atomu H w pozycji . W niskich temperaturach i przy dużym stężeniu chloru przeważa produkt addycji - 1,2-dichloropropan
Reakcja ta biegnie mechanizmem rodnikowym. W podwyższonej temperaturze powstaje rodnik chlorkowy, który przekształca propen w mezomerycznie stabilizowany rodnik allilowy, a ten z kolei z chlorem tworzy chlorek allilu i kolejny rodnik chlorkowy.
Dobrym odczynnikiem do bromowania w pozycji allilowej jest N-bromosukcynoimid (NBS). W obecności HBr uwalnia się z niego wolno brom cząsteczkowy, który łatwo ulega rozszczepieniu na rodniki. Niskie stężenie uwalnianego bromu faworyzuje reakcję substytucji atomu wodoru w pozycji allilowej, a nie addycję do podwójnego wiązania.
Reaktywność alifatycznych atomów wodoru
Atomy wodoru w pozycji allilowej ( do C=C) są bardzo reaktywne (ruchliwe) i ulegają łatwo podstawieniu. Najmniej reaktywne są winylowe atomy wodoru.
Rodnik allilowy tworzy się znacznie łatwiej niż, np. t-butylowy, który jako rodnik 3o odznacza się największą trwałością pośród rodników alkilowych. Rodnik allilowy jest o 13 kJ/mol (3 kcal/mol) stabilniejszy od rodnika t-butylowego i aż o 42 kJ/mol (20 kcal/mol) od rodnika etylowego.
Zadanie: napisz schemat reakcji bromowania 1-metylocykoloheks-1-enu za pomocą NBS
5.8.11 Addycja karbenów do podwójnego wiązania C=C
Karben jest bardzo reaktywnym ugrupowaniem o wzorze R2C:, powstającym najczęściej w wyniku oderwania z cząsteczki atomu wodoru i atomu chloru przez silną zasadę, np. z haloformu.
Atom węgla w karbenie jest płaski i ma hybrydyzację sp2. Wolna para elektronów zajmuje orbital sp2, a p jest nieobsadzony:
Karben ze względu na deficyt elektronów jest elektrofilem.
Karben przyłącza się do alkenów stereospecyficznie, w sposób syn (powstaje jeden z możliwych stereoizomerów), przy czym tworzy się nowy trójczłonowy układ cykliczny.
Pierścień trójczłonowy może utworzyć się wyłącznie po jednej stronie pierścienia cykloheksanowego, a zatem atomy wodoru zajmuję pozycje z przeciwnej strony pierścienia trójczłonowego.
Karben wytwarza się najczęściej in situ z chloroformu w reakcji z KOH.
5.8.12 Reakcja Simmonsa-Smitha
Najlepszym odczynnikiem służącym do wytwarzania pierścienia cyklopropanowego w miejscu C=C alkenu jest reagent Simmonsa-Smitha - ICH2ZnI. Z niego, w trakcie reakcji z alkenem generowany jest prawdopodobnie karben, który ulega addycji do podwójnego wiązania. Reagent reagent Simmonsa-Smitha powstaje w wyniku zmieszania jodku metylenu z pyłem cynkowym zawierającym domieszkę miedzi.
5.9 Utlenienie podwójnego wiązania C=C (tworzenie wiązania C-O)
Utlenianie alkenów, np. za pomocą epoksydowania, hydroksylowania czy ozonolizy jest jednym z najdogodniejszych sposobów wprowadzenia atomu (atomów) tlenu do cząsteczki organicznej.
5.9.1 Epoksydowanie
W reakcji epoksydowania dochodzi do utworzenia trójczłonowego pierścienia, zawierającego atom tlenu. Pierścień taki nazywa się epoksydem lub oksiranem. Alkeny mogą być przekształcone w epoksydy w reakcji z nadtlenkami, tzn. ze związkami zawierającymi ugrupowanie nadtlenkowe: -O-O-. Nadtlenki są zwykle wybuchowe. Do stosunkowo bezpiecznych należą nadkwasy i one też znalazły szerokie zastosowanie w syntezie organicznej. Najpopularniejszymi nadkwasami wykorzystywanymi w syntezie organicznej są kwasy: nadoctowy, nadbenzoesowy i m-chloronadbenzoesowy.
W wyniku epoksydowania cis-but-2-enu powstaje izomer cis-epoksyd, a izomer trans zostaje w tej reakcji przekształcony w trans-epoksyd.
Epoksydy powstają również w wyniku utlenienia alkenów tlenem z powietrza wobec srebra jako katalizatora. W ten sposób w przemyśle otrzymuje się na dużą skalę (miliony ton rocznie) epoksyetan (tlenek etylenu).
5.9.2 Hydroksylowanie podwójnego wiązania C=C
Formalnie hydroksylowanie alkenów, inaczej hydratacja, czyli przyłączenie cząsteczki HOH do podwójnego wiązania C=C nie jest reakcją utlenienia, pomimo wprowadzenia tlenu do cząsteczki organicznej, ponieważ nie zmienia się stopień utlenienia cząsteczki. Stopień utlenienia jednego atomu C wzrasta o jednostkę poprzez przyłączenie grupy -OH, ale drugiego atomu C zmniejsza się o jednostkę w wyniku utworzenia wiązania C-H. Hydratacja alkenów zachodzi pod wpływem wody w obecności kwaśnego katalizatora.
Utlenieniem są natomiast reakcje otrzymywania vic-glikoli, czyli ,-dihydroksyzwiąków, powstających np. w reakcji alkenów z nadmanganianem potasu lub tetratlenkiem osmu.
W obu przypadkach otrzymuje się produkt przyłączenia syn, czyli izomery cis, jeżeli pozwalają na to uwarunkowania stereochemiczne. Tetratlenek osmu jest rzadziej używany, zarówno ze względu na jego wysoką cenę, jak i silne właściwości toksyczne.
Mechanizm
Do tego samego efektu, ale stereochemicznie odmiennego, dochodzi się poprzez utlenienie alkenów do epoksydów i ich hydrolizę.
5.9.3 Ozonoliza
Ozonoliza oznacza reakcję rozkładu związku chemicznego pod wpływem ozonu. Takiej reakcji ulegają alkeny. Ozon przyłącza się do podwójnego wiązania alkenów, po czym w środowisku redukującym produkt addycji rozpada się do aldehydów lub ketonów. W pierwszym etapie tej reakcji powstają bardzo nietrwałe addukty ozonu do C=C, tzw. molozonki (nazwa wywodzi się ze stechiometrii reakcji - 1 mol ozonu na 1 mol alkenu), które szybko ulegają przekształceniu w ozonki.
Ozonki w wodnym, redukującym środowisku (Zn/H+ lub w nowszych procedurach pod wpływem dimetylosulfidu - CH3-S-CH3) rozpadają się na dwie części, z których powstają dwa związki karbonylowe (aldehydy lub/i ketony), przy czym grupy karbonylowe (C=O) tworzą się w miejscu podwójnego wiązania (C=C). Ozonki niższych alkenów są wybuchowe i nie powinno się ich izolować. Środowisko redukujące chroni powstające aldehydy przed dalszym utlenieniem do kwasów karboksylowych.
Reakcja ozonolizy powoduje rozpad wiązania podwójnego C=C, a w jego miejscu pojawiają się dwie grupy karbonylowe. Jeżeli podwójne wiązanie było częścią pierścienia następuje przekształcenie związku pierścieniowego w łańcuchowy.
Ketony (R2C=O) powstają, gdy na atomie węgla o hybrydyzacji sp2 są dwie grupy alkilowe (R), natomiast w przypadku, kiedy atom C uczestniczący w podwójnym wiązaniu jest połączony z atomem wodoru i grupą alkilową to tworzą się aldehydy (RCH=O).
Ozonoliza zwykle służy nie do tyle syntezy określonych związków organicznych, ale głównie do rozpoznawania konstytucji nieznanych substancji. Otrzymane produkty degradacji badanego związku ułatwiają rozpoznanie jego budowy.
Zadanie: jaki związek został poddawany ozonolizie, jeżeli w wyniku tej reakcji otrzymano następujący produkt:
5.10 Polimeryzacja rodnikowa alkenów
Polimeryzacją nazywana jest reakcja, w której małe cząsteczki (monomery) łączą się z sobą dając w rezultacie polimer - cząsteczki o zwielokrotnionej masie cząsteczkowej; kilka, kilkadziesiąt, kilkaset, tysiące, a nawet miliony razy przekraczającą masę cząsteczkową monomeru. Alkeny należą do popularnych monomerów wykorzystywanych do otrzymywania polimerów.
Eten w obecności inicjatora rodnikowego (np. nadtlenku benzoilu), w podwyższonej temperaturze i pod zwiększonym ciśnieniem ulega polimeryzacji do polietylenu - tworzywa syntetycznego o dużym zastosowaniu praktycznym. Reakcja biegnie mechanizmem łańcuchowym.
W zależności od warunków polimeryzacji otrzymuje się polietylen twardy (wysokospolimeryzowany) lub miękki; różnią się stopniem polimeryzacji.
Reakcja zaczyna się od rozpadu nadtlenku i wytworzenia rodnika - inicjatora (PhCO., In.), który inicjuje polimeryzację przekształcając cząsteczką etenu w rodnik - In-CH2CH2..
Po inicjacji następuje faza propagacji, charakteryzująca się przyłączaniem kolejnych cząsteczek monomeru, w wyniku czego następuje wzrost masy cząsteczki. Rodnik etylenowy reaguje z drugą cząsteczką etenu wytwarzając rodnik tetrametylenowy, po czym z kolei powstaje rodnik heksametylenowy, itd.
W ten sposób, w reakcji zwanej łańcuchową następuje wzrost cząsteczki, aż do momentu jej przerwania, tj. zakończenia wzrostu czyli terminacji.
Terminacja (zatrzymanie polimeryzacji) następuje poprzez kombinacje dwóch rodników lub utratę energii rodnika.
Warto zwrócić uwagę, że reakcja polimeryzacji biegnie szybko i polega na przyłączaniu kolejnych cząsteczek monomeru do uaktywnionego końca rosnącego łańcucha polimeru.
W reakcji polimeryzacji propenu otrzymuje się polipropylen, szeroko wykorzystywane tworzywo.
Podobnej polimeryzacji poddaje się różnorodne alkeny lub ich pochodne, np. styren, chlorek winylu, octan winylu, tetrafluoroeten i inne otrzymując powszechnie znane polimery, takie jak polistyren, poli(chlorek winylu), poli(octan winylu) czy teflon.
Spieniony polistyren, zwany styropianen jest zużywany w dużych ilościach jak użyteczny materiał termoizolacyjny.
Reakcje polimeryzacji alkenów można też inicjować kationami, wówczas mamy do czynienia z polimeryzacją kationową. Inne nienasycone związki mogą ulegać polimeryzacji anionowej, tzn., że aktywacja zaczyna się od aktywacji anionowej.
W przyrodzie spotyka się polimery naturalne, chociażby kauczuk, który jest poliizoprenem.
Obok powszechnie wykorzystywanego kauczuku, który jest stereoizomerem cis-, znany jest również inny naturalny polimer izoprenu, stereoizomer o geometrii trans-, zwany gutaperką. Kauczuk naturalny i gutaperka różnią się właściwościami fizykochemicznymi - kauczuk jest miękki i elastyczny, a gutaperka - krucha i twarda. Właśnie układ cis- pozwala na rozciąganie wiązań cząsteczek wzdłuż łańcucha. Stopień polimeryzacji naturalnego kauczuku waha się w granicach 8 000 - 30 000, podczas gdy gutaperki - około 1500.
24
Wyszukiwarka
Podobne podstrony:
Alkeny i alkiny id 58008 Nieznany (2)
Chemia Alkeny
CO 03 W alkeny trzewik
Alkeny
ALKENY
ściągi chemia szereg homologiczny alkany, alkeny, alkiny
Alkeny, Alkiny, Alkeny , Alkiny
II ALKENY
Zadania, alkeny
alkany alkeny alkiny id 57988 Nieznany
Alkany, alkeny, alkiny i SE do aromatu
chemia alkeny i inne
ALKENY I CYKLOALKENY
alkeny
chem2010 zad alkeny odp1pl
chemia Alkeny,Alkany,Alkiny
alkeny
alkeny
więcej podobnych podstron