Roztworem doskonałym nazywamy roztwór, który spełnia prawo Roulta: w stałej temperaturze (T = const.) ciśnienie pary składnika „i” nad roztworem jest równe iloczynowi jego ułamka xi w tym roztworze i ciśnienia jego pary nasyconej pio w stanie czystym.
pi = xi * pio
Równowaga para-roztwór ciała stałego w cieczy
Korzystając z prawa Roulta można wyprowadzić następujący wzór:
(*)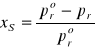
gdzie:
xs - ułamek molowy rozpuszczonego ciała stałego w roztworze.
pro - ciśnienie pary nasyconej czystego rozpuszczalnika.
pr - ciśnienie rozpuszczalnika nad roztworem.
Wyrażenie po prawej części równania (*) jest nazywane względnym obniżeniem ciśnienia pary rozpuszczalnika nad roztworem. Jak widać jest ono równe ułamkowi molowemu substancji rozpuszczonej. Ponieważ ciśnienie pary ciała stałego jest znacznie mniejsze od ciśnienia rozpuszczalnika( pS << pr ), możemy przyjąć ciśnienie ogólne w układzie p = pr.. Z powodu względnego obniżenia ciśnienia pary rozpuszczalnika i przyjęcia go jako ciśnienie układu, ulec zmianie musza temperatura wrzenia Tw(rośnie) i temperatura krzepnięcia Tk(maleje). Pomiarami i wykorzystaniem tych różnic temperatur wrzenia i krzepnięcia (ΔTk, ΔTw) zajmują się odpowiednio kriometria i ebuliometria.
Kriometria.
Zgodnie z reguła faz spośród trzech parametrów układu: Tk, pr, xS, można dobrać dowolnie dwa. Zatem, pod określonym ciśnieniem pz = pr = const., mamy f(Tk, xS) = 0. Matematycznym wyrazem tej funkcji dla roztworów rozcieńczanych jest równanie:
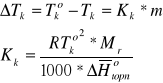
gdzie:
m - moralność roztworu.
R - stała gazowa.
Mr - masa cząsteczkowa rozpuszczalnika.
ΔHtopn - standardowa molowa entalpia topnienia rozpuszczalnika.
Wielkość Kk, zwaną stałą krioskopową, oznacza obniżenie temperatury krzepnięcia roztworu jednomolarrnego. Wielkość ta jest charakterystyczna dla danego rozpuszczalnika i nie zależy ani od rodzaju, ani od stężenia substancji rozpuszczonej.
Przy użyciu kriometrii można obliczyć masę cząsteczkowa substancji rozpuszczonej, stopnia dysocjacji elektrolitu i współczynnika osmotycznego.
Ebuliometria.
Podwyższenie temperatury wrzenia ![]()
ΔTw rozcieńczonego roztworu ciała stałego w cieczy wynosi:
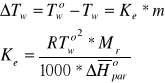
gdzie:
m - moralność roztworu.
R - stała gazowa.
Mr - masa cząsteczkowa rozpuszczalnika.
ΔHpar - standardowa molowa entalpia parowania rozpuszczalnika.
Wielkość Ke nazywamy stałą ebulioskopową, oznacza podwyższenie temperatury wrzenia roztworu jednomolarnego. Jej wartość zalezy tylko od rodzaju rozpuszczalnika.
Ebuliometria pozwala wyznaczyć te same fizyczne wielkości roztworów co kriometria.( masę cząsteczkowa substancji rozpuszczonej, stopnia dysocjacji elektrolitu i współczynnika osmotycznego)
Sprawozdanie:
Po wykonaniu pomiaru temperatury krzepnięcia dla wody odmierzyłem 2,0597 gramy soli i sporządziłem około 2% roztworu substancji (tiomocznik). Taki roztwór znów poddałem badaniu temperatury krzepnięcia. Następnie obliczyłem najpierw T = 0,49 deg, czyli różnice zmierzonych temperatur, później masę cząsteczkowa danej soli:
![]()
Gdzie:
M - masa cząsteczkowa badanej substancji.
Kk - stała kriometryczna (dla wody = 1,858
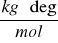
).M - masa substancji rozpuszczonej (2,0597 g).
DT - obniżenie temperatury krzepnięcia wody (0,49 deg).
Współczynnik van't Hoffa jest w takim razie równy:
![]()
Gadzie:
Mrz - tablicowa masa tiomocznika(rzeczywista) równa 78 g/mol
M - masa cząsteczkowa uzyskana poprzez doświadczenie.
Współczynnik osmotyczny:
![]()
Wnioski:
Uzyskany współczynnik van't Hoffa bliski jedności (0,97), mówi o dość dużej dokładności wyznaczania masy cząsteczkowej. Pomimo tego kriometria jest dość trudna metoda, wiele rożnych czynników jak np.: przechłodzenie cieczy, czy wpływ czynników zewnętrznych na układ może fałszować wyniki.
Wyszukiwarka
Podobne podstrony:
1-bromobutan, Sprawozdania jakieś, Współczesna Chemia Organiczna
cw 10 - Wyznaczanie przyspieszenia ziemskiego za pomocą wahadła rewersyjnego, Sprawozdania jakieś, F
cw 14 - Wyznaczanie napięcia powierzchniowego cieczy za pomocą wagi torsyjnej, Sprawozdania jakieś,
cw 52A - Badanie charakterystyk transformatora, Sprawozdania jakieś, Fizyka [na chemii]
cw 5 - Badanie oscylatora harmonicznego, Sprawozdania jakieś, Fizyka [na chemii]
cw 15 - Wyznaczanie współczynnika lepkości cieczy za pomocą wiskozymetru Stockes’a, Sprawozdania j
Metrologia sprawozdanie jakies
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
Chemia fizyczna - sprawozdanie (4-1), Chemia Fizyczna
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
7[1].1(2), Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, s
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
SPRAWOZDANIE-4-1-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fi
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
10-1-gr-11-A, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
więcej podobnych podstron