Ad 9- Energia swobodna i entalpia swobodna
Entalpia swobodna
Entalpia swobodna - potencjał termodynamiczny zwany funkcją Gibbsa lub energią swobodną Gibbsa, oznaczany przez
, a zdefiniowana następująca:
co jest równoważne:
gdzie
U - energia wewnętrzna układu,
S - entropia układu,
p, V - ciśnienie i objętość układu,
T - temperatura bezwzględna układu,
H - entalpia.
Z innymi potencjałami termodynamicznymi entalpia swobodna związana jest przez relacje:
stąd:
gdzie:
r - liczba składników (różnych substancji)
μi - potencjał chemiczny i − tego składnika
We - praca nieobjętościowa np elektryczna.
Entalpia swobodna w przemianach izotermiczno-izobarycznych (dp=0, dT=0) jest równa maksymalnej pracy nieobjętościowej
, np. elektrycznej, którą można uzyskać w takiej przemianie. Dlatego odgrywa dużą rolę w elektrochemii.
W procesach samorzutnych przebiegających pod stałym ciśnieniem oraz w stałej temperaturze entalpia swobodna nie wzrasta (maleje lub zachowuje wartość). Kryterium to jest często stosowane gdyż reakcje chemiczne oraz zmiany stanów skupienia przebiegają często przy stałym ciśnieniu a przy możliwej zmianie objętości. Reakcja zachodzi samorzutnie przy stałym ciśnieniu i określonej temperaturze, tylko gdy entalpia swobodna substratów jest nie mniejsza od entalpii swobodnej produktów.
Warunek kierunku przebiegu reakcji zapisuje się matematycznie:
Energia swobodna
Energia swobodna - w termodynamice to funkcja stanu i potencjał termodynamiczny - odpowiada tej części energii wewnętrznej, która może być w danym procesie uwolniona na zewnątrz układu w formie pracy wykonanej przy stałej temperaturze lub ciepła przy stałej objętości.
Jest to przydatna funkcja, w odróżnieniu od energii wewnętrznej, można ją łatwo wyznaczyć gdyż zależy w sposób naturalny od temperatury, objętości i liczby moli substancji, a parametry te można łatwo mierzyć. Funkcji tej używa się często przy złożonych procesach, w których przekazywanie energii odbywa się na kilka różnych sposobów (np:reakcja chemiczna połączona ze zmianą temperatury i ciśnienia).
Energię swobodną Helmholtza definiuje wzór:
Z definicji energii Helmholtza, energii wewnętrznej i entropii, dla procesu odwracalnego różniczkę energii Helmholtza określa wzór:
Wzór ten dla układu, w którym nie zmienia się liczba cząsteczek układu upraszcza się do:
Z powyższego wzoru wynikają zależności:
Entropia (S):
Ciśnienie (p):
Potencjał chemiczny (μi) i-tego składnika
gdzie:
U - energia wewnętrzna
T - temperatura
S - entropia
p - ciśnienie
V - objętość
Energia swobodna gazu doskonałego
Energię swobodną Helmholtza jednoatomowego gazu doskonałego określa wzór:
gdzie:
A - energia swobodna Helmholtza,
T - temperatura
V - objętość
n - liczba moli gazu
R - uniwersalna stała gazowa
A0 - energia swobodna Helmholtza w: T0, V0, n0 - parametry początkowe.
Równanie to dla określonej temperatury, objętości, liczności materii oraz energii Helmholtza w określonych warunkach początkowych, jednoznacznie określa energię Helmholtza, co jest uzasadnieniem, że energia Helmholtza jest potencjałem termodynamicznym. Z równania tego poprzez różniczkowanie lub całkowanie można uzyskać inne zależności dla gazu doskonałego.
Ad. 10- Związki między funkcjami termodynamicznymi
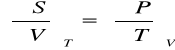
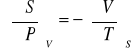
Relacje Maxwella
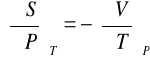
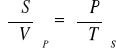
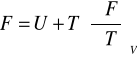
Równania Gibbsa - Helmholtza
![]()
პ
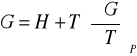
![]()
პ
![]()
![]()
Termodynamiczne równania stanu (I/II)
პ
![]()
![]()
![]()
პ
![]()
![]()
Entropia
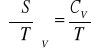
პ
![]()
![]()
პ
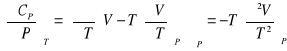
![]()
Pojemność cieplna
პ
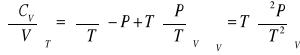
![]()
პ
Ad.11- Termodynamiczne warunki równowagi i samorzutności procesów
Równowaga chemiczna
Reakcje chemiczne zwykle przebiegają w warunkach pewnych ograniczeń takich jak stale ciśnienie, temperatura, entropia lub objętość. Dla tak określonych ograniczeń (stałych parametrów przemiany) warunek równowagi opisany w II zasadzie termodynamiki oznaczający wzrost sumaryczny entropii układu i jego otoczenia, wyraża się z pomocą potencjałów opisujących warunki równowagi tylko z użyciem parametrów układu.
Potencjały termodynamiczne mogą być również użyte do oszacowania całej ilości energii możliwej do uzyskania z układu termodynamicznego przy odpowiednio określonych stałych parametrach przemiany.
Proces termodynamiczny zachodzi dopóty, dopóki układ nie osiągnie stanu równowagi. W stanie równowagi odpowiedni potencjał termodynamiczny układu osiąga minimum, podczas gdy entropia układu i otoczenia osiąga maksimum.
W szczególności:
Kiedy entropia (S) i "zewnętrzne parametry" (np. objętość) zamkniętego układu termodynamicznego są stałymi parametrami przemiany, energia wewnętrzna (U) maleje i osiąga minimalną wartość w punkcie równowagi. Wynika to z pierwszej i drugiej zasady termodynamiki i jest nazwane zasadą minimum energii. Kolejne trzy twierdzenia są bezpośrednim wnioskiem tej zasady.
Kiedy temperatura (T) i zewnętrzne parametry zamkniętego układu termodynamicznego są stałe, energia swobodna Helmholtza (A) maleje i osiąga minimalną wartość w punkcie równowagi.
Kiedy ciśnienie (p) i zewnętrzne parametry zamkniętego układu termodynamicznego są stałe, entalpia (H) maleje i osiąga minimalną wartość w punkcie równowagi.
Kiedy temperatura(T), ciśnienie (p) i zewnętrzne parametry zamkniętego układu termodynamicznego są stałe, entalpia swobodna Gibbsa (G ) maleje i osiąga minimalną wartość w
Samorzutność
Aby mógł zajść proces samorzutny, układ musi być gotowy do zmiany bez dostarczenia do niego pracy. W rzeczywistości proces samorzutny może sam wykonać pracę na innym układzie. To że proces jest samorzutny nie oznacza, że zawsze musi zajść. Większość procesów samorzutnych musi najpierw pokonać, wynikający z ich przebiegu kinetycznego barierę potencjału energetycznego. Procesy te wymagają więc do zajścia impulsu energetycznego, ale impuls ten jest zawsze mniejszy niż energia wyzwalana na skutek zajścia procesu, na skutek czego bilans pracy procesu jest dodatni. Można więc powiedzieć, że samorzutność procesu jest termodynamicznym wyrazem tendecji do jego zajścia nie zaś absolutną koniecznością jego zajścia. Procesom samorzutnym towarzyszy zawsze zwiększenie entropii. Procesy w których entropia się zmniejsza nigdy nie są samorzutne. Wynikiem procesu samorzutnego jest zawsze wykonanie przez układ pewnej pracy. Procesy niesamorzutne nie mogą wykonać pracy - wręcz przeciwnie do ich zajścia potrzebne jest wykonanie na nich pewnej pracy.
![]()
![]()
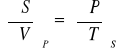
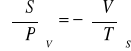
![]()
![]()
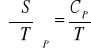
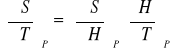
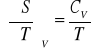
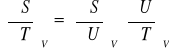
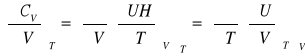
Wyszukiwarka
Podobne podstrony:
egz.42, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
Ad 7, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
polarografia, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
19, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
34 i 36, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
30, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
egz.40, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
egz.42, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
Ad 7, II rok, zimowy, Chemia Fizyczna, zagadnienia do egzaminu
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
Zagadnienia do egzaminu OSOBOWO, Psychologia, II rok III semestr, osobowość
Zagadnienia do egzaminu na kulturoznawstwo, II rok II semestr, BWC, Kultura, kulturoznawstwo, Fw Fw
Zagadnienia do egzaminu chemia budowlana, Budownictwo chemia I rok
Zagadnienia do egzaminu z psychologii rozwoju człowieka, Psychologia, II ROK, Psychologia rozwoju cz
zagadnienia do egzaminu PiOSI, INIB rok II, PiOSI Sapa
zagadnienia do egzaminu PiOSI ćw, INIB rok II, PiOSI Sapa
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 3 Ciepł
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu spr 1
zagadnienia do egzaminu-prof. Pęcherski, AGH, IMIR, II rok, Wytrzymałość materiałów, Wytrzymałość Ma
więcej podobnych podstron