WPROWADZENIE DO TOKSYKOLOGII
Historia trucizn i zatruć
Toksykologia zajmuje się:
badaniem wpływu trucizn na organizmy żywe
wszystkimi aspektami niekorzystnego działania substancji chemicznych na systemy biologiczne
Obejmuje swoim zakresem:
mechanizmy szkodliwego działania substancji chemicznych
warunki w których te szkodliwe mechanizmy działają
oraz problemy socjalno-ekonomiczne i sądowo-prawne związane z ich oddziaływaniem
W papirusie Ebersa (1500 r p.n.e.), który został uznany za jeden z najstarszych dokumentów medycznych, jest mowa o wielu starożytnych truciznach takich: arszenik, antymon, ołów, opium, mandragora, cykuta, tojad, piołun, glikozydy cyjanowe
Spożywanie niektórych z nich
bób kalabaryjski z Physostigma venenosum zawierający fizostygminę
pokruszone pestki brzoskwini zawierające amygdalinę, która rozpada się do cyjanków uznawane było za próbę bożą lub próbę ostateczną, z której osoba niewinna wychodziła bez szwanku, a śmierć w wyniku próby ponosiła osoba winna
Przypuszcza się, że już prehistoryczni Masajowie, zamieszkujący Kenię 18 tys. lat temu używali strzał zatrutych strofantyną
Termin toksykologia pochodzi od dwóch greckich wyrazów: toxicos - łuk i toxicon - substancja, w której maczano strzały
Historia nowożytnej toksykologii
W Krakowie - 1 listopada 1966 roku powstał Oddział Ostrych Zatruć i Resuscytacji Katedry Chorób Zawodowych - dzisiejsza Klinika Toksykologii Collegium Medicum Uniwersytetu Jagiellońskiego
Oddział mieścił się przy ulicy Kopernika 26 w budynku należącym do Zakonu Jezuitów; (w tym samym budynku w przeddzień II Wojny Światowej mieścił się Polski Czerwony Krzyż)
Na mocy ustawy Ministra Zdrowia i Opieki Społecznej z dnia 30 stycznia 1967 Oddział stał się jednym z 9 Regionalnych Ośrodków Zatruć działających w Polsce
Starożytność: Galen poświęcił się całkowicie stworzeniu uniwersalnej odtrutki „Theriac” składającej się z 70 składników, zawierającej m. in. ciało żmii
Rok 1939 1945: Pierwszy wielki krok w udoskonaleniu metod leczenia - wykorzystanie doświadczeń II wojny światowej w leczeniu wstrząsu - Kirkegard
1951 rok: Nilsen ustalił jak bardzo ważne w leczeniu zatruć jest utrzymanie drożności dróg oddechowych i zapobieganie niedotlenieniu
1954 rok: Dodan - po raz pierwszy skuteczna hemodializa w zatruciu salicylanami
1964 rok: Yatsidis - zastosowanie hemoperfuzji w leczeniu mocznicy
1973 rok: Chang - zastosowanie hemoperfuzji węglowej w zatruciu glimidem
Lata 80 - te XXw.: wprowadzenie do leczenia zatruć plazmaseparacji i plazmaperfuzji
Wczesne lata 90 - te XX w.: wprowadzenie metod immunologicznych
Późne lata 90 - te XX w.: transplantacja narządów
Za truciznę należy uważać każdą substancję, która wprowadzona do organizmu jakąkolwiek drogą, w stosunkowo małej ilości, wskutek swych właściwości fizyko-chemicznych może wywołać zmiany struktury lub zaburzenia czynności organizmu, których wynikiem jest choroba lub śmierć.
Zatrucia należą do chorób o określonej etiologii a rozpoznanie ich opiera się przede wszystkim na stwierdzeniu czynnika chorobotwórczego.
Choroby powstałe wskutek działania czynników chemicznych na organizm nazywamy zatruciami a substancje chemiczne, które je wywołują truciznami lub jadami.
PODZIAŁ ZATRUĆ
Zatrucia rozmyślne Zatrucia przypadkowe
- samobójcze - omyłkowe
- dobrowolne bez wyraźnej - powikłania leczenia
intencji samobójczej nadużywanie leku
impulsywne przedawkowanie
demonstracyjne omyłki farmaceutyczne
- zbrodnicze - skażenie środowiska
- egzekucje bytu
pracy - zawodowe
- upojenie alkoholem
- zależność lekowa
narkomania
lekomania
toksykomania
Domeną toksykologii klinicznej są ostre i przewlekłe działania substancji chemicznych na organizm ludzki w miejscu bytowania, zamieszkania i w miejscu pracy.
Na toksykologię kliniczną możemy patrzeć zarówno jak na jedną z gałęzi toksykologii, jak i na dziedzinę nauk medycznych, lub inaczej mówiąc- specjalność lekarską. Jej podstawowym zadaniem jest diagnostyka, terapia i profilaktyka zatruć.
Do poprzednio wymienionych zadań doszło, jako podstawowe, nowe, a zarazem bardzo obszerne zadanie w postaci ustalania granic bezpieczeństwa stosowania wszystkich substancji chemicznych.
ZASADY POSTĘPOWANIA DIAGNOSTYCZNEGO W OSTRYCH ZATRUCIACH
a) Rozpoznanie w nagłych zachorowaniach
Rozpoznanie
Stan chorego Choroby
1. Niewydolność oddechowa 1. Różnicowanie
2. Niewydolność krążenia a) Zatrucie czy inna choroba
3. Wstrząs b) Rodzaj zatrucia
c) Zatrucie mieszane
4. Krwotok zewnętrzny 2. Nasilenie
5. Krwotok wewnętrzny a) zmiany kliniczne
b) stężenie trucizny
6. Stan świadomości 3. Powikłania
7. Obrzęk płuc a) patrz rozpoznawanie stanu chorego
8. Obrzęk mózgu b) inne (Pneumonia, Peritonitis)
4. Choroby towarzyszące
b) Rozpoznanie na poszczególnych etapach pomocy
Etap Na co zwrócić uwagę i co powinno się rozpoznać?
I 1.Rozpoznanie trwającego narażenia (gazy duszące)
2.Rozpoznanie stanu chorego
3.Zebranie anamnezy od otoczenia
4.Zabezpieczenie śladów ewentualnego zatrucia
5.Rozpoznanie zatrucia jako przyczyny utraty przytomności
6.Rozpoznanie rodzaju zatrucia (cyjanki, alkilofosfaty)
II 1.Rozpoznanie stanu chorego
2.Przekazanie zebranych na miejscu danych anamnestycznych i przypuszczalnych śladów zatrucia
III 1.Pełne jakościowe i ilościowe rozpoznanie stanu chorego i choroby
ALKOHOLE
etanol - 1771 przypadków(45,55% zatruć w 2000 r.)
izopropanol
metanol - 1 przypadek (0,03% zatruć w 2000 r.)
glikol etylenowy - 5 przypadków (0,13% zatruć w 2000 r.)
ETANOL
Synonimy: etanol, Spiritus vini, Ethyl alcohol.
Etanol uzyskuje się drogą fermentacji surowców zawierających cukry: z owoców, zbóż, ziemniaków.
Proces ten można przedstawić równaniem
C6H12 O6 →2 C2H5OH +2 CO2
Otrzymuje się go także syntetycznie z etylenu i acetylenu.
Napoje alkoholowe można podzielić na:
destylowane: whisky, koniak, rum, jałowcówka, wódka czysta
niedestylowane : wina (10 - 22 % etanolu), piwa (do 6 %)
Własności fizyczne:
Etanol jest bezbarwną cieczą, o temperaturze topnienia - 117,3 *C, a wrzenia +78,3 *C. Miesza się z wodą i eterem w każdym stosunku.
Etanol znajduje zastosowanie w syntezie organicznej w przemyśle chemicznym i spożywczym; w lecznictwie jako środek bakteriobójczy.
Wchłanianie
Alkohol wchłania się na drodze dyfuzji
układ pokarmowy:
- jama ustna - niewielka ilość
- żołądek - 25 %
- jelito cienkie - 75 %
Już 50% podanej dawki wchłania się w ciągu pierwszych 15 minut.
Wypicie określonej ilości wina w czasie posiłku daje blisko 50% niższe stężenie maksymalne alkoholu, niż wypicie tej samej dawki na pusty żołądek. Jeżeli spożycie wina miało miejsce zaraz po skończeniu posiłku, to obniżenie alkoholowego maksimum było jeszcze mniejsze. Zjawisko to nazywamy deficytem alkoholowym.
Układ oddechowy
Skóra - wchłanianie na tej drodze ma znaczenie u niemowląt
Określono współczynnik „r” pozwalający na obliczenie zresorbowanego alkoholu w całym ustroju na podstawie analizy krwi. Współczynnik ten wyraża średni stosunek stężeń etanolu w tkankach całego ustroju do jego stężeń we krwi. Wynosi on:
dla mężczyzn - 0,7
dla kobiet - 0,6
Eliminacja
Eliminacja zachodzi poprzez:
1. enzymatyczny metabolizm etanolu w ustroju - 95%
2. wydalanie etanolu w postaci niezmienionej (mocz, droga oddechową, pot) - 5 %
Metabolizm enzymatyczny zachodzi poprzez:
1. układ dehydrogenaz
2. układ mikrosomalny MEOS (Microsomal Ethanol Oxidizing System)
3. Katalaza
Głównym enzymem odpowiedzialnym za przemiany alkoholu jest dehydrogenza alkoholowa (ADH) zlokalizowana w cytozolu komórek wątrobowych, tj. hepatocytach.
Szlaki przemian etanolu:
ADH
I CH3 CH2 OH + NAD+ → CH3 CHO + NADH + H+
główny szlak 70 - 90 %
CYP2E1
II CH3 CH2 OH + O2 + NADPH+ + H+ → CH3 CHO + H 2O + NAPDH+
szlak poboczny ( < 30 %)
katalaza
III CH3 CH2 OH + H 2O2 → CH3 CHO + 2H 2O ograniczony proces
Na ogół dzieli się izoenzymy ADH na 3 klasy:
I klasyczna ADH
II. do tej grupy należy enzym działający na etanol przy wysokich stężeniach
III. enzym w tej klasie wykazuje powinowactwo do wyższych alkoholi
Ostatnio w żołądku wykryto IV klasę enzymu o bardzo małym powinowactwie do etanolu.
Występuje polimorfizm populacyjny jeśli chodzi o ADH, co tłumaczy nietolerancję etanolu w pewnych populacjach.
Ten pierwszy stopień przemian alkoholu jest równocześnie etapem ograniczającym szybkość całego procesu metabolizmu etanolu. Dalsze ultenianie aldehydu do kwasu octowego i dalej do dwutlenku węgla i wody są procesami przebiegającymi znacznie szybciej i praktycznie bez większych ograniczeń. Proces utlenianina alkoholu do aldehydu przebiega z prawidłową szybkością tylko wtedy, gdy obok właściwej aktywności ADH zapewniona jest również optymalna dostawa NAD. Wzrost stężenia NADH, powstający w toku przemiany alkoholu, powoduje zmianę stosunku NAD i NADH, co w konsekwencji powoduje wyraźne naruszenie stanu równowagi oksydoredukcyjnej w cytoplazmie hepatocytów i hamuje niektóre przemiany metaboliczne.
Drugim układem, biorącym udział w przemianach alkoholu, jest mikrosomalny układ utleniania etanolu (MEOS). W odróżnieniu od ADH, enzymy tego układu zlokalizowane są nie w cytozolu, lecz w mikrosomalnych komórkach wątroby. Pierwszoplanową rolę pełni w nim cytochrom P - 450 (CYP) w swej izoformie 2E1 (CYP 2E1).
Podawanie alkoholu indukuje aktywność MEOS, równocześnie aktywność układu ADH i katalazy zmniejsza się lub nie ulega zmianom. Obecnie uważa się, że ADH utlenia etanol głównie przy niskich stężeniach alkoholu we krwi, osiągając szczyt swojej aktywności przy stężeniu 100 mg%. Natomiast układ MEOS szczyt działania wykazuje przy stężeniach 500 mg%. U osób spożywających etanol obserwuje się przewagę aktywności MEOS nad układem ADH. Stwierdzono równocześnie, że za przyspieszenie procesów przemian etanolu odpowiedzialna jest właśnie wyidukowana izoforma cytochromu P- 450.
Zakres toksyczności:
Spożycie 1 ml 95% etanolu na kg masy ciała powoduje, że po dwóch godzinach stężenie etanolu we krwi wynosi 1 g/L - 1 ‰
Objawy zatrucia etanolem pojawiają się przy stężeniach od 1,5 do 3,0 g/l etanolu we krwi.
Mechanizm działania toksycznego:
depresja ośrodkowego układu nerwowego
hipoglikemia - zaburzenie glukoneogenzy
przewlekłe nadużywanie i ostre zatrucie predysponuje do urazów, hipotermii, zaburzeń metabolicznych
Farmakokinetyka: szybka absorpcja, objętość dystrybucji = 0.5 - 0.7 L/kg, eliminacja - głównie metabolizm w wątrobie
Objawy kliniczne w ostrym zatruciu:
średnie zatrucie - euforia, zaburzenia koordynacji, ataksja, oczopląs, niekontrolowane zachowanie, osłabienie odruchów, agresywne zachowanie
ciężkie zatrucie - śpiączka, depresja oddychania, zachłyśnięcie (aspiracja do płuc); wąskie źrenice, hipotermia, hipotensja
rabdomioliza
Objawy kliniczne przewlekłego nadużywania:
uszkodzenie wątroby - stłuszczenie, zapalenie wątroby, marskość (cirrhosis)
zapalenie żołądka, przełyku, krwawienia z przewodu pokarmowego
układ krążenia - kardiomiopatie, zaburzenia rytmu (hipokaliemia, hipomagnezemia)
układ nerwowy - zmiany degeneracyjne
zespół odstawienny
Wypadki śmiertelne mają miejsce przy stężeniach większych niż 4,0 g/L chociaż znane są również przypadki zatrucia śmiertelnego przy dawkach tak niskich jak 2,6 g/L.
Dawki śmiertelne etanolu różnią się znacznie i często są dużo niższe przy równoczesnym przyjmowaniu leków uspakajająco - nasennych lub uspakajających.
Interakcje: barbiturany, p. benzodiazepiny, p. fenotiazyny, opiaty, środki p/histaminowe, trójcykliczne antydepresanty, inhibitory MAO, p. kumaryny - wzmagają działanie etanolu. Disulfiram, p. sulfonylomocznika (możliwość wystąpienia hipoglikemii), metronidazol, insulina, chloramfenikol, tiokarbaminiany wzmagają toksyczne działanie etanolu.
Centralny Układ Nerwowy
Ostre zatrucia
Charakteryzują się stanem splątania, ataksją, niestabilnością emocjonalną, zaburzeniami percepcji i czucia, możliwa jest chwilowa utrata przytomności i brak koordynacji z uszkodzoną zdolnością wykonania standaryzowanych testów. Depresja centralnego układu nerwowego może się nasilać aż do śpiączki włącznie. Śpiączce często towarzyszą drgawki związane ze znacznego stopnia hipoglikemią
Uwaga: Drgawki mogą wystąpić w kilka do kilkunastu godzin po odzyskaniu przez zatrutego przytomności.
Chroniczne zatrucia
Encefalopatie Wernickego
psychoza Korsakoffa
uzależnienie
objawy abstynencji
objawy uszkodzenia móżdżku
Objawy abstynencji mogą obejmować:
delirium tremens
drżenia
ataki drgawek
Depresja Centralnego Układu Nerwowego
Ataksja może się pojawiać przy stężeniach etanolu we krwi wyższych niż 1.5 ‰ Obserwowano również zniesienie odruchów.
Obniżenie zdolności do kierowania samochodem pojawia się przy stężeniu etanolu we krwi wynoszącym 0.5 ‰ lub niższym i pogłębia się razem z poziomem etanolu.
Prawdopodobieństwo spowodowania wypadku jest związane z poziomem etanolu we krwi :
Stężenie etanolu we krwi (mg%) |
Prawdopodobieństwo wypadku (%) |
40 (0.4 ‰) |
1 |
100 (1.0 ‰) |
7 |
140 (1.4 ‰) |
20 |
180 (1.8 ‰) |
35 |
Hipoglikemia, w wyniku której mogą pojawić się drgawki jest poważnym powikłaniem ostrego zatrucia etanolem szczególnie u dzieci i u alkoholików
Obniżony poziom potasu (hiopokaliemia)
Obniżony poziom magnezu (hipomagnezemia)
Równowaga kwasowo - zasadowa
Może występować kwasica mleczanowa i ketonowa w związku z zaburzeniami metabolicznymi takimi jak:
nadmierna produkcja NADH,
oksydacja etanolu
wzrost użytkowania kwasu mlekowego
zwolnienie wątrobowej glukoneogenezy
W ostrej kwasicy mleczanowej występuje cały szereg niespecyficznych objawów: zmęczenie, stan splątania, stupor, zapaść oddechowa (zatrzymanie oddechu), szok i śpiączka.
Rozszerzenie naczyń obwodowych i depresja centralnego systemu nerwowego mogą prowadzić do obniżenia temperatury ciała (hipotermii)
U nałogowych alkoholików zanotowano ostre i przewlekłe choroby mięśni szkieletetowych (często rabdomiolizę z następową niewydolnością nerek).
Zaburzenia immunologiczne
Znane są przypadki wystąpienia anafilaksji i innych reakcji alergicznych po spożyciu etanolu.
Rozpoznanie:
dane z wywiadu,
charakterystyczny zapach,
objawy kliniczne,
oznaczenie etanolu - krew - surowica, mocz, powietrze
1. Oznaczenie elektrolitów w surowicy krwi
2. Oznaczenie stężenia glukozy
3. Równowaga kwasowo-zasadowa
4. Pomiar osmolarności (stężenia osmolarne) w osoczu lub surowicy krwi pozwala na szybkie oznaczenie ilości etanolu we krwi: stężenie 1.5 ‰ etanolu we krwi powoduje zwiększenie osmolarności do 21.6 miliosmoli/kg wody
5. Badanie zaburzeń krzepnięcia i fibrynolizy
6. Ekg
Leczenie:
zabezpieczeniu funkcji układów oddechowego i krążenia
ułożyć pacjenta w pozycji bezpiecznej
wskazane jest podanie:
glukozy
Tiaminy - 100 mg
Naloxonu - 2 mg i.v
benzodiazepiny zapobiegają wystąpieniu drgawek (3 razy po 100 mg Fenytoiny w ciągu doby)
salicylan fizostygminy dożylnie w przypadku wystąpienia zespołu cholinolitycznego
hemodializa eliminuje etanol z organizmu 3-4 razy szybciej niż metabolizm wątroby. Jest przydatna u pacjentów z wysokim stężeniem etanolu z towarzyszącą niewydolnością wątroby i nerek.
IZOPROPANOL
Zastosowanie:
jako rozpuszczalnik, antyseptyk, składnik płynów do mycia szyb
Mechanizm działania toksycznego:
działa depresyjnie na układ nerwowy - śpiączka, depresja oddychania
metabolizowany do acetonu - przyczynia się do nasilenia i przedłużenia śpiączki
poszerzenie naczyń, depresja m. sercowego
podrażnienie przewodu pokarmowego
Objawy kliniczne:
przypominają objawy zatrucia etanolem
wymioty, bóle brzucha
ketonemia, ketonuria
Rozpoznanie:
wywiad, charakterystyczny zapach
Leczenie:
zależne od objawów
METANOL
Synonimy: spirytus drzewny, karbinol, alkohol metylowy.
Właściwości fizykochemiczne: bezbarwny płyn, dobrze rozpuszczalny w eterze i w wodzie o piekącym smaku, palny, ciężar właściwy 0.971g/cm3, temperatura wrzenia 64,8 st. C
Zastosowanie: rozpuszczalnik farb i lakierów, politury i szelaku, środek zapobiegający zamarzaniu, w syntezie chemicznej używany jako środek metylujący.
Mechanizm działania toksycznego:
metanol ma działa depresyjnie na układ nerwowy - objawy upojenia;
wysoce toksyczne metabolity
metabolizowany do formaldehydu i kwasu mrówkowego
kwasica metaboliczna - kwas mrówkowy
ślepota - mrówczany
Dawka śmiertelna: 30 - 240 ml (20-150 g);
minimalna dawka toksyczna - 100 mg/kg
Hamuje procesy oksydacyjne w ustroju, blokując liczne enzymy wewnątrzkomórkowe
Metanol ulega utlenowaniu w wątrobie przy wykorzystaniu tego samego układu enzymatycznego co etanol. Wykazuje jednak znacznie mniejsze powinowactwo do układu dehydrogenaz niż etanol, co powoduje, że kumuluje się on w organizmie i utlenia powoli do aldehydu mrówkowego i kwasu mrówkowego, a ten wolno utlenia się do wody i dwutlenku węgla.
Dystrybucja metanolu w ustroju jest równomierna, z wyjątkiem ciałka szklistego i nerwu wzrokowego, gdzie stężenia są najwyższe. Sam metanol jest stosunkowo mało toksyczny, silnie toksyczne są natomiast jego metabolity, które kompleksują żelazo oksydazy cytochromowej hamując procesy utleniania tkankowego.
Zahamowanie tlenowej fazy spalań tkankowych i wytworzenie kwasu mlekowego doprowadzają do wyczerpania rezerw zasadowych i wystąpienia kwasicy.
Brak tlenu i zakwaszenie prowadzi do ciężkiego uszkodzenia OUN.
Objawy kliniczne:
w pierwszych godzinach - objawy upojenia
po okresie utajenia (do 30 godzin) - ciężka kwasica metaboliczna, zaburzenia widzenia, drgawki, śpiączka
ślepota, śmierć
Inne objawy typowe dla zatrucia metanolem:
Rozszerzenie źrenic z osłabieniem i brakiem ich reakcji na światło, pogorszeniem widzenia aż do całkowitej ślepoty.
Zaburzenia krążenia ze spadkiem ciśnienia tętniczego
Hipokaliemia
Oziębienie ciała
Sinica i drgawki
W ciężkim zatruciu:
Niewydolność oddechowa
Uszkodzenie nerek i wątroby
Ostre zapalenie trzustki
Zespół wykrzepiania wewnątrznaczyniowego
Obrzęk siatkówki i mózgu
Późny zespół parkinsonowski
Leczenie:
Płukanie żołądka
Alkalizacja (8,4% dwuwęglan sodu)
Monitorowanie i podtrzymywanie podstawowych czynności życiowych
Hemodializa (stężenie metanolu >40 mg/dL), intensywna diureza
Kwas foliowy - przyspiesza metabolizm mrówczanów; dawka - 1 mg/kg co 4 h
Swoiste odtrutki:
Etanol ma 10 - 20 razy większe powinowactwo do ADH - hamuje metabolizm metanolu
dawka początkowa 0,7g/kg mc tj. 1-1,5 ml/kg mc, rozcieńczony do stężenia nie przekraczającego 50%
następnie: 0,5g/kg mc (0,5 - 1ml/kg mc) co 2 h p.o. lub i.v. przez 4 dni utrzymując poziom etanolu 1.5 g/L we krwi
Dawkę etanolu zwiększamy o 1/3, gdy jednocześnie stosujemy zabieg hemodializy
Fomepizol=Antizol - swoista odtrutka - kompetytywny inhibitor dehydrogenazy alkoholowej; zapobiega tworzeniu się metabolitów metanolu;
dawka: początkowa - 15 mg/kg
dawka podtrzymująca - 10 mg/kg co 12 godzin (4 dawki)
GLIKOL ETYLENOWY
Synonimy: glikol, 1,2-etanodiol, glikol monoetylenowy, 1,2 hydroksyetan
Właściwości fizykochemiczne: bezbarwna, oleista, palna ciecz o słodkim smaku, bardzo dobrze rozpuszczalna w wodzie i alkoholu, trudno rozpuszczalna w eterze;
Zastosowanie: podstawowy składnik przeciwzamarzających płynów
Mechanizm działania toksycznego:
glikol etylenowy - objawy upojenia
toksyczne metabolity - metabolizowany przez dehydrogenazę alkoholową - aldehyd glikolowy, kwas glikolowy, kwas glioksalowy, kwas szczawiowy - odpowiedzialne za ciężką kwasicę metaboliczną
kwas szczawiowy łączy się z wapniem - kryształy szczawianu wapnia wytrącają się w mózgu, nerkach i ciałku szklistym
Dawka toksyczna: 1.5 ml/kg
Objawy zatrucia:
OUN:
Początkowo objawy upojenia alkoholowego(brak zapachu alkoholu w powietrzu wydychanym)
Nasilenie zaburzeń świadomości
Pobudzenie psychoruchowe
Osłabienie
Zaburzenia mowy
Bóle i zawroty głowy
Senność i śpiączka
Drgawki
Zaburzenia oddechu: duszność, oddech Kussmaula
Możliwość wystąpienia tężyczki
Obniżenie temperatury ciała
Porażenie ośrodka oddechowego i naczynioruchowego
Możliwość nieodwracalnego uszkodzenia OUN
Układ oddechowy:
Możliwość wystąpienia obrzęku i/lub zapalenia płuc
Przebieg kliniczny zatrucia można podzielić na 3 fazy:
1. Faza narkotyczna i objawów żołądkowo jelitowych (30 min - 12 godzin)
Objawy uszkodzenia OUN z obrazem klinicznym podobnym do upojenia alkoholowego, w tym czasie rozwija się i narasta kwasica metaboliczna
2. Faza objawów sercowych i płucnych (po 12 godz)
Objawy uszkodzenia układu krążenia i oddychania
Nasilające się objawy ze strony OUN dalsze narastanie kwasicy metabolicznej
3. Faza nerkowa (24 - 72 godzin)
Rozwija się ostra niewydolność nerek
Leczenie:
Płukanie żołądka
Alkalizacja (8,4% dwuwęglan sodu)
Monitorowanie i podtrzymywanie podstawowych czynności życiowych
Hemodializa (obj. dystrybucji= 0.7-0.8 L/kg) zatrucie glikolem z niewydolnością nerek, stężenie glikolu w surowicy > 20-50 mg/dL
Glukonian wapnia?
Swoiste odtrutki:
Etanol ma 10 - 20 razy większe powinowactwo do dehydrogenazy alkoholowej niż metanol - hamuje metabolizm metanolu
dawka początkowa 0,7g/kg mc tj. 1 - 1,5 ml/kg mc, rozcieńczony do stężenia nie przekraczającego 50%
następnie: 0,5g/kg mc (0,5 - 1ml/kg mc) co 2 h p.o. lub i.v. przez 4 dni utrzymując poziom etanolu 1.5 g/L we krwi.
Fomepizol=Antizol - swoista odtrutka - kompetytywny inhibitor dehydrogenazy alkoholowej; zapobiega tworzeniu się metabolitów metanolu;
dawka: początkowa - 15 mg/kg
dawka podtrzymująca - 10 mg/kg co 12 godzin (4 dawki)
Postępowanie w przypadku zatrucia glikolem etylenowym
Leczenie |
Wskazania |
Usunięcie trucizny z przewodu pokarmowego.
|
|
Badania laboratoryjne
|
|
Zastosowanie odtrutki
|
Podawanie odtrutki należy kontynuować do czasu aż poziom glikolu etylenowego spadnie poniżej 20 mg/l i pH uzyska właściwy poziom
|
Wskazania do podania Antizolu (zamiast etanolu)
|
|
Wskazania do podania etanolu
|
|
Wskazania do hemodializy
|
|
Leczenie podtrzymujące
|
|
NEUROLEPTYKI
Leki neuroleptyczne (neuroleptyki) nazywano dawniej „dużymi trankwilizatorami”. Zostały wprowadzone do lecznictwa w latach pięćdziesiątych. Jako pierwszy lek została zsyntetyzowana chlorpromazyna. Stanowią niejednorodną pod względem chemicznym grupę leków. Stosowane są w leczeniu ciężkich schorzeń psychiatrycznych, różnych typów psychoz i stanów maniakalnych.
Wykazują działanie przeciwpsychotyczne, uspokajające, ale również wykorzystywane są ich właściwości przeciwwymiotne i przeciwhistaminowe. Wpływają na procesy behawioralne hamując napęd ruchowy. Na ogół większość tych leków działa niekorzystnie na nastrój, może nasilać lub wywoływać stany depresyjne. Leki z grupy tioksantenu mogą działać pozytywnie na nastrój i wykazywać działanie przeciwdepresyjne. Efekt zbliżony do leków anksjolitycznych wykazują np. tiorydazyna, chlorprotiksen.
Po podaniu dużych dawek pochodnych fenotiazyn lub butyrofenonu obserwowano u zwierząt zjawisko katalepsji. Charakterystyczne jest również hamowanie odruchów warunkowych.
Neuroleptyki wpływają na układy hormonalne - nasilają wydzielania prolaktyny; hamują wydzielania gonadotropin przysadkowych, hormonu wzrostu oraz ACTH.
Pochodne fenotiazyny mają zdolność potęgowania aktywności narkotycznych leków przeciwbólowych. Niektóre np. lewomepromazyna wykazują wyraźne działanie przeciwbólowe.
Charakterystycznym objawem niepożądanym leków neuroleptycznych jest wywoływanie zaburzeń ze strony układu pozapiramidowego, w szczególności parkinsonizmu i dyskinez. Objawy parkinsonowskie najsilniej wywierają pochodne fenotiazyny, butyrofenonu i difenylobutylopiperydyny.
Istotnym obwodowym działaniem niepożądanym jest działanie cholinolityczne oraz spadki ciśnienia tętniczego.
Mechanizm działania:
Zasadniczy mechanizm wiąże się z blokowaniem neurotransmisji dopaminergicznej oraz noradrenergicznej w ośrodkach podkorowych mózgu, w układzie siatkowatym pnia mózgu, podwzgórzu oraz układzie limbicznym.
Wpływ neuroleptyków na receptory noradrenergiczne, zwłaszcza blokowanie receptorów *1 wzmacnia przeciwdopaminergiczny mechanizm działania oraz ma istotne znaczenie w działaniu uspokajającym i hipotensyjnym.
Klasyczne leki neuroleptyczne blokują w mózgu do 80% receptorów D2.
Aby został osiągnięty efekt przeciwpsychotyczny wystarczy zablokować mniejszą pulą receptorów. Działanie zbyt szerokie przyczynia się do powstawania niepożądanych objawów pozapiramidowych.
Objawy parkinsonowskie wywołane są zablokowaniem receptorów dopaminergicznych D2 w prążkowiu.
Późne dyskinezy ujawniające się po długotrwałym podawaniu neuroleptyków są wyrazem zwiększenia wrażliwości i liczby receptorów D2.
Niektóre neuroleptyki blokując przekaźnictwo w układach noradrenergicznych i serotoninergicznych w podwzgórzu wywołują hipotermię wskutek zaburzenia czynności ośrodków termoregulacji oraz poprawiają łaknienie hamując ośrodek sytości.
Przeciwwymiotne działanie wiąże się z blokowaniem receptorów D2 w obszarze chemorecepcyjnym opuszki.
Neuroleptyki, szczególnie fenotiazyny, obniżają próg drgawkowy, za co odpowiedzialne jest hamowanie neurotransmisji katecholaminergicznej.
Wiele leków z tej grupy (szczególnie fenotiazyny) blokuje receptory cholinergiczne typu M, osłabiając niepożądane (parkinsonowskie) następstwa blokady dopaminergicznej. Wywierają one jednak wiele działań niekorzystnych.
Blokada receptorów histaminowych H1 przyczynia się przede wszystkim do działania uspokajającego.
Neuroleptyki atypowe blokują receptory serotoninergiczne należące do typów 5 - HT2 (ściśle do podtypu 5 - HT2A). Działanie to zwiększa skuteczność wobec tzw. negatywnych objawów schizofrenii oraz osłabia niepożądane efekty pozapiramidowe. Powinowactwo do receptorów dopaminergicznych dotyczy niewielkiej ich liczby (ok.20%), co jest wystarczające dla uzyskania efektu leczniczego, natomiast osłabia efekty niepożądane w wyniku słabszego wpływu na układ pozapiramidowy.
Wykazano istnienie złożonej interakcji pomiędzy układem dopaminergicznym i serotoninergicznym, która dotyczy hamowania układu dopaminergicznego przez układ 5-HT.
Niektóre z tej grupy leków (klozapina, risperidon, olanzapina) silniej (nawet 10-krotne) blokują receptor 5-HT2A niż receptor D2.
Klozapina, klotiapina, risperidon wywierają również wpływ na receptory adrenergiczne *1.
Podział leków neuroleptycznych:
1/ pochodne fenotiazyny:
z grupą alifatyczną: chlorpromazyna, lewomepromazyna, triflupromazyna, promazyna, cyjamemazyna, alimemazyna
z pierścieniem piperydynowym: tiorydazyna, pipotiazyna
z pierścieniem piperazynowym: flufenazyna, perazyna, perfenazyna, tioproperazyna, trifluoperazyna, tietylperazyna
2/ pochodne tioksantenu: chlorprotiksen, flupentiksol, klopentiksol,
3/ pochodne butyrofenonu: haloperidol, droperidol, metyloperidol,
4/ pochodne difenylobutylopiperydyny: pimozyd, penfluridol,
5/ pochodne benzamidu: sulpiryd
6/ pochodne indolu: molindon, oksypertyna
7/ atypowe leki neuroleptyczne (trójpierścieniowe neuroleptyki pochodne dibenzodiazepiny, dibenzotiazepiny, dibenzooksazepiny i pochodne różnych układów heterocyklicznych): klozapina, olanzapina, risperidon, klotiapina, zotepina, buspiron(?)
Pochodne fenotiazyny:
Pochodne piperazynowe są przyczyną najmniejszego działania uspokajającego i spadku ciśnienia tętniczego oraz największych działań pozapiramidowych.
W przeciwieństwie pochodne alifatyczne i piperydynowe wykazują działanie uspokajające i spadki ciśnienia przy dawkach terapeutycznych, natomiast objawy pozapiramidowe są mniej częste.
Grupa ta charakteryzuje się najsilniejszym działaniem antypsychotycznym.
Farmakokinetyka
Większość neuroleptyków ma podobne parametry farmakokinetyczne. Są one dobrze absorbowane po podaniu doustnym, ale ich biodostępność (10 - 70%) wykazuje różnice międzyosobnicze, wewnętrzny metabolizm oraz istotny efekt pierwszego przejścia. Maksymalne stężenie w osoczu po doustnym podaniu osiągają w ciągu 2 - 4 godzin oraz 1/2 do 1 godziny po natychmiast uwalnianych preparatach domięśniowych. Przedłużona absorpcja w wyniku przedawkowania związana jest z większym efektem antycholinergicznym. Większość leków antypsychotycznych w wysokim stopniu wiąże się z białkami osocza (75 - 99%). Ulegają dystrybucji do rozległych tkanek ze względu na dużą lipofilność. Objętość dystrybucji waha się od 10 - 40L/kg.
Neuroleptyki łatwo przechodzą przez łożysko i dostają się do krążenia płodowego. Są znajdowane w mleku matek. Podlegają wolnemu i rozległemu metabolizmowi wątrobowemu. Wydalanie nerkowe niezmienionego leku szacuje się na mniej niż 1%. Rozległy metabolizm wątrobowy oraz duża objętość dystrybucji jest przyczyną długiego biologicznego okresu półtrwania (10 - 40 godz).
Neuroleptyki o przedłużonym działaniu posiadają pozorny biologiczny okres półtrwania wynoszący 3 tygodnie.
Prototypem tych leków jest chlorpromazyna.
Biodostępność po podaniu doustnym chlorpromazyny waha się w granicach 10 - 69% (średnio 32%). Maksymalne stężenie pojawia się po 2 - 3h po przyjęciu leku i opada w ciągu 3 - 6h. Objętość dystrybucji jest duża i wynosi średnio 20L/kg.
Większość fenotiazyn w wysokim stopniu wiąże się z białkami (95 - 99%). Dodatkowo kumulują się one w tkance tłuszczowej, a poziomy w mózgu osiągają 10-krotne stężenia w surowicy.
Wchłonięte fenotiazyny ulegają wolnemu metabolizmowi wątrobowemu do polarnych metabolitów. Mniej niż 1% dawki jest wydalanych w postaci niezmienionej przez nerki. Wiele metabolitów jest związkami aktywnymi farmakologicznie dlatego trudny jest do określenia biologiczny okres półtrwania tych leków. Polarne metabolity mogą pojawić się w moczu 2 - 6 tygodni po przewlekłym podawaniu.
Fenotiazyny przechodzą przez barierę łożyska, o czym dowodzą obserwacje dzieci matek przyjmujących te leki (depresja oddechowa, objawy pozapiramidowe).
Objawy zatrucia
W wyniku zatrucia lekami neuroleptycznymi dochodzi do zaburzenia ośrodkowego i autonomicznego układu nerwowego oraz sercowo - naczyniowego.
Istotnymi objawami przedawkowania są reakcje pozapiramidowe oraz złośliwy zespół neuroleptyczny.
Głównym celem diagnostycznym jest oddzielenie pacjentów manifestujących oznaki kardiotoksyczności lub neurotoksyczności od pacjentów wymagających jedynie terapii podtrzymującej w ramach pomocy ambulatoryjnej.
Zatrucie mieszane neuroleptyków i innych depresantów OUN np. cyklicznych leków antydepresyjnych, szczególnie pogłębia depresje oddechową wymagającą intubacji.
Układ sercowo-naczyniowy
obniżenie ciśnienia tętniczego krwi, zaburzenia rytmu serca i przewodnictwa (opóźnienie przewodnictwa, niemiarowości komorowe, bloki), tachykardia.
Kardiotoksyczność częściej pojawia się przy przedawkowaniu piperydynowych pochodnych fenotiazyny, rzadziej przy alifatycznych pochodnych, rzadko w przypadku atypowych neuroleptyków.
Spadek ciśnienie tętniczego charakterystyczny jest dla piperydynowych i alifatycznych pochodnych.
Objawy sercowo - naczyniowe są wynikiem blokady receptorów cholinergicznych, obwodowych receptorów *-adrenergicznych, działania chinidynopodobnego oraz bezpośredniego wpływu depresyjnego na mięsień sercowy.
Ośrodkowy układ nerwowy
uspokojenie jako najczęstszy objaw depresji OUN, senność, śpiączka, depresja ośrodka oddechowego (możliwość bezdechu oraz nagłej śmierci niemowląt), zamazana mowa, ataksja, dezorientacja, możliwość wystąpienia drgawek. Pojawiają się one częściej po loksapinie oraz klozapinie. Objawy depresji OUN ujawniają się w ciągu 1-2 godzin po nadużyciu.
Dysfunkcja ośrodka termoregulacji: hipotermia, rzadziej hipertermia
Narząd wzroku: zwężenie źrenic towarzyszy znacznemu stopniu śpiączki
Obwodowe objawy antycholinergiczne: zaczerwienienie skóry, suchość błon śluzowych, zatrzymanie moczu, nudności, wymioty, niedrożność jelit, hipertermia, tachykardia. Mogą pojawić się szczególnie po alifatycznych i piperydynowych pochodnych fenotiazyny, klozapinie oraz olanzapinie.
Złośliwy zespół neuroleptyczny
sztywność mięśni szkieletowych, hipertermia, zmienny stan świadomości (delirium lub przymroczenie),
dysfunkcja autonomiczna (obfite poty, bladość).
Syndrom ten pojawia się częściej u mężczyzn poniżej 40 r.ż.
Czynnikami predysponującymi są choroby organiczne mózgu, odwodnienie, wyczerpanie fizyczne.
Reakcja ta może pojawić się po pojedynczej dawce. Podwyższenie aktywności CPK może być znaczne.
Objawy rozwijają się przez 24 - 72 godzin i trwają 5 - 10 dni po przerwaniu doustnej terapii lekami neuroleptycznymi.
Neurologiczne objawy uboczne
ostre reakcje dystoniczne: objawy zwykle rozpoczynają się 5 godzin (5 - 30h) po przyjęciu leku, w ciągu pierwszych 7-10 dniach leczenia. Wszystkie pochodne fenotiazyny, butyrofenonu i tioksantenu odpowiedzialne są za te reakcje. Leki posiadające najmniejsze objawy cholinolityczne (np. haloperidol, trifluoperazine, flufenazine) eksponują najsilniejsze objawy pozapiramidowe.
Reakcje dystoniczne są bardziej zaznaczone u niemowląt i młodych osób, szczególnie gdy jednocześnie współdziałają czynniki predysponujące takie jak gorączka lub odwodnienie. Mężczyźni są dwukrotnie bardziej predysponowani niż kobiety w granicach wieku od 5 do 45 lat. U dzieci typowe są następujące objawy: mowa zamazana, dyzartria, dezorientacja, trudności w połykaniu, śpiączka, bezbolesny skurcz, hipertoniczność, drżenia oraz niepokój mięśniowy.
akatyzja (niemożność usiedzenia na miejscu): hiperkineza, pobudzenie i bezsenność pojawiają się zwykle w najwcześniejszym etapie leczenia. Podstawową dolegliwością jest subiektywne odczuwanie wewnętrznego napięcia, lęku. Kobiety są bardziej predysponowane od mężczyzn w każdym wieku. Ostra akatyzja rozpoczyna się wkrótce po rozpoczęciu lub zwiększeniu dawkowania leków neuroleptycznych
zespół parkinsonoidalny
późne dyskinezy: są najbardziej groźnym objawem pozapiramidowym leczenia pochodnymi fenotiazyny i butyrofenonu. Te reakcje charakteryzują mimowolne, powtarzające się ruchy twarzy, ust ale również dotyczą kończyn i tułowia.
Reakcje nadwrażliwości
Zarówno haloperidol jak i chlorpromazyna mogą wywołać rozlaną pokrzywkę lub fotodermatozę. Ponadto chlorpromazyna może być przyczyną hiperpigmentacji podczas ekspozycji skóry na światło. Podczas przewlekłej terapii może rozwijać się żółtaczka cholestatyczna.
Diagnostyka
Poziomy w surowicy nie korelują dobrze z efektami klinicznymi z powodu dużej ilości aktywnych metabolitów. Oznaczenie jakościowe będzie jedynie potwierdzeniem przyjęcie tej grupy leków, natomiast wdrożenie leczenia jest oparte na objawach klinicznych.
Leczenie
Większość pacjentów po przedawkowaniu czystymi lekami antypsychotycznymi nie wymagają hospitalizacji. Bezobjawowi pacjenci powinni być jednak obserwowani i monitorowani przez 4-6h od momentu nadużycia leków zanim zostaną poddani konsultacji psychiatrycznej. Pacjenci z zaburzeniami rytmu, zmianami w EKG, przedłużającym się spadkiem ciśnienia, drgawkami, zespołem antycholinergicznym oraz utrzymującą się depresją OUN powinni być hospitalizowani w jednostce intensywnej terapii.
W zatruciu neuroleptykami należy jak najszybciej ocenić stan ogólny pacjenta, a następnie monitorować podstawowe czynności życiowe. W przypadku ciężkich zatruć konieczne jest stałe monitorowanie układu krążenia celem natychmiastowego wdrożenia leczenia antyarytmicznego oraz zwalczanie wstrząsu. W leczeniu komorowych zaburzeń rytmu zalecane są lidokaina i fenytoina. Przeciwwskazane są chinidyna, prokainamid oraz disopyramid.
Diazepamu podawany dożylnie jest lekiem stosowanym w opanowaniu aktywności padaczkowej
antycholinergicznego stosuje się podskórnie lub dożylnie salicylan fizostygminy w dawce 1-2mg u dorosłych i 0.02mg/kg u dzieci powoli przez 3-5 minut.
Aby zabezpieczyć przed wchłonięciem leku należy wykonać płukanie żołądka, podawać węgiel aktywowany, jak również doustnie solne środki przeczyszczające.
W diagnostyce pacjentów pochodnymi fenotiazyn można wykorzystać fakt, że nie przepuszczają one promieni rtg, co może być uwidocznione w badaniu radiologicznym
Efekt antycholinergiczny leków neuroleptycznych opóźnia opróżnianie żołądka, co wpływa na skuteczność płukania żołądka nawet kilka godzin po spożyciu
W przypadku wystąpienia objawów ze strony układu pozapiramidowego należy podawać leki stosowane w chorobie Parkinsona takie jak triheksyfenidyl, benzatropina, biperiden.
W złośliwym zespole neuroleptycznym skuteczny okazał się Dantrolen, podawane są również amantadyna, benzodiazepiny, bromokryptyna, lewodopa/karbidopa, pankuronium oraz nitroprusydek sodu.
Zabiegi przyspieszonej eliminacji trucizn takie jak forsowana diureza czy hemodializa lub hemoperfuzja nie są efektywne w usuwaniu neuroleptyków z uwagi na wysoki stopień wiązania z białkami oraz dużą objętość dystrybucji.
TRÓJCYKLICZNE ANTYDEPRESANTY
LEKI PRZECIWDEPRESYJNE
Leki przeciwdepresyjne działają leczniczo w zespołach depresji endogennej
podwyższają chorobowo obniżony nastrój
wywierają leczniczy wpływ na pozostałe podstawowe cechy tego zespołu: usuwają lęk i niepokój, zaburzenia napędu psychoruchowego (spowolnienie, zahamowanie) oraz zaburzenia rytmów biologicznych zwłaszcza rytmu dobowego (zaburzenia snu)
Historia
1948 - zsyntetyzowano imipraminę i zastosowano ją jako środek uspokajający
1958 - zastosowano imipraminę jako środek przeciwdepresyjny, wprowadzono amitryptylinę
1960 - zwrócono uwagę na kardiotoksyczność i neurotoksyczność cyklicznych leków antydepresyjnych
1988 - wprowadzono leki hamujące selektywnie wychwyt serotoniny
Mechanizm działania
hamowanie zwrotnego wychwytu niektórych monoamin, odgrywających rolę substancji przekaźnikowych w OUN, dotyczy to głównie noradrenaliny (NA) oraz serotoniny (5-HT):
Trójpierścieniowe leki przeciwdepresyjne
Podstawowy mechanizm działania
nasilenie przekaźnictwa noradrenergicznego (zmniejszenie wychwytu zwrotnego NA)
blokowanie receptorów 5-HT (zmniejszenie wychwytu zwrotnego serotoniny)
blokowanie receptorów cholinergicznych M
blokowania receptorów H2
zwiększenie wrażliwości receptorów D2
zahamowanie szybkiego kanału sodowego - stabilizacja błon komórkowych (dz. chinidynopodobne - lek antyarytmiczny kl. IA)
Właściwości farmakokinetyczne
Dostępność biologiczna
szybko i prawie całkowicie wchłaniają się z przewodu pokarmowego
stężenie maksymalne osiągane jest po upływie 2 - 6h
Dystrybucja
jako związki lipofilne łatwo przechodzą do tkanek
Vd jest duża - od kilku do kilkudziesięciu L/kg
wiązanie z białkami osocza od 60 - 98 %
Metabolizm i wydalanie
eliminacja zachodzi głównie na drodze metabolizmu w wątrobie
produkty demetylacji i hydroksylacji są aktywne farmakologicznie
ok. 5% wydalane jest z moczem w postaci niezmienionej
okres półtrwania T1/2 - od kilku do kilkudziesięciu godzin
są wydalane z mlekiem matek karmiących
Mechanizm działania toksycznego
(narządy krytyczne - układ krążenia i ośrodkowy układ nerwowy)
Układ krążenia
działanie antycholinergiczne i zahamowanie wychwytu zwrotnego katecholamin → tachykardia i umiarkowane nadciśnienie
obwodowa blokada alfa-adrenergiczna → rozszerzenie naczyń
działanie depresyjne na błony komórkowe (zahamowanie szybkiego kanału sodowego) - działanie chinidynopodobne → depresja mięśnia sercowego i zaburzenia przewodnictwa
Ośrodkowy układ nerwowy
działanie antycholinergiczne → senność, splątanie, pobudzenie, delirium, śpiączka
zahamowanie wychwytu zwrotnego katecholamin i serotoniny w mózgu i inne ośrodkowe mechanizmy → drgawki, mioklonie
Objawy kliniczne ostrego zatrucia:
objawy ze strony układu krążenia zaburzenia przewodzenia, arytmie, hipotensja
objawy zespołu antycholinergicznego ośrodkowe i obwodowe
Układ krążenia - zaburzenia przewodzenia, arytmie, hipotensja
typowe zmiany w ekg:
tachykardia zatokowa z przedłużeniem czasu trwania PR, QRS i QT
bloki AV różnego stopnia
częstoskurcz komorowy, migotanie komór, atypowa lub polimorficzna tachykardia komorowa (torsades de pointes)
bradyarrytmie
hipotonia
wstrząs kardiogenny
obrzęk płuc
objawy zespołu antycholinergicznego
ośrodkowe
niepokój
pobudzenie psychoruchowe
splątanie, zespół majaczeniowy (delirium)
śpiączka
drgawki
mioklonie, ruchy mimowolne
objawy zespołu antycholinergicznego
obwodowe
źrenice szerokie, bez reakcji na światło
zaczerwieniona skóra, błony śluzowe suche zmniejszone pocenie
hipertermia
osłabienie lub zniesienie perystaltyki
zatrzymanie moczu
Leczenie
Ocena stanu pacjenta i wstępna stabilizacja funkcji układu oddychania i krążenia
Leczenie hipotensji i zaburzeń rytmu
dwuwęglan sodu (NaHCO3)
(bolus 1- 2 mEq/kg, następnie powtarzać w takiej dawce aby pH krwi wynosiło 7.45- 7.50)
dożylna infuzja roztworu soli fizjologicznej
hiperwentylacja
(wentylacja powinna być prowadzona w taki sposób aby pH krwi wynosiło 7.45- 7.50)
lidokaina, bretylium, fenytoina
(należy zastosować w przypadku wystąpienia zaburzeń rytmu; leki należące do grupy Ia [prokainamid, chinidyna] nie powinny być stosowane)
norepinefryna, dopamina iv
Leczenie drgawek i pobudzenia ruchowego
W przypadku wystąpienia drgawek lekiem pierwszego rzutu jest diazepam w dawce 5 mg iv u dorosłych i 0.1- 0.5 mg/kg u dzieci.
Dekontaminacja przewodu pokarmowego
Zaleca się podawanie węgla aktywowanego w dawce 1 g/kg m.c.
Przyspieszona eliminacja
forsowana diureza , hemodializa nie są skuteczne
hemoperfuzja z zastosowaniem kolumn żywiczych - tylko we wczesnym okresie zatrucia
Selektywne Inhibitory Wychwytu Zwrotnego Serotoniny (SSRIs)
Mechanizm działania
hamują wychwyt zwrotny serotoniny (5-HT) bez istotnego wpływu na wychwyt noradrenaliny i dopaminy
nie wywierają bezpośredniego działania na receptory adrenergiczne, histaminergiczne, muskarynowe i serotoninergiczne
są bezpieczniejsze przy przedawkowaniu
Budowa chemiczna
grupa niejednorodna chemicznie - należą do niej: fluoksetyna, sertralina, paroksetyna, fluwoksamina, venlafaksyna, trazodon
Farmakokinetyka
grupa o odmiennych profilach farmakokinetycznych: duża objętość dystrybucji, metabolizowane w wątrobie, długi okres półtrwania
Objawy zatrucia
OUN - senność, zaburzenia równowagi, śpiączka
depresja oddechowa - rzadko, tylko przy równoczesnym zatruciu etanolem lub innymi lekami działającymi depresyjnie na OUN
zażycie SSRIs razem z inhibitorami MAO, lub zażywanie dwóch różnych leków tej grupy może doprowadzić do wystąpienia zespołu serotoninowego
Objawy zespołu serotoninowego - splątanie, dezorientacja, niepokój ruchowy, mioklonie, wygórowanie odruchów, zaburzenie zborności ruchów, dreszcze, obfite pocenie się, hipertermia
NLPZ
Niesterydowe leki przeciwzapalne (NLPZ), to duża grupa leków o różnorodnej budowie chemicznej, ale o podobnych właściwościach farmakologicznych. Wywierają działanie przeciwzapalne, przeciwbólowe i przeciwgorączkowe, aczkolwiek poszczególne efekty są wyrażone w różnym stopniu.
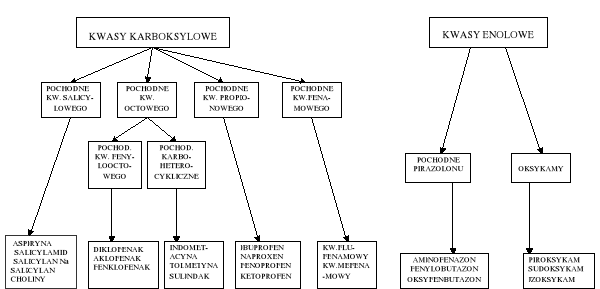
PODZIAŁ NIESTERYDOWYCH LEKÓW PRZECIWZAPALNYCH W ZALEŻNOŚCI OD BUDOWY CHEMICZNEJ
Różna budowa chemiczna
pochodne kwasu octowego (diclofenac, metindol)
pochodne kwasu propionowego (ibuprofen, naproxen)
pochodne kwasu antranilowego (mefacit)
butylopirazolidyny (butapirazol)
oksykamy (piroxicam)
Podobne właściwości farmakologiczne - działanie przeciwbólowe i przeciwzapalne
Objawy kliniczne zatrucia
objawy ze strony przewodu pokarmowego - nudności, wymioty (mogą być podbarwione krwią), bóle brzucha
rzadko - senność, ataksja, szum w uszach, oczopląs, dezorientacja
w ciężkich zatruciach niektórymi lekami (piroxicam, ibuprofen, fenylobutazon, kw. mefenamowy) - drgawki, śpiączka, niewydolność nerek, uszkodzenie wątroby, zaburzenia krzepnięcia, agranulocytoza
Leczenie - objawowe
Powikłania ze strony przewodu pokarmowego
Efekty uboczne związane ze stosowaniem aspiryny i innych NLPZ obejmują łagodne dolegliwości dyspeptyczne po krwawienie z przewodu pokarmowego czy jego perforację. Przyjmowanie przez ponad rok przepisywanych przez lekarza NLPZ może prowadzić do objawowej choroby wrzodowej i jej powikłań. Uszkodzenie śluzówki przewodu pokarmowego jest wynikiem bezpośredniego hamowania syntezy prostaglandyn, które stanowią element „bariery śluzówkowej”. Wykazano, że dawki aspiryny nieprzekraczające 10mg/dobę hamują syntezę prostaglandyn w śluzówce żołądka. Niskie dawki NLPZ mają być również odpowiedzialne za krwawienia z przewodu pokarmowego nie związane z wrzodami, ale będące wtórne do upośledzenia funkcji płytek krwi.
niestrawność - występuje u 25-40% pacjentów przyjmujących NLPZ i jest zależna od dawki. niestrawność - występuje Częściej jest zgłaszana przez ludzi starszych.
nadżerka - u 90% badanych, którzy przyjęli na 2 godziny przed badaniem 1300mg aspiryny, wykazano w żołądku obecność poszerzenia naczyń śluzówkowych (petechie). Mogą one stanowić podłoże do powstawania nadżerek, które często stwierdza się u przewlekle stosujących NLPZ
wrzód - gdy uszkodzenie śluzówki sięga błony podśluzowej. U osób przyjmujących aspirynę dłużej niż 3 miesiące wrzód żołądka stwierdzano u 15%, a dwunastnicy u 2-4%.
krwawienie i perforacja - powikłania choroby wrzodowej. Dotyczy 1% pacjentów po 3-6miesięcznej kuracji z użyciem NLPZ, ale już 2-4% po rocznym leczeniu. Powikłania te są zależne od dawki przyjmowanej aspiryny. Ryzyko względne wystąpienia przewlekłego wrzodu żołądka nie wzrasta znacząco, gdy ilość spożywanej aspiryny nie przekracza 20 tabl. tygodniowo.
90% pacjentów, u których potwierdzono endoskopowo nadżerkę śluzówki bądź wrzód nie zgłaszało dolegliwości.
Ponad 7 pacjentów/1000 z chorobą zwyrodnieniową stawów, którzy są leczeni z użyciem NLPZ przez rok, dochodzi do poważnego powikłania ze strony przewodu pokarmowego.
Oznacza to, że 16 500 pacjentów z chorobą zwyrodnieniową stawów umiera w USA, co należy wiązać ze stosowaniem NLPZ. Jest to liczba porównywalna z liczbą zgonów z powodu AIDS, a większa od liczby zgonów z powodu choroby Hodgkin'a, szpiczaka mnogiego, astmy oskrzelowej.
Ryzyko powikłań wzrasta wraz z dawką stosowanego NLPZ. Ilość hospitalizacji związanych z terapią NLPZ wzrasta z 4/1000 leczonych do 40/1000 leczonych dużymi dawkami. Do 1/3 zgonów u chorych powyżej 65r.ż. przyczyniają się NLPZ.
Czynniki ryzyka powikłań ze strony górnego odcinka przewodu pokarmowego
u chorych przyjmujących NLPZ
wiek
ciężki ogólny stan chorego
stosowanie doustnych glikokortykosterydów
choroba wrzodowa w wywiadzie (wrzód trawienny)
epizod krwawienia z górnego odcinka przewodu pokarmowego w wywiadzie.
leczenie przeciwzakrzepowe
kombinowana terapia NLPZ
duże dawki NLPZ
palenie tytoniu (?)
picie alkoholu (?)
Powikłania hematologiczne
Aspiryna i inne NLPZ wpływają na hemostazę i funkcję płytek krwi poprzez hamowanie syntezy prostaglandyn i tromboksanu A2, wynikiem czego jest wydłużenie czasu krwawienia i zmniejszenie agregacji płytek krwi. Aspiryna blokuje COX nieodwracalnie poprzez acetylację z wytworzeniem wiązania kowalencyjnego. Ponieważ płytki krwi pozbawione są jądra komórkowego resynteza COX staje się niemożliwa, a antyagregacyjne działanie aspiryny przedłuża się na 7-10 dni. Po odstawieniu aspiryny czas krwawienia ulega normalizacji w ciągu 1-2dni, ale agregacja płytek pozostaje upośledzona conajmniej 7dni.
Pozostałe NLPZ hamują aktywność COX odwracalnie, powodując przejściowe (Piroxicam do 3 dni, Ibuprofen do 24h), zależne od dawki, wydłużenie czasu krwawienia, który rzadko przekracza górną granicę normy.
Poważne spontaniczne krwawienia zdarzają się rzadko. Nawet duże zabiegi chirurgiczne w nikłym procencie komplikowane są przez znaczną utratę krwi, co wiązać by można ze stosowaniem przed zabiegiem przez chorego NLPZ. Ryzyko krwawień dotyczy głównie tych chorych, którzy mają upośledzoną hemostazę (np. wrodzone koagulopatie, trobocytopenię) czy też ciężkie uszkodzenie wątroby. Większe ryzyko krwawień dotyczy również osób, które stosują równocześnie antykoagulanty (np.pochodne kumaryny), bądź też piją alkohol.
Powikłania nerkowe
Duże ryzyko powikłań nerkowych w terapii NLPZ dotyczy chorych z wcześniej już występującą chorobą nerek, bądź schorzeniami innych narządów.
Czynniki ryzyka chorób nerek indukowanych przez NLPZ
wcześniej już istniejąca choroba nerek
cukrzyca
nadciśnienie tętnicze
zastoinowa niewydolność krążenia
marskość wątroby
utrata płynów (biegunka, krwotoki, stosowanie środków moczopędnych)
Aktualnie dobrze udokumentowano 2 rodzaje uszkodzenia nerek indukowane przez NLPZ:
1. „Klasyczna” nefropatia analgetyczna - jest efektem nawykowego spożywania przez co najmniej kilka lat mieszaniny leków, wśród których są przynajmniej 2 przeciwgorączkowe oraz kodeina lub kofeina. Charakteryzuje się martwicą brodawek nerkowych i przewlekłym śródmiąższowym zapaleniem nerek, co z czasem wiedzie do postępującej niewydolności nerek.
Toksyczne uszkodzenie nerek związane ze stosowaniem NLPZ - schorzenie to występuje pod różnymi postaciami:
-
ostra niewydolność nerek wtórna do skurczu naczyń nerkowych
śródmiąższowe zapalenie nerek często objawiające się jako zespół nerczycowy
hiperkaliemia
zatrzymanie wody i sodu w organizmie
martwica brodawek nerkowych (rzadko)
Zaburzenia wodno-elektrolitowe:
Najczęstsze powikłanie nerkowe w trakcie terapii NLPZ. Obrzęki stwierdza się u 3-5% leczonych. Często stwierdza się hipernatriemię, hiperkaliemia jest rzadsza. Zaburzenia te są wynikiem hamowania syntezy prostaglandyn, które mediują efekty wywierane przez ADH, przeciwstawne do aldosteronu. Skurcz naczyń nerkowych prowadzi do zmniejszenia przepływu nerkowego zwiększając reabsorpcję sodu.
Ostra niewydolność nerek
Dotyczy osób z wcześniej już upośledzoną funkcją nerek.
Opisywana przy przedawkowaniu paracetamolu.
Pacjenci z wyjściowym poziomem kreatyniny w surowicy przekraczającym 2.5mg% powinni unikać stosowania jakichkolwiek NLPZ.
Zespół nerczycowy i ostre śródmiąższowe zapalenie nerek
Zespół nerczycowy jest efektem uszkodzenia cewek nerkowych. Stwierdza się obniżenie przesączania kłębkowego oraz zatrzymanie wody i sodu w organizmie. NLPZ działają jak alergeny prowadząc do aktywacji limfocytów. Rozwija się zespół nerczycowy i śródmiąższowe zapalenie nerek. Jest rzadkim powikłaniem (dotyczy 0.01-0.02% leczonych NLPZ) i może wystąpić w każdym momencie leczenia.
Martwica brodawek nerkowych
Wywoływana przez fenacetynę, jednoczesne stosowanie paracetamolu, aspiryny i kofeiny lub kodeiny. Jest najcięższym powikłaniem związanym z przewlekłym stosowaniem dużych dawek środków przeciw-bólowych.
Aspiryna w dawkach terapeutycznych u osób z prawidłową funkcją nerek nie prowadzi do zaburzenia ich funkcji. U osób ze schorzeniem nerek może odwracalnie upośledzić ich funkcję. Duże ryzyko powikłań dotyczy chorych z wcześniej już występującą chorobą nerek, nadciśnieniem, zastoinową niewydolnością krążenia, marskością wątroby.
Paracetamol spożyty w dawce 500mg-1g/kg m.c./dobę (badania doświadczalne) prowadzi do martwicy brodawek nerkowych. Ale brak dowodów, aby sporadyczne stosowanie paracetamolu prowadziło do uszkodzenia nerek. Spożywanie nawykowe mieszaniny środków przeciwbólowych (w tym aspiryny i paracetamolu) wiąże się z dużym ryzykiem uszkodzenia nerek, a z czasem ich niewydolnością.
Paracetamol
Historia
Paracetamol został zsyntetyzowany w Stanach Zjednoczonych w Johns Hopkins University w 1877 roku
W 1950 roku został szeroko wprowadzony do lecznictwa w USA jako środek przeciwgorączkowy i przeciwbólowy, zastępując i wypierając fenacetynę
wraz ze wzrostem stosowania paracetamolu zaczęto notować przypadki zatruć tym lekiem. W 1966 roku w Wielkiej Brytanii zarejestrowano i opisano pierwszy przypadek masywnego uszkodzenia wątroby wskutek przedawkowania paracetamolu
W UK paracetamol jest czynnikiem etiologicznym samozatruć głównie u pacjentów poniżej 35 roku życia (ok. 41%)
w Polsceznany jest od ok. 20 lat, natomiast od 5 - 6 lat jest szeroko stosowany, często jako lek przeciwbólowy i przeciwgorączkowy pierwszego rzutu
Obecnie dostępny jest w większości sklepów ogólnospożywczych, stacji benzynowych
Jest też szeroko reklamowany we wszystkich mediach
Zatruciom paracetamolem i jego toksyczności poświęcono wiele uwagi i według niektórych autorów problem jest przeceniony, gdyż tylko u niewielkiej liczby pacjentów rozwija się toksyczne uszkodzenie wątroby, która i tak ma duże zdolności regeneracyjne
Budowa
Paracetamol jest syntetyczną pochodną para - aminofenolu (aniliny)
Działanie toksyczne paracetamolu na inne układy i narządy:
Nerki: martwica proksymalnych kanalików nerkowych, niewydolność nerek
(uszkodzenie nerek może być niezależne od uszkodzenia wątroby)
Trzustka: krwotoczne zapalenie trzustki
(występuje znacznie częściej u osób nadużywających alkohol)
Układ krążenia: bradykardia, tachykardia zatokowa, blok przewodzenia/rytm węzłowy, arytmie komorowe, uniesienie bądź obniżenie odcinka ST, niespecyficzne zmiany ST-T, odwrócenie załamka T, ogniskowa martwica myocardium, lokalne krwawienia,zwyrodnienie tłuszczowe miocytów, kardiomiopatia roztrzeniowa, zastoinowa niewydolność krążenia.
Objawy uboczne
Objawy uboczne stosowania paracetamolu w dawkach terapeutycznych występują bardzo rzadko
Wielopostaciowe wysypki skórne
Zaburzenia ze strony układu krwiotwórczego: trombocytopenia, leukopenia, neutropenia, agranulocytoza, pancytopenia
zaczerwienienie skóry
obrzęk naczynioruchowy
hipotermia
zaburzenie oddychania, skurcz oskrzeli
zaburzenie krążenia obwodowego do wstrząsu włącznie
Paracetamol a używanie alkoholu
Etanol zwiększa hepatotoksyczność paracetamolu u osób stale nadużywających alkohol (jest to wynik wysokiej aktywności układu moonoksygenaz wątrobowych już wcześniej indukowanych przez etanol).
U osób ostro zatrutych etanolem dochodzi do zwolnienia i obniżenia metabolizmu paracetamolu w wątrobie, a co za tym idzie obniżenia działania hepatotoksycznego paracetamolu.
Objawy i przebieg zatrucia
Faza I - występuje po ok. ½ godz. po spożyciu i trwa 24 godziny
brak łaknienia
złe samopoczucie
obfite pocenie się
bladość skóry
Faza II - 24 do 48 godzin
bóle w okolicy podżebrza prawego
wzrost aktywności AspAT, AlAT i stężenia bilirubiny
obniżenie wskaźnika protrombiny
może rozpocząć się ostra niewydolność nerek (oliguria początkowo z prawidłowym poziomem mocznika, ze względu na brak jego syntezy w uszkodzonej wątrobie)
Faza III - od 72 do 96 godzin
postępujące uszkodzenie wątroby biochemiczne (wzrost aktywności transaminaz, wzrost stężenia bilirubiny, obniżenie stężenia protrombiny) i kliniczne (wymioty, zażółcenie powłok skórnych, bóle okolicy podżebrza prawego, splątanie, drżenia rąk, zaburzenia świadomości)
encefalopatia wątrobowa, śpiączka wątrobowa
uszkodzenie cewek nerkowych, niewydolność nerek
zaburzenia metaboliczne (hipoglikemia, kwasica metaboliczna)
niedotlenienie, uszkodzenie mięśnia sercowego, wzrost CPK, frakcji mB
krwotoczne zapalenie trzustki (zwłaszcza przy współistniejącym uzależnieniu od alkoholu)
zespół wykrzepiania wewnątrznaczyniowego DIC
wstrząs
Faza IV - faza zdrowienia - od 4 dnia do 2 tygodni
Jeżeli w ciągu 4 pierwszych dni ostrego zatrucia nie dojdzie do martwicy wątroby, to objawy występujące w trzecim etapie powoli cofają się i dochodzi do całkowitego wyzdrowienia pacjenta
Do zgonu dochodzi zwykle między 4 a 6 dniem od zatrucia
Uszkodzenie wątroby cofa się w czasie do kilku tygodni. Dochodzi do całkowitej odbudowy struktury wątroby.
Stosunkowo rzadko dochodzi do powstania zmian zwłóknieniowych w wątrobie.
Postępowanie lecznicze
opóźnienie wchłaniania
prowokowanie wymiotów
płukanie żołądka i podanie środka przeczyszcającego (do 2 godzin od zażycia)
podawanie węgla aktywowanego
podawanie specyficznej odtrutki
N-acetylocysteina jest specyficzną odtrutką (prekursor glutationu), podawanie odtrutki powinno być rozpoczęte jak najszybciej, najkorzystniej jest podać NAC w 4 - 8 godz. od zatrucia lub wcześniej
Podawanie NAC zapobiega akumulacji, powstawaniu i gromadzeniu toksycznych produktów przemiany paracetamolu, przyspiesza i pobudza syntezę glutationu oraz przyspiesza sprzęganie z kwasem siarkowym, jako donor grup sulfhydrylowych
DAWKI
Doustnie: dawka początkowa 140 mg/kg m.c., następnie: 70 mg/kg m. c. co 4 godziny do 68 godzin od momentu zatrucia (w sumie 17 dawek)
Dożylnie: 150 mg/kg m.c. w 200 ml 5% glukozy przez 15 min., następnie 50 mg/kg m.c. w 500ml 5% glukozy w ciągu 4 godzin oraz ostatnia dawka - 100 mg/kg m.c. w 1 L 5% glukozy przez 16 godzin
Przyspieszenie eliminacji
hemodializa wskazana tylko do kilku godzin po spożyciu leku
hemoperfuzja jest zalecana w zatruciach dużymi dawkami paracetamolu w celu zmniejszenia powstawania toksycznych produktów przemiany materii; zalecana także w rozpoczynającej się encefalopatii wątrobowej
dializa otrzewnowa - nieskuteczna
Leczenie objawowe
uzupełnianie i korygowanie zaburzeń elektrolitowych
nzwalczanie hipoglikemii
witamina K1, osocze mrożone, przetaczanie krwi
blokery H2
leczenie obrzęku mózgu
Przeszczep wątroby
SALICYLANY
Historia
Salicylany należą do grupy niesterydowych leków przeciwzapalnych, w skład której wchodzi kwas acetylosalicylowy oraz jego pochodne: kw. aminosalicylowy, salicylan amonu, etylu, metylu, potasu, diflunisal, benorylat
ASPIRYNA (kwas acetylosalicylowy) - najpopularniejszy lek na świecie, ma działanie przeciwbólowe, przeciwzapalne, przeciwgorączkowe i przeciwzakrzepowe
W 1887 roku niemiecki chemik Feliks Hoffman otrzymał trwały kwas acetylosalicylowy
Wynalazek zarejestrowano w 1899 roku pod nazwą ASPIRYNA - jako lek przeciwbólowy i łagodzący objawy przeziębienia
Początkowo sprzedawana była jako proszek w słoiczkach lub torebkach, od 1904 roku w postaci tabletek
Farmakokinetyka
Absorbcja
Salicylany dobrze wchłaniają się w żołądku, głównie jednak proces ten zachodzi w górnym odcinku jelita cienkiego
Dystrybucja
Salicylany przenikają do większości tkanek i płynów ustrojowych, w tym do mleka, płynu mózgowo-rdzeniowego, płynu stawowego, łożyska, głównie dzięki biernej dyfuzji zależnej od pH środowiska. Stopień wiązania się z białkami oraz objętość dystrybucji zależą od stężenia salicylanów w surowicy
Metabolizm i wydalanie
Salicylany są hydrolizowane w ścianie jelit, mikrosomach komórek wątrobowych i krwinkach czerwonych do kwasu salicylowego i innych pochodnych przy udziale swoistych esteraz. W wątrobie, nerkach, a także aktywowanych granulocytach obojętnochłonnych, kwas salicylowy ulega dalszej hydroksylacji, lub sprzęganiu z glicyną i kwasem glukuronowym. Metabolity nie wykazują aktywności farmakologicznej
Salicylany są w całości wydalane z moczem, a proces ten zależny jest od pH moczu
Zakwaszenie moczu zmniejsza wydalanie salicylanów i podwyższa ich stężenie w surowicy
Natomiast alkalizacja zwiększa wydalanie salicylanów i obniża ich stężenie w surowicy prawie o połowę
Węgiel aktywowany zmniejsza absorbcję salicylanów z jelit i wydłuża T1/2 kwasu salicylowego do 30 godzin
Mechanizm działania toksycznego
Salicylany nasilają procesy utleniania w ustroju → zwiększona produkcja CO2 → pobudzenie ośrodka oddechowego i zwiększenie wentylacji pęcherzyków płucnych - hiperwentylacja
W większych dawkach, kiedy stężenie we krwi osiąga 350 mg/L, salicylany bezpośrednio pobudzają ośrodek oddechowy → zwiększenie częstości oddechów → alkaloza oddechowa
Organizm broni się przed alkalozą przez zwiększenie wydalania nerkowego wodorowęglanów → kwasica metaboliczna; razem z wodorowęglanami - utrata sodu i potasu → obniżenie pH krwi i stężenia wodorowęglanów oraz hipokaliemia
Pobudzenia metabolizmu ustroju → gromadzenie we krwi produktów przemiany materii: kwasu acetooctowego, pirogronowego, mlekowego → kwasica metaboliczna. Występuje ona gdy poziom salicylanów we krwi wynosi ok. 500 mg/L, co odpowiada lekkiemu zatruciu.
Duże dawki salicylanów powodują obniżenie pH krwi i stężenia wodorowęglanów oraz hamują wrażliwość ośrodka oddechowego na CO2 →niewyrównana kwasica oddechowa →porażenie ośrodka oddechowego i naczynioruchowego
Objawy zatrucia
Zatrucie lekkie : najczęściej występuje u osób przewlekle zażywających aspirynę, zwłaszcza u osób starszych
Zaburzenia równowagi
Drżenia mięśniowe
Szum w uszach
Zaburzenia słuchu - niedosłyszenie
Wzmożona potliwość
Nudności, wymioty
Bóle głowy
Zaburzenia świadomości, splatanie
Zatrucie ciężkie:
Hiperwentylacja
Wysoka gorączka (wtórna do hipertermii rhabdomyoliza)
Pocenie się - prowadzi do odwodnienia organizmu
Hipoglikemia
Drgawki
Halucynacje wzrokowe i słuchowe
Pobudzenie a następnie depresja OUN
Porażenie ośrodka oddechowego
Wstrząs sercowo - naczyniowy
Śmierć spowodowana jest zwykle niewydolnością oddechową, towarzyszy jej wstrząs sercowo-naczyniowy. Niekiedy przyczyną śmierci może być hipertermia. Najczęściej do zgonu dochodzi przy przewlekłym zatruciu, u osób starszych (> 70 roku życia), u których średnie stężenie salicylanów w surowicy wynosi 700-900 mg/L.
Leczenie
płukanie żołądka
powtarzane dawki węgla aktywowanego aby zapobiec absorbcji salicylanów z przewodu pokarmowego
wyrównanie zaburzeń wodno - elektrolitowych (hipokaliemia) i
kwasowo - zasadowych (kwasica metaboliczna - leczenie kwasicy powinno być agresywne, ponieważ obniżone pN zwiększa penetrację salicylanó do tkanek, zwłaszcza OUN)
modyfikowana diureza alkaliczna - wodorowęglan sodu - optymalne jest
utrzymywanie pH moczu w granicach 8 - 8.5
leczenie hipertermii, hipoglikemii, drgawek
pozaustrojowe metody eliminacji - hemodializa (wskazanie - stężenie salicylanów w surowicy 1000 - 1200 mg/L)
GRZYBY
Grzyby rosną przez cały rok!
prawdziwe grzybowe święto zaczyna się w sierpniu i trwa w pełni do końca września - pierwszej połowy października, by skończyć się powoli wraz z nastaniem pierwszych mrozów
Z punktu widzenia praktycznego przyjął się podział zatruć grzybami na zatrucia
krótkim okresie utajenia, w którym zwykle po upływie pół do pięciu godzin po spożyciu grzybów występują objawy kliniczne: najczęściej bóle brzucha, wymioty i biegunka
długim okresie utajenia, w którym pierwsze objawy żołądkowo - jelitowe występują po upływie ponad sześciu godzin od spożycia grzyba
Grzyby trujące
Grupa 1. Grzyby zawierające cyklopeptydy
czynnik toksyczny - amatoksyny
rodzaj/gatunek grzyba -
muchomor sromotnikowy (Amanita phalloides)
muchomor wiosenny (Amanita verna)
muchomor jadowity (Amanita virosa)
czas wystąpienia objawów - 10 do 12 godzin
narząd krytyczny - wątroba
objawy: faza 1 - nudności, wymioty, biegunka, bóle brzucha; faza 2 - toksyczne uszkodzenie wątroby (żółtaczka, skaza krwotoczna); faza 3 - śpiączka wątrobowa, niewydolność nerek, zgon/ powolne zdrowienie
Grupa 2. Grzyby zawierające gyromitrynę
czynnik toksyczny - gyromitryna (monometylhydrazyna, kwas helwellowy)
rodzaj/gatunek grzyba -
piestrzenica kasztanowata (Gyromitra esculenta)
czas wystąpienia objawów - 6 do 10 godzin
narząd krytyczny - ośrodkowy układ nerwowy
objawy: nudności, wymioty, osłabienie, drgawki, methemoglobinemia
Piestrzenica kasztanowata (Gyromitra esculenta)
Jest gatunkiem wywołującym zatrucia po spożyciu potrawy przyrządzonej ze świeżych grzybów.
W analizowanych przypadkach zatruć stwierdzono, że potrawy ze świeżych piestrzenic spożywane po raz pierwszy nie wywoływały zatrucia. Ponowne spożycie potrawy z tych grzybów w krótkim odstępie czasu wywołuje zatrucie, którego obraz kliniczny zwykło się porównywać z zespołem faloidynowym o zmniejszonym nasileniu.
Zatrucia występowały mimo obgotowywania grzybów i odrzucania wywaru.
Grupa 3. Grzyby zawierające koprynę
czynnik toksyczny - kopryna
rodzaj/gatunek grzyba -
czernidlak pospolity (Coprinus atramentarius),
czernidlak kołpakowaty (Coprinus comatus)
czas wystąpienia objawów - 0.5 do 2 godzin z równoczesnym spożyciem etanolu; do 48 godzin od zjedzenia grzybów po spożyciu etanolu
miejsce działania - zahamowanie enzymu dehydrogenazy alkoholowej
objawy: „reakcja antabusowa” - zaczerwienie skóry, niepokój, tachykardia, nudności
Grupa 4. Grzyby zawierające muskarynę
czynnik toksyczny - muskaryna
rodzaj/gatunek grzyba -
strzępiak ceglasty (Inocybe patouillardi),
strzępiak czerwony (Inocybe godeyi),
lejkówka odbielona (Clitocybe dealbata)
czas wystąpienia objawów - 0.5 do 2 godzin godzin
narząd krytyczny- autonomiczny układ nerwowy
objawy: pocenie się, ślinienie, łzawienie, nudności, wymioty, bóle brzucha, biegunka
Grupa 5. Grzyby zawierające pochodne izoksazolu
czynnik toksyczny - muscymol, kwas ibotenowy (wywierają działanie podobne do atropiny)
rodzaj/gatunek grzyba -
muchomor czerwony (Amanita muscaria),
muchomor plamisty (Amanita pantherina),
muchomor narcyzowy (Amanita gemmata)
czas wystąpienia objawów - 0.5 do 2 godzin
narząd krytyczny - ośrodkowy układ nerwowy
objawy: pobudzenie, splątanie, delirium, zaburzenia równowagi, drgawki
Zespół atropinowy
Zaburzenia żołądkowo - jelitowe: nudności, wymioty, niewielka biegunka
Zahamowanie wydzielanie gruczołów
Zaburzenia wzroku, źrenice rozszerzone, nie reagują na światło
Szum w uszach, podwyższenie temperatury ciała nieraz do 40°
Pobudzenie nerwowe: niepokój, napady szału, agresja, odurzenie, halucynacje słuchowe i wzrokowe. Zaburzenia równowagi, pobudzenie ruchowe.
Głęboka śpiączka
Grupa 6. Grzyby zawierające psylocybinę
czynnik toksyczny - psylocybina, psylocyna
rodzaj/gatunek grzyba -
łysiczka lancetowata (Psilocybe semilanceata),
kołpaczek motylkowaty (Panaeolus papilionaceus
stożkogłówka biała (Conocybe lactea)
czas wystąpienia objawów - 0.5 do 1 godziny
narząd krytyczny - ośrodkowy układ nerwowy
objawy: halucynacje, nadmierna ruchliwość, zaburzenia równowagi
Grupa 7. Grzyby zawierające sybstancje drażniące przewód pokarmowy
czynnik toksyczny - różne
rodzaj/gatunek grzyba -
gołąbek (Russula),pieczarka (Agaricus),
krowiak (Paxilus),
wieruszka (Entoloma),
tęgoskór (Scleroderma),
gąska (Tricholoma)
czas wystąpienia objawów - 0.5 do 1 godziny
narząd krytyczny - przewód pokarmowy
objawy: nudności, wymioty, biegunka
Grupa 8. Grzyby zawierające orelaninę
czynnik toksyczny - orelanina
rodzaj/gatunek grzyba -
zasłonak rudy (Cortinarius orellanus)
zasłonak szpiczasty (Cortinarius specioissimus)
czas wystąpienia objawów - > 24 godzin, dni, tygodnie
narząd krytyczny - nerki
objawy: nudności, wymioty, małomocz, niewydolność nerek
Trzeba zawsze
sprawdzać swój zbiór dwukrotnie: starzy zbieracze grzybów są jak dobrzy pływacy; nadmiar zaufania do samego siebie (i do znanego losu) może ich zgubić.
Należy zwalczać wynikające z przesądów poglądy dotyczące „domowych i ludowych” sposobów różnicowania grzybów na jadalne i trujące:
Ślimaki zjadają tylko grzyby jadalne
Sinieją i mają gorzki smak tylko grzyby trujące, białe nie czerniejące grzyby są jadalne.
Na łąkach rosną grzyby jadalne
Próba czerniejącej srebrnej łyżki lub cebuli w zetknięciu z grzybami trującymi jest fikcją.
Na naszym kontynencie występuje ponad 5 tysięcy różnych gatunków grzybów, z tego ponad 160 śmiertelnie trujących. Dlatego:
Zbieracz amator nie może być grzybiarzem super znawcą. Może dobrze znać zaledwie kilka. I tych grzybów się trzymaj. A jeśli masz najmniejszą nawet wątpliwość - nie zbieraj!
Jeśli chcesz mieć całkowitą pewność, że zbierasz grzyby dobre - nie zbieraj grzybów młodych, bo trudno jest odróżnić te, które są trujące
Zrezygnuj ze zbierania grzybów blaszkowatych - wśród nich jest tyle trujących. Łatwo o pomyłkę.
Nie pozwól zbierać grzybów małym dzieciom. One często są ofiarami śmiertelnych zatruć
Jeśli kupujesz grzyby - to tylko gdy masz zaufanie do sprzedającego i możesz stwierdzić, jakie to są gatunki.
Nie kupuj suszonych grzybów, zwłaszcza mieszanych z niewiadomego źródła. Tu o pomyłkę najłatwiej.
Nie wierz tym, którzy twierdzą, iż kilkakrotne gotowanie nieznanego ci grzyba spowoduje, że już nadaje się on do jedzenia. To najczęściej może być groźne w skutkach.
Tak zwane ludowe sposoby na rozpoznanie jadalnych grzybów są zawodne! To nieprawda, że tylko trujący grzyb nie siwieje po przełamaniu! To nieprawda, że tylko trujący grzyb ma gorzki smak. Także wiele innych ludowych sposobów jest zawodnych. Trujący grzyb może nie mieć gorzkiego smaku, może być biały i nie siwieć, może być nadjedzony przez ślimaki.
Nie pomaga także wrzucenie cebuli do gotowania grzybów, by po zmianie jej koloru rozpoznać, czy grzyb jest trujący. Także nie pomaga próba srebrnej łyżki. Są grzyby trujące, przy których łyżka wcale nie ciemnieje.
Trucizna zawarta w grzybach nie ma smaku ani zapachu.
Grzyb (dobry), choć jest bardzo smaczny nie ma specjalnych wartości odżywczych. Jest ciężko strawny. Dlatego jedzenie grzybów surowych jest wykluczone!
Gdy zrobisz sobie jakąś potrawę z dobrych grzybów - zjedz ją zaraz po przygotowaniu. Nie zostawiaj na następny dzień.
„Przeminie dzień i jeszcze dzień,
A potem dnia nie stanie.
Odejdę w światło albo w cień
Na wieczne grzybobranie.”
Jan Sztaudynger
ROŚLINY TRUJĄCE I JADY ZWIERZĘCE
Substancje toksyczne roślin wyższych:
1.Alkaloidy
2.Glikozydy: cyjanogenne, nasercowe, saponiny, glukonolany, antrazwiązki, kumaryny
3.Toksalbuminy
4.Olejki (niektóre)
5.Żywice (niektóre)
6.Związki uczulające na światło
Zatrucia roślinami należą a priori do zatruć mieszanych
Końcowy efekt zależy od składu jakościowego i ilościowego substancji farmakologicznie aktywnych
Ich wzajemnych interakcji: sumowania lub addycji; potęgowania lub synergizmów, wzajemnego znoszenia efektów lub antagonistycznego działania poszczególnych związków
Skład chemiczny ulega znacznym wahaniom nawet w obrębie jednego gatunku botanicznego: odmiana, miejsce i czas zbioru, rodzaj spożytego organu roślinnego
Wiek, ogólny stan zdrowia pacjenta
Ilość, forma i droga przyjęcia mają także wpływ na obraz kliniczny i przebieg zatrucia
Surowe lub niedogotowane nasiona fasoli, zwłaszcza w stanie kiełkowania lub niepełnej dojrzałości mogą wywołać zatrucie fazyną - toksalbumina (fazyna ulega rozkładowi w czasie gotowania)
Przyjęcie per os większych ilości jemioły wywołuje na ogół jedynie podrażnienie przewodu pokarmowego; podanie pozajelitowe prowadzić może do ciężkich zatruć z zaburzeniami czynności serca, uszkodzeniem mięśnia sercowego, znacznym spadkiem ciśnienia tętniczego krwi (wiskotoksyna i inne towarzyszące jej choliny) - związki te przy podaniu doustnym są praktycznie nieaktywne, wiskotoksyna nie wchłania się ze zdrowego przewodu pokarmowego
Zatrucie roślinami, które mają w składzie substancje o przeciwstawnym działaniu farmakologicznym
Ujawnienie toksycznego działania raz jednego raz drugiego składnika
Często zależy to od stanu organizmu osoby zatrutej , jej wieku
Rośliny o działaniu toksycznym ośrodkowym:
Rośliny wywołujące niedotlenienie na skutek porażenia ośrodka oddechowego i powodowania bloku enzymatycznego
Czynnik toksyczny: cyjanowodór
Zatrucia są najczęściej powodowane przez gorzkie migdały oraz pestki jadalnych owoców drzew z rodziny Rosaceae.
Nasiona zawierają glikozyd cyjanogenny amygdalinę, który w organizmie ulega hydrolizie, uwalniając cyjanowodór. W przypadku zjedzenia nasion owoców pestkowych występuje zatrucie cyjanowoderm per os.
Przykłady roślin:
Śliwa- migdał\
Morela zwyczajna
Brzoskwinia zwyczajna
Czereśnia
Wiśnia
Len zwyczajny: w nasionach występuje linamaryna, notowano liczne zatrucia bydła skarmianego wytłokami z nasion lnu, dla człowieka ilość dwóch łyżeczek sproszkowanych nasion lnu nie jest szkodliwa
Dziki bez czarny (Sambucus nigra)
Kwitnienie: czerwiec - lipiec
Owocowanie: sierpień - wrzesień
Objawy : nudności, bóle brzucha, biegunka
Rośliny działające na rdzeń przedłużony i rdzeń kręgowy
Głównie rośliny z rodziny baldaszkowatych (Umbelliferae)
Rośliny te powodują porażenie lub pobudzenie, z następującym porażeniem ośrodków w rdzeniu przedłużonym i rdzeniu kręgowym
Szczwół plamisty (Conium maculatum)
Cechą charakterystyczną szczwołu plamistego jest przykry zapach mysiego moczu, który wydziela roślina i kwiaty po roztarciu
Czynnikiem toksycznym są: koniina i gamma- koniceina
Działają one początkowo pobudzająco, a następnie depresyjnie na ośrodek oddechowy porażając również obwodowo mięśnie oddechowe
Szczwół plamisty: objawy zatrucia
pieczenie w jamie ustnej, przełyku,
bóle brzucha,
ślinotok,
nudności, wymioty,
zwężenie źrenic,
podwójne widzenie,
zaburzenia ostrości widzenia
początkowo tachykardia, potem bradykardia,
zaburzenia oddychania
drgawki toniczno- kloniczne
Zgon następuje w wyniku uduszenia
Szalej jadowity ( Cicuta virosa)
Czynnikami toksycznymi są cykutotoksyna i cykutol
Są one truciznami drgawkotwórczymi, porażającymi ośrodek oddechowy.
Doustna dawka śmiertelna oceniana jest na kilka gramów kłącza.
Pierwsze objawy zatrucia mogą pojawić się po kilkunastu minutach.
Szalej jadowity ( Cicuta virosa)- objawy zatrucia
Pieczenie
niesmak w jamie ustnej
Nudności
bóle brzucha
zaburzenia równowagi
zaburzenia świadomości
drgawki o charakterze dużego napadu padaczkowego
utrata przytomności
zaburzenia oddychania do bezdechu włącznie
Rośliny alkaloidowe o działaniu ośrodkowym pobudzającym oraz obwodowo parasympatykolitycznym
Pokrzyk wilcza jagoda (Atropa belladonna)
Substancja czynna: alkaloidy tropanowe, hioscyjamina, atropina i skopolamina
Spożycie jednej jagody wywołuje objawy zatrucia u dziecka, trzy są potencjalnie śmiertelne. Dla osoby dorosłej spożycie 10-20 jagód może być zatruciem śmiertelnym.
Pokrzyk wilcza jagoda (Atropa belladonna)
rozszerzenie źrenic, zaczerwienie twarzy, suchość w jamie ustnej, sucha skóra, tachykardia zatokowa, czasami wzrost ciśnienia tętniczego, niepokój, pobudzenie psychoruchowe, dezorientajahalucynacje, w ciężkich zatruciach może dojść do śpiączki, zaburzenia perystaltyki jelit, zatrzymanie moczu wskutek porażenia zwieraczy pęcherza moczowego, wysoka temperatura.
Bieluń dziędziarzawa (Datura stramonium)
Roślina jednoroczna z rodziny psiankowatych, chwast
30 - 100 cm, nieprzyjemna woń
Kwitnienie: od czerwca do września
Nasiona: drobne (2-3 mm), nerkowate, czarne lub brązowe
Trujące są wszystkie części rośliny, a zwłaszcza liście i nasiona
Alkaloidy tropanowe: atropina, hioscyjamina i skopolamina są konkurencyjnymi antagonistami acetylocholiny w obwodowych receptorach cholinergicznych i w receptorach w OUN
Cechy zespołu cholinolitycznego:
gorący jak piec
suchy jak pieprz
czerwony jak burak
ślepy jak nietoperz
pobudzony jak tygrys w klatce
Bieluń dziędziarzawa (Datura stramonium): objawy zatrucia
Sucha, ciepła i zaczerwieniona skóra
Suche śluzówki
Szerokie źrenice
Zniesienie perystaltyki
Zatrzymanie moczu
Tachykardia
Pobudzenie
Splątanie, majaczenie, halucynacje
W ciężkich przypadkach: hipertermia, śpiączka, drgawki, zatrzymanie oddechu
Rośliny glikoalkalodowe o działaniu ośrodkowym oraz drażniącym na przewód pokarmowy
Psianka słodkogórz (Solanum dulcamara)
Czynnikiem toksycznym jest solanina. Ma ona działanie drażniące na przewód pokarmowy działa również na ośrodkowy układ nerwowy, początkowo pobudzająco, a następnie drażniąco
Spożycie około 10 jagód może już wywołać poważne objawy zatrucia,szczególnie u małych dzieci
Psianka słodkogórz (Solanum dulcamara: objawy zatrucia
pieczenie w jamie ustnej, nudności, wymioty, bóle brzucha, biegunka, wzrost temperatury ciała, apatia lub niepokój, pobudzenie psychoruchowe, czasami halucynacje, drżenia mięśniowe, zaburzenia czynności serca, przyspieszenie oddechu.
Rośliny olejkowe powodujące zmiany zwyrodnieniowe ośrodkowego układu nerwowego
Tuja zachodnia (Thuja occidentalis)
Czynnik toksyczny: tujon
Wywiera działanie silnie drażniące miejscowo na błony śluzowe i skórę oraz działanie ogólnoustrojowe.
Działa pobudzająco a następnie depresyjnie na OUN, uszkadza narządy miąższowe, działa depresyjnue na serce.
Działa poronnie ale dawki konieczne do wywołania poronienia przekraczają dawkę śmiertelną dla kobiety ciężarnej.
Wrotycz pospolity (Tanacetum vulgare)
Substancje czynne: betatujon, kamfora, terpeny
Zatrucia przypadkowe preparatem Artemisol
Rośliny zawierające żywice i inne substancje czynne o działaniu ośrodkowym oraz miejscowo drażniącym
Wilczomlecz sosnka ( Euphorbia cyparissias)
Substancje toksyczne: euforbina, euforben, euforbol
Działają drażniąco na błonę śluzową przewodu pokarmowego, skórę i spojówki. W dużych ilościach działają na ośrodkowy układ nerwowy, powodując jego depresję niekiedy drgawki
Kontakt ze skórą prowadzi do miejscowych reakcji alergicznych, stanów zapalnych, pęcherzy i długo gojących się owrzodzeń
Wawrzynek wilczełyko ( Daphne mezereum)
Substancja toksyczna: mezereina oraz inne alkaloidy
Liczba kilku jagód uważana jest za potencjalnie śmiertelną dla dzieci, kilkunastu dla dorosłych
Według niektórych autorów śmiertelność w poważnym ostrym zatruciu wynosi około 30 %.
Wawrzynek wilczełyko ( Daphne mezereum): objawy zatrucia
nudności, wymioty, podrażnienie błon śluzowych, jamy ustnej, bóle brzucha, nudności, wymioty, biegunka, może być wodnista lub krwawa, senność, dezorientacja, drgawki, spadek ciśnienia i objawy wstrząsu są wtórne do dużej utraty płynów
Śnieguliczka biała ( Symphoricarpus albus )
Czynnikami toksycznymi są alkaloidy zawarte w owocach
Wywierają działanie drażniące na przewód pokarmowy, skórę i spojówki
Spożyte w większych ilościach wykazują również działanie na OUN, początkowo w postaci pobudzenia, a potem w postaci zaburzeń świadomości
Rośliny o działaniu toksycznym na układ krążenia
Rośliny o działaniu kardiotoksycznym
Naparstnica purpurowa (Digitalis purpurea)
Czynniki toksyczne to glikozydy nasercowe.
Ich działanie wynika z blokowania pompy sodowo- potasowej w błonie komórkowej, co prowadzi do zmian w potencjale jonowym i w efekcie do zaburzeń przewodzenia bodźca i zaburzeń rytmu.
Na toksyczność naparstnicy wpływa wiele czynników np. wydolność nerek, stopień wydolności pracy serca, zaburzenia elektrolitowe
Konwalia majowa (Convallaria maialis)
Substancja toksyczna: konwalotoksyna, konwatoksol i inne
Oleander (Nerium oleander)
Substancja czynna: oleandryna
Zaburzenia rytmu serca i objawy żołądkowo-jelitowe (uporczywa biegunka)
Rośliny działające toksycznie na ośrodek oddechowy i układ krążenia
Tojad mocny (Aconitum napellus)
Jest to jedna z najbardziej niebezpiecznych roślin w Polsce!!!
Substancja czynna :akonityns
Działa na OUN powodując w pierwszym okresie zatrucia krótkotrwałe pobudzenie
Wywiera działanie na serce, wywołując zaburzenia przewodzenia i rytmu
poraża mięsnie szkieletowe, powodując poważne zaburzenia oddechu, a w większych dawkach zgon z powodu porażenia ośrodka oddechowego i zakończeń nerwowych włókien mięśniowych.
Cis pospolity (Taxus baccata)
Substancją czynną jest taksyna
Działa ona drażniąco na błonę śluzową przewodu pokarmowego, a po wchłonięciu wywołuje objawy żołądkowo- jelitowe, działa depresyjnie na OUN, układ oddechowy i serce
Ligustr pospolity (Ligustrum vulgare)
Substancja czynna nie znana.
Objawy dotyczą przewodu pokarmowego i mogą mieć charakter ostrego nieżytu żoładkowo jelitowego.
W ciężkich zatruciach opisywano drgawki, zapaść krążeniową i zgon.
Rośliny o działaniu miejscowo drażniącym i poronnym - Jałowiec pospolity
Substancja czynna: olejek eteryczny zawarty w owocach
Działa on drażniąco na błonę śluzową przewodu pokarmowego,
w dużych ilościach działa pobudzająco
oraz powoduje skurcze mięśniówki macicy oraz krwawienie z dróg rodnych. Nie ma działania poronnego
Uszkadza drogi moczowe
IV. Rośliny o działaniu hepato-, nefro- i gastroenerotoksycznym
hepato - Mięta polej (Mentha pulegium);
nefro - Szczaw zwyczajny (Rumex acetoza);
gastroentero - Kruszyna pospolita (Rhamnus frangula)- świeża kora i owoce,Piwonia lekarska (Paeonia officinalis)- nasiona i kwiaty, Narcyz biały (Narcissus poeticus), Narcyz żółty (Narcissus pseudonarcissus) - cebulki, Śnieżyczka przebiśnieg (Galanthus nivais) - cebulki
V. Rośliny o działaniu hematotoksycznym
Zimowit jesienny (Colchicum autumnale)
VI. Rośliny o działaniu dermatotoksycznym i alergogennym.
Rącznik pospolity ( Ricinus communis L.)
Rośliny o działaniu dermatotoksycznym i alergogennym: Rącznik pospolity ( Ricinus communis L.)
Rącznik pospolity (Ricinus communis): opis rośliny
Roślina roczna lub bylina albo krzew lub niewielkie drzewo
W krajach tropikalnych lub subtropikalnych osiąga rozmiary od 1- 13 m
Jest silnie rozgałęziona, łodygi brązowo-czerwone
Liście do 1 m średnicy, dłoniaste głęboko wcinane, na długich ogonkach
Kwitnie w lipcu i sierpniu: kwiaty czerwone zebrane w groniaste kwiatostany.
Owocem jest kulista kolczysta torebka, wielkości wiśni: każda zawiera trzy komory, mieszczące po 1 fasolowatym, owalnym nasieniu długości do 12 mm o błyszczącej powierzchni szaro-brązowo-marmurkowej
Nasiona dojrzewają od sierpnia do listopada
Pochodzi z tropikalnej Afryki lub Indii, uprawiany w krajach tropikalnych i subtropikalnych
Z nasion otrzymuje się olej rycynowy używany w lecznictwie, kosmetyce, farbiarstwie mający również zastosowanie techniczne (smar do silników lotniczych)
Wytłoki stanowią wartościowy nawóz
W Polsce hodowany jako roślina ozdobna
Rącznik pospolity: toksyczność
Substancje trujące - toksalbuminy: związki białkowe o złożonej strukturze podobnej do toksyn bakteryjnych i wywołujące zbliżone reakcje fizjologiczne
Podobnie jak toksyny bakteryjne działają jak antygeny powodując tworzenie przeciwciał (podawanie rosnących dawek wywołuje odporność, możliwe jest także wyprodukowanie przeciwciał)
In vitro: aglutynacja krwinek czerwonych
Toksalbuminy są wrażliwe na działanie wysokiej temperatury
Są bardziej toksyczne przy podaniu pozajelitowym i śródskórnym niż spożyte doustnie
Rycyna najbardziej znaną i najbardziej toksyczną toksalbuminą
Czysta rycyna należy do najbardziej toksycznych spośród znanych związków
W doświadczeniach na zwierzętach minimalna dawka śmiertelna przy podaniu pozajelitowym wynosiła 0,0001 mg/kg.
Przy podaniu doustnym jest kilkaset razy mniej toksyczna, co świadczy o jej niecałkowitym wchłanianiu lub rozkładzie w przewodzie pokarmowym
Spożycie 1-2 nasi rącznika może wywołać poważne objawy u osoby dorosłej, dla dzieci może to być dawka potencjalnie śmiertelna
Uważa się, że spożycie ponad 10 nasion rącznika jest potencjalną dawką śmiertelną dla człowieka
Rącznik pospolity: objawy zatrucia
bóle , pieczenia w jamie ustnej i przełyku
nudności, wymioty, biegunka (może być krwista)
bóle brzucha.
U osób z alergią mogą wystąpić objawy skurczu oskrzeli
Przyspieszenie akcji serca i spadek ciśnienia tętniczego krwi są przede wszystkim wynikiem odwodnienia na skutek obfitych wymiotów i biegunki
Wstrząs sercowo- naczyniowy jest najczęściej przyczyną zgonu w tym zatruciu.
Obserwuje się również drżenia mięśniowe, senność, hipoglikemię i jej objawy kliniczne.
Niekiedy pojawia się wysoka temperatura
Powikłaniami w ciężkich zatruciach jest uszkodzenie wątroby i nerek
Opisywane były zatrucia wziewne, przez skórę oraz skażenie oczu
U osób wrażliwych może wystąpić silna reakcja już po spożyciu jednego nasienia, a nawet rozgniatanie nasion w palcach może wywołać objawy o charakterze uczuleniowym, także ze ze strony układy oddechowego: napady dychawicy oskrzelowej oraz kataru
Opis przypadku- iniekcja podskórna wyciągu z rącznika pospolitego w celu samobójczym
•20 letni mężczyzna, chemik
•Przyjęty do Kliniki po upływie 36 godzin z objawami: osłabienie, ból i zawroty głowy, nudności, ból brzucha, wymioty, ucisk w klatce piersiowej, bóle mięśniowe kończyn z objawami sztywnienia,
•Przy przyjęciu: tachykardia, hipotensja, anuria, kwasica metaboliczna
•Pacjent skierowany na oddział intensywnej terapii: podbiegnięcia krwawe w miejscu wkłucia po igłach, świeża krew w badaniu per rectum
•Brak koagulacji krwinek, podwyższona aktywność transaminaz, podwyższone stężenie mocznika, kreatyniny, leukocytoza
Opis przypadku- iniekcja podskórna wyciągu z rącznika w celu samobójczym
•W czasie obserwacji pogorszenie stanu: skaza krwotoczna, uszkodzenie wątroby, nerek
•Intubacja dotchawicza , sztuczna wentylacja
•Maksymalne dawki amin presyjnych
•Leczenie skazy krwotocznej
•Niewydolność układów oddechowego i krążenia
•Mimo intensywnej terapii narastanie objawów uszkodzenia wielo-narządowego
•Po upływie 18 godzin od przyjęcia - zatrzymanie akcji serca - resuscytacja nie efektywna
Doniczkowe rośliny ozdobne: Filodendron (Philodendron)
Te rośliny pnące są niezmiernie popularnymi roślinami domowymi i są częściej niż inne przyczyną zatruć.
Podstawową substancją toksyczną zawartą w filodendronach jest szczawian wapnia w formie krystalicznej.
Podczas żucia liści lub innych części rośliny, kryształy mogą wniknąć do tkanki miękkiej i błony śluzowej ust, czego skutkiem jest nasilone podrażnienie jamy ustnej.
Może pojawić się również podrażnienie skóry i oczu.
Natychmiastowe usunięcie resztek rośliny z ust dziecka i podanie płynów ogranicza jej toksyczność.
Wbrew powszechnemu przekonaniu, roślina ta nie jest wysoce toksyczna
Difenbachia malowana
Difenbachia zwykle rośnie pionowo na dużej łodydze podobnej do trzciny, co sprawia, że roślina ta ustawiana jest często na podłodze, w miejscach łatwo dostępnych dla dzieci.
Podobnie jak filodendron należy do rodziny Araceae i wykazuje te same właściwości toksyczne
Często przypisuje się jej nazwę "niema trzcina", ponieważ osoby, które żuły łodygę nie były zdolne mówić na skutek silnego podrażnienia i obrzęku jamy ustnej
Wilczomlecz piękny, Poinsecja, Poinsecja nadobna, Gwiazda betlejemska (Euphorbia pulcherrima)
Poinsecja dziko rosnąca była otoczona większym mitem, dotyczącym jej toksyczności niż ta, która jest kolorową, dekoracyjną rośliną, niezwykle popularną w okresie Świąt Bożego Narodzenia
Ani badania na zwierzętach, ani przypadki opisane wśród ludzi nie potwierdziły wysokiej toksyczności poinsecji, uwalniając ją tym samym od miana rośliny trującej.
Spożycie małych ilości nie wywołuje żadnych objawów. Sok wyciekający z uszkodzonych liści, podobny do lateksu może wywołać niekiedy podrażnienia skórne
ZATRUCIA JADAMI ZWIERZĘCYMI
mają przebieg gwałtowny, ostry
W naszych warunkach geoklimatycznych praktyczne znaczenie mają zatrucia powodowane zwłaszcza przez
owady (pszczoły, osy, trzmiele, szerszenie)
•ukąszenia żmii
Owady
Owady poprzez żądło wydzielają truciznę do rany.
W składzie jadów znajdują się substancje hemolityczne, neurotoksyny, histamibna, saponina.
Jady działają tylko pozajelitowo
Żądło pszczoły miodnej po użądleniu wraz ze zbiorniczkiem jadowym pozostaje w miejscu użądlenia, a pszczoła ginie
Żądło osy nie jest uzbrojone w groty, więc nie trzeba go usuwać ze skóry. Po użądleniu osa wyciąga je, toteż może żądlić wiele razy
Owady - objawy użądlenia
W następstwie użądlenia najpierw występuje bolesny odczyn miejscowy: zaczerwienienie, obrzęk, bolesność
Czasem obserwujemy objawy ogólne: dreszcze, podwyższona temperatura ciała, bóle i zawroty głowy, nudności, wymioty, pokrzywka, obrzęk powiek, obrzęk błon śluzowych nosa, obrzęk nosa, stan astmatyczny, przyspieszenie tętna, bicie serca, duszność, zapaść, obrzęk płuc-porażenie oddechu.
Zwykle objawy ustępują po 4-5 godzinach, choć niekiedy uczucie znużenia i bóle głowy mogą utrzymywać się przez kilka dni
Niebezpieczne jest użądlenie w nasadę języka, gardło, krtań- obrzmienie błony śluzowej krtani może doprowadzić do uduszenia (lodowate napoje, ssanie lodu).
Użądlenie przez owady: pierwsza pomoc
Zwilżenie miejsca użądlenia amoniakiem, sodą, nadmanganianem potasu (utlenienie trucizny)
Usunięcie żądła
Okłady ochładzające
Pajęczaki - Kleszcz pastwiskowy (Ixodes ricinus)
Nie wytwarza jadu, może przenosić dwie poważne choroby
wywołane przez arbowirusy wiosenno-letnie zapalenie mózgu
chorobę wywołaną przez krętki duru powrotnego
Obie choroby mogą mieć przebieg ostry (śmiertelny) lub przewlekły: ból głowy, porażenia, nastroje depresyjne
Wiosenno-letnie zapalenie mózgu
Okres inkubacji (3 - 14 dni)
Objawy grypo-podobne: gorączka, ból głowy, brzucha, kończyn ustępują w ciągu 4-6 dni
U 8-10% osób - II faza: wysoka gorączka, silne bóle głowy, wymioty i objawy porażenia
Ustępowanie choroby, rzadko zejścia śmiertelne
Choroba wywołana przez krętki duru powrotnego
Silny ból w okolicy ukłucia, zaczerwienienie skóry
Objawy wypadania czynności ze strony obwodowego układu nerwowego
Przewlekło limfocytowe zapalenie opon mózgowo-rdzeniowych,
Zapalenie stawów
Żmija zygzakowata (Vipera berus): jad
Jady wężów zawierają substancje o charakterze enzymów o bardzo dużej toksyczności i różnorodnym działaniu na organizmy zwierzęce: hemoraginy (wywołujące zespół krwotoczny), fosfolipazy, koaguliny, substancje hamujące krzepnięcie krwi
Działanie
Hemolityczne i histolityczne
Zaburzenia krzepliwości krwi
Uszkodzenia naczyń krwionośnych
Jad żmij u nas żyjących działa przede wszystkim na układ krążenia, wywołując objawy podobne do wstrząsu anafilaktycznego.
Działa również bezpośrednio na mięsień sercowy, uszkadzając go, oraz na układ krzepnięcia, powodując skazę krwotoczną.
Żmija zygzakowata: objawy zatrucia
Ukąszenie jest bolesne, miejsca nakłucia przez zęby jadowe oddalone od siebie ok. 1 cm
W miejscu ukąszenia i odśrodkowo od niego występuje bardzo szybko bolesny obrzęk, wybroczyny, zapalenie naczyń i węzłów chłonnych
Po kilkunastu minutach do godziny pojawiają się zawroty i ból głowy, nudności i wymioty, krwawienie z błon śluzowych, przyspieszenie tętna, obniżenie ciśnienia, niemiarowość, wstrząs
Szczególnie niebezpieczne są ukąszenia w twarz, szyję i kark, zwłaszcza u dzieci
Żmija zygzakowata: pierwsza pomoc
Opaska uciskowa między miejscem ukąszenia a sercem tak aby nastąpiło zatrzymanie przepływu krwi w żyłach (ucisk żylny, tzn. tętno obwodowe od opaski powinno być wyczuwalne) na nie dłużej niż 1 godzinę, zwalniając ucisk co 20 min na 1 minutę
Okłady z lodu
Unieruchomienie kończyny
Okład z wody utlenionej
Podawanie kawy i herbaty, które podtrzymują czynność układu oddechowego
GAZY DUSZĄCE
Gazy duszące fizycznie
Gazy duszące fizycznie zastępują miejsce tlenu w mieszance oddechowej, co skutkuje zmniejszonym dowozem tlenu do płuc. Mniejsza ilość tlenu dostarczana jest do tkanek, co prowadzi do zwiększonego metabolizmu beztlenowego. Organy szczególnie wrażliwe na niedotlenienie (OUN i serce) pierwsze manifestują niedobór tlenu.
Należy pamiętać, że szereg z tych związków posiada bardzo niebezpieczne właściwości (np. łatwopalność propanu czy butanu - w połączeniu z tlenem mogą tworzyć mieszanki wybuchowe).
Toksykodynamika
Nie wywierają bezpośredniego działania toksycznego na błony śluzowe układu oddechowego. Zastępując tlen w mieszance oddechowej powodują, że jego stężenie jest mniejsze niż w atmosferze (<21%). Jest to powodem mniejszego ciśnienia parcjalnego tlenu w pęcherzykach płucnych konsekwencją czego jest gorsze utlenowanie hemoglobiny w płucach. Prowadzi to do hipoksemii.
Gazy duszące chemicznie
Związki duszące chemicznie
1.Tlenek węgla (CO)
2.Związki methemoglobinotwórcze
anilina, nitrobenzen, nitrogliceryna, azotyn amylu, azotyn sodu
3.Cyjanki i związki cyjanowe
a. Cyjanki - cyjanowodór (HCN)
- cyjanek potasu (KCN)
- cyjanek sodu (NaCN)
b. Związki cyjanowe - acetonitryl (CH3CN)
- akrylonitryl (CH2CHCN)
- cyjanogen (CNHN)
- cyjanogen chlorkowy (CNCl)
4.Siarkowodór (H2S) i siarczki - s
iarczek potasowy(K2S)
- siarczek sodowy (Na2S)
5. Kwas azotowodorowy (HN3) i azydki -
azydek sodowy (NaN3)
- azydek ołowiowy (Pb(N3)2)
Tlenek węgla - CO
Wszechobecny gaz zanieczyszczający środowisko, będący produktem niezupełnego spalania związków węgla; pozbawiony barwy, zapachu; miesza się z powietrzem we wszystkich proporcjach.
mieszając się z powietrzem tworzy mieszaniny wybuchowe
łatwopalny (pali się niebieskim płomieniem)
lżejszy od powietrza
słabo rozpuszczalny w wodzie, dobrze rozpuszczalny w alkoholu
Ostre zatrucie CO można uznać za model zatrucia substancją, która
nie ulega przemianom w ustroju i wywiera działanie na wszystkie narządy, a w pierwszym rzędzie na OUN i serce.
Występowanie
źródła egzogenne
spaliny samochodowe (garaż)
gazy przemysłowe - wielkopiecowy (9-25 %), wodny (40%), wybuchowy (40-60%),
świetlny (11 %)
koksownie, gazownie, odlewnie, rafinerie, górnictwo, kotłownie
dym tytoniowy (3-6%)
w gospodarstwie domowym - piecyki gazowe, piece - opalanie węglem drzewnym
drewnem, wysuszonym kałem pochodzenia zwierzęcego
pożary
chlorek metylenu
źródła endogenne
metaboliczna degradacja hemoglobiny (u zdrowych ludzi ok. 0.5%)
Prawidłowe poziomy HbCO
endogenna produkcja 0.4-0.7%
kobieta ciężarna 0.4-2.6%
noworodek 0.5-4.7%
dorosły 1-5%
anemia hemolityczna do 6%
palacz tytoniu /1 paczka dz./ 3-7%
1% CO jest utleniane endogennie do CO2
Poziomy gazu w powietrzu oddechowym a jego toksyczność:
NDS = 30 mg/ m3
NDSCh = 180 mg/ m3
Stężenie toksyczne w powietrzu :
1% - możliwy natychmiastowy zgon
0,5% - natychmiastowa utrata przytomności
Metabolizm
wchłaniany w drogach oddechowych
<1% utleniane endogennie do dwutlenku węgla
wydalany w 99% w postaci niezmienionej przez płuca
czas połowiczego rozpadu COHb we krwi
przy oddychaniu powietrzem atmosferycznym: śr. 4- 5 h.
przy oddychaniu 100% przez maskę: 80 min (u zaintubowanych 60 min)
przy oddychaniu w warunkach hiperbarii (2-3 ATA): śr. 23 min
Toksykodynamika
CO przenika przez błonę pęcherzykowo-włośniczkową w płucach - 85% wiąże się z żelazem grup hemowych hemoglobiny - powstaje HbCO. CO wykazuje 230 - 270 razy większe powinowactwo do Hb niż tlen wypierając tlen z Hb prowadzi do względnej anemii.
Hipoksja - wzrost wentylacji minutowej - zwiększenie pobierania CO w miejscu narażenia - ↑poziomu HbCO
15% CO wiąże się z takimi białkami jak : mioglobina, hemoproteiny cytochromu P-450, cyklaza guanylowa, syntetaza tlenku azotu, hydroperoksydaza, oksydaza cytochromowa
Generowanie wolnych rodników → peroksydacja lipidów
Uwalnianie neurotransmiterów
HEMOGLOBINA
Klasyczna teoria Haldane'a z 1895r. (hipoksja transportowa)
1. Wykazujący ok. 240 krotnie większe powinowactwo do Hb tlenek węgla zajmuje miejsca wiązania tlenu → hipoksja tkankowa.
2. Wiązanie tlenku węgla przez 1 z 4 miejsc w cząsteczce Hb prowadzi do zmian konformacyjnych, co wyraża się mocniejszym wiązaniem cząsteczek tlenu w 3 pozostałych miejscach.
krew normalnie zawiera 20vol% tlenu
średnia ekstrakcja tlenu wynosi 5vol% (w spoczynku)
(ekstrakcja tlenu w mózgu 6vol %, a w sercu 11vol %)
MITOCHONDRIA
Tlenek węgla wykazuje powinowactwo do oksydazy cytochromowej
W warunkach upośledzenia przepływu i lokalnej hipoksji CO skutecznie współzawodniczy o przyłączenie się do oksydazy cytochromowej.
CO wolniej dysocjuje od tego enzymu w porównaniu z cząsteczką tlenu
Upośledza transport elektronów w łańcuchu oddechowym prowadząc do powstawania wolnych rodników.
Inny mechanizm związany jest z uwalnianiem przez płytki krwi NO, który w kontakcie z wolnymi rodnikami jest przekształcany do nadtlenku azotu, a ten wykazuje znacznie większe powinowactwo do oksydazy cytochromowej niż CO oraz inaktywuje szereg enzymów mitochondrialnych.
MIOGLOBINA
Stanowi krótkoterminowy rezerwuar tlenu dla mięśni.
Tlenek węgla wykazuje 20-krotnie większe powinowactwo do mioglobiny niż tlen.
W obecności CO krzywa dysocjacji oksymioglobiny zostaje przesunięta w lewo.
WOLNE RODNIKI
Morfologiczne zmiany w obrębie mózgu w zatruciu CO są analogiczne do opisywanych w poanoksycznej encefalopatii.
Uszkodzenie mózgu jest związane z tworzeniem się wolnych rodników, których toksyczny efekt podtrzymywany jest przez wtórnie do nich powstające nadtlenki lipidowe.
Za tworzenie wolnych rodników i peroksydację lipidów odpowiedzialna jest oksydaza ksantynowa i prawdopodobnie błonowa oksydaza leukocytów.
HbCO |
brak objawów lub pobudzenie psychoruchowe, zaburzenia myślenia logicznego |
10 - 20% |
uczucie ucisku w okolicy czołowej, bóle głowy, zaczerwienienie skóry, duszność wysiłkowa |
20 - 30% |
ból głowy, uczucie zmęczenia, zawroty głowy, nudności |
30 - 40% |
osłabienie, silne bóle i zawroty głowy, zaburzenia orientacji, nudności, wymioty, spadek CTK |
40 - 70% |
znaczne nasilenie wymienionych objawów, wzrost tętna, zaburzenia rytmu serca, przyśpieszenie oddechu, sinica, lęk, zaburzenia świadomości, śpiączka, drgawki, zwolnienie akcji serca i oddechu, możliwa śmierć |
70 - 80% |
tętno napięte, spowolnienie oddechu, śmierć w ciągu kilku godzin |
80 - 90% |
zgon do godziny |
>90% |
zgon w ciągu paru minut |
Stopień nasilenia zmian chorobowych zależy od :
1. stężenia CO w powietrzu oddechowym
2. czasu narażenia
3. współwystępowania innych toksycznych gazów
4. indywidualnej wrażliwości - ogólnego stanu zdrowia (choroby serca, choroby układu oddechowego), tempa przemian metabolicznych.
5. wieku - płód, dzieci, ludzie starsi
Objawy kliniczne :
podmiotowe - bóle głowy, ogólne osłabienie, zmęczenie, nudności, wymioty, zaburzenia równowagi, wzroku, słuchu, drętwienia kończyn, kołatanie serca, bóle w klatce piersiowej, uczucie niepokoju, apatia, trudności z koncentracją uwagi, porywczość, nie trzymanie kału lub stolca.
przedmiotowe -
układ sercowo - naczyniowy
wystąpienie lub nasilenie dusznicy bolesnej i/lub zawału mózgu
zaburzenia rytmu: częstoskurcz zatokowy, migotanie i trzepotanie przedsionków, dodatkowe skurcze komorowe, migotanie komór.
EKG - zmniejszenie wysokości załamka R, zmiany w zakresie odcinka ST (uniesienie lub obniżenie), odwrócenie załamka T, bloki A-V, bloki odnogi pęczka Hisa,
znaczny spadek ciśnienia tętniczego krwi
Osoby z chorobą mięśnia sercowego są szczególnie wrażliwe na kardiotoksyczne działanie tlenku węgla.
układ nerwowy i stan psychiczny
zmiany zapalne mikrogleju do martwicy mieliny - uszkodzenia dotyczą wyłącznie substancji białej głównie w zakresie płatów czołowych i ciemieniowych oraz jąder podkorowych
zastój w krążeniu żylnym (wzrost ciśnienia płynu mózgowo - rdzeniowego) - obrzęk mózgu
częściowym lub całkowitym zniesieniem odruchów ścięgnistych, rogówkowych, źrenicznych, połykowych, rozlanym obniżeniem napięcia mięśniowego.
inne : zaburzenia pamięci („amnestic confabulatory state”), zmiany osobowości, euforia, zaburzenia zdolności osądu, abstrakcyjnego myślenia, słaba koncentracja, agnozja wzrokowa, dyspraksja, afazja, dysgrafia, porażenie połowicze, sztywność pozapiramidowa, akinezja, ślepota korowa, pląsawica.
Skala Pacha
ocena stanu chorego na podstawie zespołu objawów neurologicznych
I stan dobry - bez zaburzeń świadomości i bez innych objawów neurologicznych lub z równocześnie występującymi : drżeniami mięśniowymi , drgawkami tonicznymi, drgawkami klonicznymi
II stan średni - przymroczenie i ewentualnie równocześnie: nadmiernie wzmożone odruchy głębokie, odruch Babińskiego (obustronny), drgawki kloniczne lub toniczne, wzmożone napięcie mięśniowe.
III stan ciężki - całkowita utrata przytomności
IV stan bardzo ciężki - całkowita utrata przytomności oraz równocześnie: nadmiernie wzmożone odruchy ścięgniste, napięcie mięśniowe, odruch Babińskiego, drgawki toniczne, kloniczne,
układ oddechowy
przepuszczalności kapilar płucnych + otwarcie anastomoz tętniczo- żylnych - niekardiogenny obrzęk płuc; (ew. uszkodzenie mięśnia sercowego - ostra niewydolność lewokomorowa - kardiogenny obrzęk płuc)
poza tym: stany zapalne krtani, oskrzeli, płuc, zespół Mendelsona.
wątroba
toksyczne uszkodzenie wątroby *podwyższenie poziomu AspAT, ALAT, bilirubiny, objawy skazy krwotocznej
upośledzenie czynności metabolicznej hepatocytów → obniżenie aktywności AChE, poziomu protrombiny.
mięśnie i nerki
martwica mięśni - mioglobinuria - ostra przednerkowa niewydolność nerek → wysoka aktywność CPK, AspAT, LDH
narząd słuchu i równowagi
niedosłyszenie, szum w uszach, oczopląs,
narząd wzroku
zmniejszenie ostrości wzroku, obniżenie wzrokowego progu percepcji światła, stała lub czasowa ślepota, ubytki w polu widzenia, krwotoki do siatkówki.
skóra
rumień, pęcherzyki, pęcherze, głęboka martwica,
działanie spermatotoksyczne
spontaniczna
hipertermia
Punktowa skala stopnia ciężkości zatrucia tlenkiem węgla
Parametry
|
Skala punktowa
|
|||
|
0 |
1 |
2 |
3 |
Wiek (lata) |
do 29 |
30-39 |
40-49 |
powyżej 50 |
Czas narażenia w minutach |
do 30
|
31-60 |
61-120 |
powyżej 120 |
Skala wg Pacha |
I*
|
II* |
III* |
IV* |
COHb % |
ujemny
|
do 15 |
15-30 |
powyżej 30 |
Poziom mleczanu (mmol/l) |
1,0-1,78
|
1,8-3,6 |
3,7-5,4 |
powyżej 5,5 |
Stopnie ciężkości zatrucia:
I*- zatrucie lekkie- 1-4 punkty
II*- zatrucie średnie- 5-8 punktów
III*- zatrucie ciężkie- powyżej 9 punktów
Rozpoznanie :
Udokumentowane narażenie
Objawy fizykalne
Oznaczenie poziomu HbCO, mleczanów
Badanie gazometryczne krwi (kwasica, pO2 w normie)
Oznaczenie poziomu glukozy - (hiperglikemia)
Oznaczenie poziomu leukocytów - (leukocytoza *)
Oznaczenie poziomu: AspAT, ALAT, bilirubiny, czynników krzepnięcia, AchE, LDH, CPK, CK-MB, elektrolitów, Ht (-)
Dalsza diagnostyka :
mózg - EEG, KT, NMR
wątroba - scyntygrafia
serce - EKG, echo, scyntygrafia, badanie holterowskie, próba wysiłkowa (nie w ostrej fazie choroby)
płuca - rtg
Leczenie - Pomoc przedlekarska
wynieść chorego ze skażonego środowiska
zapewnić drożność dróg oddechowych, ułożyć chorego w pozycji bezpiecznej.
zapewnić dopływ świeżego powietrza
skierować do szpitala
Leczenie - Pomoc lekarska
1. tlenoterapia - przez szczelną maskę - 100% tlenem, aż do spadku poziomu COHb poniżej wartości 7%, następnie podawać mieszankę tlenu 50% przez ok. 6 godzin, następnie z przerwami mieszankę tlenu 30% przez 24 godziny.
2. komora hiperbaryczna (HBO)
stężenie tlenu fizycznie rozpuszczonego w surowicy zależy od
stężenia tlenu w mieszance oddechowej i ciśnienia atmosferycznego:
przy oddychaniu 21%tlenem, 1ATA -----------------------0.3vol%
przy oddychaniu 100%tlenem, 1ATA -----------------------2vol%
przy oddychaniu tlenem pod ciśnieniem 2.5ATA ------ 5.6vol%
3. leczenie objawowe
· kwasica metaboliczna - 8.4% Natrium bicarbonicum
· obrzęk mózgu - badanie neurologiczne z badaniem dna oka, 20%Mannitol, sterydy
zmiatacze wolnych rodników - vit.C i E
Allopurinol - blokuje oksydazę ksantynową, która utlenia hipoksantyny do ksantyny, a następnie ksantyny do kwasu moczowego.
· obrzęk płuc - rozważyć intubację + PEEP
· monitorowanie pracy serca- wykonanie EKG i oznaczenie enzymów: CPK, LDH, AspAT, AlAT
· Rozważenie ewentualnych innych przyczyn u pacjentów u których nie stwierdza się dobrej odpowiedzi na zastosowane leczenie (zatrucie cyjankami, substancjami methemoglobinotwórczymi, encefalopatii, współistniejącego urazu)
· unikanie wysiłku fizycznego i spoczynkowy tryb życia przez okres 2- 4 tygodni.
Hospitalizacja
Należy rozważyć nasilenie objawów, poziom stężenia HbCO, oraz indywidualną wrażliwość na zatrucie!
1. pacjenci z objawami klinicznymi zatrucia ze stężeniem HbCO >25%
2. pacjenci cierpiący na chorobę mięśnia sercowego ze stężeniem
HbC>15%
3. kobiety ciężarne ze stężeniem HbCO > 10%
4. pacjenci którzy w wywiadzie utracili przytomność, bólami w klatce piersiowej, u których stwierdza się nieprawidłowości w badaniu neurologiczno- psychiatrycznym
5. pacjentów u których stwierdza się obniżoną temperaturę ciała, kwasica metaboliczną hipoksję, nieprawidłowości w zapisie EKG lub w zdjęciu RT klatki piersiowej, z mioglobinurią
Zatrucie przewlekłe
Objawy:
ból głowy, ból brzucha,
osłabienie, męczliwość,
zaburzenia koncentracji, obniżenie funkcji poznawczych,
zaburzenia widzenia
w fazie ostrej mogą wystąpić dolegliwości stenokardialne oraz chromanie przestankowe,
podwyższenie się temperatury ciała,
wzrost wartości ciśnienia tętniczego krwi,
w badaniu dna oka - obrzęk tarczy nerwu wzrokowego i wybroczyny w siatkówce,
badania laboratoryjne mogą wskazywać na zwiększenie się liczby erytrocytów i leukocytów; może wystąpić białkomocz i cukromocz
HCN
KCN CYJANKI
Cyjanowodór i jego pochodne są używane w wielu procesach przemysłowych, w produkcji włókien syntetycznych i mas plastycznych, w galwanizacji, metalurgii, w pozyskiwaniu złota i srebra z rud metali, w procesach fotograficznych, w labolatoriach.
Szereg związków może uwalniać cyjanki spontanicznie, po podgrzaniu (np.cyjanogen - osoby narażone na dym w pożarach zamkniętych pomieszczeń, przy spalaniu tworzyw sztucznych i włókien poliakrylowych), w trakcie metabolizmu (nitroprusydek sodu), na skutek reakcji zachodzących w przewodzie pokarmowym po spożyciu cyjanogennych glikozydów (np. amygdalinę zawartą w nasionach jabłek, migdałów, pestkach śliw, wiśni, moreli, która jest metabolizowana do cyjanowodoru).
Drogi narażenia: inhalacyjna, doustna, przez nieuszkodzoną skórę.
TOKSYKODYNAMIKA
Wywołują hipoksję histotoksyczną.
Niekompetycyjnie blokują oksydazę cytochromową.
Cyjanki wiążą się z enzymami zawierającymi żelazo lub miedź, ale połączenie z Fe+3 oksydazy cytochromowej w mitochondriach ma znaczenie fundamentalne.
Przerywają transport elektronów w łańcuchu oddechowym.
Upośledzają utylizację tlenu przez komórki (zahamowanie fosforylacji oksydatywnej w komórce).
Zahamowanie syntezy ATP - ↑ metabolizmu anaerobowego, który nie jest wystarczający by pokryć zapotrzebowanie energetyczne komórek.
↑ produkcji mleczanów = kwasica metaboliczna ze zwiększoną luką anionową.
PATOFIZJOLOGIA
W pierwszej kolejności dochodzi do uszkodzenia tkanek, których metabolizm jest wybitnie tlenowy - pozyskują energię z fosforylacji oksydatywnej (serce i układ nerwowy).
Wiązanie cyjanków z oksygenazą cytochromową jest procesem odwracalnym - w ustroju występuje enzym rodanaza, który katalizuje wiązanie cyjanków z siarką tworząc o wiele mniej toksyczny jon tiocyjanianowy.
PRZEBIEG ZATRUCIA
Szybko występujące zaburzenia które zagrażąją życiu - śpiączka, drgawki, wstrząs, niewydolność oddechowa; (szybciej występują po inhalacji, niż spożyciu doustnym).
Utrata przytomności po kilku oddechach w skażonym miejscu
Po doustnym spożyciu ilości zagrażających życiu, groźne objawy występują po 30-60min.
Objawy po 1-12h od narażenia występują przy narażeniach na cyjanogeny (np. cyjanek alkilowy, amygdalina).
Wczesne objawy zatrucia: niepokój, ból i zawroty głowy, przyspieszenie akcji serca i oddechu, łagodne nadciśnienie
Późne objawy zatrucia: nudności i wymioty, tachykardia lub bradykardia, niedociśnienie, drgawki uogólnione, śpiączka, szerokie źrenice, zatrzymanie oddechu, nadkomorowe i komorowe zaburzenia rytmu serca, bloki AV, niedotlenienie mięśnia sercowego (EKG), zatrzymanie krążenia, niekardiogenny obrzęk płuc (może wystąpić nawet po narażeniu doustnym).
Zapach gorzkich migdałów - cecha uwarunkowana genetycznie (!).
Sinica początkowo nie występuje - jest objawem późnym.
Znacznego stopnia zwolnienie akcji oddechowej przy jednoczesnym braku sinicy nasuwa podejrzenie zatrucia cyjankami.
Oznaczenie stężenia cyjanków w pełnej krwi wymaga czasu, jest więc mało przydatne w zatruciach cyjankami.
Pomocne badania labolatoryjne:
RKZ (↑ pO2 krwi żylnej >40mmHg, saturacja krwi żylnej >70%)
Mniejsza niż normalnie różnica pomiędzy saturacją krwi tętniczej, a saturacją krwi z żył centralnych (norma ~ 70%).Saturacja krwi tętniczej <90% nie wyklucza zatrucia cyjankami!
stężenie mleczanów
luka anionowa * = c(Na+) - *c(Cl-) + c (HCO3-)* norma = 12-16mmol/l
LECZENIE
Pacjenci demonstrujący niepokój, zmęczenie bądź przyspieszenie oddechu wymagają tlenoterapii i bacznej obserwacji.
U chorych u których rozwiną się bardziej poważne objawy wymagają leczenia z użyciem odtrutek specyficznych.
Pomoc przedszpitalna obejmuje:
dekontaminację skażonej skóry i oczu
prowadzenie tlenoterapii 100% tlenem (jeśli konieczne po intubacji)
Uwaga! Unikać sztucznej wentylacji chorego metodą usta-usta!
założenie centralnego wkłucia
leczenie wstrząsu, wyrównywanie kwasicy ( Natrium bicarbonicum!)
leczenie zaburzeń rytmu serca i drgawek (typowo)
Podać azotyn amylowy inhalacyjnie (30 s inhalacji na każdą minutę; co 3-4 min używać nowej ampułki azotynu).
Płukanie żołądka efektywne do godziny od spożycia.
Niektórzy autorzy zalecają podanie węgla aktywowanego w dawce 1g/kg m.c. - brak potwierdzenia skuteczności takiego postępowania.
Korzystne działanie telnoterapii 100% O2
fizycznie rozpuszczony tlen we krwi może być wystarczający do nieenzymatycznej konwersji zredukowanego cytochromu do utlenionego; nie wykluczone, że wypiera związek cyjanowy z oksydazy cytochromowej; korzystny przy współistniejącej MetHb.
Leczenie tlenem w komorze hiperbarycznej (HBO) zaleca się w przypadku braku efektu przy tlenoterapii pod normalnym ciśnieniem oraz w wypadku osób zatrutych tlenkiem węgla, które podejrzane są o jednoczesne zatrucie cyjankami.
ODTRUTKI SPECYFICZNE
MetHb wykazuje większe powinowactwo do związków cyjanowych niż oksydaza cytochromowa.
MetHb wiąże wolne związki cyjanowe, jak również powoduje dysocjację kompleksu: związek cyjanowy-oksydaza cytochromowa.
MetHb wiąże się ze związkiem cyjanowym tworząc cyjanoMetHb
CyjanoMetHb wchodzi w reakcję z tiosiarczanem - powstaje mało toksyczny tiocyjanian, który jest wydalany przez nerki.
Dawka podawanego azotynu amylu: 0.03 - 0.05g
Azotyn sodu podaje się dożylnie: 0.02g iv.
konieczna kontrola CTK i poziomu MetHb!
MetHb nie powinna przekraczać 40%!!
Po podaniu azotynu podaje się tiosiarczan sodu (10-25%) iv.: 2.5ml/min w ilości 15g jednorazowo.
Kelocyanor (dwukobaltowy wersenian sodowy): 300-600mg iv.
tworzy trwały kompleks z jonem cyjanowym
4-Dimethyloaminophenol (4-DMAP): 3-4mg/kg m.c.w ciągu 30s, następnie tiosiarczan sodowy: 50-100mg/kg m.c. Iv.
H2S SIARCZKI
Siarkowodór jest gazem drażniącym, bezbarwnym, wybuchowym, cięższym od powietrza, rozpuszczalnym w wodzie.
W małych stężeniach ma zapach zgniłych jaj (po krótkim okresie przebywania w skażonej atmosferze porażenie nici węchowych).
Powstaje w wyniku gnicia materii organicznej
Źródła: wulkany, źródła lecznicze, kopalnie węgla i siarki, oczyszczalnie ścieków, szamba, w wykopach, w rowach odwadniających, w przemyśle hutniczym (wielkie piece), w rafineriach ropy naftowej, koksowniach, zakładach gazowniczych, w przemyśle chemicznym (produkcja kwasu solnego i siarkowego, sody, farb, dwusiarczku węgla, jedwabiu wiskozowego, włókna celulozowego), w garbarniach, przy produkcji kleju.
Drogi narażenia: inhalacyjna, przez skórę.
Metabolizm: 1. utlenianie do siarczanów (wymaga tlenu) /wątroba/
2. metylacja /wątroba/
3. interakcja z jonami metali bądź białkami zawierającymi grupy sulfhydrylowe (glutation).
Wydalanie metabolitów następuje głównie przez nerki.
Patofizjologia
1. pojedyncza, subletalna dawka siarkowodoru pobudza kłębki tt.szyjnych, co prowadzi do krótkiego, dramatycznego wzrostu wentylacji.
2. Narażenie na śmiertelne stężenia prowadzi do porażenia ośrodka oddechowego (utrata przytomności w ciągu kilku sekund).
OBJAWY KLINICZNE
Przy niskich stężeniach pierwsze objawy wiążą się z działaniem drażniącym (zapalenie spojówek, dróg oddechowych).
Układ oddechowy: jw., obrzęk płuc, zapalenie płuc.
Układ krążenia: zaburzenia rytmu serca, niewydolność wieńcowa, zaburzenia przewodzenia (węzeł A-V, bloki pęczka Hisa).
Przewód pokarmowy: nudności, wymioty, zaparcia, brak łaknienia.
Układ nerwowy: zapalenie wielonerwowe, uszkodzenia pnia mózgu, parkinsonizm, zespół psychoorganiczny.
porażenie ośrodka oddechowego w pniu mózgu (bezpośrednia przyczyna śmierci) - pień mózgu zbudowany jest z większej ilości substancji białej, niż pozostałe części mózgowia; siarkowodór jest lipofilny - substancja biała bardziej narażona!
LECZENIE
Usunięcie ze skażonej atmosfery
Tlenoterapia nieskuteczna
Pojedyncze doniesienia o przewadze HBO
Odtrutki: azotyny - wytworzenie sulfmetHb (hipoteza)
MetHb Toksyczne methemoglobinemie
Czynniki wyzwalające:
1.Prowadzące do rozpadu krwinki
anilina i inne aminofenole
nitrobenzen
Naftalen
2. Prowadzące jedynie do wytworzenia MetHb
chlorany
Dapson i inne sulfony
Sulfonamidy
tlenek azotu
hydroksylamina
środki znieczulające miejscowo ( w tym lignokaina)
azotany i azotyny
Fenacetyna
nitraty
Drogi narażenia:
Przez skórę, drogą doustną, inhalacyjną.
Objawy kliniczne:
Ich pojawienie się może wystąpić kilka godzin po narażeniu, gdyż część substancji dopiero w ustroju podlega biotransformacji do związków methemoglobinotwórczych.
Sinica centralna, ból głowy, senność, osłabienie, zwroty głowy, zasłabnięcia, duszność, przyspieszenie oddechu, przyspieszenie akcji serca, niedociśnienie, wstrząs, zaburzenia rytmu serca, drgawki, depresja OUN.
Azotyny rozszerzają naczynia obwodowe prowadząc do hipotensji i odruchowej tachykardii.
szereg związków methemoglobinotwórczych wywołuje hemolizę!
Czynniki ryzyka
Anemia, choroba wieńcowa, COPD.
Dzieci < 3miesięcy oraz ludzie starsi.
Niedobór G-6-PD, niedobór NADH reduktazy MetHb.
Stężenie MetHb w większości przypadków dobrze koreluje ze stanem pacjenta.
15-20%: sinica centralna, czekoladowo-brązowa krew, chory bez dolegliwości.
20-45%: ból głowy, senność, zawroty głowy, osłabienie, zasłabnięcia, duszność.
45-55%: postępujące depresja OUN.
55-70%: śpiączka, drgawki, zaburzenia rytmu serca, wstrząs.
> 70%: wysoki odsetek zgonów w grupie nie leczonej
Leczenie
Dekontaminacja
Tlenoterapia 100% tlenem (do momentu gdy MetHb < 20%); ew. HBO.
Błękit metylenowy
Dawka wstępna: 1-2mg/kg m.c./dawkę = 0.1- 0.2ml/kg m.c. /dawkę dożylnie.
W razie potrzeby dawki powtarza się co 4 godziny.
Uwaga! Dawki większe od 15mg/kg m.c. wywołują hemolizę!
•W wypadku masywnej hemolizy wymienne przetaczanie krwi
Leczenie objawowe i podtrzymujące wg ogólnie przyjętych zasad.
AZYDKI
Azydki są solami kwasu azotowodorowego.
Kwas azotowodorowy i azydki są substancjami wybuchowymi.
Najbardziej rozpowszechniony jest azydek sodowy (NaN3), który jest używany m.in. w poduszkach powietrznych - azydek sodowy (350-600g) jest tu źródłem azotu (N2) i wodorotlenku sodu.
Azydki wykazują wysokie powinowactwo do Fe na +3 stopniu utlenienia - blokują oksydazę cytochromową w mitochondriach hamując metabolizm tlenowy.
Pary kwasu azotowodorowego mogą powodować podrażnienie spojówek, śluzówek dróg oddechowych, zapalenie oskrzeli, a nawet być przyczyną obrzęku płuc.
Drogi narażenia:
doustna, przez skórę, inhalacyjna, dożylna, podskórna i inne.
Objawy kliniczne
Ból głowy, nudności, wymioty, biegunka, nadmierne pragnienie, duszność, nadmierne pocenie się, niewyraźne widzenie.
zaburzenia świadomości, śpiączka, drgawki, szerokie źrenice, obrzęk płuc, hipo- lub hipertermia, bradykardia lub tachykardia, hipotensja, nadkomorowe i komorowe zaburzenia rytmu serca.
kwasica mleczanowa, leukocytoza.
Azydek sodu: bezbarwny, bezwonny, stosowany jako substancja wybuchowa , w przemyśle farmaceutycznym, w rolnictwie (herbicyd, fungicyd), w labolatoriach chemicznych do syntez organicznych.
Opisywano zgony po spożyciu 700-800mg 13-15mg/kg m.c.)
Leczenie
Dekontaminacja
Leczenie objawowe i podtrzymujące;
tlenoterapia 100% tlenem.
Odtrutka specyficzna nieznana.
PROBLEMY DIAGNOSTYCZNE I LECZNICZE W ZATRUCIU METALAMI
OŁÓW Pb
znany od czasów prehistorycznych
starożytni Rzymianie budowali ołowiane rurociągi, pili z ołowianych kielichów, przechowywali żywność w ołowianych naczyniach, bogate Rzymianki nosiły biżuterię z ołowiu
znaleziono monety ołowiane już sprzed 7000 lat
pierwiastek metaliczny wykazujący na świeżym przekroju niebiesko-białą barwę o pięknym połysku
jest bardzo miękki, kowalny i łatwo topliwy, po ogrzaniu staje się plastyczny, dzięki czemu można z niego wytwarzać blachę, mało ciągliwy
Występowanie w przyrodzie
W stanie wolnym ołów występuje w niewielkich ilościach, głównym jego źródłem jest galena minerał zawierający PbS
Inne minerały
anglezyt (PbSO4)
cerusyt (PbCO3)
piromofrit (Pb3(PO4)2, PbCl2)
sztolcyt (PbWO4)
krokoit (PbCrO4)
wulfenit (PbMoO4)
wanadynit [3Pb3(VO4)2]
lanarkit [PbO*PbSO4]
Zastosowanie ołowiu
Produkcja baterii i akumulatorów, produkcja wielu wyrobów chemicznych (farb, dodatków do paliw), amunicji, stopów do lutowania
Rury do kwasów: siarkowego, siarkawego, fosforowego oraz rury kanalizacyjne, wykłada się nim komory, wieże i wanny do produkcji kwasu siarkowego, celulozy i wapna bielącego
Ekrany ołowiane zabezpieczające przed promieniowaniem gamma i rentgenowskim są stosowane w lecznictwie i laboratoriach naukowych
Pojemniki do przechowywania i transportu nuklidów promieniotwórczych
Ponadto stosuje się go do wyrobu płyt akumulatorowych, pokrywania kabli elektrycznych, wytwarzania stopu używanego w drukarstwie, do wyrobu rdzeni pocisków karabinowych, szkła ołowiowego
Zastosowanie związków ołowiu
Glejta ołowiana PbO jest używana do wulkanizowania kauczuku
Minia Pb3O4 - w postaci farby olejnej jako środek zabezpieczający żelazo przed korozją
Azydek ołowiu Pb(N3)2 ma zastosowanie jako materiał inicjujący w spłonkach detonujących
Czteroetylek ołowiu Pb(C2H5)4 jest stosowany jako środek przeciwstukowy do benzyn
Występowanie ołowiu w środowisku
Obecny jest w powietrzu, wodzie, glebie, organizmach roślinnych i zwierzęcych
W powietrzu może być przenoszony na znaczne odległości, zdeponowany w glebie pozostaje przez lata i może migrować do wód
Od lat 20-tych naszego stulecia, największym źródłem emisji ołowiu do atmosfery (90%) było spalanie benzyn ołowiowych
Obecnie, wraz z ograniczaniem zawartości ołowiu w benzynach, ilość metalu uwalniana z tego źródła znacząco zmalała
Inne źródła emisji ołowiu do atmosfery to hutnictwo metali nieżelaznych, spalarnie odpadów komunalnych, zakłady produkcji akumulatorów i baterii
Głównymi źródłami ołowiu w wodzie są rury, w których zastosowano spawy ołowiowe oraz zanieczyszczenia pochodzące ze ścieków
Znaczącym źródłem ołowiu, w skali indywidualnej, jest palenie tytoniu
Zanieczyszczenie żywności jest następstwem pobrania ołowiu przez rośliny uprawne, hodowane w pobliżu ruchliwych tras samochodowych, składowisk odpadów czy obszarów intensywnej produkcji przemysłowej z zastosowaniem ołowiu
Źródła ołowiu w Polsce
komunikacja (w tym również szeroko rozumiane usługi komunikacyjne, m.in. stacje paliw, warsztaty naprawcze)
emisja przemysłowa (huty metali nieżelaznych, huty żelaza, stalownie, cementownie, itp.)
nieprawidłowa gospodarka odpadami, w tym szczególnie złomem akumulatorowym
zanieczyszczenie gleb i chemizacja rolnictwa
Czteroetylek ołowiu Pb(C2H5)4
Oleista ciecz o zapachu owocowym
Czteroetylek ołowiu jest stosowany jako środek przeciwstukowy do benzyn silnikowych
Do organizmu może dostać się przez drogi oddechowe, przewód pokarmowy oraz nieuszkodzoną skórę (ze względu na dużą lipofilność)
Zatrucia często mają ciężki przebieg
O zagrożeniu ołowiem należy myśleć szczególnie:
W rejonach o dużym natężeniu transportu kołowego
Gdy jest to rejon naturalnego występowania rud metali nieżelaznych
Gdy w okolicy stosuje się do ogrzewania zanieczyszczony, niskiej jakości węgiel
Gdy na danym obszarze zlokalizowane są zakłady przemysłowe, stanowiące źródło emisji ołowiu:
huty metali nieżelaznych, niektóre huty żelaza
zakłady przetwórstwa metali nieżelaznych,
zakłady produkujące baterie i akumulatory,
rafinerie
gdy w okolicy zlokalizowane jest składowisko odpadów przemysłowych
gdy tereny upraw zasilane mogą być osadami ściekowym o niekontrolowanej jakości
Źródła narażenia na ołów:
zawodowe: Hydraulicy, instalatorzy urządzeń wodnych,
Górnicy pracujący przy wydobywaniu ołowiu, Mechanicy samochodowi, Fabryki szkła, Budowniczy statków, Drukarze, Fabryki plastiku, Wytapiacze ołowiu i pracownicy rafinerii, Policjanci, Spawacze i hutnicy, Fabryki gumy i kauczuku, Fabryki baterii, Remonty mostów
Środowiskowe: Farby zawierające ołów, zanieczyszczona ołowiem ziemia w pobliżu zakładów przemysłu ołowiowego, domy w których użyto farb ołowiowych, wodociągi, wyroby ceramiczne, benzyna ołowiowa
Inne: garncarstwo, przebudowa domów, strzelectwo, lutowanie z użyciem ołowiu (elektronika), produkcja pocisków, produkcja witraży, malowanie, naprawa samochodów i łodzi
Substancje użytkowe: leki medycyny naturalnej, zdrowa żywność, kosmetyki, przemycana „whisky”, benzyna
Farby i lakiery zawierające ołów istotnym źródłem narażenia
Farby i lakiery stosowane przed rokiem 1950 zawierały wysokie (do 50%) stężenia węglanu i tlenku ołowiu.
Wprawdzie od roku 1950 dopuszczalne stężenie ołowiu w farbach zostało ograniczone (od roku 1977 zawierają nie więcej niż 0.06% tj. 600 ppm ołowiu w suchej masie), to jednak farby i lakiery przemysłowe do malowania samochodów, maszyn, mostów itp. nadal zawierają zwykle 10 - 20%, a czasami nawet 40% ołowiu.
Farby do stosowania zewnętrznego mogą być źródłem zanieczyszczenia gleby wokół budynków.
Bezpośrednie narażenie na ołów ma miejsce gdy farba się odłamuje bądź złuszcza, jest naruszona przy przemalowywaniu i czyszczeniu, położona na elementach ulegających przycieraniu podczas ich używania, jest na powierzchniach, po których się chodzi (podłoga), na przedmiotach i zabawkach, które mogą być brane do buzi przez dziecko
Ołów - inne źródła narażenia
Nadużycie leków: Zanieczyszczona ołowiem heroina lub amfetamina mogą powodować zatrucie ołowiem. Można je podejrzewać u pacjentów skarżących się na bóle brzucha, nudności, wymioty, bóle nóg i pleców, słabość, utratę wagi, anoreksję. Badania laboratoryjne: anemia lub obecność ziarnistości zasadochłonnych w krwinkach czerwonych
Rany postrzałowe: Rany takie u dzieci i dorosłych mogą prowadzić do anoreksji, bólów brzucha, wymiotów, anemii, encefalopatii i podwyższenia stężenia ołowiu we krwi
Ołów - drogi narażenia
Ołów jest pobierany głównie drogą inhalacyjną lub doustną wraz z pożywieniem i wodą
U osób dorosłych, a szczególnie u tych narażonych zawodowo, dominuje droga inhalacyjna, u dzieci zaś narażenie drogą doustną
Cząsteczki o wielkości od 0.5 - 1 µm łatwo docierają do pęcherzyków płucnych i niemal w całości ulegają absorpcji
Cząsteczki większe osadzają się w drogach oddechowych i po oczyszczeniu przez rzęski błon śluzowych mogą być połykane
Woda pitna
Ołów z wody pitnej lepiej się absorbuje niż z pożywienia
u dorosłych: 35 - 50%
u dzieci: ponad 50%
W wodzie gruntowej i powierzchniowej stężenie ołowiu jest zwykle niskie, ale może wzrastać na poziomie systemów nawadniających - ołowiane łącza, rury, połączenia w miedzianych instalacjach, fontanny i chłodziarki oraz kurki z mosiądzu i inny osprzęt
Wchłanianie/dystrybucja ołowiu
Wchłonięty do organizmu ołów przedostaje się do krwi obwodowej, gdzie w 99% wiązany jest przez błony komórkowe krwinek czerwonych, a następnie wraz ze strumieniem krwi przedostaje się do różnych tkanek i narządów.
95% ołowiu u osób dorosłych, a tylko 70% ołowiu u dzieci gromadzi się w kościach (stabilna pula).
Pozostała część odkładana jest w tkankach miękkich m. in. w wątrobie, nerkach, szpiku kostnym i mózgu które stanowią szybko-wymienną pulę ołowiu.
Ołów - dystrybucja
W przeciwieństwie do tkanek miękkich, w kościach ołów gromadzi się przez całe życie (całkowita ilość ołowiu, która gromadzi się w ciągu życia może wynosić od 200 do ponad 500 mg u ludzi narażonych zawodowo) począwszy już od okresu prenatalnego
Metal ten przechodzi bowiem przez barierę łożyskową osiągając u płodu 85 - 90% stężeń stwierdzanych we krwi matki
Eliminacja ołowiu
Czas połowicznej eliminacji z krwi i tkanek miękkich wynosi około 20 - 30 dni, a z kości średnio około 5 lat
Wydalanie ołowiu, który nie został zatrzymany w ustroju odbywa się głównie z moczem (65%) i z żółcią (35%)
Ilości wydalane wraz z potem, włosami i paznokciami są niewielkie
T1/2 w erytrocytach - 35 dni
T1/2 w kościach - do 20 lat
Toksyczność ołowiu
Ołów metaliczny i wszystkie jego związki są silnie trujące
Ołów jest trucizną wielonarządową
Jego powinowactwo do grup sulfhydrylowych sprawia, że może przyłączać się i upośledzać aktywność białek strukturalnych i enzymatycznych
Z uwagi na swoje podobieństwo chemiczne do wapnia, zakłóca liczne szlaki metaboliczne, szczególnie w mitochondriach i w systemie zawiadującym komórkową przemianą energetyczną działając jak inhibitor lub agonista procesów zależnych od jonów wapnia
Wykazuje działanie mutagenne i rakotwórcze u myszy i szczurów. Brak jest natomiast wystarczających dowodów działania rakotwórczego u ludzi
Objawy związane z toksycznością ołowiu
niska toksyczność |
średnia toksyczność |
silna toksyczność |
Poziom ołowiu we krwi: 35-50 *g/dl - dzieci 40-60 *g/dl - dorośli Bóle mięśniowe, parestezje Zmęczenie Podrażnienie Senność Okazjonalne zaburzenia pokarmowe |
Ból stawów Ogólne zmęczenie Trudności w koncentracji Zmęczenie mięśni Drżenia Ból głowy Ból brzucha Wymioty Utrata wagi Zaparcia |
Poziom ołowiu we krwi: 70 *g/dl lub więcej - dzieci 100 *g/dl lub więcej - dorośli Niedowłady lub porażenia Encefalopatia - może prowadzić do napadów padaczkowych, utraty przytomności, śpiączki i śmierci Rąbek ołowiczy (niebiesko-czarny) na dziąsłach
Kolka (ostre skurcze brzucha) |
Ostre zatrucie ołowiem
Zatrucie ostre występuje pod postacią ostrej encefalopatii, niezwykle rzadkiej u osób dorosłych, przy stężeniach ołowiu we krwi przekraczających 800 - 1000 µg/l lub ciężkiego toksycznego uszkodzenia wątroby
To ostatnie występuje szczególnie często przy samozatruciach związkami ołowiu drogą doustną i jest często błędnie rozpoznawane jako ostre wirusowe zapalenie wątroby
Częściej obserwuje się zespół ostrych objawów brzusznych (bóle brzucha o różnym stopniu nasilenia, przypominające ostrą niedrożność trudne do zdiagnozowania) zwanych kolką ołowiczą
Może ona wystąpić po krótkim narażeniu na wysokie dawki ołowiu lub jako ostra manifestacja zatrucia przewlekłego, szczególnie w narażeniu zawodowym
Jedną z cech charakterystycznych jest fakt, iż przy badaniu palpacyjnym jamy brzusznej dolegliwości bólowe ulegają znacznemu zmniejszeniu
Przewlekłe zatrucie ołowiem
Działanie toksyczne ołowiu, jako skutek przewlekłego narażenia obserwuje się przede wszystkim w układzie krwiotwórczym oraz w układzie nerwowym
Układami krytycznymi u osób dorosłych są układ krwiotwórczy i obwodowy układ nerwowy, u dzieci - OUN
Efektem przewlekłego zatrucia ołowiem jest anemia
Ołów jest jedną z nielicznych substancji toksycznych, dla których istnieje zależność dawka - efekt
Zależność ta odnoszona jest zwykle do wielkości dawki wyrażonej w formie stężenia ołowiu we krwi
Ołów - połknięcie ciała obcego
Przedmioty ołowiane pozostające w przewodzie pokarmowym przez dłuższy okres mogą prowadzić do toksycznej encefalopatii i śmierci
Leczenie powinno bazować na leczeniu objawowym, obserwacji w kierunku bólów brzucha, wymiotów lub gorączki
Należy wykonać badanie rtg jamy brzusznej, jeśli przedmiot nie opuści przewodu pokarmowego w ciągu kilku dni
W przypadku przesuwania się ciała obcego zawierającego ołów przez przewód pokarmowy wskazana jest 10-dniowa obserwacja
Jeśli obiekt nadal nie zostanie wydalony należy wykonać rtg jamy brzusznej i oznaczenie poziomu ołowiu we krwi; powtarzać badania co 4 dni
Jeśli obiekt nie przesuwa się, a poziom ołowiu wzrasta, lub gdy pacjent ma nasilające się bóle brzucha, albo takie komplikacje jak perforacja, krwawienia, obstrukcje, konieczna jest interwencja chirurgiczna
Nefropatia ołowicza
Objawy uszkodzenia nerek nasuwające podejrzenie śródmiąższowego zwłóknienia i zmian zanikowych cewek nerkowych bez dającej się wykazać innej przyczyny niż narażenie na ołów aktualne lub w przeszłości
Podstawę oceny zależności przyczynowo-skutkowej stanowią aktualne lub udokumentowane w przeszłości objawy wzmożonego wchłaniania i toksycznego działania ołowiu
RTĘĆ Hg
Rtęć: Symbol chemiczny Hg - pochodzi od greckiego słowa hydrargyrum (srebrna woda)
znana jest od czasów starożytnych
Już przed naszą erą eksploatowane były kopalnie rtęci w południowej Hiszpanii
Rzymianie używali jej do ługowania piasków rzecznych w celu uzyskania z nich srebra i złota
tlenek rtęci (HgO) był głównym składnikiem czerwonej farby stosowanej do malowania i szminkowania
Średniowiecze: w domach bogaczy i władców płynną rtęć metaliczną pod nazwą „żywego srebra” trzymano w charakterze zabawki, a ówcześni alchemicy łączyli rtęć z siarką wierząc, że w ten sposób otrzymają upragnione złoto
W XVI w. Paracelsus wprowadził związki rtęci do farmacji, a Lavoisier uznał rtęć za pierwiastek chemiczny
Choroba szalonych kapeluszników
Azotanu rtęci używano w procesie wytwarzania filcu, a uwalniane podczas podgrzewania pary rtęci były inhalowane w czasie wykańczania i formowania filcowych kapeluszy
W 1860 r. Freeman opisał drgawki wytwórców kapeluszy, nazywane czasami drżeniami Danbury, w odniesieniu do Dubury, Connecticut - centrum przemysłu kapeluszniczego
Powszechnie uznawano kapeluszników za szalonych z powodu ich dziwnego, zrywanego kroku, skrajnej cichości, zaburzeń mowy - stąd nazwa „choroba szalonych kapeluszników”
Uwaga o możliwości wywoływania choroby kapeluszników przez rtęć znalazła swoje miejsce w książce pt. „Przygody Alicji w krainie czarów” opublikowanej po raz pierwszy w 1865 roku
Ojciec medycyny przemysłowej Ramazzini w 1790 roku opisał utratę zębów, nadmierne ślinienie się i zaburzenia neurologiczne w wyniku zawodowego narażenia na rtęć.
Występowanie w środowisku
Rtęć występuje w środowisku w trzech postaciach:
metalicznej (cząsteczkowej)
w połączeniach organicznych
i nieorganicznych
Rtęć
O ciężkości i przebiegu zatrucia decyduje nie tylko czas narażenia, wielkość dawki, droga narażenia, wrażliwość osobnicza, ale także forma wchłoniętej rtęci
Ostre zatrucie występuje najczęściej w wyniku inhalacji par rtęci metalicznej i spożycia rtęci w postaci związków nieorganicznych, głównie w wyniku narażenia zawodowego
Narażenie na jej organiczne połączenia wiąże się na ogół z zatruciem przewlekłym i związane jest najczęściej ze spożywaniem skażonej żywności
Rtęć metaliczna (cząsteczkowa)
Płynny srebrny metal, łatwo parujący w temperaturze pokojowej
Źródłem narażenia w gospodarstwach domowych mogą być pęknięte termometry rtęciowe
Pogląd, że wypełnienia amalgamatowe stanowić mogą istotne źródło wchłaniania rtęci do organizmu wydaje się być dość kontrowersyjny
Spożyta drogą doustną nie jest toksyczna
Istotne znaczenie ma narażenie na jej pary drogą inhalacyjną
Pary rtęci metalicznej są też głównym źródłem narażenia zawodowego
Narażenie zawodowe: pary rtęci metalicznej
Pracownicy zatrudnieni przy wydobywaniu i oczyszczaniu (rafinacji) złota
Pracownicy tych zakładów, które stosują rtęć metaliczną w procesach przemysłowych: produkcja suchych ogniw oraz elektrolitycznej produkcji chloru, gdzie rtęć służy jako katoda
Rtęć metaliczną stosuje się także do produkcji i napraw termometrów, pomp próżniowych, transformatorów, lamp rtęciowych, barometrów i termostatów rtęciowych
Stomatolodzy stosujący amalgamat do wypełnień zębów
Pracownicy laboratoriów (metody polarograficzne)
Rtęć metaliczna: toksykokinetyka
Rtęć metaliczna w postaci par łatwo wchłania się przez błonę pęcherzyków płucnych do krwi, a następnie w krwinkach czerwonych utleniana jest do jonów Hg+2 i w takiej postaci jest częściowo wydalana z moczem i kałem
Proces ten przebiega niecałkowicie i pewna ilość rtęci elementarnej, pozostająca w osoczu krwi, przenika przez barierę krew/mózg oraz barierę łożyskową powodując odkładanie rtęci w mózgu, a także w tkankach płodu
Zdolność przekraczania bariery krew/płyn mózgowo-rdzeniowy i odkładania się w mózgu mają także jony rtęci utlenionej Hg+2
Kumulacja rtęci w mózgu określana mianem „pułapki mózgowej” sprawia, że ośrodkowy układ nerwowy jest układem krytycznym w przypadku narażenia na pary rtęci
Biologiczny okres półtrwania rtęci w mózgu wynosi kilka lat
Rtęć metaliczna: wydalanie
Połowiczny okres eliminacji rtęci (T1/2 ) we krwi wynosi od 2 - 4 dni
W ciągu pierwszego tygodnia wydala się około 19% ilości wchłoniętej, z czego:
50% wraz z kałem
37% w powietrzu wydechowym
13% z moczem
Przeciętny okres wydalania przez nerki wynosi 59 - 64 dni
Rtęć metaliczna: toksyczność
Stężenie 28 mg/m3 rtęci (osiągane w instalacjach pomiarowych, piecach próżniowych) może być niebezpieczne dla życia
Stężenie 300 mg/L rtęci w moczu świadczyć może o zatruciu rtęcią, 100 mg/L zwykle wymaga leczenia, natomiast stężenie 50 mg/L rtęci w moczu uważane jest za bezpieczne
Zaleca się dokładne monitorowanie zachowania i stanu neurologicznego osób narażonych na rtęć przy stężeniu rtęci w moczu wynoszącym 100 *g/dL i więcej
Zatrucie rtęcią metaliczną - objawy
Rtęć metaliczna nie wchłania się z przewodu pokarmowego i dlatego jej spożycie nie wywołuje objawów zatrucia
Istotne znaczenie ma narażenie drogą inhalacyjną
Narządem krytycznym w przypadku ostrego narażenia na pary rtęci metalicznej są płuca
U pacjentów narażonych na wysokie stężenia par rtęci może wystąpić okres bezobjawowy trwający od 1 do 4 godzin od narażenia
Rozwinięcie się pełnego obrazu klinicznego zatrucia rtęcią metaliczną: trzy etapy
Początkowe objawy obejmują gorączkę, dreszcze, przyspieszenie oddechu, metaliczny smak w ustach i ból głowy.
Z innych objawów występować może zapalenie jamy ustnej, nudności, wymioty, splątanie
Objawy te mogą ustąpić lub nasilać się aż do martwiczego zapalenia oskrzelików, śródmiąższowego zapalenia płuc i obrzęku płuc
Zespół ten u dzieci często kończy się zgonem
Faza przejściowa (objawy pojawiają się po 2 tygodniach od narażenia) - to okres rozwijania się poważnego uszkodzenia wielonarządowego obejmującego:
ośrodkowy układ nerwowy
układ oddechowy
przewód pokarmowy
układ wydalniczy
W ciężkich przypadkach dochodzi do obrzęku płuc pochodzenia sercowego z bezdechem, sinicą i rozległymi, obustronnymi naciekami w obrazie rtg klatki piersiowej.
Powikłania obejmują zapalenie śródpiersia, odmę i zgon
Toksyczność par rtęci metalicznej może stymulować rozwój śluzówkowo-skórnego zespołu węzłów chłonnych (choroba Kawasaki).
Rzadziej pojawiają się - ostra niewydolność nerek, zaburzenia ze strony komórek wątroby i drgawki.
W fazie późnej nasilają się objawy ze strony OUN prowadząc do odległych, prawdopodobnie nieodwracalnych zaburzeń neurologicznych
Iniekcje podskórne rtęci metalicznej
mają najczęściej charakter prób samobójczych
powodują powstawanie miejscowych ropni i zatory płucne
rzadziej wywołują objawy systemowe
Przewlekłe narażenie na pary rtęci metalicznej
Układ krytyczny: ośrodkowy układ nerwowy
Nerki są drugim narządem docelowym w przewlekłym narażeniu na rtęć: zapalenie nerek najczęściej w postaci błoniastego zapalenia kłębuszków nerkowych (MGN) lub ostrej martwicy cewkowej z następowym zespołem nerczycowym
Rtęć metaliczna jest łatwo rozpuszczalna w tłuszczach (lipofilna), co powoduje, że gromadzi się w komórkach mózgu
Toksyczne działanie związane jest z jej utlenianiem w mózgu do Hg2+ - postaci, która w związku z silnym powinowactwem do grup sulfhydrylowych powoduje inhibicję szeregu enzymów
Objawy przewlekłego zatrucia rtęcią metaliczną
drżenia
, bóle i drętwienie kończyn,
zaburzenia chodu tzw. zrywany krok
, zapalenie jamy ustnej,
ślinotok,
rozchwianie zębów,
błękitny rąbek na dziąsłach,
biegunka, utrata masy ciała,
zaburzenia ze strony OUN
, stany lękowe
, jąkanie się,
bóle głowy,
halucynacje,
otępienie
, depresja
Długotrwałe wchłanianie par rtęci, pyłów zawierających rtęć
lub wchłanianie rtęci bądź jej związków przez skórę powoduje rtęcicę
Nieorganiczne związki rtęci: źródła narażenia
leki stosowane w leczeniu kiły
produkcja acetaldehydu
pracownie chemiczne
kosmetyki
wybuchy wulkaniczne
produkcja tuszu
srebrzenie luster
fotografika
tusze do tatuaży
produkcja PCV
środki konserwujące drewno
Nieorganiczne związki rtęci: toksyczność
Rtęć nieorganiczna nie przekracza z taką łatwością bariery krew/mózg jak rtęć metaliczna, jednakże gromadzi się we wszystkich tkankach, głównie w wątrobie i nerkach
Nie tylko łączy się chciwie z grupami sulfhydrylowymi białek (receptorowych, enzymów wewnątrzkomórkowych) dezorganizując metabolizm komórkowy, ale tworzy w nich pulę utlenionej i nie utlenionej rtęci, co w efekcie prowadzi do śmierci komórki (trucizna plazmatyczna). Sole rtęci są toksyczne dla wszystkich komórek
Odkładają się w nerkachprowadząc do uszkodzenia kłębuszków i kanalików nerkowych. Badania anatomopatologiczne w przypadkach śmiertelnych wykazują ostre zwyrodnienie kanalików i kłębuszków nerkowych lub cechy krwotocznego kłębuszkowego zapalenia nerek
Sole rtęci nieorgan
icznej działają miejscowo żrąco (szczególnie w przewodzie pokarmowym mogą powodować nadżerki i zmiany martwicze)
Dawka toksyczna: sublimat (HgCl2): 1 - 4g
Dawka śmiertelna: sublimat (HgCl2) - 1.0 g
cyjanek rtęci (Hg(CN)2) - 0.2 do 1.0 g
Nieorganiczne związki rtęci: ostre zatrucie
Zasadniczymi objawami, które pojawiają się już po upływie 20-30 minut od spożycia są objawy wynikające ze żrącego działania soli rtęci na przewód pokarmowy: ostry nieżyt żołądkowo-jelitowy, zapalenie błony śluzowej jamy ustnej, wrzodziejąco-krwotoczne zapalenie jelita grubego
W wyniku działania nefrotoksycznego: bezmocz z następową mocznicą
Nieorganiczne związki rtęci są truciznami systemowymi
Przewód pokarmowy
metaliczny smak w ustach
pieczenie w jamie ustnej i gardle
w 2-3 dobie wrzodziejące zapalenie błony śluzowej jamy ustnej
wodnisto - śluzowa biegunka
nudności, wymioty
czarna obwódka na szyjkach zębowych i wargach tzw. „rąbek rtęciowy”
dysfunkcja komórek wątroby
Ośrodkowy Układ Nerwowy
bóle i zawroty głowy
wzmożenie pobudliwości
obniżenie nastroju
zaburzenia pamięci
utrata apetytu
bezsenność
zmniejszenie masy ciała
drżenie
Układ oddechowy
podrażnienie błony śluzowej
bóle w klatce piersiowej
kaszel
zapalenie oskrzeli
toksyczny obrzęk płuc
rozlane śródmiąższowe zapalenie płuc z wtórnym włóknieniem tkanki płucnej
Układ krążenia
możliwy spadek ciśnienia tętniczego krwi
Nerki
białkomocz
wielomocz przechodzący w skąpomocz
zespół nerczycowy
zgon z powodu ciężkiej mocznicy
Oczy
zapalenie spojówek
owrzodzenie rogówek
Nieorganiczne związki rtęci: zatrucie przewlekłe
uszkodzenie nerek
wzrost wydzielania śliny oraz zmiany zapalne dziąseł z czarną obwódką wokół zębów
skóra: różne wykwity, wysypki, owrzodzenia
obrzęki rąk i stóp
światłowstręt
bezsenność
utrata włosów
objawy zatrucia przewlekłego
metaliczny smak w ustach
nudności, wymioty
nadżerki w jamie ustnej i gardle
bóle w przełyku
dysfagia
bóle w nadbrzuszu
biegunka, niekiedy krwawa
objawy perforacji jelit
tachykardia
spadek ciśnienia tętniczego krwi
wstrząs oligowolemiczny
ostra niewydolność serca
proteinuria
oliguria
Organiczne związki rtęci
są szeroko stosowane w rolnictwie w charakterze fungicydów, herbicydów oraz w charakterze środków odkażających
Dostają się do organizmu wraz z żywnością i wodą, których zanieczyszczenie jest odzwierciedleniem skażenia środowiska przez pyły, gazy przemysłowe, ścieki, odpady a także procesy spalania węgla
Najważniejsze z toksykologicznego punktu widzenia są preparaty rtęciowe zawierające:
grupę alkilową: metylortęć (chlorek metylortęciowy)
etylortęć (chlorek etylortęciowy)
grupę arylową: fenylortęć
Obie grupy różnią się pod względem absorpcji, dystrybucji i eliminacji, co powoduje, że mają też różną toksyczność:
Alkilowe związki rtęci(metylortęć, etylortęć) są odporne na procesy biochemicznej degradacji w ustroju
Etylortęć wywołuje objawy zespołu żołądkowo - jelitowego
Związki arylowe (fenylortęć) po absorpcji ulegają przekształceniu do formy nieorganicznej i w związku z tym ich działanie toksyczne zbliżone jest do toksyczności nieorganicznych związków rtęci
Organiczne związki rtęci: metylortęć
Najbardziej rozpowszechniony w środowisku i najbardziej toksyczny
Ulega kumulacji w mięsie ryb i w akwenach o wysokim stopniu zanieczyszczenia może osiągnąć stężenie do 10 mg/kg
W Japonii w r 1950 przemysłowe zanieczyszczenie zatok oceanicznych i rzek spowodowało śmiertelne zatrucia ponad 1000 osób w wyniku spożywania mięsa ryb zawierającego metylortęć. Dzienna dawka metylortęci pobieranej z mięsem ryb wynosiła 5 mg
Stężenie metylortęci w mięsie ryb żyjących w Bałtyku: od 0,3 - 0,8 mg/kg; stężenie w mięśniach zwierząt lądowych: około 20 *g/kg
Śmiertelna dawka metylortęci: 10 - 60 mg/kg masy ciała
źródła narażenia
Organiczne związki rtęci:
antyseptyki
, środki bakteriobójcze
, środki balsamujące
, rolnictwo
fungicydy,
insektycydy
przemysł papierniczy,
zaprawy nasienne,
tusze do tatuaży,
produkcja PCV,
środki konserwujące drewno
Zatrucie organicznymi związkami rtęci
Objawy rozwijają się najczęściej po dość długim bo trwającym od 30 do 70 dni okresie utajenia i dotyczą skóry, układu pokarmowego (nudności, wymioty, biegunka, bóle brzucha)
Układem krytycznym jest OUN
Wczesnymi objawami są zaburzenia czucia z parestezją w kończynach (także język, okolica warg)
Następnie pojawia się niezborność ruchów, zaburzenia słuchu i zaburzenia widzenia, a także mogą pojawić się drgawki kloniczne
Anatomicznie stwierdza się zmiany patologiczne w mózgu w postaci degeneracji neuronów i atrofii kory mózgowej
zatrucie prenatalne
daleko posunięte zmiany ze strony ośrodkowego układu nerwowego o charakterze symetrycznego zaniku mózgu (także móżdżku)
Badaniem mikroskopowym stwierdza się wyraźne zmniejszenie ilości neuronów w części korowej
Tym zmianom anatomicznym odpowiadają zaburzenia motoryki o cechach niezborności (ataksja) oraz poważne schorzenia umysłowe
Leczenie: Zatrucie parami rtęci
natychmiastowe przerwanie narażenia
Monitorowanie czynności układu oddechowego - w razie konieczności wspomaganie oddechu
Należy natychmiast włączyć leczenie środkami chelatującymi i kontynuować ich podawanie do momentu ustąpienia objawów i spadku stężenia rtęci we krwi i moczu
Leczenie: Zatrucie organicznymi związkami rtęci
jeśli pacjent jest przytomny należy prowokować wymioty i wykonać płukanie żołądka celem usunięcia jak największej ilości rtęci
Podawanie węgla aktywnego, który adsorbuje duże ilości rtęci organicznej i nieorganicznej, wraz ze środkami przeczyszczającymi zapobiega dalszemu wchłanianiu
Wprawdzie, z uwagi na niskie stężenie rtęci w osoczu krwi i jej powolną redystrybucję z tkanek, forsowana diureza nie jest przydatna do eliminacji rtęci jako takiej, to jednak powinno się ją stosować przy podawaniu środków chelatujących, bowiem zarówno same środki chelatujące jak i ich kompleksy z rtęcią wydalane są z moczem
Z uwagi na właściwości nefrotoksyczne rtęci i samych środków chelatujacych, należy dokładnie kontrolować dobową ilość moczu
Odtrutki swoiste - środki chelatujące
BAL (dimerkaprol, 2,3-dimerkaptopropanol) pierwszy ze środków - zapobiega inaktywacji lub odwraca inaktywację enzymów zawierających grupę - SH
BAL tworzy z rtęcią związek rozpuszczalny w płynach ustrojowych i bardziej trwały niż połączenie rtęci z enzymem: rtęć zostaje w ten sposób usunięta z surowicy i wydalona
BAL pobudza OUN i powoduje skurcz tętniczek w mięśniach, być może wskutek hamowania oksydazy cytochromowej
Środki chelatujące - BAL
Podstawowe znaczenie ma jak najszybsze podanie: największa skuteczność przy podaniu w ciągu pierwszych 4 godzin od zatrucia.
Dostępny w postaci 10% roztworu olejowego do wstrzyknięć im. Każda ampułka zawiera 3 ml (300mg) dimerkaprolu
Dawkowanie: 3mg/kg co 4 godziny przez pierwsze 2 dni a następnie 2 mg/kg co 12 godzin
Leczenie może trwać nawet do 10 dni. Należy je kontynuować do chwili gdy wydalanie rtęci w moczu spadnie do 50 ug/d
Z uwagi na to, że kompleksy metalu z dimerkaprolem w kwaśnym środowisku nie są trwałe podczas leczenia należy utrzymywać zasadowy odczyn moczu
Należy obserwować też pacjenta pod kątem zaburzeń ze strony OUN z uwagi na możliwość penetracji chelatu dimerkaprolu do mózgu.
Nie należy stosować dimerkaprolu u chorych z niewydolnością wątroby.
Środki chelatujące - przedawkowanie BAL-u
Różne objawy uboczne, zależne od dawki
dawki rzędu 3mg/kg wywołują niepokój, uogólnione bóle, świąd, ślinotok, wzrost ciśnienia tętniczego krwi średnio o 20 - 30 mmHg u ponad 20% pacjentów
przy dawkach 5 mg/kg masy ciała u ok. 60% pacjentów obserwuje się podwyższona gorączkę, tachykardię, i wzrost CTK o ponad 30 - 40mmHg
U chorych którym podano dawkę wyższą niż 5mg/kg występują: nudności, wymioty, drgawki, zaburzenia świadomości i śpiączka po upływie 30 min od wstrzyknięcia dimerkaprolu. Reakcja ta przemija po ok. 1-6 h
Nawet przy podaniu dawki 40 mg/kg, nie zanotowano przypadków śmiertelnych
Środki chelatujące - DMSA
Rozpuszczalny w wodzie analog dimerkaprolu stosowany doustnie, wydalany głównie z moczem (80 - 85%)
Wykazuje nieznaczne objawy uboczne
Dawkowanie: 30 mg/kg/dzień co 4 - 6 godzin lub 100 mg dwa razy dziennie
DMPS (Dimval-Heyl i współ., Berlin) =2.3 dimercaptopropano-sulfonian
Zwiększa wydalanie rtęci z moczem
Dawkowanie: dożylnie w dawce 5mg/kg m.c. lub per os 12 do 24 caps/24 godz w 12 dawkach (co 2 godz.), a następnie 3 x dziennie 1 kap. do 15 dni od zatrucia
W zatruciach przewlekłych 3-4 kaps/dzień 1 godzinę przed jedzeniem.
Środki chelatujące:UNITHIOL
•iv lub im. 2,5 mg/kg m.c.
•1 i 2 doba: co 4 godziny
•3 i 4 doba: co 6 godzin
•5 i 6 doba: co 12 godzin
•Dawka jednorazowa nie może przekraczać 6 mg/kg m.c.
•Po 5 dniach leczenia Unithiolem wskazane jest rozpoczęcie podawania D-pencylaminy= Cuprenilu p.o. 100 mg/ kg m.c. przez 7 dni,
•w przypadku ekspozycji przewlekłej do kilku tygodni wraz z wit. B6
Środki chelatujące: D - penicylamina
podawanie doustne
Dobrze wchłaniana (nieznacznie tylko metabolizowana) tworząc z rtęcią kompleksy wydalane z moczem i kałem
Dawkowanie: dzieci - 100 mg/kg/dzień w czterech dawkach podzielonych (dawka dzienna nie powinna przekraczać 1 g); dorośli 250 - 500 mg 4 razy dziennie
Środki chelatujące: N - Acetylcysteina, cysteina
Zwiększają eliminację nieorganicznych związków rtęci i częściowo także jej organiczne połączenia.
Mogą być stosowane doustnie
Obydwa leki wykazują niską toksyczność a ich kompleksy z rtęcią z łatwością przechodzą przez błony hemodializacyjne
Dawkowanie: dawka uderzeniowa 140 mg/kg a następnie 70 mg/kg co 4 godz.
Leczenie: zatrucie organicznymi związkami rtęci
Organiczne związki rtęci zawierające grupę alkilową (metylortęć, etylortęć) słabo wiążą się ze środkami chelatującymi.Środki te wiążą jedynie tę część rtęci, która uległa już przemianie do rtęci nieorganicznej
Z uwagi na to, że BAL przejściowo zwiększa stężenie metylortęci w mózgu, wzmagając tym samym jej toksyczność, jego podawanie w zatruciach rtęcią organiczną jest niewskazane
Forsowana diureza jest przydatna tylko do eliminacji tej części rtęci, która uległa konwersji do związków nieorganicznych (pozostała, niezmieniona część jest wydalana głównie z kałem.
Forsowana diureza powinna być wykonywana bardzo ostrożnie z uwagi na nefrotoksyczne działanie rtęci organicznej.
Leczenie: zatrucie organicznymi związkami - postępowanie ogólne
Lecze nie ostrej niewydolności nerek, wg zasad ogólnie przyjętych
Podawanie neostyg miny 15 - 22,5 mg/d oraz atropiny 2-3mg/d w celu zwiększenia siły mięśniowej w zatruciu związkami alkilortęciowymi.
Leczenie: zatrucie organicznymi związkami - zatrucie przwlekłe
usunąć pacjenta z warunków ekspozycji
Podać dimerkaprol (?)
Leczyć niewydolność nerek
Przewodnik postępowania w przypadku rozlania się rtęci termometr lekarski
Sprawdź czy rozbity termometr zawierał srebrny płyn (rtęć), a nie czerwony (ftalan dibutylu)
Sprawdź czy uszkodzony jest zbiornik termometru. Jeżeli zbiorniczek jest złamany lub zgnieciony, powinno zastosować się procedurę związaną z większym niebezpieczeństwem/nieznaną ilością rozlanej rtęci
Przed podjęciem jakichkolwiek działań, poradź dzwoniącemu aby nie używał odkurzacza na powierzchni gdzie rozlała się rtęć
Określ typ skażonej powierzchni. Jeżeli powierzchnia jest porowata (surowe deski drewniane, dywan), zaleca się kontakt z lokalnym wydziałem zdrowia lub prywatną firmą do pomocy w usuwaniu rozlanej rtęci
Przed rozpoczęciem usuwania rozlanej rtęci zdjąć złotą biżuterię
Wyłączyć ewentualne źródła ciepła w okolicy zanieczyszczenia
Nie należy zamiatać rtęci przy pomocy miotły, gdyż włosie rozbija krople rtęci na mniejsze trudniejsze do usunięcia kropelki rtęci
Należy zminimalizować kontakt rtęci ze skórą.
Do usuwania używać kartoników lub kawałków sztywnego papieru
Zebrane razem krople rtęci umieścić w zakręcanym słoiku lub plastikowej torbie z zamknięciem typu „ziplock”.
Tak zebraną rtęć należy oddać do specjalnej utylizacji szkodliwych odpadów
Zaleca się przeprowadzenie dodatkowej wentylacji powierzchni na którą rozlała się rtęć aby uniknąć nagromadzenia się par rtęci
TAL Tl
Został odkryty w roku 1861 i znalazł zastosowanie jako lek przeciw chorobom wenerycznym, w grzybicy, dnie moczanowej, czerwonce i gruźlicy.
Obecnie używa się go do produkcji barwników jubilerskich, stosowany jest także w termometrach do mierzenia niskich temperatur, jako półprzewodnik, w licznikach scyntylacyjnych oraz w soczewkach optycznych.
Stosowanie związków talu w środkach przeciw gryzoniom, które były najczęściej przyczyną zatruć przypadkowych i samobójczych zostało zaniechane ze względu na jego dużą toksyczność.
Tal jest znany jako kumulująca się, mordercza trucizna.
Średnia dawka śmiertelna dla dorosłego człowieka wynosi 1 g rozpuszczalnej soli talu.
Znane jest przeżycie po zażyciu 1.3 g przez osobę dorosłą oraz śmierć na skutek spożycia dawki wynoszącej 3.2 g.
Donoszono o toksyczności talu po zażyciu chlorku talu będącego lekiem homeopatycznym.
Tal jest szybko absorbowany z przewodu pokarmowego, przechodzi do wnętrza komórek, głównie do komórek krwi, objętość dystrybucji jest ogromna i wynosi w przybliżeniu 50 L (1 - 5 L/kg).
Jest gwałtownie absorbowany przez skórę, płuca i błony śluzowe
Wchłanianie przez skórę - stosowanie maści zawierających tal.
Wdychanie siarczanu talu przez okres dłuższy niż 3 tygodnie może być powodem zatrucia. Pojawia się nadciśnienie, łysienie i parestezje.
W przypadku przedawkowań ostrych znaczna część talu znajduje się w jelicie, prawdopodobnie z powodu krążenia wątrobowo-jelitowego.
Okres eliminacji do dawki półtrwania wynosi w przybliżeniu 1.9 dni.
Wydala się wolno z moczem (3% całkowitej zawartości) i kałem.
Tal przechodzi przez łożysko i wywołuje łysienie oraz zniekształcenia paznokci u płodu, jeśli ekspozycja miała miejsce w ostatnim trymestrze ciąży.
Patofizjologia
Tal jest trucizną komórkową
Zachowuje się jak analog potasu i jest początkowo dystrybuowany wewnątrzkomórkowo do wszystkich tkanek ciała, zmiany w dystrybucji pojawiają się dopiero z upływem czasu
Najwyższe stężenia tal osiąga w nerkach, kościach, żołądku, w jelicie cienkim i grubym, śledzionie, wątrobie, mięśniach, płucach i mózgu
Objawy kliniczne:
Początek choroby jest podstępny - po 2 do 3 tygodniach stan stopniowego cofania się objawów zatrucia może dojść do zgonu
Opisano 4 charakterystyczne zespoły objawów chorobowych
1) Natychmiastowy (3 - 4 godziny) - głównie objawy ze strony przewodu pokarmowego takie jak nudności, wymioty i biegunka
2) Po okresie utajenia (godziny do dni)
OUN - dezorientacja, senność, śpiączka, drgawki, psychozy, wzmożone pragnienie, bezsenność, aż do obrzęku mózgu z depresją ośrodka oddechowego
Obwodowy układ nerwowy - równoczesne zaburzenia ruchowo-czuciowe, nadmierne drżenia rąk i stóp. W przeciwieństwie do zespołu Guillain-Barre, odruchy wyprostne w przebiegu zatrucia pojawiają się później. Pierwotne zmiany czuciowe poprzedzone są osłabieniem ruchowym
Autonomiczny układ nerwowy - tachykardia, nadciśnienie, gorączka, ślinotok, pocenie się
Układ oddechowo - krążeniowy:
- w przypadkach ostrych może wystąpić martwica mięśnia sercowego z zaburzeniami rytmu i niewydolność hemodynamiczna; hipotensja i bradykardia dominują wśród objawów klinicznych
zespół ciężkich objawów oddechowych rozwinął się u dorosłej osoby po pierwszych 48 godzinach hospitalizacji od momentu zażycia talu; ciśnienie w kapilarach płucnych było prawidłowe, badanie pośmiertne wykazało rozproszone śródmiąższowe i pęcherzykowe zapalenie płuc z tworzeniem błon szklistych
inne
występuje także zapalenie nerwów ocznych i porażenie mięśni ocznych
na skórze mogą pojawić się niebiesko-szare linie
w pierwszych dniach po narażeniu wokół korzeni włosów pojawia się ciemna pigmentacja
3) Późne objawy zatrucia (po upływie 2-4 tygodni)
Skóra staje się wysuszona łuskowata, na paznokciach pojawiają się charakterystyczne białe prążki
Najbardziej charakterystycznym objawem zatrucia jest plackowate wypadanie włosów
4) Objawy późne, szczątkowo (miesiące)
Nadal mogą utrzymywać się objawy ze strony ośrodkowego i obwodowego układu nerwowego, takie jak ataksja, drżenia, opadanie stopy przy porażeniu nerwu strzałkowego i utratę pamięci
Testy labolatoryjne:
Stężenia talu we krwi oznaczane za pomocą płomieniowej absorpcji atomowej potwierdzają narażenie, ale nie dają wskazówek co do postępowania lekarskiego
W 8% próbek krwi w trakcie rutynowego badania diagnostycznego znajduje się mniej niż 5 ng/mL talu
Stężenia wyższe niż 30 μg/dL wskazują na istotne spożycie talu
Badanie stężenia talu w moczu jest mniej wiarygodne, jako że tal jest wydalany głównie z kałem
Badanie korzeni włosów wykazywało czarną pigmentację w 95% przypadków po upływie 4 dni od momentu narażenia
Tal nie przepuszcza promieni rtg, stąd „mgliste cienie” w badaniu rtg jamy brzusznej odpowiadają zawartości talu w wątrobie
Po upływie tygodnia lub później od narażenia, badania laboratoryjne mogą dostarczyć pewności co do zaburzeń funkcjonalnych nerek, wątroby lub mięśni w wyniku zatrucia
Nieznacznie obniżony poziom potasu i łagodna alkaloza hipochloremiczna najprawdopodobniej odzwierciedlają dysfunkcje kanalików nerkowych
Leczenie:
W zatruciach drogą doustną:
podtrzymanie funkcji układu krążenia i oddychania
dekontaminacja przewodu pokarmowego - płukanie żołądka, węgiel aktywowany
stosowanie powtarzanych dawek węgla aktywowanego jest uzasadnione, jako, że w badaniach in vitro wykazano, że wiąże on jony talu
Zaleca się podawanie 30 gramów węgla w zawiesinie wodnej - dawka optymalna nie jest ustalona, najczęściej jest zalecana dawka 30 do 100 gramów węgla dla dorosłych i 15 -30 g u dzieci
Przyspieszenie eliminacji
wykonanie hemodializy jest kontrowersyjne ze względu na dużą dystrybucję wewnątrzkomórkową talu
w przypadkach ciężkich zatruć zalecano wykonanie hemodializy i forsowanie diurezy z zastosowaniem chlorku potasu
Odtrutki:
Błękit krystaliczny żelazicjanku potasu inaczej błękit pruski zwiększa wydzielanie talu poprzez wymianę talu na potas
Podawanie błękitu pruskiego jest w Europie terapią z wyboru
Kompleks talu z błękitem pruskim nie jest absorbowany i dlatego wywołuje szereg efektów ubocznych między innymi zaparcia
Błękit pruski - Dawka dzienna wynosi 250 mg/kg i powinna być podzielona na 4 dawki doustne
Do każdej dawki należy podać łagodny środek przeczyszczający np. 50 ml 15% sorbitolu
Ciężkie zatrucia z gwałtownymi wymiotami mogą wymagać założenia sondy dwunastniczej w celu podania błękitu pruskiego
Błękit pruski powoduje zwiększone wydalanie talu z kałem w ilości około 2 mg w ciągu więcej niż 20 dni
Wydalanie z moczem wynosi 820 mg przez ponad 46 dni i 225 mg w dializacie w ciągu więcej niż 25 dni
Terapię z zastosowaniem błękitu pruskiego tworzącego z talem nierozpuszczalne kryształy powinno się kontynuować do momentu kiedy mniej niż 0,5 μg//24 godziny talu jest wydalane z moczem
Stosowanie błękitu pruskiego nie wymaga podawania soli potasu w czasie trwania kuracji
60
Wyszukiwarka
Podobne podstrony:
wprowadzenie do pedagogiki, Uczelnia
Kontekst społeczny pracy socjalnej, UCZELNIA, ROK III, Wprowadzenie do pracy socjalnej
Praca socjalna, UCZELNIA, ROK III, Wprowadzenie do pracy socjalnej
Praca socjalna w odniesieniu do społeczeństwa, UCZELNIA, ROK III, Wprowadzenie do pracy socjalnej
Praca sojalna jako zawód misja, UCZELNIA, ROK III, Wprowadzenie do pracy socjalnej
media w edukacji do druku, Uczelnia
do prezentacji, uczelnia semestr 3, EPIDEMIOLOGIA cw
makro-do-cwiczen, uczelnia WSEI Lublin, UCZELNIA WSEI 2, MAKRO
3. Motywacje do pracy, Uczelnia
9 - Straty ciepla do otoczenia, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Bilansowanie urz. ciepl
pytania do kolosa, UCZELNIA, SEMESTR 4, TECHNOLOGIA BETONU
fizjologia do zal., uczelnia - Licencjat, sem 2, fizjologia
Teoria stosunków międz. do nauki, Uczelnia Łazarskiego, Teorie Stosunków Miedzynarodowych
ekonometria2 ściąga do druku, Uczelnia Warszawska, Ekonometria
notatka wstep do ekonomii, Uczelnia Warszawska, Mikroekonomia
Malus do wydruku, Uczelnia, sem I, fiza, LABORATORIUM, Nowe laborki, Malus
egzamin - sciaga do druku, Uczelnia, Technologia budowy maszyn, Materiały pomocnicze
INSTRUKCJA DO ĆWICZENIA, UCZELNIA, SEMESTR 4, FIZYKA BUDOWLI, Labolatoria, 1
więcej podobnych podstron