skanuj0080 3

5. Równowag jonowe w roxcterictonjch roawtradi wodnych
Ocena kompletności modelu matematycznego
Model składa się z sześciu liniowo niezależnych równań: (8.5), (8.6), (8.9)-(8.12). Niewiadomymi są stężenia: o„>0, , oNl, . c(lso;, omJ... cQ1). 1 cHjS0).
Przyjęto, że stężenie wody jest stało i wynosi cHj0 = 55,34 mol/dm3. Wartości
stałych Kał, K^, Kw i stężenie formalne kwasu c podano w treści zadania. Uzupełnienie modelu stanowią równania (8.7) i (8.8) wiążące wartości stałych K.|, K«2 zKbi, K*2- Model matematyczny jest kompletny.
UPROSZCZONY MODEL MATEMATYCZNY
Rozwiązanie pełnego modelu jest trudne i pracochłonne. Wyrażając stężenia wszystkich jonów poprzez cQH_ i podstawiając do równania (8.12) otrzymuje się
równanie czwartego stopnia:
2c + ——= cc-
K«oflB.+ci«.+Kw.K
b2 KblCoH.+cJH-+Kb,KM
+ COH*
(8.13)
Model można uprościć przez pominięcie w bilansie ładunków (8.12) składnika o najmniejszym stężeniu.
Uproszczenie modelu
W-roztworze zasady c^*-spełniona jest zależność:
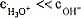
(8.14)
Jony oksoniowe powstają tylko w reakcji (8.4), której równowaga przesunięta jest w kierunku substratów (roztwór zasadowy). Można więc założyć, że:
(8-15)
ohi_>20
Hj|0*
f w bilansie (8.12) pominąć stężenie jonów oksoniowych. Po tym uproszczeniu równanie (8.13) będzie miało postać:
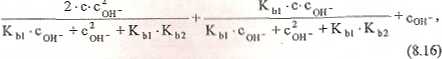
która w obliczeniach również nastręcza wiele trudności.
Siarczan(IV)jest słabą zasadą. Wartości stałych Kb, i K« wynoszą zaledwie:
|
^.[,0.10- =1 . K„ 632-10-1 K“ K„ 1.74-10-1-5’75 10 ’ ' | ||
|
przy czym |
Kw»Kb2 |
(8.17) |
|
Stąd można złożyć, |
że: | |
|
cso!->o..so,->>cH^>,“0 |
(8.18) |
i w równaniach (8.11) i (8.12) pominąć stężenie kwasu H2SO3.
Rozwiązanie
Uwzględniając (8.14) i (8.18) równanie bilansu ładunków (8.12) można zapisać:
CHa* “ 2 °S0i- +CHSOi +COH- ■ (8I9>
a równanie bilansu materiałowego (8.11):
c-V' +chso; <8'20)
Uproszczony model matematyczny stanowią równania (8.5), (8.6), (8.9), (8.10), _(8.]£), (8.20)_oiaz (8.7) i (8.8). Rozwiązanie tego układu równań jest proste. Mianowicie, przekształcając równania (8.19) i (8.20) oraz uwzględniając (8.10), stężenia cHSQ. i cgoj. wyraża się przez stężenie jonów wodorotlenkowych:
HSOi
OH’
c-c.
(8.21)
ipt
Następnie podstawiając (8.21), (8.22) i (8.7) do (8.5) otrzymuje się równanie:
(8x23)_
"Kw __COH“
które po uporządkowaniu ma postać:
^ +£ł.c
K
•2
ow
c=0
(8.24)
Wyszukiwarka
Podobne podstrony:
skanuj0094 5. Hównowłiął Junumi w rozctortc/onych roztworach wodnych Ocena kompletności modelu
skanuj0062 (16) 120 5. Równowagi Jonowe w rozclortesonych roztworach wodnych5.1. Roztwory mocnych kw
skanuj0065 (15) MO 1 ^ł<c 126 _- S. Równowag jonowe w rozckricropydi roztworach
skanuj0064 (16) 5. Równowagi jonowe w rozcieńczonych roztworach wodnych prawa strona bilansu P = cHj
skanuj0061 2 na 5. Równowiigl jonowe w rozcieńczonych roztworach wodnych Ml* <V Bocływ
skanuj0069 134- 5. Równowagi Jonowe w rozcieńczonych rortworuch wodnych b) c ■ 0,1
skanuj0083 162 5. Równowag jonowe w rozcieńczonych roztwoiii^ wodnych 162 5. Równowag jonowe w rozci
skanuj0089 174 5. Równowri Jonowe w roickśczonych roztworach wodnych Przykład 11 W jakim stosunku ob
skanuj0093 - 182 5. Równowagi jonowe w rozcieńczonych roztworach wodnych - 182 5. Równowagi jonowe w
skanuj0095 186 S. Równowagi jonowe w rozcieńczonych roztworach wodnych Ks = cscs(cs+c)
skanuj0097 190 5. Równowagi jonowe w nudcńcłonych roztworach wodnych stężenie jonów OH- c --^--l0(’p
skanuj0098 192 5. Równowagi Jonowe w roickfeoaytfa roztworach wodnych Przykład 14 Ile moli HNÓj nale
skanuj0100 2 196 5. Równowag jonowe w rozocócronych roztworach wodnych Odpowiedź Aby sól trudno rozp
skanuj0102 2 200 5. Równowag jonowe w rozcieńczonych roztworach wodnych 22. Oblicz
12293 skanuj0075 (15) 146 5. Równowagi Jonowe w roitclcricsonych roztworach wodnych 146 5. Równowagi
39741 skanuj0062 (16) 120 5. Równowagi Jonowe w rozclortesonych roztworach wodnych5.1. Roztwory mocn
więcej podobnych podstron