351

A HibUl. IM1U.1 .Vvu .•»•»»«. :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«}
11 6 WODNE ROZTWORY SOU
Terminem hydroliza określa się ogólnie rozkład substancji organicznych luh nieorganicznych zachodzący pod wpływem wody. Hydrolizą nazywano do niedawna także zjawisko zmiany stężenia (wzrost lub zmniejszenie) jonów wodorowych w wodzie następujące na skutek rozpuszczenia w mej różnego rodzaju soli. Dokładniejsze zbadanie tego zjawiska prowadzi jednak do wniosku, ze w istocie mamy Ul do czynienia z ustaleniem się równowag lcwasowo-zasadowych opisywanych przez teorię Bnmstcda. z którymi zapoznaliśmy się już w p.l 1.3—11.5. Ten ich specyficzny charakter różni je od większości procesów hydrolitycznych i teiminu hydroliza soli obecnie unikamy.
Podczas rozpuszczania wielu soli obserwujemy zakwaszanie lub alkalizowanic roz-tworu. Jest to skutek zachodzących reakcji protolizy.
Rozpatrzmy, na przykład, zachowanie octanu sodu w wodzie. Sól ta w roztworze wodnym jest zdysocjowana całkowicie na jony Na' oraz na jony octanowe CHiCOO :
CH.COONa — CH.COO' + Na*
lal
Jony octanowe, stanowiące według teorii Bronsteda zasadę, wchodzą w reakcję z czą steczkami wody pełniącymi funkcję kwasu:
CHiCOO’ + H.O ł* CH-.COOH + OH
Utworzone w nadmiarze jony OH zaburzają równowagę dysocjacji wody. jaka ustaliła się w czystym rozpuszczalniku:
2H.O
H.O* •+• OH
(c)
Warunkiem ustalenia się nowej równowagi jest związanie części jonów OH przez jony H?0+ pochodzące z dysocjacji wody, tak by wartość iloczynu jonowego wody [równ. <11.2b)| została nie zmieniona. Po ustaleniu się nowej równowagi stężenie jonów OH jest większe niż stężenie jonów HiO , a roztwór ma odczyn zasadowy (pH > 7). Jony OH- mc łączą się w roztworze z jonami Na* pochodzącymi z dysocjacji octanu sodu. gdyż wodorotlenek sodu jest mocnym elektrolitem i równowaga:
Na' + Ol! *- NaOłl
<dl
jest całkowicie przesunięta w lewą stronę.
Zastosujmy do równowagi (b) prawo działania mas; otrzymujemy w przypadku roztworów rozcieńczonych:
* rpu /wwi • i i ui
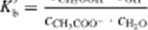
(11.12)
W roztworze rozcieńczonym stężenie wody < H.(ł jest praktycznie biorąc stałe, co pozwala na zapisanie równania (11.12) w postaci
w któtej występuje siała Kb. czyli stała dysocjacji zasady, sprzężonej z kwasem octowym.
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 .Vvu :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3.1
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © t>< »N TOS >«} 3.11
A HibUl. IM1U.1 .Vvu r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 8
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 8 11 JA
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 11 5 DY
A HibUl. IM1U.1 .Vvu r.., r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 34
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 a SZY
A HibUl. IM1U.1 ,Vvu r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 37
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 40 2
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 2 1
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3 1 DWO
A HibUl. IM1U.1 .Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 2 ZAS
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-Ż © l>. »N TOS »*} 3.2 ZASADA
A HibUl. IM1U.1 .Vvu r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 54 3
A HibUl. IM1U.1 .Vvu -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 E
więcej podobnych podstron