skanuj0085

166 5. Równowagi jonowe w rozcloricaonych roztworach woduych
Stała protolizy kwasu mrówkowego pKa=3,75; stała protolizy kwasu octowego pK*“ 4,76; iloczyn jonowy wody pKw *=14. ';
166 5. Równowagi jonowe w rozcloricaonych roztworach woduych
CZĘŚĆ A
Przed dodaniem kwasu woda ma odczyn obojętny (równanie (11)).
4_7 mol dm3
pH"- logc
H»0*
7,00
Po dodaniu 1 mola kwasu HCI do 10 dm3 wody otrzymuje się roztwór kwasu solnego o stężeniu c = 0,1 mol/dm3. Wartość pH tego roztworu można obliczyć zgodnie ze wzorem (1.13):
pH = - log c = 1,00 (103)
CZĘŚĆ B
Jak obliczono w przykładzie 2, wartość pH roztworu kwasu mrówkowego o stężeniu formalnym C| = 1,0* 10-3 mol/dm3 wynosi:
pH-3,47 (10.4)
Po dodaniu kwasu HCI otrzymuje się .roztwór stanowiący mieszaninę kwasu mrówkowego o stężeniu formalnym c, - 1,0-10"3 mol/dm3 i kwasu solnego ó stężeniu toitnainym Cs “ 0,1 móPdm^T '
MODEL STECHJOMETRYCZNY
HCOOH + H20 * HCOO" + HjO+ (10.5)
HCI + H20 -► C1-+H30+ (10.6)
2H20 ss HjO+ + OH" (10.7)
Składniki roztworu: jony HjO^HCOO', Cl^OH" i cząsteczki HCOOH i H20.
MODEL MATEMATYCZNY Opis równowagi
K,.w-y (108)
CHCOOH
K»=C.łj0*'C0H- i®
..............

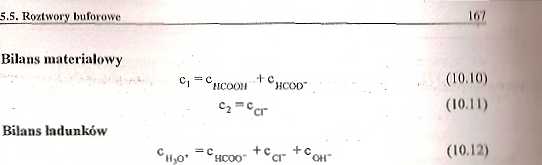
Ocena kompletności modelu matematycznego
Model składa się z pięciu niezależnych liniowo równań (10.8) - (10.12)a które wiążą nieznane wartości stężeń cHj0., ccr , cHC0Q_, c0|r , clłC00„ ,A
Przyjęto, że stężenie wody jest stałe i wynosi cHj0 - 55,34 mol/dm3. Równanie definicyjne pH stanowi uzupełnienie modelu. Model jest kompletny.
UPROSZCZONY MODEL MATEMATYCZNY Uproszczenie modela
Podobnie jak w przykładzie 2 rozwiązanie modelu poprzez analizę matematyczną prowadzi do równania trzeciego stopnia. Model można uprościć. W roztworze tych dwóch kwasów musi być spełniona zależność:
So*>>coh- ^>20 *(10.13)
--------------------------------------_______^
iw równaniu (10.12) można pominąć stężenie jonów wodorotlenkowych.
Rozwiązanie
Równanie (10.12) można teraz zapisać:
im. <i(u4)
Ponieważ ca__sę2l więc:
CHCOO-=C„^-C2 <l015)
Z równania (10.10) oblicza się stężenie kwasu mrówkowego:
°hcooh =C| ~chcoo- “Cl +Oj -CM)0. (10.16)
Podstawiając (10.15) i (10.16) do wyrażenia na stałą Ka (10.8) otrzymuje się równanie:
Wyszukiwarka
Podobne podstrony:
skanuj0067 2 130 5. Równowagi Jonowe w rcreeleiiczoiiych roztworach woduych 5.2. Roztwory hlabydi kw
skanuj0062 (16) 120 5. Równowagi Jonowe w rozclortesonych roztworach wodnych5.1. Roztwory mocnych kw
39741 skanuj0062 (16) 120 5. Równowagi Jonowe w rozclortesonych roztworach wodnych5.1. Roztwory mocn
skanuj0064 (16) 5. Równowagi jonowe w rozcieńczonych roztworach wodnych prawa strona bilansu P = cHj
skanuj0061 2 na 5. Równowiigl jonowe w rozcieńczonych roztworach wodnych Ml* <V Bocływ
skanuj0073 142 5. Równowagi Jonowe w rozcieńczonych roztworach wodnjcŁ Stąd stężenie formalne roztwo
skanuj0083 162 5. Równowag jonowe w rozcieńczonych roztwoiii^ wodnych 162 5. Równowag jonowe w rozci
skanuj0089 174 5. Równowri Jonowe w roickśczonych roztworach wodnych Przykład 11 W jakim stosunku ob
skanuj0093 - 182 5. Równowagi jonowe w rozcieńczonych roztworach wodnych - 182 5. Równowagi jonowe w
skanuj0095 186 S. Równowagi jonowe w rozcieńczonych roztworach wodnych Ks = cscs(cs+c)
skanuj0097 190 5. Równowagi jonowe w nudcńcłonych roztworach wodnych stężenie jonów OH- c --^--l0(’p
skanuj0098 192 5. Równowagi Jonowe w roickfeoaytfa roztworach wodnych Przykład 14 Ile moli HNÓj nale
skanuj0100 2 196 5. Równowag jonowe w rozocócronych roztworach wodnych Odpowiedź Aby sól trudno rozp
skanuj0102 2 200 5. Równowag jonowe w rozcieńczonych roztworach wodnych 22. Oblicz
skanuj0065 (15) MO 1 ^ł<c 126 _- S. Równowag jonowe w rozckricropydi roztworach
skanuj0081 158 • S. Równowagi Jonowe w roy,doliczonych roztworach wodnych Stężenie jonów wodorotlenk
więcej podobnych podstron