29347 skan0159 (2)

162 Roztwory i równowagi fazowe
c) Podczas mieszania w 25°C wody z HN03 w stosunku molowym 3 :1 na każdy mol kwasu wydziela się 24,3 kJ (tab. 4.9). Aby zmieszać 400 g H20 z HN03 w takim stosunku, masa dodanego kwasu wyniesie
162 Roztwory i równowagi fazowe
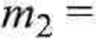
400-63,012 18,015 - 3
= 466,4 g (7,40 moli) HN03.
Przy szybkim zmieszaniu praktycznie nie ma warunków do równie szybkiego oddania do otoczenia całego wydzielonego ciepła, toteż naczynie wraz z zawartością ogrzewa się od temperatur}' początkowej Tp do jakiejś temperatury Tk. Bilans cieplny opisuje równanie
h
~77~dHint+ J [(ml + m2)cp+W\dT= 0. m2 Tp
Pomijając wartość wodną naczynia W i straty do otoczenia oraz zakładając niezależność ciepła właściwego od temperatury, otrzymamy, po prostym przekształceniu,
Tk-Tp
M2 (m i + m2)cp
466,4 • (-24,3 • 103) 63,012 (400 + 466,4) -2,78
= 74,7°C,
co oznacza, że roztwór osiągnie temperaturę 99,7°C, niebezpiecznie bliską temperatury wrzenia. ■
Fazą nazywamy homogeniczną część układu oddzieloną od otoczenia wyraźną powierzchnią graniczną i mającą w każdym miejscu takie same właściwości termodynamiczne.
Liczbą składników niezależnych a nazywamy różnicę między liczbą wszystkich składników a liczbą wiążących je równań.
Liczbą stopni swobody n układu złożonego z a składników i /? faz nazywamy najmniejszą liczbę parametrów intensywnych (T, p, skład), które możemy dowolnie zmieniać, nie powodując zmiany liczby faz układu.
Reguła faz Gibbsa określa liczbę stopni swobody układu złożonego z a składników (niezależnych) i /? faz
n = a - /? + 2, (4.44)
gdzie liczba 2 oznacza dwa parametry zewnętrzne - temperaturę T i ciśnienie p.
Liczba stopni swobody układu jednoskładnikowego (ot = 1) zależy od liczby faz /?; n = 3 - /?. Ponieważ minimalna liczba faz musi być równa 1, stąd maksymalne n = 2; w tym układzie równowagi są przedstawiane we współrzędnych p-T. Największa liczba faz, które mogą występować obok siebie, wynosi w tym przypadku 3, przy tym w' ściśle określonych temperaturze i ciśnieniu (punkt po-
Wyszukiwarka
Podobne podstrony:
11532 skan0147 150 Roztwory i równowagi fazowe Termodynamiczna funkcja mieszania yM, gdzie Y jest do
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
skan0155 158 Roztwory i równowagi fazowe Po podstawieniu odpowiednich wartości z tab. 4.9 dostaniemy
skan0167 170 Roztwory i równowagi fazowe Rys. 4.20. Równowaga w układzie dwuskładnikowym, ciało stał
skan0171 (2) 174 Roztwory i równowagi fazowe Przykład 4.16. W tab. 4.12 zestawiono dla ciśnienia 760
skan0195 198 Roztwory i równowagi fazowe Temperatury wrzenia benzenu i toluenu pod ciśnieniem 400 mm
12851 skan0127 130 Roztwory i równowagi fazowe wego w wodzie c i ksylenie c" wynosiły odpowiedn
skan0125 128 Roztwory i równowagi fazowe Zatem 0,343 0,343 + 5,11 0,0629; x} = 1 -x2 = 0,937. c) Stę
skan0133 136 Roztwory i równowagi fazowe Temperatura krzepnięcia roztworu Tk, zawierającego nielotną
skan0135 138 Roztwory i równowagi fazowe Rozwiązanie. Do obliczeń y2 wykorzystamy wzór (4.20) 0- 1 m
skan0139 142 Roztwory i równowagi fazoweym = Y n + n2 - X] Yy + x2Y2. (4.28) Różniczkując (4.27) otr
skan0177 180 Roztwory i równowagi fazowe Hz0 (0) % wagowe N
skan0181 184 Roztwory i równowagi fazowe 4c:l. W 25°C prężność pary wodnej wynosi 23,76 mm Hg. Oblic
więcej podobnych podstron