skrypt wzory i prawa z objasnieniami60


Pierwsza zasada termodynamiki. Praca
■ L podstaw termodynamiki leży kilka podstawowych praw, zwanych zasadami termodynamiki. Jeżeli stykające się dwa ciała znajdują się w równowadze cieplnej, to ciałom tym przypisuje się taką samą temperaturę. Jeżeli natomiast pierwsze ciało przelani e ciepło drugiemu, to mówimy, że pierwsze ciało ma wyższą temperaturę od drugiego. Po pewnymi czasie ustala się 3lan równowagi cieplnej - ustala się temperatura f układu dwóch ciał. Wynika stąd sformułowanie fctw. "zerowej” zasady termodynamiki: Jeżeli dwa cala znajdują się w stanie równowagi cieplnej z trzecim ciałem, to są one w równowadze cieplnej ze sobą. Ta trzecie ciało może służyć do określenia temperatury (termometr).
■ Pierwsza zasada termodynamiki wyraża zasadę zachowranla energii Jedno z jej sformułowań brzmi: Ciepło dostarczone układowi /.ostaje zużyte na zwiększenie energii wewnętrznej układu i na wykonanie przez układ pracy przeciwko siłom zewnętrznym. W przypadku bardzo malej zmiany parametrów stanu układu pierwszą zasadę termodynamiki zapisujemy w tz.w. postaci różniczkowej
* dQ = dU+dW.
■ W opisie przemian termodynamicznych posługujemy się zarówno pojęciem pracy W wykonanej pr/cz układ jak i pojęciem pracy H" = -łf' wykonanej nad układem.
Często o użyciu takiej czy innej nazwy decyduje to, która z dwóch prac będzie dodatnia. Natomiast do opisu ciepła wygodnie jest stosować pojęcie ciepła dostarczonego do układu Wtedy, jeśli układ pobiera ciepło z otoczenia, to Q > 0. jeśli układ oddaje ciepło,
to Q < 0.
■ Gdy układ termodynamiczny jest maszyną działającą okresowo, tzn. gdy układ w wyniku jakiegoś procesu wraca co stanu pierwotnego, to wtedy AŁ/= 0 a zatem ^ -Q, gdzie Q jest wypadkowym ciepłem dostarczonym do układu (ciepło pobrane minus ciepłu oddane) w jednym cyklu. Praca wykonana przez układ w jednym cyklu tówtji s:ę wypadkowemu ciepłu doprowadzonemu do układu. Wynika stąd inne sformułowanie pierwszej zasady termodynamiki:
Nie można zbudować silnika działającego okresowo, który wykonywałby pracę bez doprowadzania cło mego energii łub wykonywałby pracę większą od ilości doprowadzonej do niego energii (niemożliwe jest zbudowanie perpetuum mobile pierwszego rodzaju).
■ Energia wewnętrzna układu jest jednoznaczną funkcją jego stanu Oznacza tu, ie poduas dowolnego procesu, w wyniku którego układ wraca do stanu wyjściowego, całkowita zmiana jego energii wewnętrznej równo jest zeru. Wyrazić można to następującą zależnością <JdLr= 0. która jest warunkiem koniecznym i wystarczającym, aby dL' było różniczką zupełną
Prus* i ciepło podobne; zależności nic spełniają, zatem dW i AQ nie są różniczkami zupełnymi.
■ Praca w procesie termodynamicznym. W dwuwymiarowym układzie współrzędnych, w którym na osiach jest ciśnienie i objętość, zależność p od P w pewnym procesie przedstawia krzywa (rys. pc prawej stronic). Punkty (p|.ł’’i)i(P2**‘2) charakteryzują początkowy i końcowy stan układu, a krzywa je łącząca przedstawia pewien proces termodynamiczny. Praca wykonywana przez układ jest równa polu pod krzywą (zakreskowana część wykresu) i można ją obliczyć jako całkę oznaczoną Wielkość pracy zależy zatem me tylko od początkowego i końcowego stanu układu, ale i od tego po jaldej krzywej odbywało się zmiana stanu, czyli od rodzaju procesu
układ termodynamiczny
aepło pobrane przez układ
N,-
siły zewnętrzne wykonują pracę nad układem

układ wykonuje pracę przeciwko siłom zewnętrznym
układ oddaje ciepło
• układ pobiera ciepło
Q<0
--
\
7/
praco wykonana nad układem
pnryrost energ:: • pnłca wykonani przez układ pr/rz ^ zewnętrzne wewnętrznej układu przeciwko siłom zewnętrznym ^yf _ _ jy
ilość ciepła dostarczona do układu
przyrost energii ^ wewnętrznej układu
=*=
\ praca elemeniama wykonana przez układ przeciwko siłom zewnętrznym dH' ~p t\V
zależność ciśnienia
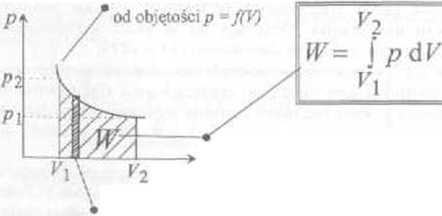
praca wykonana przez układ przy zmianie objętości od V\ do Kj
praca elementarna dłV=p dV
Wyszukiwarka
Podobne podstrony:
skrypt wzory i prawa z objasnieniami66 130 Potencjały termodynamiczne ■ Rozważania
skrypt wzory i prawa z objasnieniami60 j 118 Pierwsza zasada termodynamiki. Praca ■ &nbs
skrypt wzory i prawa z objasnieniami64 126 Cykl Carnota. Druga zasada termodynamiki Termodynamika 12
skrypt wzory i prawa z objasnieniami64 126 Cykl Carnota. Druga zasada termodynamiki Termodynamika 12
skrypt wzory i prawa z objasnieniami74 146 Spis treści —3 39 Zasada zachowania nomenlu pędu u*ładu c
skrypt wzory i prawa z objasnieniami20 36 Praca ■ Dla stałej siły pracę wydłuż odcinka o długości /
skrypt wzory i prawa z objasnieniami23 44Pole grawitacyjne ■ Energia potencjalna w polu grawitacyjny
skrypt wzory i prawa z objasnieniami29 Zasada zachowania pędu 56
skrypt wzory i prawa z objasnieniami30 56 Zderzenia - zasada zachowania pędu ■ W p
skrypt wzory i prawa z objasnieniami59 116 Pojącia podstawowe. Ciepło Termodynamika117 H Podstaw owe
skrypt wzory i prawa z objasnieniami41 80Ruch obrotowy ciała ■ Zasada zachowania m
skrypt wzory i prawa z objasnieniami41 80Ruch obrotowy ciała ■ Zasada zachowania m
skrypt wzory i prawa z objasnieniami65 128 Entropia ■ Dugą zasadę termodynamiki można sformułować po
skrypt wzory i prawa z objasnieniami74 146 Spis treści 39 Zasada zachowania momentu pędu układu aal.
skrypt wzory i prawa z objasnieniami03 4 Układy współrzędnych ■ Układem odniesienia nazywamy ciało,
skrypt wzory i prawa z objasnieniami05 8 Prędkość ■ Tor jest to krzywa opisywana w przestrzeni przez
skrypt wzory i prawa z objasnieniami24 46 Pole grawitacyjne ■ Pole grawitacyjne przy powierzchni Zie
więcej podobnych podstron