skrypt wzory i prawa z objasnieniami66

130 Potencjały termodynamiczne
■ Rozważania termodynamiki opierają się na wykorzystaniu funkcji stanu, które nazywamy potencjałami termodynamicznymi Zmiany potencjałów w wyniku pewnych przemian s<i równe pracy układu lub otrzymanemu przez układ ciepła.
Przyrost każdego z potencjałów jest różniczką zupełną funkcji, którą jest or. wyrażony. Dla przykładu jednym z potencjałów termodynamicznych jest energia wewnętrzna układu Jej przyrost dlo przemiany odwracalnej ca podstawie pierwszej zasady termodynamiki na postać dU = TdS-pdV. Widać, że w sposób naturalny można wybrać tutaj jako zmienne niezależne entropię ó’ i objętość V Różniczka zupełna funkcji ma żalem postać dU - J di’4 , J dl'
Otrzymujemy stąd zależności ^ I ^ -T oraz ^ ^ = -p.
funkcji iś-dfJ— T&S’- SdT = 7c1?-;?g F- TdS-Sd7. Stąd dF~ -SdT-pdy.
Wykorzystaliśmy tu zależność na przyrost ÓO Energia swobodna F est zatem funkcją lempcrnmry Ti objętość; V Różniczka zupełna funkcji F[T,V) wyraża sic wzorem
■ I iK-rgią swobodną układu nazywamy funkcję r = U- 7S. Rozważmy różniczkę tej
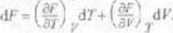
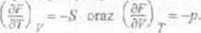
Porównując dwa ostatnie wzory otrzymujemy
Na podstawie pierwszej zasady termodynamiki dlc izotcrmiczncgo procesu odwracalnego można napisać dłf = -dl/TdS - -ÓtU- TS) = -dF. Stąd wniosek, źc praca w izoterm iczr.ym procesie odwracalnym jest równa ubytkowi energii swobodnej ciała.
■ Entalpią układu nazywany funkcję H-V+pT Różniczkując c i uwzględnia a: wzór na di' otrzymujemy dH —AU • pd V+ Edp ~ TdS pdV-*• pd V + I dp - TiLS’ * 1 er Entalpia jest więc potencjałem termodynamicznym dla zmiennych 5 i p Odpowiednie pochodne cząstkowe wynoszą (|£H = T oraz (^) v = *’ •
Jeżeli przemiana zachodzi dla /»**ccnst. to ciepło pobrane pracz układ można przedstawić w postaci dQ=dU+póV*d(U+pV)-=dH Zatem cic|»ło pobrane przez układ w przemianie i zobaryc zn ej jest rów rc przyrost owi entalpii ciała.
■ Termodynamicznym potencjałem Gibbta nazywamy funkcję G H- TS Jej różniczka jest równa dG= Ed^-SdT. Funkcja G jest zatem funkcja ciśnienia p ■ leir.ncraturv T.
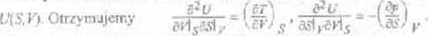
Zakładając ciągłość funkcji U otr/.vmuiemv ieden ze związków Maxwclla (wzory 69.i
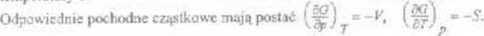
■ Zwią/ki Muc w dla Obliczmy mieszane pochodne cząstkowe rzędu drogiego funkcji
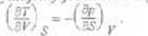
Analogicznie można wyprowadzić pozostałe związki MaxwcJla Są one bardzo przydatne do praktycznego zastosowania zasad termodynamiki.
:iśmcrje
G = H - TS

entropia
entalpia
pochodne czas tle o we temperatury po objętości i ciśnieniu przy ustalonej entropii
pochodne cząstkowe entropii po objętości t ciśnieniu przy ustalonej temperaturze
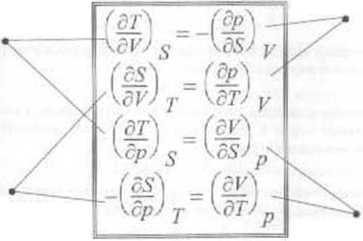
pochodne cząstkowe ciśnienia po entropii i teraperat jrzc przy ustalonej objętości
pochodne cząstkowe objętości po entropii i temperaturze przy ustalonym ciśnieniu
Wyszukiwarka
Podobne podstrony:
skrypt wzory i prawa z objasnieniami60 Pierwsza zasada termodynamiki. Praca ■ L po
skrypt wzory i prawa z objasnieniami34 66Ruch środka masy ■ Całkowitą siłę zewnętr
skrypt wzory i prawa z objasnieniami25 Pole sił zachowawczych (potencjalnych) ■ Jeśli w każdym punkc
skrypt wzory i prawa z objasnieniami64 126 Cykl Carnota. Druga zasada termodynamiki Termodynamika 12
skrypt wzory i prawa z objasnieniami23 44Pole grawitacyjne ■ Energia potencjalna w polu grawitacyjny
skrypt wzory i prawa z objasnieniami25 48 Pole sił zachowawczych (potencjalnych) ■ Jeśli w każdym pu
skrypt wzory i prawa z objasnieniami26 50 Pole sił zachowawczych (potencjalnych) ■
skrypt wzory i prawa z objasnieniami46 90 Energia drgań harmonicznych ■ Wzór na energię potencjalną
skrypt wzory i prawa z objasnieniami59 116 Pojącia podstawowe. Ciepło Termodynamika117 H Podstaw owe
skrypt wzory i prawa z objasnieniami60 j 118 Pierwsza zasada termodynamiki. Praca ■ &nbs
skrypt wzory i prawa z objasnieniami64 126 Cykl Carnota. Druga zasada termodynamiki Termodynamika 12
skrypt wzory i prawa z objasnieniami47 92 J 1 Małe drgania ■ Jeżeli energia potencjalna układu, któr
skrypt wzory i prawa z objasnieniami65 128 Entropia ■ Dugą zasadę termodynamiki można sformułować po
skrypt wzory i prawa z objasnieniami03 4 Układy współrzędnych ■ Układem odniesienia nazywamy ciało,
skrypt wzory i prawa z objasnieniami05 8 Prędkość ■ Tor jest to krzywa opisywana w przestrzeni przez
skrypt wzory i prawa z objasnieniami24 46 Pole grawitacyjne ■ Pole grawitacyjne przy powierzchni Zie
więcej podobnych podstron