409 [1024x768]

ELEKTROCHEMIA
Aktywność jonów wodorowych wynosi:
(H*)
K,
(OH)
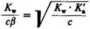
(5.170)
zaś wyrażenie na pH ma prostą postać:
pH - l/2pX. + l/2pK; + l/2!ogc (5.171)
2. Sól mocnego kwasu i słabej zasady. Reakcja hydrolizy ma tu ogólną postać: BH+ + H,0 = HaO* + B
zgodnie z którą stała hydrolizy Kh wyraża się za pomocą równania:
(H3Q*) (B) K. (BH+) " AT,
(5.172)
w którym A', oznacza stalą dysocjacji słabej zasady. Równania na stopień hydrolizy oraz stężenie jonów wodorowych można otrzymać jak poprzednio:
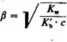
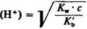
(5.173)
(5.174)
3. Sól słabego kwasu i słabej zasady. Reakcję hydrolizy należy w tym przypadku przedstawić za pomocą równania:
BH* + A" B + HA
na podstawie którego stała hydrolizy wynosi:
(B) (HA) K.
* (BH+)(A-) = *.•*„
(5.175)
Ponieważ w tym przypadku:
Wyszukiwarka
Podobne podstrony:
Płytka ta zanurzona jest w roztworze mocnego kwasu o jednostkowej aktywności jonów wodorowych.
345 [1024x768] ELEKTROCHEMIA a przechodząc od prędkości do ruchliwości, Onsagcr otrzymał równanie na
230 [1024x768] TERMODYNAMICZNE FUNKCJE MIESZANIA I NADMIARU •>rr Szczególnie proste jest wyrażeni
P1050508 ** BSTtODY 111 W normalnej elektrodzie wodorowej ciśnienie cząstkowe wodoru wynosi 1 atm. a
P1120617 [1024x768] 21 I £° — SEA-f pomiarowego ogniwa elektrodowego w roztworze jonów mierzonych o
Gdy aktywność jonów H+ oraz ciśnienie wynoszą 1 to mówimy o normalnej elektrodzie wodorowej (NEW), k
P1120615 [1024x768] ELEKTRODY JONOSELEKTYWNE. WYZNACZANIE STĘŻENIA JONÓW METODAMI DODATKU WZORC
atomami wynosi 1,27 10^cm. Gdyby chlorowodór składał się wyłącznie z jonów wodorowych i chlorkowych
329 [1024x768] ELEKTROCHEMIA bezładnego rozmieszczenia jonów. Debye i Hiickel, w oparciu o model chm
335 [1024x768] 344 ELEKTROCHEMIAWspółczynnik aktywności w bardziej stężonych roztworach Teoria Debye
2011 10 27 43 03 Przykład 3 Obliczyć stopień dysocjacji a i stężenie jonów wodorotlenowych [OH ] w
P1050542 i. POTENCJOM ETUI A Potencjał elektrody szklanej £2(M) zależy od aktywności jonów wodoru i
383 [1024x768] 3*2 ELEKTROCHEMIA Podobnie jak .przy wyznaczaniu współczynnika aktywności przez pomia
401 [1024x768] 410 ELEKTROCHEMIA Całkowite stężenie zasady wynosi: ibhm+ibi = 0,20 • 150 150+K równa
arkusz dII + odpowiedzi0008 _2_ 15. • Za obliczenie stężenia jonów wodorowych w roztworze (x) C0H
DSCN4131 (2) Dysocjacja wody. Stężenie jonów wodorowych i pH.
f3 Ładunek elementarny - ładunek pojedynczego elektronu (-e), którego wartość bezwzględna wynosie =
więcej podobnych podstron