4640480830
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 17
Tabela 4. Alkilowanie oksazyDonu Williamsa za pomocą reagentów elektrodowych [31]
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 17

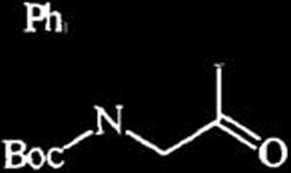
Redukcja H2N^ ^C02H
|
Anti | ||
|
RX |
Wydajność [%] |
ee [%] |
|
0CHjBr |
76 |
98,2 |
|
BrCH2C02Et |
71 |
95,9 |
|
Mel |
54 |
97,2 |
3. METODY Z WYKORZYSTANIEM EKWIWALENTU KATIONU GLICYNY
Szersze zastosowanie oksazynony, jako ekwiwalenty kationu glicyny, mają w reakcjach z odczynnikami nukleofilowymi. Tok syntezy przedstawia schemat 9 [32].
Oksazynony poddane bromowaniu za pomocą N-bromosukcynimidu (NBS) tworzą pojedynczy diastereoizomer, w którym atom bromu znajduje się w pozycji anti w stosunku do obu grup fenylowych. Jako że bromki ulegają rozkładowi na krzemionce, dalszym reakcjom poddawane są bez oczyszczania. Substytucja atomu halogenu przez związki metaloorganiczne może biec dwiema drogami: jako reakcja jednocząsteczkowa (SN1) z retencją konfiguracji (otrzymujemy izomer anti) lub dwucząsteczkowa (SN2) z inwersją konfiguracji (otrzymujemy izomer syn). Kierunek przebiegu reakcji determinowany jest mocą nukleofila, rodzajem rozpuszczalnika i stosowanego kwasu Lewisa [32, 33],
Reakcja typu SN2, dająca dostęp do izomeru syn, uprzywilejowana jest w rozpuszczalnikach niepolarnych, np. CH2C12, w obecności miękkich kwasów Lewisa (ZnCl2) i dla twardych nukleofili.
Zastosowanie mocniejszych kwasów Lewisa (np. trifluorometylosulfonian srebra(I) — AgOTf) w obecności odczynników o mniejszej nukleofilowości i w rozpuszczalnikach polarnych, faworyzuje reakcję typu SN1, a tym samym produkt anti reakcji substytucji (tab. 5). Wytłumaczyć ten fakt można następująco: kwas Lewisa (Ag+) odciąga halogen od cząsteczki oksazynonu, tworzy się
2 - Wiadomości Chemiczne 1-2/98
Wyszukiwarka
Podobne podstrony:
ASYMETRYCZNA SYNTEZA o-AMINOKWASÓW 19 Tabela 5. Substytucja w halogenowanych oksazynonach Williamsa
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 11 Alkilowanie enolanu litowego, tworzonego w reakcji związku
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 5 — nadmiar diastereoizomeru (ang. diastereomeric excess, de), zw
ASYMETRYCZNA SYNTEZA o-AMINOKWASÓW 15 H EtOH O HC1 H HC1-H-Ń C02Et H2 / Pd / C H2N n
ASYMETRYCZNA SYNTEZA o-AMINOKWASÓW 25 5. REAKCJE NA P-WĘGLU Seryna i jej N-chronione pochodne, cyste
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 27 sunobu, ale w obecności chlorku p-bromofenylosulfonowego
WIADOMOŚCI 1998, 52, 1-2 chemiczne pl ISSN 0043-5104 ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW ASYMMETRIC
ASYMETRYCZNA SYNTEZA a-AMINOKWASÓW 3 Contrary to the “electrophilic”, a “nucleophilic amination”
5 (456) Tory tunerów FM-aplikacje i strojenie - Amplituner RADMOR5102 Tabela 2 Strojenie toru FM z
19684 skanuj0380 (2) 398 PHP i MySQL dla każdego Tabela ta zostanie utworzona za pomocą instrukcji S
4 (507) Tory tunerów FM - aplikacje i strojenie - Amplituner RADMOR 5102 Tabela 1 Strojenie toru F
CCF20120227�029 Tabela 2.5. Identyfikacja wybranych włókien za pomocą odczynników chemicznych 2.3.7.
ASYMETRYCZNA SYNTEZA ct-AMINOKWASÓW 9 b) działaniem bezwodnika kwasu benzoesowego w temp. 130°C z
ASYMETRYCZNA SYNTEZA ct-AMINOKWASÓW 23 Zastosowanie (lS,2S,5S)-2-hydroksy-3-pinanonu prowadziło do
ASYMETRYCZNA SYNTEZA ot-AMINOKWASÓW 31 jest budową przestrzenną produktu przejściowego, będącego
ASYMETRYCZNA SYNTEZA cc-AMINOKWASÓW 41 [8] K. Weinges, B. Stemmle, Chem. Ber., 197
9. Zastosowanie hydroksy- i dihydroksyacetonu w asymetrycznej syntezie związków polihydro-ksylowych
więcej podobnych podstron